摘要
背景
RAD21内聚蛋白除了在染色单体内聚中发挥公认的作用外,还在DNA双链断裂(dsb)修复中发挥作用。在拟南芥有三个RAD21旁系基因(AtRAD21.1,AtRAD21.2和AtRAD21.3),但只有AtRAD21.1已被证明是DNA dsb损伤修复所必需的。内聚蛋白在DNA dsb修复中的作用进行了进一步的研究,并在这里报道。
结果
我们首次发现不仅AtRAD21.1而且AtRAD21.3在体细胞DNA dsb修复中发挥作用。彗星数据显示,缺乏任何一种内聚蛋白都会导致类似的高基础水平的DNA dsb核在这两种内聚蛋白突变体中,DNA dsb修复动力学较慢。观察到的AtRAD21.3对DNA dsb诱导的转录反应进一步加强了这种内聚蛋白在DNA dsb修复中的作用。暴露于DNA dsb损伤诱导剂后,AtRAD21.3在DNA dsb损伤修复中的重要性是臭名昭著的,在表型水平上是明显的,特别是当DNA dsb损伤诱导剂AtRAD21.1基因也被破坏了。
DNA dsb损伤修复动力学数据和DNA损伤敏感性分析,单和双atrad21突变体,以及AtRAD21内聚蛋白在诱导DNA dsb损伤后48小时内的转录动态也被显示。
结论
我们的数据证明了这两点拟南芥内聚蛋白(AtRAD21.1和AtRAD21.3)在体细胞DNA dsb修复中起作用。此外,表型数据来自atrad21.1 atrad21.3双突变体表明这两种内聚蛋白在DNA dsb修复中具有协同作用。讨论了这些数据的含义。
背景
RAD21(又称SCC1) [1],[2], SMC1, SMC3和SCC3是姐妹染色单体内聚所需复合物的核心亚基[3.].芽殖酵母的姐妹染色单体内聚在G1晚期和S期建立[4],[5]并在中期/后期转变期间被废除,以允许正确和及时的有丝分裂姐妹染色单体分离[6].姐妹染色单体内聚也建立新创在形成DNA dsb的G2/M二倍体阶段[5],[7].这新创DNA dsb诱导的内聚发生在出芽酵母的全基因组范围内[7],[8].相反,在G2期的人类细胞中,RAD21内聚蛋白被招募并特异性靶向到DNA dsb附近位点[9],[10].有人提议新创内聚建立将DNA dsb受损链与其相同且完整的姐妹染色单体相结合,以促进无错误的DNA修复[7].
DNA dsb可以通过不同的DNA修复途径进行修复,如无错误同源重组(HR)途径,该途径需要同源DNA链模板进行修复,或通过其他不需要同源模板的替代DNA dsb修复途径进行修复。后者,如典型的非同源端连接(C-NHEJ)、单链退火和微同源端连接DNA修复途径大多是容易出错的[11],[12].例如,在吸收的种子中,DNA dsb可以通过不同的DNA dsb修复途径进行修复。因此,据报道,影响HR或C-NHEJ的突变会导致从吸收的突变体种子发芽的幼苗丧失活力或发育迟缓拟南芥暴露于DNA dsb损伤诱导剂的拟南芥和玉米[13] - [16].
除了触发新创DNA dsb损伤也会引发基因表达的变化。一些拟南芥在DNA dsb的HR修复早期阶段编码蛋白质的基因,例如AtRAD51,AtBRCA1,AtRPA-related,AtGR1/COM1 / CtIP和GMI1, DNA dsb诱导后基因表达增加[17] - [23].然而,并非所有拟南芥基因都参与HR,即AtRAD50和AtNBS1(也参与C-NHEJ),在转录上对DNA dsb损伤有反应[21],[22],[24],[25].DNA dsb损伤也可引起DNA表达水平的升高AtWEE1,CycB1:1和AtRAD17,在G2时参与细胞周期阻滞的基因[21],[26],[27].这种DNA dsb诱导的G2细胞周期阻滞主要在分生组织中检测到[21],[22],[28],[29].观察到的稳态转录水平的增加,由DNA dsb诱导,上述基因和AtRAD21.1是由ATM激酶介导的[21],[30.].
拟南芥有三个RAD21同源基因;AtRAD21.1 / SYN2,AtRAD21.1.2 / SYN3和AtRAD21.3 / SYN4[14],[31].AtRAD21.1转录本在大多数植物组织中检测到的水平较低[14],[32],但在茎尖,特别是在种子中(在干燥和吸收的种子中更是如此),较高水平的AtRAD21.1原文可在[33] - [35].AtRAD21.1在DNA dsb诱导后,转录本在ATM依赖性下变得更加丰富[14],[20.],[21].检测较高AtRAD21.1种子和茎尖的表达水平特别有趣,因为它们含有活跃分裂的分生组织细胞,其中基因组完整性的维持至关重要。就像AtRAD21.1,AtRAD21.2基因也在不同组织中低水平表达[14],[31].然而,不像AtRAD21.1,AtRAD21.2稳态转录水平已被证明不会因DNA dsb损伤诱导而增加[14].相反,内聚体AtRAD21.3表现出最高的稳态转录水平AtRAD21基因(14].AtRAD21.3已被证明在基因组稳定性中发挥作用,并与复制因子有关[36].事实上,atrad21.3突变体经历基因组不稳定(如atrad21.1)及染色单体排列缺陷[37],然而,不同于atrad21.1突变体,atrad21.3尚未报道单个突变体与DNA dsb损伤修复相关,也未显示DNA dsb损伤超敏表型[14].然而,出乎意料的是,AtRAD21.3参与了DNA dsb损伤修复。
在这里,我们首次报道了AtRAD21.3,像AtRAD21.1一样,也在体细胞DNA dsb修复中发挥作用。这两个atrad21.3和atrad21.1与野生型Columbia-0 (Col)相比,单个突变体具有更高的DNA dsb基础水平。此外,atrad21.3突变也影响DNA dsb诱导后的DNA dsb损伤修复动力学。此外,这两种突变的结合使吸收的种子atrad21.1 atrad21.3双突变体对DNA dsb诱导更敏感atrad21.1和atrad21.3单突变体。
我们还展示了紧急情况AtRAD21.1DNA损伤的基因表达反应在DNA dsb诱导后立即突然触发。
结果
的AtRAD21.1互补结构足以促进吸收的种子抵抗电离辐射诱导的损伤
的atrad21.1突变(salk_044851)使拟南芥种子对DNA dsb诱导剂高度敏感[14].建立所描述的表型是由atrad21.1而不是源于染色体重排或与T-DNA插入没有物理联系的另一个基因的破坏[38],atrad21.1利用互补结构对突变体进行转化。
为了获得互补结构,基因组区域包括AtRAD21.1基因及其上游2,602 bp的序列,被扩增为单个PCR产物并克隆。基因组互补结构的测序证实,该结构的编码序列与该基因的编码序列相同AtRAD21.1野生型等位基因。测序也证实了互补结构AtRAD21.1将基因序列克隆到表位标签框中绿色荧光蛋白6 x他的(来自pMDC107载体)。
的转变atrad21.1具有互补结构的纯合子植株产生了至少9个独立转化的互补系(Comp)。进一步分析了其中的5条线,并表明可以挽救atrad21.1突变表型,表现出对150戈瑞(3.25戈瑞/分钟;来源:Cs137)的电离辐射(图1).对这些植物进行了基因分型,证实它们具有互补结构atrad21.1突变等位基因(数据未显示)。因此,我们的结果表明AtRAD21.1基因及其上游序列是拯救癌症所必需且充分的atrad21.1突变表型(对电离辐射过敏)(图1).暴露于电离辐射的Comp系的分子特征也表明,重新建立的col样抵抗电离辐射和高剂量的AtRAD21.1-绿色荧光蛋白6 x他的检测到抄本(附加文件1:图S1a及S1c);(引物对:CR1 + GFPOUT和3HOM6 + GFPOUT;额外的文件1:表S1)。
互补线也表明atrad21.1突变体保留了转化和整合T-DNA到其基因组的能力,表位标签(GFP-6xHis)融合到预测的c端AtRAD21.1蛋白不影响AtRAD21.1蛋白在γ射线辐照的种子中的功能(图1).不幸的是,我们无法使用荧光显微镜检测到GFP信号,无论是在未辐照的互补系中还是在γ射线辐照的互补系中(数据未显示),这可能是由于GFP标签在重组蛋白中的构象变化所致。
AtRAD21.1表达:对DNA dsb损伤诱导的紧急反应
已经证明转录AtRAD21.1对DNA dsb损伤的诱导有反应(以ATM依赖的方式)[14],[20.],[21],而那atrad21.1突变体吸收的种子对DNA dsb损伤高度敏感[14].这表明AtRAD21.1DNA dsb诱导的转录本含量增加可能是DNA dsb损伤修复所必需的。
据报道,暴露于100戈瑞的电离辐射1小时后,没有明显变化AtRAD21.2和AtRAD21.3基因转录可在北方印迹中检测到[14].然而,目前尚不清楚当应用更高剂量的电离辐射并诱导更多的DNA损伤时,转录是否也保持不变。的AtRAD21.2和AtRAD21.3DNA dsb损伤诱导后不同时间点的基因转录动态也不清楚。因此,由于RAD21内聚蛋白在DNA修复中的重要性,以及由于缺乏更详细的特征拟南芥AtRAD21基因表达对DNA dsb的响应性,我们监测了AtRAD21.1,AtRAD21.2和AtRAD21.3电离辐射暴露后48小时内不同时间点的转录本内容。的AtRAD21采用实时荧光定量PCR (qRT-PCR)技术,在316gy电离辐射(2.65 Gy/min;来源:Co60)。
早在5分钟AEI,我们就观察到50倍的增长AtRAD21.1辐照后的文本内容与对照(未辐照)样品(图2;额外的文件1:图S2(A)及S2(B);额外的文件1:表S2)。记录的数量达到顶峰大约在1至2小时的AEI,几乎比未辐照的样品高100倍(图2;额外的文件1:表S2)。在4小时AEI时,的稳态水平AtRAD21.1AEI 48小时后,转录物逐渐下降,接近非辐照水平(图2).所述数据来自三个独立的重复,并使用两个不同的引物对(附加文件1:表S3;引物对“1”和“1 m”)针对基因的两个不同区域AtRAD21.1成绩单(附加文件)1:图S1f)。
AtRAD21.1对DNA dsb损伤有紧急转录反应。稳态AtRAD21.1和AtRAD51在316 Gy (2.65 Gy/min;来源:Co60);未辐照样品作为参比(即1倍)。的AtRAD21.1和AtRAD51稳态转录本水平峰值出现在1 ~ 2小时(AEI)(60 ~ 120分钟);山峰的大约在增加了100倍和317倍AtRAD21.1和AtRAD51,分别。AtRAD21.1在48小时(2880分钟)AEI后,稳态转录水平恢复到正常表达水平。AtRAD21.2和AtRAD21.3与AtRAD21.1相比,转录水平的变化是温和的AtRAD21.3转录稳态水平增加两倍响应DNA dsb。数值为每个时间点三次生物重复的平均值。计算相对转录本含量Actin2和AtEF1αA4作为内参基因,对未辐照的样品进行归一化处理。误差条表示标准偏差。定量RT-PCR数据可在附加文件1:表S2。
AtRAD51,一个与HR有关的基因[17),而AtRAD21.1具有非常相似的转录物稳态含量变化模式。然而,这种变化在AtRAD51比在AtRAD21.1。AtRAD51转录本稳态水平达到317倍的峰值,2小时AEI(图2;额外的文件1:图S2(A)及S2(B);额外的文件1:表S2)。
报告AtRAD21.2和AtRAD21.3DNA dsb诱导后的基因表达限制在一定时间点(即AEI 1小时和AEI 1.5小时;Northern blots和微阵列数据,[14],[21]),并提示这些基因的表达对DNA dsb的诱导不敏感。我们的结果表明AtRAD21.2在DNA dsb诱导后48小时的大部分时间内,转录本含量都减少了(图2);的AtATMDNA dsb诱导后的mRNA含量变化更难解释,因为可以检测到转录含量的增加和减少(附加文件)1:图S2(A))。相比之下,qRT-PCR数据显示稳态AtRAD21.3暴露于316戈瑞的电离辐射后,转录水平翻倍。AtRAD21.3表达式,它的响应性不如AtRAD21.1是对DNA dsb的诱导,AEI在4 ~ 8小时之间达到峰值AtRAD21.1达到峰值的转录水平大约在1 - 2小时AEI(图2;额外的文件1:图S2(A))。这些观察结果表明,这两个内聚蛋白基因可能在细胞中扮演不同的角色,因为在诱导DNA dsb损伤后,它们的RNA含量变化的动态是不相同的。
AtRAD21.3与AtRAD21.1结合,具有抵抗电离辐射诱导损伤的能力
因为qRT-PCR数据显示,dsb的诱导DNA诱导的加倍AtRAD21.3我们进一步研究了AtRAD21.3是否在DNA dsb修复中起作用。不像atrad21.1,atrad21.3单个突变体不表现出明显的DNA dsb损伤超敏表型(如DNA损伤诱导的致命性)[14].因此,我们使用atrad21.1 atrad21.3双突变体,更容易识别和描述AtRAD21.3在DNA dsb中的作用。理性是任何atrad21.3诱导的DNA dsb损伤表型(可能不被注意到atrad21.3单突变体由于被AtRAD21.1所起的作用所掩盖)在双突变体中更容易被检测到。的atrad21.1 atrad21.3双突变植株是可育的,在每个角果中产生一个完整的种子(数据未显示)。
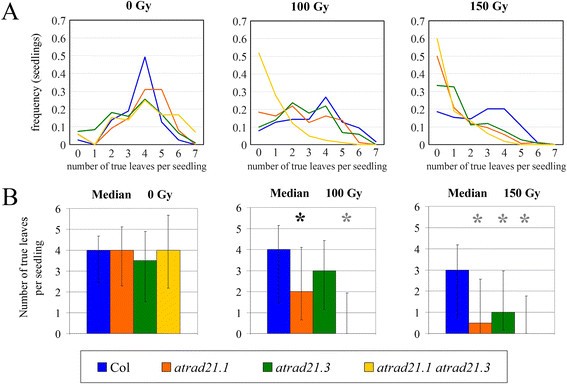
辐照(γ射线)30天后,以150 Gy (3.25 Gy/min;来源:Cs137),atrad21.1 atrad21.3幼苗对γ辐射的超敏反应比atrad21.1苗(图3.).的atrad21.1 atrad21.3γ射线超敏表型,与atrad21.1和atrad21.3单突变体的特点是较高的幼苗发病率,只有两个扩展的子叶和没有真叶(图4).这在100 Gy (γ射线;3.25 Gy /分钟;来源:Cs137)(图4(一);额外的文件1:表S4和图S3),尽管少数幼苗确实会长出更多的真叶。在无真叶的苗木中发病率较高atrad21.1 atrad21.3双突变体,相对于atrad21单突变体和Col,则清楚地反映在中位数的值上(图4(B)),模式和手段(附加文件1:表S5和图S4)。此外,根据Mann-Whitney U-test分析真叶数数据(暴露于100 Gy和150 Gy (γ射线;3.25 Gy /分钟;来源:Cs137)),该atrad21.1 atrad21.3双突变体与Col有显著差异(p值(p) = 0,2尾假设)(图4(B))。相对于双突变γ射线过敏症,atrad21.1突变苗长出更多真叶。尽管如此,atrad21.1就真叶的数量和叶的大小而言,与野生型相比,发育迟缓(图3.和4).在100戈瑞,atrad21.1虽然p值(p = 0.00652)高于双突变体(p = 0),但已与Col显著不同。相比之下,atrad21.3与Col在100 Gy时差异不显著(p = 0.06432)。只有在150戈瑞时,才有可能检测到两者之间的显著差异atrad21.3和Col(图4(B);额外的文件1:图S4)。最终,许多(如果不是全部的话)幼苗表现出对电离辐射的超敏感(主要是紫菀)atrad21.1和atrad21.1 atrad21.3没有或很少有真叶的突变体)会衰老。
的atrad21.1 atrad21.3双突变体对DNA dsb损伤更敏感atrad21.1.这两个atrad21.1 atrad21.3双突变体atrad21.1单突变体对电离辐射(150 Gy)敏感,前者比后者更敏感;正如在不同的实验副本中观察到的。相比之下,atrad21.3即使暴露在150 Gy的电离辐射下,单个突变体也会达到与Col相似的发育阶段。在暴露于150 Gy电离辐射后的幼苗放大图像(3倍放大)中,突出了发育的差异。这些说明了显性双突变苗的表型;在早期发育阶段的发育停滞和衰老,即在没有或只有一片真叶的幼苗中。这些放大的图片也显示了这一点atrad21.1幼苗经历严重的发育延迟,但不像双突变体那样严重(幼苗比双突变体长出更多的真叶)。在单突变体和双突变体中,一些植物设法进一步发育,形成更多的真叶。所有幼苗都是在150 Gy γ射线照射下(0.7532 Gy/min +/−0.003 Gy/min;来源:Cs137),并在30天后拍摄。0gy -不暴露于电离辐射。Col野生型哥伦比亚-0型植物。
DNA dsb严重影响儿童的发育atrad21.1 atrad21.3双突变体。(一)atrad21.1 atrad21.3显示最严重的DNA dsb损伤引起的发育停滞。在发育的早期阶段(0和1真叶),幼苗被截留的频率最高atrad21.1 atrad21.3双突变体表明其对DNA dsb损伤高度敏感。在100 Gy时,双突变体的这一频率高于单突变体和Col;只有在150戈瑞时,这个频率才会atrad21.1双突变体变得相似。在100 Gy时,0和1真叶的幼苗频率,Col和inatrad21.3,是相似的;但在150戈瑞时,它变得更高atrad21.3.(B)atrad21.1 atrad21.3和atrad21.1与Col (100 Gy)有显著差异。中位数和Mann-Whitney非参数检验(p值(p)<0.01, 2尾假设)表明DNA dsb导致严重的发育停滞atrad21.1 atrad21.3在美国,这种情况较少atrad21.1.这两个突变体都与Col (100 Gy和150 Gy)有显著差异。只有在150戈瑞atrad21.3误差条:数据的标准偏差(到中位数)。黑色星号:差异显著(0
DNA dsb损伤修复动力学受到影响,检测到较高的基础水平的DNA dsbatrad21.3突变体
为了进一步描述AtRAD21内聚蛋白的作用,我们在暴露于博莱霉素的10天大的幼苗中,通过彗星实验监测了DNA dsb的修复。我们选择使用博莱霉素,这是一种放射性抑癌剂,它以类似于电离辐射的方式诱导DNA dsb [39],因为它允许我们将我们的结果与之前发表的DNA dsb修复动力学数据进行比较[23],[40],[41].三个不同的atrad21纯合突变体用于彗星试验(atrad21.1,atrad21.3和atrad21.1 atrad21.3).的atrad21.2突变体被排除在本试验和其他试验之外,因为据我们所知,没有可行的atrad21.2纯合突变敲除系可用[42].
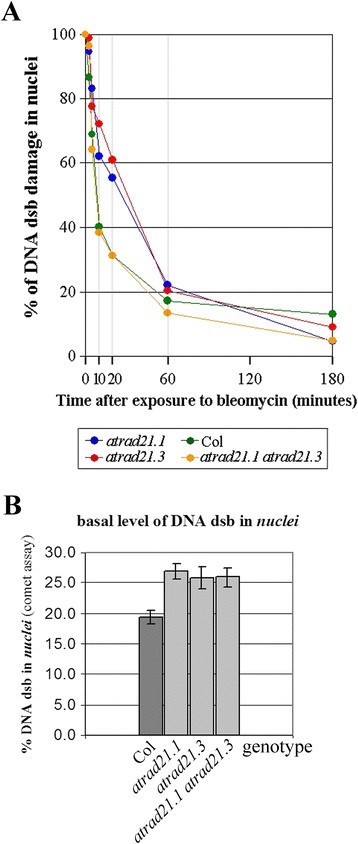
野生型Col幼苗的修复动力学atrad21.1,atrad21.3和atrad21.1 atrad21.3双突变体对照(未暴露)与暴露10 μg/ml博莱霉素无显著差异(数据未显示)。然而,当使用较高的博莱霉素浓度(30 μg/ml)时,会诱导更多的DNA dsb [40],相对于野生型,单个突变体的DNA dsb修复受损变得明显。DNA dsb诱导后10 ~ 60分钟之间的显著差异尤其明显(图5(A)),即从dsb修复动力学的初始快阶段过渡到随后的dsb修复动力学的慢阶段[43],[44](附加文件1:图S5;额外的文件1:表S6)。与单一突变体不同,atrad21.1 atrad21.3在30 μg/ml博莱霉素作用下,具有野生型(Col-like) DNA dsb损伤修复动力学。然而,双突变体和atrad21.1和atrad21.3单突变体表现出明显高于野生型的核DNA dsb含量(DNA dsb的基础水平较高)(图5(B)),即使没有诱导DNA dsb。
atrad21.1和atrad21.3突变体的DNA dsb基础水平和修复动力学发生改变。(一)atrad21.1和atrad21.3单个突变体的DNA dsb损伤修复动力学相似。在DNA dsb损伤诱导后的前60分钟内,atrad21.1和atrad21.3突变体比col保留更多未修复的DNA dsb,这种差异在10分钟时更加显著(单个突变体中诱导的DNA dsb仍有62.1%至72.2%未修复与Col为40.2%,单突变体为55.4% ~ 60.9%与Col为31.3%,60 min为20.3% ~ 22.1%与在DNA dsb损伤诱导后,17.1%为Col)。的atrad21.1 atrad21.3双突变体具有col样DNA dsb损伤修复动力学。DNA dsb损伤定量核在30 μg/ml博莱霉素作用后0、3、5、10、20、60和180分钟收获的10日龄幼苗。Col型野生型哥伦比亚0号植物。(B)atrad21.1,atrad21.3和atrad21.1 atrad21.3突变体的DNA dsb基础水平高于col核从未接触DNA dsb诱导剂的幼苗中得到的结果表明,Col中检测到的DNA dsb含量明显低于atrad21.1,atrad21.3和atrad21.1 atrad21.3突变体。DNA dsb损伤定量核没有接触博莱霉素的10天大的幼苗。误差条表示标准误差。Col型野生型哥伦比亚0号植物。彗星分析数据可在附加文件1:表S6。
的atrad21.1 atrad21.3双突变体对DNA dsb损伤的超敏反应较非突变体轻atku80 atrad21.1双突变体atku80单突变
DNA dsb通过不同的DNA修复途径进行修复。RAD21已被提出通过HR促进DNA dsb修复,其方法是将姐妹染色单体的同源DNA序列保持在近距离[7].然而,在植物中,DNA dsb主要通过双碱基断裂末端的直接连接(特别是通过正常-非同源-末端连接- C-NHEJ)进行修复,而不需要延长同源DNA序列链进行修复[[endnoteref: 6]]45].为了确定在C-NHEJ DNA修复途径突变体中破坏AtRAD21(与HR相关)的后果,我们已将atrad21.1突变等位基因进入atku80突变体背景[46]产生atrad21.1 atku80双突变体。
的atku80 atrad21.1双突变株进行基因分型(附加文件1:图S6),并证明是可行的。在正常生长条件下(未受到电离辐射照射),这些植物具有正常的营养和育性表型;双突变体的每个角果中的种子与Col植物的种子没有区别(数据未显示)。当种子被吸收的时候atku80 atrad21.1双突变体,和atku80突变体,暴露于γ射线(100 Gy, 3.25 Gy/分钟;来源:Cs137),这两个突变体表现出相似的急性超敏反应表型(图6;100 Gy)。在吸收Col时,没有检测到对DNA dsb的超敏反应,atku80和atku80 atrad21.1突变体种子照射50 Gy (3.25 Gy/min;来源:Cs137)的电离辐射(数据未显示)。
C-NHEJ与人力资源相关atrad21DNA dsb损伤超敏性。DNA dsb损伤诱导C-NHEJ相关表型的比较atku80突变体与人力资源相关的rad21突变。吸收的突变体种子为纯合子atku80突变等位基因(atku80 atrad21.1和atku80)对DNA dsb极度敏感;此外,它们对DNA dsb的敏感程度高于小鼠atrad21.1 atrad21.3双突变体甚至比atrad21.1单突变体;这已经在不同的实验副本中得到了证实。放大(2倍放大)的幼苗图atku80和atku80 atrad21.1对DNA dsb损伤表现出更严重的超敏反应atrad21.1 atrad21.3.虽然一些atrad21.1 atrad21.3在100戈瑞的电离辐射照射下,幼苗仍能形成一些真叶(图中为长有9片小真叶的幼苗),atku80和atku80 atrad21.1发育在较早的阶段(没有真叶或只有一片初生真叶的幼苗)停止。的atrad21.1在所有四种突变体中,幼苗表现出最不敏感的表型。吸收的种子暴露于100戈瑞的电离辐射(3.25戈瑞/分钟;来源:Cs137);0 Gy未暴露于电离辐射。在电离辐射照射23天后,从辐照吸收的种子中发芽的幼苗被拍摄下来。Col -野生型Columbia-0植物;Ws -野生型Wassilewskija-1植物。
电离辐射引起的DNA dsb超敏反应的比较表明atku80和atku80 atrad21.1突变体对DNA dsb的敏感程度明显高于atrad21.1 atrad21.3双突变体,甚至更多atrad21.1单突变体(图6).
这些观察结果表明,尽管AtRAD21.1和AtRAD21.3内聚蛋白在吸收种子的DNA dsb修复中起着重要作用,但与C-NHEJ相关的AtKu80蛋白在DNA dsb修复中起着主要作用。这与之前的报道一致,即C-NHEJ修复途径是植物中主要的修复途径[45].由于病情严重atku80和atku80 atrad21.1突变表型,不可能确定是否DNA损伤超敏表型观察atku80 atrad21.1双突变体与atku80,或者它是累积的,但被严重的atku80表现型。
讨论
AtRAD21.1和AtRAD21.3拟南芥内聚蛋白对DNA dsb损伤的应急反应
稳态的增加AtRAD21.3RNA水平,更引人注目的是,迅速和立即的稳定状态的增加AtRAD21.1诱导DNA dsb后的RNA水平表明,这两种内聚蛋白在DNA dsb损伤的紧急反应中发挥作用(图2;额外的文件1:图S2)。转录上调AtRAD21.1-绿色荧光蛋白6 x他的暴露于电离辐射的互补系植物中的转基因(附加文件)1:图S1c)和救援atrad21.1在这些相同的系中,DNA dsb损伤超敏表型(图1)连结AtRAD21.1DNA dsb修复的应急响应。这一数据表明AtRAD21.1转录活性可能与DNA dsb诱导的内聚增加直接相关(新创凝聚力)。这一假设与已报道的观察结果相一致,即DNA损伤诱导Col在照射后仅10分钟姐妹染色单体内聚增加[47].而且,同样在诱导DNA dsb损伤10分钟后,对atrad21.1突变体经历了DNA dsb修复的显著延迟(图5(A))。总之,这些观察结果表明,正如在其他生物中观察到的RAD21同源物一样,AtRAD21.1也可能参与DNA dsb诱导新创拟南芥DNA dsb修复所需的内聚。事实上,在酵母和人类细胞中,有人提出在DNA dsb诱导后,RAD21内聚蛋白被募集到染色体上[7],[9],[10]通过快速建立诱导的DNA dsb来加强姐妹染色单体的拴系新创凝聚力。需要进一步的实验来证明这种AtRAD21.1紧急响应是否确实会导致新创内聚和姐妹染色单体内聚的增加。的上调AtRAD21.3转录(图2)和诱导DNA dsb后10分钟检测到的同时较慢的DNA dsb修复(图5)表明AtRAD21.3可能也参与了类似atrad21.1的DNA dsb修复紧急响应。
最后,相似的时机AtRAD51和AtRAD21.1转录本含量的增加(qRT-PCR数据)表明,在DNA dsb修复的第一阶段也可能需要AtRAD21.1。AtRAD51,与其在酵母中的同源物相似,被认为在重组的第一阶段参与DNA链的入侵和同源性搜索[48] - [50].因此,AtRAD21.1也可能在体细胞重组(DNA dsb修复)的早期阶段发挥作用。
AtRAD21.1和AtRAD21.3都是DNA dsb修复所必需的
当大量DNA dsb被诱导(30 μg/ml博莱霉素)时,AtRAD21.1和AtRAD21.3对DNA dsb的修复是必需的(图5(A)),以及当植物未暴露于DNA dsb诱导剂(图5(B))。
atrad21.1,atrad21.3单变种人,还有atrad21.1 atrad21.3双突变体,与Col相比,表现出相似且显著更高的DNA dsb基础水平(图5(B))。这表明AtRAD21.1和AtRAD21.3可能是内源性应激(如DNA复制)或自然环境应激诱导的DNA dsb修复(或限制其形成)所必需的。
DNA修复动力学数据atrad21.1[40],atrad21.3(图5(A)),以及其他影响体细胞组织HR的拟南芥突变体,并且在减数分裂期间没有明显的有害缺陷,如atrad17[26),gmi1(含有蛋白质的SMC-Hinge结构域)[23],表明当许多DNA dsb被诱导时,这些突变体经历了DNA dsb修复的延迟。这种延迟是明显的,早在博莱霉素治疗后10至20分钟atrad21.1和atrad21.3突变苗(图5(A)),以及gmi1突变体(23].这些相似性表明,像GMI1一样,AtRAD21.1和AtRAD21.3也可能参与HR。观察到DNA dsb修复动力学的下降atrad21.1和atrad21.3在含有少量RAD21蛋白的酵母菌株中也观察到单个突变体[51].这表明细胞中诱导的DNA dsb的数量与DNA dsb修复所需的RAD21蛋白的数量之间存在相关性。在较低的博莱霉素浓度(10 μg/ml)下,诱导的DNA dsb较少,观察到Col、c、c之间的修复动力学atrad21.1,atrad21.3和atrad21.1 atrad21.3没有显著差异(数据未显示)。修复动力学相似性的一个可能解释是,突变系中保留的染色体内聚水平足以抵消产生的少量DNA dsb,因此DNA dsb修复的效率不受影响。然而,当产生更多的DNA dsb时(30 μg/ml博莱霉素)[40],在单个突变体中缺乏AtRAD21.1或AtRAD21.3对DNA修复至关重要。
我们假设,细胞中DNA dsb数量的增加导致对大量内聚蛋白库的需求增加新创内聚,允许DNA dsb HR修复。因此,内聚蛋白的数量较少atrad21.1和atrad21.3单个突变体可以解释在DNA dsb高发诱导后的前10到20分钟内观察到的较低效率的DNA修复(较慢的动力学)(图5(A))。较慢的DNA修复动力学观察atrad21.1和atrad21.3单个突变也可能是由依赖于atrad21的dna损伤修复检查点引起的。事实上,酵母rad21突变与dna损伤诱导的检查点的破坏有关。同样,在哺乳动物细胞中,RAD21在DNA复制和G2/M细胞周期阶段参与DNA损伤诱导的细胞周期进展停滞[52] - [54].
在这种特殊情况下atrad21.1 atrad21.3双突变体,具有类似野生型的修复动力学(图5(A)),这是合理的,由于两者的淘汰AtRAD21.1和AtRAD21.3基因(附加文件)1:图S6), atrad21依赖的DNA dsb修复途径完全受损。因此,我们认为在双突变体中,DNA dsb修复被切换到atrad21不依赖的DNA dsb修复途径,其动力学与在该突变体中观察到的相似atku80突变体(40]和野生型。AtKu80与NHEJ DNA修复相关,不像RAD21 (AtRAD21同源物)、AtRAD17和GMI与HR相关[23],[26],[44],[53],[55].
进一步的实验将有助于验证这些或其他假设。
对DNA dsb急性超敏反应atrad21.1 atrad21.3双突变体
尽管缺乏AtRAD21.3蛋白,但该蛋白被认为在姐妹染色单体臂内聚和着丝粒内聚中发挥作用[37),atrad21.3暴露于电离辐射后,单个突变体形态似乎与Col没有区别(图3.).只有更详细的表征(真叶数)atrad21.3突变表明,只有在暴露于高剂量辐射后(图4(B);150戈瑞)的区别atrad21.3Col变得很重要。此外,AtRAD21.3内聚蛋白的缺乏atrad21.1 atrad21.3突变背景导致较高的DNA dsb超敏表型,相对于atrad21.1单突变体和Col’s DNA dsb超敏表型(图3.;数字4;数字6).这些结果表明,AtRAD21.1和AtRAD21.3都有助于植物应对DNA dsb损伤的能力,其中AtRAD21.3对AtRAD21.1功能具有协同和非冗余作用。其他例子存在协同作用对DNA dsb损伤修复和基因组稳定性,即AtRAD50和叔,NBS1和叔,NBS1和自动取款机[25],[56],[57].
从依赖于atrad21的,可能无错误的HR修复,到错误倾向于atrad21独立的DNA dsb修复途径的转变可能是该超敏反应增加的起源atrad21.1 atrad21.3双突变对DNA dsb损伤。这种转变将导致由DNA dsb修复引起的有害突变的频率增加,从而导致在双突变体中观察到的对DNA dsb的增强超敏反应(图2).在苔藓中观察到基因组损伤的频率增加小立碗虫ppmre11和pprad50突变体(41].这些作者提出,病变频率的增加是由易出错的DNA修复途径的转变引起的,该途径在处理DNA dsb末端后直接连接DNA dsb末端,也由RAD50和MRE11在将两个DNA dsb末端紧密连接中的作用被破坏引起的。
尽管atrad21.1 atrad21.3,atku80双突变体的DNA dsb修复动力学与野生型相当,双突变体对DNA dsb不像野生型那么敏感atku80突变体(40)(图6).人们可以推测,这种差异是由吸收的种子中不同的DNA dsb修复途径引起的atku80和atrad21.1 atrad21.3突变体。
AtRAD21.3和AtRAD21.1在姐妹染色单体内聚和DNA修复中的作用
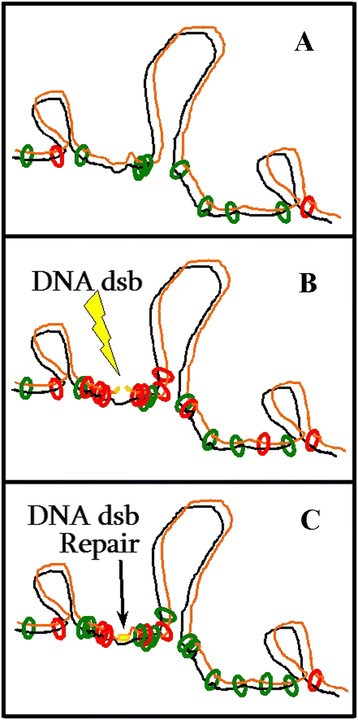
在这项工作中,我们发现AtRAD21.3和AtRAD21.1都参与DNA dsb修复。在图7说明了一个假设,提出在诱导DNA dsb,AtRAD21.1紧急转录反应确保了丰富的AtRAD21.1库,在DNA dsb诱导后加强姐妹染色单体的内聚。这种功能似乎在DNA dsb修复的早期阶段是必需的(图2),这是至关重要的atrad21.1对DNA dsb损伤高度敏感。AtRAD21.3上调也被认为对诱导DNA dsb后DNA dsb修复所需的AtRAD21内聚蛋白库有贡献,但在较晚的阶段。然而,无论DNA dsb是否存在,AtRAD21.3的主要作用可能是建立染色体内聚,并有助于染色体结构的形成。事实上,来自高桥和金巴亚的数据等.[36]提示AtRAD21.3内聚可能与DNA复制有关。因此,AtRAD21.3对DNA dsb修复的主要贡献可能是提供一个预先存在的染色体支架和内聚,这将有助于随后出现的DNA dsb的修复。
提出的模型:AtRAD21.1和AtRAD21.3在DNA dsb损伤诱导前后。(一)在DNA dsb诱导前,姐妹染色单体内聚由AtRAD21.3(绿环)促进,也可能由内源性因素产生的与DNA dsb相关的一些AtRAD21.1(红环)促进。(B)在诱导DNA dsb断裂(闪光)后,AtRAD21.1表达增强。这有望增加细胞中含有AtRAD21.1(红色环)的内聚复合物库,从而有助于促进和增强姐妹染色单体内聚。(C)DNA dsb损伤引起细胞凋亡的增加AtRAD21.3转录本内容(出现在AtRAD21.1之后)也有望增加含有AtRAD21.3的池内聚复合物(绿色环)。这些内聚蛋白复合物(绿圈)可能加强姐妹染色单体的内聚,或者它们可能取代(全部或部分)AtRAD21.1内聚蛋白复合物(红圈)新创凝聚力。有人提出,内聚的增加通过促进具有DNA dsb的染色单体(橙色)与其完整的姐妹染色单体(黑色)之间的物理接近来促进DNA dsb修复。绿色和红色环:连接两个姐妹染色单体(黑色和橙色)的内聚复合物。黄线:DNA dsb的位置。闪光(黄色):DNA dsb诱导剂。
AtRAD21.3在染色体结构中起作用的猜想是基于后生动物中RAD21蛋白参与染色质结构的证据[58],[59]并与核矩阵相关联[60].有趣的是,就像atrad21.3突变体(14](附加文件1:图S7),也有报道称,一些有助于染色质重塑的基质相关蛋白的错误表达或敲除也会影响花抽苔时间[61],[62].
结论
AtRAD21.3参与DNA dsb损伤修复的鉴定为拟南芥中参与DNA dsb修复的已知蛋白质组增加了另一个参与者。AtRAD21.3在DNA dsb损伤修复中的作用由彗星实验数据和在研究中观察到的γ射线超敏表型清楚地证明atrad21.1 atrad21.3双突变体。同样,真叶数的减少atrad21.3与Col相比,单突变,特别是暴露于高剂量辐射(150 Gy)后,也表明AtRAD21.3在DNA dsb损伤修复中起作用。此外,不同的γ射线过敏表型表现为atrad21.1,atrad21.3和atrad21.1 atrad21.3这两个基因对DNA dsb损伤的反应都上调,这一事实表明它们在DNA dsb损伤修复中的功能不是多余的。我们的数据揭示了内聚蛋白参与DNA dsb损伤修复的复杂性增加,这可能是特定于植物的。
方法
植物材料
拟南芥种子表面消毒,镀于萌发培养基中,4°C暗处吸收3 - 4天。除图中所示苗外的所有苗3.在发芽固体培养基(GM)上(MS培养基+ Gamborg B5维生素,1%蔗糖;0.8%微琼脂(Duchefa),在无菌培养皿中或装有经过灭菌的商业草皮、土壤和肥料混合物的罐中;pH值5.5 - 6.5。转基因和土壤种植的植物都被保存在生长室中,光照周期为22°C下16小时,19°C下黑暗8小时。在图所示的化验中3.在21°C、连续光照(24小时)的生长室中,在1 / 2 MS固体培养基中萌发并生长30天。
用于基因分型的引物见附加文件1:表S7,植物材料来源(Col, Ws,atku80,atrad21.1,atrad21.3和atrad21.1 atrad21.3)在附加文件中描述1:材料与方法。用爱德华兹设计的方法提取植物基因组DNA等.[63].
AtRAD21.1互补构造
互补结构包括上游基因组区(2,602 bp)和编码基因组序列(包含内含子和外显子)AtRAD21.1(4109 bp),不包括翻译终止密码子。按照制造商的方案,使用Pfx50 DNA聚合酶(Invitrogen) PCR扩增基因组片段;使用引物GP1G (CACCGCATCTTTGCTCACCTACCTCAAACG)和GR1cDR (ACAAGCTTTTTGTGGTCTGGAAACACGCAT)(附加文件1:图S1f))。以拟南芥生物资源中心(ABRC)提供的MHK7 P1克隆的基因组DNA为模板。PCR产物克隆于pENTR/D-topo载体(Invitrogen)中,重组至pMDC107载体[64]使用LR clonase II酶混合反应(Invitrogen),并进行测序。
AtRAD21.1互补行
坳至atrad21.1用基因组转化纯合突变植株AtRAD21.1-绿色荧光蛋白6 x他的用花浸法构建互补[65],使用根癌土壤杆菌携带质粒pMP90RK的GV3101菌株[66].在含湿霉素培养基上选择T1型转化体,收获T2型种子。T2种子暴露于电离辐射(DNA损伤敏感性试验),那些对DNA dsb不过敏的植物(暴露于150 Gy电离辐射27天后)进行基因分型(引物对信息可在附加文件中获得1:表S7)。的表达式AtRAD21.1-绿色荧光蛋白6 x他的利用从样品中提取的RNA,冷冻在液氮中,暴露于辐照和模拟辐照后1小时,通过RT-PCR对构建物进行评估(验证互补)1:表S1)。RNA从辐照(150 Gy;3.25 Gy /分钟;来源:Cs137)莲座叶来自杂合子atrad21.1植物,和幼苗从互补系(在atrad21.1纯合突变遗传背景)和来自非辐照(模拟)山坳丛叶。cDNA被合成(如附加文件所述)1:材料与方法)。
电离辐射敏感性测定
四周大的Col植物开始生长在体外(在GM固体介质中)以316 Gy (2.65 Gy/min;来源:Co60),在黑暗中。样品吸收的辐射剂量由放置在辐照样品下面和上面的辐射剂量计监测。辐照后,植物被放回生长室。
表面消毒后对种子进行辐照,在无菌的0.1%琼脂糖中,4°C,暗处吸收3 - 4天。种子在GammaCell 2000中辐照,计算剂量为50 Gy、100 Gy或150 Gy的电离辐射(γ射线;3.25 Gy /分钟;来源:Cs137),或在GammaCell 40中,计算剂量为150 Gy (γ射线;0.7532 Gy/分钟±0.003 Gy/分钟;来源:Cs137)。辐照后,将种子镀在转基因固体培养基上,在无菌条件下生长。吸收的种子和4周大的植株作为实验对照,不接受0 Gy的辐照。
统计分析
在种子辐照(15 DAI)或模拟辐照后15天,计数单个幼苗中出现和形成真叶的数量。辐照(和未辐照,0 Gy)的种子在0.1%琼脂糖中浸泡3天,在4°C的黑暗中,然后用100 Gy或150 Gy (γ射线;3.25 Gy /分钟;源Cs137)。种子在无菌培养皿中萌发和生长,在发芽固体培养基(GM)上,在生长室(光照16小时,22°C;黑暗8小时,19°C)。
非参数Mann-Whitney u型检验[67] (p < 0.01;(2尾假设),以确定是否有显著差异atrad21.1,atrad21.3和atrad21.1 atrad21.3突变体和野生型植物Col;通过每棵幼苗的真叶数量来估计对电离辐射暴露的超敏反应的差异。编译后的数据(附加文件1:表S4)用于Mann-Whitney u检验。
RNA提取及实时定量PCR表达数据采集与分析
在316 Gy辐照处理后(2.65 Gy/min;来源:Co60),并立即在液氮中冷冻并保存在−80°C。从三个独立的生物副本(辐照和未辐照)中提取RNA,并合成cDNA。Real-Time PCR定量转录稳态水平。所监测的基因为:被表征的内聚基因(AtRAD21.1,AtRAD21.2,AtRAD21.3),AtATM,阳性对照AtRAD51[68],而内参基因(Actin2和AtEF1αA4) [47],[68].使用Pfaffl方法获得转录物积累的相对定量[69].引物信息和进一步的协议信息在附加文件中提供1:《材料与方法》和《附加文件》1:表S3。
彗星试验:DNA dsb诱导,数据采集和评估
10日生拟南芥幼苗核DNA dsb片段分析atrad21.1,atrad21.3和atrad21.1 atrad21.3纯合子突变系)采用单细胞凝胶电泳(彗星)检测的中性方案进行评估[40],[70].未处理的幼苗和10 μg/ml和30 μg/ml硫酸博莱霉素(Bleomedac Medac, Germany)在液体½MS中处理1小时的幼苗,在博莱霉素处理(DNA dsb诱导剂)后3、5、10、20、60和180分钟的液氮中冷冻。处理后,用SYBR金染色(分子探针/Invitrogen)对核“彗星”进行染色,在尼康Eclipse 800荧光显微镜下观察,并使用LUCIA细胞遗传学软件(LIM,捷克共和国)的彗星模块(LUCIA彗星检测)进行评估。进行并编制了三个独立的实验。DNA dsb的发生率被测量为从彗星头部移动到彗星尾部的DNA碎片的百分比(%尾DNA)。每个给定修复时间t的DNA损伤剩余的计算百分比x定义为:
附加文件中提供了更详细的协议1:材料与方法。
支持数据
支持本文结果的数据集包含在本文及其附加文件中。
额外的文件
缩写
- AEI:
-
辐照照射结束后
- C-NHEJ:
-
典型的非同源端连接DNA修复途径
- 上校:
-
野生型Columbia-0
- 排版:
-
互补行
- 双边带:
-
双股断线
- 通用汽车:
-
萌发固体培养基
- 人力资源:
-
同源重组DNA修复途径
- NHEJ:
-
非同源端连接DNA修复途径
- 存在:
-
实时定量PCR
- rt - pcr:
-
逆转录PCR
参考文献
- 1.
Birkenbihl RP, Subramani S:克隆和表征rad21一种必不可少的基因粟酒裂殖酵母参与DNA双链断裂修复。中国生物医学工程学报,1994,20(24):6605-6611。10.1093 / nar / 20.24.6605。
- 2.
Michaelis C, Ciosk R, Nasmyth K:内聚蛋白:防止姐妹染色单体过早分离的染色体蛋白。细胞科学学报,1997,91(1):35-45。10.1016 / s0092 - 8674(01) 80007 - 6。
- 3.
内聚蛋白:一种有独立入口和出口的连环酶?细胞生物学杂志,2011,13(10):1170-1177。10.1038 / ncb2349。
- 4.
Uhlmann F, Nasmyth K:姐妹染色单体之间的内聚必须在DNA复制过程中建立。动物学报,1998,8(20):1095-1101。10.1016 / s0960 - 9822(98) 70463 - 4。
- 5.
Heidinger-Pauli JM, Ünal E, Koshland D: Eco1乙酰转移酶在S阶段调节内聚和对DNA损伤的响应。分子化学,2009,34(3):311-321。10.1016 / j.molcel.2009.04.008。
- 6.
Uhlmann F, Lottspeich F, Nasmyth K:内聚蛋白亚基Scc1的分裂促进了后期姐妹染色单体的分离。自然科学进展,2004,27(4):344 - 344。10.1038/21831。
- 7.
Ström L, Lindroos HB, Shirahige K, Sjögren C: DNA修复需要复制后内聚素招募到双链断裂。生物化学学报,2004,16(6):1003-1015。10.1016 / j.molcel.2004.11.026。
- 8.
Ünal E, Heidinger-Pauli JM, Koshland D: DNA双链断裂通过Eco1触发全基因组姐妹染色单体内聚(Ctf7)。科学通报,2007,27(3):344 - 344。10.1126 / science.1140637。
- 9.
Potts PR, Porteus MH, Yu H:人类SMC5/6复合体通过招募smc3 /3内聚复合体到双链断裂促进姐妹染色单体同源重组。环境科学学报,2006,25(14):3377-3388。10.1038 / sj.emboj.7601218。
- 10.
Bauerschmidt C, Arrichiello C, back -Rothkamm S, Woodcock M, Hill MA, Stevens DL, Rothkamm K:内聚蛋白促进电离辐射诱导的复制染色质DNA双链断裂的修复。中国生物医学工程学报,2010,38(2):477-487。10.1093 / nar / gkp976。
- 11.
Lord CJ, Garrett MD, Ashworth A:靶向双链dna断裂修复途径作为治疗策略。临床癌症杂志,2006,12(15):4463-4468。10.1158 / 1078 - 0432. - ccr - 06 - 1269。
- 12.
Hiom K:处理DNA双链断裂。DNA修复,2010,9(12):1256-1263。10.1016 / j.dnarep.2010.09.018。
- 13.
弗里斯纳J,布里特AB:Ku80- - -DNA连接酶IV缺乏症植物对电离辐射敏感,T-DNA整合有缺陷。植物学报,2003,34(4):427-440。10.1046 / j.1365 - 313 x.2003.01738.x。
- 14.
da Costa-Nunes JA, Bhatt AM, O 'Shea S, West CE, Bray CM, Grossniklaus U, Dickinson HG:三个人的特征拟南芥RAD21内聚蛋白揭示了对电离辐射的不同反应。应用实验学报,2006,57(4):971-983。10.1093 / jxb / erj083。
- 15.
Li J, Harper LC, Golubovskaya I, Wang CR, Weber D, Meeley RB, McElver J, Bowen B, Cande WZ, Schnable PS:玉米RAD51在减数分裂和dsb修复中的功能分析。中国生物医学工程学报,2007,26(3):344 - 344。10.1534 / genetics.106.062604。
- 16.
王丽娟,王丽娟,王丽娟,王丽娟。植物DNA连接酶对植物种子寿命的影响。植物学报,2010,36(5):344 - 344。10.1111 / j.1365 - 313 x.2010.04285.x。
- 17.
Klimyuk VI, Jones JDG:AtDMC1酵母的拟南芥同源物一代基因:特征,转座子诱导的等位基因变异和减数分裂相关的表达。植物学报,1997,11(1):1-14。10.1046 / j.1365 - 313 x.1997.11010001.x。
- 18.
德沃克斯,阿隆索B, Pierrugues O, Godon C, Kazmaier M:分子克隆与发育表达AtGR1,一个新的生长相关的拟南芥基因强烈诱导电离辐射。地球科学进展,2000,34(4):355-364。10.1667 / 0033 - 7587 (2000) 154 (0355: MCADEO) 2.0.CO; 2。
- 19.
拉法基S, Montané MH:表征拟南芥人乳腺癌易感基因1的同源图:AtBRCA1,由伽马射线强烈诱发。中国生物医学工程学报,2003,31(4):1148-1155。10.1093 / nar / gkg202。
- 20.
West CE, Waterworth WM, Sunderland PA, Bray CM:拟南芥DNA双链断裂修复途径。生物化学学报,2004,32 (Pt 6): 964-966。
- 21.
Culligan KM, Robertson CE, Foreman J, Doerner P, Britt AB: ATR和ATM在电离辐射响应中既起着不同的作用,又起着叠加作用。植物学报,2006,48(6):947-961。10.1111 / j.1365 - 313 x.2006.02931.x。
- 22.
Ricaud L, Proux C, Renou J-P, Pichon O, Fochesato S, Ortet P, Montané M-H: γ射线介导的转录和发育反应拟南芥.公共科学学报,2007,2 (5):e430-10.1371/journal.pone.0000430。
- 23.
Böhmdorfer G, Schleiffer A, Brunmeir R, Ferscha S, Nizhynska V, Kozak J, Angelis KJ, Kreil DP, Schweizer D: GMI1,一种含有染色体结构维持-枢纽域的蛋白,参与拟南芥体细胞同源重组。植物学报,2011,27(3):344 - 344。10.1111 / j.1365 - 313 x.2011.04604.x。
- 24.
Gallego ME, Jeanneau M, Granier F, Bouchez D, Bechtold N, White CI:拟南芥RAD50基因的破坏导致植物不育和MMS敏感性。植物学报,2001,25(1):31-41。10.1046 / j.1365 - 313 x.2001.00928.x。
- 25.
Waterworth WM, Altun C, Armstrong SJ, Roberts N, Dean PJ, Young K, Weil CF, Bray CM, West CE: NBS1参与DNA修复,在介导植物减数分裂同源重组中与ATM协同作用。植物学报,2007,26(1):1- 4。10.1111 / j.1365 - 313 x.2007.03220.x。
- 26.
叶辰,叶海泽,叶海东,李志刚,李志刚,李志刚Rad17拟南芥同源基因参与了DNA损伤修复和同源重组的调控。植物学报,2004,38(6):954-968。10.1111 / j.1365 - 313 x.2004.02097.x。
- 27.
de Schutter K, Joubès J, coolts T, Verkest A, Corellou F, Babiychuk E, Van Der Schueren E, Beeckman T, Kushnir S, Inzé D, de Veylder L:拟南芥WEE1激酶控制细胞周期阻滞对DNA完整性检查点激活的响应。植物细胞学报,2007,19(1):211-225。10.1105 / tpc.106.045047。
- 28.
Culligan K, Tissier A, Britt A: ATR调节g2期细胞周期检查点拟南芥.植物学报,2004,16(5):1091-1104。10.1105 / tpc.018903。
- 29.
胡夫纳,胡夫纳,杨晓明,等:拟南芥DNA损伤对细胞周期的影响。DNA修复。2006,5(1):102-110。10.1016 / j.dnarep.2005.08.013。
- 30.
Garcia V, Bruchet H, Camescasse D, Granier F, Bouchez D, Tissier A: AtATM在植物减数分裂和DNA损伤的体细胞反应中至关重要。植物细胞学报,2003,15(1):119-132。10.1105 / tpc.006577。
- 31.
董峰,蔡晓霞,Makaroff CA:拟南芥染色体凝聚蛋白RAD21/REC8家族基因的克隆与鉴定。基因工程学报,2001,271(1):99-108。10.1016 / s0378 - 1119(01) 00499 - 1。
- 32.
Winter D, Vinegar B, Nahal H, Ammar R, Wilson GV, Provart NJ:用于探索和分析大规模生物数据集的“电子荧光象形文字”浏览器。公共科学学报,2007,2 (8):e718-10.1371/journal.pone.0000718。
- 33.
AtGenExpress可视化工具(AVT)(开发)。[http://jsp.weigelworld.org/expviz/expviz.jsp?experiment=development&normalization=absolute&probesetcsv=At5g40840&action=Run]
- 34.
AtGenExpress可视化工具(AVT)(激素)。[http://jsp.weigelworld.org/expviz/expviz.jsp?experiment=hormones&normalization=absolute&probesetcsv=At5g40840&action=Run]
- 35.
Schmid M, Davison TS, Henz SR, Pape UJ, Demar M, Vingron M, Schölkopf B, Weigel D, Lohmann JU:拟南芥发育的基因表达图谱。植物学报,2005,37(5):501-506。10.1038 / ng1543。
- 36.
Takahashi N, Quimbaya M, Schubert V, Lammens T, Vandepoele K, Schubert I, Matsui M, Inzé D, Berx G, De Veylder L: mcm结合蛋白ETG1有助于复制后同源重组修复所需的姐妹染色单体内聚。公共科学学报,2010,6 (1):e1000817-10.1371/journal.pgen.1000817。
- 37.
Schubert V, Weiβleder A, Ali H, Fuchs J, Lermontova I, Meister A, Schubert I:内聚蛋白基因缺陷可能损害姐妹染色单体的排列和基因组稳定性拟南芥.中国生物医学工程学报,2009,34(5):591-605。10.1007 / s00412 - 009 - 0220 - x。
- 38.
Tax FE, Vernon DM:拟南芥t - dna相关复制/易位。对突变分析和功能基因组学的启示。中国植物学报,2001,26(4):344 - 344。10.1104 / pp.126.4.1527。
- 39.
Charles K, Povirk LF:博莱霉素对DNA双链裂解中间产物结构模拟的作用。化学与毒物,1998,11(12):1580-1585。10.1021 / tx980154g。
- 40.
Kozak J, West CE, White C, da Costa-Nunes JA, Angelis KJ: DNA双链断裂的快速修复拟南芥依赖于参与染色体结构维持的蛋白质。DNA修复,2009,8(3):413-419。10.1016 / j.dnarep.2008.11.012。
- 41.
Kamisugi Y, Schaefer DG, Kozak J, Charlot F, Vrielynck N, Holá M, Angelis KJ, Cuming AC, Nogué F: MRE11和RAD50,但不包括NBS1Physcomitrella金属盘.中国生物医学工程学报,2012,40(8):3496-3510。10.1093 / nar / gkr1272。
- 42.
姜玲,夏敏,李氏,Makaroff CA:拟南芥内聚蛋白SYN3定位于核仁,对配子发生至关重要。植物学报,2007,30(6):344 - 344。10.1111 / j.1365 - 313 x.2007.03106.x。
- 43.
古达兹AA, Jeggo P, Lobrich M:异染色质对DNA双链断裂修复的影响:使强沉默型放松。DNA修复,2010,9(12):1273-1282。10.1016 / j.dnarep.2010.09.013。
- 44.
Jeggo PA, getting V, Löbrich M:同源重组在辐射诱导双链断裂修复中的作用。放射学杂志,2011,30(1):1 -12。10.1016 / j.radonc.2011.06.019。
- 45.
夏波奈尔,艾兰,葛乐高,怀特CI: DNA双链断裂修复通路的动力学分析拟南芥.DNA修复,2011,10(6):611-619。10.1016 / j.dnarep.2011.04.002。
- 46.
West CE, Waterworth WM, Story GW, Sunderland PA, Jiang Q, Bray CM:拟南芥的中断AtKu80基因显示AtKu80蛋白在DNA双链断裂的有效修复中起重要作用在活的有机体内.植物学报,2002,31(4):517-528。10.1046 / j.1365 - 313 x.2002.01370.x。
- 47.
Watanabe K, Pacher P, Dukowic S, Schubert V, Puchta H, Schubert I: DNA损伤后,染色体5/6复合体的结构维持促进姐妹染色单体对齐和同源重组拟南芥.植物细胞学报,2009,21(9):2688-2699。10.1105 / tpc.108.060525。
- 48.
bluyard JY, Gallego ME, Savigny F, White CI:拟南芥Rad51序列在减数分裂和DNA修复中的不同需求。植物学报,2005,41(4):533-545。10.1111 / j.1365 - 313 x.2004.02318.x。
- 49.
Sanchez-Moran E, Santos J-L, Jones GH, Franklin FCH:拟南芥减数分裂过程中ASY1介导atdmc1依赖同源体重组。基因开发,2007,21(17):2220-2233。10.1101 / gad.439007。
- 50.
Pradillo M, López E, Linacero R, Romero C, Cuñado N, Sánchez-Morán E, Santos JL: RAD51和DMC1在植物减数分裂重组中的作用的新见解。植物学报,2012,29(6):344 - 344。10.1111 / j.1365 - 313 x.2011.04845.x。
- 51.
Covo S, Westmoreland JW, Gordenin DA, Resnick MA:内聚蛋白抑制同源染色体间DNA损伤诱导的重组。公共科学学报,2010,6 (7):e1001006-10.1371/journal.pgen.1001006。
- 52.
Watrin E, Peters J-M:在哺乳动物细胞中,内聚蛋白复合物是DNA损伤诱导的G2/M检查点所必需的。环境科学学报,2009,28(17):2625-2635。10.1038 / emboj.2009.202。
- 53.
许h, Balakrishnan K, Malaterre J, Beasley M, Yan Y, Essers J, Appeldoorn E, Thomaszewski JM, Vazquez M, Verschoor S, Lavin MF, Bertoncello I, Ramsay RG, McKay MJ:Rad21-内聚蛋白单倍体缺陷阻碍DNA修复,增强小鼠胃肠道辐射敏感性。公共科学学报,2010,5 (8):e12112-10.1371/journal.pone.0012112。
- 54.
徐华,Tomaszewski JM, McKay MJ:染色体内聚的破坏会成为癌症的通道吗?中华癌症杂志,2011,11(3):199-210。10.1038 / nrc3018。
- 55.
Gallego ME, Bleuyard JY, Daoudal-Cotterell S, Jallut N, White CI: Ku80在非同源重组中起作用,但在T-DNA整合中不是必需的拟南芥.植物学报,2003,35(5):557-565。10.1046 / j.1365 - 313 x.2003.01827.x。
- 56.
Vannier JB, Depeiges A, White C, Gallego ME: Rad50在端粒维护中的两个作用。环境科学学报,2006,25(19):4577-4585。10.1038 / sj.emboj.7601345。
- 57.
Najdekrova L, Siroky J: NBS1与端粒酶在小鼠端粒的维持中发挥协同作用拟南芥.中国生物医学工程学报,2012,29(4):457 - 457。
- 58.
Bose T, Gerton JL:内聚病,基因表达和染色质组织。中国生物医学工程学报,2010,29(2):319 - 319。10.1083 / jcb.200912129。
- 59.
金玉娟,陈建平,金涛:同源盒基因A位点染色体环和异染色质屏障活性的发育调控机制。中国科学:自然科学,2011,29(3):389 - 397。10.1073 / pnas.1018279108。
- 60.
Sadano H, Sugimoto H, Sakai F, Nomura N, Osumi T: NXP-1是一种与Rad21/Scc1/Mcd1相关的人蛋白,是核基质的组成部分。生物化学学报,2000,26(1):418-422。10.1006 / bbrc.1999.1969。
- 61.
尹俊,金玉生,郑俊华,徐普杰,朴春梅:拟南芥AT-hook基序蛋白AHL22通过修饰开花位点T染色质调控开花起始。中国生物医学工程学报,2012,29(3):357 - 357。10.1074 / jbc.M111.318477。
- 62.
徐艳,王颖,Stroud H,顾霞,孙波,甘e - s,吴k -H, Jacobsen SE,何艳,Ito T:一种基质蛋白通过与视网膜母细胞瘤相关蛋白相互作用沉默转座子并重复。动物学报,2013,23(4):345-350。10.1016 / j.cub.2013.01.030。
- 63.
爱德华兹K,约翰斯通C,汤普森C:一种简单快速的方法制备植物基因组DNA进行PCR分析。核酸研究,1991,19 (6):1349-10.1093/nar/19.6.1349。
- 64.
Curtis M, Grossniklaus U: A GatewayTM高通量植物基因功能分析的克隆载体集。植物营养学报,2003,23(2):462-469。10.1104 / pp.103.027979。
- 65.
克拉夫SJ,弯曲AF:花浸:一个简化的方法农杆菌属-介导转化拟南芥.植物学报,1998,16(6):735- 738。10.1046 / j.1365 - 313 x.1998.00343.x。
- 66.
康兹C,谢尔J: T的启动子ldna基因5控制嵌合基因的组织特异性表达由一种新型农杆菌属二进制向量。生物化学学报,2004,28(3):383-396。10.1007 / BF00331014。
- 67.
社会科学统计学。[http://www.socscistatistics.com/mannwhitney/Default.aspx]
- 68.
Endo M, Ishikawa Y, Osakabe K, Nakayama S, Kaya H, Araki T, Shibahara K, Abe K, Ichikawa H, Valentine L, Hohn B, Toki S:拟南芥caf1突变体中同源重组和T- dna整合频率的增加。环境科学学报,2006,25(23):5579-5590。10.1038 / sj.emboj.7601434。
- 69.
Pfaffl MW:一种新的实时RT-PCR相对定量数学模型。中国生物工程学报,2001,29 (9):e45-10.1093/nar/29.9.e45。
- 70.
Olive PL, Banath JP:彗星实验:一种测量单个细胞DNA损伤的方法。Nat协议,2006,1(1):23-29。10.1038 / nprot.2006.5。
确认
JCN感谢Eng。Paula Matos在辐照会议中提供的宝贵帮助(CHIP/Instituto Tecnológico e Nuclear,葡萄牙)。我们也感谢Gulbenkian de Ciência研究所(葡萄牙)、CHIP/ Tecnológico e Nuclear研究所(葡萄牙)和新墨西哥大学(美国)允许使用他们的设施进行辐照试验。JCN。感谢C. West博士(英国利兹大学)提供Ws landrace和atku80突变,和Eng。Alexandre Calapez (Instituto de Sistemas e Robótica,里斯本大学,葡萄牙)对统计数据分析进行批判性讨论。这项工作得到了Fundação para a Ciência ea Tecnologia[奖学金SFRH/BPD/30365/2006和研究项目PTDC/BIA-BCM/ 641992 /2006到JC-N]、捷克共和国教育、青年和体育部[项目LD13006到JK和KJA]和捷克科学基金会[项目13_06595S到JK和KJA]以及美国新墨西哥大学(UNM)的支持。[毕业后研究和教育计划,R25GM075149从NIH,到GMD,启动资金到PCN和OP]。CC由奖学金[24/04/10 CPS]资助(在IBET项目331项目范围内Produção em cultura de células em suspensão in vitro do principio activo de胸腺mastichina”。在实验室里。Pedro Fevereiro教授,Laboratório de Biotecnologia de Células Vegetais)。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
JC-N协调了这项研究,并设计了除qRT-PCR和彗星测定外的所有实验工作。qRT-PCR实验由JC-N和CC共同设计并进行;CC处理数据。JK和KJA设计、执行和处理了彗星数据。JC-N、PCN、GMD、OP进行辐照测定;PCN和JC-N进行基因分型。本文由JC-N撰写,所有作者都有宝贵的贡献。所有作者都阅读并批准了最终的手稿。
电子辅助材料
材料与方法植物材料;存在分析;彗星试验。
附加文件1:图S1。AtRAD21.1-绿色荧光蛋白6 x他的转录本检测,基因示意图表示。图S2。电离辐射照射后48小时内稳态转录水平的相对变化。图S3。在电离辐射照射前后,不同基因型的具有不同数量真叶的幼苗的频率。图S4。电离辐射照射后,每株幼苗真叶数的平均值。图S5。彗星试验-显著差异。图S6。纯合突变植物的基因分型。图S7。螺栓表现型。表S1。检测基因表达的引物(RT-PCR)。表S2。诱导DNA dsb损伤后,Col中转录稳态含量的相对变化。表S3。qRT-PCR定量引物AtRAD21电离辐射照射后转录本稳态水平的变化。表S4。每株幼苗真叶数。表S5。平均值,模式和中位数(每苗真叶)。表S6。彗星分析数据。表S7。突变体和互补系的引物基因分型。(pdf 2mb)
权利和权限
本文由BioMed Central Ltd授权发布。这是一篇开放获取文章,根据创作共用属性许可协议(http://creativecommons.org/licenses/by/4.0),允许在任何媒介上不受限制地使用、传播和复制,前提是原创作品的名称要注明出处。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
da Costa-Nunes, j.a., Capitão, C., Kozak, J.;et al。AtRAD21.1和AtRAD21.3拟南芥内聚蛋白在体细胞DNA双链断裂损伤修复中发挥协同作用。BMC植物生物学14,353(2014)。https://doi.org/10.1186/s12870-014-0353-9
收到了:
接受:
发表:
关键字
- 拟南芥
- AtRAD21.1
- AtRAD21.3
- 内聚蛋白
- 彗星试验
- DNA损伤
- 基因表达