抽象的
背景
植物对保守的微生物衍生或损伤衍生分子(所谓的微生物或损伤相关的分子图案,扫描或潮湿)触发蜂窝信号传导级联以启动抵消防御反应。利用MAMP诱导的细胞钙水平升高作为最早的生化读数之一,我们启动了涉及早期混乱信号中涉及的组件的遗传筛拟南芥蒂利亚纳.
结果
我们在这里描述了钙升高改变5“(CCE5.)突变,其中5个等位基因CCE5.突变体被分离出来。它们都显示出用代表细菌衍生的混乱(FLG22和ELF18)和内源性潮湿(ATPEP1)的肽诱导蛋白后的钙水平降低,但对几丁质八胞素的正常反应。映射,突变的基因座的测序和互补研究揭示CCE5.编码受体样细胞质激酶(RLCK),avrPphB敏感的1-like 1(PBL1).PBL1的激酶活动来自三个CCE5.等位基因已经废除了在活的有机体内.验证具有T-DNA突变体的验证,除了PBL1,还需要另一种RLCK,诱导的钙胰酶1(BIK1),用于MAMP / DAMP诱导的钙升高。
结论
因此,PBL1和BIK1(而不是两个相关的rlck, PBS1和PBL2)是MAMP/ damp诱导的钙信号通路所必需的。拟南芥基因组中编码的许多其他rlck是否影响早期钙信号转导还有待研究——可能依赖于MAMP/DAMP配体的类型。未来的挑战将是识别这些不同rlck的底物,以阐明它们在质膜受体复合物和下游细胞信号元件之间的信号传递作用。
背景
在它们试图感染时,微生物激活了潜在宿主的细胞内信号级联。来自宿主的特定模式识别受体(PRRs)识别保守的微生物相关分子模式(MAMPs)或由组织损伤产生的某些特征分子,通常称为损伤相关分子模式(DAMPs) [1].PRRs是典型的受体样激酶(RLKs),如FLS2(鞭毛蛋白感应2)、EFR(延伸因子Tu受体)或PEPR1/PEPR2 (atpep受体1/2)。它们分别识别MAMPs, flg22 (n端鞭毛蛋白衍生肽),elf18 (n端延伸因子Tu片段)和DAMP, AtPep1 [2].结合各自的配体[3.] - [5.],用BAK1(BRI1相关激酶1),FLS2,PEPR1 / PEPR2或EFR杂磷酸化,其最初作为芸苔类固醇激素受体的交互式的激酶,BRI1 [6.].最近的结构研究表明,BAK1也与fls2结合的flg22的c端直接接触,因此可能被认为是一种共受体[7.].因此,Bak1.突变体对这些MAMPs/DAMPs的反应受损[5.]、[8.]、[9.].因此,BAK1充当植物免疫和发展中的多种途径的蛋白质伴侣(或共同受体?)[10].另一方面,由其他扫描诱导的信号传导,例如依甲酸丁,与Bak1相似[11].这种差异可能是感知甲壳素,Cerk1(Chitin Elicitor受体激酶1),拟拟南芥的含溶酶的rlk所需的潜在受体结构的结果[12] - [14与lrr型RLKs(如FLS2、EFR或PEPR1/R2)相比。
在MAMP/DAMP感知后,最早的信号事件是跨越质膜的离子通量,包括钙流入胞质[8.]、[15] - [17].通过多种钙结合的“解码器”蛋白如钙霉菌或钙依赖性蛋白激酶(CPKS)或钙蛋白B样(CBL)蛋白及其合作伙伴,CBL相互作用蛋白激酶(Cupks)(Cupks)的升高检测)进一步发送信号[18]、[19].钙作为一种信号分子,是MAMPs/DAMPs诱导的大多数下游反应的先决条件。例如,拟南芥中NADPH氧化酶RBOHD产生活性氧(ROS) [20.]是一个钙依赖的过程,由钙直接结合到RBOHD n端ef手刺激。此外,钙依赖蛋白激酶5 (CPK5)磷酸化RBOHD以促进其活性[21].丝裂原活化蛋白激酶(MAPKs)的激活也需要钙,因为细胞外钙的消耗或钙通道的抑制会阻止mmap诱导的MAPK激活[9.]、[22].
植物免疫钙的重要性也是间接的,观察到植物疗法细菌分泌细胞外多糖以螯合妊娠钙和衰减宿主MAMP信号[23].然而,植物钙信号的很多方面还没有被发现,特别是感知MAMPs/DAMPs和钙信号产生之间的步骤。我们使用了表达apoaequorin的转基因植物拟南芥蒂利亚纳在整个幼苗中调查MAMP信号事件的线[9.].Aequorin是一种钙敏感报告蛋白,用于测量细胞钙水平的变化[24].在结合钙后,它将结合的Coelenterazine假体组氧化成激发的Coelentamide,其在469nm处发出蓝光。所谓的l / l最大限度Aequorin产生的发光(L)与总剩余Aequorin的比率(L最大限度)被用作相对钙水平的估计。通过适当的校准参数,还可以转换L / L.最大限度值是绝对的细胞溶质钙浓度的值[25].
我们之前证明基于Aequorin的测量适用于高通量筛选,并用它来分离突变体“改变了钙海拔(CCE.)的表型。第一组已确定CCE.突变体是FLS2受体及其伴侣激酶BAK1 [26].这些突变体证明了在配体识别和钙通量之间寻找信号成分的筛选的适用性。目前的工作报告的特征CCE5.突变体和受体样细胞质激酶(Rlck)的鉴定,PBS1样1(PBL1是作为CCE5.基因,其中PBS1代表avrPphB sensitive 1,是一种RLCK假单胞菌含油pv。phopololicola蛋白酶avrpphb [27].对三个相关rlck突变体的分析表明,MAMP/ damp诱导的钙升高需要Botrytis-induced kinase 1 (BIK1)。
结果
这钙升高改变5(CCE5.)突变体受早期信号传导影响
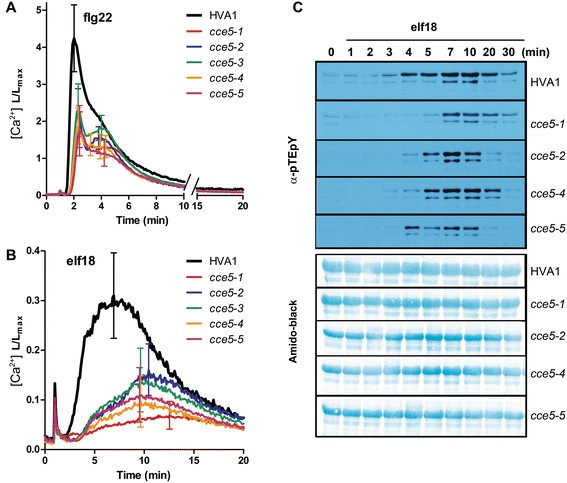
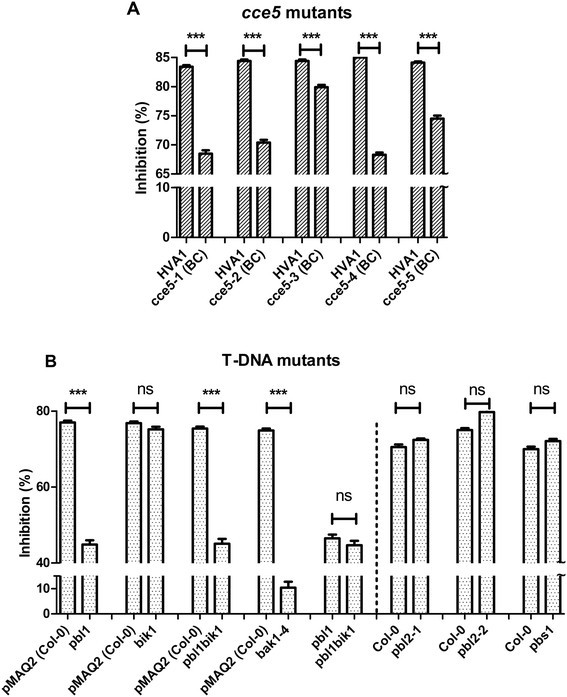
其他四个独立孤立改变了钙海拔(CCE.当交叉到先前描述时,突变体并未恢复到F1生成中的FLG22的“正常”钙响应CCE5.突变体(26(数据未显示)。缺乏互补性说明了这五个方面CCE.突变体是等位基因,因此被称为CCE5-1来CCE5-5.所有五个CCE5.与亲本HVA1线相比,突变线显示出降低的FLG22和ELF18诱导的钙升高;然而,ELF18诱导的钙水平的减少似乎比FLG22更强(图1a,b)。相应地,ELF18诱导的MAPK激活部分减少和延迟(图1C)。令人惊讶的是,FLG22诱导的MAPK活化的降低并不像ELF18那么明显。如果使用FLG22肽的较低浓度(例如10nm),则仅可见;在较高的浓度下,与HVA1相比没有差异是可辨别的(附加文件1:图S1)。因此,CCE5可能对这两种mamp有不同的信号作用。同样,其他快速反应,如活性氧(ROS)的积累也减少了CCE5.用FLG22或ELF18处理时等位基因(附加文件1:图S2)。由于MAPK激活和ROS累积在挑选时几分钟内发生,CCE5.在一些早期信号成分中“突变”。
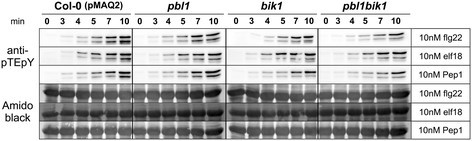
早期反应在钙升高改变5(CCE5.)突变体与亲本HVA1系比较。幼苗(〜8天)引发1μmflg22(一)或1 μM elf18(B)并测量钙水平。相对钙水平被描绘为L / Lmax比率(其中L / Lmax =每秒的发光计数/总发光计数剩余)。误差栏代表标准偏差(n> 12幼苗)。MAPK激活通过免疫印迹(α-PTEPY)显示1μmELF18elicitation后的磷酸化MAPKS(C).氨基黑染色硝基膜被用来估计等负荷。关于flg22处理后的MAPK激活,请参见附加文件1:图S1。
差分MAMP/DAMP响应CCE5.突变体让人想起BAK1依赖性的反应,但是CCE5.不是BAK1
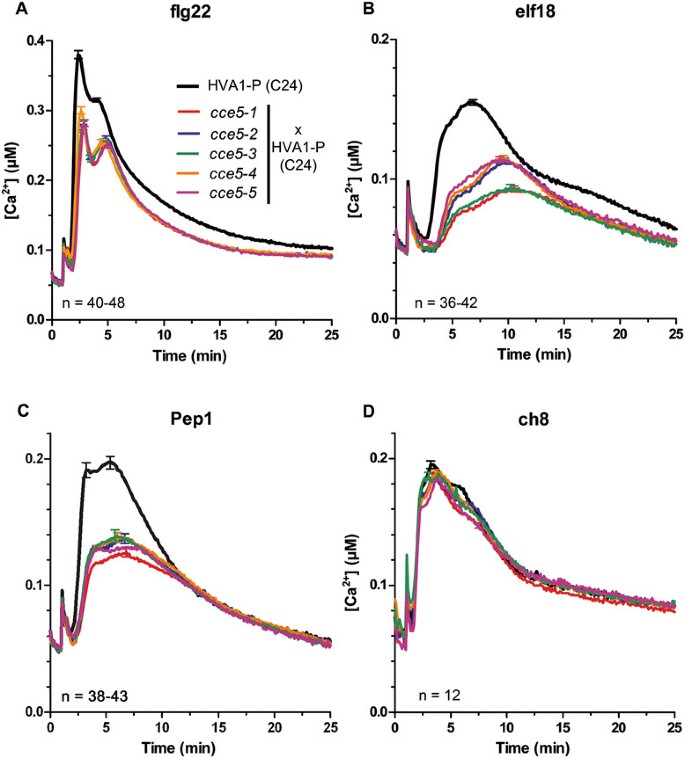
背景线CCE5.变种人携带着所谓的HVA1“转基因(在拟南芥蒂利亚纳C24生态型),其中aequorin报告对象是液泡外表面,它检测出液泡中的钙,但不允许测定绝对的钙浓度[28].为了执行计算绝对钙浓度所需的校准,并确认效果CCE5.细胞溶质钙水平的突变,五CCE5.等位基因被杂交到HVA1系(HVA1- p),该系还被细胞质apoaequorin (pMAQ2)构建物转化。这些“回交”系也减少了化学诱变引起的继发突变的可能影响。从F2群体中筛选降低mamp诱导的钙表型,以鉴定纯合子CCE5.通过帽标记分析验证植物和突变(见附加文件1:表S2)。使用这些细胞系,对不同MAMPs/DAMPs的调查显示,钙离子对flg22、elf18和AtPep1的反应降低,但对几丁质八聚体(ch8)的反应正常CCE5.(数字2).对各种MAMP / DAMP的这种差异表型是让CENCH的“BAK1依赖性”响应类型中兴,其中CH8诱导的钙升高不需要BAK1 [9.].
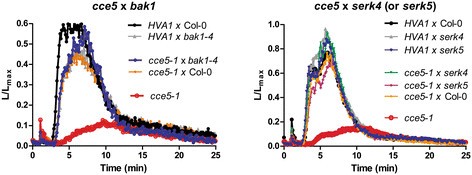
BAK1是bri1相关受体激酶,显示与FLS2, EFR和PEPR1/R2受体以配体依赖的方式相互作用[29].排除CCE5.突变体是弱的等位基因BAK1或相关的体细胞胚胎发生相关激酶(塞尔克)成员,CCE5-1和变种人杂交了bak1-4, serk4-1和serk5-1[5.].自CCE5.ELF18诱导效果最突出,我们测量了F1幼苗中的ELF18诱导的钙通量,并观察到CCE5.表型补充(图3.).这一结果表明CCE5.不是等位基因Bak1,Serk4.或SERK5因此CCE5.在不同的基因上发生了突变
CCE5.编码受体样激酶,PBL1
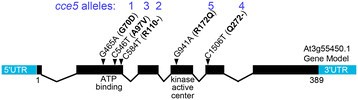
识别CCE5.基因,通过杂交获得F2群体CCE5-1拟南芥(Arabidopsis accession L呃0。对36个F2植株的分离分析表明CCE5.连接到aequorin转基因,位于3号染色体INDEL标记CER460928(1重组)和473892(1重组)之间[30.].CER460928和473892的地图位置分别为17.243303和21.186345 Mbp(基于TAIR 10)。这个区间包括1107个基因座,包括PBS1样1基因(PBL1,AT3G55450)编码受体样细胞质激酶(RLCK)。序列的序列PBL1基因的CCE5.突变体在所有五种基因中都显示了单核苷酸多态性(SNP)CCE5.等位基因,但不在PBL1来自另外两个的序列CCE.突变体,CCE7.和CCE8.[26].这些SNP导致两个过早的停止(CCE5-2/ r110-和CCE5-4/Q272-)及三种氨基酸交换(CCE5-1/ G70D,CCE5-3/ A97V和CCE5-5/R172Q)的PBL1序列(图4.).预测了两种基因模型PBL1TAIR数据库中的转录物,但由于我们无法检测到预测的替代剪接基因模型的成绩单(数据未显示),我们使用了389个氨基酸长PBL1蛋白(由AT3G55450.1的基因模型预测)指定氨基酸交换的位置CCE5.突变的蛋白质。
PBL1或PBS1样1属于RLCK的子类VII(附加文件1:图S3,包括创建成员AVRPHB易感1(PBS1)[31]和Botrytis诱导的激酶1(Bik1)[32]、[33].进一步验证CCE5.是PBL1的T-DNA插入突变体PBL1被孤立。对于比较,该系列RLCK的相关成员的T-DNA突变体显示参与PTI(BIK1,PBS1,PBL2)[34],也得到了。将T-DNA突变体与胞质溶胶表达(Col-0背景中的PMAQ2)交叉。然而,在一些十字架中观察到Aequorin报告者的沉默,在这些情况下(即pbl2和PBS1),这是一个独立生成的行,由驱动的apoaequorin表达ubiquitin10启动子(PUBQ-AEQ.在col0背景下)进行杂交。
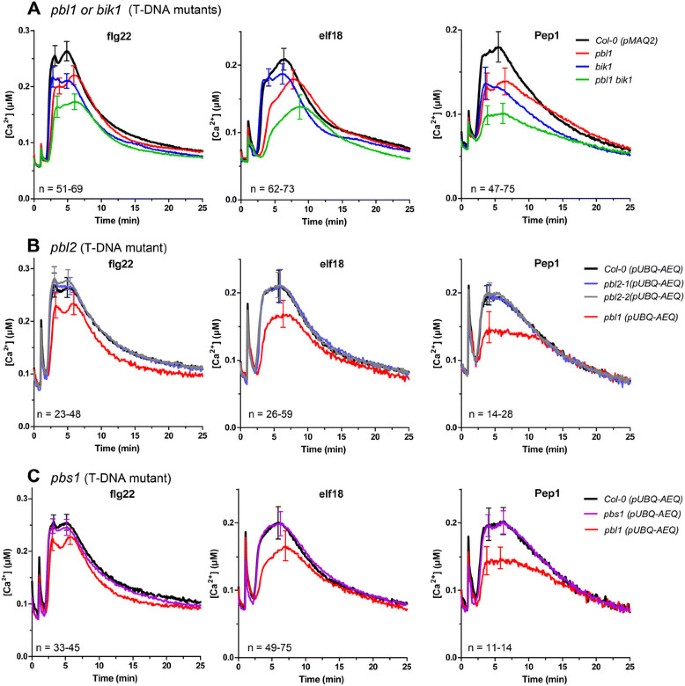
与之一致CCE5.在突变体中,由flg22、elf18和AtPep1诱导的钙升高降低可以在pbl1T-DNA突变体(图5.一种)。同样,A.bik1T-DNA突变体在由flg22、elf18和AtPep1诱导的钙升高中受到抑制pbl2和PBS1钙质升高没有降低(图5.公元前)。在实验中pbl2和PBS1, 一种pbl1线横渡了PUBQ-AEQ.以品系为对照,证明其表型缺失pbl2和PBS1不是由于Aequorin记者背景不同。此外,A.pbl1bik1与...相比,双突变体表现出FLG22-,ELF18-或ATPEP1诱导的钙升高的进一步减少pbl1和bik1单突变体(图5.一种)。还应该注意,改变的钙签名之间的不同之处bik1和pbl1突变体(图5.一种)。一起占据了这个Rlck家族的成员,差异差异地达到了MAMP / DAMP诱导的钙高度,并且之间存在部分冗余PBL1和BIK1.
在T-DNA插入突变体中的MAMP / DAMP诱导钙升高PBL1那BIK1那PBL2和PBS1.T-DNA插入突变体pbl1那bik1或者pbl1bik1双突变体与pMAQ2 aequorin转基因株系杂交。通过PCR验证突变体基因型后,在F2代或F3代测定MAMPs诱导的钙水平变化(一).由于沉默当跨越到pma2的记者pbl2(B)和PBS1(C)突变体,杂交是用独立产生的PUBQ-AEQ.一行与apoaequorin记者的表达相呼应UBIQUITIN-10启动子。因此,父母PUBQ-AEQ.Col-0背景中的线用作野生型钙签名的参考pbl2和PBS1.(两个独立的pbl2包括突变等位基因)。误差棒表示标准误差。
差分下游响应pbl1和/或bik1突变体
由于防御和生长调节之间可能的权衡,持续激活防御反应通常对植物的生长是有害的。因此,生长抑制试验是防御激活的一种简便方法。这是通过比较生长在正常和含mamp琼脂板上的幼苗的根长度来实现的。在这个实验中,我们将两种基因型放在同一个培养皿上并排进行比较,以消除培养皿之间可能产生的差异(例如,每个培养皿的琼脂数量影响幼苗可获得的MAMPs的绝对数量)。采用双因素方差分析分别确定基因型和处理间根长差异的统计学意义。为简单起见,抑制率(与生长在标准平板上的植物的平均根长相比)如图所示6..都是为了减少次级突变的影响CCE5.突变体被扫描到HVA1父母,筛选CCE.在测定前通过帽标记分析的表型和证实。与相应的背景线相比,介导的FLG22介导的生长抑制可以看出所有五个回复CCE5.突变体(图6.a)和pbl1T-DNA突变,但不是PBS1和pbl2(数字6.b)。令人惊讶的是,尽管钙增加了减少(图5.a),bik1突变体表明根本生长抑制没有降低。也没有添加增长的增长pbl1bik1双突变体(图6.B).直接比较pbl1单突变体和pbl1bik1在同一板上测定的双突变体也显示出根生长抑制没有统计学上显着的差异(图6.B)。PBL1和BIK1根中的表达水平非常相似(即,在整个当前可用的微阵列实验中的类似信号强度,如Genevistigator的分析),对FLG22介导的生长减少的差异影响不是由于缺乏BIK1表达的根源。因此,虽然PBL1和BIK1对早期信号事件有影响,比如钙的增加,PBL1扮演比BIK1在迟到的根生长抑制对FLG22的响应。另一方面,已显示BIK1但不是PBL1,在FLG22介导的抵抗力中发挥着重要作用假单胞菌含油感染,而BIK1和PBL1调节由选定的扫描和防御基因表达引起的胼舌沉积[34].因此,PBL1和BIK1在防御信号/反应中有重叠但也有不同的作用,这也反映在野生型表型pbl1植物与改变的生长表型和组成型SA积累相比bik1突变体(33].
因为钙的起坐激活的上游[9.]、[22[我们在T-DNA突变体中分析了MAPK激活PBL1那BIK1还有双突变体。然而,flg22、elf18和Pep1对MAPK的激活没有降低pbl1那bik1和pbl1bik1与他们的Col-0(PMAQ2)背景线相比(图7.).这与降低的ELF18诱导的MAPK激活相反(图1C)和剂量依赖性减少flg22诱导的MAPK激活(附加文件1:图S1)CCE5.突变体。由于MAPK激活的减少可以在多个中看到CCE5.在ems诱变株系中,这种差异不太可能是由于次级突变造成的。
激酶活性和rlck的适当定位决定了下游信号的传递
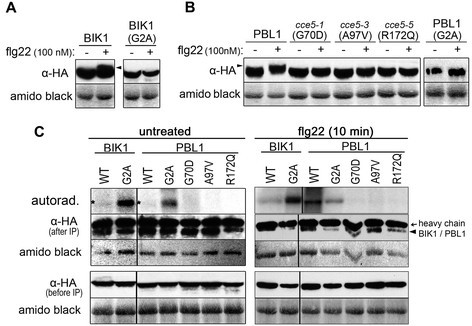
在刺激植物后,聚丙烯酰胺凝胶中PBL1和BIK1蛋白条带的迁移率降低(即“移动换档”),指示在活的有机体内据报道了激酶的磷酸化[34]、[35].自三个CCE5.预测等位基因编码PBL1蛋白与一个氨基酸交换(图4.),我们在凝胶迁移率方面测试了这些突变的PBL1蛋白以及BIK1。作为阴性对照,我们突变了PBL1和BIK1的推定的MyRistoylation(G2A),预期预期蛋白质靶向质膜。所有这些构建体均用C末端HA表位标记,用于在拟南芥叶片原生质体中瞬时表达。在FLG22处理原生质体后,可以看到野生型PBL1和BIK1的迁移率,但不适用于G2A Myristoylation位点和G70D,A97V和R172Q PBL1变体(图8.A, B).这表示没有在活的有机体内FLG22处理后突变蛋白变体的磷酸化。
在活的有机体内flg22处理后PBL1或BIK1的磷酸化。用表达ha标记BIK1的质粒转染原生质体(一), PBL1(B),或指示的变体。蛋白表达过夜后,用100 nM flg22 (10 min)处理原生质体,收获后用抗ha蛋白印迹(western blotting)。在活的有机体内通过降低蛋白质的迁移率(用黑色箭头突出显示)通过磷酸化。氨基黑色染色硝基膜被用来估计等负荷。在(C),使用免疫沉淀的激酶的自磷酸化用于确定激酶活性是否受到突变损害。该实验进行了三次以相似的结果进行了三次。注意,未处理原生质体中的野生型(WT)激酶的自磷酸化是可变的,通常低,但可以看到弱带(由星号表示)。G70D,A97V和R172Q变体的自磷酸化始终不可见(或低于野生型激酶)。
为了检测激酶的活性是否受到影响,我们用抗ha抗体对蛋白进行免疫沉淀,并在放射性ATP存在下孵育免疫沉淀以实现自磷酸化。sds -聚丙烯酰胺凝胶分离后,野生型和G2A突变的PBL1和BIK1蛋白对应的放射性信号显示,这些蛋白仍然是活性激酶(图)8.C)。值得注意的是,在FLG22处理之前,野生型BIK1或PBL1自动磷酸化信号(突出显示图中星号8.C,左面板)。然而,与野生型PBL1蛋白相比,G70D、A97V或R172Q突变的PBL1突变体没有(或明显减少)自磷酸化(图)8.C)。一起参加这三个CCE5.突变导致PBL1激酶活性丧失,而PBL1定位错误G2A.和BIK1G2A.蛋白质防止了在活的有机体内这些激酶在flg22信号转导后的磷酸化。
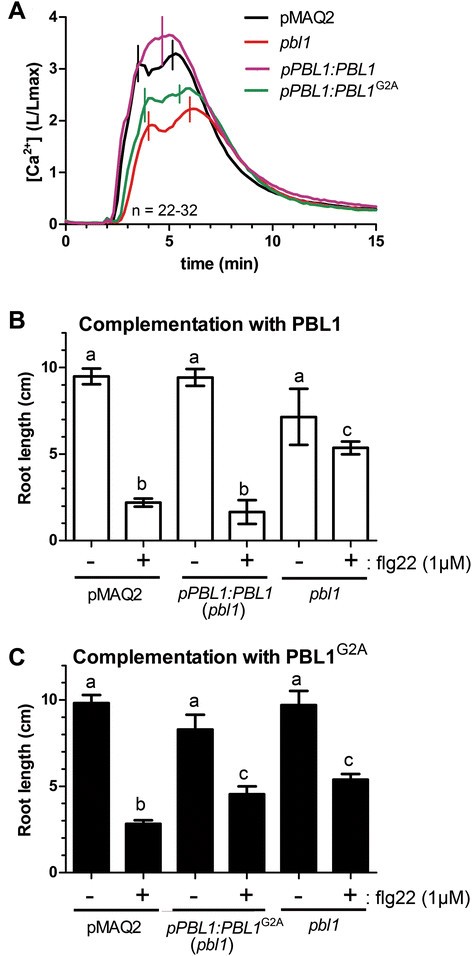
作为MAMP诱导的钙升高所需PBL1所需的最终证据,我们介绍了包含的基因组DNA片段PBL1基因座位进入pbl1T-DNA突变体。该基因组片段补充了降低的钙抬高(图9.A)和根生长抑制(图9.B)表型的pbl1.作为阴性对照,推定的MyRistoylation位点(G2A)的突变阻止了互补CCE.表型(图9.A)以及flg22诱导的根生长抑制(图9.C).因此,肉豆蔻酰化和PBL1对质膜的适当靶向是PBL1信号功能的必要条件。
讨论
钙信号和MAMP/DAMP信号所需要的特殊rlck
利用正向和反向遗传学以及互补研究,我们鉴定了CCE5.基因作为编码受体样细胞质激酶,pbl1和与CCE5.变种人,我们分离出五种新的pbl1等位基因。我们进一步证明了另一种RLCK BIK1,而不是PBS1和PBL2,是MAMP/ damp诱导的钙升高通路所必需的。这与最近的一篇报道一致,即flg22诱导的钙通量在bik1[36].使用这些新的pbl1等位基因和T-DNA插入突变体,MAMP介导的根生长抑制测定确认了要求PBL1导致生长停滞的下游信号。然而,bik1突变对flg22介导的生长阻滞无明显影响。因此,尽管两pbl1和bik1突变体显示出降低的MAMP / DAMP诱导的钙升高,下游生长抑制效果不同。一个解释是PBL1和BIK1不仅仅是多余的冗余,而且还具有不同的信号传导角色,其其他研究增强,显示了对MAMP诱导的ROS生产中PBL1和BIK1的重叠和明显的要求,调用沉积,基因表达和病原体抵抗力[33]、[34]、[37]、[38].事实上,这种概念从不同的钙签名中明显明显pbl1和bik1突变体(见图5.A).第二种可能性是,细胞质钙水平的信号关键阈值对于决定生长抑制(或其他mamp诱导的反应)的程度并不是关键或原因,这意味着与BIK1相比,PBL1的信号作用更重要。调节生长和防御激活之间可能的平衡。BIK1的反向作用可能是作为防御的正调节,但作为油菜素内酯信号的负调节[39促成了这种增长差异。最近,另一种RLCK, PBL27被发现是CERK1几丁质受体的首选底物(与BIK1相比)。相比之下,已知能使BIK1磷酸化的BAK1几乎不能使PBL27磷酸化。PBL27似乎对flg22信号传导也不是必需的[40].因此,根据配体,招募不同的RLK或RLCK用于信令。这些发现支持BAK1要求FLG22,ELF18和ATPEP1信号传导至甲壳素的信号[5.]、[9.].我们的数据显示,由flg22、elf18和AtPep1诱导的最佳钙信号需要PBL1,而不是几丁质(图)5.),适合这种模式。总之,对于不同的混乱/潮湿信号传导的受体下游的RLCK系列成员似乎存在差异要求。
磷酸化对于信号继电器至关重要
MAMP/DAMP感知后,质膜上各种RLKs和RLKs的募集(和/或交换)表明磷酸化级联在早期信号传导中的作用。在刺激之前,FLS2和BIK1已经在一个蛋白质复合物中[38Bak1交互RLK(BIRS),BAK1也似乎也很复杂[41].flg22刺激后几分钟内,FLS2招募BAK1 [3.]磷酸盐酸盐酸盐。反过来,活化的Bik1横向磷酸化FLS2和BAK1 [38].Bak1也跨越FLS2,但显然在不同的残留物中作为BIK1 [42].基于自磷酸化测定(图8.c),FLG22处理的原生质体中的BIK1和PBL1的激酶活性似乎更高。未处理原生质体中的Bik1 / PBL1的较低活性可能暗示引发前的一些其他组分(例如,磷酸酶)抑制。沿着这个想法,值得注意的是,n末代MyRistoylation Bik1G2A.和pbl1.G2A.突变体通常以较高的自磷酸化水平恢复。人们可以推测PBL1的定位错误G2A.和BIK1G2A.防止与磷酸酶接触,该磷酸酶可能在FLS2-BIK1(或PBL1)蛋白质复合物中以限制防御信号传导。实际上,已显示SER / THR蛋白磷酸酶2A(PP2A)与BAK1相关联并控制PRR复合物的激活[43];同样或相似的PP2As是否负调控BIK1或PBL1还有待证实。最近,研究表明BAK1和BIK1都是双特异性激酶,可以修饰丝氨酸/苏氨酸和酪氨酸残基[44].PRRs、BAK1、BIK1和PBL1之间的一系列复杂的磷酸化作用是重要的,因为这些激酶中的任何一个的突变消除活性都会阻碍信号传导。在凝胶电泳中,PBL1蛋白的迁移率发生了变化CCE5.基因显然是磷酸化的在活的有机体内经MAMP激发后[34].激酶活性的丧失(或减少)CCE5-衍生的蛋白质变异(图8.C)对应于激酶结构域重要残基的变化。G70D和A97V突变位于ATP结合区(即激酶亚结构域I和II),而R172Q位于激酶亚结构域VI活性中心的n端(C.F.数字4.和图8.C).结合文献数据,我们新分离的钙信号减弱CCE5./pbl1等位基因表明,PBL1(和所有其他招募的RLK / RLCK)的激酶活动对于早期的加工/潮湿信号至关重要。
下游MAPK激活受影响pbl1和bik1突变体?
PBL1 / BIK1磷酸化的下游是钙升高,这反过来已经通过药理学抑制剂研究表明,下游MAPK激活[22].然而,尽管钙升高衰减,但FLG22,ELF18或ATPEP1的MAPK激活没有减少pbl1和bik1T-DNA突变体以及pbl1bik1与他们的COL-0(PMAQ2)背景线相比时双突变体(图7.).这一观察结果与以前的报告一致[34]、[45]、[46].另一方面,我们观察到elf18诱导的MAPK激活减少/延迟CCE5.突变体(图1c),而对于FLG22,当使用较低浓度的FLG22肽时,可以观察到弱效果。对该差异的可能解释可能是突变或截断的CCE5蛋白(具有抑制性质)表示CCE5.而不是T-DNA插入突变体中(推测)缺乏蛋白质。另外,突变体的不同遗传背景也可能起到一定作用。在所有未观察到MAPK激活差异的研究中,突变在Col-0,而在CCE5.(pbl1)突变体具有C24背景。我们以前报道,C24加入具有较高水平的FLS2受体,同时,在公共基因表达分析数据的基础上,对EFR受体的相反是如此[26].同时也检测到了一些snpFLS2.和EFR声码器作为HVA1 (C24)基因[26],这可能进一步有助于对FLG22和ELF18的不同敏感性。在一起,这可以解释观察到的降低的ELF18诱导的MAPK激活CCE5.突变体,但只有剂量依赖性FLG22诱导的MAPK响应。沿着这个概念,张等人。[34的研究也报道了胼胝质沉积pbl1突变体在FLG22处理时是正常的,但在用ELF18处理时减少[34].因此,基因型之间的其他信令组分中的差分扫描受体水平和/或尚未改变可以确定从PBL1到MAPK和其他下游事件中的信号中继系统中的系统的灵敏度。另外,Rlck,ripk,磷酸化rin4和类似于RPM1抗性蛋白的RIN4磷酸化的识别与RPS2的RIN4切割相比[47[可以推测,通过拟南芥在拟南芥之间的抗性蛋白质光谱的不同结构,也可以推测MAMP诱导的RLCK磷酸化。
定位到膜是PBL1和BIK1功能的先决条件
除了其激酶活动,PBL1和BIK1的定位似乎对互补的互补非常重要CCE.表型。作为GFP融合蛋白的Bik1已被证明是在洋葱表皮细胞中使用异源表达的血浆膜局部化[33].然而,为了我们的知识,从未经过实验确定这是由于其他蛋白质的靶向或招募。当引入推定的MyRistoylation位点时,铸造器官脱落所需的rlck,显示器脱落所需的血浆膜定位降低。MyRistoylation通常与棕榈酰化有关,以增强膜相互作用。然而,即使邻近的棕榈酰基位点(C4s)另外发生突变,也没有观察到铸造定位的进一步降低[48].肉豆蔻酰化被认为是与质膜的初始但微弱的相互作用;这种膜定位的稳定性可能通过其他修饰或与原质膜定位成分的相互作用而进一步加强[49].我们现在表明PBL1 / BIK1推定的MyRistoylation站点的G2A突变被阻止信号传导(即NO.在活的有机体内MAMP处理后磷酸化,图8.),但激酶(自磷酸化)功能明显完整。此外,G2A变异并没有补充pbl1突变(图9.).同样,尽管被avrPphB半胱氨酸蛋白酶切割,但被识别的“活性”PBS1片段必须保留在质膜上以激活RPS5 [50].在这种情况下,血浆膜靶向通过在PBS1的N-末端中的半胱氨酸残基的S-酰化介导。因此,不仅是PBS1蛋白的功能,而且还识别其扰动(即Eti)需要正确的膜定位。连合在一起,将RLCKS定位到适当的细胞隔室对于功能至关重要。
在发病过程中禁用RLCK功能会阻断防御信号
PBS1是PBL(PBS1样)组的创始成员。这假单胞菌AVRPHB效应器,一种注射到宿主细胞中的细菌毒力蛋白,通过其半胱氨酸蛋白酶活性切割PBS1 [31].随后,发现AVRPHB可以切割至少10个其他PBS1样RLCK [34].它们的切割/拆除代表AVRPPH的毒力函数,并表明这些PBLS / RLCKS在抗细菌的抵抗机制中起作用。涉及的研究提供了对此概念的支持Xanthomonas.XopAC效应器,似乎针对多个rlck [37].与avrPphB不同,XopAC不裂解,但在易感植物中尿苷化BIK1和RIPK [45].这种尿苷5'-单磷酸盐在Bik1和裂纹的活化环中的保守磷酸化位点转移,防止磷酸化,从而减少它们的激酶活动并因此抑制下游防御信号传导。根据武器 - 竞争的假设,XOPAC似乎是在抗药性植物中识别的主要无流动因素,例如拟南芥COL-0加入。此外,还有更多的增长Xanthomonas Campestris.pv。Campestris.表达XopAC在里面pbl2背景。这表明XOPAC触发的免疫需要RLCK,PBL2 [37].这些靶向RLCK的各种病原体效应子的观察结果符合RLCK在防御信号中的推测重要性。但是,虽然AVRPPHB切割多个PBLS / RLCK [34],只有rps5识别PBS1裂解[27]、[51].我们在此报告PBL1和BIK1,但既不是PBL2也不是PBS1,也不需要用于MAMP / DAMP诱导的钙信令(图5.).这就提出了一个问题:如果PBS1对mamp诱导的钙信号不重要,那么avrPphB为什么会以PBS1为靶点?事实上,到目前为止,还没有证据表明PBS1在病原体抗性中的重要性。正如张提出的等等。[46,一种观点认为PBS1可能是一个“诱饵”[52进化到能够识别病原体效应器的真实目标的扰动。在这种情况下,PBL1和BIK1将是avrPphB真正的靶点,这与受体复合物组分的交叉磷酸化以及随后钙的触发和下游防御信号有关。
方法
株系及栽培条件
这拟南芥蒂利亚纳在C24背景中的COL-0背景中PMAQ2和HVA1的线条是从M.和H. Knight获得[25].这些品系在花椰菜花叶病毒35S启动子的控制下表达apoaequorin基因。在HVA1的情况下,aequorin作为焦磷酸酶(H + - PPase)-apoaequorin融合蛋白靶向到液泡膜表面的所谓液泡微区(vmd);这样就可以测量这个液泡附近的钙变化。为回交所示的图2,首先用PMAQ2构建体重新转换HVA1(C24)线,以获得表达含细胞溶质apoaequorin(指定的HVA1-P)的线。然后将其HVA1-P线路越过CCE5.突变体。本研究中使用的T-DNA线列在附加文件中1:表S1)。在短的日期条件下(8小时光,16小时黑暗循环),在气候室中的土壤中种植了ROS测定的植物。对于钙和MAPK测定,种子被表面灭菌,在4℃下分层> 2d,并在如下所述的长期条件下(16小时光,8小时黑暗循环)在液态MS中生长。[25].
钙测量
如上所述,进行种子灭菌,幼苗生长和用于96孔板格式的钙测量的其他实验设置如上所述[26].
ROS,MAPK和生长抑制测定
如前所述,检测早期mamp触发的反应,如MAPK激活和活性氧(ROS)积累[9.].作为MAMPs的晚期反应,生长抑制试验如所述进行[26].简单地说,幼苗在添加或不添加1 μM flg22的ATS琼脂平板上垂直生长14天。为了区分由于治疗和基因型效应造成的生长差异,对对数进行了双向方差分析2-Transformed根长数据(基因型与治疗; P <0.001; R统计包)[54].为了更紧凑和简化的概述,请参见图中的数据6.描述为与对照相比的生长抑制率。
原生质体的瞬时表达,免疫沉淀和自磷酸化
如上所述进行拟南芥原生质体中的瞬时表达[9.].对于每个样品,1ml原生质体(约2 × 105.原生质体ML.-1)被转化;其中300μL被蛋白表达的蛋白表达分析。剩余的700μL用于免疫沉淀。除了补充萃取缓冲液的情况外,从转染的原生质体中提取蛋白质,除了补充1%Triton X-100 [55].将蛋白质与抗HA(Covance)和蛋白-G-琼脂糖一起温育(至少2小时,4℃)。在Lee等人中进行珠子的洗涤。[55],在洗涤术中沉淀琼脂糖珠的离心。最后,将具有免疫沉淀蛋白质的琼脂糖珠粒重悬于20μl激酶缓冲液中(20mM Hepes pH 7.5,15mM MgCl2, 5 mM EGTA, 1 mM DTT);保留5 μl进行western blot,以确定ha标记蛋白的回收率。γ32P-ATP (3000 Ci mmol .-1) (0.1 μl),在剩余的15 μl中加入0.1 μl, 30℃孵育1 h启动自磷酸化。加入5 μl 4 × sds加载缓冲液,95℃孵育5 min, 12 μl上载10% SDS-PAGE。电泳后,凝胶干燥,曝光过夜,磷酸化成像分析。
映射
从十字架产生F2种群CCE5-1(C24)与拟南芥生态浮标兰德斯堡erecta(L.呃0)。选择含有aequorin转基因(即表现出coelenterazine依赖性发光)的F2植株并自交。从F2植株叶片或F3幼苗中分离DNA,对每条染色体的3 ~ 5个标记(SNPs、INDELs)进行基因分型。对F3幼苗进行钙测量,分离表型用于推断相应的F2亲本是杂合子还是纯合子CCE5.突变。
分子克隆,植物转化和互补
对于互补分析,通过PCR使用Phusion®热启动高保真DNA聚合酶(Thermo Sciencific)和PENTER PBL1-PROM / -Stop并克隆到Pentr中的基因组片段,通过PCR扩增覆盖PBL1-ORF和2kb上游顺式CIS调节区的基因组片段。™/D-TOPO according to manufacturer’s instructions. Mutation of the N-myristoylation site (G2A) was performed using the QuikChangeII-Kit (Stratagene) with primers PBL1-NMSmut-F/-R according to manufacturer’s instructions. Clones were verified by sequencing and transferred通过LR反应成目的载体pGWB1得到ppbl1.:: PBL1和ppbl1.:: PBL1(G2A)。将构建传输到后根癌土壤杆菌(GV3101),拟南芥pbl1突变植物通过花卉 - 浸渍转化转化。在含叔霉素的板上选择转基因植物并与之交叉pbl1- 推出apoaequorin转基因。对于原生质体中的瞬时表达,PBL1和BIK1-ORFS从从COL-0的cDNA扩增或指示CCE5.通过PCR使用Phusion®热启动高保真DNA聚合酶(Thermo Scientific)的等位基因PBL1-START / -NOSTOP和BIK1-START / -NOSTOP并克隆到PETR中TM/D-TOPO根据制造商的说明。利用引物PBL1-STARTmut和BIK1-STARTmut引入n -豆粕酰化位点(G2A)突变。克隆经测序验证并转移通过LR反应成目的载体pUGW14得到P35S.:: pbl1-3xha,P35S.:: bik1-3xha,P35S.:: pbl1(g2a)-3xha和P35S.:: BIK1 xha (G2A) 3。
利用Phusion®热启动高保真DNA聚合酶(Thermo Scientific)从质粒pMAQ2中扩增aequorin-ORF,引物为AEQ-START/-STOP,克隆至pENTRTM/ D-Topo根据制造商的说明,通过测序和转移验证通过LR反应到目的地矢量酒吧 - 灯具获得PUBQ10:: AEQ。将结构转换为根癌土壤杆菌(GV3101),通过用花浸液转化转化拟南芥COL-0植物,通过用BASTA®(GlufofoSinat-铵;拜耳)来选择转基因植物。用于克隆的所有引物都列在附加文件中1:表S3)。
可获得的支持数据
所有支持数据都可以在文章中或附加文件中提供。系统发育树(附加文件1:图S3)已存放在TreeBase(ID:16757)中,数据将在以下URL上使用:http://purl.org/phylo/treebase/phylows/study/tb2:s16757.
附加文件
参考
- 1.
Boller T,Felix G:Elicitors的复兴:通过图案识别受体对微生物相关的分子模式和危险信号的感知。Annu Rev植物Biol。2009,60:379-406。10.1146 / annurev.arplant.57.032905.105346。
- 2.
Monaghan J,Zipfel C:植物图案识别受体复合物在质膜上。CurrOp植物BIOL。2012,15(4):349-357。10.1016 / J.PBI.2012.05.006。
- 3.
Chinchilla D,Zipfel C,Robatzek S,Kemmerling B,Nürnbergert,琼斯JD,Felix G,Boller T:鞭毛蛋白诱导的受体FLS2和BAK1引发植物防御。自然。2007,448(7152):497-500。10.1038 / Nature05999。
- 4.
Postel S,Kufner I,Beuter C,Mazzotta S,Schwedt A,Borlotti A,Halter T,Kemmerling B,Nurnberger T:多官能亮氨酸富含的重复受体激酶Bak1涉及拟南芥的发育和免疫。EUR JBelt Biol。2009,89(2-3):169-174。
- 5.
Roux M, Schwessinger B, Albrecht C, Chinchilla D, Jones A, Holton N, Malinovsky FG, Tor M, de Vries S, Zipfel C:拟南芥富含亮氨酸重复受体样激酶BAK1/SERK3和BKK1/SERK4在半生物营养和生物营养病原体的先天免疫中是必需的。植物学报,2011,23(6):2440-2455。10.1105 / tpc.111.084301。
- 6.
Wang Zy,Seto H,Fujioka S,Yoshida S,Chory J:Bri1是植物类固醇等离子体膜受体的关键组成部分。自然。2001,410(6826):380-383。10.1038 / 35066597。
- 7.
Sun Y,Li L,Macho Ap,Han Z,Hu Z,Zipfel C,Zhou Jm,Chai J:FLG22诱导的拟南芥FLS2-BAK1免疫复合物激活的结构基础。科学。2013,342(6158):624-628。10.1126 / Science.1243825。
- 8.
Krol E,Mentzel T,Chinchilla D,Boller T,Felix G,Kemmerling B,Postel S,Atens M,Jeworutzki E,Al-Rasheid Ka,Becker D,Hedrich R:拟南芥危险信号肽1的看法涉及模式识别受体ATPEPR1及其近同源物ATPEPR2。J Biol Chem。2010,285(18):13471-13479。10.1074 / JBC.M109.097394。
- 9.
RANF S,ESCHEN-LIPPOLD L,PECHER P,LEE J,SCHEEL D:在防御响应到微生物或损坏相关分子模式期间的钙信令和早期信号元件之间的相互作用。工厂J.2011,68(1):100-113。10.1111 / J.1365-313x.2011.04671.x。
- 10.
Schwessinger B, Roux M, Kadota Y, Ntoukakis V, Sklenar J, Jones A, Zipfel C:通过调节受体样激酶BAK1磷酸化依赖的植物生长、细胞死亡和先天免疫的差异调控。中国科学(d辑):地球科学(英文版)。
- 11.
Shan L, He P, Li J, Heese A, Peck SC, Nurnberger T, Martin GB, Sheen J:细菌效应分子靶向于常见的信号伴侣BAK1,扰乱多种MAMP受体信号复合物并阻碍植物免疫。细胞宿主微生物。2008,4(1):17-27。10.1016 / j.chom.2008.05.017。
- 12.
Miya A,Albert P,Shinya T,Desaki Y,Ichimura K,Shirasu K,Narusaka Y,Kawakami N,Kaku H,Shibuya N:Cerk1,Lysm受体激酶,对于拟南芥中的几丁质Elicitor信号传导至关重要。Proc Natl Acad Sci U S A. 2007,104(49):19613-19618。10.1073 / pnas.0705147104。
- 13.
Petutschnig ek,琼斯am,serazetdinova l,Lipka U,Lipka V:Lysm-RLK Cerk1是一个主要的邻豚结合蛋白拟南芥蒂利亚纳并受依托酸诱导的磷酸化。J Biol Chem。2010,285(37):28902-28911。10.1074 / JBC.M110.116657。
- 14.
万军,张晓春,Neece D, Ramonell KM, Clough S, Kim SY, Stacey MG, Stacey G:一种LysM受体样激酶在几丁质信号转导和拟南芥真菌抗性中起关键作用。植物学报。2008,20(2):471-481。10.1105 / tpc.107.056754。
- 15.
Ranf S,Wunnenberg P,Lee J,Becker D,Dunkel M,Hedrich R,Scheel D,Dietrich P:Vacuolar阳离子通道的丢失,ATTPC1不损害CA2+非生物和生物应力诱导的信号。工厂J.2008,53(2):287-299。10.1111 / J.1365-313x.2007.03342.x。
- 16.
Blume B,Nürnbergert,Nass N,Scheel D:受体介导的荷兰芹激活病原体防御所需的细胞质免疫钙。植物细胞。2000,12(8):1425-1440。10.1105 / TPC.12.8.1425。
- 17.
Samaj J, Ovecka M, Hlavacka A, Lecourieux F, Meskiene I, Lichtscheidl I, Lenart P, Salaj J, Volkmann D, Bogre L, Baluska F, Hirt H:丝裂原激活蛋白激酶SIMK在根尖生长调控中的作用。机械工程学报,2002,21(13):3296-3306。10.1093 / emboj / cdf349。
- 18.
Seybold H,Trempel F,Ranf S,Scheel D,Romeis T,Lee J:CA2+植物免疫反应中的信号转导:从模式识别受体到Ca2+解码机制。植物营养学报,2014,33(6):762 - 762。10.1111 / nph.13031。
- 19.
钙和活性氧在信号传导中的作用。植物营养与肥料学报。2013,29(2):461 - 468。10.1104 / pp.113.222950。
- 20。
Torres Ma,Dangl JL,Jones JD:Arabidopsis GP91phox同源物ATRBOHD和ATRBOHF是植物防御反应中的反应性氧中间体的积累所必需的。Proc Natl Acad SCI U S A. 2002,99(1):517-522。10.1073 / pnas.012452499。
- 21。
Dubiella U, Seybold H, Durian G, Komander E, Lassig R, Witte CP, Schulze WX, Romeis T:钙依赖蛋白激酶/NADPH氧化酶激活电路是快速防御信号传播所必需的。中国科学(d辑:地球科学),2013,32(6):734 - 741。10.1073 / pnas.1221294110。
- 22。
Ligterink W,Kroj T,Zurnieden U,Hirt H,Scheel D:受体介导的植物病原体防御映射激活的激活。科学。1997,276(5321):2054-2057。10.1126 / science.276.5321.2054。
- 23。
Aslam SN, Newman MA, Erbs G, Morrissey KL, Chinchilla D, Boller T, Jensen TT, De Castro C, Lerano T, Molinaro A, Jackson RW, Knight MR, Cooper RM:细菌多糖通过钙螯合抑制先天免疫。生物医学进展,2008,18(14):1078-1083。10.1016 / j.cub.2008.06.061。
- 24。
拟南芥冷驯化后低温钙信号的空间和细胞特征成像。植物营养与肥料学报,2000,21(3):429 - 434。10.1093 / jexbot / 51.351.1679。
- 25。
拟南芥的冷钙信号涉及两个细胞池和驯化后钙信号的变化。acta botanica sinica(云南植物学报). 1996,8(3):489-503。10.1105 / tpc.8.3.489。
- 26。
通过定量高通量筛选,发现了与防御相关的钙信号突变体拟南芥蒂利亚纳.莫尔植物。2012,5(1):115-130。10.1093 / MP / SSR064。
- 27.
Swiderski Mr,Innes Rw:拟南芥PBS1抗性基因编码新型蛋白激酶亚家族的成员。工厂J.2001,26(1):101-112。10.1046 / J.1365-313x.2001.01014.x。
- 28.
Knight H,Trewavas AJ,Knight Mr:钙信号拟南芥蒂利亚纳回应干旱和盐度。工厂J.997,12(5):1067-1078。10.1046 / J.1365-313x.1997.12051067.x。
- 29.
陈志刚,王志刚,王志刚,等:受体相关激酶BAK1。植物科学进展,2009,14(10):535-541。10.1016 / j.tplants.2009.08.002。
- 30。
Salathia n,Lee Hn,Sangster Ta,Morneau K,Landry Cr,Schellenberg K,Behere As,Gunderson Kl,Cavalieri D,Jander G,Queitsch C:Indel阵列:基因分型的负担得起的替代品。工厂J. 2007,51(4):727-737。10.1111 / J.1365-313x.2007.03194.x。
- 31。
Shao F,Golstein C,Ade J,StOTemyer M,Dixon Je,Innes Rw:通过细菌III型效应器切割拟南芥PBS1。科学。2003,301(5637):1230-1233。10.1126 / sciencel1085671。
- 32。
Laluk K,罗H,柴M,Dhawan R,Lai Z,Mengiste T:免疫应答调节器诱导的植物生长,乙烯信号传导和拟拟合症状的PAMP引发的免疫力诱导激酶1的生物化学和遗传要求。植物细胞。2011,23(8):2831-2849。10.1105 / TPC.111.087122。
- 33。
Veronese P, Nakagami H, Bluhm B, Abuqamar S, Chen X, Salmeron J, Dietrich RA, Hirt H, Mengiste T:膜固定的botrytis诱导的KINASE1在拟南芥对坏死和生物营养病原体的抗性中发挥着独特的作用。植物学报,2006,18(1):257-273。10.1105 / tpc.105.035576。
- 34.
张j,李文,翔t,刘z,laluk k,丁x,zou y,gao m,张x,陈某,mengiste t,zhangy,Zhou y,Zhou Jm:受体样细胞质激酶从多种植物免疫中整合信号传导受体并由a瞄准假单胞菌含油效应。细胞宿主微生物。2010,7(4):290-301。10.1016 / j.chom.2010.03.007。
- 35.
程C,高X,Feng B,Sheen J,Shan L,他P:植物免疫应对病原体的反应与变化的温度不同。NAT Communce。2013,4:2530。
- 36.
李玲,李敏,于玲,周铮,梁旭,刘铮,蔡刚,高丽,张旭,王勇,陈胜,周建明:fls2相关激酶BIK1直接磷酸化NADPH氧化酶RbohD调控植物免疫。细胞宿主微生物。2014,15(3):329-338。10.1016 / j.chom.2014.02.009。
- 37.
Guy E,Lautier M,Chabannes M,Roux B,Lauber E,Arlat M,Noel Ld:Xopac-Trigered对Xanthomonas的免疫依赖于拟南芥受体样细胞质激酶基因PBL2和ripk。Plos一个。2013,8(8):E73469-10.1371 / journal.pone.0073469。
- 38.
陆东平,吴胜,高晓霞,张玉英,单林,何鹏:一类受体样胞质激酶BIK1与鞭毛蛋白受体复合物联合启动植物天然免疫。中国科学(d辑:地球科学),2010,27(1):496-501。10.1073 / pnas.0909705107。
- 39.
林伟,卢丹丹,高旭,姜胜,王志平,何平,单丽:受体样胞质激酶BIK1对植物免疫和油菜素内酯信号通路的反向调控。中国科学(d辑:地球科学),2013,40(11):1294 - 1294。10.1073 / pnas.1302154110。
- 40。
Shinya T, Yamaguchi K, Desaki Y, Yamada K, Narisawa T, Kobayashi Y, Maeda K, Suzuki M, Tanimoto T, Takeda J Nakashima M, Funama R, Narusaka M, Narusaka Y, Kaku H, Kawasaki T, Shibuya N:通过拟南芥受体样胞质激酶PBL27选择性调节几丁质诱导的防御反应。植物J2014,11111 / TPJ.12535。
- 41。
Halter T,Imkampe J,Mazzotta S,Wierzba M,Postel S,Bucherl C,Kiefer C,Stahl M,Chinchilla D,Wang X,NürnbergerT,Zipfel C,Clouse S,Borst JW,Boeren S,De Vries SC,税收F,Kemmerling B:富含亮氨酸的重复受体激酶Bir2是Bak1在植物免疫中的负调节剂。Curr Biol。2014,24(2):134-143。10.1016 / J.CUB.2013.11.047。
- 42。
徐杰,魏X,闫立,刘德,马y,郭y,彭c,周h,阳c,娄血管,水,拟拟合拟拟合素诱导的激酶1的磷酸化残基的鉴定与功能分析。蛋白质细胞。2013,4(10):771-781。10.1007 / s13238-013-3053-6。
- 43。
Segonzac C,Macho Ap,Sanmartin M,Ntoukakis v,Sanchez-serrano JJ,Zipfel C:植物先天免疫期间蛋白质磷酸酶2a对Bak1的阴性控制。Embo J. 2014,33(18):2069-2079。10.15252 / embJ.201488698。
- 44。
Lin W, Li B, Lu D, Chen S, Zhu N, He P, Shan L:酪氨酸磷酸化蛋白激酶复合物BAK1/BIK1介导拟南芥先天免疫。中国科学(d辑:地球科学),2014,32(6):643 - 648。10.1073 / pnas.1318817111。
- 45。
冯峰,杨芳,荣伟,吴旭,张军,陈胜,何超,周建明:尿嘧啶黄单胞菌5 ' -单磷酸转移酶抑制植物免疫激酶的研究。自然科学。2012,485(7396):114-118。10.1038 / nature10962。
- 46。
张军,周建明:微生物分子信号触发植物免疫。植物学报,2010,33(5):783-793。10.1093 / mp / ssq035。
- 47。
亨利E,雅德塔凯,面板G:识别细菌植物病原体:局部,全身和转基因免疫力。新植物。2013,199(4):908-915。10.1111 / nph.12214。
- 48。
Curr Ca,Leslie Me,Orlowski Sk,Chen I,Wright Ce,Daniels MJ,Liljegren SJ:抛弃,膜相关的受体样激酶,抑制了拟南芥的器官脱落。植物理性。2011,156(4):1837-1850。10.1104 / pp.111.175224。
- 49。
Stael S, Bayer RG, Mehlmer N, Teige M:蛋白质N-酰化覆盖不同的靶向信号。中国海洋大学学报(自然科学版)。10.1016 / j.febslet.2011.01.001。
- 50。
对假单胞菌SYRINGAE5的抗性依赖于s-酰化和AVRPPHB sensitible1的暴露环。植物营养与肥料学报。2014,34(1):1 - 8。10.1104 / pp.113.227686。
- 51。
Ade J,Deyoung BJ,Golstein C,Innes RW:通过细菌蛋白酶间接激活植物核苷酸结合位点 - 富含亮氨酸的重复蛋白。Proc Natl Acad SCI U S A. 2007,104(7):2531-2536。10.1073 / pnas.0608779104。
- 52。
Van der Hoorn Ra,Kamoun S:从守卫诱饵:一种新模型,用于感知植物病原体效应。植物细胞。2008,20(8):2009-2017。10.1105 / TPC.108.060194。
- 53。
Kadota Y,Sklenar J,Derbyshire P,Stransfeld L,Asai S,Ntoukakis V,Jones JD,Shirasu K,Menke F,Jones A,Zipfel C:在植物免疫期间PRR相关激酶Bik1直接调节NADPH氧化酶RBOHD.Mol细胞。2014,54(1):43-55。10.1016 / j.molcel.2014.02.021。
- 54。
Delker C,Poschl Y,Raschke A,Ullrich K,Ettingshausen S,Hauptmann v,Grosse I,Quint M:拟南芥中转录营养响应网络的自然变化。植物细胞。2010年,22(7):2184-2200。10.1105 / TPC.110.073957。
- 55。
Lee J, Rudd JJ, Macioszek VK, Scheel D: MAPK级联组件控制的本地化动态变化病因相关(PR.)在欧芹先天免疫过程中的基因表达。中国生物医学工程学报。2004,27(4):434 - 434。10.1074 / jbc.M401099200。
确认
这项工作得到了德国研究基金会的资助,通过优先“SPP1212植物微”项目给J.L (LE 2321/1-3),以及合作研究中心项目SFB648给J.L.和D.S. L.E.-L。在ProNet-T3程序(03ISO2211B)中支持。我们感谢Nicole Bauer, Marina Häußler和Siska Herklotz出色的技术援助。
作者信息
隶属关系
通讯作者
附加信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
SR设计实验和KF,进行了钙,MAPK,遗传交叉,植物转化和互补实验。Le-L进行了原生质体转换研究。LW辅助遗传绘图CCE5.突变。DS和JL监督和协调。JL起草了手稿。所有作者阅读并批准了最终的手稿。
电子辅料
图S2。
附加文件1:图S1。: MAPK激活CCE5.突变体。减少MAPK激活CCE5-1在低浓度(10nm)(a)处的FLG22诱导突变体,但在较高浓度(100nm flg22)(b)下不明显。图S2。混乱诱导的活性氧(ROS)积累。减少了ROS积累CCE5.elf18 (A)或flg22 (B)处理后的突变体。图S3。51个“群VII”RLCKs的进化关系。表S1。本研究使用的突变系。表S2。用于基因分型的帽标记CCE5.突变等位基因。表S3。用于分子克隆的引物。(PDF 1 MB)
作者为图像提交的原始文件
以下是与作者的原始提交的图像的链接。
权利和权限
开放获取本文根据创意公约归因于4.0国际许可证,这允许在任何中或格式中使用,共享,适应,分发和复制,只要您向原始作者和来源提供适当的信贷,提供了一个链接到Creative Commons许可证,并指出是否进行了更改。
除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。
要查看本许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
创作共用及公共领域专用豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
Ranf, S., Eschen-Lippold, L., Fröhlich, K。等等。微生物相关的分子模式诱导的钙信号传导需要受体样细胞质激酶,PBL1和BIK1。BMC植物杂志14,374(2014)。https://doi.org/10.1186/s12870-014-0374-4
已收到:
公认:
发表:
关键词
- 钙
- 改变钙升高(cce)突变体
- 受体细胞质激酶
- 信令