- 研究文章
- 开放访问
- 发表:
一种新型抗病等位基因的遗传定位Puccinia Hordei.在Rph9 / Rph12大麦5HL染色体上的基因座
BMC植物生物学体积14.文章编号:1598(2014)
摘要
背景
大麦是一种重要的谷类作物,主要用作麦芽和反刍动物饲料,在某些地区还被用于人类消费。它易患多种叶面病害,包括由病原体引起的大麦叶锈病Puccinia Hordei..
结果
暂时指定的电阻轨迹RphCantala(RphC)在澳大利亚大麦芽甜瓜品种“Cantala”表现为中-低侵染类型(“;12 = N”)P荷尔迪病理类型253P-(在Rph1、Rph2、Rph4、Rph6、Rph8和RphQ).' CI 9214 '(易感)x ' Stirling ' (RphC) (CI 9214/Stirling)幼苗期加倍单倍体(DH)群体P荷尔迪病理类型253P-,证实RphC是单性遗传的。小麦标记性状关联分析RphC在CI 9214/Stirling DH人群中,使用4500个DArT-seq标记识别出高度显著的(−log)10.Pvalue > 17) 5H (5HL)染色体长臂上的单峰。对等位基因的进一步测试表明RphC基因上独立于Rph3, Rph7,Rph11, Rph13和RPH14,是一个等位基因Rph12(Rph9.z),也映射到5HL。
结论
多athotype测试和随后的血统分析确定了14个相关的澳大利亚大麦品种(包括“斯特林”和“港”)携带RphC这种抵抗力的可能来源是通过捷克斯洛伐克地兰LV-KVASICE-NA-MORAVE通过普通祖先品种的“汉娜”和“吸收活页夹”转移。RphC是的等位基因Rph12(Rph9.z因此被指定了上午9点.利用连锁不平衡的DArT-seq标记序列阵列进行生物信息学分析上午9点确定了可能的候选基因,为进一步的基因克隆工作和标记的发展奠定了基础Rph9型/Rph12/上午9点轨迹。
背景
叶锈病,由Puccinia Hordei.,是大麦最具破坏性的叶面病害之一,已在许多大麦种植地区造成重大产量损失[1.]-[3.].据报道,在澳大利亚和北美,某些感病大麦品种减产多达32% [4.]. 由于杀菌剂对环境的潜在不利影响,控制大麦叶锈病的最可取和最具成本效益的方法是通过发展和部署持久的寄主抗性[5.].
在谷物中,对锈病病原体的两种主要抗性类型已被描述为幼苗抗性和成虫抗性(APR)。幼苗抗性基因在作物发育的各个阶段都是有效的,通常表现为超敏感反应。许多基因赋予幼苗抗性P荷尔迪(气道)已确认(Rph1-Rph19[6.],Rph21-Rph22[7.],[8.])然而,已经检测到与这些基因中大多数基因相匹配的毒力[9]. 在包括南澳大利亚在内的一些地区,候补东道国的存在Ornithogalum umbellatum(‘伯利恒之星’)可以允许有性重组,并增加新的致病类型发展的可能性[9]-[12.]. 新的苗木抗性来源需要在育种计划中与APR结合使用,以持久地保护苗木P荷尔迪. 此外,为了在育种计划中进行有效部署,了解新鉴定的抗性基因的遗传机制和病理类型特异性同样重要。
苗期抗逆性遗传研究进展P荷尔迪已经确定了许多已知的气道基因座是复杂的。从总共23个目录中气道先前已经报告了三种基因是其他基因的等位基因。Rph5型等位基因Rph6型[13.],Rph12等位基因Rph9型[14.]以及Rph15等位基因Rph16[15.]. 如果是Rph9型和Rph12,一个大F2.“HOR 2596”的3858个后代群体(Rph9型)x“胜利”(Rph12)未检测到重组子,表明两者是同一基因的等位基因[14.].Rph9型和Rph12也映射到染色体上的相同基因座5H,并与普通分子标记,ABC155连接。以前的研究已经确定澳大利亚品种的“甲丹州珊瑚礁”携带一种无论育种的幼苗基因是否抵抗P荷尔迪那是临时指定的RphCantala(RphC)[1.].最近的证据表明RphC存在于几个澳大利亚和欧洲大麦品种中,最初源自欧洲血统。虽然毒性RphC在澳大利亚的P荷尔迪,这种耐药性可能与其他耐药性来源结合使用有用。本文报道了该植物的特性和遗传定位RphC阻力。关于物理位置和可能的候选基因的数据RphC提出并讨论了抗性位点。
方法
植物病原物
一个双倍单倍体(DH)群体,CI 9214/Stirling,来源于' CI 9214 ' (PI 186125)(推测携带Rph1型;R. F. Park,未出版)和“Stirling”(PI 466919) (RphCantala;[1.[, r.f . Park,未发表)的258个子代进行遗传分析。F3.通过“港口”(PI 483047)与“Estate”(PI 483047)衍生的人口(Rph3型)(CI 3410),'CEBADA CAPA'(CI 6193)(Rph7型),'Clipper BC8'(Rph10),“胜利”(Rph12) (PI 186125)‘π531849”(Rph13)用于等位性试验。共有五种病理类型P荷尔迪与他们的毒力/无毒特性以及对大麦差异系和澳大利亚栽培品种的反应一起被用于研究RphC列于表格1..使用的所有病理型起源于年度致病性调查P荷尔迪在澳大利亚进行,并在悉尼大学植物育种研究所保存在液氮中。
播种、接种和疾病评估程序
播种和接种按照Sandhu等人的描述进行[6.].根据McIntosh等人的描述,在接种后12天使用改良的“0”-“4”量表评估疾病反应[16.]. 侵染类型的变异以“-”(低于该类平均值)、“+”(高于该类平均值)、“C”(黄化)、“N”(坏死)和“X”表示中间型侵染类型,在同一叶片上混合侵染类型。用逗号分隔不同的感染类型,以表示在给定的测试宿主基因型内的异质性。当在一片叶子上观察到两种不同的感染类型时,它们被写在一起,没有逗号。
遗传的映射RphC在CI 9214/Stirling DH人群中
基因组DNA从258个原始CI 9214/Stirling DH系中的61个亚群中提取,基本上如Fulton等人所述[17.].每个DH系的DNA稀释到100 ngμL−1.并采用Curtois等人所述的DArT-seq平台进行基因型分析[18.]除标记清除涉及去除低次要等位基因频率(MAF)的标记外(即< 0.1)和>缺失50%的数据。
利用MSTMap软件构建遗传连锁图谱[19.].MSTMap使用了以下具体参数即。映射人口的名称:DH;距离函数:Kosambi;用于将标记聚类为lg的阈值为:0.000001;目标函数:COUNT。此外,将距离其余标记15厘米(cM)且小于2个的标记组作为单独的连锁群。该连锁图谱是专门构建的CI 9214/Stirling DH群体遗传定位图谱RphC为此,我们收集了P荷尔迪病理类型253P-被转换为二进制数据[(易感3+ =0或抗性,即12 = CN " =1],然后被纳入作为一个额外的标记。所有紧密相连的DArT-seq标记的地图位置(cM)RphC将ci9214/Stirling遗传图谱与Bowman一致性图谱和基因型图谱进行了比较大麦芽l .简历。“鲍曼”基因组组装[20.].
近链DArT标记的标记性状和生物信息学分析RphC轨迹
对每个DArT标记进行标记性状分析RphC表型采用R统计软件对2 × 2计数表进行Fisher精确检验(www.r-project.org).无效假设是DArT标记基因型与抗性无关P荷尔迪;因此,基因型在抗性和易感表现型群体中的随机分布。P值的-log10与物理Bowman基因组组装的位置相对应[20.通过染色体和基因组的“曼哈顿”图。
连锁不平衡(LD)R2.是在二进制分数之间测量的RphC表型(0,1)与每个DArT-seq标记基因型使用GOLD [21.].每个标记的相关系数RphC通过全基因组“曼哈顿”图,将二元表型得分与鲍曼基因组组装图进行对比。DArT-seq标记序列R2. > 0.8 were individually blasted (blastn) against the ‘Morex’ barley genome sequence browser (www.gramene.org)在标记的两侧区域确定基因的物理支架RphC基于CI 9214/Stirling DH群体遗传图谱与“Bowman”共识遗传图谱的关系。将位于DArT-seq标记DART461(504808312-504808380)和DART4872(509749584-509749620)之间的所有基因的物理位置和注释制成表格,以确定可能的候选基因RphC.进一步的pam蛋白注释也被分配到位于‘Morex’基因组预测基因内的DArT-seq标记上。重要区域的单倍型块是用Haploview构建的[22.]来检测该区域和显著的DArT-seq标记之间的LD。
结果
多athotype测试
大麦品种“卡塔拉”含有一种不具特征的幼苗抗性基因(RphC)P荷尔迪通过澳大利亚大麦差线(包括'Cantala')的表型评估来确定,其中一系列P荷尔迪病变型(表1.). 对其他大麦品种的多重病理分型试验表明,除了‘Cantala’ , ‘班杜拉的 , ‘“布塞尔” , ‘Chebec'(带Rph19)“哈梅林” , ‘劳拉的 , ‘米尔比的 , ‘“月亮达因” , ‘是的 , ‘帕尔旺 , ‘研究 , ‘瑞斯比 , ‘“Tilga”(异质)和“Stirling”也携带RphC.这些品种都没有携带Rph12(表1.).
DH群体ci9214/Stirling的遗传分析
ci9214/Stirling-DH群体的亲本基因型被假定为携带Rph1型和RphC根据观察到的感染类型(IT)进行响应P荷尔迪致病性200P-(对Rph1型和毒性RphC)和253P-(对Rph1型对人体无害RphC),分别为(图1.;表格1.).致病性200P-对“CI 9214”无毒(Rph1型)及“凯旋”(Rph12)在“坎塔拉”上有毒力(RphC). 相反,病理型253P-对“CI 9214”具有毒力(Rph1型)和“斯特林”的无毒(RphC)、“龙舌兰纤维”(RphC)及“凯旋”(Rph12). 这两种致病型在普遍易感品系“Gus”上都具有毒力(图1)1.;表格1.).The CI 9214/Stirling population of 258 DH lines was phenotyped using pathotype 253P- and in response the resistant parent ‘Stirling’ gave the same IT “;12 = CN” as observed in the barley variety ‘Cantala’ with the same pathotype, whilst the susceptible parent ‘CI 9214’ gave IT “3+” to this pathotype. The observed segregation within the CI 9214/Stirling population fitted with a predicted single gene inheritance model 1:1 ratio using Chi squared analysis (121 resistant: 137 susceptible (P > 0.3)).
遗传的映射RphC
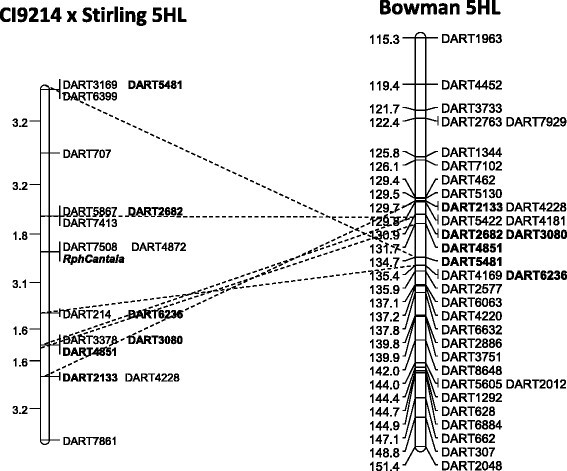
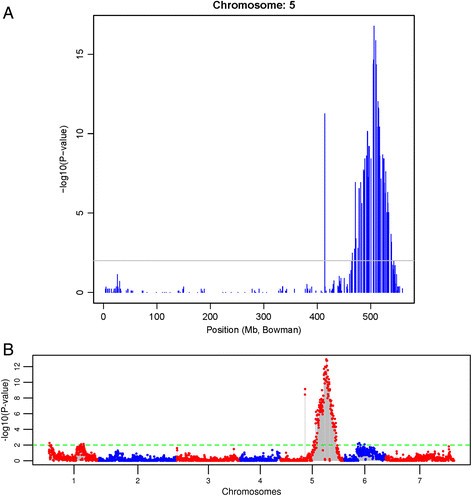
在CI 9214/Stirling DH群体中,从抗性和易感表型类别中选择61个具有代表性的基因型进行遗传定位RphC随后使用10258个DArT-seq标记位点进行基因分型。利用4500多个DArT-seq标记构建了9个连锁群,覆盖4246 cMRphC二元表型作为标记。根据已知的“鲍曼”、“莫克斯”和“巴克”基因图谱上的侧翼标记位置,RphC在129-134厘米之间被定位到染色体5HL(图2.).RphC与两个DArT标记(达特4872和达特7508)共分离,距离侧翼标记达特2682、达特5867和达特7413远1.8 cM,距离达特6236和达特214近3.9 cM(图)2.).进一步的全基因组标记-性状关联表明,仅在5HL上的DArT序列与此相关RphC由两个显著峰值表示的表型分数[−log10(P值)为17.5],在整个基因组中,5HL上约506MB(图3.A和3.b)并与LD映射结果相关联RphC(附加文件)1.).进一步的连锁不平衡分析确定了2nd430mb的峰值是由于单个DArT标记的地图位置不正确(数据未显示)。
标记-性状关联分析用Fisher精确检验纵轴表示标记-性状关联P值的-log10(P)值。峰值高于最小阈值2(P值 = 0.03)可被视为显著相关。用蓝色和红色区分染色体(1H-7H)。(一种)Chromosome-wise情节和(b)用Fisher精确检验法在2×2计数表上分析5HL染色体的全基因组曼哈顿图Puccinia Hordei.采用4500个DArT-seq标记,对CI9214/Stirling双单倍体群体的致病型为253P-(二进制评分数据)。p值的-log10与物理Bowman基因组组装的位置相对应[20.].在最小阈值2 (P-value = 0.03)以上的峰值可以认为是显著相关的。
等位性测试
等位性检验RphC和两个先前确认的气道染色体5HL上的幼苗基因(Rph12和Rph13)表明,RphC是独立于Rph13但完全与Rph12. 在F3.涉及十字架的家庭RphC与Rph13使用pathotype 253P进行试验时-(表2.).另一方面,F3.交叉涉及的家庭RphC和Rph12当用致病型253p-(两者来说)测试时RphC和Rph12). 这表明RphC是的等位基因Rph12(Rph9.z)具有明显的特异性,因此可以指定等位基因上午9点.另外两个来自“地产”(Rph3型) /‘“坎塔拉”和“切巴达卡帕”(Rph7型)/‘Cantala’也用致病型253P-进行检测,两个群体均符合预期的双基因分离模型(表2.).
家谱分析RphC抵抗
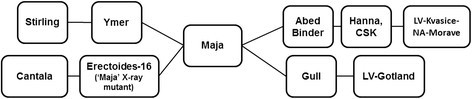
对14个澳大利亚大麦品种进行了系谱分析RphC包括:Bandulla, Bussell, Cantala, Chebec, Hamelin, Lara, Milby, Moondyne, noyes, Parwan, Research, Resibee, Tilga(异种)和Stirling,使用在线大麦血统资源http://genbank.vurv.cz/barley/pedigree/. 在此基础上,预测品种“海鸥”和“宾德”可能是该病的来源RphC“斯特林”,'诺伊普','Lara','斯特林','Research','Chebec','Moondyne','Bussell'和'Catra''。谱系分析表明'Maja'('ymer'和'erectoides 16')分享了“佩德尔”和“鸥”的共同祖先(图4.).“海鸥”和“Binder”分别来自瑞典(“LV-Gotland”)和捷克斯洛伐克(“LV-Kvasice-NA-Morave”到“Hanna”)的地方品种(图)4.). ‘汉南’苗期抗性的供体来源 , ‘“米尔比”和“蒂尔加”无法根据可用的谱系信息进行解释。
近链DArT标记的生物信息学分析RphC轨迹
共有15个DArT-seq标记有R2. > 0.8 and five of these were in complete LD (R2. = 1) 与RphC(表3.;数字3.;额外的文件1.). 表4.提供每个标记的DArT轨迹名称、克隆ID和相关序列的列表。DArT序列标记DART4872和DART7508与RphC在ci9214/Stirling基因图谱中,两个基因均为完全LDRphC然而,他们和达特7846没有出现在“鲍曼”共识图(表3.;数字2.).此外,最密切相关的DArT-seq标记序列基于最低的Fisher确切检验P值RphC(DArT4851)位于基于Pfam分析的预测抗病蛋白(NB-ARC)内(表3.).另外两种序列(DART7846和DART3079)位于其他预测抗病基因(丝氨酸/苏氨酸受体激酶基因)的相同转录物中,染色体5HL。在“MoreX”基因组中,DART7846和DART3079都与物理位置相对于所有其他紧密相关的DART序列的物理位置最近的匹配,但“Bowman”组装中的CONDIG映射到物理位置506583400(表3.).
含DArT-seq标记区间的生物信息学分析R2.值> 0.81共5 Mb,基因丰富,有75个基因(>60%未特征化)(表5.).使用显着的DART-SEQ标记的单倍型块分析显示出这些标记中的非常高的连锁不平衡(数据未示出)。从该区域内的75个预测的转录物中,还存在各种转录因子的相对大的表示,而仅鉴定出三种预测的抗病蛋白质,包括Nb-arc,NBS-LRR和丝氨酸/苏氨酸受体激酶(表5.).
讨论
在这里,我们报告的发现和定位(遗传和物理)的一个新的幼苗抗等位基因P荷尔迪,以前临时指定为RphC公司。以前用大F2.人口决定Rph12在'胜利'的抗性位点是一个等位基因Rph9型[14.]因此被重新指定为Rph9.z基于Franckowiak等人[23.]. 我们的研究表明RphC是的等位基因Rph12(Rph9.z),通过等位基因、染色体位置和病理类型特异性的检测,在“胜利”号上发现。本研究采用“甜瓜”与大麦差异系杂交,进行了等位基因检测Rph3、Rph7、Rph10、Rph12和Rph13。RphC是独立于Rph3、Rph7 Rph10和Rph13基于观测分离比符合双基因预测模型。F3.种群表明,没有隔离的抗性P荷尔迪病理类型为253P-在' Cantala '和' Triumph '之间,表明RphC和Rph12可能是等位基因,因此RphC应指定Rph9.am。
都是多径分析和观察其之间的“坎塔拉” , ‘斯特林和其他13个澳大利亚大麦品种假定携带上午9点表明本研究所定位的抗性基因是同一基因。上午9点有不同的特异性Rph12(Rph9.z).P荷尔迪病理类型253P-对小鼠无毒性上午9点和Rph12而致病型210P+和200P-对小鼠均无明显毒性Rph12但对我来说是致命的Rph9.am。对ci9214/Stirling-DH群体进行了253P致病型遗传分析,结果表明,该致病型符合Stirling亲本的单基因遗传。对这一人群的进一步评估P荷尔迪患者243P+(对上午9点而且毒力很强Rph19)和4610P+(有毒Rph12和Rph19)排除了这些基因在CI 9214 /斯特林人群中观察到的抗性的累积。
Rph9, Rph12和上午9点均定位于染色体5H(5HL)的长臂。本研究使用4500个指定的DArT标记进行标记性状分析上午9点染色体5HL的一个相似的区域Rph9型和Rph12虽然在基因图谱之间没有可比较的标记来准确评估比较位置。“Bowman”和ci9214/Stirling遗传图谱之间的比较遗传分析确定了6个共同的标记在15厘米的区域内上午9点该区域与5HL大麦抗叶锈病QTL共定位,位于离品种斯佳丽126~140cm之间[24.]. 亲本遗传图谱(ci9214/Stirling)和一致的Bowman遗传图谱之间的DArT标记顺序和距离存在差异。这可能是由于用于基因图谱构建和基因图谱绘制的品系数量有限所致上午9点表型。附加文件2.为每个紧密相连的省道提供标记单倍型数据上午9点.一小部分标记缺失数据,这可能进一步解释了CI 9214/Stirling遗传图谱中标记顺序和距离的不准确性。从DArT标记中获得的序列读取的生物信息学分析上午9点(R2.> 0.8)表明有4个可能的候选基因Rph9.am/Rph12/Rph95 Mb基因丰富区内的位点,包括一个NB-ARC、NBS-LRR和两个丝氨酸/苏氨酸受体激酶。两个DArT标记(DART7846和DART3079)的物理位置在“Bowman”和“Morex”基因组装配之间观察到变异,这两个标记与同一丝氨酸/苏氨酸受体激酶转录本的相似性最高。这种差异可能是由于“Bowman”和“Morex”基因组之间的装配错误(鉴于它们最近的发布)或“Bowman”中缺少mloc38941) , 哪种幼苗容易感染P荷尔迪缺乏任何气道基因和上午9点(右)。F公园,未出版)。
单倍型块分析表明,该区域显著的DArT-seq标记中LD值较高,说明上午9点可以位于跨越至少5 MB的染色体5HL上的宽区域。鉴于F的人口规模3.用于等位性检验的家系,有可能Rph12和上午9点可能是独立的紧密相连的抗性基因,通过非常小的物理距离分开。对被认为携带的物理区域内的基因进行生物信息分析上午9点基于LD和“鲍曼”共识图表明NBS基因的存在。NBS-LRR基因的作用及其在对锈病和其他植物病原体的种族特异性抗性中的参与是有充分记载的[25.],[26.由于进化压力导致的复制事件的选择,它们倾向于在草基因组中聚集[27.],[28.].另外,有一种可能性是同一个丝氨酸/苏氨酸受体激酶基因负责对多种致病型的抗性P荷尔迪基于先前报道的广谱电阻授予两者Rpg1和Rpg5大麦茎锈病这两个Rpg1和Rpg5编码丝氨酸/苏氨酸受体激酶,被认为具有显著的同源性。Rpg5地图距离预测的目标大约20 Mb上午9点然而,最近一项筛选澳大利亚大麦品种的研究Rpg5在14条假定携带病毒的线中,只有6条被标记出来上午9点还带着Rpg5表明它们不是同一个基因[29.].
澳大利亚的大麦品种假定携带上午9点根据现有的家系信息,他们都是密切相关的。在本研究中使用5个P荷尔迪致病型表明,上午9点可能存在于14个澳大利亚品种中。进一步的系谱分析所有澳大利亚品种假定携带上午9点“海鸥”和“活页夹”显示出强烈的亲缘关系和共同的祖传血统,这可以追溯其来源上午9点对来自瑞典或前捷克斯洛伐克的地方品种的抗性。“Cantala”和“Stirling”在“Maja”中都有共同的血统,这是由“海鸥”和“Binder”之间的杂交产生的[30.].之前的一项关于前捷克斯洛伐克和捷克共和国春大麦系谱分析和多样性的研究报告表明,包括LV-Gotland在内的三个祖传地方品种对大麦栽培品种有显著贡献。这些品种富含高产基因型的种质资源,在育种过程中牺牲了麦芽品质,成为生物抗逆的供体[31.]. 然而,先前的研究也发现“海鸥”容易受到澳大利亚的影响P荷尔迪只携带Rph4.d等位基因Rph4型轨迹。这一证据表明,“粘合剂”而不是“海鸥”是更可能的来源上午9点抵制“龙舌兰纤维”。
结论
巩固先前和目前的研究,至少有三个等位基因有助于抗叶锈[Rph9、Rph12(Rph9.z)和上午9点(上午9点)],每一个都具有不同的种族特异性,在可能相同的基因座上定位到染色体5HL。在这三个等位基因中,Rph12和上午9点似乎是最常见的澳大利亚种质。本研究中的遗传图谱和LD分析确定上午9点很可能位于染色体5HL上一个横跨5 Mb的物理区域。此外,该区域包含三个潜在的候选基因,这将为未来的基因克隆工作提供信息上午12点/9点诊断标记发展的基因座。
支持数据的可用性
手稿中的所有支持数据都作为附加文件包括在内。
其他文件
参考文献
- 1。
Cotterill PJ,Rees RG,Platz GJ:澳大利亚大麦品种叶锈的响应(Puccinia Hordei.).农业实验,1994,34:783-788。10.1071 / EA9940783。
- 2。
Woldeab G,Fininsa C,Singh H,Yuen J:病毒的毒力谱Puccinia Hordei.在埃塞俄比亚的大麦生产系统中。植物病理学。2006年,55:351-357.10.1111/j.1365-3059.2006.01357.x。
- 3.
穆雷,布伦南JP:目前和潜在的成本由大麦疾病在澳大利亚。粮食研究开发公司。澳大利亚堪培拉。2009,59。
- 4.
Park RF, Karakousis A:基因的表征与定位Rph19赋予抵抗Puccinia Hordei.在品种'reka i'和几个澳大利亚大猫头鹰。植物品种。2002,121:232-236。10.1046 / J.1439-0523.2002.00717.x。
- 5.
在澳大利亚培育抗锈谷物。植物病理学杂志,2008,57:591-602。10.1111 / j.1365-3059.2008.01836.x。
- 6.
Golegonkar PG,Park RF,Singh D:幼苗和成株植物对烟草的抗性评估Puccinia Hordei.在大麦。Euphyt. 2009, 166: 183-197。10.1007 / s10681 - 008 - 9814 - 2。
- 7.
Sandhu Ks,Forrest Kl,Kong S,Bansal UK,Singh D,Hayden MJ,Park RF:赋予幼苗抗性基因的遗传和分子映射Puccinia Hordei.在大麦品种里卡多。理论应用基因。2012,125(7):1403-1411.10.1007/s00122-012-1921-8。
- 8.
Johnson PA, Niks RE, Meiyalaghan V, Blanchet E, Pickering P:Rph22:一个从非寄主中导入的抗叶锈新基因的定位大麦bulbosum我喜欢种植大麦(大麦芽五十) 是的。理论应用基因。2014,126(6):1613-1625.10.1007/s00122-013-2078-9。
- 9
Park-RF:病毒的致病特化和病理类型分布Puccinia Hordei.1992年到2001年在澳大利亚。植物保护学报,2001,21(3):349 - 352。10.1094 / PDIS.2003.87.11.1311。
- 10.
Clifford BC:大麦叶锈。在谷物生锈II。Rofss AP编辑,Bushnell WR。纽约,美国:学术出版社;1985年:173-205。
- 11.
墙饰H、Preece P、Cotterhill PJ:Puccinia Hordei.论大麦与小麦伞形明矾在南澳大利亚。南方植物病理学。1992,1992(21):95-97.10.1071/APP9920095。
- 12.
Steffenson BJ, Jin Y, Griffey CA:病理类型Puccinia Hordei.具有毒力的大麦叶锈抗性基因Rph7型在美国。植物分布。1993,77:867-869.10.1094/PD-77-0867。
- 13。
钟sb, Effertz RJ, Jin Y, Jerome D, Franckowiak J, Steffenson BJ:抗叶锈基因的分子定位Rph6型大麦及其与小麦的连锁关系Rph5型和Rph7型.植物病理学杂志。2003,93:604-609。10.1094 / PHYTO.2003.93.5.604。
- 14。
Borovkova IG,Jin Y,Steffenson BJ:叶锈病抗性基因的染色体定位和遗传关系Rph9型和Rph12在大麦。植物病理学。1998,88:76-80。10.1094 / PHYTO.1998.88.1.76。
- 15.
Weerasena JS, Steffenson BJ, Falk AB:一个扩增片段长度多态性标记转化为共显性标记Rph15抗大麦叶锈病基因,Puccinia Hordei.奥思。理论应用基因2014, 108(4):712–719.
- 16
麦金托什,韦林斯CR,帕克RF:小麦锈病:抗性基因图谱。澳大利亚堪培拉:CSIRO出版物;1995
- 17
从番茄和其他草本植物中提取DNA的方法。植物生物学杂志,1995,13:207-209。10.1007 / BF02670897。
- 18
Courtois B、Audebert A、Dardou A、Roques S、Ghneim-Herrera T、Droc G、Frouin J、Rouan L、GozéE、Kilian A、Ahmadi N、Dingkuhn M:粳稻群体根系性状的全基因组关联图谱。公共科学图书馆一号。2013,8(11):e78037-10.1371/journal.pone.0078037。
- 19
Wu Y,Bhat PR,Close TJ,Lonardi S:从图的最小生成树高效准确地构建遗传连锁图。公共科学图书馆Genet。2008年,4:e1000212-10.1371/journal.pgen.1000212。
- 20.
Mayer KF, Waugh R, Brown JW, Schulman A, Langridge P, Platzer M, Fincher GB, Muehlbauer GJ, Sato K, Close TJ, Wise RP, Stein N:大麦基因组的物理、遗传和功能序列组装。自然科学学报,2012,37(6):729 - 736。
- 21.
链接不平衡的gold图解概述。生物信息学,2000,16:182-183。10.1093 /生物信息学/ 16.2.182。
- 22.
Haploview: LD和单倍型图的分析和可视化。生物信息学,2005,21:263-265。10.1093 /生物信息学/ bth457。
- 23.
大麦叶锈病抗性基因的推荐等位基因标记。大麦基因报1997年,27:36-44。
- 24。
冯考夫,王宏,李昂J,皮伦KP:春大麦AB-QTL分析。一。野生大麦白粉病、叶锈病和烫伤抗性基因的检测。理论应用基因。2005,111:583-590.10.1007/s00122-005-2049-x。
- 25。
Dangl J,Jones J:植物免疫系统。自然。2006,444:323-329.10.1038/nature05286。
- 26。
Meyers BC,Kozik A,Griego A,Kuang H,Michelmore RW:人类NBS-LRR编码基因的全基因组分析拟南芥.植物学报,2003,15:809-834。10.1105 / tpc.009308。
- 27。
周涛,王勇,陈建强,Arakim H, Jing Z,蒋凯,沈军,田丹:NBS基因的全基因组鉴定揭示了非tir分化型NBS- lrr基因的显著扩增。中国生物医学工程学报,2004,31(4):431 - 431。10.1007 / s00438 - 004 - 0990 - z。
- 28
Dracatos PM,Cogan Noi,Sawbridge Ti,Gendall Ar,Smith Kf,Spangenberg G,Forster JW:多年生黑麦草(Lolium Perenne L)的定性疾病抗性的候选基因的分子表征和遗传映射。BMC植物BIOL。2009,9:62-10.1186 / 1471-2229-9-62。
- 29
Derevnina L,Fetch T,Singh D,Brueggeman R,Dong C,Park RF:澳大利亚大麦品种茎锈病抗性分析。工厂说2014.http://dx.doi.org/10.1094/PDIS-11-13-1174-RE
- 30.
古斯塔夫森J:大麦的突变实验。遗传病。1941, 27: 225-242.
- 31.
Milotova J,Martynov SP,Dobrotvorskaya TV,Vaculova K:前捷克斯洛伐克和现代捷克共和国春大麦品种多样性的系谱分析。Genet的Russ J。2008年,44(1):51-59.10.1134/S1022795408010079。
- 32.
Hanson WD:遗传实验计划的最小家庭规模。中国农学通报,1999,15(1):1- 5。10.2134 / agronj1959.00021962005100120005x。
致谢
作者要感谢谷物和研究开发公司资助这项工作,感谢Matthew Williams先生和Huda Elmansour女士提供技术援助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有相互竞争的利益。
作者的贡献
PD在表型、生物信息和分子遗传分析中发挥了重要作用。MK进行了部分分子遗传学研究、DArT图谱构建和LD分析,并协助撰写稿件。DS进行了等位基因检测和遗传分析,RP对基因表型进行了表征,进行了杂交,开发了群体,并进行了项目构想。所有作者阅读并批准最终稿件。
电子辅助材料
DArT-seq标记与基因的连锁不平衡(LD)作图
额外的文件1:RphCantala二进制特征标记。纵轴为相关系数值。在最小阈值0.5以上的峰值可以认为是与RphCantala. 用蓝色和红色区分染色体(1H-7H)(TIFF(129 KB)
连锁不平衡中每个DArT标记的单倍型数据(r
额外的文件2:2.> 0.8)带RphC.缺失的标记数据用星号*表示。A和B denote the presence and absence of the DArT marker allele respectively. (DOC 22 KB)
权利和权限
本文在BioMed Central Ltd.的许可下发布了这是一个开放的访问文章,根据Creative Commons归因许可(http://creativecommons.org/licenses/by/4.0)允许在任何媒介中不受限制地使用、分发和复制,前提是原作被适当地记入贷方。知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
德拉卡托斯,p.m., Khatkar, m.s., Singh, D。et al。一种新型抗病等位基因的遗传定位Puccinia Hordei.在Rph9 / Rph12大麦5HL染色体上的位点。BMC植物生物学14,1598(2014)。https://doi.org/10.1186/s12870-014-0382-4
收到了:
认可的:
出版:
关键字
- 电阻
- Puccinia Hordei.
- 基因映射