抽象的
背景
叶红色着色是许多植物种类的重要特征,包括种植桃子的品种(碧桃).桃叶颜色由单个控制Gr联动组6,用红色等位基因在绿色等位基因上显着。在这里,我们报告候选基因的鉴定Gr在桃子里。
结果
桃叶的红色着色是由于花青素颜料的积累,这在转录水平上调节。基于红细胞和绿色叶片之间的转录组比较,MYB转录调节器ppmyb10.4在Gr间隔对桃叶花色苷的着色有调节作用。瞬态的表达ppmyb10.4在烟草和桃树叶中可以诱导花青堆积。而且,一个功能MYB基因PPMYB10.2在3号键上,它与ppmyb10.4,在红色和绿色的叶子中也有表达,但对叶子的红色没有作用。这表明桃叶中花青素积累的机制是复杂的。此外,ppmyb10.4和其他花青素激活MYB蔷花科中负责果实中花青素积累的基因可以追溯到7000万年前的共同祖先(MYA)。然而,ppmyb10.4已从这些花青素激活偏离mybs.产生一个新的基因家族,调控叶等营养器官中花青素的积累。
结论
激活一个古老的复制品MYB基因ppmyb10.4在Gr在LG 6上的间隔,代表了血清素激活的新枝MYB在蔷薇科的基因,能够在桃中激活叶红色着色。
背景
桃 [碧桃L.(BATSCH)]是枸杞家族的成员,是全球重要的果树作物。这是一个具有小基因组大小的二倍体[1].除了提供美味的水果外,桃树广泛用于观赏种植。在中国,花卉桃子已经为景观或露台植物栽培成千年。鲜花和叶子的颜色是最具吸引力的特征之一,这有助于植物的观赏价值[2].桃的红色主要是由花青素的积累引起的。
花青素是植物界最大的水溶性色素群,属于类黄酮化合物家族。花青素储存在中央液泡中,并在许多植物组织中形成红色、蓝色和紫色,包括茎、叶、根、花、果实和种子[3.],[4].花青素是通过类黄酮生物合成途径合成的,具有广泛的生物功能,例如吸引传粉者和种子散布者,以及保护植物免受病原生物和紫外线辐射的攻击[5].此外,花青素对人类健康有有益的作用,因为它们表现出广泛的生物活性,如抗氧化、抗炎、抗菌和抗癌活性[6].因此,花青素长期以来一直是植物学家和植物生理学家调查的主题。
在矮牵牛花和金鱼草等观赏植物中,花青素的生物合成途径已被很好地确立[7],[8].香豆蔻酰辅酶a与丙二酰辅酶a通过查尔酮合成酶(CHS)缩合形成柚皮素查尔酮,是花青素生物合成的开始。查尔酮通过查尔酮异构酶(CHI)转化为柚皮素。黄酮3-羟化酶(F3H)催化柚皮素的羟化反应生成二氢山奈酚(DHK)。DHK可通过类黄酮3 '、5 ' -羟化酶(F3 ' 5 ' h)或类黄酮3 ' -羟化酶(F3 ' h)进一步羟基化生成二氢杨梅素(DHM)或二氢槲皮素(DHQ)。DHK、DHM和DHQ通过二氢黄酮醇还原酶(DFR)和白花青素双加氧酶(LODX)转化为花青素。最后,花青素被UDP葡萄糖:类黄酮3-糖基化O-葡萄糖基转移酶(UFGT)生成花青素。到目前为止,花青素途径基因已经在多种模式植物中分离和表征,如矮牵牛花、金鱼草和植物拟南芥[4].
通过编码R2R3 MYB,碱性螺旋环 - 螺旋(BHLH)和WD40蛋白的三种调节基因,在转录水平下调节花青素途径基因分别进行调节水平[5].这些调节剂彼此相互作用以形成与启动子结合的MBW复合物,并诱导花青素生物合成途径的基因转录。迄今为止,迄今为止,众所周度地报道了果实中的花青素生物合成的分子机制。例如,在葡萄两个相邻的MYB转录因子(TFS)中VvMYBA1和VvMYBA2负责激活UFGT.因此,基因对花青素积累进行调节作用[9].类似地,三个似乎是等位基因的转录因子,MdMYB10,MdMYB1, 和mdmyba,已被隔离并在苹果中表征[10.] - [12.].在其他蔷薇科水果中,如梨、覆盆子、草莓和李子,与MYB10已被孤立[13.].最近,MYB基因被命名为Ruby,已在柑橘中发现,其激活是血橙中花青素积累的原因[14.].除果实外,花青素在叶片中的积累也是一种广泛的现象,在温带落叶植物中,花青素在叶片衰老中的作用已被研究[15.].然而,少数关于装饰树木或其他落叶树木的分子机制的报道。
桃叶颜色是由单一基因控制的(Gr),红色等位基因占优势于绿色等位基因[16.].最近,这Gr轨迹已被映射到连锁组(LG)6的中间区域[17.].据报道,在桃中,有两种MYB TFs可控制果皮中的花青素着色[18.]和花[19.].最近,有三个集群mybs.,称为myb10.1,myb10.2和myb10.3,与花药颜色(Ag))性状位于连锁群3,参与调控果实花青素的生物合成[20.].在这里,我们报告了识别MYB TFGr间隔,担任候选人Gr关键词:观赏桃,红野桃,叶片颜色,基因这一品种的特点是其迷人的红色叶子颜色和粉红色的花朵。桃子的功能MYB该基因在烟草和桃中均有瞬时表达。本研究结果有助于对桃花青素生物合成机制的全面认识。
结果
桃不同颜色组织中花青素的积累
测定了红叶桃(HYT)和满天红(MTH)两个品种不同组织的花青素含量(见表2)1).'hyt'是一种装饰品种。它产生带有白色肉体的小棕色皮肤水果,春天有紫红色的叶子,红茎和粉红色的花朵。然而,叶子的颜色与成熟度降低到绿色。粉红色的花含有最高水平的花青素,其次是红色叶子和茎,而成熟的绿色叶子和果实积累了小花青素。'MTH'有绿叶,红色花朵和白肉体水果。红花含有高水平的花青素,而在其他组织中,花青素含量非常低,包括叶,茎和果实。总之,红彩色组织中的花青素积累显着高于非红色组织,其类似于先前的报道,即花青素积累是桃子中的红色造成红色[18.] - [23.].
桃子中候选基因的鉴定Gr通过比较转录组分析的间隔
的Gr区间已被定位到LG6上两个SSR标记BPPCT009和CPDCT041两侧的区间[17.].两个SSR标记对桃草稿基因组的底漆序列的比较显示Gr间隔的物理尺寸约为7.9 MB,LG6的11.9 MB至19.8 MB。识别候选人Gr基因,转录组。利用Illumina RNA-seq技术对HYT和MTH进行测序,分别获得了1600万条和1100万条转录本。将测序结果映射到桃树参考基因组上,并将结果保存在NCBI SRA数据库中,登录号分别为SRX767357和SRX796311。基因表达水平使用FPKM(每千碱基外显子片段/百万片段)值估算,并使用1.5倍变化阈值来分离差异表达和非差异表达的基因。在129个基因中Gr区间内,有18个基因在红色和绿色叶片间有差异表达2).在这些基因中,只有一个(ppa018744)编码了与拟南芥AtMYB113与花青素生物合成有关。基因,指定ppmyb10.4,红色叶片的表达量是绿色叶片的239.5倍。除了ppmyb10.4基因,另一个AtMYB113外围的同源物GrLG3的间隔,称为PPMYB10.2[20.],在桃叶转录组中鉴定。然而,其表达水平比在绿色叶子中的红色叶子下降0.3倍。
随后,我们检测了花青素结构基因的表达水平,发现PPCH,PPCHI.,ppf3h.,ppf3'h.,PPDFR., 和PpLDOX在红色的叶子中分别显示1.5-,1.6-,2.1-,2.7,4.5和4.9倍的表达水平而不是在绿色叶子中。PPUFGT.在红色叶子中高度表达,而其成绩单在绿叶中几乎不可检测到。这表明桃叶中的花青素积聚在转录水平上受到调节。由于花青素生物合成受MBW复合物调节[5,我们还研究了桃叶片转录组中与花青素相关的bHLH和WD40转录因子。两种同系物ATGL3.(PPBHLH3和ppbhlh33.)和两个同源物ATTTG1.(PPWD40A1和PPWD40A2)被确定。PPBHLH3和ppbhlh33.在红色叶子中分别具有0.6-和0.1倍的表达水平而不是绿叶。相比之下,PPWD40A1和PPWD40A2在红色叶子中分别具有0.3和0.1倍的表达水平而不是绿叶。连同,所有结果表明ppmyb10.4是候选基因的Gr轨迹。
桃基因组中myb型花青素调控因子的两个簇
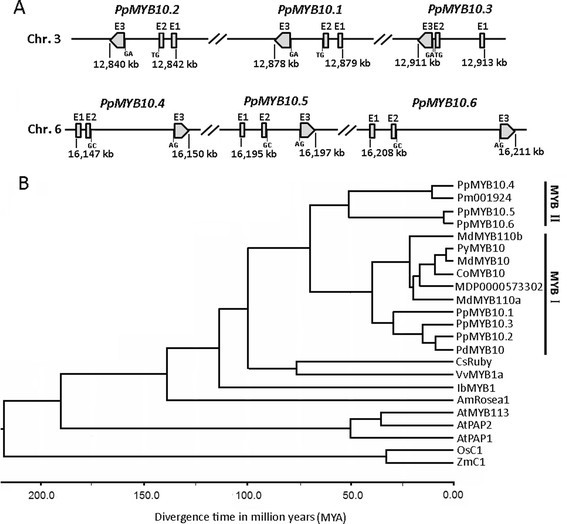
为了确定MYB基因是否参与了桃叶片花青素积累的调控,我们比较了MYB基因的cDNA序列PPMYB10.2和ppmyb10.4抵抗桃CV的基因组草案。Lovell使用blastn [1].因此,PPMYB10.2它的两个谬误PPMYB10.1.和PPMYB10.3[20.],在染色体3的72 kB区域内彼此相邻,同时ppmyb10.4它的两个谬误(ppmyb10.5和ppmyb10.6)在染色体6的63 kB区域内聚集(图1A).加入编号PPMYB10.1.到ppmyb10.6蔷薇科基因组数据库(GDR,http://www.rosaceae.org/)被列入额外文件1:表S.1.PPMYB10.2顺序是相同的PPMYB10以前从桃果中分离[13.].PPMYB10.3和PPMYB10.1.最近被认为与桃果的色素沉着有关[20.].所有6个MYB转录因子由三个外显子组成,外显子由两个内含子分开。在两个内含子的5 '和3 '边缘发现了一致序列GC和AGPPMYB10.1.到PPMYB10.3,严格遵循Breathnach和Chambon提出的真核内含子的“GT-AG”剪接位点[24.].相比之下,为第一和第二内含子观察到“GT-AG”和“GC-AG”剪接位点ppmyb10.4到ppmyb10.6,分别。
桃基因组中6个花青素相关MYB基因。Ag)ydF4y2Ba, 6个桃MYB基因的结构特征和染色体位置。B基于使用Bayesian MCMC分析的对齐核苷酸序列的植物中花青素相关的MYB基因之间的估计分歧时间。GenBank登录号如下:李属有PDMYB10(ABX71492);马吕斯 × 家庭MdMYB10 (AFC88038)、MdMYB110a (JN711473)和MdMYB110b (JN711474);Pyrus Communis.Pymyb10(JX403957);Cydonia oblonga.COMYB10(EU153571);素类CsRuby (AFB73909);vitis ViniferaVVMYB1A(ABB87014);番薯甘薯IBMYB1(BAF45114);拟南芥ATPAP1(NP_176057),ATPAP2(NP_176813),ATMYB11(NP_191820)和ATMYB113(NP_176811);Antirrhinum Majus.Amrosea1(ABB83826),玉米ZMC1(NM_001112540);和奥雅萨苜蓿OsC1 (HQ379703)。Pm001924和MDP0000573302从释放的基因组序列中提取李春万[27.]和苹果。
进化史分析揭示了祖先MYB大约在7000万年前(MYA),蔷花科早期阶段的基因经历了一次复制,产生了两个基因家族,命名为MYBII和MYBII(图)1b)。Mybi包括PPMYB10.1.到PPMYB10.3他们的同源物如MdMYB10[12.],mdmyb110a[25.] 在马吕斯和Pymyb10.[26.] 在Pyrus.和PdMYB10在李属有,而mybii包含ppmyb10.4到ppmyb10.6他们的同源物如PmMYB基因李春万[27.].
花青素相关基因在红、绿桃叶片中的表达分析
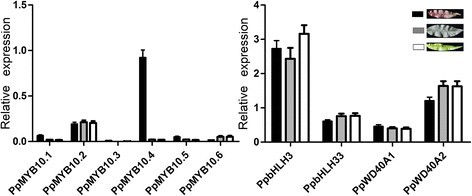
为了验证基于rna -seq的基因表达谱,我们检测了花青素生物合成基因在cv叶片中的表达水平。HYT和MTH采用qRT-PCR。所有的生物合成途径基因,包括气,CHS,DFR,F3'H,F3h.,Ldox., 和UFGT.,红色叶片的表达量显著高于绿色叶片(图2).对于调节基因,PpbHLH和PPWD40基因在叶片中表达,但在红色和绿色变异中表达量没有差异(图)3.).六MYB四(即基因,。PPMYB10.1.,PPMYB10.3,ppmyb10.5, 和ppmyb10.6)在红叶和绿叶中均表现出极低的表达。PPMYB10.2基因在叶片中表达,但在红色和绿色叶片之间表达水平没有差异。相比之下,表达水平ppmyb10.4红叶中的基因显着高于绿叶的基因。
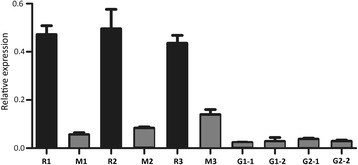
此外,表达剖面ppmyb10.4在QRT-PCR分析中,还包括在不同发育阶段的叶片中检查基因,并将第二种绿色叶片品种“Baihuabitao”(图4).表达水平ppmyb10.4结果表明,甘蓝型油菜幼叶中基因表达量显著增加。红叶桃在春、夏、秋三个季节都比成熟叶多。然而,表达水平ppmyb10.4基因在CVS的年轻和成熟叶片中非常低。白海塔和侧田龙。QRT-PCR的结果与基于RNA-SEQ的基因表达分析一致,这证实了激活ppmyb10.4红色叶子的基因。
表达水平PPMYB10.4不同颜色的桃叶的基因。r1,cv的年轻叶子。在春天的情况;M1,成熟的CV叶子。在春天晚期;r2,cv的年轻叶子。在夏天;m2,成熟的cv叶子。在夏天;r3,幼叶的cv。Hyt在秋天; M3, mature leaves of cv. HYT in autumn; G1-1, young leaves of cv. MTH in spring, G1-2, mature leaves of cv. MTH in spring; G2-1, young leaves of cv. Baihuabitao in spring; G2-2, mature leaves of cv. Baihuabitao in spring. The black and grey boxes indicate red- and green-colored leaves, respectively.
ppmyb10.4是一种功能调节剂,诱导烟草和桃子中的花青素积累
的转录活动ppmyb10.4最初使用烟草瞬态颜色测定进行测试。PPMYB10.4和BHLH3被注射器渗透到膨胀的下侧尼科尼亚塔哈瓦姆树叶。在转化后7天在渗透部位观察无色素沉着PPBHLH3(图5a),同时观察到浸润的轻微色素沉着ppmyb10.4(图5B)在两种药物转化后7天,在浸润部位检测到强烈的色素沉着ppmyb10.4和PPBHLH3(图5C)。
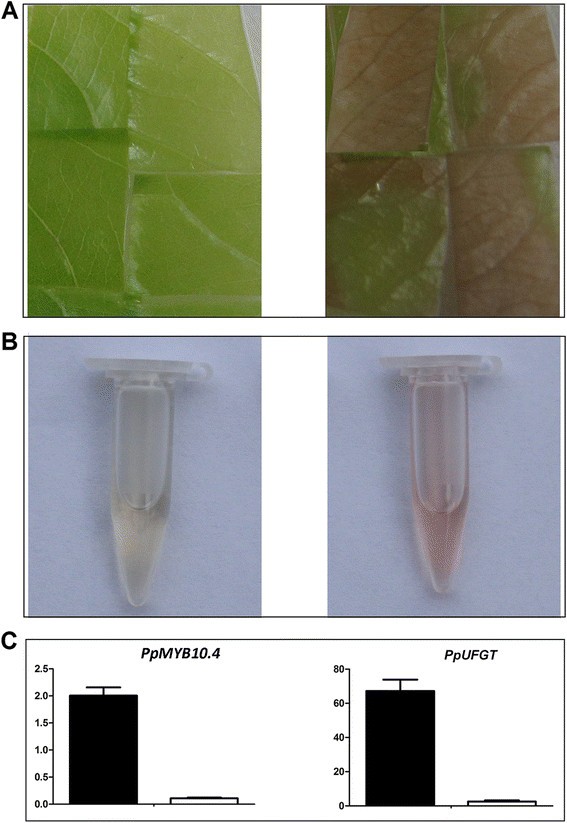
功能的功能ppmyb10.4通过粒子轰击介导的cv绿色幼叶瞬时表达进一步验证了其有效性。m。2天后叶片变红ppmyb10.4,但是用空向量(EV)变换后的叶子仍然是绿色的(图)6一种)。花青素提取结果表明,桃叶变形ppmyb10.4含有花青素,但不适用于EV转化的叶子(图6此外,B)。ppmyb10.4在转化为ppmyb10.4,而在EV转化的叶片中转录水平极低(图)6C)。同样的,PPUFGT.随着叶片转化的表达水平超过30倍ppmyb10.4而不是用EV转化的叶子。
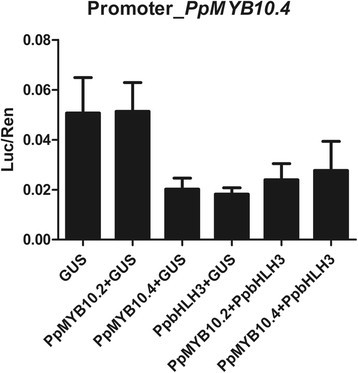
它以前已经显示过Apple MyB10可以规范是自己的表达[28.].进行双荧光素酶测定以澄清如果表达ppmyb10.4是自动调节的,或者可以被PpMYB10.2调节。而PpMYB10.2与的启动子没有相互作用ppmyb10.4,PPMYB10.4对这段瞬态测定中的自己表达没有影响(图7).
启动子区的序列多态性ppmyb10.4
虽然表达概况存在差异ppmyb10.4在红色和绿色叶子之间,编码序列ppmyb10.4都是相同的。为企业和m。因此,我们设计了一对引物5 ' -GGATCTCGCCGCTGTTTCTG-3 '和5 ' -TCTCACTCCCGAAGAACTATCCAT-3 '扩增该基因的启动子基因组区域ppmyb10.4在简历。为企业和m。的启动子序列ppmyb10.4来自CVS。对齐HTY,MTH和LOVELL,并在上游的2.06kb区域内鉴定了18种单核苷酸多态性(SNP)和3bp indel。ppmyb10.4起始密码子(图8).在这些snp中,有7个位于潜在基序内,这些基序是通过PLACE程序识别的[29.].在这些motif中,一个MYBCORE是myb型花青素调节剂的潜在结合位点。然而,MYBCORE位点的T/G SNP同时存在于‘HYT’和‘MTH’的启动子中,表明它不是导致红叶着色的原因。在cv的启动子中发现一个3 bp的插入。HYT, 3-bp indel位点具有多态性。然而,在cv的启动子中未发现3 bp的插入。m和洛弗尔。测试如果3-bp indel有关红色的叶子颜色,一对引物侧翼3-bp indel(5“-TTTTACCTTCTCGATCCGGTAT-3”和5 -AATTGTTACAAGCATTCTCCAGTT-3)旨在扩大产品在多样化的桃品种,包括‘Datuanmilu’、‘Gangshanbai’,‘Huyou002’,‘晋元’,‘可能火’,‘Nanfangzaohong’,‘Ruiguangmeiyu’,“五月贤”、“西庄一号”、“朝霞”。所有这些品种的叶子都是绿色的。 However, the 3-bp insertion was also found in the promoter of four cultivars, Huyou002, Nanfangzaohong, Xizhuangyihao, and Zhaoxia. This suggests the indel is unlikely to be responsible for leaf red coloration in peach.
我们还确定了启动子序列中的重复元素ppmyb10.4使用重复遮罩程序(http://www.repeatmasker.org/).发现尺寸的一个转座子样片段280bp在ATG翻译起始密码子上游定位为692bp。然而,在HTY和MTH之间的核苷酸序列中,转座子样片段几乎相同。这表明这种转换元件不太可能负责激活ppmyb10.4.
讨论
桃树叶中的花青素积累的机制
在许多植物物种中,花青素累积主要通过R2R3 MYB转录因子的转录调节来控制[4].在这里,R2R3花青素激活MYB基因ppmyb10.4,位于Gr是候选的Gr红叶着色的基因在桃中。此外,我们的研究表明ppmyb10.4同源物PPMYB10.2在桃叶中也有表达。之前的研究已经证明了这一点PPMYB10.2是负责桃皮中的花青素色素沉着的功能基因[18.],[20.].然而,PPMYB10.2单独表达不太可能诱导桃叶中花青素色素沉着。首先,PpMYB10.2对诱导无影响ppmyb10.4表达。还,PPMYB10.2与绿叶相比,红叶的表达水平相似或更低。转录组分析显示,两个同源基因ppa019522m和ppa010846mATMYBL2,花青素生物合成的负调控因子拟南芥,在叶子中表达。这些MYB阻遏物可以与MyB活化剂竞争,用于BHLH和/或花青素结构基因的结合位点,如DFR[30.].PPA019522M和PPA010846M都以红色叶子的更高水平表示,而不是在绿色叶子中。因此,似乎桃叶中的花青素积累可能是由花青素生物合成的正面和负调节剂的协调性地调节。
R2R3 MYB TFS在植物中功能保守,但可以激活不同的结构性花青素基因[31.].结构花青素基因可分为两类:早期生物合成基因(EBGs)和早期生物合成基因(EBGs)。CHS,气,F3h., 和F3'H)和晚期生物合成基因(LBGS,即DFR,Ldox., 和UFGT.)[32.].在拟南芥,PAP1.,PAP2.,myb113和myb114通过调控LBGs调控花青素积累[33.].类似地,葡萄藤中的两个MYB基因,VvMYBA1和VvMYBA2,通过激活,增加浆果中花青素的生物合成UFGT.[9].相比之下,苹果MdMYB10激活花青素生物合成途径的所有基因,导致果实、茎和叶中的花青素色素沉着[12.].在花椰菜,BomyB2.特别激活两个调节基因Bobhlh1.晚期花青素途径的结构基因,包括BOF3'H.,Bodfr., 和BoLDOX[34.].
在本研究中,整个花青素途径基因在红色叶片中的表达水平高于绿色叶片。这说明桃叶中花青素的积累受转录水平的调控ppmyb10.4,像苹果一样MYB10,可直接或间接激活EBGs和lbg。另一方面,瞬时显色试验表明,桃子PpMYB10.4与苹果MdMYB10一样,与bHLH3相互作用,诱导花青素生物合成[12.].以前的研究表明,MBW复合物主要激活LBG [33.],[34.].这在我们的桃瞬时试验中也是正确的,这表明ppmyb10.4,就像葡萄藤一样VvMYBA基因,通过激活增加叶片中的花青素积累UFGT..
ppmyb10.4代表蔷薇科在蔷薇科激活的花青素激活MYB基因的新枝
基因复制经常发生在血清素激活的进化发展中MYB基因。例如,多个集群MYB在葡萄藤[9]和花椰菜[34.].在这项研究中,在LGS 3和6中鉴定了桃中的三种花青素调节MYB基因的两种簇。覆盖这两个簇的染色体区域不是来自于逃离古生学术的同一个祖传古古代肌肉1].在苹果中,两种花青素调节基因MYB110a和MYB110b也聚集在染色体17的60kb区域[25.],似乎与之相关MYB10在同源染色体9.然而,我们没有发现任何花青素激活的簇MYB草莓基因组中的基因[35.].基因组Fragaria.,马吕斯和李古鲁乌斯通过重建具有九种染色体的假设祖先罗索西基因组[36.].因此,可能是花青素激活的簇MYB在其他枸杞物种的桃子分歧后,基因已经进化。
如上所述,花青素激活MYB蔷薇科基因可分为MYBI和MYBII两个家族。有趣的是,MYBI家族由之前报道过的成员组成MYB主要负责果实中花青素积累的基因。例如,苹果mdmyb110a有助于果实成熟后期花青素在果实皮层的积累[25.].同样,桃子PPMYB10.1 / 2/3参与水果中的Anthocaynin积累[18.],[20.].两位等位基因MdMYB10轨迹MdMYBA和MdMYB1控制苹果皮的红色着色虽然MdMYB10由于其组成型过表达剖面,能够在果实(皮肤和皮层)和叶子中诱导花青素色素沉着[10.],[11.].相比之下,桃子ppmyb10.4调节叶片等植物器官中的花青素色素沉着,但在水果中没有水果中没有花青素饮用。编码序列ppmyb10.4苹果和p .却已使用BLASTN和来自Apple的两个基因MDP0000573302和PM001924p .却已的相似性最高ppmyb10.4。ppmyb10.4其同源物Pm001924与之前报道的花青素激活不同MYBMYB基因在蔷薇科形成一个新的基因家族。然而,MDP0000573302属于MYBI家族。我们的研究表明MYBI和MYB II基因可以追溯到一个共同的祖先约70个MYA。最近的共同祖先马吕斯和李古鲁乌斯已被日期为49.42±0.54 mya [37.,桃子最近没有进行全基因组复制[1].因此,桃子基因组中的两个MYB簇可能来自假设的祖先罗索西基因组,而是orthoologppmyb10.4在从桃子分开苹果后可能已经丢失在苹果基因组中。
我们的研究表明两者都是ppmyb10.5和ppmyb10.6没有用桃叶表达。在我们先前报道的桃花和水果组织的转录组中未发现它们的转录物[38.].据报道,siRNA,TAS4-siRNA81( - ),瞄准一组MYB TFS,如PAP1.和myb113在拟南芥[39.].用于TAS4-siRNA81( - )的共有靶序列(5'-GGCCTCAACCACGAACCTTCT-3')也发现了两者的第三个外显子ppmyb10.5和ppmyb10.6.这可能负责发现ppmyb10.5和ppmyb10.6在任何测试的桃子组织中都没有表达。相比之下,ppmyb10.4不含Tas4-siRNA81( - )的目标站点,其表达在红色叶子中高度诱导。在启动子区发现了几个SNPppmyb10.4.在Apple中,ATG翻译上游的SNP 1,661启动密码子myb1.已被报道与红色皮肤的种族隔离[10.].因此,如果激活的激活尚不清楚ppmyb10.4基因可归因于启动子区中的单核苷酸突变。此外,在F中的连杆组6和8之间发现互易易位2一种种间杂交的' Garfi '杏仁和' Nemared '桃子,易位断点位于附近Gr基因座[40].此易位也在f中找到2两个桃子品种'akame'和'juseitou'之间的十字架41.].由于'Nemared'和'Akame'都是红叶品种,值得进一步研究,以确定这种易位和桃叶着色之间的关系。
影响观赏桃叶色变化的潜在因素
桃是一组温带落叶果树的成员,其中许多人在秋季衰老过程中产生绿叶并积累花青素[2].花青素色素在叶片养分重吸收的关键时期提供有效的光保护。相比之下,观赏桃子‘HYT’的幼叶是红色的,但随着成熟,叶子的颜色会逐渐变绿。叶片颜色的变化主要是由于ppmyb10.4.
温度是影响植物中的花青素生物合成的重要因素[42.],在苹果中是通过表达的MYB10[43.].然而,ppmyb10.4春、夏、秋三季(武汉高温地区)红幼叶的表达水平无显著差异。这与之前的一篇报道相似,即在高温下生长的葡萄浆果中,花青素生物合成基因没有被强烈下调[44.].此外,在不同季节生长的年轻红色叶子之间也相似的花青素含量也是类似的,这与葡萄皮中的高温增加了高温增加了花青素的降解[44.].据报道,光和激素在花青素的生物合成中也起着重要的作用[45.],[46.].因此,除了温度之外,其他因素可能是导致表达减少的原因ppmyb10.4.需要进一步的研究来阐明哪些因素在下调中起作用ppmyb10.4成熟叶子中的表达,导致桃叶颜色变化。
结论
有两个编码花青素激活的簇MYB桃子基因组中的基因,用一种基因ppmyb10.4在GrLG 6的间隔负责桃树叶中的花青素积累。花青素激活MYB蔷薇科的基因可分为两个家庭Mybi和Mybii,这是从大约70 Mya的古代复制出来的。Mybi家族主要负责果实中的花青素积累,而MyB II家族调节叶子等植物器官中的花青素积累。
方法
植物材料
本研究中使用的所有桃子均在中国科学院武汉植物园(湖北省武汉)维持。选择了一种红叶品种“Honyetao”以及两个绿叶品种“白叶”Baihuabitao'和'螳螂红'进行定量RT-PCR分析(QRT-PCR),以鉴定负责叶片中的花青素色素沉着的基因。对于CV。“宏yetao”,少年和成熟的叶子在三个不同的赛季中抽样,包括春天,夏天和秋季,而其他品种的叶子被春天收集。将所有样品在液氮中冷冻,然后在-75℃下储存直至使用。
花青素浓度的测量
按照先前研究描述的协议进行测定的花青素含量[47.].简单地说,将大约1g的组织在液氮中研磨成细粉,用5 ml萃取液(0.05% HCl in甲醇)在4℃下提取12 h。在10000 g离心20 min后,将上清转移到一个干净的管中。用额外的5 ml提取液在4°C下提取6 h,合并上清液,测量最终体积。然后,将1 ml上清与4 ml缓冲液A (0.4 M KCl,用HCl调整pH为1.0)或缓冲液B (1.2 N柠檬酸,用NaH调整pH为4.5)混合2阿宝4和氢氧化钠)。在510和700 nm处测定混合物的吸光度。花青素含量计算公式如下:TA = A * MW * 5 * 100 * V/e,其中TA代表总花青素含量,即花青素-3- o -葡萄糖当量(mg/100 g), V代表最终体积(ml), A = [(A510——一个700ph1.0]在ph1.0] - [(a510——一个700)在pH 4.5]中,E是氰茚-3-葡糖苷(26,900)的吸光度,MW是氰茚-3-葡糖苷的分子量(449.2)。进行每个生物复制样品的三次测量。
illumina测序的RNA-SEQ图书馆构建
使用Trizol试剂提取总RNA,然后使用RNase-free dnase (Takara, Dalian, China)进行RNA清除。PolyA mrna用oligo-dT-attached magnetic beads纯化。将纯化的mrna经超音波裂解成200 ~ 500 bp的小片段。根据我们之前报道的协议,使用Cleaved mrna作为模板构建RNA-Seq库[38.].构建的文库由AMPure珠进行纯化,并由Qiagen核酸纯化试剂盒(Qiagen, CA, USA)从低熔点琼脂糖(2%)中回收约300个碱基对的长度。转录组测序采用Illumina Hiseq2000测序仪。
QRT-PCR的基因表达分析
根据制造商说明,使用Universal Plant Total RNA Extraction Kit (BioTeke, Beijing, China)进行总RNA分离。RNA样本用DNase I (Takara,中国大连)处理,以去除任何基因组DNA的污染。使用上标III逆转录酶(Invitrogen)合成cDNA,每个样本3微克总RNA。以SYBR Green为基础的实时荧光定量PCR检测方法,总反应量为25 μL,其中包含12.5 μL的2× SYBR Green I Master Mix (Takara, Dalian, China),每个引物0.2 μM,模板cDNA 100 ng。桃子基因PpTEF2与Genbank登录号。JQ732180用作基因表达谱分析的组成型对照。与花青素途径相关的结构基因的底漆序列与我们之前的研究中的报告相同[21.].值得注意的是,这四个CHS桃中的基因在编码区中享有高水平的核苷酸序列同一性(94至97%),并使用由保守区域设计的一对引物研究其集体表达。桃子和花青素结构基因中的花青素调节基因的引物序列列于额外档案中1:表S.1.
使用Applied Biosystems 7500实时PCR系统进行扩增。扩增程序由1个95℃的1个循环组成10分钟,然后将40个循环为95℃,30秒,60℃为30秒。在每个循环的第二步中检测到荧光产物。在40个循环结束时进行熔化曲线分析,以确保适当扩增靶片段。在熔点过程中在熔点读数以0.5℃/秒的加热速率下熔化过程中连续收集荧光读数。使用三个生物重复重复三次全部分析。
估计花青素相关的MYB基因的分歧时间
根据我们先前的报告方法进行了MYB基因分歧时间的估计[48.].简而言之,使用肌肉对准编码DNA序列(通过日志预期的多个序列比较)[49.]并集成在Mega5中。使用两个校准点校准分子时钟;水稻玉米(31.0±6.0 mya)以及单子叶床(250.0±40.0 mya)的分歧。这种校准用作地标,以评估所使用的所有样品中估计的分歧时间点的后验分布。进行贝叶斯马尔可夫链Monte Carlo(MCMC)分析以估计分歧日期[50.]并且分析包括四个独立的运行,每个运行都有1000万MCMC步骤,并每1000代采样。
瞬时转化烟草叶片的双荧光素酶测定
设计引物5 ' -CACCATGGATAGTTCTTCGGGAGTGA-3 ' /5 ' -GTTATGTTGATAGATTCCAAAGGTC-3 '和5 ' -CACCATGGCTGCACCGCCAAGT-3 ' /5 ' -CTAGGAATCAGATTGGGGAATTATT-3 'ppmyb10.4和PPBHLH3利用cv。Hongyetao。在35S启动子的控制下,利用Invitrogen公司的LR克隆酶II试剂盒将编码序列分别插入到pHEX2载体中。包含A的pHEX2向量格斯基因作为对照进行双荧光素酶检测。起始密码子上游DNA片段大小约2.3 kbppmyb10.4从cv克隆。宏雄使用一对引物(5'-ggatctcgccgctgttttttg-3'/ 5'-ctcgtacgtcggatgatgtaactagt-3')。随后将DNA片段插入PGREENII 0800-LUC +载体的多克隆位点,其含有报告盒[51.].进行双荧光素酶测定使用与先前研究所述的相同方案[12.].
烟草瞬态转化诱导花青素
降生的幼苗尼科尼亚塔哈瓦姆温室生长用于渗透。选择农杆菌菌株GV3101用于瞬态颜色测定。单独的菌株含有ppmyb10.4要么PPBHLH3与35S启动子融合的pHEX2载体渗透或共渗透到叶片背面。每次渗透都是用三片叶子对同一植物进行的。浸润后7天拍摄照片。
颗粒轰击介导的桃子叶中的瞬时表达测定
包含的构造ppmyb10.4如上所述被引入CV的幼叶中。MTH使用轰炸方法如前所述[52.].简单地,用次氯酸钠溶液处理桃树幼叶。消毒后,将叶片切成直径1cm的方形,在MS培养基上预培养24 h。亚微米金颗粒(0.6 μm)按照厂家说明书处理。根据制造商的说明,使用PDS-1000/He粒子枪(BIO-RAD)递送dna涂层金颗粒。空矢量也被转换为控件。轰击后,桃树叶片在MS上培养2天,培养基置于22℃、相对湿度50% ~ 80%的生长室中。
收集转化的桃叶,在液氮中细化地研磨,然后进行花青素和RNA提取。使用如上所述的方案进行RNA提取,而在室温下以1%(v / v)HCl-甲醇溶液中萃取花青素并连续摇动过夜。将提取物以10,000g离心15分钟,通过添加氯仿除去叶绿素。收集含有花青素的上清液。
作者的责任
YZ和SV参与基因表达和转基因分析。LW和Hz分析了转录组数据。Hz,Kl,Re和AA参与了基因功能研究。耶是整体项目领导者。所有作者阅读并认可的终稿。
额外的文件
参考文献
- 1。
国际桃子基因组倡议:桃子的高质量草案(碧桃)确定了遗传多样性、驯化和基因组进化的独特模式。《中国科学院院刊》2013年第4期。10.1038 / ng.2586。
- 2。
Feild Ts,Lee DW,Holbrook NM:为什么叶子在秋天变红。花青素在红色奥西尔山茱萸的叶片中的作用。植物理性。2001,127:566-574。10.1104 / pp.010063。
- 3.
黄酮类化合物:生物化学途径调控和进化的彩色模型。植物科学进展,2005,10:236-242。10.1016 / j.tplants.2005.03.002。
- 4。
Tanaka Y,Sasaki N,Ohmiya A:植物颜料的生物合成:花青素,贝氏菌和类胡萝卜素。工厂J. 2008,54:733-749。10.1111 / J.1365-313x.2008.03447.x。
- 5。
Grotewold E:花卉颜料的遗传和生物化学。Annu Rev植物Biol。2006,57:761-780。10.1146 / annurev.arplant.57.032905.105248。
- 6。
Zafra-Stone S,Yasmin T,Bagchi M,Chatterjee A,Vinson Ja,Bagchi D:Berry花青素作为人类健康和疾病预防的新型抗氧化剂。Mol Nutr Food Res。2007,51:675-683。10.1002 / mnfr.200700002。
- 7。
Broun P:类黄酮生物合成的转录控制:一个涉及拟南芥分化多个方面的保守调节的复杂网络。acta botanica yunnanica(云南植物研究).2005,8:8-10.1016/j.pbi.2005.03.006。
- 8。
类黄酮生物合成。遗传学、生物化学、细胞生物学和生物技术的彩色模型。植物营养与肥料学报。2001,22(4):457 - 461。10.1104 / pp.126.2.485。
- 9。
Walker Ar,Lee E,Bogs J,McDavid da,Thomas Mr,Robinson SP:白葡萄通过两个类似和相邻的监管基因的突变来源。工厂J. 2007,49:772-785。10.1111 / J.1365-313x.2006.02997.x。
- 10。
Takos Am,Jaffe FW,Jacob SR,Bogs J,Robinson SP,Walker Ar:光诱导的MyB基因表达调节红苹果中的花青素生物合成。植物理性。2006,142:1216-1232。10.1104 / pp.106.088104。
- 11.
Ban Y,Honda C,Hatsuyama Y,Igarashi M,Bessho H,Moriguchi T:MyB转录因子基因的分离和功能分析是苹果皮中红色发育的关键调节因子。植物细胞生理。2007,48:958-970。10.1093 / PCP / PCM066。
- 12.
Espley RV, Hellens RP, Putterill J, Stevenson DE, Kutty-Amma S, Allan AC:苹果果实的红色着色是由于MYB转录因子MdMYB10的活性。植物学报,2007,49:414-427。10.1111 / j.1365 - 313 x.2006.02964.x。
- 13。
Lin-Wang K,Bolitho K,Grafton K,Kortsee A,Karunairetnam S,Mcghie TK,埃斯普利RV,Hellens RP,Allan AC:R2R3 MyB转录因子与蔷薇科的花青素生物合成途径相关。BMC植物BIOL。2010,10:50-10.1186 / 1471-2229-10-50。
- 14。
刘建平,张永强,张永强,张永强,张永强,刘建平。反转录转座子对血橙花色苷积累的调控作用。acta botanica sinica, 2017, 36(4): 457 - 462。10.1105 / tpc.111.095232。
- 15.
花青素在秋季叶片衰老过程中的生理意义。植物生理学。2001,21:1-8。10.1093 / treephys / 21.1.1。
- 16。
马晓峰:桃育种进展。地球物理学报1937,35:49-53。
- 17。
Lambert P,Pascal T:将RM2基因展示赋予桃子栽培品种“Rubira®”的绿色桃蚜(Myzus Persicae Sulzer)的抗性。树遗传学基因组织。2011,7:1057-1068。10.1007 / s11295-011-0394-2。
- 18。
rapaglia D, Espley RV, Henry-Kirk RA, Andreotti C, Ziosi V, Hellens RP, Costa G, Allan AC:油桃类黄酮生物合成的转录调控(碧桃)通过一组R2R3 MYB转录因子。植物生态学报。2013,29(3):457 - 461。
- 19。
Uematsu C,Katayama H,Makino I,Inagaki A,Araakawa O,Martin C:和平,一种类似的人的转录因子,调节开花桃子'Genpei'轴承杂色和完全着色花的花瓣色素沉着。J Exp Bot。2014,65:1081-1094。10.1093 / JXB / ERT456。
- 20.
Rahim Ma,Busatto n,Trainotti L:在桃子果实中对花青素生物合成的调节。Planta。2014,240:913-929。10.1007 / s00425-014-2078-2。
- 21.
关键词:桃,光呼吸,温度,花青素生物合成碧桃个)。植物基因组学杂志。2012,9:265-278。10.1007 / s11295 - 012 - 0552 - 1。
- 22.
邓小敏,王志强,王志强,等。低温胁迫下苹果和桃幼苗花青素的积累。中国科学:地球科学,1999,30(4):427 - 434。10.1016 / s0304 - 4238(99) 00065 - 5。
- 23.
程军,魏刚,周华,顾超,廖玲,韩艳:桃花色苷糖基化和甲基化机制的初步研究。植物营养与肥料学报。2014,33(4):457 - 461。10.1104 / pp.114.246876。
- 24.
AppreeNach R,Chambon P:组织和蛋白质真核分裂基因的表达。annu rev biochem。1981年,50:349-383。10.1146 / annurev.bi.50.070181.002025
- 25。
Chagnéd,林王克,埃斯普利·克朗,沃尔兹·鲁克,罗斯·斯,邦戈里斯C,Carlisle Cm,Kumar S,De Silva N,Micheletti D,Mcghie T,Crowhurst RN,Story Rd,Velasco R,Hellens RP,Gardiner SE,Allan AC:古代复制苹果MYB转录因子是对新的红果肉表型负责。植物理性。2013,161:225-239。10.1104 / pp.112.206771。
- 26。
冯珊珊,王玉英,杨树华,徐玉华,陈晓霞:梨花青素的合成受R2R3-MYB转录因子的调控Pymyb10..Planta。2010,232:245-255。10.1007 / S00425-010-1170-5。
- 27。
张问,陈W,太阳L,赵F,黄B,杨W T Y,王J,元Z,风扇G,邢Z,汉族C, H,钟X, W,梁X, Du D, F,徐Z,郝R, Lv T, Lv Y,郑Z,太阳M, L, Cai M,高Y,王J,阴Y,徐X, et al:的基因组李春万.NAT Communce。2012,3:1318-10.1038 / ncomms2290。
- 28。
Espley RV,Brendolise C,ChagnéD,Kutty-Amma S,Green S,Volz R,Putteriliill J,Schouten HJ,Gardiner SE,Hellens RP,Allan AC:启动子段的多重重复导致红苹果中的转录因子自动调节。植物细胞。2009,21:168-183。10.1105 / TPC.108.059329。
- 29。
HIGO K,UGAWA Y,Iwamoto M,Korenaga T:植物顺式作用调控DNA元素(Place)数据库:1999。核酸RES。1999年,27:297-300。10.1093 / nar / 27.1.297。
- 30。
Matsui K, Umemura Y, Ohme-Takagi M: AtMYBL2是一种具有单一MYB结构域的蛋白,在植物中作为花青素生物合成的负调控因子拟南芥.工厂J. 2008,55:954-967。10.1111 / J.1365-313x.2008.03565.x。
- 31。
Quattrocchio F,Wing JF,Leppen H,Mol J,Koes Re:控制花青素色素沉着的调节基因在植物物种中具有功能保守,并具有不同的靶基因组。植物细胞。1993年,5:1497-1512。10.1105 / TPC.5.11.1497。
- 32。
Dubos C,Le Gourierec J,Baudry A,Huep G,Lanet E,Debeaujon I,Retaboul JM,Alboresi A,Weisshaar B,Lepiniec L:MyBl2是拟南芥中黄酮类生物合成的新稳压因素。工厂J. 2008,55:940-953。10.1111 / J.1365-313x.2008.03564.x。
- 33。
TTG1/bHLH/Myb转录复合物对花青素生物合成途径的调控拟南芥幼苗。植物学报,2008,53:814-827。10.1111 / j.1365 - 313 x.2007.03373.x。
- 34。
赵丽文,周旭,吴旭,Prior RL,李丽:紫菜花的形成与MYB转录因子的激活有关。植物营养与肥料学报,2010,29(4):489 - 494。
- 35。
Shulaev V,萨金特DJ,克劳赫RN, Mockler TC, Folkerts O, Delcher,贾斯瓦尔P, Mockaitis K,萨金特DJ,克劳赫RN, Mockler TC, Folkerts O, Delcher,贾斯瓦尔P, Mockaitis K,斯通,鬃毛SP,伯恩斯P,戴维斯TM, Slovin JP,巴希尔N,赫楞RP,埃文斯C,哈金斯T, Kodira C, B Desany Crasta或者,詹森房车,艾伦AC,迈克尔•TP等:林地草莓(Fragaria vesca)基因组。王志强。2011,43:109-116。10.1038 / ng.740。
- 36。
Jung S, cesaro A, Troggio M, Main D, Zheng P, Cho I, Folta KM, Sosinski B, Abbott A, Celton JM, Arús P, Shulaev V, Verde I, Morgante M, Rokhsar D, Velasco R, Sargent DJ: Fragaria Prunus和Malus的全基因组比较揭示了不同的蔷薇亚科进化模式。中国生物医学工程学报。2012,13:129-10.1186/1471-2164-13-129。
- 37。
本尼迪克特JC,Devore Ml,Pigg KB:李古鲁斯和Oemleria(Rosaceae)从美国东北部初期的初期农民共和国植物群花卉。int j植物sci。2011,172:948-958。10.1086 / 660880。
- 38。
王我,赵某,顾世,周y,周h,ma j,cheng j,han y:深rna-seq揭开桃子转录ome景观。植物mol biol。2013,83:365-377。10.1007 / s11103-013-0093-5。
- 39。
罗QJ,Mittal A,Jia F,Rock CD:涉及PAP1和TAS4的自动调节反馈循环响应于糖拟南芥.植物mol biol。2012,80:117-129。10.1007 / s11103-011-9778-9。
- 40.
JáureGuiB,De Vicente MC,Messeguer R,Felipe A,Bonnet A,Salesses G,ArúsP:“Garfi”杏仁和'Nemared'桃子之间的互惠易位。Al Appl Genet。2001,102:1169-1176。10.1007 / S001220000511。
- 41.
Yamamoto T,Yamaguchi M,Hayashi T:SSR,STS,AFLP和RAPD的桃子综合遗传联系地图。J JPN SOC HORT SCI。2005,74:204-213。10.2503 / jjshs.74.204。
- 42.
Leyva A,Jarillo Ja,Salinas J,Martinez-Zapater JM:低温诱导亚苯丙氨酸氨基酶和Chalcone氨基丙酮的积累以轻依赖性的方式。植物理性。1995,108:39-46。
- 43.
Lin-Wang K,Micheletti D,Palmer J,Volz R,Lozano L,Espley R,Hellens RP,Chagnèd,罗文DD,Troggio M,Iglesias I,Allan AC:通过调制花青素调节来降低苹果果实颜色复杂的。植物细胞环境。2011,34:1176-1190。10.1111 / J.1365-3040.2011.02316.x。
- 44.
Mori K,Goto-Yamamoto N,Kitayama M,Hashizume K:在高温下红葡萄酒葡萄中的花青素丧失。J Exp Bot。2007,58:1935-1945。10.1093 / JXB / ERM055。
- 45.
Takada K,Ishimaru K,Minamisawa K,Kamada H,Ezura H:突变的甜瓜乙烯受体基因CM-ETR1 / H69A的表达影响雄蕊发育尼科尼亚塔哈瓦姆.植物SCI。2005,169:935-942。10.1016 / J.PlantsCi.2005.06.012。
- 46.
Li Y, Mao K, Zhao C, Zhao X, Zhang H, Shu H, Hao Y: MdCOP1泛素E3连接酶与MdMYB1相互作用调控光诱导的苹果花色苷合成和红果着色。植物营养与肥料学报。2012,29(6):751 - 756。10.1104 / pp.112.199703。
- 47.
Romero I, Teresa Sanchez-Ballesta M, Maldonado R, Isabel Escribano M, Merodio C:高co2处理低温贮藏葡萄的花青素、抗氧化活性和胁迫诱导基因表达。植物营养与肥料学报。2008,29(4):523 - 527。10.1016 / j.jplph.2006.12.011。
- 48.
程俊,汗马,邱WM,李继,周,张Q,郭W,朱吨,彭俊,孙F,Li S,Korban SS,HAN Y:在单焦度中编码颗粒结合淀粉合酶基因的多样化并且Dicots标有多种基因组重复事件。Plos一个。2012,7:e30088-10.1371 / journal.pone.0030088。
- 49。
德拉蒙德AJ,Rambaut A:野兽:贝叶斯进化分析采样树。BMC EVOL BIOL。2007,7:214-10.1186 / 1471-2148-7-214。
- 50.
Haegawa M,Kishino H,Yano T:由线粒体DNA的分子时钟进行人体猿分裂的约会。J Mol Evol。1985年,22:160-174。10.1007 / BF02101694。
- 51.
Hellens RP,Allan AC,Friel Zh,Bolitho K,Grafton K,Templeton MD,Karunairetnam S,Gleave AP,Laing Wa:功能基因组学的瞬态表达载体,植物中启动子活性的定量和RNA沉默。植物方法。2005,1:13-10.1186 / 1746-4811-1-13。
- 52。
Wang C, Zeng J, Li Y, Hu W, Chen L, Miao Y, Deng P, Yuan C, Ma C, Chen X,臧明,Wang Q, Li K, Chang J, Wang Y, Yang G, He G: Enrichment of vitamin A in wheat(小麦中维生素A原含量的富集)Triticumaestivum.通过引入细菌类胡萝卜素生物合成基因CrtB和CrtI。[J] .中国生物医学工程学报,2014,35(6):757 - 762。10.1093 / jxb / eru138。
致谢
基金资助:国家863计划项目(No. 2011AA100206)和国家自然科学基金项目(No. 31101533)资助。
作者信息
从属关系
通讯作者
额外的信息
相互竞争的利益
提交人声明他们没有竞争利益。
周颖、周慧对这项工作的贡献是一样的。
作者的原始提交的图像文件
下面是作者提交的原始图片文件的链接。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用及公共领域专用豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
周勇,周洪,林旺。et al。转录组分析和瞬态转化表明,古代重复的MYB转录因子作为桃子红色的候选基因。BMC植物BIOL.14,388(2014)。https://doi.org/10.1186/s12870-014-0388-y
已收到:
接受:
发表:
关键字
- 碧桃
- 花青素的颜色
- 基因重复
- 转录组分析