摘要
背景
细胞程序性死亡(PCD)是多细胞真核生物发育和维持的重要过程。在动物中,有三种形态不同的细胞死亡类型:细胞凋亡、自噬细胞死亡和坏死。基于植物细胞死亡形态学的全面分类系统的研究仍在继续。花边植物是研究PCD的一个模型系统,因为叶片穿孔在发育过程中可预测地形成。本研究使用不同程度和类型的应激(热、盐、酸和碱)诱导未发生发育性PCD的细胞死亡。通过活细胞成像观察细胞死亡,并与发育性PCD途径进行比较。
结果
发育性PCD和诱导性PCD在形态学上的相似之处包括:花青素从液泡中消失,囊泡形成增加,核凝聚,以及在细胞器崩溃之前含有细胞器的囊泡与液泡融合。质膜收缩是发育性PCD的一个关键特征,但并非发生在所有诱导的细胞死亡模式中。
结论
不管细胞死亡的原因是什么,液泡似乎在死亡细胞中起着核心作用。结果表明,在单一系统内,不同类型和强度的应激会影响细胞的死亡形态。为了建立植物细胞死亡分类体系,未来的研究应将形态学数据与生物化学和分子数据相结合。
背景
在真核生物中已经进化出细胞死亡过程,清除不需要的、受感染的或受损的细胞[1]-[3.]。传统上,主动细胞死亡被称为程序性细胞死亡(PCD),而更被动发生的细胞死亡被称为坏死;然而,最近的研究对这种二分法的有效性提出了质疑,因为有证据表明,坏死也是一个活跃的过程[4]。PCD可受发展管制或受环境影响[5],尽管在机制上存在显著的重叠[6]。在同一物种内,不同的分类群,甚至不同的组织学起源,细胞死亡特征都是不同的[3.]、[7]。正是由于这个原因,人们一直在努力创建细胞死亡分类系统,该系统主要基于细胞形态学,最近则基于生物化学和分子数据。
在动物中,有三种不同的细胞死亡形态:凋亡、自噬细胞死亡和坏死[8]。首先由Kerr等人创造。[9],凋亡形态的特征是细胞体积缩小,染色质凝聚,核断裂,细胞器超微结构的保存,质膜(PM)完整性的保留,直到死亡过程的晚期,随后形成凋亡小体(由Kroemer等人评论)。8])。经历凋亡的细胞不会引起炎症反应,并被吞噬细胞吞噬。自噬性细胞死亡的特点是死亡前自噬显著增加[8]。动物的自噬细胞死亡通常包括自噬体(双膜囊泡)的增加,随后与溶酶体融合,与细胞凋亡相反,没有染色质凝结[10]。在动物中存在三种类型的自噬:微自噬、巨自噬和伴侣介导的自噬,而在植物中还有其他形式的自噬,包括但不一定限于涉及叶绿体塌陷和叶绿体内部降解的巨自噬[11]。虽然自噬或“自食”是一种典型的促生存或修复机制,但在某些情况下,它被认为会促进细胞死亡,例如果蝇变态过程中的唾液腺(如Green [12])。坏死通常与强应激源诱导的细胞死亡有关,传统上被认为是一个更被动的过程。坏死形态的特征是细胞体积增加,细胞器肿胀,早期PM破裂,随后细胞内成分溢出[10]。
目前,对不同植物PCD类型的分类明显缺乏共识。2000年,Fukuda根据细胞学特征将植物PCD分为三类:凋亡样细胞死亡、叶片衰老和液泡起核心作用的PCD [7]。Fukuda认为,凋亡样细胞死亡的形态学标志是PM从细胞壁撤回和细胞质凝聚[7]。Van Doorn和Woltering(2005)指出,没有植物样本符合真正凋亡的特征[13]。他们认为,一些PCD样本似乎是自噬的,而许多其他类型的PCD都不属于这两类[13]。Reape和McCabe在2008年,以及2013年,基于凋亡样细胞死亡分类[14]、[15]。他们认为,尽管植物中不存在真正的细胞凋亡,但存在许多相似之处,特别是在PM收缩方面,这可能是进化保守的[15]。Van Doorn et al.,(2011)认为植物PCD有两种形式:液泡细胞死亡和坏死细胞死亡,在讨论植物PCD时使用凋亡这个术语或其衍生物是一种误用[16]。根据这些作者的观点,空泡细胞的死亡包括细胞的降解,包括自噬样过程和细胞质破裂后立即释放水解酶[16]。此外,坏死性细胞死亡被认为是一种植物PCD,因为最近有报道称动物模型中的坏死过程中存在内部信号通路[16]。另外,van Doorn(2011)后来认为,由于液泡几乎参与了所有植物PCD类型(包括那些不属于液泡细胞死亡定义的植物PCD类型),因此植物PCD类别应基于与细胞质清除相关的细胞质破裂[17]。因此,van Doorn [17提出了两种新的类别:自溶性PCD,即在细胞质塌陷后发生快速的细胞质清除;非自溶性PCD,尽管细胞质破裂,但没有发生快速的细胞质清除。尽管有近15年的尝试,但基于形态的植物PCD类型的明确、可行的定义仍在开发中。
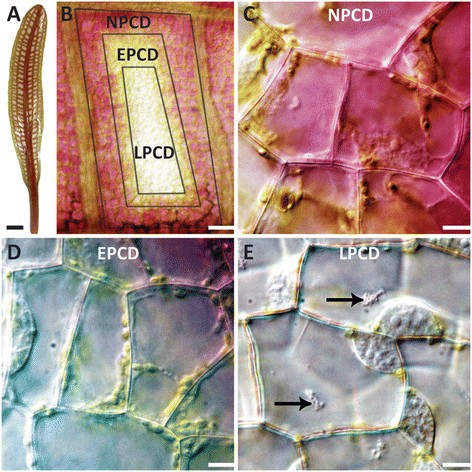
Aponogeton madagascariensis也被称为花边植物,是马达加斯加溪流特有的淡水单子叶植物。花边植物的叶子具有穿孔的叶片,并通过叶柄与鞘基部固定在球茎上[18]、[19]。这种独特的穿孔叶形态为水族馆爱好者提供了100多年的培育机会[18]。花边植物叶片穿孔通过发育调控的PCD形成[20.]。由于窗期叶片的细胞死亡可预测性,蕾丝植物是研究发育调控的PCD的极好模式生物(图2)1A)纵向和横向静脉之间(图1B).此外,薄而几乎透明的叶子便于通过活细胞显微镜观察[5]、[20.]-[22]。在一个孔内,在发育的窗口阶段可以看到PCD的梯度,该阶段包括三个阶段:非(NPCD);数字1C),早期(EPCD;数字1D)和晚期PCD (lcd;数字1E) (24]。
PCD开始于微孔中心,由于lcd细胞已经失去了花青素和大部分叶绿素含量,因此微孔中心几乎没有色素1E).在LPCD细胞中,液泡膨胀,将细胞核和细胞质成分移向PM。随后的张力质体破裂和水解酶释放发生,也被称为大自噬。那些失去花青素但仍有叶绿素的细胞称为EPCD细胞(图2)1有趣的是,叶脉附近的4-5个细胞层在叶片穿孔期间没有发生PCD,它们处于NPCD阶段(图2)1C;[23])。与经历PCD的细胞不同,NPCD细胞在穿孔形成过程中保留花青素(图2)1C).花青素丧失后,叶绿体发生变化,导致叶绿素减少。同时,叶绿体和线粒体的空泡链(TVS)、囊泡、空泡聚集体和核周聚积都有增加[22]。
我们的研究目的是阐明不同程度和类型的应激源的细胞死亡形态,以促进植物细胞死亡分类系统的形成。极端压力导致的细胞死亡通常会导致坏死形态。相反,由于轻度应激源导致的细胞死亡发生得更缓慢,通常表现为发育性PCD的典型形态。我们将此作为本研究的假设。本研究利用独特的蕾丝植物模型系统,比较了NPCD细胞中各种环境诱导的细胞死亡形态与使用活细胞成像技术描述的穿孔形成过程中典型的发育调节的PCD形态。认识到细胞死亡形态,特别是液泡和PM在单个系统内不同诱导模式下的变化,将有助于更好地理解细胞死亡的细胞内动力学。
结果
发展性PCD和比较框架
叶片穿孔是通过一种发育调控的PCD形成的。伴随这种转变的形态学特征由Wertman等人定义。[22](在背景中描述),并用于与本研究的诱导处理进行比较(附加文件)1;表格1).未经处理的NPCD细胞(在穿孔形成过程中没有发生发育性PCD)在6小时的观察中没有显示出明确的细胞死亡迹象,并被用作实验对照,以确保处理触发细胞死亡(附加文件)2).细胞死亡发生的时间表示为平均值±标准差,并且从施加给定治疗的那一刻起,直到观察到质体塌陷或PM内收。所有视频,无论原始获取时间如何,都已标准化为1分钟的长度,这是造成播放速度差异的原因。
附加文件2:控制NPCD单元格。未处理的NPCD细胞置于蒸馏水中观察6小时。这些细胞没有表现出明显的应激迹象,在6小时内没有死亡,因此可以作为与诱导细胞死亡处理比较的对照。大约360倍的播放速度。(mp4 12mb)
热冲击实验
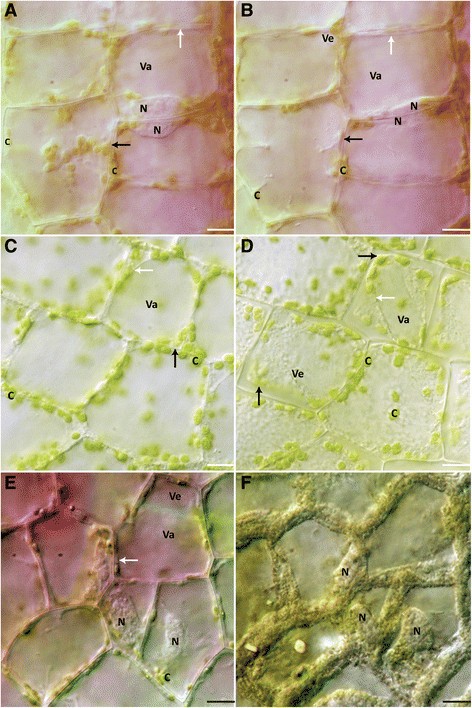
分别在45°C、55°C、65°C条件下处理10 min,然后显微镜下观察。45℃处理6 h内未见细胞死亡(图2)2A、B)。细胞的颜色、细胞核、叶绿体、液泡、囊泡和PM的形态在6小时内没有观察到变化(图2)2A、B;额外的文件3.).55℃处理后,细胞在5.57±0.21 h内全部死亡(图2)2C, D)。细胞在热处理后不久花青素几乎轻微消失(图2)2C;额外的文件3.).似乎有戏剧性的核凝结(附加文件)4).叶绿体丰度和形状似乎没有变化(图2)2C, D)。值得注意的是,囊泡的数量增加了(附加文件)4).随着液泡肿胀的持续,一些囊泡似乎立即与中央液泡融合在一起,随后就出现了媒质渗透性4).膜质体塌陷后不久就发生了PM回缩(图2)2D;额外的文件4).
在65°C下处理的叶片在显微镜下检查时(处理后约5分钟)没有活细胞。因此,分别采集热休克处理前后的图像(图2)2E、F)。暴露在这种处理下的细胞经历了颜色从粉紫色到透明的变化2E、F)。胞内成分的显着变色和外观变化使细胞器鉴定变得困难。然而,热处理前后的图像对比显示,热处理后,沿着细胞边缘出现颗粒状外观(图1)2E、F)。
氯化钠实验
将叶片分别置于100 mM、400 mM和2 M NaCl溶液中观察6 h(或直至细胞死亡)。经100 mM NaCl处理的叶片,在6小时内细胞着色、细胞质流动以及核和PM动力学均无变化(图2)3.A、B;额外的文件5).叶绿体在观察结束时呈皱褶状(附加文件)5).此外,液泡的大小似乎增加(图2)3.A、B;额外的文件4).细胞未在6 h内死亡。
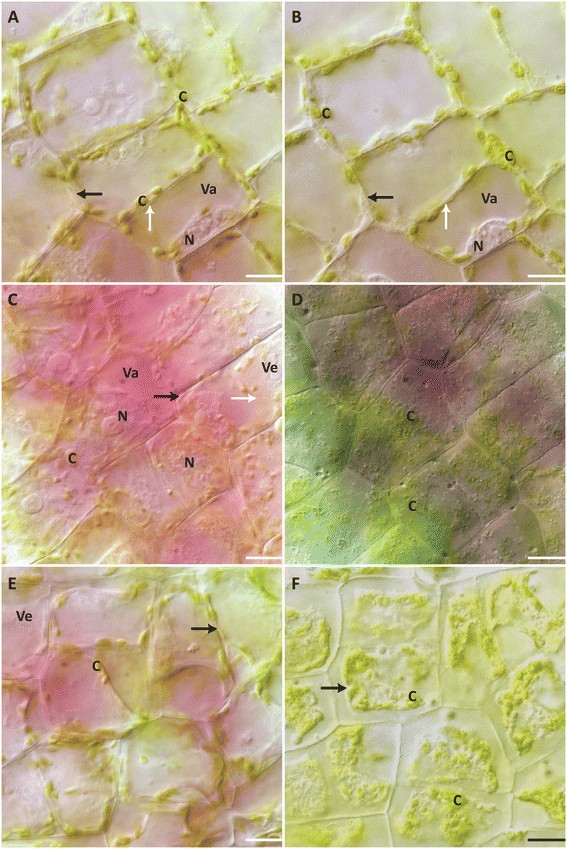
经400 mM NaCl处理的叶片,细胞在5.32±0.63 h后呈现灰色,直至细胞死亡瞬间变绿(图2)3.C, D)。治疗开始后立即发生质解,PM从细胞壁剥离,PM和细胞壁之间可见丝状结构(附加文件)6).细胞核开始收缩,随后叶绿体肿胀起皱(图2)3.C, D)。细胞内发生囊泡形成,细胞质流动停止(图2)3.C, D)。空泡肿胀发生在囊泡溶解和张力质体渗透之前(图2)3.C, D;额外的文件6).一旦膜质体崩溃,就没有撤回PM(附加文件)6).当囊泡溶解时,细胞颜色由粉红色变为绿色(附加文件)6).
2 M NaCl处理的叶片,在4.25±0.38 h的时间内,随着细胞死亡的进展,细胞颜色逐渐改变,最终变为绿色(图2)3.E、F)。处理后,PM从细胞壁上脱落。观察到一些连接PM与细胞壁的丝状结构,但与400 mM NaCl处理相比很少。细胞质很少运动,细胞死亡后出现囊泡。观察到空泡肿胀和张力质体破裂。在死亡过程的后期,许多大小不一的不透明球形体突出,可以看到它们融合在一起(图2)3.E, F;额外的文件7).随着细胞的死亡,这些球形体收缩并消失,PM收缩发生(附加文件)7).
附加文件7:用2m NaCl溶液处理的NPCD细胞。与溶液接触后,质解迅速发生。和田链存在于PM和细胞壁之间,但并不丰富。注意细胞死亡前形成的球形体。在整个过程中,组织中的花青素色素沉着慢慢改变颜色,随着细胞死亡而变成绿色。肿胀发生在扁桃体塌陷和PM剧烈收缩之前。大约300倍的播放速度。(mp4 4mb)
酸碱实验
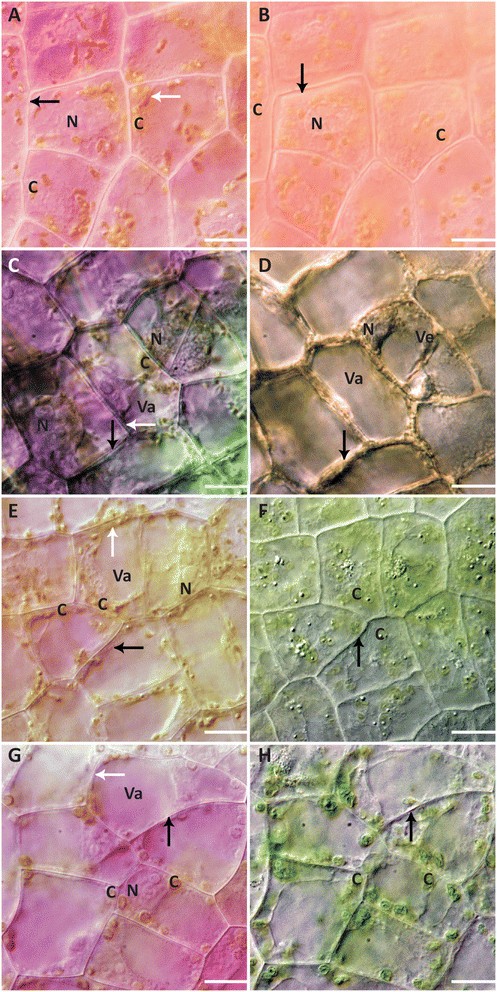
实验中选择的酸碱浓度是可行的最严重浓度(12 M HCl, 1 M NaOH),以及最不严重但仍在6小时内引发细胞死亡的浓度(3 mM HCl, 30 mM NaOH)。叶片分别用12 M HCl、3 mM HCl、30 mM NaOH和1 M NaOH溶液处理,观察结果如上所述。在12 M HCl溶液中,细胞平均死亡时间为3.48±1.67 min。细胞颜色立即改变,细胞呈亮粉色(另附文件)8).在核凝结之前,核仁立即膨胀(附加文件)8).细胞核、叶绿体和液泡凝结似乎同时发生(附加文件)8).在囊泡形成方面没有观察到差异。在PM从细胞中缩回之前,细胞膜发生了塌陷(图2)4A、B;额外的文件8).
酸、碱处理细胞形态。(一)12 M HCl处理0 h NPCD细胞。(B)NPCD细胞经12 M盐酸处理后死亡。核凝结是明显的。观察到PM收缩。花青素的着色仍然存在,尽管会发生轻微的颜色变化。(C)NPCD细胞在3 mM HCl处理0 h。(D)3mm盐酸诱导NPCD细胞死亡后。花青素在整个治疗过程中消失。(E)NPCD细胞在0 h进行30 mM NaOH处理。(F)NPCD细胞在30 mM NaOH处理下死亡。没有发生PM的收回。注意叶绿体肿胀和褶皱的外观。(G)NPCD细胞在0 h进行1m NaOH处理。(H)NPCD细胞死亡后进行1m NaOH处理。没有PM撤回发生。注意叶绿体肿胀和褶皱的外观。(a)N -细胞核,C -叶绿体,Va -液泡,Ve -囊泡,白色箭头-叶绿体,黑色箭头- PM。比例尺:A-H = 25 μm。
附加文件8:用12 M盐酸溶液处理的NPCD细胞。由于压力源的严重性,细胞死亡发生得非常快。在低pH溶液的存在下,液泡花青素的粉红色不会在细胞死亡时消失。值得注意的是核仁在核凝结前瞬间膨胀。质质体塌陷和PM从细胞壁缩回同时发生。大约1.25倍的播放速度。(mp4 3mb)
3 mM HCl溶液处理的叶片细胞在处理后4.02±1.02 h死亡。观察到细胞的半透明度增加,同时颜色下降(图2)4C, D;额外的文件9).液泡的膨胀与囊泡的形成同时发生,细胞核和叶绿体的凝结发生在细胞死亡之前9).在整个治疗过程中,除了TVS增加外,其总数和大小也明显增加(附加文件)9).在先前的研究中,发现这些聚集体含有细胞器,如叶绿体和线粒体[22]。在死亡后期,神经质体塌陷很明显,PM没有缩回(图2)4C, D;额外的文件9).
附加文件9:NCPD细胞用3mm盐酸溶液处理。注:核位移可能是由于液泡尺寸的变化引起的。细胞质流动减慢,随后在细胞质崩溃之前,囊泡形成增加。质体坍缩和核凝聚同时发生。没有PM从细胞壁上缩回。大约180倍的播放速度。(mp4 6mb)
用30 mM NaOH溶液处理的叶片,细胞死亡的平均时间为33.72±5.44分钟。处理导致细胞在清除前颜色从粉红色变为蓝/绿色(图2)4E, F;额外的文件10).核位移在整个治疗过程中逐渐发生(附加文件)10).在整个死亡过程中,囊泡数量增加(附加文件)10).细胞死亡时,叶绿体肿胀(图2)4F)。囊泡的大小似乎比其他诱导处理中所见的大(附加文件)10).随着囊泡的增加,液泡的大小明显增加(附加文件)10).泡体塌陷之前立即发生囊泡膜塌陷或与中央液泡融合(附加文件)10).在囊泡和液泡内部,塌陷前立即出现沉淀(附加文件)10).与叶绿体塌陷同时发生的是叶绿体的急剧膨胀(附加文件)10).没有撤回首相的言论,然而,人们认为它并没有保持完整(图2)4F;额外的文件10).用30mm NaOH处理蕾丝植物叶鞘组织显示出与NPCD细胞相同的细胞死亡特征,但与叶组织相比,细胞内的囊泡更清晰(附加文件)11).聚集体和细胞内成分,包括整个细胞器,如叶绿体,在细胞死亡之前立即进入囊泡并与中央液泡融合(附加文件)11).
附加文件10:用30mm NaOH溶液处理的NPCD细胞。囊泡形成增加,并在泡质体崩溃前与液泡融合。在胞浆塌陷之前,可见液泡中有大量沉淀物。注意叶绿体肿胀的外观。没有PM撤回发生。大约45倍的播放速度。(mp4 7mb)
附加文件11:叶鞘组织用30mm NaOH溶液处理。暴露于30mm NaOH后,细胞内出现大量囊泡。叶绿体在囊泡内可见,囊泡在叶绿体塌陷之前立即与中央液泡融合。未观察到PM缩回。大约25倍的播放速度。(m4v 7mb)
以1 M NaOH溶液处理叶片,诱导细胞死亡的平均时间为49±5.3 s。细胞死亡后,细胞颜色从粉红色变为蓝色,然后变为绿色(附加文件)12).细胞核在细胞死亡前立即消失(图2)4G H;额外的文件12).叶绿体在囊泡和液泡塌陷之前或期间迅速膨胀(图2)4H;额外的文件12).水泡塌陷在空泡塌陷之前或与空泡塌陷同时发生12).总理没有收回,似乎失去了诚信(图2)4G H;额外的文件12).
讨论
热休克治疗已被发现改变细胞代谢,破坏线粒体,并导致ROS增加[23]、[25]。根据严重程度,热休克会导致细胞死亡。在55℃处理下,花青素在处理后立即消失。作者怀疑,活性氧的激增可能在花青素的消失中起了作用,尽管花青素也是一种热敏色素[26]。除了花青素消失外,细胞内的囊泡数量也显著增加。囊泡的特征性增加,液泡中细胞器的出现,以及中央液泡体积的增加,直到tono质体崩溃,为宏观和巨型自噬提供了证据。在细胞壁坍塌后,PM从细胞壁上的缩回类似于在植物发育PCD过程中观察到的PM缩回,但此时PM的超微结构并未被研究。虽然,应该注意的是,发育性PCD的细胞尸体相比之下表现出更浓缩的形态。同样,在使用蕾丝植物原生质体进行的热休克实验中也显示了PM的收缩[23]。令人惊讶的是,原生质体在55°C的温度下对热休克的敏感性要低于原位实验中,原生质在20 min后进行PCD处理原位细胞在10分钟后发生PCD。65°C处理的严重程度导致细胞在处理完成前死亡。65°C处理的细胞死亡形态与55°C处理的细胞死亡形态明显不同,缺乏PM收缩,叶绿体中叶绿素丢失。沿着细胞外围的纹理外观被认为是细胞碎片的残留物。人们认为细胞内的膜已不能保持其完整性。65°C处理后的形态学特征通常被认为是坏死性细胞死亡[15]、[16]。
在100 mM NaCl处理下,细胞质流动明显减慢。氯化钠胁迫与细胞质钙的增加有关2 +钠可以阻止细胞质的流动+取代Ca2 +从首相手中,从解放Ca手中2 +源自internal stores [27]。然而,很少有研究评估盐度对细胞质流动的影响[28]。在100 mM和400 mM NaCl处理下,叶绿体呈褶皱状。在含有100 mM NaCl的培养基中生长的番茄细胞的TEM图像中也观察到这种对叶绿体超微结构的起皱效应[29]。在400 mM NaCl处理下,叶绿体出现肿胀现象,但在2 M NaCl处理下没有出现这种现象。在马铃薯品种中,电镜观察显示,分别用100 mM和200 mM NaCl溶液灌溉植株时,虽然细胞结构完整,但叶绿体出现肿胀[30.]。在盐胁迫下,小麦和甘薯叶片的叶绿体也会肿胀[30.]、[31]。
有趣的是,在100 mM NaCl处理下,液泡的大小出现了增加,这在叶片穿孔发育PCD期间的lcd细胞中也有类似的情况。在红树林细胞和大麦根分生组织细胞的悬浮培养中已经证明,液泡大小在盐水条件下会迅速增加。32]。Na+在中央液泡的积累和随后液泡体积的增加已被证明是一个积极的过程,被认为是细胞应对盐胁迫的一种策略[32]。在400 mM和2 M NaCl处理下发生了囊泡形成,表明宏观自噬增加,可能是为了回收受损的细胞内成分[33]。高盐溶液已被证明可引起细胞自噬拟南芥通过上调自噬相关基因[33]。在400 mM和2 M NaCl处理下,PM从细胞壁的最初缩回,与发育性PCD中后期PM的缩回相反,是由于渗透压的变化引起的质解。在质解过程中观察到的PM和细胞壁之间的丝状结构被推测为支链([34];附加文件6,7).有趣的是,与2 M NaCl处理相比,400 mM NaCl处理中有更多的这些链。在死亡的最后阶段,这两种治疗方法之间存在对比;在400 mM NaCl处理下,细胞质破裂,无PM收缩,而在2 M NaCl处理下,PM收缩明显。作者推测,在400 mM NaCl处理组中,与细胞壁连接的大量链在抑制高浓度处理后发生的PM缩回中发挥了作用。
12m盐酸处理的最显著特征是PM从细胞壁惊人的戏剧性缩回。在12 M HCl处理下,PM收缩与植物穿孔形成过程中发育调控的PCD结束时的PM收缩相似。尽管这种回缩在形态上似乎相似,但这种细胞死亡与穿孔形成中的PCD相反,后者通常需要几天时间。12 M HCl处理下的细胞死亡过程迅速,尽管PM的超微结构变化尚不清楚,但作者怀疑这是一个被动过程。在3mm盐酸处理下,细胞质流动减慢,这可能是细胞质pH改变或细胞质钙增加的结果2 +.液泡广泛膨胀,这可能是细胞对细胞外酸度的反应,通过增加液泡的体积,因为液泡通常比正常情况下的细胞质酸性更强。在这种处理中,液泡的肿胀类似于发育性PCD中lcd细胞的肿胀。观察到的囊泡与盐胁迫处理相似,可能表明宏观自噬增加。细胞死亡发生在细胞质渗透过程中。在30 mM NaOH处理下,与其他处理相比,囊泡明显增加,这也可能表明宏观自噬增加。在细胞死亡之前,液泡的颜色从粉红色变为蓝色/绿色,这表明随着花青素的可见颜色变化,液泡的pH值急剧上升到接近碱性。
诱导细胞死亡与发育细胞死亡的比较表明,它们有几个共同的特征,包括细胞质流动停止和细胞质塌陷(表1)1).在发育和诱导细胞死亡的视频中,液泡动力学似乎是一致的(表1)1),并且占据植物细胞的大部分,它很可能对细胞死亡过程作出重大贡献。核周叶绿体形成只发生在发育性细胞死亡期间。同样,12 M HCl处理是唯一没有花青素消失的细胞死亡,这可能是由于色素对低pH溶液的反应。在NaOH处理中,没有观察到核凝聚,与所有其他细胞死亡类型相反。囊泡形成是所有细胞死亡类型的共同特征,除了那些导致细胞快速死亡的细胞,如12 M HCL和1 M NaOH处理。射孔地层、55°C、2 M NaCl和12 M HCl处理组均出现PM回缩。有趣的是,在所有观察到细胞死亡的病例中,液泡起了核心作用,特别是在所有细胞死亡类型中都发生了张力质体塌陷。本比较研究的结果总结于表中1.
在动物细胞中,存在细胞死亡类型的形态学分类系统,分为凋亡、自噬细胞死亡和坏死三大类。在蕾丝植物中发现的最类似凋亡的特征是由于叶片穿孔发育性PCD期间观察到的细胞体积减少而导致的PM收缩。在55℃、2 M NaCl和12 M HCl处理下,可以看到类似的形貌。对于自噬细胞死亡,在高温、盐和大多数pH处理下观察到空泡肿胀和囊泡形成的增加。值得注意的是,在最极端的pH处理(12 M HCl, 1 M NaOH)中没有观察到囊泡的增加。在大多数不太严重的应激源诱导的细胞死亡形态中,如在叶鞘组织中30 mM NaOH处理下,可以看到被囊泡包裹的整个细胞器在细胞质坍塌之前与液泡融合。最近,Minina等人提出了自噬的双重作用,即在HR(超敏反应)期间作为PCD的启动者,或在发育性PCD期间作为下游的刽子手。[qh]36]。目前的作者认为,这里显示的自噬的例子是下游的,可能是通过激活一些类似于花边植物叶片穿孔发育途径的成分。有趣的是,在2 M NaCl处理下形成的大量球形不透明体与邻近的其他不透明体融合,在PM收缩和细胞死亡之前消失或缩小,但需要更多的研究来确定它们的组成和功能。
坏死特征,如PM的早期破裂,在最极端的治疗中是典型的。细胞体积的减少,以及PM的主动收缩通常与较慢,更内部调节的细胞死亡形式相关;然而,在最极端的酸处理(12 M HCl)中,PM会在几分钟内发生缩回。虽然在55°C和2 M NaCl处理下观察到的PM缩回在形态上与12 M HCl处理相似,但相比之下,细胞死亡发生的时间要长得多。考虑到55°C和2 M NaCl处理的细胞死亡时间相对较慢(分别为5.57±0.21 h和4.25±0.38 h),作者假设PM收缩是一个主动过程,而12 M HCl处理则代表坏死塌陷。然而,需要进一步的研究来确定这里显示的各种诱导细胞死亡形态是否是PCD的形式。
2000年,Fukuda提出植物中存在三种PCD类型:凋亡样、叶片衰老和液泡起核心作用的PCD [7]。从那时起,提出了几种植物PCD分类系统,但目前没有一个被一致接受。提出的分类通常集中在特定细胞器的特征上,特别是液泡或PM。PM是常用的,因为它的外观明显时,从细胞壁撤回。在动物模型中,这种收缩和细胞体积减少是细胞凋亡的特征,但在坏死中不存在。强调液泡可能是由于其在植物细胞中的扩张性,通常占据细胞体积的90%,这与动物细胞中发现的任何自溶细胞器不同。此外,液泡以其自溶特性而闻名,参与细胞过程,如自噬,这与细胞死亡事件有关。当细胞成分通过双膜囊泡被隔离到液泡中时,就会发生大自噬。在本研究中,我们观察到植物细胞死亡过程中,液泡肿胀随后是细胞质塌陷,被称为巨噬。很有可能,未来的细胞死亡分类将集中在液泡在植物细胞死亡中的作用,正如在以前的分类建议中所看到的那样。 Our data indicates that individual stressors typically result in different cell death morphologies amongst differing stressor intensities, despite being within a single system. Other researchers are encouraged to consider the means by which induced PCD studies are carried out. Although the experiments in this paper used isolated stressors, it has been found that more damage occurs to plants when multiple stressors occur simultaneously [35],因此,可以认为治疗应该复制自然发生的综合压力源。
结论
花边植物(答:madagascariensis)是研究发育性PCD和诱导细胞死亡的理想模式生物,特别是因为它的薄而近透明的叶子适合用活细胞显微镜观察。利用活细胞成像技术,区分了诱导处理与发育植株PCD的异同。热休克、NaCl、HCl和NaOH等物理和化学胁迫均可诱导细胞死亡。尽管不同处理之间存在显著差异,但液泡在观察到的所有形式的细胞死亡中都发挥了巨大自噬的核心作用。本研究阐明了在不同胁迫条件下细胞死亡形态的可变性,作者认为形态学数据虽然重要,但必须与生物化学和分子数据相结合,才能对植物细胞死亡分类系统的形成做出重大贡献。
方法
水族植物
Aponogeton madagascariensis植物生长在三个装有淡水的水族箱中,每周补充1mg /L磷酸一钾,10mg /L硝酸钾和3mg /L CSM + B plantex(水族馆肥料,Napa, California, USA)。水族光强约为125 μmol m2年代1,它是由一个水辉光T8荧光灯灯泡产生的(Hagen, montracimal, quacimbec,加拿大)。水族箱维持在12小时的明暗循环中,并保持在24°C的房间中。
组织制备,实验设计,对照处理
实验蕾丝植物组织来源于窗期叶片,利用NPCD细胞,这些细胞在穿孔形成过程中不会发生发育性PCD。从植株叶柄处取下叶片,在dH中冲洗2O.切除中脉,将后续组织切成约5mm2碎片。治疗前,组织块保持在dH内2O,在环境温度下pH范围为6.7-7.0。所有的组织都是在实验当天从一片叶子上取出的。将组织片置于显微镜载玻片上,在载玻片上加入适当的溶液,然后用VALAP(石蜡、羊毛脂、凡士林按2:1:1的比例混合)覆盖并密封。每个试验至少有3个独立的重复,取材于不同的叶片组织。实验持续6小时或直到细胞死亡,细胞死亡是通过胞质体塌陷或PM收缩来确定的。对于所有的治疗,每个应激源的不同强度水平都是优化的。本文提出的所有处理也都使用Wertman等人的自定义玻片法在整片叶子上进行了测试。[22以确保在整个器官中发生相同的细胞死亡形态,因此可以与先前描述的植物发育PCD途径进行比较。本研究利用叶片切片获得更高分辨率的视频,并且由于在显微镜下应用极端酸和碱处理时的后勤限制,这是必要的,因为细胞死亡发生得很快。对照组安装在dH中2零,在环境温度下。首先将溶液放置在安装的组织上,形成一个湿的安装,然后用VALAP密封盖玻片。
热处理
一个水浴(VWR International, Radnor, Pennsylvania, USA)被设置到所需的温度,并装满水。一个装满dH的烧杯2O被放在水浴的中央。一旦达到设定温度(45°C, 55°C或65°C),将一块组织浸入烧杯内。10分钟后,取出组织,置于载玻片上2O(在室温下)创建一个湿安装,然后用VALAP密封盖卡。
氯化钠处理
100 mM、400 mM、2 M NaCl溶液(纯度>99.5%;SIGMA-ALDRICH公司,圣路易斯,密苏里州,美国)准备。将组织贴在载玻片上,加入适当的溶液形成湿贴片,用VALAP密封玻璃罩的四面。
酸碱处理
对于中等pH的溶液(3mm HCl, 30mm NaOH),在放置之前将溶液加入到载玻片中,然后密封盖玻片。对于强酸溶液或强碱溶液,分别为(12 M HCl, 1 M NaOH),将盖片密封在相反的两面,将盖片安装在显微镜上后加入溶液。一旦确定细胞死亡(不超过6小时),就停止观察。使用30 mM NaOH处理的叶鞘组织视频来提供更清晰的囊泡图像。
光学显微镜,视频和图像采集,编辑和时间分析
使用DIC光学,在配备DXM 1200c数码相机的Nikon 90i (Nikon Canada, Mississauga, Ontario, Canada)显微镜上拍摄表皮细胞、NPCD阶段细胞和未发生发育性PCD的细胞的视频和图像。数据采集使用NIS Elements AR 3.10软件(Nikon Canada, Mississauga, Ontario, Canada)。数码照片是用尼康Coolpix L110相机拍摄的(尼康加拿大,加拿大安大略省密西沙加)。使用Adobe Photoshop和Adobe Illustrator (Adobe Systems Inc., San Jose, California, USA)进行图像编辑。使用Adobe Premier Pro CS5 (Adobe Systems Inc., San Jose, California, USA)进行视频编辑。所有附加的文件视频都被标准化为1分钟的持续时间,而不考虑原始持续时间的长度,这种标准化说明了不同的播放速度。细胞死亡发生的时间表示为平均值±标准差,并且从施加给定治疗的那一刻起,直到观察到质体塌陷或PM内收。数据以平均值±标准差表示。
附加文件
缩写
- EPCD:
-
早期程序性细胞死亡
- LPCD:
-
程序性细胞晚期死亡
- NPCD:
-
非程序性细胞死亡
- 纤毛运动:
-
细胞程序性死亡
- 下午:
-
等离子体膜
- ROS:
-
活性氧
- 电视:
-
Transvacuolar链
参考文献
- 1.
Jan N, Mahboob-ul-Hussain, Andrabi KI:程序性细胞死亡或凋亡:动物和植物有任何共同点吗?生物技术分子生物学杂志2008年,3:111 - 126。
- 2.
在发育和防御过程中的程序性细胞死亡。植物生理学报,2001,25(4):564 - 567。10.1104 / pp.125.1.94。
- 3.
Gunawardena AHLAN:秀丽隐杆线虫、哺乳动物和植物的程序性细胞死亡。中国生物医学工程学报,2012,31(1):391 - 391。10.1016 / j.ejcb.2012.02.002。
- 4.
黄春华,黄春华。动物发育与疾病的细胞程序性死亡。细胞学报,2011,47(7):742-58。10.1016 / j.cell.2011.10.033。
- 5.
植物细胞程序性死亡和组织重塑。实验学报,2008,59:445- 451。10.1093 / jxb / erm189。
- 6.
面仔(编辑):植物细胞死亡:过程.学术出版社;2003:392。
- 7.
福田H:植物管状细胞的程序性死亡。植物学报,2009,44(4):559 - 561。10.1023 /: 1026532223173。
- 8.
Kroemer G, El-Deiry WS, Golstein P, Peter ME, Vaux D, Vandenabeele P, Zhivotovsky B, Blagosklonny MV, Malorni W, Knight RA, Piacentini M, Nagata S, Melino G:细胞死亡分类:细胞死亡命名委员会的建议。细胞与死亡。2005,12:1463-7。10.1038 / sj.cdd.4401724。
- 9.
Kerr JFR, Wyllie AH, Currie AR:细胞凋亡:一个基本的生物现象,在组织动力学中具有广泛的意义。中国生物医学工程杂志,2002,26(2):369 - 369。10.1038 / bjc.1972.33。
- 10.
Kroemer G, Galluzzi L, Vandenabeele P, Abrams J, Alnemri ES, Baehrecke EH, Blagosklonny MV, El-Deiry WS, Golstein P, Green DR, Hengartner M, Knight RA, Kumar S, Lipton SA, Malorni W, Nuñez G, Peter ME, Tschopp J, Yuan J, Piacentini M, Zhivotovsky B, Melino G:细胞死亡分类:细胞死亡命名委员会建议2009。细胞死亡差异。2009,16:3-11。10.1038 / cdd.2008.150。
- 11.
范道恩等。植物细胞自噬的超微结构研究[j]。细胞自噬。2013,9(9):222 -36。10.4161 / auto.26275。
- 12.
格林:达到目的的手段:细胞凋亡和其他细胞死亡机制。冷泉港实验室出版社;2011.
- 13.
范·多恩:有很多方法可以退出?植物细胞死亡的种类。植物科学进展,2005,10:117-22。10.1016 / j.tplants.2005.01.006。
- 14.
Reape TJ, McCabe PF:植物细胞凋亡样程序性死亡。植物学报,2008,18(1):13-26。10.1111 / j.1469-8137.2008.02549.x。
- 15.
Reape TJ, McCabe PF:评论:垂死植物细胞的细胞凝聚:程序性收缩或坏死塌陷?植物科学,2013,27(2):559 - 559。10.1016 / j.plantsci.2013.03.001。
- 16.
Van Doorn WG, Beers EP, Dangl JL, Franklin-Tong VE, Gallois P, Hara-Nishimura I, Jones AM, kawai yamada M, Lam E, Mundy J, Petersen M, Smertenko A, Taliansky M, Van Breusegem F, Wolpert T, Woltering E, Zhivotovsky B, Bozhkov PV:植物细胞死亡的形态学分类。中国生物医学工程学报,2011,28(2):444 - 444。10.1038 / cdd.2011.36。
- 17.
Van Doorn WG:植物中程序性细胞死亡的类别,与动物中的相比。实验学报,2011,32(2):449 - 461。10.1093 / jxb / err196。
- 18.
Van Bruggen HV:附藤属专论(附藤科)。Bibl机器人1985年,33:1 - 76。
- 19.
Tomlinson PB: VII泽泻科。在单子叶植物的解剖.梅特卡夫CR编辑。牛津:克拉伦登出版社;1982九- 225。
- 20.
Gunawardena AHLAN, Greenwood JS, Dengler NG:植物发育过程中细胞程序性死亡重塑叶片形状。植物细胞,2004,16(1):60-73。10.1105 / tpc.016188。
- 21.
Wright H, van Doorn WG, Gunawardena AHLAN:植物发育性程序性细胞死亡的体内研究(aponogeton madagascar);附板藤科)叶模式系统。[J] .中国生物医学工程学报,2009,26(6):865- 876。10.3732 / ajb.0800343。
- 22.
Wertman J, Lord CEN, Dauphinee AN, Gunawardena AHLAN:植物叶片程序性细胞死亡过程中细胞拆除的途径。植物学报,2012,32(1):1- 6。10.1186 / 1471-2229-12-115。
- 23.
作者:Lord CEN, Gunawardena AHLAN:环境诱导的马达加斯加植物叶片原生质体的程序性细胞死亡。植物学报,2011,33(3):457 - 457。10.1007 / s00425 - 010 - 1304 - 9。
- 24.
Lord CEN, Wertman JN, Lane S, Gunawardena AHLAN:线粒体在植物程序性细胞死亡过程中重塑叶片中的作用吗?植物学报,2011,(11):1-17。10.1186 / 1471-2229-11-102。
- 25.
Vacca RA, de Pinto MC, Valenti D, Passarella S, Marra E, de Gara L:活性氧的产生、胞质抗坏血酸过氧化物酶的改变和线粒体代谢的损伤是热休克诱导的烟草亮黄2细胞程序性死亡的早期事件。植物生理学报,2004,34(4):1109 - 1109。10.1104 / pp.103.035956。
- 26.
李建军,李建军,李建军,等。梅子果浆中花青素的热降解动力学研究。食品科学与技术,2004,18(2):525-8。10.1007 / s00217 - 004 - 0906 - 5。
- 27.
植物非生物胁迫中的钙信号。中华医学杂志,1999,19(5):379 - 379。10.1016 / s0074 - 7696(08) 62707 - 2。
- 28.
Mansour MMF, Salama KHA:植物耐盐性的细胞基础。环境科学学报,2004,32(2):113- 122。10.1016 / j.envexpbot.2004.01.009。
- 29.
黄春华,黄春华。NaCl对番茄叶片光合色素、糖类和叶绿体超微结构的影响。植物生态学报,2009,35(5):394 - 394。10.1023 /: 1006846504261。
- 30.
张建军,张建军,张建军,等。长期盐胁迫对马铃薯抗氧化防御系统、叶片水分关系和叶绿体超微结构的影响。中国生物医学工程学报,2004,15(5):591 - 592。10.1111 / j.1744-7348.2004.tb00374.x。
- 31.
潘丽娟,李建平,李建平,等。植物耐盐性及盐胁迫效应研究进展。中国生物医学工程学报,2005,31(2):344 - 349。10.1016 / j.ecoenv.2004.06.010。
- 32.
Miura T, Kura-Hotta M, Tsujimura T, Ohnishi M, Miura M, Okazaki Y, Mimura M, Maeshima M, Washitani-Nemoto S:盐胁迫下液泡体积快速增加的响应。植物学报,2003,26(2):397-402。
- 33.
刘艳,熊艳,Bassham DC:植物对干旱和盐胁迫的耐受需要自噬。细胞自噬,2009,5:954-63。10.4161 / auto.5.7.9290。
- 34.
Lang I, Barton DA, Overall RL:质酵解植物细胞的膜壁附着。生物医学工程学报,2004,24(2):391 - 391。10.1007 / s00709 - 004 - 0062 - 6。
- 35.
米特勒R:非生物胁迫,田间环境和胁迫组合。植物科学,2006,11:15-9。10.1016 / j.tplants.2005.11.002。
- 36.
Minina EA, Bozhkov PV, Hofius D:自噬作为细胞死亡的启动者或执行者。植物科学进展,2014,19:692-7。10.1016 / j.tplants.2014.07.007。
致谢
作者非常感谢Jaime Wertman (Dalhousie University药学系)对本ms的批判性审查。作者感谢加拿大国家科学与工程研究委员会(NSERC)和Killam信托基金的博士学位。资助AND。作者也感谢Sarah Lawson研究奖学金(Dalhousie University)对TSW的资助。最后,感谢加拿大创新基金会(CFI)提供的领袖机会基金,以及NSERC为AHLANG提供的发现和设备资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
除了叶鞘组织的所有实验外,还进行了所有的全株实验,并选择了NaCl、酸碱长期成像、视频和图形编辑。TSW进行的实验包括:全热长期成像、NaCl长期成像、选定酸碱长期成像、选定视频和图像编辑。TSW和and撰写了手稿的初稿,and编辑了最终手稿并完成了所有要求的修改。AHLANG构思了这项研究,参与了它的设计和协调,编辑了手稿的修改,并监督了所有的实验工作。所有作者都阅读并批准了最终的手稿。
作者提交的原始图片文件
12870 _2014_389_moesm1_esm.mp4
附加文件1:单个孔内超过30分钟的发育PCD梯度。NPCD阶段细胞(右)在叶片形态发生期间不经历PCD,叶肉中含有花青素色素沉着。EPCD和LPCD阶段的细胞不含花青素。可见几个核,包括核仁。注意与EPCD细胞相比,LPCD细胞的叶绿体数量减少。在EPCD细胞中形成大的聚集体,在LPCD细胞中也很明显。TVS在EPCD细胞中显著增加,但在LPCD细胞中较少发生。大约30播放速度。(mp4 13mb)
12870 _2014_389_moesm3_esm.mp4
附加文件3:在45°C下处理10分钟的NPCD细胞。这种热休克处理的细胞与未处理的NPCD细胞基本相似。核位移可能是由于液泡尺寸的变化。TVS是可见的,并且有标记。没有细胞死亡。大约360倍的播放速度。(mp4 7mb)
12870 _2014_389_moesm4_esm.mp4
附加文件4:NPCD细胞在55°C下处理10分钟。花青素在热休克过程中从底层叶肉细胞中消失。在整个治疗过程中,细胞周围的囊泡形成增加。质质体塌陷和PM从细胞壁缩回同时发生。大约360倍的播放速度。(mp4 2mb)
12870 _2014_389_moesm5_esm.mp4
附加文件5:用100 mM NaCl溶液处理的NPCD细胞。在细胞的中央液泡中形成大的聚集体。TVS在整个治疗过程中增加。叶绿体外观在整个处理过程中发生变化,出现“褶皱”。在整个治疗过程中,PM似乎保持完整,没有发生缩回。没有细胞死亡。大约360倍的播放速度。(mp4 5mb)
12870 _2014_389_moesm6_esm.mp4
附加文件6:用400 mM NaCl溶液处理的NPCD细胞。hchtian链存在于PM和细胞壁之间。注意开始时的酶解细胞。在整个治疗过程中,叶绿体似乎肿胀,看起来“起皱”。细胞死亡时,细胞质塌陷和PM收缩。大约300倍的播放速度。(mp4 6mb)
12870 _2014_389_moesm12_esm.mp4
附加文件12:用1m NaOH溶液处理的NPCD细胞。囊泡的形成增加,随后囊泡融合到中央液泡中,随后囊泡塌陷。在细胞死亡之前,由于NaOH对叶肉中花青素的影响,颜色发生了戏剧性的变化。同时,胞核消失,液泡内出现大量沉淀。注意叶绿体肿胀的外观。没有PM撤回发生。大约2.5倍的播放速度。(mp4 4mb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议,该协议允许以任何媒介或格式使用、共享、改编、分发和复制,只要您适当地注明原作者和来源,提供知识共享许可协议的链接,并注明是否进行了更改。
本文中的图像或其他第三方材料包含在文章的知识共享许可协议中,除非在材料的署名中另有说明。如果材料未包含在文章的知识共享许可中,并且您的预期用途不被法律法规允许或超过允许的用途,您将需要直接获得版权所有者的许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域免责声明(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
Dauphinee, A.N, Warner, T.S.和Gunawardena, A.H.植物诱导和发育细胞死亡形态的比较[j]。Aponogeton madagascariensis树叶)。BMC Plant Biol14日,389(2014)。https://doi.org/10.1186/s12870-014-0389-x
收到了:
接受:
发表:
关键字
- 细胞程序性死亡
- 液泡
- 等离子体膜
- 形态
- 细胞死亡分类
- 发展纤毛运动
- 环境诱发PCD
- 液泡膜
- 活细胞成像
- 自噬