摘要
背景
雄性不育是开花植物的普遍现象,利用杂种优势已在几种作物中成功发展。利用陆地棉空间诱变育种,分离到一个新的光敏雄性不育(PGMS)突变体。为了在棉花杂交种育种中充分利用PGMS系,研究其雄性不育的分子机制具有重要意义。
结果
从花药截面分析可以看出,PGMS花药绒毡层的延迟降解发生在不同的发育阶段。为了深入了解PGMS花粉发育过程中发生的细胞缺陷,我们使用差异蛋白质组学方法研究了突变型和野生型花药在四核、单核和双核花粉阶段的蛋白质谱。该方法鉴定出62个差异表达蛋白点,其中19个与能量和代谢通路有关,7个与花粉管生长有关,5个与蛋白质代谢有关,4个与花粉壁发育有关。其余27个蛋白点被分为其他功能过程,如蛋白质折叠和组装(5个点)和应激防御(4个点)。这些差异表达蛋白显著影响了PGMS突变体花药的花粉发育,导致花粉粒形成异常,这可能是导致其雄性不育的关键原因。
结论
这项工作是第一个使用比较蛋白质组学在可育棉花和PGMS棉花之间识别PGMS相关蛋白的研究。这一结果证明了花药发育过程中存在复杂的代谢网络,并促进了我们对微配子形成的分子机制的理解,为研究雄性不育的分子机制提供了新的思路。
背景
雄性不育现象在超过150种开花植物中广泛存在[1].有两种主要类型的雄性不育植物,表现细胞质雄性不育(CMS)和表现遗传雄性不育(GMS)。由于其在杂种优势利用中的重要作用,关于雄性不育相关性状的报道很多,特别是在水稻中[2] - [4].CMS是一种母体遗传性状,其特征是线粒体能量缺乏、CMS蛋白细胞毒性和绒毡层程序性细胞死亡(PCD) [3.].野生流产不育系(CMSWA)是一个研究得很好的不育系,自20世纪70年代以来在中国被用于生产大多数“三线”水稻杂交种[5].在CMS-WA线WA352,一个新的线粒体基因赋予CMS-WA表型,因为它的蛋白质与核编码的线粒体蛋白COX11相互作用。WA352优先积累在花药绒毡层中,从而抑制COX11在过氧化物代谢中的作用,引发绒毡层过早PCD,从而导致花粉败育[3.].
光敏遗传雄性不育(PGMS)是花粉育性受日长调控的一种特殊类型的GMS,是杂交生产中理想的母本。农垦58S是一种自发发生的突变体粳稻水稻品种农垦58在长日照条件下完全不育,而在短日照条件下其育性从部分到完全不等[6].绒毡层过早退化被认为是导致生育能力变化的主要原因[2]、[7].的碳饥饿花药(csa)突变体,另一种类型的PGMS突变体,在短日照条件下显示雄性不育,但在长日照条件下可生育。CSA对调节水稻花药发育和花粉成熟所需的糖分配具有关键作用[8].因此,在白昼较短的情况下csa突变导致同化物分配减少,导致雄性不育。然而,这个突变在csa长日照条件下的植物,如生育力增加所表明的[4].这些研究对于克服当前杂交稻系统存在的问题具有重要意义,明确水稻的CMS和GMS机制将极大地有利于大规模的作物育种项目[9].
陆地棉(陆地棉小麦是一种重要的经济作物,主要用于生产纺织纤维。它在铃数、铃重和籽棉产量方面具有很强的杂种优势,杂交种子在印度和中国广泛生产[10].利用陆地棉空间诱变育种,我们分离到新的PGMS突变体CCRI9106 (MT),该突变体在长日照条件下雄性不育,在短日照条件下可育,表达绿色标记[11].为了在杂交育种中充分利用PGMS系,研究其分子机制是十分重要的。对MT和野生型(WT)花药的转录组分析表明,在长日照条件下,MT单核花粉(UNPs)中泛素-蛋白酶体系统被诱导。这种诱导很可能引起花粉蛋白的降解,导致雄性不育[11].尽管蛋白质是大多数细胞功能的主要效应器,但由于磷酸化和糖基化等翻译后修饰,在基因组、转录组和细胞过程如何相关方面存在信息缺口[12].因此,为了更好地了解棉花的不育机制,对MT和WT花药进行蛋白质组学研究具有重要意义。
蛋白质组学是阐明基因功能和相互作用的重要工具。该方法已被广泛应用于揭示植物不育花药和可育花药之间蛋白质表达水平的变化,并用于解释植物的不育机制。蛋白质组学技术的应用已经在水稻中发现了几种与雄性不育相关的蛋白质,它们在蛋白质合成、信号转导、细胞死亡和碳水化合物代谢中起作用[13].番茄野生型与野生型的蛋白质组学分析7 b - 1雄性不育突变体的花药显示,在绒毡层退化过程中具有潜在作用的蛋白酶体和5B蛋白在雄性不育突变体中下调。半胱抑素是种子成熟、萌发和PCD中内源性蛋白水解活性的调节因子,在雄性不育突变体中表达上调[14].另一项蛋白质组学分析表明,与碳水化合物和能量代谢、光合作用和类黄酮合成相关的蛋白质,这些蛋白质也可能在花粉发育中起作用,在小麦的CMS花药中均被下调芸苔属植物显著[15].对陆地棉GMS系和可育系花药的差异蛋白质组学研究发现,突变株花药中较低水平的几种碳水化合物代谢和光合作用相关酶胞质抗坏血酸过氧化物酶1和谷氨酰胺trna合成酶可能在花粉发育中发挥重要作用[16].此外,其他蛋白质组学研究已经在雄性不育8囊里的玉米[17),YX-1枸杞雄性不育突变花药[18],以及mes诱导油菜籽雄性不育[19].迄今为止,对男性不育机制的研究取得了很大进展。但据我们所知,目前还没有关于棉花PGMS花药蛋白质组学研究的报道。雄性不育系的研究将促进棉花杂种优势的利用。
本研究采用二维凝胶电泳(2-DE) - MALDI-TOF-MS联用技术,研究了MT和WT花药在三个关键发育阶段的蛋白质谱差异。66个蛋白差异表达点,其中62个经MALDI-TOF-MS鉴定成功。这些蛋白质参与能量和代谢途径、蛋白质代谢、花粉壁发育、花粉管生长等功能过程。比较WT和PGMS花药的蛋白质谱对了解花药和花粉发育具有重要意义,并将为雄性不育研究提供新的思路。
结果
长日照条件下的WT和MT表型
在自然昼长条件下,MT和WT在7月中旬开花。与WT花相比(图1A), MT花较小,花表型异常,花丝较短,花药枯萎(图)1B).此外,MT花药没有开裂,也没有观察到可见的花粉粒(图1)1B)。
为了确定MT和WT的花药是否能产生正常的花粉粒,用镊子表达,并用2%的TTC染色。不同于WT成熟花粉(图1C), MT花粉粒流产,不能被TTC深染,表明它们不能活(图1D).此外,MT植物在自交杂交后不结实,但在与WT异花授粉时结实。与我们之前的研究一致[11基因分析显示,约四分之一的F2后代是不育的,而其余的表现出正常的生育能力,表明不育是由一个单一的隐性等位基因引起的(可育/不育= 144:45;χ2= 0.18 (3:1), P < 0.05)。这些结果表明MT不能产生活花粉,是雄性不育的。
花药发育
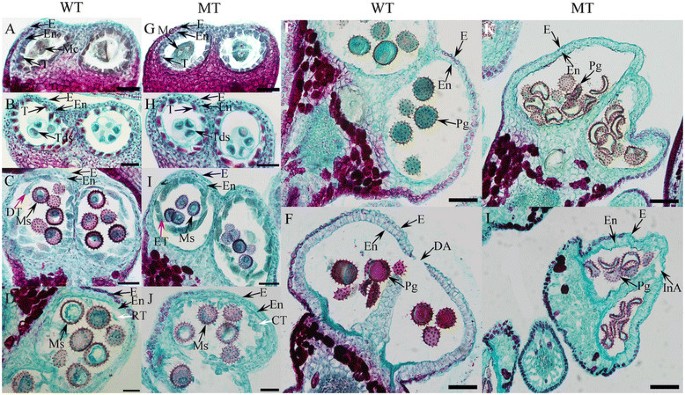
为了更详细地了解MT中花粉发育过程中发生的细胞缺陷,研究人员根据花芽长度对WT和MT的花药样品在不同发育阶段的横断面进行了研究[20.]、[21].在四分体期之前,MT和WT在花药组织中没有观察到细胞学差异。花芽长约3-4毫米,发生减数分裂(图2A,G),从而产生四分体(花芽长约4.5-5 mm),被致密的绒毡层包围(图2B, H)。然后,两株单细胞小孢子释放并扩增。细胞学异常最早出现在UNP早期绒毡层细胞的MT中(花芽长~ 5-5.5 mm)。在这一阶段,小WT中的绒毡层开始退化(图2C),从而为小孢子提供营养,这是小孢子发育所必需的。相比之下,绒毡层在MT中没有退化,似乎有更小的小孢子(图2我)。
野生型(WT)和PGMS突变型(MT)棉花花药的横断面(陆地棉L.)在不同的发展阶段。WT和MT花药的横截面(G)减数分裂阶段(MC),(B、H)TTP阶段,(C I)UNP早期阶段,(J D)UNP后期阶段,(E、K)法国巴黎舞台,(F、L)图示花期。红色的箭头(C I)白色箭头表示WT中退化的绒毡层和MT中完整的绒毡层(J D)表示WT中残留绒毡层,MT中凝结绒毡层(一)来(D)而且(G)来(J)、100 μmE,F,K而且l.E,表皮;恩,内层;Mc,母细胞T,绒毡层;Tds、四联球菌;女士,小孢子;DT,退化毯;等,整个毯;RT,剩余毯;CT,凝聚毯; Pg, pollen grain; DA, dehisced anther; and InA, indehisced anther.
绒毡层继续退化,几乎没有残留在腔室中(图2D) UNP后期(花芽长~ 5.5-6 mm)。这与MT花药中发生的情况完全不同,在MT花药中绒毡层逐渐消失,但大部分仍然存在于同一阶段(图2J).因此,在BNP期(花芽长,WT约10 mm, MT约9 mm), MT花粉粒无法积累贮藏材料,小孢子缺乏细胞质,形状不规则(图1)2相反,WT的小孢子充满细胞质,呈规则的圆形(图2E).在开花期,在WT中,花药内胚层膨胀,花药开裂,释放出成熟的花粉粒2F).与之前的观察一致,MT花药是枯萎的,没有开裂,导致花粉释放失败(图)2L)。
总糖含量测定
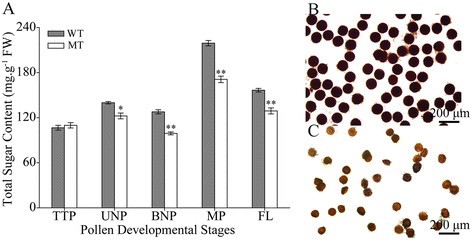
因为MT花粉颗粒中没有形成任何物质(图2L)和改变MT植物碳水化合物代谢途径中的蛋白质表达模式(表2)1),我们推测MT花药在糖积累和淀粉合成方面可能存在缺陷。在WT花药中,总可溶性糖含量从TTP期到UNP期增加,BNP期下降,在成熟花粉期(开花前1天)显著增加,开花时再次下降(图)3.一个额外的文件1).在TTP期,MT花药总可溶性糖含量与WT相比无显著差异;然而,在发育的后期,它明显较低3.一个额外的文件1).此外,WT花粉中淀粉含量丰富,用I染色显示为深色2ki(图3.B).相比之下,MT花粉仅被I轻微染色2ki(图3.C),表明淀粉合成有限。这些结果表明,碳水化合物代谢途径中基因表达模式的改变导致MT花药中总糖积累减少和淀粉合成限制,这可能是导致雄性不育的原因。
野生型(WT)和PGMS突变型(MT)棉花花药可溶性糖含量及花粉粒淀粉染色陆地棉l .)。(一)不同发育阶段总可溶性糖含量。(B, C)淀粉的染色(B)WT和(C)太花粉粒。数据表示三次复制的平均值和标准偏差。* P < 0.05;**P < 0.01经Student 's t检验。确切的值显示在附加文件中1.
蛋白质组学分析
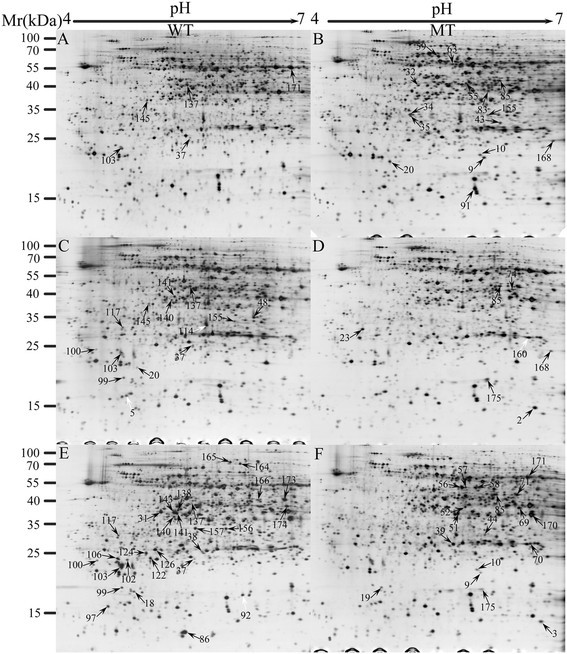
如前所述,MT和WT的异常首先出现在UNP期,而BNP期则完全不同。因此,我们收集了MT和WT花蕾TTP(花芽长,4.5-5 mm)、UNP(花芽长,5.5-6 mm)和BNP(花芽长,WT 10 mm, MT 9 mm)阶段的花药样本,用于蛋白质组学分析,以评估花粉发育。在TTP、UNP和BNP阶段获得MT和WT的多个2-DE凝胶,并以最佳凝胶作为参考图。点对点比较和定量图像分析显示,66种蛋白质的相对丰度在至少一个阶段发生了至少1.5倍的变化(上限和下限分别设置为1.5和0.67)(P < 0.05)2).
在66个变化显著的地点中,有20个出现在TTP地图上,包括5个强度较低的地点和15个强度较高的MT TTP地点(图4)4A, B和桌子1).在UNP地图上确定了23个点,包括15个强度较低的点,1个缺失点,以及MT UNP中7个强度较高的点(图4C, D和表1).最大的差异出现在BNP的地图之间。共识别出46个点,包括24个低强度点、17个高强度点、4个缺失点和1个新点(图1)4E, F和Table1).66个鉴别斑点中,1期检出49个斑点,2期检出13个斑点,3期检出5个斑点。此外,仅在野生型花药BNP期检测到3个斑点(斑点102、斑点122和斑点166),提示这些斑点在花药后期和花粉发育过程中具有重要的功能作用。
差异表达蛋白的鉴定和功能分类
我们能够从制备的考马斯氏染色2-DE凝胶中手动去除所有66个显著不同的点,以进一步通过MALDI-TOF-MS分析进行鉴定。62个蛋白点,代表56个不同的蛋白质,通过搜索我们的cotton_AD_nr数据库(附加文件3.).一些斑点被鉴定为相同的基因产物。例如,两个位点(2和3)被鉴定为富含甘氨酸的rna结合蛋白,两个位点(166和173)被鉴定为果胶酯酶PPME1。
已确定的点列于表中1,包括点数、蛋白ID、蛋白名称、吉祥物评分、覆盖率、理论质量/等电点、Swiss-Prot蛋白ID、平均比值和细胞位置。亚细胞定位分析预测大多数蛋白质(34)将定位到任何其他位置。另外,10个定位于叶绿体,11个定位于分泌途径,7个定位于线粒体1).SDS-PAGE预测的实验Mr和pI与理论值相比误差约15%(表5)1和额外的文件2),表明一些蛋白质似乎是其完整蛋白或翻译后修饰蛋白的部分降解产物。大多数被识别的蛋白质在数据库中都有功能注释;然而,两个蛋白(由19和175点表示)没有功能注释。注释蛋白在功能上被分为7类(表1(1)能量和代谢途径,(2)花粉壁发育,(3)蛋白质代谢,(4)花粉管生长,(5)蛋白质折叠和组装,(6)应激防御和(7)其他功能途径。
与拟南芥花粉蛋白质组
为了更好地了解蛋白质的功能,我们将蛋白质与它们最接近的蛋白质进行了匹配拟南芥同系物和根据它们的预测功能分组(附加文件4).这样,大多数棉花蛋白(56个鉴定蛋白中的50个)可以被分配到一个拟南芥同系物。只有6个接入实现了较差的匹配(E-value > 10−10).这支持了棉花花粉中大部分在花粉发育中起重要作用的蛋白都能被检测到的理论,这些蛋白的表达改变可能导致雄性不育。此外,拟南芥五个点的同源物(点51、83、137、166、174;额外的文件5)已被证实影响花粉发育或花粉管生长。这些蛋白的表达模式发生改变,提示花粉发育受到严重干扰,导致雄性不育。
qRT-PCR验证差异表达
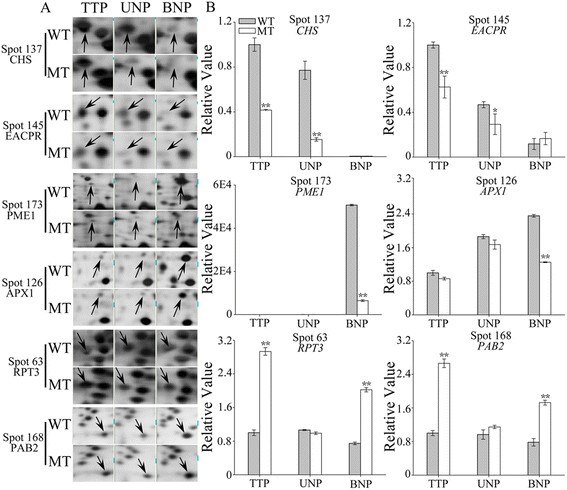
为了验证我们的2-DE结果,并检验蛋白质丰度的差异是否反映在转录水平上,我们用qRT-PCR分析了差异表达蛋白对应的6个编码基因(CHS、EACPR、PME1、APX1、RPT3和PAB2)的mRNA表达水平。在TTP、UNP和BNP三个阶段,CHS和EACPR在WT中的斑点强度都高于MT, PME1和APX1仅在BNP阶段在WT中的斑点强度更高(图)5一个额外的文件6).同时,qRT-PCR结果显示,这4个基因在MT花药中转录表达水平均较低(图5B,额外的文件6).在TTP期和BNP期,RPT3斑点强度及其转录在MT中均表现出较高的表达水平(图5额外的文件6).综合来看,编码这五种蛋白质的基因转录水平显示出类似的趋势。在TTP和UNP阶段,PAB2蛋白斑点在MT中表现出更高的强度(图5一个额外的文件6), TTP期mRNA水平相应升高(图5B,额外的文件6).
野生型(WT)和PGMS突变型(MT)棉花差异表达蛋白斑点的蛋白和mRNA表达水平陆地棉l .)。(一)全蛋白质组中六个蛋白质点的放大视图。(B)相应基因转录本的qRT-PCR分析。将每个基因的mRNA表达值归一化为参考基因18S rRNA的mRNA表达值,然后按照WT的四分体阶段归一化。数据表示三次复制的平均值和标准差。* P < 0.05;根据同阶段值的Student 's t检验,**P < 0.01。确切的值显示在附加文件中6.CHS(斑点137),查尔酮合成酶;EACPR (spot 145),烯酰-[酰基载体蛋白]还原酶;PME1(斑点173),果胶酯酶PPME1;APX1 (spot 126), l-抗坏血酸过氧化物酶1;RPT3(斑点63),26S蛋白酶调节亚基6B和PAB2(斑点168),蛋白酶体β -1型亚基。
然而,PAB2在UNP期和BNP期的转录水平与点对点比较结果不一致,在MT中UNP期无差异,而在MT中BNP期水平升高。此外,APX1在MT花药中转录水平和蛋白质水平的积累模式不同,从UNP期到BNP期蛋白质丰度增加,但转录水平下降(图)5额外的文件6).这并不奇怪,因为许多转录后调节机制可以导致mRNA水平只与蛋白质浓度部分相关。此外,mRNA和蛋白质水平之间在转录物和蛋白质半衰期或按需翻译方面存在差异[22].因此,蛋白质组学分析对于识别负责不同细胞功能的最终产物至关重要。
讨论
通过细胞学和蛋白质组学分析,比较了PGMS、MT和WT花药的发育差异。MT花药在UNP期的绒毡层降解被证实是延迟的。为了进一步了解导致这些发育差异的分子机制,我们进一步分析了MT和WT花药TTP、UNP和BNP阶段的蛋白质组。62个不同表达的蛋白点(代表56个不同的蛋白质)被成功识别。根据所标注的生物学和细胞功能,56个差异表达蛋白可能参与花粉发育过程中的一系列过程,包括能量和代谢途径、花粉壁发育、蛋白质代谢、花粉管生长和其他功能蛋白。这些结果有助于阐明PGMS突变体雄性不育的发生机制。
MT花药中绒毡层的延迟退化
花药的形成是由花药原基中皮下细胞的周鞘分裂开始的。有丝分裂后的最终结构是配子体被一系列细胞层所包围,即绒毡层、中层细胞层、内膜和外表皮[23].这些层,特别是绒毡层,在花粉发育中起着重要作用,如房室液和愈伤酶的产生,以及外质前体的形成[24].花药发育后期通过PCD诱导绒毡层退化,过早或延迟退化导致雄性不育[25]、[26].
在我们的研究中,WT花药的绒毡层在UNP早期就开始退化(图2C),在BNP期几乎没有残留在腔室中(图2D).然而,绒毡层未能在适当的阶段在MT花药中退化(图1)2I),大多数仍停留在UNP后期阶段(图2J).由于MT花药中绒毡层降解延迟,没有足够的营养物质用于正常的小孢子发育。结果导致MT花粉发育异常,导致雄性不育。
拟南芥花粉发育中同源体受到影响
为了找出棉花花粉与拟南芥花粉,我们比较了我们的研究中发现的蛋白质与花粉蛋白质组中的蛋白质拟南芥[27] - [29].56个被识别的蛋白质中有50个可以被分配到一个拟南芥同源,表明蛋白质组高度相似。这种差异可能是由于所使用的样品不同所致。在本研究中,对整个花药进行蛋白质提取和鉴定,而不是对分离的花粉粒进行蛋白质提取和鉴定拟南芥蛋白质组。查尔酮合成酶(CHS,位点137)在MT花药的所有三个阶段均显著下调(见表1).它的拟南芥花粉蛋白组中缺少同源基因AT4G34850 (LAP5和LAP6)。LAP5和LAP6是雄性器官特异性成员,在花药中表达与外壁形成时间一致[30.].
在拟南芥许多突变体被描述为影响花粉发育和花粉管生长。Till Ischebeck等人总共调查了215个基因。31].从这些点中,我们发现了五个有同源物的点(e值等于或小于10)−10)在我们的书房。虽然这些基因在棉花花药中的作用尚未被讨论,但它们的高度相似性表明它们具有保守的功能。其表达模式的改变导致MT花药花粉发育异常,导致雄性不育。然而,在56个确定的蛋白质中,迄今为止只有5个同源蛋白被描述拟南芥突变体研究,为未来花粉研究留下了巨大的空间。
能量和代谢过程
在高等植物中,雄性配子体的发育是一个精心规划的过程[32,这可能需要更多的基因表达。例如,与其他器官相比,在棉花花药中检测到的表达基因超过2万个[33].为了完成这个复杂的过程,许多蛋白质与花药发育中的能量和代谢有关。它已经被很好地研究了拟南芥.例如,在成熟花粉的2-DE参考蛋白组图上识别的蛋白质拟南芥,约40%预测在代谢和能量产生的功能[27]、[28].除了这些基于2-DE的蛋白质组学分析,代谢和能量功能类别也在霰弹枪蛋白质组学中过度代表拟南芥花粉(29].此外,烟草花粉发育早期到晚期的蛋白质组分析表明,参与初级代谢和淀粉合成的蛋白质是花粉管生长所必需的[31].这说明能量和代谢过程是花粉中最主要的过程。这些过程中的蛋白质表达紊乱可能导致男性不育[16]、[19].在本研究中,确定的62个斑点中约31%(19个)与能量和代谢有关(表1).它们的上调或下调可能导致MT花药发育异常。
具体来说,这里确定的两个蛋白质在碳水化合物代谢中具有功能(点38代表三磷酸异构酶,点164和165代表半乳糖氧化酶),两个在能量生成中(点18代表ATP合成酶,点48和99代表NADH脱氢酶),其他的参与代谢过程。花药作为最高的库,需要获得大量的糖来支持其早期的发育,而在后期花粉成熟需要积累淀粉,淀粉是萌发的能量储备,因此是花粉成熟的标志[8].研究表明,棉花GMS突变体花药在减数分裂和UNP阶段,碳代谢和能量代谢基因表达的改变导致总可溶性糖含量的降低[33].在本研究中,由于碳水化合物代谢相关基因表达水平的改变,在发育后期MT花药中糖的积累显著减少(图3.A)和在MT成熟花粉粒中有限的淀粉合成(图3.C).正如所料,WT成熟花粉粒(图2F)储存了许多物质(如多糖、蛋白质、脂类和激素),这些物质对成功萌发和管生长的能量和碳储备有很高的要求[19].但是MT花粉粒从UNP后期开始几乎是空的(图2J).在花药发育过程中,对呼吸功能和ATP形式的细胞能量的需求增加。ATP合成缺陷可导致花药发育异常,花粉无功能[16]、[34].在本研究中,MT花药中产生能量的两个蛋白(18号点代表ATP合酶,48号点和99号点代表NADH脱氢酶)显著减少,表明MT花药处于能量匮乏状态。
这些结果表明,MT花粉粒中碳水化合物代谢和能量萌发的基因表达紊乱导致总糖积累减少,淀粉和其他物质合成缺乏,从而为加深我们对雄性不育的认识提供了重要信息。
花粉壁的发展
花粉壁由若干层组成:外层外壁、外层雕花层(或称sexine)和内内壁。外膜主要由孢粉素组成,孢粉素主要由绒毡层合成,是一种脂肪族聚合物,由一系列来自长链脂肪酸、苯丙素和含氧芳香环的聚合物组成[24].它的主要作用是为小孢子细胞质提供结构和物理支持,并保护小孢子免受恶劣条件的伤害,如长时间干燥、高温和紫外线。它还通过吸引更喜欢精致花粉外壁的媒介来促进授粉[24].在拟南芥,孢子花粉素形成缺陷可导致男性不育[23].在本研究中,我们发现了4个参与孢粉素形成的蛋白,分别以位点137、140、141和145为代表,在MT花药中存在差异表达(图4).
查尔酮合成酶(CHS, spot 137),是所有类黄酮生物合成的第一个参与酶,对花粉发育和孢粉素的生物合成至关重要[35],在MT花药发育的所有三个阶段均显著减少。在拟南芥,LAP5而且LAP6编码与CHS同源的花药特异性蛋白,可能在花粉外壁脂肪酸和酚类物质的合成中起作用。这两种基因中的任何一种突变都会导致异常的外壁模式lap5 lap6双突变体产生缺乏外壁的花粉粒,导致强烈的雄性不育[30.].
以140、141和145为代表的属于脂肪酸合成途径的蛋白在MT中也显著减少。脂肪酸是孢粉素的重要组成部分。脂肪酸合成中的突变可导致花粉壁形成受损[36].烯酰基[酰基载体蛋白]还原酶(EACPR, spot 145)是脂肪酸合成酶复合体的一个亚基,催化脂肪酸的从头合成。这种基因的功能减弱的突变拟南芥,马赛克death1(mod1),导致其酶活性显著下降,损害脂肪酸的生物合成,减少总脂类的数量[37].
丙酮酸脱氢酶E1组分β亚基(PDH E1- b,斑点140和141)是合成孢粉素前体所必需的。乙酰辅酶a由丙酮酸通过线粒体中的PDH复合体形成,释放的乙酰辅酶a是质体中从头合成脂肪酸的底物[24].PDH_E1α-1在花药绒毡层中的反义抑制足以引起雄性不育,这是一种甜菜不育的表型[38].MT花药中相对较少的孢粉素形成相关蛋白可能导致雄性不育。因为脂肪酸是孢粉素的可能成分,它有助于形成保护性花粉衣[24],这些蛋白的减少可能导致MT中花粉衣层的异常形成。MT花粉形状不规则(图1K),这可能是由于不正常的孢粉素形成。为了揭示花粉壁的详细变化,我们将在高分辨率显微镜下进一步研究花粉壁的结构。
蛋白质代谢
花药作为非光合作用的雄性生殖器官,需要从源器官中获取营养物质来支持花粉的发育和成熟,而蛋白质和氨基酸是花粉细胞质的重要组成部分[11]、[39].蛋白酶体是真核生物中重要的蛋白酶,调节许多细胞过程,包括代谢、细胞周期和调节蛋白的蛋白水解。番茄中蛋白酶体相关酶表达水平的改变7 b - 1花药可能影响小孢子母细胞的减数分裂[14].在我们之前的研究中[11],几个与泛素-蛋白酶体系统相关的基因在UNP期MT花药中上调。因此,在长日条件下,在UNP阶段的MT中诱导泛素-蛋白酶体系统,并可能导致蛋白质降解。在蛋白质和氨基酸水平不足的情况下,MT花粉粒的细胞质很可能逐渐分解,花粉粒很可能失去活力,导致雄性不育[11].
在本研究中,蛋白水解酶α型蛋白酶体亚基-2- b(斑点39),蛋白酶体β型蛋白酶亚基-1(斑点168)和26S蛋白酶亚基6B同源物(斑点63)(图)43-异丙基苹果酸脱水酶小亚基(位点37和155)在MT花药中表达下调。这些变化可能会导致MT花粉粒中蛋白质和氨基酸水平的降低,尽管这种影响的确切机制还不清楚。与之前的研究一致,诱导MT花粉中细胞质蛋白的降解可能是其雄性不育的另一个原因。
花粉管生长
花粉萌发与花粉管生长是开花植物繁殖的重要过程。花粉管的壁由一层果胶组成,果胶甲基酯酶(PMEs)可能在花粉管的生长和花粉管形态的决定中起着中心作用[40].PMEs在几种植物花粉管生长和花粉萌发中的作用已经得到了很好的研究。AtPPME1是花粉特异性基因,其蛋白只存在于成熟的花粉粒和生长中的花粉管中。花粉管在体外萌发和培养后atppme1突变体花粉粒具有弯曲、不规则的形态,并严重发育不良[41].
在植物中,PME活性由特异性PME抑制剂蛋白(PMEIs)的差异表达或翻译后修饰调节[42].有研究表明,AtPMEI2只在花粉管顶端积累,通过局部抑制PME活性调节花粉管壁的稳定性[43].此外,异位表达的aBoPMEI1反义基因拟南芥抑制其同源基因的表达,At1g10770,导致花粉管生长迟缓,雄性部分不育,结实率降低[44].
LAT52也是花粉发育所必需的,因为花粉粒表达反义LAT52RNA水合物和发芽异常,无法受精[45].有趣的是,在这个分析中所有三个相关的蛋白质(用PME的166和173点表示;PMEI的103、138和143位点和LAT52的102和122位点)在我们的MT花药图中表达量较低,而在WT图中表达量极高,尤其是在BNP期(图)4).我们认为这一变化可能减少了花粉管生长所需花粉成分的积累,导致花粉成熟后无法萌发,导致花粉粒无法存活。
其他功能的蛋白质
剩下的27种蛋白质可以被分类为其他不同的功能类别(见表1).它们在花药发育中也有重要作用,包括5个与蛋白质折叠和组装相关的蛋白质。23.6 kda热休克蛋白(HSP;20号位点、17.3-kDa的HSP(91号位点)、59号位点的蛋白二硫异构酶和71号位点的伸长因子Tu均上调;而HSP70(124号位点)表达下调。这些蛋白质已经得到了很好的研究,它们负责蛋白质的折叠和组装[46].在本研究中,HSPs的不同表达水平暗示了MT花药中蛋白质折叠和组装发生了改变,提示了蛋白质翻译和翻译后修饰的变化,这可能导致了花药发育异常。
应激防御相关蛋白形成了另一个功能类别,包括l -抗坏血酸过氧化物酶(APX;126年,图4)和醛脱氢酶(ALDH;这些蛋白在陆地棉花药发育过程中对活性氧损伤的解毒作用非常重要[21].因此,这些蛋白在MT花药中的差异表达可能导致氧化还原过程的不平衡,这可能在花药和花粉发育中发挥重要作用[18]、[21].此外,其他表达水平显著改变的蛋白质也可能影响花药和花粉的发育。这些蛋白质的功能有待进一步研究。
结论
雄性不育是开花植物的普遍现象。采用空间诱变育种的方法,开发并鉴定了一个新的PGMS突变系。MT植株的花药发生了延迟绒毡层降解。为了更好地了解花粉发育过程中发生的细胞缺陷,采用比较蛋白质组学方法,在PGMS和WT花药的三个发育阶段中鉴定出62个差异表达蛋白点。这些蛋白参与能量和代谢途径、蛋白质代谢、花粉壁发育、花粉管生长等功能过程。这些蛋白的差异表达可能强烈干扰MT花药中的花粉发育,导致花粉粒形成异常,这可能是导致不育的关键原因。
绒毡层降解延迟可能导致小孢子成熟的营养供应不足。导致花粉壁发育异常,无法积累花粉管生长所需的花粉成分。最后,在MT花药中形成了不可活的花粉粒。我们的研究结果可能与花药和花粉发育的许多生物学过程有关,并为深入了解高等植物光敏雄性不育背后的机制提供了依据。
方法
植物生长和花药收集
两个g .分子本研究采用L.基因型,PGMS突变株CCRI9106及其WT系CCRI040029。CCRI040029是我实验室选育的优良山地品种,突变系CCRI9106于2010年通过空间诱变鉴定[11].从4月到10月,它们在中国河南安阳的一块农作地里种植。每个基因型制备30行(长8 m ×宽0.8 m),每10行形成1个重复。
正如我们之前的研究[21],在花期观察不同长度的花蕾,以确定花粉发育阶段,每隔一天采集花药。将每个花芽的花粉粒排出,溶解在混合酸(铬酸/硝酸/盐酸,15/10/5,v/v/v)中,然后用2%碘-碘化钾(I2-KI)或2% 2,3,5-三苯基四唑氯化盐(TTC)。然后用奥林巴斯DP72光学显微镜对它们进行了拍摄。为了观察花药的横截面,花药被固定在福尔马林-乙酰醇(FAA)中,并在乙醇系列中脱水。然后将样本嵌入石蜡中。纵向切片用徕卡RM2265超显微切片切割,用快速绿色反染色的藏红花染色,用奥林巴斯DP72光学显微镜拍照。
此外,在四分体花粉(TTP)期、早期和晚期、双核花粉(BNP)、成熟花粉和开花期收集MT和WT的花药进行进一步分析。收集的花药立即在FAA中固定进行横切或在液氮中冷冻,并在- 80°C保存,直到进行蛋白质、总糖和mRNA提取。
蛋白质的提取和定量
选择tca -丙酮法提取花药蛋白[47].按照Pang等人的方法进行蛋白质提取,但进行了少量修改[48].简单地说,约1.5 g冷冻花药用10%聚氯乙烯聚吡咯烷酮(w/w)在液氮中研磨,使用研钵和杵。将得到的细粉与10% (w/v)三氯乙酸在含0.07% (w/v) 2-巯基乙醇的冷丙酮中混合至少2 h,然后在4℃下以12000 g离心1 h。先用含有0.07% (w/v) 2-巯基乙醇的冷丙酮洗涤球团,然后用80%冷丙酮洗涤球团,最后悬浮在裂解缓冲液(7 M尿素,2 M硫脲,4% CHAPS, 20 mM二硫苏糖醇,2%无edta蛋白酶抑制剂)中。上清液在4°C下12万g离心90分钟,用于进一步测定。以牛血清白蛋白为标准,用2-D定量试剂盒(GE Healthcare)测定蛋白溶液浓度。上清液保存在−80°C直到需要。
二维凝胶电泳
二维凝胶电泳(2-DE)如下所示。每个阶段准备两个技术重复和三个生物重复(即每个样品至少6个凝胶)。花药总蛋白为150 μg或1.5 mg,用银或考马斯亮蓝(考马斯亮蓝R-350;GE Healthcare)的凝胶。IPGphor系统(GE医疗)进行等电聚焦。固定化pH 4- 7和24cm线性干带(GE Healthcare)在30 V运行8小时,50 V运行4小时,100 V运行1小时,300 V运行1小时,500 V运行1小时,1000 V运行1小时,8000 V运行12小时,使用补液缓冲液(8 M尿素,2% CHAPS, 20 mM DTT)含有0.5% (V / V) IPG缓冲液(GE Healthcare)。在Ettan DALTsix电泳单元230 (GE Healthcare)中,使用12.5%聚丙烯酰胺凝胶进行二次元SDS-PAGE,不使用堆叠凝胶。银染色时,凝胶用0.25% (w/v)硝酸银染色,0.004% (v/v)甲醛在2.6% (w/v)碳酸钠中显色。对于CBB染色,凝胶用0.04% (w/v) PhastGel Blue R(考马斯亮蓝R-350;GE Healthcare)在10%醋酸中浸泡,用10%醋酸测定。 Silver-stained gels were immediately scanned at a resolution of 300 dots per inch using a PowerLook 2100XL (UMAX) and analyzed using ImageMaster platinum 6.0. The relative volume (% volume) was used to quantify and compare the spots. Spots with significant changes, at least 1.5-fold up- or down-regulated at P < 0.05 (Additional file1),手动从cbb染色凝胶中切除。
MALDI-TOF-MS和数据库搜索
用Bruker UltrafleXtreme MALDI-TOF/TOF质谱仪对切除的蛋白斑点进行分析。单同位素峰质量范围为500 ~ 3500 Da。5个最强烈的离子信号被选为MS/MS采集的前体。基于肽质量指纹图谱结果和MALDI-TOF/TOF-MS分析,使用Mascot 2.3.02软件(Matrix Science, Boston, MA, USA)对我们的cotton_AD_nr数据库使用默认参数进行蛋白质识别的序列相似性搜索。该数据库包含38,460个序列Gossypium raimondii就基因组(49和43,097名来自木本棉基因组(50的D亚基因组和A亚基因组的假定贡献者g .分子广告的基因组。如果没有显著的匹配,则在UniProt viridiplantae数据库(http://www.uniprot.org/, Release 2012_12),报道了评分最高的蛋白质。搜索变量设置如下:一个胰蛋白酶裂解缺失,氨基甲基半胱氨酸残基为固定修饰,蛋氨酸氧化为变量修饰,肽质量容差为100 ppm,片段离子质量容差为0.4 Da。
蛋白质的功能分类
差异表达蛋白用KEGG自动注释服务器(KAAS)进行功能分类,http://www.genome.jp/tools/kaas/)使用默认参数[51].然后,根据预测的生物功能将它们分为不同的类别。使用TargetP 1.1 Server (TargetP,http://www.cbs.dtu.dk/services/TargetP/)使用默认设置[52].比较与拟南芥花粉蛋白质组(3517个蛋白质来自拟南芥花粉蛋白质组)[27] - [29,这项研究中所有的蛋白质都是最接近的拟南芥e值≤10−10.
实时定量PCR (qRT-PCR)
根据制造商的协议,使用pBiozol总RNA提取试剂(BioFlux)从花药样品中提取总RNA。使用SuperScriptIII逆转录酶(Invitrogen, USA)按照其协议进行逆转录反应。在ABI 7500实时PCR系统(Applied Biosystems, USA)上使用SYBR Green PCR Master Mix(德国罗氏应用科学公司)进行反应,重复3次。反应体积为25 μL,包含12.5 μL SYBR Green PCR Master Mix和9.5 μL去离子H2O, 1 μL引物和2 μL cDNA。扩增反应由预变性步骤(95°C 10分钟)开始,随后变性(95°C 10秒)、退火(60°C 35秒)和延伸(72°C 35秒)40个循环。数据处理采用2-△△Ct方法,采用18S rRNA作为内源性内参基因进行数据归一化,然后针对WT的TTP进行归一化。qRT-PCR的引物对是根据我们花药cDNA文库中表达的序列标签序列设计的[21].将鉴定出的蛋白序列与cDNA文库进行裂解,选择最佳片段进行引物设计和qRT-PCR。相应的序列和引物见附加文件7.
总糖含量测定
采收花药,在−80°C冷冻。样品在液氮中用研钵和研杵磨成细粉。在装有1g花药组织的玻璃管中加入20毫升水。试管在100°C下孵育10分钟,然后在2500 g下离心5分钟。制备含葡萄糖、果糖或半乳糖的2ml溶液。A 200 μg·mL−1以葡萄糖溶液为标准进行优化。采用蒽酮比色法测定WT和MT雄性不育花药的总糖含量[33].
支持数据的可用性
支持本文结果的数据集包含在本文及其附加文件中。
附加文件
缩写
- 二:
-
二维凝胶Electrophor
- 法国巴黎:
-
双核花粉
- CMS:
-
细胞质雄性不育
- 客服人员:
-
碳饥饿花药
- 总经理:
-
基因雄性不育
- MALDI-TOF-MS:
-
基质辅助激光解吸/电离飞行时间质谱分析
- 纤毛运动:
-
程序性细胞死亡
- 铂族金属:
-
光敏基因雄性不育
- PMC:
-
花粉母细胞
- 存在:
-
定量实时聚合酶链反应
- 柠檬酸:
-
三氯乙酸
- TTC):
-
2、3、氯化作用
- TTP:
-
四个花粉
- UNP:
-
单核的花粉
参考文献
- 1.
Kaul ML:高等植物雄性不育:Springer-Verlag,柏林,德国;1988.
- 2.
丁军,陆强,欧阳勇,毛辉,张萍,姚娟,徐超,李旭,肖军,张强:一种长链非编码RNA调控杂交水稻光周期敏感雄性不育。中国生物医学工程学报,2011,29(6):369 - 369。10.1073 / pnas.1121374109。
- 3.
罗德平,徐辉,刘志林,郭建新,李红艳,陈丽婷,方超,张秋艳,白梅,姚楠,吴红,金春华,郑红强,陈艳玲,叶松,李旭云,赵旭春,李仁强,刘永刚:一种有害的线粒体-核相互作用引起水稻细胞质雄性不育。中国生物技术学报,2012,45(5):573-8。10.1038 / ng.2570。
- 4.
张辉,徐超,何勇,宗杰,杨旭,司华,孙铮,胡娟,梁伟,张东:CSA突变创造了一种新的适用于杂交稻制种的光周期敏感核不育系。中国生物医学工程学报,2013,29(1):381 - 381。10.1073 / pnas.1213041110。
- 5.
吕世成,杨龙平:杂交水稻育种在中国的应用。水稻育种的创新方法:1979年国际水稻研究会议的论文选集,菲律宾洛斯巴诺斯国际水稻研究所,1980,35-51。
- 6.
石勇,赵松,姚静:绒毡层过早退化:水稻光周期敏感核雄性不育花粉发育失败的主要原因。植物生物学杂志,2009,51(8):774-81。10.1111 / j.1744-7909.2009.00849.x。
- 7.
细胞工程学报,2012,22(4):649-60。10.1038 / cr.2012.28。
- 8.
张慧,梁伟,杨旭,罗旭,蒋宁,马红,张丹:碳饥饿花药编码调控水稻花粉发育所需糖分配的MYB结构域蛋白。植物细胞学报,2010,22 (3):18-10.1105/tpc.109.073668。
- 9.
李松,杨东,朱燕:杂交水稻雄性不育的鉴定及其在育种中的应用。植物工程学报,2007,26(6):791-804。10.1111 / j.1744-7909.2007.00513.x。
- 10.
朱伟,刘坤,王晓东:秋葵叶取向杂交棉产量、纤维品质和光合作用的杂种优势。植物生态学报,2008,32(1):369 - 369。10.1007 / s10681 - 008 - 9732 - 3。
- 11.
马军,魏华,刘军,宋明,庞超,王磊,张伟,范松,于松:陆地棉光敏雄性不育系的选育与鉴定。植物生物学杂志,2013,55(7):608-18。10.1111 / jipb.12067。
- 12.
Deeba F, Pandey AK, Ranjan S, Mishra A, Singh R, Sharma YK, Shirke PA, Pandey V:棉花的生理和蛋白质组学反应(草本棉L.)对干旱胁迫的影响。植物生理与生物化学,2012,53:6-18。10.1016 / j.plaphy.2012.01.002。
- 13.
刘刚,田宏,黄永强,胡娟,季永霞,李淑琴,冯永强,郭玲,朱永刚:红莲(HL)型细胞质雄性不育水稻线粒体蛋白组装和茉莉酸生物合成途径的改变。中国生物医学工程学报,2012,29(6):891 - 891。10.1074 / jbc.M112.382549。
- 14.
Sheoran IS, Ross ARS, Olson DJH, Sawhney VK:番茄野生型和7B-1雄性不育突变体花药中蛋白质的差异表达:蛋白质组学分析。蛋白质组学学报,2009,71(6):624-36。10.1016 / j.jprot.2008.10.006。
- 15.
Sheoran IS, Sawhney VK:对甘蓝型油菜(Brassica napus)正常和Ogura (ogu) CMS花药进行蛋白质组学分析,以鉴定与雄性不育相关的蛋白质。植物学杂志,2010,38(3):378 - 378。10.1139 / b09 - 085。
- 16.
岳健,任勇,吴松,张旭,王宏,唐超:陆地棉雄性不育系和可育系花药的差异蛋白质组学研究。基因基因组学,2014,36(4):415-26。10.1007 / s13258 - 014 - 0176 - y。
- 17.
王丹,Adams CM, Fernandes JF, Egger RL, Walbot V:玉米可育和雄性不育8个花药的低分子蛋白质组比较。植物生态学报,2012,10(8):925-35。10.1111 / j.1467-7652.2012.00721.x。
- 18.
郑锐,岳森,徐旭,刘静,徐强,王旭,韩磊,于冬:野生植物的蛋白质组学分析YX-1枸杞雄性不育突变花药(枸杞l .)。科学通报,2012,7 (7):e4181 -10.1371/journal. 0041861。
- 19.
程艳,王强,李铮,崔健,胡珊,赵红,陈明:化学杂交剂单硫酯钠诱导甘蓝型油菜雄性不育的细胞学和比较蛋白质组学分析。《公共科学图书馆•综合》2013年,8 (11):e8019。
- 20.
闵亮,李媛媛,胡强,朱丽峰,高文华,吴玉玲,丁艳红,刘明明,杨晓燕,张晓玲:棉花花药发育过程中糖和生长素信号通路对高温胁迫的响应。植物生理学报,2014,29(3):369 - 369。10.1104 / pp.113.232314。
- 21.
马军,魏华,宋明,庞超,刘军,王亮,张军,范晟,于松:转录组分析表明,黄酮类化合物和抗坏血酸-谷胱甘肽循环在陆地棉花药发育过程中起重要作用。科学通报,2012,7 (11):e49244-10.1371/journal. 0049244。
- 22.
李艳娟,张晓燕,王凤霞,杨春林,刘芳,夏国祥,孙娟:比较蛋白质组学分析为棕色纤维色素的生物合成提供了新的思路。中国生物医学工程学报,2013,38(4):378 - 388。10.1016 / j.jprot.2012.10.005。
- 23.
Wilson ZA,张d - b:从拟南芥到水稻:花粉发育的途径。中国生物医学工程学报,2009,32(5):369 - 369。10.1093 / jxb / erp095。
- 24.
王晓燕,王晓燕,王晓燕:孢粉素合成与花粉外壁发育的遗传调控。植物学报,2011,32(4):437-60。10.1146 / annurev - arplant - 042809 - 112312。
- 25.
拟南芥绒毡层PCD和花粉壁发育的变化ms1突变体。中国生物医学工程学报,2006,29(4):369 - 369。10.1093 / jxb / erl032。
- 26.
李鑫,高鑫,李伟,欧阳阳,陈刚,李鑫,齐发,吴超:水稻凋亡抑制因子5偶联两种DEAD-Box腺苷5’-三磷酸依赖RNA解旋酶调控绒膜退化。植物细胞学报,2011,23(4):1416-34。10.1105 / tpc.110.082636。
- 27.
Holmes-Davis R, Tanaka CK, Vensel WH, Hurkman WJ, McCormick S:拟南芥成熟花粉的蛋白质组学定位。蛋白质组学,2005,5(18):4864-84。10.1002 / pmic.200402011。
- 28.
黑尔S, Bräutigam A,科尔比T,施密特J,潘斯特鲁加R:参考地图拟南芥成熟花粉蛋白质组。生物化学与工程学报,2004,25(4):357 - 366。10.1016 / j.bbrc.2005.09.185。
- 29.
Grobei MA, Qeli E, Brunner E, Rehrauer H, Zhang R, Roschitzki B, Basler K, Ahrens CH, Grossniklaus U:鸟枪蛋白质组学数据的确定性蛋白质推理为拟南芥花粉发育和功能提供了新的见解。基因组学报,2009,19(10):1786-800。10.1101 / gr.089060.108。
- 30.
Dobritsa AA, Lei Z, Nishikawa S-i, Urbanczyk-Wochniak E, Huhman DV, Preuss D, Sumner LW: LAP5和LAP6编码与拟南芥花粉外壁发育所需查尔酮合成酶相似的花药特异性蛋白。植物生理学报,2010,32(3):369 - 371。10.1104 / pp.110.157446。
- 31.
Ischebeck T, Valledor L, Lyon D, Gingl S, Nagler M, Meijon M, Egelhofer V, Weckwerth W:从二倍体小孢子细胞到花粉管生长的花粉发育早期和晚期的细胞特异性蛋白综合分析。分子蛋白质组学,2014,13(1):295-310。10.1074 / mcp.M113.028100。
- 32.
Goldberg RB, Beals TP, Sanders PM:花药发展:基本原理和实际应用。植物生态学报,2004,25(5):369 - 369。10.1105 / tpc.5.10.1217。
- 33.
魏敏,宋敏,范珊珊,于珊:基因表达谱分析在遗传雄性不育和野生型棉花花药发育过程中差异表达基因的转录组学分析。中国生物医学工程学报,2013,14(1):97-10.1186/1471-2164-14-97。
- 34.
林珂,陈晓燕,陈晓燕。线粒体对花和花粉发育的影响。中国生物医学工程学报,2005,5(6):389-402。10.1016 / j.mito.2005.10.001。
- 35.
黄酮:旧分子的新作用。植物工程学报,2010,42(1):1 - 6。10.1111 / j.1744-7909.2010.00905.x。
- 36.
Dobritsa AA、Shrestha J、Morant M、Pinot F、Matsuno M、Swanson R、Møller BL、Preuss D: CYP704B1是一种长链脂肪酸ω-羟化酶是拟南芥花粉中合成孢粉素所必需的酶。植物生理学报,2009,29(2):369 - 369。10.1104 / pp.109.144469。
- 37.
牟铮,何莹,戴莹,刘旭,李娟:脂肪酸合成酶缺乏导致植物细胞过早死亡和形态发生显著变化。植物生态学报,2000,12(3):405-17。10.1105 / tpc.12.3.405。
- 38.
Yui R, Iketani S, Mikami T, Kubo T:花药绒膜线粒体丙酮酸脱氢酶E1α亚基反义抑制引起雄性不育。植物学报,2003,34(1):57-66。10.1046 / j.1365 - 313 x.2003.01704.x。
- 39.
高兹M,戈特DE, guvarc 'h A, Kahmann U, Chriqui D, Roitsch T:碳水化合物代谢工程诱导植物雄性不育。中国生物医学工程学报,2001,29(4):369 - 369。10.1073 / pnas.091097998。
- 40.
Bosch M,张AY, Hepler PK:果胶甲基酯酶,调控花粉管生长。植物生理学报,2004,24(3):334- 334。10.1104 / pp.105.059865。
- 41.
田广伟,陈明辉,Zaltsman A, Citovsky V:参与花粉管生长的花粉特异性果胶甲基酯酶。中国生物医学工程学报,2006,29(4):369 - 369。10.1016 / j.ydbio.2006.02.026。
- 42.
果胶甲基酯酶:在植物生理中起重要作用的细胞壁酶。植物动态,2001,6(9):414-9。10.1016 / s1360 - 1385(01) 02045 - 3。
- 43.
Röckel N, Wolf S, Kost B, Rausch T, Greiner S:花粉管尖细胞壁PME和PMEI的精细空间格局涉及PMEI内吞作用,反映了果胶酯化和去酯化的分布。植物学报,2008,32(4):369 - 369。10.1111 / j.1365 - 313 x.2007.03325.x。
- 44.
张光光,冯娟,吴娟,王晓伟:花粉特异性果胶甲基酯酶抑制剂BoPMEI1在花粉管生长中起重要作用。植物学报,2010,31(6):1323-34。10.1007 / s00425 - 010 - 1136 - 7。
- 45.
Muschietti J, Dircks L, Vancanneyt G, McCormick S: LAT52蛋白在番茄花粉发育中起着至关重要的作用:表达反义LAT52 RNA的花粉会异常水合和发芽,无法受精。植物学报,1998,6(3):381 - 381。10.1046 / j.1365 - 313 x.1994.06030321.x。
- 46.
李斌,何亮,郭松,李娟,杨勇,闫斌,孙娟,李娟:蛋白质组学揭示了黄瓜在正常条件和盐胁迫下的spd响应。植物生理与生物化学,2013,37(4):447 - 447。10.1016 / j.plaphy.2013.02.016。
- 47.
Sheoran IS, Ross ARS, Olson DJH, Sawhney VK:蛋白质组分析中植物蛋白质提取方法与质谱的相容性。植物生态学报,2009,26(1):489 - 489。10.1016 / j.plantsci.2008.09.015。
- 48.
庞春燕,王辉,庞颖,徐超,焦莹,秦艳梅,西TL,于树新,朱艳霞:比较蛋白质组学研究表明,果胶前体的生物合成对棉花纤维和拟南芥根毛伸长具有重要作用。分子细胞蛋白质组学,2010,9(9):2019-33。10.1074 / mcp.M110.000349。
- 49.
王克波、王志伟、李凤光、叶伟伟、王建勇、宋国良、岳铮、丛琳、尚红红、朱淑玲、邹春生、李强、袁艳丽、卢春荣、魏红亮、苟晨宇、郑志强、尹莹、张晓燕、刘凯、王波、宋春、石宁、Kohel RJ、Percy RG、于建忠、朱艳霞、王俊、于淑欣:棉棉二倍体基因组的草拟。植物学报,2012,44(10):1098-103。10.1038 / ng.2371。
- 50.
李芳,范刚,王凯,孙芳,袁颖,宋刚,李强,马铮,陆春,邹春:栽培棉棉树基因组序列。中国生物技术学报,2014,46(6):567-72。10.1038 / ng.2987。
- 51.
Moriya Y, Itoh M, Okuda S, Yoshizawa AC, Kanehisa M: KAAS:自动基因组注释和通路重建服务器。核酸学报,2007,35(增刊2):W182-5。10.1093 / nar / gkm321。
- 52.
Emanuelsson O, Brunak S, von Heijne G, Nielsen H:使用TargetP, SignalP和相关工具在细胞中定位蛋白质。通信学报,2007,2(4):953-71。10.1038 / nprot.2007.131。
确认
国家高技术研究与发展计划项目(2011AA10A102)资助。该研究在中国农业科学院棉花研究所棉花生物学国家重点实验室进行。感谢河南师范大学生命科学学院马建辉博士和中国农业科学院植物保护研究所Evans Ondati教授的专业建议。作者也感谢BIOMEDITOR (http://www.biomeditor.com)征求他们对改进稿件的有益意见。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
SY和SF构思并设计了实验。JL和CP进行了实验。YM, HW和MS分析了数据。JL撰写并修改了手稿。所有作者阅读并批准了最终稿件。
电子辅料
野生型(WT)和PGMS突变型(MT)棉花花药总可溶性糖含量
额外的文件1:陆地棉l .)。(XLSX 12 KB)
12870 _2014_390_moesm2_esm.xlsx
附加文件2:野生型(WT)之间的相对体积(%体积)和显著变化斑点的比例。(XLSX 29 KB)
棉花花药与花药的比较
额外的文件4:拟南芥花粉的蛋白质。(XLSX 19 KB)
最亲密的
额外的文件5:拟南芥影响花粉发育或花粉管生长的基因。(XLSX 15 KB)
野生型(WT)和PGMS突变型(MT)棉花差异表达蛋白斑点蛋白和mRNA表达水平的比较
额外的文件6:陆地棉l .)。(XLSX 12 KB)
权利和权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。
本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。
欲查看此许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献放弃书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
Liu J。,彭日成,C。,H。et al。野生型和光敏遗传雄性不育突变体棉花花药的蛋白质组学分析(陆地棉l .)。BMC植物杂志14日,390(2014)。https://doi.org/10.1186/s12870-014-0390-4
收到了:
接受:
发表:
关键字
- 花粉管
- 男性不育
- 细胞质雄性不育
- 花粉管生长
- 花粉的开发