摘要
背景
小GTP酶是单体鸟嘌呤核苷酸结合蛋白。在植物中,ROPS调节植物细胞极性,植物细胞分化和发育以及生物和非生物应激信号通路。
结果
我们使用GFP融合向烟草表皮细胞中的血浆膜中的ATROP1蛋白的亚细胞定位。另外,瞬态和稳定表达的主要负面形式(DN)拟南芥马铃薯中的AtRop1导致H2O.2积累与发展的减少有关5种Montagne:和感染马铃薯叶片上的小病变的表达式斯特伯-D用RT-PCR方法对马铃薯NADPH氧化酶同源基因进行了分析。在DN-AtRop1转基因植株中,该基因的表达在病毒感染后得以维持P. Infestans。在转基因薯系中,水杨酸(SA)和茉莉酸(JA)标记基因的转录物水平(Npr1和液态氧,分别分析了。这氧合酶基因急剧诱导,而表达Npr1,通过SA上调的基因,在感染后DN-ATROP1转基因植物中略微下降P. Infestans..
结论
综上所述,我们的研究结果表明,DN-AtROP1影响了马铃薯的抗性P. Infestans。这与增加的NADPH氧化酶介导的H相关联2O.2生产和JA信号。
背景
土豆(马铃薯)是世界上第四大作物。由于高海拔,寒冷温度和有限的病毒矢量,内蒙古已成为中国最大的马铃薯生产省。但是,由于没有抗性基因P. Infestans.在大多数栽培马铃薯品种中,马铃薯晚疫病在内蒙古造成了巨大的产量损失[1],[2]. 因此,马铃薯育种工作者面临的主要挑战之一是破译马铃薯的抗性机制P. Infestans.通过传统育种和分子育种相结合的方法培育抗病品种。许多研究调查了病原菌数量抗性的分子基础[3.]马铃薯显性抗病基因的鉴定[4.],[5.]病原入侵机制[6.],[7.]以及马铃薯抗性信号分子[6.],[8.].以前的研究还表明水杨酸(SA),茉莉酸(JA)和防御基因如公关,StPK1,和StLRPK1与马铃薯晚疫病的抗性有关[9.] - [11]. 然而,对小G蛋白如何调节抗药性的理解P. Infestans.缺土豆。
小GTP酶是单体鸟嘌呤核苷酸结合蛋白[12].Rho GTPase是小GTPase Ras超家族的一个分支,包含三个相关亚家族:Rho、Rac和Cdc42 [13],[14].在酵母和哺乳动物细胞中,Rho GTPases在植物中有多种作用,调节细胞骨架重组、细胞极性、细胞壁合成、过氧化氢(H2O.2)生产、细胞周期和分化[15] - [18].植物已经进化出了一类独特的小GTPases,称为Rho-related GTPase (ROPs),它与哺乳动物细胞中的Racs (Rho GTPase的一个亚家族)非常相似[19] - [21.].植物ROP不仅与哺乳动物RHO GTP酶表现出高序列相似性,而且具有类似的功能[20.],[22.],[23.]. 与哺乳动物一样,ROPs通过鸟嘌呤核苷酸交换因子(GEFs)将GDP交换为GTP而被激活,而它们被GTPase激活蛋白(GAPs)灭活并刺激GTP水解为GDP。鸟嘌呤核苷酸解离抑制剂(GDIs)通过抑制GDP的释放,使ROPs处于非活性状态[19] - [21.].ROPs在gtp结合形式和gdp结合形式之间循环,从而调节多种细胞反应[24.].迄今为止,已识别出几种植物ROP基因,包括11个拟南芥ROP基因[19],[25.],[26.],7种水稻和9种玉米基因[27.]. 由这些ROP基因编码的蛋白质调控多种信号通路,导致多种细胞反应,如细胞极性/顶端生长、细胞骨架重组、次生壁形成和植物防御[20.],[22.],[23.],[28.].
RHO相关的GTP酶明确参与了植物防御的建立。在米饭中,OSRAC1积极调节辩护响应格里西大道H2O.2通过调节NADPH氧化酶活性来实现积累[29.] - [32.].Osracb,OSRAC4和OSRAC5在建立对稻瘟病的抵抗力时起负调节器[33.] - [36.,但OsRac6以积极的方式调节水稻抗性[36.]. 在哺乳动物细胞中,ZmRac(从玉米中克隆)的显性正构象的过度表达也导致超氧化物和其他ROS分子的产生增加[37.]. 在拟南芥中过度表达GhRac13基因(来自棉花)和在大豆中过度表达HsRac1(来自人类)抑制H2O.2生产(38.],[39.].在拟南芥中,ATROP2和ATROP11转基因植物表现出增加的抗性两PV。番茄(太平洋标准时间)DC3000(第。丁香科).但是,ATROP10对细菌的抗性有相反的影响[40].在大麦中,HvRacB的沉默通过减少真菌吸器以细胞自主和基因型特异性的方式建立来增加对白粉病的抗性[41.].然而,大麦的Ca-HVRACB,CA-HVRAC1和CA-HVRAC3(主动构象)的稳定过表达导致对粉末状霉变的易感性提高了[33.],[42.],[43.]. 在烟草中,过表达的MsRac1基因导致细胞死亡,从而导致褐色坏死病变的发展[44.]. 另外,利用RNA干扰沉默的方法进行研究Medicago Truncatula.植物表明MtROP9在ROS介导的早期感染信号中起着关键作用[45.]. 以上结果表明,ROPs对植物防御系统的建立起着积极和消极的作用。
活性氧(ROS)包括超氧化物(O2-)、过氧化氢(H2O.2)、羟基自由基(HO·)和单线态氧(1O.2)由质膜产生的NADPH氧化酶在防御反应中起关键作用,被认为是诱导抗性反应的第二信使,如防御基因表达增加和诱导超敏细胞死亡,称为超敏反应(HR)[46.],[47.].ROS的快速生产是植物和病原体之间不相容的相互作用期间的早期事件之一[46.],[48.].在尼古利亚娜·宾夕法尼亚州抑制ROS累积导致阻力降低P. Infestans.[47.]. 大豆细胞中的ROS可能与一氧化氮相互作用,触发HR,从而有效地抑制病原菌的生长[49.].在拟南芥中,ROS的诱导导致超敏细胞死亡反应,增强其对Pst和活体营养型卵菌[50.]. 水稻ROS产量的增加诱导HR样反应,极大地减少了稻瘟病菌强毒小种引起的病损大小,改变了防御相关基因的表达[51.].
许多研究表明,SA (salicylic acid,水杨酸)和JA (Jasmonic acid,茉莉酸)是通过诱导一系列防御基因的表达来调节植物抗性的关键信号分子PR-1那PAD4那EDS1,和PDF1.2[52.].SA在建立对生物养学病原体感染和全身获得的抵抗(SAR)的抵抗力方面发挥作用[53.].Pr基因1的非富沸点(尼泊尔卢比1)在病原体感染过程中被SA积累上调,并被常规用作跟踪SA介导的信号通路的标记基因[54.].最近的一项研究确定了SA是基础防御所必需的,如病原体引发的土豆中的免疫力(PTI)P. Infestans.;SA的减少使植物更容易受到P. Infestans.可能是由于较低公关基因表达(55.].增加马铃薯中水杨酸的含量可提高其抗性P. Infestans.[56.]. JA还被认为在建立植物对病原菌的抗性和对各种胁迫的反应中起着重要的作用[57.],[58.].在植物中,JA是参与诱导系统抗性(ISR)建立的关键信号成分[59.].脂氧合酶(LOX)是JA合成途径中的关键酶,以及表达氧合酶该基因与不同胁迫下JA的积累高度相关[6.].拟南芥在JA信号通路中受损的突变体始终受到对病症的抵抗力的影响[60.]. 感染pstdc3000后,JA也有累积[59.].沉默烯烯氧化物环酶(AOC公司)或OPDA还原酶3(OPR3)编码JA生物合成相关酶的基因也扰乱了马铃薯对Pep-13的反应,Pep-13是马铃薯的一种病原相关分子模式(PAMP)P. Infestans.通过减少ROS的积累和超敏细胞的死亡。在缺乏JA的植株中观察到SA积累[6.]表明在马铃薯抗性建立过程中,JA和SA信号通路之间存在着相互作用。
我们分析了AtRop1,一种小G蛋白拟南芥其在建立对土豆抗性枯萎的作用。我们的结果表明,ATROP1(DN-ATROP1)的非活性形式的瞬态或稳定过表达增强了马铃薯抗性P. Infestans.感染,一种与H2O.2由NADPH氧化酶同源物基因介导。这表明h2O.2在ATROP1介导的马铃薯抗性中起着至关重要的作用P. Infestans.感染。此外,初步结果表明,JA参与了atrop1介导的马铃薯对晚疫病的抗性。
结果
AtRop1的亚细胞定位
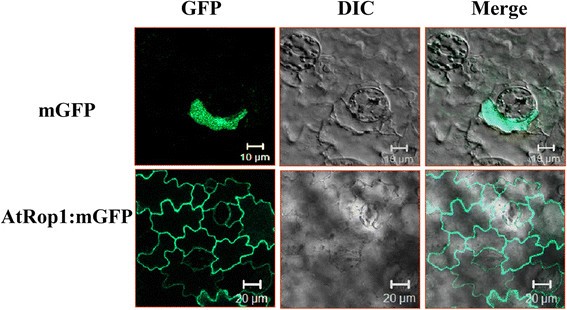
为了确定AtRop1的亚细胞定位,在烟草表皮细胞中瞬时表达了mGFP:AtRop1结构,并在荧光显微镜下检测到GFP信号。如图所示1,绿色信号仅在质膜(PM)上可见,而单独的GFP(对照)主要在细胞质中可见。因此,AtRop1在PM处本地化。
AtRop1显性失活构象(DN-AtRop1)的瞬时表达增强了马铃薯的抗性P. Infestans.
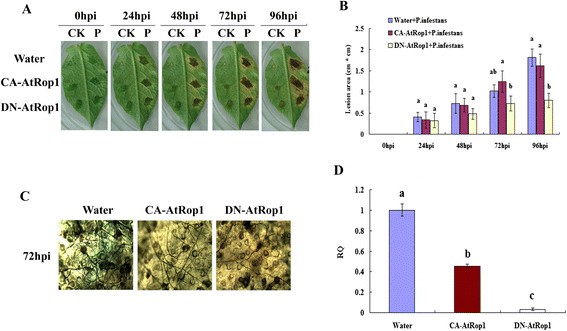
确定ATROP1在马铃薯响应中的重要性P. Infestans.那农杆菌肿瘤术分别携带CA-AtRop1(构成活性)和DN-AtRop1(显性阴性)的菌株(LB4404)侵染马铃薯叶片。24小时后,P. Infestans.(5×105.Zoospore / ml)接种在浸润部位,并且在接种后在不同时间点测量病变尺寸。如图所示2A,接种24h后马铃薯叶片出现病变,并逐渐扩大。病变大小在72 hpi和96 hpi时有差异。瞬时表达DN-AtRop1的浸润部位病变远小于表达CA-AtRop1的浸润部位病变(图)2A).病变大小量化显示,与CA-AtRop1浸润部位相比,DN-AtRop1浸润后病变的扩张速度要慢得多(图)2b).这些结果表明ATROP1可能参与马铃薯抗性P. Infestans..
At-Rop1基因瞬时表达负调控马铃薯对烟草的抗性P. Infestans..农杆菌肿瘤术(LB4404)携带CA-AtRop1和dn - atrop1结构体,在OD浓度下渗透到马铃薯叶片中600= 0.5。一种.马铃薯叶片接种后病斑大小的发展P. Infestans.(5×105.游动孢子/毫升)。叶片左侧接种水作为对照;接种正确的部分P. Infestans..B.. A.fter transient expression of CA-AtRop1 and DN-AtRop1, the lesion area (length by width) was measured at different time point after inoculation withP. Infestans..每个值表示三个病变的平均值(cm2 ± 标准差)。没有用同一个字母标记的水平在同一时间是显著不同的P < 0.05基于方差分析的水平。C.的发展P. Infestans.通过Trypan Blue染色量化Ca-ATROP1和DN-ATROP1瞬时表达的位点的菌丝体。D..的发展P. Infestans.在瞬时表达位点,通过比较特定重复DNA序列的水平来通过实时PCR量化72HPIP. Infestans.(作为真菌生物量的测量)相对于马铃薯EF-1α基因(用于平衡)。没有用同一个字母标记的水平在同一时间是显著不同的P < 0.05基于方差分析的水平。条形图代表三个技术复制品的标准差平均值。
要理解为什么DN-ATROP1的瞬态表达抑制马铃薯叶上的病变扩张,开发P. Infestans.锥虫蓝染色首次检测到接种部位周围的菌丝。如图所示2C、 与CA-AtRop1表达位点相比,在DN-AtRop1瞬时表达的位点周围观察到较少的菌丝体(图1)2C).重要的是,CA-AtRop1表达位点和对照位点的菌丝发育显著,而DN-AtRop1表达位点的菌丝数量较少,说明过表达DN-AtRop1在一定程度上抑制了菌丝的发育。同时,利用实时荧光定量PCR技术对其生物量进行评价P. Infestans..这表明,P. Infestans.CA-ATROP1和DN-ATROP1瞬时表达位点的菌丝体发育明显低于对照位点,DN-ATROP1表达位点显示最低生物质水平(图2D) 是的。总之,DN-AtRop1瞬时表达位点的小病灶大小可能与肿瘤生长受限有关P. Infestans..
接下来,我们调查了抑制的可能机制P. Infestans.DN-ATROP1Expression后马铃薯的发展。最近的研究表明,ROPS和ROS积聚之间的紧密联系方式[37.]. 这促使我们分析H2O.2DAB染色在P. Infestans.感染网站。在DN-ATROP1表达位点,H2O.2在48hpi时观察到,在72hpi时急剧累积,在96hpi时仍处于高水平(图1)3.A) 是的。然而,在CA-ATROP1表达位点并非如此。在图中3.B、 DAB染色定量显示两种结构都导致H2O.2接种后的水平P. Infestans..但是,H的积累2O.2在DN-AtRop1的表达部位明显高于CA-AtRop1的表达部位。我们提出高水平H2O.2DN-ATROP1表达位点的累积可以是增加抗性的原因之一P. Infestans.,通过抑制来说明P. Infestans.马铃薯叶片的发展和较小的病变大小。
DN-AtRop1增强了马铃薯的抗性P. Infestans.
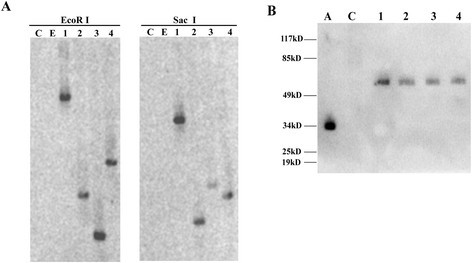
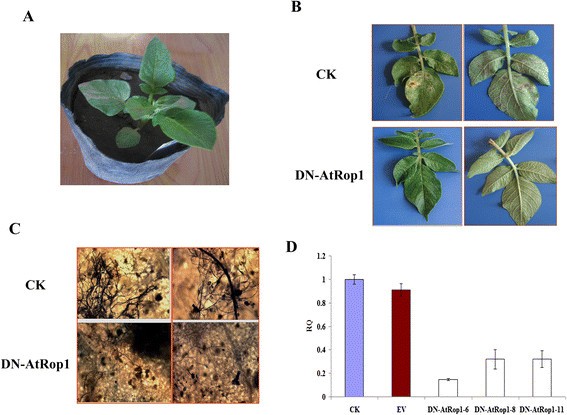
为了验证瞬时表达系统的结果,我们制备了转基因马铃薯株系DN-AtRop1通过农介导的转换.叶片盘方法用于产生转基因素,通过南纹分析证实阳性转基因系(图4.A) 以及使用商业抗GFP抗体的western blot(图4.b)。选择DN-ATROP1转基因系6,8和11用于进一步的功能分析。
我们在接种后,首先检查转基因马铃薯叶上的症状开发P. Infestans.. A.s shown in Figure5.B,当控制线显示出变色症状96 HPI时,DN-ATROP1转基因马铃薯叶上没有出现病变。通过台盼蓝染色检测转基因马铃薯叶上的菌丝体发育。稀疏的菌丝体P. Infestans.在96 hpi的DN-AtRop1转基因马铃薯叶片中检测到,而对照叶片表达空载体,在显微镜下显示大量蓝色染色(图5.C) 是的。P. Infestans.采用实时荧光定量PCR (real-time PCR)方法检测转DN-AtRop1基因马铃薯(6、8、11)叶片的生物量。定量分析表明发育减慢P. Infestans.在三个DN-AtRop1转基因株系中与对照植株进行比较(图5.d),表明DN-ATROP1转基因抑制了开发P. Infestans.从而提高马铃薯对晚疫病的抗性。
马铃薯AtRop1 (DN-AtRop1)转基因株系对P. Infestans.. A.. 转基因马铃薯(DN-AtRop1)4周龄。B..感染后DN-ATROP1转基因系脱落的症状P. Infestans..96 hpi拍摄。C.96 hpi后,转dn - atrop1基因株系6和11叶片上的菌丝发育。菌丝被台盼蓝染色。D..通过比较水平的损伤部位的实时PCR相对量化(RQ)P. Infestans.-特异性的重复DNA序列(作为真菌生物量的测量)相对于马铃薯EF-1α96hpi的基因(平衡)。条形图代表三个技术复制品的标准差平均值。CK代表野生型马铃薯,EV代表用空载体p1300-221转化的马铃薯。
H2O.2参与马铃薯ATROP1介导的抗性P. Infestans.
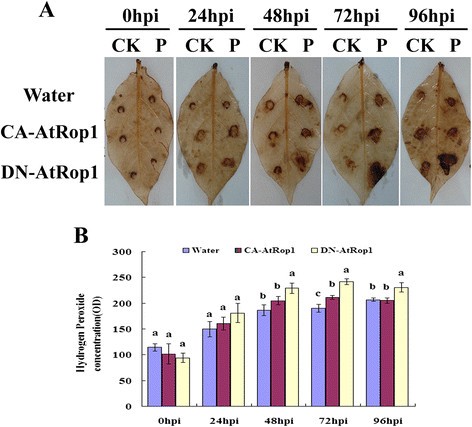
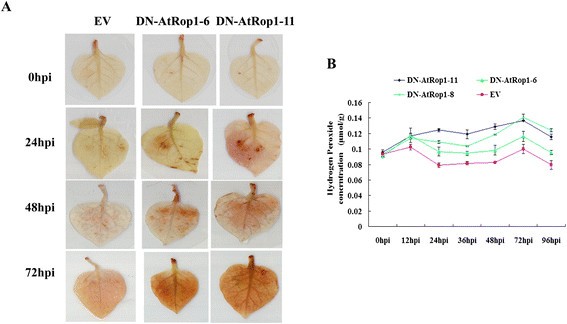
为了验证H2O.2在马铃薯DN-AtRop1转基因株系的抗性中起关键作用P. Infestans.,我们分析了H2O.2在转基因系中通过DAB染色。转DN-AtRop1基因的叶片在24 hpi时呈棕色,而对照植株中未检测到信号。H的积累2O.2DN-AtRop1转基因植株在48hpi时有较高的表达水平,在72hpi时有较高的表达水平,而对照植株的棕色仅略有增加(图1)6.A) 是的。H的定量2O.2水平(基于硫酸钛标准曲线法)表明,H2O.2在DN-ATROP1和控制线中遵循相同的时间模式,但DN-ATROP1转基因系中的水平显着高(图6.b)。与对照相比,测试的所有转基因素都有更高的H.2O.2结果表明,AtRop1通过H2O.2积累。
AtRop1负调控H2O.2马铃薯NADPH氧化酶同系物的积累
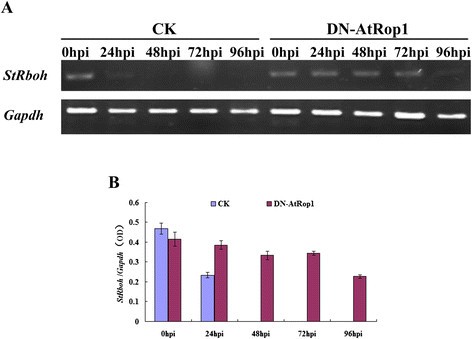
我们检测到H的积累2O.2接种后P. Infestans.在DN-ROP1转基因中。该数据促使我们检查膜位于膜是否(马铃薯中的NADPH氧化酶同源物)是H的主要调节器2O.2在这些转基因中的生产。使用来自的引物进行RT-PCR斯特伯-D,如图所示7.A和B;比较接种后不同时间点DN-AtRop1和对照植株中Strboh-D的转录水平(图7.b)。在对照植物中,表达减少了24 HPI,并在48 HPI下未检测到。但是,在DN-ATROP1转基因植物中,mRNA水平斯特伯-D基因在24 hpi时保持不变,在72 hpi时略有下降,在96 hpi时几乎是对照水平的一半(图1)7.这些结果表明膜是局部性的斯特伯-D基因可引起H2O.2在接种后的DN-ATROP1转基因系中P. Infestans..
JA可能在DN-AtRop1转基因马铃薯的抗病性中起一定作用P. Infestans.
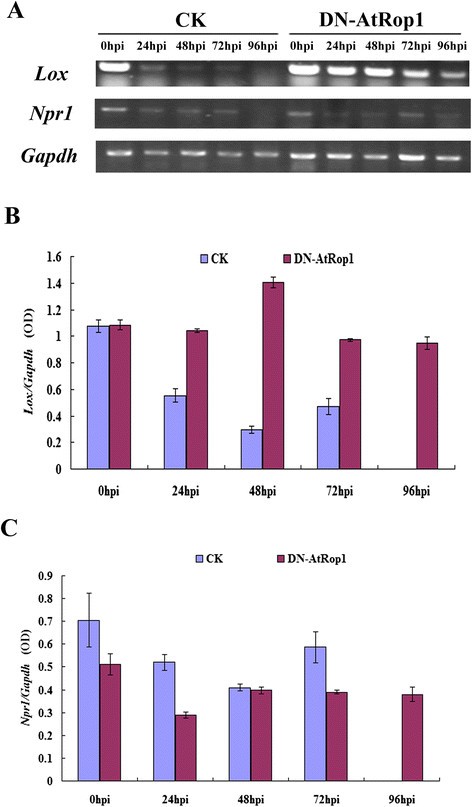
SA和JA是涉及植物抗原病原体的主要信号激素。检查JA-和SA依赖的信号通路是否参与了DN-ATROP1相关的抵抗力P. Infestans.,分析SA和JA标记基因的转录水平。这些标记基因Npr1,是SA信号通路的中心成分,并由SA积累上调,以及氧合酶,它们在JA生物合成途径中编码关键酶。如图所示8.A和B,氧合酶在对照植物中,转录水平在24 hpi时显著降低,在96 hpi时检测不到,而在DN-AtRop1转基因植物中,氧合酶mRNA在48 hpi前保持不变,随后逐渐下降。关于Npr1同时也进行了研究。表达数据的量化表明Npr1DN-ATROP1植物中的基础水平略低于对照植物(图8.C),接种后进一步降低24hpiP. Infestans..这些结果表明,JA信号可能参与了atrop1介导的马铃薯对晚疫病的抗性。
讨论
ATROP1蛋白的亚细胞定位
利用瞬时表达系统,利用GFP标记技术研究了AtROP1在烟草表皮细胞中的亚细胞定位。我们的结果显示mGFP:AtRop1主要定位于PM(质膜)(图1)1). 在哺乳动物和植物细胞中,NADPH氧化酶负责产生H2O.2也位于PM [61.],[62.].这提出了ATROP1可以在PM处调节NADPH氧化酶同源物的可能性,从而促进H的积累2O.2。在水稻中获得相同的结果,其中OsRac1也位于PM并调节H.2O.2生产,从而提高水稻的抗逆性m .盘菌[29.] - [31.].PM被认为是小G蛋白向下游因子传递信号转导的平台,从而促进马铃薯防御反应的建立。
AtRop1负调控马铃薯对晚疫病的抗性通过H的积累2O.2
RAC/ROP家族的小gtp酶在植物防御反应的建立中起着重要的作用[48.],[63.].在水稻中,过表达OsRac1型通过增加H2O.2水平[29.],[51.];在水稻中沉默这个基因会导致在感染稻瘟病菌后比对照植株发育更大的病变[64.].进一步研究OSRAC1Function揭示了osRac1的组成型活性形式(CA-OsRac1)促进H2O.2生产(29.],而俄罗斯奥克拉克的主要负面形式(DN OsRac公司1)抑制H2O.2[51.]. 另外,表达人的显性否定形式RAC1.(DN -hRac1)在大豆或OsRac1型在水稻细胞中,悬浮液也导致H的抑制2O.2响应激发子处理的生产。这表明H介导的小G蛋白对植物抗性存在正调控机制2O.2积累[39.],[51.],[65.]. 然而,小G蛋白可能发挥更为复杂的作用,表现为显性阴性形式的OsRac1(DN-OsRac1)在烟草中。这导致了H2O.2感染后积聚烟草马赛克病毒(TMV) (66.]和过度表达NtRac5公司(RAC5克隆烟草)在烟草中导致H较低的H2O.2[67.]我们据表明,拟南芥的主要负面形式的瞬态和稳定表达ATROP1.(DN-AtRop1)马铃薯的基因导致了下降的发展P. Infestans.在感染部位。说明AtRop1对马铃薯抗晚疫病的负调控机制。H2O.2被发现是与ATROP1介导的马铃薯抗性相关的信号通路中的关键球员。ATROP1的阴性形式的过表达导致H的积累2O.2,提高了马铃薯的抗病性P. Infestans.感染。H2O.2在植物抗性的建立过程中起着关键作用[48.],[63.].h的快速生产2O.2在被非寄主或无毒病原菌侵染的植物中观察到了在侵染区域触发HR的现象。在我们的研究中DN-AtRop1促进H的积累2O.2后P. Infestans.感染,可能引发了感染地区的HR,从而限制了发展P. Infestans.,并导致较小的病变(图2和数字5.)。因此增加了h2O.2积累可提高转基因马铃薯品系对晚疫病的抗性。我们的数据与在烟草品系中观察到的过度表达完全一致DN-OsRac1在TMV感染后也表现出较小的病变[66.].
H2O.2DN-AtRop1转基因株系的积累是由NADPH氧化酶介导的
一般来说,H的产生2O.2既可以通过有氧呼吸过程中的线粒体电子传递实现,也可以通过氧化还原酶和金属催化氧化实现。与膜相关的NADPH氧化酶的激活是H的主要来源2O.2积累[68.],[69.].StRBOH是NADPH氧化酶的同系物,不仅在马铃薯叶片中有很强的诱导作用,而且在马铃薯侵染后的块茎中也有很强的诱导作用P. Infestans.[70]. 在我们的研究中StRboh在接种后观察到马铃薯转基因素P. Infestans..然而,在对照植物中其表达被显著抑制。这说明H2O.2在转基因株系中可能是由膜定位的持续表达引起的StRboh.同时,AtRop1和StRboh的质膜定位表明,PM可能是连接AtRop1和的平台StRboh有利于H的积累2O.2. 过氧化氢酶是一种主要的H2O.2清除植物细胞内的酶,水解H2O.2在H2O和O2保护植物细胞免受对H的有害影响2O.2[71.].然而,我们没有观察到对照和转基因株感染后过氧化氢酶的转录水平的差异P. Infestans.(数据未显示),表明H2O.2积累主要是由马铃薯pm定位的NADPH氧化酶同源物引起的。
JA参与了AtRop1调控马铃薯抗性的过程
SA和JA是植物对病原体的重要信号分子。检查它们是否参与了DN-ATROP1转基因系的抗性增加P. Infestans.RT-PCR检测两条通路中标记基因的转录水平。我们的数据显示氧合酶在此过程中,转基因株系DN-AtRop1的基因表达被诱导P. Infestans.说明过表达DN-AtRop1激活了JA通路,而本研究部分抑制了SA信号通路。
我们的数据与先前的报道不同,表明SA信号通道被激活,并且在某种程度上被抑制了JA信号通路P. Infestans.马铃薯抗病品种紫花白的入侵[72.].此外,没有发现SA不仅要规范土豆的基础防御P. Infestans.但也参与了BABA诱导马铃薯系统获得性抗性的建立[55.],[73.]. 然而,Rosah和他的同事发现马铃薯的PAMP反应需要SA和JA,表明JA是马铃薯抗性建立所必需的[6.].因此,ATROP1过表达可以激活粘合性诱导的电阻途径,从而提高马铃薯抗性P. Infestans.. A.recent study established that JA and SA signaling pathways act antagonistically in potato [72.]. 减少了Npr1成绩单水平和接种后Ja的伴随增加P. Infestans.表明SA和JA的拮抗作用具有保护作用。除了SA和JA,还有其他激素参与植物抗性,如乙烯(ET)、油菜素内酯(brassinosteroids)、细胞分裂素(Cytokinins)和生长素。其中油菜素内酯和油菜素内酯通过NPR1增强了植物对病原体的抗性[74.] - [76.]是SA信号通路的主要调节因子。乙烯对SA信号通路具有拮抗作用[52.],而生长素可能通过影响SA生物合成而增强对生物营养性病原体的敏感性[77.].我们的数据显示,表达DN-ATROP1导致降低Npr1感染后的转录水平P. Infestans.表明AtRop1可能正调控马铃薯NPR1的表达。
结论
结果表明,AtRop1可调控马铃薯对晚疫病的抗性。DN-AtRop1通过激活膜相关NADPH氧化酶,促进H2O.2积累。我们建议那个2O.2依次累积限制P. Infestans.开发,导致较小的病变尺寸,并提高马铃薯抗性。我们的结果还表明JA可参与ATROP1介导的马铃薯耐药性P. Infestans..
方法
质粒建设
构建的pLG-CARop1、DNRop1和Rop1以及pbi121空载体由赵燕博士(中国科学院遗传与发育生物学研究所北京)提供。构念用EcoR我和囊我,然后钝端并用空载体pbi121连接到构建三个表达载体:pbig-carop1,pbig-dnrop1和pbigrop1。PCR鉴定A. Tumefaciens.含pBIG-CARop1、pBIG-DNRop1、pBIG-Rop1的GFP引物5’-GAC GTA AAC GGC CAC AAG TT-3’和5’-GAA CTC CAG CAG GAC CAT GT-3’。
AtRop1的亚细胞定位
农杆菌肿瘤术(菌株LB4404)含有表达载体(pBIG-CARop1/pBIG-DNRop1/ pBIG-Rop1)和空载体(只含GFP),在含有10 mM MES (pH 5.7)、20 μM acettosyone和100 mg/L利福平的5 ml LB培养基中培养约48小时。收集农杆菌,在5%的蔗糖浓度下重悬600= 2.0,然后使用无针注射器渗入烟叶。通过共聚焦显微镜(Carl Zeiss LSM-510)检测烟草表皮细胞中GFP信号。
玉米游动孢子悬浮液的制备P. Infestans.
5种交配型A1是由张若福教授(内蒙古大学土豆工程中心)提供的。在18°C的灭菌燕麦籽粒培养2-3周后,孢子囊P. Infestans.用无菌水冲洗,并在4°C下保持4–6小时,以促进游动孢子释放。游动孢子经1-2层消毒纱布过滤,显微镜下用血细胞仪测定浓度。将游动孢子溶液稀释至5 × 105.所有接种的游动孢子/mL[3.].
马铃薯叶片接种20μL游动孢子悬浮液(5 × 105./mL),并在20°C和85%湿度下培养,以进行抗性评估和测定H2O.2积累[78.].用无菌刷子将游动孢子悬浮液涂抹在转基因马铃薯叶片背面,20℃保存检测H2O.2菌丝体生物量的生产和测定。
农杆菌肿瘤术介导的瞬态表达
农杆菌肿瘤术(菌株LB4404)携带AtRop1突变体(CA-AtRop1和DN-AtRop1),在含10 mM MES (pH 5.7)和20 μM乙氧丁酮的LB培养基中培养约48 h。离心后,将细菌重悬在含有10 mM氯化镁的渗透培养基中2,10 mM MES(pH 5.7)和150μM乙酰丁香酮(OD浓度)600 = 0.5 (optical density 600 nm). The bacteria were infiltrated into detached potato leaves using a syringe without needle. Twenty-four hours later, 20 Μl of the zoospore suspension(5 × 105./mL)接种于浸润部位。马铃薯对P. Infestans.使用不同时间点的接种叶片的病变区域评估。通过计算病变的长度×宽度估计病变区域。每次实验都重复三次。
H的定量和定性测定2O.2生产
染色方法3,3'-二氨基苯甲酸(DAB)用于检测H的积累2O.2. DAB溶液是新制备的,以避免自动氧化。叶段在0.1%(w/v)DAB溶液(ph3.8)中漂浮,并在25℃黑暗中保持。8小时后,将叶片转移到95%乙醇中,煮沸漂白30分钟。然后将叶片储存在甘油-乙醇(1/4 v/v)溶液中直到拍照。由DAB聚合形成的棕色代表了H的积累水平2O.2[79.].DAB的颜色量化数据由数量(Bio-Rad,American)工具评估。
采用硫酸钛标准曲线法测定H2O.2.H.2O.2硫酸钛生成黄色过氧化物-钛化合物沉淀。用硫酸处理解决了这一问题;颜色代表H的浓度2O.2,. 在OD时收集数值415.与H呈线性相关2O.2专注 [80]. 生成H的标准曲线2O.2, 30%标准H2O.2(0、0.1、0.2、0.4、0.6、0.8、1.0 μM)与5%硫酸钛(w/v)在含氨和丙酮的缓冲液中反应,再用2 M硫酸溶液溶液。回归方程为:Y = 0.8144X + 0.025, R2 = 0.9953 by using values collected at OD415.通过分光光度法(TU-1901)测定nm,并作为标准曲线。取0、24、36、48、72和96 hpi的马铃薯碎叶0.1 g,置于液氮中,然后将粉末转入含有1ml预冷丙酮(4℃)的1.5 mL离心管中提取H2O.2. A.fter centrifugation for 10 min at 6000 rpm, the 100 μL supernatant was used to react with 5% titanium sulfate (w/v). After the mixture was solved in 2 M sulphuric acid, the H2O.2紫外分光光度法测定0、12、24、36、48、72和96 hpi浓度415.纳米。
台盼蓝染色检测菌丝发育
台盼蓝染色法检测肿瘤的发展P. Infestans.菌丝体。将被感染的土豆叶片转移到95%乙醇中,并煮沸30分钟以漂白叶子。然后在25℃下用0.5%(w / v)台盼蓝溶液渗透叶4小时。用水洗涤样品三次后,在显微镜下可视化菌丝体[81].
量化发展P. Infestans.在马铃薯叶上
施用定量实时PCR以确定生长P. Infestans.在马铃薯植株上使用lightcycler 480II(美国罗氏公司)和qPCR试剂盒SYBR Select Master Mix(美国ABI公司)。采用十六烷基三甲基溴化铵(CTAB)法提取DNA[82]. 用引物PIO8-3-3F(5-CAA-TTC-GCC-ACC-TTC-GA-3)和PIO8-3-3R(5-GCC-TTC-CTG-CCC-TCA-AGA-AC-3)扩增和检测aP.infestans-特定重复DNA序列[83]和底漆STEF-1-F(5-GTG TGT TAC GAG AAC TTG CTT TAC T-3)和STEF-1-R(GGA作用ATG TTT GCC ACC GTC CTG)用于扩增马铃薯EF-1α基因作为内源性控制。
植物材料与转化
土豆植物马铃薯“Shepody”生长在Murashige和Skoog(MS)培养基上体外在光束密度为3000-4000 Lx,60-85%的相对湿度,25°C的16 h / 12 H日和夜间周期。在含有卡那霉素(100mg / L)和利福平(100mg / L)的10ml LB培养基的振荡器培养物中培养了一块农杆菌Lb4404的殖民地,并在28℃下保持220rpm 48小时。3〜4周的叶子静脉切割叶片,然后漂浮在含有细菌悬浮液的MS液体介质中(细菌浓度是OD600 = 0.5),并在黑暗中保持2-3天。叶片在无菌滤纸上干燥后转移到MS固体培养基上。2天后,将叶片转化到含有0.5 mg/L吲哚乙酸(IAA)、2.0 mg/L 6-苄基氨基嘌呤(6-BA)、2.5 mg/L赤霉素(GA3)、25 mg/L潮霉素和500 mg/L头孢噻肟的MS培养基上诱导不定芽。4周后,在含25 mg/L潮霉素和500 mg/L头孢噻肟的再生培养基上进行马铃薯再生芽的筛选。通过Southern杂交和Western杂交对转基因植株进行鉴定。
南方印迹分析
采用CTAB法提取马铃薯基因组DNA [82].对于DNA提取,在液氮中研磨0.2g新鲜收获的叶片。将粉末悬浮在1ml DNA萃取缓冲液(50mM Tris-HCl pH 8.0,10mM EDTA,700mM NaCl,1%CTAB溶液,0.5%PVP)中,并在65℃下孵育30分钟。通过用相等体积的氯仿混合萃取DNA:异戊醇(24:1),并在4℃下以12,000rpm以12,000rpm离心10分钟。将上清液除去向新鲜管中并用相等体积的冰冷异丙醇和0.1体积3m乙酸钠沉淀过夜。将混合物在4℃下以12,000rpm离心10分钟。将沉淀用70%乙醇洗涤两次,然后完全干燥并溶解在Te缓冲液中。用RNase纯化DNA并通过UV分光光度法量化。
根据其序列,根据挖掘DNA标记和检测试剂盒II(Roche,American)的指令产生的用于Southern印迹的GFP探针。用EcoR I和Sac I消化基因组DNA后,将产物分离在1.0%琼脂糖凝胶上,然后转移到尼龙膜上。用2×SSC(0.3M NaCl,30mM柠檬酸钠,pH7.0)洗涤膜,然后用0.1%SDS(5分钟)两次,然后用0.5×SSC洗涤两次,用0.1%SDS(15min)在65°C。将膜在80℃下烘烤2小时,以将DNA与尼龙膜交联。将膜与标记的GFP探针的杂交在杂交缓冲液中进行过夜(通过DIG DNA标记和检测试剂盒II)在42℃下进行过夜。杂交后,用洗涤缓冲液(0.1M马来酸,0.15m NaCl,0.3%Tween 20,pH 7.5)洗涤膜5分钟;然后用阻塞溶液孵育(通过DIG DNA标记和检测试剂盒II提供)30分钟。然后将膜与抗Digoxigenin-AP(1:5000稀释液)一起温育30分钟。用洗涤缓冲液洗涤膜两次,并在检测缓冲液(0.1M Tris-HCl,0.1M NaCl,pH9.5)中平衡5分钟。 The membrane was stained with 1 ml CSPD, and incubated at 25°C for 5 min, then analysed ueing a Chemi XT4 (Syugene, American).
西部印迹分析
将转基因马铃薯叶片在液氮中研磨,然后将粉末转移到含有5mmM K的1mL蛋白质分离缓冲液(pH6.0)中3.阿宝4.、2.5%蔗糖、0.1% β-巯基乙醇和0.5 mM苯甲基磺酰氟。粗提物4℃,12000 rpm,离心20 min,收集上清,与上清液混合。蛋白质通过SDS-PAGE分离并转移到硝化纤维素膜上。用5%脱脂奶粉在PBST(磷酸盐缓冲盐水吐温-20)缓冲液中封闭硝化纤维素膜,用抗gfp单克隆抗体(1:5000稀释,中国生工)和hrp标记抗大鼠二抗(1:3000稀释,中国生工)孵育,用Chemi XT4 (Syugene,美国)检测信号。
rt - pcr
采用RNA iso Reagent (TaKaRa, Japan)从转基因马铃薯叶片中提取总RNA。用1.2%的琼脂糖凝胶检测RNA的质量。RT-PCR用AMV转录酶(TaKaRa,日本)根据制造商的说明生成cDNA。用于RT-PCR分析的特异性引物如下:
StRboh-D-F(5-AGC TGC AGA ATA CGC AGC GTT GA-3)
Strboh-D-R(5-GGC att Gaa Acc GGT Gag CTT GT-3)
Npr1-F(5-TGC TGC CAT GCG TAA CGA ACC A-3)
NPR1-R(5-TGG ACC AAA ACT TGG CCC CAC A-3)
Lox-F(5-AGA ACT TTG CTC TTC TTG CAA G-3)
Lox-R(5-GGT AAT ATT CAT TGT GTC CCG-3)
GAPDH-F(5-TGG ACA ATG GAA GCA CCA TGA GC-3)
GAPDH-R(5-TGC TTG ACC TGC TGT CAC CAA-3)。
参考文献
- 1.
赵志忠,孙晓:马铃薯晚疫病研究现状及防治对策。中国植物保护,2009,8:12-14。
- 2。
太阳ZK,NIU C,杨SS:马铃薯沉闷的研究。生活SCI res。2006年,S1:71-75。
- 3.
王必利:马铃薯晚疫病数量抗性相关基因的诱导表达谱及数量抗性机制的初步探讨。武汉:华中农业大学;2005
- 4.
炸我们,Goodwin SB:爱尔兰马铃薯饥荒菌的复苏。生物科学。1997, 47: 363-371. 10.2307/1313151.
- 5。
Vleeshouwers VG, Van Dooijeweert W, Govers F, Kamoun S, Colon LT:超敏反应与宿主和非宿主对疫霉菌的抗性有关。植物生态学报,2000,20(6):853-864。10.1007 / s004250050690。
- 6。
Halim Va,Altmann S,Ellinger D,Eschen-Lippold L,Miersch O,Scheel D,Rosahl S:Pamp诱导马铃薯的防御反应需要水杨酸和茉莉酸。工厂J. 2009,57:230-242。10.1111 / J.1365-313x.2008.03688.x。
- 7。
寡肽诱导子Pep-13在马铃薯中诱导水杨酸依赖性和非依赖性的防御反应。中国植物病理学杂志,2004,26(6):531 - 534。10.1016 / j.pmpp.2004.10.003。
- 8.
Yamamizo C, Kuchimura K, Kobayashi A, Katou S, Kawakita K, Jones jtg, Noriyuki D, Hirofumi Y:正反馈重组丝裂原激活蛋白激酶级联反应使马铃薯抗枯萎病。植物生理学杂志,2006,29(5):649 - 652。10.1104 / pp.105.074906。
- 9.
Shibata Y, Kawakita K, Takemoto D: benthamiana对半生物营养病原菌Phytophthora infestans的年龄相关抗性需要乙烯和水杨酸介导的信号通路。植物微生物学杂志。2010,23(9):1130-1142。10.1094 / mpmi - 23 - 9 - 1130。
- 10
Shi X,Tian Z,Liu J,Van der Vossen EA,谢C:马铃薯发病机制相关的蛋白基因,StprP27,有助于对植物对植物的抗特异性抗性。MOL BIOL REP。2012,39(2):1909-1916。10.1007 / s11033-011-0937-5。
- 11
Cohen Y,Gisi U,Niderman T:Zhasmonic酸和茉莉甲酯在马铃薯和番茄植物中诱导的植物和全身保护。植物病理学。1993,83(10):1054-1062。10.1094 / phyto-83-1054。
- 12
Parada LF,Tabin CJ,Shih C,Weinberg RA:人EJ膀胱癌癌基因与Harvey carcoma病毒Ras基因同源。自然。1982,291(5866):474-478.10.1038/2974a0。
- 13。
Rho GTPases和肌动蛋白骨架。科学出版社,1998。10.1126 / science.279.5350.509。
- 14。
GTPase级联调控细胞行为:运动、形态发生和更多。细胞,1995,81:1-4。10.1016 / 0092 - 8674(95) 90363 - 1。
- 15.
Takai Y,Sasaki T,Matozaki T:小GTP结合蛋白。Physiol Rev.2001,81(1):153-208。
- 16。
Rac 'n Rho:塑造发育中的胚胎的音乐。细胞生物学杂志,2001,1(3):331 -331。10.1016 / s1534 - 5807(01) 00053 - 3。
- 17。
Rho GTPases:控制肌动蛋白细胞骨架的组织和动力学的分子开关。黄建平,李建平。生物多样性研究进展[j] .中国生物医学工程学报,2000,21(3):349 - 352。10.1098 / rstb.2000.0632。
- 18.
rho - gtppase在植物细胞极性转换中的调控。生物化学学报,2014,42(1):212-218。10.1042 / BST20130269。
- 19.
郑泽,杨泽:ROP GTP酶:植物中的新出现信号开关。植物mol biol。2000,44:1-9。10.1023 /答:1006402628948。
- 20.
杨ZB:小GTP酶:植物中的多功能信号开关。植物细胞。2002,14(SUP):S375-S388。
- 21.
拟南芥小GTPase基因超家族的分析。植物生理学杂志,2003,31(3):431 - 436。10.1104 / pp.013052。
- 22.
顾奕,王梓,杨梓:ROP/RAC GTPase:一种新老的植物信号主调节器。植物生物学。2004年,7:527-536.10.1016/j.pbi.2004.07.006。
- 23.
徐杰,谢瑞斯B:细胞极性:把两端绑在一起。植物生物学。2005,8(6):613-618.10.1016/j.pbi.2005.09.003。
- 24。
植物ROP/Rac GTPases Rho信号转导的新发现。中国生物医学工程学报,2012,22(4):492-501。10.1016 / j.tcb.2012.05.002。
- 25。
植物中gtp结合蛋白的研究进展。中国生物医学工程学报,1999,22(1):1 - 6。10.1007 / s000180050287。
- 26。
WIELE P,BREMBU T,Kristensen R,骨骼AM:拟南芥中Rac-GTP酶的遗传结构和演变。遗传学。2000,156(4):1959-1971。
- 27。
Christensen TM,Vejlupkova Z,Sharma YK,Arthur Km,Spatafora JW,Albright Ca,Meeley RB,Duvick JP,Quatrano Rs,Fowler Je:Monocot ROP基因家族中的保守亚组和发育规则。植物理性。2003,133:1791-1808。10.1104 / pp.103.029900。
- 28。
Humphries JA,Vejlupkova Z,Luo A,Meeley RB,Sylvester AW,Fowler JE,Smith LG:ROP-GTPases与受体样蛋白PAN1作用于玉米细胞不对称分裂。植物细胞。2011年,23(6):2273-2284.10.1105/tpc.111.085597。
- 29。
Kawasaki T,Henmi K,ONO E:小GTP结合蛋白RAC是植物中细胞死亡调节因素。Proc Natl Acad Sci U S A. 1999,96:10922-10926。10.1073 / pnas.96.19.10922。
- 30
肉桂酰辅酶a还原酶(cinnamoylcoa reducase)是木质素生物合成中的关键酶,是水稻防御信号中小GTPase Rac的一个效应酶。中国生物医学工程学报,2006,26(1):1 - 6。10.1073 / pnas.0509875103。
- 31
Ono E,Wong HL,Kawasaki T,Hasegawa M,Kodama O,Shimamoto K:小GTPase Rac在水稻抗病性中的重要作用。美国国家科学院学报。2001年,98(2):759-764.10.1073/pnas.98.2.759。
- 32
关键词:NADPH氧化酶,N-末端调控结构域,生物信息学,生物信息学中国生物医学工程学报。2010,28(2):431 - 434。10.1074 / jbc.M109.058909。
- 33
Schultheiss H, Hensel G, Imani J, Broeders S, Sonnewald U, Kogel KH, Kumlehn J, Hückelhoven R:构成激活的RACB异位表达增强了大麦对白粉病和非生物胁迫的敏感性。植物生理学报,2005,42(1):1 - 5。10.1104 / pp.105.066613。
- 34
Schultheiss H, Preuss J, Pircher T, Eichmann R, Hückelhoven R:大麦RIC171与植物中的RACB相互作用,支持白粉病真菌的进入。细胞微生物学。2008,10(9):1815-1826。10.1111 / j.1462-5822.2008.01167.x。
- 35
Jung YH,Agrawal GK,Rakwal R,Kim JA,Lee MO,Choi PG,Kim YJ,Kim MJ,Shibato J,Kim SH,Iwahashi H,Jwa NS:水稻基础抗病性潜在负调控因子OsRacB GTPase的功能特性。植物生理生化。2006年,44(1):68-77.10.1016/j.plaphy.2005.12.001。
- 36
3 .陈玲,陈立平,陈丽丽:水稻中Rac/Rop小GTPase家族的表达、亚细胞定位及在抗病中的作用。植物生理学杂志。2010,51(4):585-595。10.1093 /卡式肺囊虫肺炎/ pcq024。
- 37。
Hassanain HH,Sharma Y,摩尔多瓦L,Khramtsov V,Berliner LJ,Duvick JP,Goldschmidt-Clermont PJ:植物RAC蛋白诱导哺乳动物细胞中的超氧化物产生。Biochem Biophys Res Communce。2000,272:783-788。10.1006 / BBRC.2000.2791。
- 38。
Potikha TS,Collins CC,Johnson DI,Delmer DP,Levine A:过氧化氢在棉纤维次生壁分化中的作用。植物生理学。1999年,119(3):849-858.10.1104/pp.119.3.849。
- 39。
Park J,Choi HJ,Lee S,Lee T,Yang Z,Lee Y:Rac相关GTP结合蛋白在诱导子诱导悬浮培养大豆细胞产生活性氧中的作用。植物生理学。2000年,124(2):725-732.10.1104/pp.124.2.725。
- 40。
王AR,陈X,张德明,陈HH,卢国达,王志军:不同拟南芥ROPs对丁香假单胞菌pv增殖的影响。番茄DC3000。福建农业大学学报(自然科学版)。2008, 37 (6): 610-613.
- 41。
Schultheiss H, Dechert C, Kogel KH, Hückelhoven R:白粉病真菌进入大麦表皮细胞需要一个小的gtp结合宿主蛋白。植物生理学杂志,2002,28(4):449 - 454。10.1104 / pp.010805。
- 42。
Pathuri IP, Zellerhoff N, Schaffrath U, Hensel G, Kumlehn J, Kogel KH, Eichmann R, Hückelhoven植物细胞学报,2008,27(12):1877-1887。10.1007 / s00299 - 008 - 0607 - 9。
- 43。
Hoefle C, Huesmann C, Schultheiss H:一种大麦ROP GTPase激活蛋白与微管相关,调控大麦白粉病菌进入叶表皮细胞。植物细胞学报,2011,23(6):2422-2439。10.1105 / tpc.110.082131。
- 44.
Schiene K,Puhler A,Niehaus K:表达衍生自编码RAC相关的小GTP结合蛋白的Medicago Sativa cDNA的反义构建的转基因烟草植物未能在引发浸润后发育坏死病变。Mol Gen Genet。2000,263(5):761-770。10.1007 / S004380000248。
- 45.
Leonard MK,Hannah FB,Christine S,Wimmer D,Korte J,Schmitz U,Niehaus K,Colditz F:截短苜蓿中Rac1 GTPase MtROP9的沉默刺激早期菌根和卵菌根定殖,但对根瘤菌感染产生负面影响。植物生理学。2012年,159(1):501-516.10.1104/pp.112.193706。
- 46.
Doke N:马铃薯块茎组织对侵染马铃薯晚疫病菌不亲和小种和菌丝壁组分的超敏反应中超氧阴离子的产生。植物生理病理学。1983,23:345-357.10.1016/0048-4059(83)90019-X。
- 47.
Yoshioka H,Numata N,Nakajima S,Katou S,Kawakita K,Rowland O,Jones JD,Doke N:尼古利亚娜Benthamiana GP91phox同源物NBRBOHA和NBRBOHB参与H2O2积累和抗植物肺炎患者。植物细胞。2003,15(3):706-718。10.1105 / TPC.008680。
- 48。
Lamb C, Dixon RA:植物抗病中的氧化爆发。中国生物防治学报,1997,3(1):1- 7。10.1146 / annurev.arplant.48.1.251。
- 49。
Delledonne M,Zeier J,Marocco A,Lamb C:植物超敏抗病反应中一氧化氮和活性氧中间产物之间的信号相互作用。美国国家科学院学报。2001年,98:13454-13459。10.1073/pnas.231178298。
- 50
辣椒patatin-like磷脂酶CaPLP1在植物细胞死亡和防御信号转导中的作用中国生物医学工程学报,2014,34(3):349 - 352。10.1007 / s11103 - 013 - 0137 - x。
- 51
Ono E,Wong HL,Kawasaki T,Hasegawa M,Kodama O,Shimamoto K:小GTPase Rac在水稻抗病性中的重要作用。美国国家科学院学报。2001年,98:759-764.10.1073/pnas.98.2.759。
- 52
Glazebrook J:生物营养型和坏死营养型病原体防御机制的对比。植物病理学年鉴。2005年,43:205-227.10.1146/annurev.phyto.43.040204.135923。
- 53
Kunkel BN,Brooks DM:病原体防御中信号通路间的串扰。植物生物学。2002年,5:325-331.10.1016/S1369-5266(02)00275-3。
- 54
Durrant WE,Dong X:系统获得性抵抗。植物病理学年鉴。2004年,42:185-209.10.1146/annurev.phyto.42.040803.140421。
- 55
Halim V, Eschen-Lippold L, Altmann S, Birschwilks M, Scheel D, Rosahl S:水杨酸在马铃薯抗疫病菌基础防御中起重要作用。植物与微生物的相互作用,2007,11:1346-1352。10.1094 / mpmi - 20 - 11 - 1346。
- 56
花生四烯酸可诱导马铃薯植株局部而非系统地合成水杨酸,并对马铃薯晚疫病菌(Phytophthora infestans)和茄链孢霉(Alternaria solani)产生系统抗性。中国生物医学工程学报,1995,15(1):1 - 6。
- 57
在拟南芥中,jamate和乙烯反应通路的激活是诱导植物防御素基因的必要条件。植物营养与肥料学报。1998,10(12):2103-2113。10.1105 / tpc.10.12.2103。
- 58
Spoel Sh,Koornnef A,Claessens SM,Korzelius JP,Van Pelt Ja,Mueller Mj,Buchala Aj,Métrauxjp,棕色r,kazan k,van loon lc,dong x,Pieters cm:npr1调制水杨酸盐之间的串扰通过细胞溶胶中的新功能的Jasononated Enceport途径。植物细胞。2003,15(3):760-770。10.1105 / TPC.009159。
- 59
Truman W:Arabimopsis Systemic Immunity使用保守的防御信令途径,并由Jasmonals介导。Proc Natl Acad Sci U S A. 2007,104(3):1075-1080。10.1073 / PNAS.0605423104。
- 60
关键词:拟南芥,链格孢(Alternaria brassicola),表达谱,早期响应植物营养与肥料学报,2003,22(2):1 -6。10.1104 / pp.103.022186。
- 61
Segal AW, Abo A:吞噬细胞NADPH氧化酶的生化基础。生物化学学报,1993,18:43-47。10.1016 / 0968 - 0004 (93) 90051 - n。
- 62。
Keller T,Damude Hg,Werner D,Dorerner P,Dixon Ra,Lamb C:中性粒细胞NADPH氧化酶GP91phox亚基基因的植物同源物编码血浆膜蛋白,具有Ca2 +结合基序。植物细胞。1998年,10:255-266。
- 63。
过氧化氢信号转导。中国生物医学工程学报,2002,25(5):529 - 533。10.1016 / s1369 - 5266(02) 00282 - 0。
- 64。
关键词:水稻,Rac/Rop,小GTPase,亚细胞定位,抗病性植物生理学杂志。2010,51(4):585-595。10.1093 /卡式肺囊虫肺炎/ pcq024。
- 65。
Suharsono U,Fujisawa Y,Kawasaki T,Iwasaki Y,Satoh H,Shimamoto K:水稻抗病性中,异三聚体G蛋白α亚基作用于小GTPase Rac上游。美国国家科学院学报。2002年,99(20):13307-13312.10.1073/pnas.192244099。
- 66。
GTPase Rac参与烟草对病原体的防御反应。MPMI。2005, 18(2): 116-124。10.1094 / mpmi - 18 - 0116。
- 67。
NtrbohD是一种介导烟草细胞氧化破裂的氧化酶。植物学报,2004,37(2):282-293。10.1046 / j.1365 - 313 x.2003.01957.x。
- 68.
Lambeth JD:通过蛋白质相互作用调节吞噬细胞呼吸爆发氧化酶。J Biochem mol Biol。2000,33:427-439。
- 69.
Bokoch GM, Diebold BA: Rac GTPase调控NADPH氧化酶的分子模型。血,2002,100:2692-2696。10.1182 / - 2002 - 04 - 1149血。
- 70.
高丽,屠志杰,米利特BP,布莱登JM:植物器官特异性病原防御反应的研究:马铃薯块茎晚疫病菌相互作用的RNA序列分析。BMC基因组学。2013, 14: 340-10.1186/1471-2164-14-340.
- 71.
Frank VB,EVA V,James FD,Dirk I:活性氧气种类在植物信号转导中的作用。植物SCI。2001,161:405-414。10.1016 / s0168-9452(01)00452-6。
- 72.
na r,张z,yu x,张x,杨f,zhao j:ros和水杨酸(sa)对植物品种Zihuabai的抗性建立作出的作用。j植物探索。2013,119(5/6):191-199。
- 73.
eschen - lipold L, Altmann S, Rosahl S: dl - β -氨基丁酸诱导的马铃薯对疫病菌的抗性需要水杨酸,而不是氧脂素。植物分子微生物的相互作用。2010,23(5):585-592。10.1094 / mpmi - 23 - 5 - 0585。
- 74
Dong X:NPR1,所有的东西都考虑。CurrOp植物BIOL。2004,7:547-552。10.1016 / J.PBI.2004.07.005。
- 75
油菜素甾醇介导的拟南芥的胁迫耐受性与脱落酸、乙烯和水杨酸途径相互作用。中国生物医学工程学报,2010,31(1):1- 7。
- 76
Choi J,Huh SU,Kojima M,Sakakibara H,Paek KH,Hwang I:细胞分裂素激活的转录因子ARR2通过TGA3/NPR1依赖的水杨酸信号传导促进拟南芥中的植物免疫。开发单元。2010年,19:284-295.10.1016/j.devcel.2010.07.011。
- 77
Navarro L,Bari R,Achard P,Lisón P,Nemri A,Harberd NP,Jones JD:DELLAs通过调节茉莉酸和水杨酸信号的平衡来控制植物免疫应答。电流生物学。2008年,18(9):650-655.10.1016/j.cub.2008.03.060。
- 78
马铃薯晚疫病水平抗性无性系的筛选。Wu Ha:华中农业大学;2003
- 79
HernándezJA,Ferrer Ma,JiménezA,BarcelóAR,塞维利亚F:抗氧化系统和O2。 - / H2O2在豌豆叶的血管壳中产生。它与盐诱导的小静脉诱导的坏死病变的关系。植物理性。2001,127(3):817-831。10.1104 / pp.010188。
- 80。
关键词:大豆,下胚轴,H2O2,光,二胺氧化酶,木质素植物物理学报,2005,42(2):457 - 461。10.1016 / j.jplph.2005.04.033。
- 81。
关键词:油菜,核核病,MPK4,过表达,核核病MPMI。2009, 22(3): 235-244。10.1094 / mpmi - 22 - 3 - 0235。
- 82
一种用于少量叶片组织的快速DNA分离程序。植物化学学报,1987,19:11-15。
- 83
Lennart EL、Grit R、Michael S、Göbel C、Feussner I、Rosahl S:转基因马铃薯植株中含二乙烯基醚多不饱和脂肪酸的还原。植物化学。2007年,68:797-801.10.1016/j.phytochem.2006.12.010。
承认
感谢张若芳教授(内蒙古大学马铃薯工程中心)的热情提供P. Infestans.压力。国家自然科学基金资助项目(no . 30760132, no . 31260425)。
作者信息
从属关系
通讯作者
附加信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
JZ构思和设计了实验。ZZ FY RN XZ执行了实验。SY JG分析了数据。YZ MF有助于试剂/材料/分析工具。ZZ写了这篇论文。所有作者阅读并认可的终稿。
权利和权限
开放访问本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
本文中的图像或其他第三方材料包括在文章的创作共用许可中,除非在材料的信用线中另有说明。如果材料没有包含在文章的创作共用许可证中,而您的预期使用不被法律法规允许或超过允许的使用,您将需要直接获得版权持有人的许可。
如欲浏览本许可证的副本,请浏览https://creativecommons.org/licenses/by/4.0/.
“创作共用公共领域”豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
张卓,杨峰,纳瑞。等。AtROP1负调控马铃薯对5种通过NADPH氧化酶介导的h2O.2.BMC植物BIOL.14,392 (2014). https://doi.org/10.1186/s12870-014-0392-2
收到:
公认:
发表:
关键词
- ATROP1.
- 土豆
- 电阻
- NADPH氧化酶
- 过氧化氢生产
- 茉莉酸