摘要
背景
干旱是降低农业生产力的主要非生物胁迫因素。GRAS转录因子是植物特异性蛋白,在植物发育过程中发挥多种作用。然而,在水稻中发现的许多GRAS基因的功能尚不清楚,尤其是与水稻抗旱性相关的GRAS基因尚未被研究清楚。
结果
在这项研究中,一种名为的新型克拉斯转录因子基因OsGRAS23该QTL位于水稻第4染色体抗旱QTL区间。表达OsGRAS23干旱、NaCl和茉莉酸处理诱导。融合蛋白OsGRAS23-GFP定位于烟草表皮细胞的细胞核中。酵母细胞的反式激活试验表明OsGRAS23蛋白具有很强的转录激活活性。OsGRAS23过表达的水稻植株的抗旱性和抗氧化性较好,而H2O2与野生型植物相比积累。此外,基因芯片分析显示,多个抗氧化相关基因表达上调OsGRAS23-过度表达的水稻植株。酵母单杂交试验表明,OsGRAS23能与潜在靶基因的启动子结合。
结论
我们的结果表明OsGRAS23编码胁迫应答GRAS转录因子,通过诱导一系列胁迫应答基因正向调节水稻耐旱性。
背景
干旱是降低农业生产力的一个主要环境压力因素。水稻是世界上最重要的农作物之一,它消耗了大量的淡水资源,在中国约占50%。发展节水抗旱水稻品种是实现粮食安全、防止干旱和缺水危害的有效策略[1].阐明遗传性的基础和分子机制下潜水稻的抗旱是必不可少的,对新型水稻品种的发展至关重要,改善干旱抵抗[2].
干旱和水分亏缺会降低光合能力,导致叶绿体的氧化损伤,限制代谢反应,减少干物质的积累和分配[3.].为了应对干旱,植物已经发展出了多种策略,包括发展更大更深的根系以增加土壤深处的水分吸收,调节气孔闭合以减少水分流失,积累相容性溶质和保护蛋白,以及增加抗氧化剂的水平[4].
在干旱胁迫下,植物会诱导一系列基因,这些基因的产物参与胁迫反应。这些应激反应基因的转录很大程度上是由转录因子控制的[5].在过去的几年里,已经发现了一些转录因子,它们在调节植物对逆境的反应中起着重要的作用[6].例如,包括DREB和CBF蛋白在内的AP2转录因子与脱水反应元件结合,控制应激反应基因的表达[7].过表达DREB1B和DREB1A在拟南芥分别增强了抗冻性和脱水/耐盐性[8,9].在水稻中,AP2转录激活子如OsDREB1A已经被隔离。OsDREB1A是由脱水和高盐胁迫诱导的[10]和过度表达OsDREB1A在转基因拟南芥提高压力宽容。近年来,水稻中的其他几种转录因子包括SNCA1[11],DST[12],MYB[13),而邮政编码[14,15]通过调节气孔关闭、活性氧(ROS)清除等生理过程在抗旱中发挥重要作用。尽管转录因子基因已被广泛研究,但还需要进一步的研究来确定其他参与应激反应的新转录因子。
GRAS蛋白是植物特异性蛋白,在许多高等植物中发现了类似物,如拟南芥、西红柿、矮牵牛花、大米和大麦。这个名字来源于最初确定的三个成员,GIBBERELLIN-ACID不敏感(盖),REPRESSOR G的一个1 (RGA)和年代CARECROW (SCR)[16].GRAS蛋白通常由400-770个氨基酸残基组成,在各自的c端结构域内具有相当大的序列同源性,而n端氨基酸序列则具有很大的差异[17].GRAS家族蛋白可分为几个亚家族,如DELLA、SHR、SCR、PAT、LISCL和SCL3 [18].在过去的几年里,研究表明GRAS蛋白在赤霉素信号转导、根发育、分生组织发育、光信号、生物胁迫和非生物胁迫响应等方面发挥着不同的作用[19].DELLA蛋白是目前研究最广泛的GRAS亚家族之一,它们是赤霉素(GA)响应植物生长的抑制因子,是GA信号通路的关键调控靶点[20- - - - - -22].DELLAs还被发现分别通过与JAZ1蛋白(JA信号的关键抑制因子)和光响应转录因子PIFs的相互作用,参与植物对茉莉酸(JA)信号和光信号的响应[23- - - - - -25].
一般来说,GRAS蛋白被假设为转录因子;然而,目前只有少数的报道,如关于LISCL和NSP1/NSP2 [26- - - - - -28,表明GRAS蛋白是典型的转录因子,具有转录激活活性,可直接与DNA结合。
在水稻中至少有57个GRAS基因,其中有几个基因,比如MOC1,SLR1型,可控硅,DLT.,OsGRAS19[29- - - - - -33,而其他GRAS基因在水稻中的功能尚不清楚。
在这工作,OsGRAS23,分离到一个定位于水稻抗旱QTL区间的GRAS基因。研究了其在水稻抗旱性中的表达模式和功能。人们发现OsGRAS23通过渗透胁迫诱导,该基因的过表达增强了转基因水稻的抗旱性。该蛋白具有反式激活活性,可与假定靶基因的启动子结合。这些结果表明OsGRAS23蛋白作为转录因子参与了干旱胁迫的响应。
结果
OsGRAS23编码一个GRAS蛋白,属于liscll亚家族
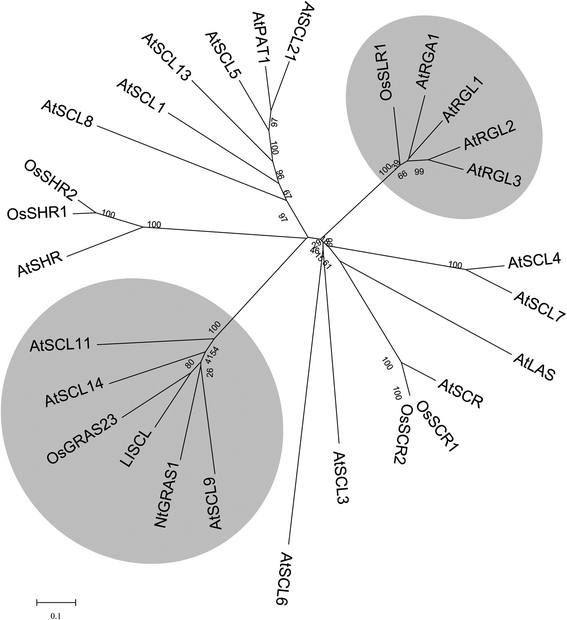
本研究利用旱稻IRAT109和水稻珍山97b的RIL群体进行水稻抗旱qtl定位。34].在4号染色体上选择了一个包含多个抗旱QTL的QTL区间进行进一步研究。通过生物信息学和基因表达谱分析,筛选出该QTL区间的一些关键候选基因[35]; 其中,从旱稻中分离到一个编码GRAS转录因子的候选基因OsGRAS23(注册号:NM001060241.1)[18].氨基酸序列比对分析表明,OsGRAS23具有典型的GRAS结构域,其c端包含LEUCINE HEPTAD、VHIID、PFYRE和SAW基序(附加文件)1:图S1)。系统发育分析表明,含有LISCL分支的OsGRAS23类群拟南芥同源基因AtSCL9和AtSCL14(图。1).
GRAS家族和OsGRAS23代表成员的分子系统发育树。蛋白质主要来自拟南芥和水稻,等等。利用MEGA5软件进行序列比对和系统发育树构建。DELLA和LISCL分支用灰色的盒子表示。拟南芥信息资源中的蛋白质登录数(www.arabidopsis.org)和GenBank数据库如下:AtSCL1、AT1G214520;AtSCL3 AT1G50420;AtSCL5 AT1G50600;AtSCL6 AT4G00150;AtSCL7 AT3G50650;AtSCL8 AT5G52510;AtSCL9 AT2G37650;AtSCL11 AT5G59450;AtSCL13 AT4G17230;AtSCL14 AT1G07530; AtSCL21, AT2G04890; AtSHR, AT4G37450; AtSCR, AT3G54220; AtLAS, AT1G55580; AtPAT1, AT5G48150; AtRGA, AT2G01570; AtRGL1, AT1G66350; AtRGL2, AT3G03450; AtRGL3, AT5G17490; OsSHR1, A2YN56.1; OsSHR2, A2XIA8.1; OsSLR1, AC087797.5; OsSCR1, A2ZAX5.2; OsSCR2, A2ZHL0.2; OsGRAS23, NP_001053706; LISCL, BAC77269; and NtGRAS1, ABE02823.1
的表达模式OsGRAS23
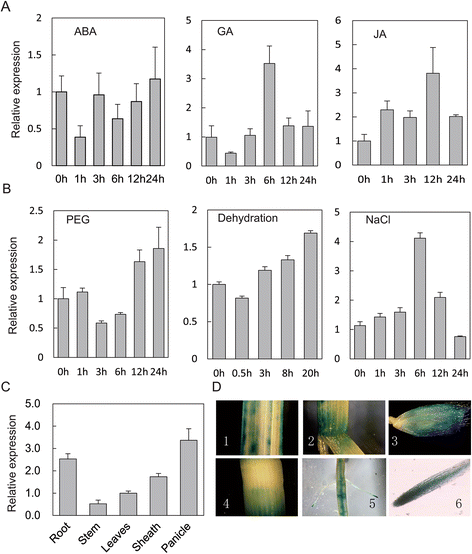
研究和预测OsGRAS23利用实时荧光定量RT-PCR研究了不同胁迫和激素处理下其表达模式。如图所示。2,表示OsGRAS23聚乙二醇(PEG)、脱水、盐处理、赤霉素和茉莉酸处理显著诱导水稻叶片生长。
组织表达模式OsGRAS23β-葡萄糖苷酸酶(GUS)结构在OsGRAS23启动子。对转基因水稻植株进行染色后,在根尖和穗中检测到较强的GUS信号。在茎和叶中也有GUS信号,但信号较弱。二维).Real-time PCR进一步证实OsGRAS23水稻穗和根的表达高于茎和叶(图。2厘米).
的分子特征OsGRAS23 -过表达转基因水稻植株
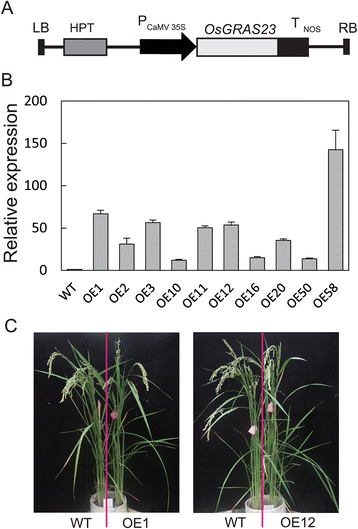
目的:研究黄芪多糖的生物学功能OsGRAS23,转基因水稻植株过表达OsGRAS23在CaMV35S启动子的控制下,产生了CaMV35S启动子。3A级).实时PCR分析表明表达水平OsGRAS23在这些转基因水稻植株中显著高于野生型(WT) Zhonghua11(ZH11)植株(图1)。3B级). 形态无明显差异(图。3摄氏度)和转基因植株成年期的农艺性状(数据未显示)。
过表达OsGRAS23提高转基因水稻植株对干旱和氧化胁迫的耐受性
为了进一步确定OsGRAS23在植物胁迫响应中的作用,我们对转基因水稻和WT植株进行了不同的胁迫处理。
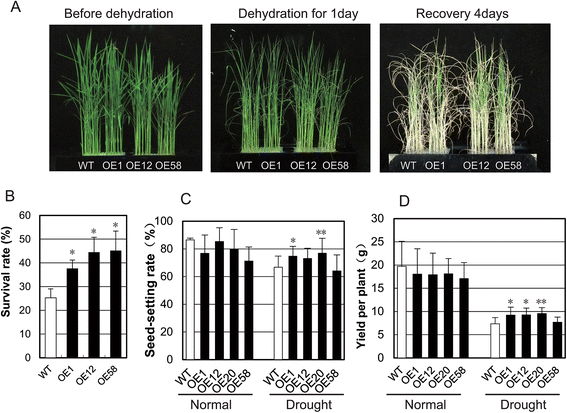
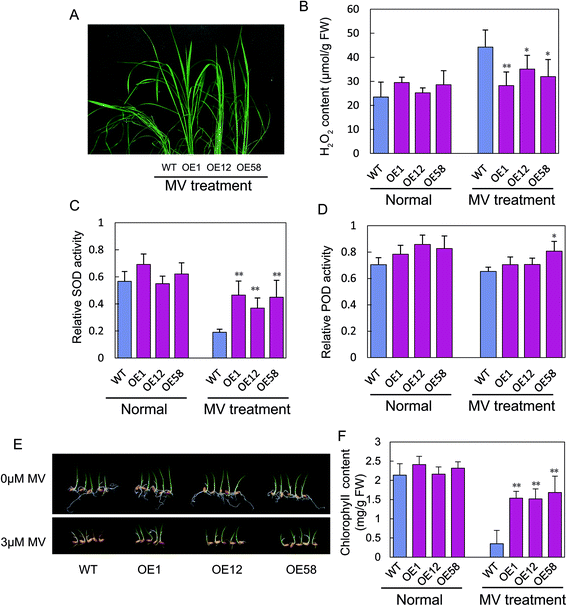
在脱水应激条件下,OsGRAS23与野生型相比,过表达水稻植株的萎蔫程度较低,恢复能力较好(图1)。4), 37%至45%OsGRAS23-过度表达的植株恢复了,明显高于野生型植株(图。4 b).当在后续分蘖阶段的干旱胁迫下在水稻田中生长,种子设定率和产量OsGRAS23-过表达株系(OE1和OE20株系)显著高于野生型株系(图1)。4 c和D).这些结果表明过表达OsGRAS23可提高转基因水稻的抗旱性。
幼苗的WT和OsGRAS23- 也用30μM甲基Violologen(MV)处理,其是氧化应激诱导剂的30μM甲基Viologen(MV)处理,以确定对氧化应激的耐受性。治疗24小时后,WT水稻植物的潜水者比OsGRAS23-过度表达的植物(图。5).生理分析表明,在MV处理下,转基因水稻植物积累了较少的H.2O2与野生型相比,具有较高的超氧化物歧化酶(SOD)和过氧化物酶(POD)活性(图。5C和D).类似地,在3μmmV处理4天后,WT植物显示出比OSGRAS23过表达植物更严重的光学表型(图。5 e),WT植物的叶片中的叶绿素含量显着低于转基因植物的叶片(图。5 f).这些结果表明OsGRAS23增强了转基因水稻植株的ROS清除能力和对氧化胁迫的耐受能力。
在酵母细胞中具有转录激活活性的OsGRAS23定位于烟草表皮细胞细胞核中
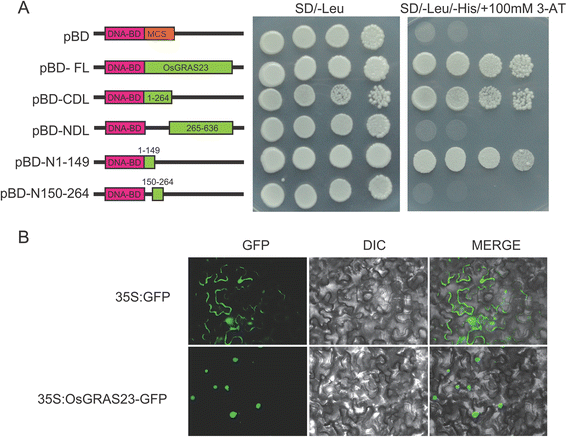
据报道LISCL定位于细胞核,在酵母和植物细胞中具有转录激活活性[26].为了确定OsGRAS23蛋白的亚细胞定位,我们构建了CAMV35S启动子控制下由OsGRAS23编码区和绿色荧光蛋白(GFP)组成的嵌合基因。根癌土壤杆菌将携带OsGRAS23的GFP或GFP构建体渗入烟草叶片,并在入渗后第2天观察GFP。仅用空GFP载体转化的烟草表皮细胞在整个细胞内显示荧光。然而,在表达OsGRAS23–GFP结构的细胞中,发现荧光定位于细胞核(图。6 b).结果表明OsGRAS23蛋白是核定位蛋白。
为了评估OSGRAS23蛋白作为转录因子的功能,将OSGRAS23的全长融合到GAL4的DNA结合结构域并引入酵母MAV203细胞中。如图。6结果表明,OsGRAS23全长可强烈诱导报告基因的表达,表明OsGRAS23蛋白具有转录激活活性。通过检测酵母中OsGRAS23不同部分片段的转录激活活性,进一步鉴定了OsGRAS23的转录激活基序。与前面的命题一致[17[OSGRAS23的N末端中的相对保守的基序(NI)具有强型反式激活活性;而C末端GRAS结构域显示出明显的反式激活活性(图。6).结果表明,OSGRAS23蛋白是推定的转录因子,并且OSGRAS23的N-末端区域是转录激活所必需的。
OsGRAS23调控应激反应基因,并与几个假定靶基因的启动子结合
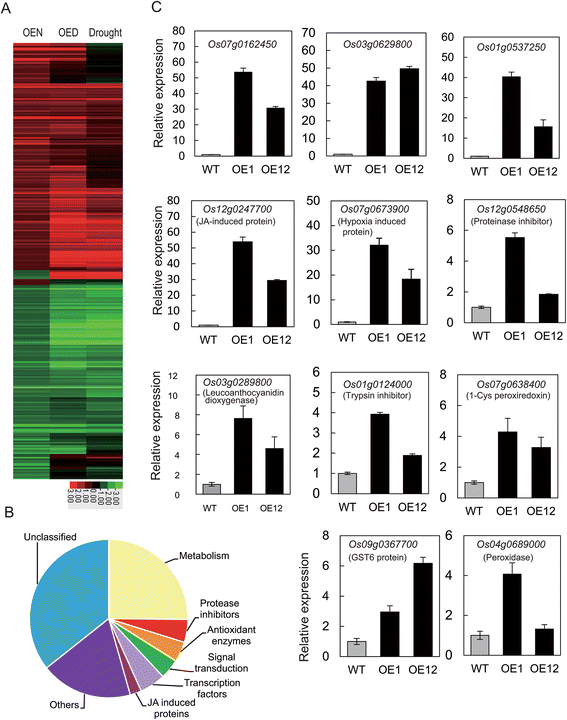
寻找OsGRAS23的下游基因,对其进行基因表达谱分析OsGRAS23利用Affymetrix水稻基因组基因芯片分析过表达植株和WT植株。结果表明,有175个基因表达上调(倍数> 2),160个基因表达下调(倍数< 0.5)OsGRAS23-过表达植物与WT植物在正常条件下(附加文件2:表S1)。在上调的基因中,有76个基因在WT水稻中也被干旱胁迫诱导,这表明OsGRAS23上调的这些基因可能参与了干旱响应(图1)。7一个).这些上调的基因编码具有多种功能的蛋白,如转录因子、JA诱导蛋白、蛋白酶抑制剂和抗氧化酶(图)。7 b).
为了进一步证实芯片结果,我们采用qRT-PCR分析了几个上调基因的转录水平。结果与芯片检测结果一致。表达明显上调的基因(即。Os07g0162450, Os03g062980,Os01g0537250)高度诱导OsGRAS23-overexpressing线。其他与抗氧化和防御反应相关的基因的表达。Os04g068900编码过氧化物酶;OS07G0638400.编码的酶类;Os09g036770编码glutathione-s-transferase(销售税);Os03g0289800编码白藻霉素二恶英酶;和Os12g0548650和Os01g0124000编码蛋白酶抑制剂)OsGRAS23-过表达株系也显著高于WT株系(图5)。7 c).这说明OsGRAS23可能正调控这些基因的转录。
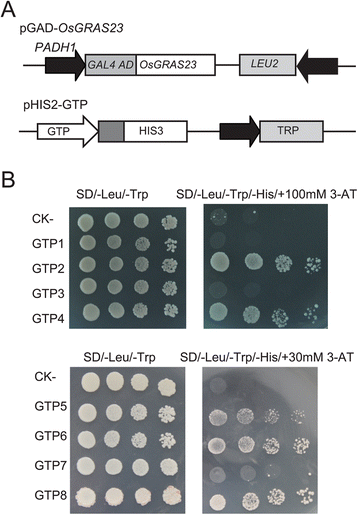
在微阵列分析的基础上,选择8个上调基因,通过酵母单杂交实验确定OsGRAS23蛋白是否能与这些基因的启动子区结合。pga -OsGRAS23质粒(含有OsGRAS23的dna结合域与GAL4激活域融合)和报告构建的pHIS-cis(8个假定靶基因的1.2 kb启动子)共转化到酵母株Y187(图1)。8).如报告基因的激活所示,OSGRAS23可以与几种基因的启动子结合(Os03g062980,Os01g0537250,Os07g0673900型编码缺氧诱导蛋白;Os04g0173800编码外源凝集素前体;和Os03g0289800编码无色花青素双加氧酶)(图。8 b).这些结果提示OsGRAS23具有DNA结合活性,可能直接调控这些靶基因的表达。
用酵母单杂交方法鉴定OsGRAS23调控的可能靶基因。一个酵母表达载体pGAD-OsGRAS23和报告载体pHIS2.1-GTP (OsGRAS23假定的target基因p罗马特)。bSD / -LEU-/ TRP / -HIS培养基上的转化体的生长性能含有100mm或30mm 3-at。GTP1-GTP8表示PGAD-OSGRAS23加pHIS2.1-CIS(启动子Os07g0162450,Os01g0537250,OS07G0638400.,Os03g0629800、Os04g0173800、Os03g0289800、Os06g0513781,和Os07g0673900分别在pHIS2.1)。ck-:阴性对照(pGADT7-rec2-OsGRAS23 + p53HIS2.1)
讨论
OsGRAS23编码干旱反应性GRAS蛋白
胁迫相关基因的转录调控是植物逆境响应的关键步骤之一,转录因子在这一过程中发挥着重要作用[36].例如,渗透胁迫激活了几个转录因子,包括NAC蛋白,它激活了对脱水的早期反应1 (ERD1) [37]. 一些bZIP蛋白被认为是ABA应答转录因子(AREB/ABF),与ABRE结合,在ABA依赖的基因激活中起着关键作用[38- - - - - -40]. 还有许多转录因子,特别是新型转录因子尚未被详细研究。在本研究中,OsGRAS23蛋白被鉴定为一种新的参与水稻非生物胁迫反应的GRAS转录因子。
GRAS蛋白是植物特异性蛋白,大量报道表明其在植物生长发育和激素信号转导中起着重要作用。然而,关于GRAS蛋白参与非生物胁迫的报道相对较少。在这项研究中,OsGRAS23从水稻中分离得到,属于LISCL亚家族,与NtGRAS1、SCL9和SCL14同源(图。1).以前的研究表明,非生物应激诱导了这些基因的表达[41,42].已经发现SCL14在植物胁迫反应中起着重要的作用[43].OSGRAS23与这些蛋白质之间的紧密遗传关系表明OSGRAS23也可能在植物非生物应激反应中发挥作用。
表达OsGRAS23(Fig. 4)2).JA和GA激素也能诱导表达,而ABA没有诱导表达OsGRAS23.此外,促进OsGRAS23包含热胁迫响应元件、参与meja响应的顺式调控元件、ga响应元件和其他参与胁迫和植物激素响应的顺式元件,使用PlantCARE进行预测(数据未显示)。这些结果表明,OsGRAS23是一种胁迫响应GRAS蛋白,可能参与植物对非生物胁迫(如干旱)和植物激素信号传导(如JA)的响应。
OsGRAS23蛋白作为GRAS转录因子发挥作用
一些先前的特征GRAS蛋白通过与其他蛋白在信号转导途径中相互作用而发挥作用,并被发现参与转录调控。调控可分为两种类型:转录辅助调控或转录因子[17].当用作转录因子时,几种GRAS蛋白,例如LISCL和NSP,具有型逆激活活性,并且能够直接与酵母或植物细胞中的测定指示的DNA结合[26,27,44].在本研究中,OsGRAS23蛋白与LISCL蛋白的亲缘关系非常接近(图1)。1),这表明OsGRAS23蛋白可能也是一个转录因子。进一步鉴定发现OsGRAS23蛋白主要定位于细胞核,在酵母细胞中具有明显的反式激活活性和DNA结合能力(图1)。6和无花果。8).此外,一些基因在OsGRAS23-过度表达的水稻植株,支持OsGRAS23可以积极调节下游基因的表达(图。7),这些结果证实了OSGRAS23用作转录因子的假设。
几个基因在转基因水稻中的表达量明显高于野生型水稻(图1)。7),强烈建议这些基因可以通过OSGRAS23直接调节。酵母一种杂交测定进一步证实了OSGRAS23蛋白可以直接与几个上调基因的启动子结合,例如Os03g0289800它们编码了白藻藻酰胺二恶英酶(图。8 b).然而,研究发现OsGRAS23不能与ROS清除酶编码基因的启动子结合(例如:OS07G0638400.),这表明这些与抗氧化活性相关的基因是由OsGRAS23间接调控的。
GRAS蛋白一般在c端包含保守的GRAS结构域,而n端则相对无序。先前的生物信息学研究表明,n端重复疏水/芳香残基侧翼酸性残基的基序丰富度可能与转录激活有关[17]. 而先前的研究则认为NSP1/NSP2和LISCL的N末端是主要的反式激活结构域[26,27].在该研究中,OSGRAS23的N-末端结构域也负责逆激活活性。进一步的分析发现,主要的反式激活图案是第一个保守的基序(Ni),但不是第二个图案(NiI)(图。6),与LISCL蛋白类似。
OsGRAS23通过上调胁迫响应相关基因正向调控水稻的耐旱性
一些研究发现GRAS蛋白参与了非生物应激反应。PeSCL7最近被隔离了Populus Euphratica Oliv,其过度表达拟南芥显示出更好的抗旱和耐盐能力[45].NtGRAS1在干旱、盐胁迫和H2O2治疗(41].DELLA蛋白也参与ROS反应[46]和非生物胁迫中的发育协调[47].在这里,过度的OsGRAS23赋予转基因水稻对干旱胁迫和氧化应激的增强抗性(图。4和无花果。5),为在稻稻糜应激反应中运作的克拉斯蛋白质提供新的证据。
OsGRAS23作为一个公认的转录因子,可能通过调控下游基因的转录参与植物对逆境的响应。芯片分析显示,在过表达osgras23的水稻植株中,一些干旱诱导的基因确实是上调的。7一个和额外的文件2:表S1)。上调基因编码调节和功能性蛋白质,例如转录因子,蛋白激酶,抗氧化剂,蛋白酶抑制剂和与代谢相关的酶(图。7 b和额外的文件2:表1)。这些基因的同源物被报道在植物的胁迫耐受中发挥作用。例如,活性氧清除酶,包括过氧化物酶、过氧化物酶和谷胱甘肽- s -转移酶,已被证实能够减轻氧化损伤,提高植物的抗逆性[48- - - - - -51].活性氧清除酶(SOD和POD)活性增加,H2O2在氧化胁迫下过表达osgras23的植株中表达量减少(图。5),进一步说明转基因植物清除活性氧能力的增强可能是转基因植物抗旱性增强的部分原因。蛋白酶抑制剂,如Bowman Birk胰蛋白酶抑制剂,也被发现可能通过抑制胁迫缓解蛋白的降解来授予植物胁迫耐受性[52,53]. 白细胞花青素双加氧酶参与黄酮类化合物花青素的生物合成[54];以前的研究表明,黄酮类化合物与植物应激适应有关[55].我们还注意到转基因植物中一些编码凝集素前体、蛋白酶抑制剂和JA诱导蛋白的基因被上调,这表明OsGRAS23可能也参与了JA介导的防御反应。综上所述,OsGRAS23增加了与胁迫响应相关的基因的转录(特别是抗氧化和蛋白质保护),并正向调节水稻的耐旱性。
结论
我们分离了一个水稻的GRAS基因,OsGRAS23,从一个水稻抗旱性QTL区间及其功能进行了表征。干旱、NaCl、JA和GA处理均能诱导细胞表达OsGRAS23.OsGRAS23蛋白定位于细胞核,具有较强的转录激活活性。此外,OsGRAS23蛋白可以结合多个靶基因的启动子,调控一系列应激相关基因的表达。过表达OsGRAS23对转基因水稻进行抗旱性改良。因此我们可以得出这样的结论OsGRAS23编码新的应激响应性GRAS转录因子,并积极调节水稻干旱应激反应。
方法
植物材料、胁迫处理和基因表达模式分析
分析的表达模式OsGRAS23,旱稻品种IRAT109的幼苗(粳稻),分别以20% (m/v) PEG6000处理,脱水处理,100 mM NaCl,然后在指定的时间取样。在植物激素处理中,将0.1 mM ABA、JA和GA分别喷施于幼苗上,同时将根系浸入溶液中。
用TRNzol试剂(TIANGEN)提取总RNA,用PrimerScript逆转录酶(TaKaRa)合成cDNA。采用Bio-Rad CFX96 Real- time PCR检测系统(Bio-Rad)在96孔板上进行实时定量PCR,使用SYBR预混物Ex Taq (TaKaRa)进行检测。反应流程为:95°C 60s, 94°C 15s, 62°C 60s,循环40次。以水稻肌动蛋白基因为内参基因,对目的基因的表达进行归一化处理,并采用相对量化方法(2-ΔΔct).
载体构建与水稻转化
的全长cDNAOsGRAS23从陆地稻IRAT109的cDNA中扩增,克隆到pMD-18t载体中测序。本研究中使用的引物在附加文件中列出3.S2:表。采用Clutal W对GRAS蛋白序列进行比对,采用MEGA5.1的邻位连接法构建系统发育树。的全长cDNAOsGRAS23消化了Xba我和BstE二、 然后连接到植物表达载体pCAMBIA1323中,用相同的酶消化。因此,OsGRAS23是由CaMV35S启动器驱动的。
基因上游1.3 kb启动子序列OsGRAS23从伊拉特109的基因组DNA分离预测的ATG密码子。对于组织表达模式分析,在消化后在PBI121中的GUS报告基因的上游旋转启动子Bam嗨Kpn我。
控件中引入了这两种构造粳稻水稻中华11号(ZH11)经农介导的转换方法。在含潮霉素的Murashige和Skoog (MS)培养基上选择转基因水稻植株。通过PCR对转基因水稻植株进行初步鉴定OsGRAS23已成功集成到水稻基因组中。
调查OsGRAS23组织中的表达模式,积极的亲OsGRAS23:对GUS转基因水稻进行取样,并使用上述组织化学染色方法进行染色[56].
测试是否OsGRAS23在OsGRAS23-过表达水稻植株,进行实时定量RT-PCR,并测定表达量OsGRAS23在转基因水稻中,计算方法如上所述。
子蜂窝定位
为了研究OsGRAS23蛋白的亚细胞定位,研究了其全长OsGRAS23克隆到植物表达载体pCAMBIA1300EGFP中Xba我和Bam嗨,使OSGRAS23能够与GFP融合。将GFP融合向量转化为农菌株EHA105及其转化农杆菌是叶子渗入的吗烟草benthamiana上文所述的植物[57].农渗植株生长48 h后,在徕卡荧光显微镜下观察GFP荧光。
酵母菌细胞反式活化试验
研究了OsGRAS23在酵母细胞中的反式活化活性。的全长、n端截断片段和c端截断片段OsGRAS23通过重组反应(Invitrogen)将酵母GAL4 DNA结合结构域分别与叶片GAL4 DNA结合结构域分开融合到框架中。将不同的构建体单独引入酵母菌菌株MAV203(MATα; LEU2-3,112; TRP1-901; HIS3D200; ADE2-101; GAL4D; GAL80D; SPAL10 :: URA3; GAL1 :: LACZ; HIS3UASGAL1 :: HIS3 @ LYS2; CAN1R;使用乙酸锂方法和转化体在SD / -LEU培养基中选择CyH2R; Invitrogen。通过在补充有不同浓度的3-氨基-1,2,4-三唑(3- at)的SD / -LEU / -HIS培养基上的SD / -LEU / -HIS培养基进行阳性转化体。
植物材料的胁迫处理及生理测定
在所有胁迫处理中,T3过表达系的种子在添加50 mg/L潮霉素的MS培养基上萌发,WT种子在MS培养基中生长。在脱水处理中,将发芽最均匀的种子播种在去掉底部的96孔板中。在16小时光照(28°C)/8小时黑暗(24°C)光周期/温度旋转的生长室内液体培养液中生长。然后将21日龄幼苗移栽到滤纸上,进行脱水胁迫处理。WT植株枯萎后,全部转入正常培养液中。
在温室水田进行了穗发育期(~开花前2周)干旱胁迫试验。干旱胁迫的开始和发展是通过停止供水,直到所有的叶子都卷起来(枯萎),然后水稻植株通过重新灌溉恢复原状。
氧化剂应力处理和ROS相关生化测定
如上所述,在96孔板中播种T3转基因系并在培养溶液中生长。此后,将21天龄幼苗转移到补充有30μM甲基Viologen(MV)的培养溶液中,并生长24小时。为ROS相关生化分析收获叶子。
H2O2根据前面描述的方法从叶子中提取[58]和H2O2使用Amplex Red过氧化氢/过氧化物酶检测试剂盒(分子探针)按照制造商的说明进行生产。采用生理盐缓冲液提取可溶性蛋白,采用南京建成生物工程研究所(中国江苏)的试剂盒测定SOD、POD和过氧化氢酶(CAT)活性,测定ros清除酶活性。
对于另一氧化胁迫试验,将发芽的WT和转基因系的种子转移到含3μmmV的培养溶液中并生长四天。然后测量叶绿素含量如先前描述的[59].
微阵列分析,qRT-PCR,酵母一个杂种
收获WT和osgras23过表达水稻21日龄幼苗进行微阵列分析。采集一半植株作为未处理对照,另一半植株转移到滤纸上诱导干旱胁迫,当WT植株的叶片开始滚动时采集RNA进行分离。进行2个生物重复(每个重复20株幼苗)。用TRizol试剂提取总RNA。对于微阵列分析,实验程序遵循Affymetrix GenChip服务(基因生物技术)的标准协议。数据采用稳健多芯片分析(RMA)算法进行分析,采用Parterk Genomics Suite 6.5的默认分析设置和全局缩放作为归一化方法。选择转基因水稻植株与WT植株之间的差异表达基因,其变化倍数高于2倍(上调)或小于0.5倍(下调)。实时定量RT-PCR证实了部分明显上调的基因的表达。
在上调的基因中,八个基因(即Os07g0162450,Os01g0537250,Os03g0629800,OS07G0638400.,Os06g0513781,Os07g0673900型,Os04g0173800,Os03g0289800)作进一步分析。从IRAT109基因组DNA中克隆了这些可能靶基因的上游1.2 kb启动子。对于酵母单杂交,启动子序列克隆到酵母表达载体pHIS2.1Sma我和EcoR我的网站。共转化酵母Y187 (MATa;ura3-52;his3 - 200;ade2 - 101;trp1 - 901;leu2-3, 112;gal4D;gal80D;遇见,; URA3::GAL1 UAS-GAL1 TATA-LacZ; MEL1; Clontech) with the pGADT7-Rec2-OsGRAS23生成OsGRAS23和GAL4反式激活域融合蛋白的载体。通过转化子在SD/-Leu/-Trp/-His培养皿上的生长来测定dna -蛋白相互作用。
支持数据的可用性
支持本文结果的微阵列数据可在NCBI基因表达式omnibus存储库中获得(http://www.ncbi.nlm.nih.gov/geo/),注册号为GSE64576。
系统发育分析的数据可在TreeBASE (http://purl.org/phylo/treebase/phylows/study/TB2:S17663)
缩写
- 遗传算法:
-
赤霉素
- JA:
-
茉莉酸
- ROS:
-
活性氧
- SOD:
-
超氧化物歧化酶
- 圆荚体:
-
过氧化物酶
- 销售税:
-
Glutathione-s-transferase
- MV:
-
甲基紫罗碱
- 格斯:
-
β-葡萄糖醛酸酶
- WT:
-
野生型
- OE:
-
超表达
参考文献
- 1.
lu lj。中国节水和干旱耐水稻(WDR)的育种。J Exp Bot。2010; 61(13):3509-17。
- 2.
[11]胡辉,熊磊。抗旱作物的基因工程与育种。植物生物学杂志。2014;65:715-41。
- 3.
Farooq M, Wahid A, Lee DJ, Ito O, Siddique KHM。水稻抗旱性研究进展。植物科学学报,2009;
- 4.
Chaves MM, Maroco JP, Pereira JS。了解植物对干旱的反应——从基因到整个植物。植物生物学杂志。2003;30(3):239-64。
- 5.
Hirayama T,Shinozaki K.在基因组时代植物非生物应激反应研究:过去,现在和未来。工厂J.2010; 61(6):1041-52。
- 6.
辛格kb,foley rc,onate-sanchez l.植物防御和压力反应中的转录因子。CurrOp植物BIOL。2002; 5(5):430-6。
- 7.
低温和脱水的分子响应:两种应激信号通路的差异和交叉对话。植物生物学杂志。2000;3(3):217-23。
- 8.
Gilmour SJ, Sebolt AM, Salazar MP, Everard JD, Thomashow MF。拟南芥CBF3转录激活因子的过表达模拟了与冷驯化相关的多种生化变化。植物杂志。2000;124(4):1854 - 65。
- 9.
关键词:胁迫诱导转录因子,植物,抗旱性,耐盐性生物科技Nat》。1999;17(3):287 - 91。
- 10。
杜布泽等[j]。水稻OsDREB基因编码转录激活因子,在干旱、高盐和冷响应基因表达中发挥作用。植物j . 2003; 33(4): 751 - 63。
- 11
胡红红,戴mq,姚建林,肖伯忠,李兴华,张秋芳,等。过表达NAM、ATAF和CUC (NAC)转录因子可以提高水稻的抗旱性和耐盐性。中国科学:地球科学,2006;
- 12
黄晓燕,超达元,高建平,朱敏贞,石敏,林慧霞。一种未知的锌指蛋白,DST,通过气孔控制调控水稻的干旱和耐盐性。基因Dev。2009;23(15):1805 - 17所示。
- 13
戴晓燕,徐玉英,马庆斌,徐文英,王涛,薛玉斌,等。一个R1R2R3 MYB基因OsMYB3R-2的过表达增加了转基因拟南芥对冰冻、干旱和盐胁迫的耐受性。植物杂志。2007;143(4):1739 - 51。
- 14
向勇,唐宁,杜辉,叶海燕,熊丽珍。OsbZIP23作为基本亮氨酸Zipper转录因子家族的关键成员,在水稻脱落酸敏感性、盐性和耐旱性方面具有重要作用。植物杂志。2008;148(4):1938 - 52。
- 15.
关键词:水稻,转录因子OsbZIP46,转录激活,抗旱性植物杂志。2012;158(4):1755 - 68。
- 16.
Pysh LD, wysoka - diller JW, Camilleri C, Bouchez D, Benfey PN。拟南芥GRAS基因家族:稻草人样基因的序列表征和基本表达分析。植物j . 1999; 18(1): 111 - 9。
- 17.
孙晓丽,薛斌,Jones WT, Rikkerink E, Dunker AK, Uversky VN。植物王国的功能需要展开:本质上紊乱的GRAS蛋白的n端结构域参与植物发育过程中的分子识别。中国生物医学工程学报,2011;
- 18.
关键词:水稻,拟南芥,GRAS基因家族,全基因组分析中国生物医学工程学报,2004;
- 19.
植物GRAS蛋白在植物信号转导和发育中的作用。足底。2004;218(5):683 - 92。
- 20.
Peng J, Carol P, Richards DE, King KE, Cowling RJ, Murphy GP,等。拟南芥GAI基因定义了一个负调控赤霉素反应的信号通路。基因Dev。1997;11(23):3194 - 205。
- 21。
赤霉素受体GID1对DELLA的识别具有重要意义。自然。2008;456(7221):459 - 63。
- 22。
Schwechheimer C.了解甘草酸信号 - 我们是否有?CurrOp植物BIOL。2008; 11(1):9-15。
- 23
acta photonica sinica, 2011, 41(5): 689 - 693 .冯绍峰,Martinez C, Gusmaroli G,王颖,周杰,王峰,等。光和赤霉素对拟南芥发育的协调调控。大自然。2008;451(7177):475 - 9。
- 24
De Lucas M,Daviere JM,Rodriguez-Falcon M,Pontin M,Iglesias-Pedraz JM,Lorrain S等人。浅色和胃纤维蛋白控制细胞伸长的分子框架。自然。2008; 451(7177):480-4。
- 25
关键词:茉莉酸,信号转导,转录因子,信号转导Dev细胞。2010;19(6):884 - 94。
- 26
一种调节减数分裂相关基因表达的新型GRAS基因的分离和鉴定。中国生物医学工程杂志。2003;278(23):20865-73。
- 27.
Hirsch S, Kim J, Munoz A, Heckmann AB, Downie JA, olddroyd GED。苜蓿结瘤信号转导过程中,GRAS蛋白形成DNA结合复合物诱导基因表达。植物细胞。2009;21(2):545 - 57。
- 28.
Smit等[1]对该方法的应用进行了研究。GRAS蛋白家族的NSP1是根瘤菌Nod因子诱导转录所必需的。科学。2005;308(5729):1789 - 91。
- 29.
李晓燕,钱强,付志明,王永红,熊广生,曾丽玲,等。水稻分蘖控制。大自然。2003;422(6932):618 - 21所示。
- 30.
池田A、Ueguchi-Tanaka M、Sonoda Y、Kitano H、Koshioka M、Futsuhara Y等。细长水稻是一种构成型赤霉素反应突变体,是由高度调节基因GAI/RGA/RHT/D8的同源SLR1基因的一个空突变引起的。植物细胞。2001;13(5):999 - 1010。
- 31.
关键词:水稻,非对称细胞分裂,稻草人基因,水稻abstract:植物j . 2003; 36(1): 45 - 54。
- 32.
佟海宁,金勇,刘文斌,李峰,方静,尹永红,等。矮秆低分蘖是GRAS家族的新成员,在水稻油菜素内酯信号转导中起着积极的作用。植物j . 2009; 58(5): 803 - 16。
- 33。
Chen L,Xiong G,Cui X,Yan M,Xu T,Qian Q等。OSGRAS19可以是在水稻中铜鳞状信号传导途径中涉及的新组分。莫尔植物。2013; 6(3):988-91。
- 34。
邹GH,梅哈威,刘海,刘加,胡sp,yu xq等。水稻人群中水分制度的谷物产量反应:特征和遗传标志物之间的关联。Al Appl Genet。2005; 112(1):106-13。
- 35
曾浩,罗璐,张伟,周杰,李忠,刘辉,等。PlantQTL-GE:一个通过基因表达和QTL信息鉴定水稻和拟南芥候选基因的数据库系统。核酸研究2007;35(数据库版):D879-882。
- 36
关键词:干旱,低温胁迫,基因表达,调控网络植物生物学杂志。2003;6(5):410-7。
- 37
Tran LSP,Nakashima K,Sakuma Y,Simpson SD,Fujita Y,Maruyama K,等。拟南芥应激诱导NAC转录因子的分离与功能分析与早期响应脱水应激1启动子结合干旱响应顺式CIS元素的转录因子。植物细胞。2004; 16(9):2481-98。
- 38
崔H,洪俊,哈俊,姜俊,金世贤。abf是aba反应元件结合因子家族。中华医学杂志。2000;275(3):1723-30。
- 39.
Uno Y,Furihata T,Abe H,Yoshida R,Shinozaki K,Yamaguchi-Shinozaki K. Arabidopsis基本亮氨酸Zipper转录因子涉及干旱和高盐度条件下的脱钙依赖性信号转导途径。PROC NATL ACAD SCI U S A. 2000; 97(21):11632-7。
- 40.
Kang JY, Choi HI, Im MY, Kim SY。拟南芥碱性亮氨酸拉链蛋白介导应激性脱落酸信号转导。植物细胞。2002;14(2):343 - 57。
- 41.
Czikkel BE, Maxwell DP。NtGRAS1是烟草中应激诱导的新的GRAS家族成员,定位于细胞核。植物生理学杂志。2007;164(9):1220-30。
- 42.
李浩,金波,宋世凯,何乔,于妮,李莎,等。拟南芥GRAS基因家族的大规模分析。植物分子生物学。2008;67(6):659–70.
- 43.
拟南芥GRAS蛋白SCL14与II类TGA转录因子相互作用,对胁迫诱导启动子的激活至关重要。植物细胞。2008;20(11):3122 - 35。
- 44.
Hirano K, Kouketu E, Katoh H, Aya K, Ueguchi-Tanaka M, Matsuoka M.水稻DELLA蛋白SLR1的抑制作用依赖于其转录激活活性。植物j . 2012; 71(3): 443 - 53年。
- 45。
马海生,梁丹,帅平,夏晓丽,尹文伟。盐和干旱诱导的杨树GRAS蛋白SCL7赋予拟南芥盐和干旱耐受性。实验机器人。2010;61(14):4011-9。
- 46。
植物della通过降低活性氧水平来抑制生长和促进逆境生存。当代生物学。2008;18(9):656 - 60。
- 47
李建平,陈建平,陈建平,等。整合植物对环境激活植物激素信号的反应。科学。2006;311(5757):91 - 4。
- 48
活性氧:代谢、氧化应激和信号转导。植物生物学杂志。2004;55:37 - 39。
- 49
Mittler R,Vanderauwera,Gollery M,Van Breusegem F.植物反应性氧基因网络。趋势植物SCI。2004; 9(10):490-8。
- 50。
Kim YH, Kim CY, Song WK, Park DS, Kwon SY, Lee HS,等。甘薯swpa4过氧化物酶的过表达增加了烟草的过氧化氢产量,增强了烟草的胁迫耐受性。足底。2008;227(4):867 - 81。
- 51.
关键词:转基因烟草,谷胱甘肽s -转移酶,谷胱甘肽过氧化物酶,抗逆性植物生理学杂志。2000;41(11):1229-34。
- 52.
Xiao B,Xiong L.应力响应蛋白酶抑制基因的表征在水稻中改善抗旱性的阳性作用。Planta。2007; 226(1):73-85。
- 53.
Srinivasan T, Kumar KR, Kirti PB。在转基因烟草中,胰蛋白酶蛋白酶抑制剂的组成性表达提供了多重胁迫耐受性。植物生理学杂志。2009;50(3):541-53。
- 54.
Abrahams S,Lee E,Walker AR,Tanner GJ,Larkin PJ,Ashton AR.拟南芥TDS4基因编码白细胞花青素双加氧酶(LDOX),对原花青素合成和液泡发育至关重要。植物J。2003;35(5):624–36.
- 55.
黄酮类化合物的生物合成及其胁迫效应。植物生物学杂志。2002;5(3):218-23。
- 56.
吴C,李X,元W,陈克,基拉A,李杰,等。增强子捕集线的培养型水稻基因组功能分析。工厂J. 2003; 35(3):418-27。
- 57。
刘璐,张勇,唐松,赵强,张震,张宏,等。农业渗透法检测本氏烟蛋白泛素化的高效体系。工厂j . 2010, 61(5): 893 - 903。
- 58。
茉莉酸信号调节臭氧诱导的超敏性细胞死亡。植物细胞。2000;12(9):1633 - 46。
- 59
Lichtenthaler港元。叶绿素和类胡萝卜素:光合生物膜的色素。方法Enzymol。1987;148:350 - 83。
确认
这项工作得到了中国青年自然科学基金(31100862, 31100237)、中国基础研究国家计划(2012CB114305、2010CB125901)、上海农业系统人才开发计划(SNQ2014-1-30)的资助。
感谢华中农业大学熊立忠教授、上海农业生物基因中心梅汉伟博士和余顺武博士对本文的阅读和评论。我们感谢熊立忠教授提供的酵母单杂交系统和余顺武博士对植物表达载体的构建提供的帮助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者们宣称他们没有相互竞争的利益。
作者的贡献
KX进行酵母测定,亚细胞定位,应力处理,基因表达分析并写了稿件;XFD和SJC进行了基因克隆和矢量建筑;TFL进行了大米的转化;XSM和XHL进行了田间抗旱试验;Hyl和LJL设计了实验,监督了这项工作,并协助编辑手稿。所有作者阅读并认可的终稿。
附加文件
附加文件1:图S1。
将推导出的OsGRAS23氨基酸与特征明确的GRAS家族蛋白进行比对。以上的线表明了拟议的反式激活基序(NI和NII)的位置,以及GRAS蛋白中的保守区域是之前定义的。蛋白登录号如下:AtSCL9、AT2G37650;AtSCL14 AT1G07530;AtSHR AT4G37450;阿特拉斯,AT1G55580;AtPAT1 AT5G48150;AtRGA1 AT2G01570;和OsSLR1 AC087797.5。
附加文件2:表S1。
微阵列分析OsGRAS23-overexpressing水稻。列出了与WT相比,过表达系上调大于2倍或下调低于0.5的基因。
附加文件3:表S2。
本研究使用的引物。
权利和权限
开放存取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
除非信用额度另有说明,否则本文中的图像或其他第三方材料包含在文章的创造性公共许可证中,除非信用额度另有说明。如果物品不包含在物品的创造性的公共许可证中,法定规定不允许您的预期用途或超过允许使用,您需要直接从版权所有者获得许可。
要查看本许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
“创作共用公共领域”豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于这篇文章
引用这篇文章
徐,克。,陈,斯。,李,T.等等。OsGRAS23水稻GRAS转录因子基因,通过调控胁迫应答基因的表达,参与干旱胁迫应答。BMC植物杂志15日,141(2015)。https://doi.org/10.1186/s12870-015-0532-3
收到了:
接受:
发表:
关键词
- 抗旱性
- 格拉斯
- 米
- 转录因子