抽象的
背景
野生emmer小麦的遗传结构和分化表明,遗传多样性是生态地理位理的结构。然而,关于遗传表观遗传变异的结构和程度,很少熟知其对天然群体局部适应的影响。
结果
在自然居群内和居群间评估了甲基化表观遗传变异的结构和程度小麦属植物turgidumssp.dicoccoides.利用甲基化敏感扩增多态性(methylation sensitive amplification polymorphism, MSAP)和转座子甲基化显示(transposon methylation display, TMD)技术,分别评估随机基因组CCGG位点和转座子侧位CCGG位点的甲基化状态。这两种技术都应用于从5个不同地理隔离区域收集的50份二聚体材料的DNA。为保证表观遗传变异的可遗传性,所有材料均在普通园地条件下进行2代栽培。在所有供试材料中,CCGG位点(包括te侧位的CCGG位点)的甲基化水平差异无统计学意义,且相对较高,在46 ~ 76%之间。不同种质间甲基化模式存在显著差异,群体特异性甲基化模式清晰且具有统计学意义。
结论
在这项研究中,我们观察了来自五个地理隔离地区的二粒小麦的遗传甲基化模式。我们的数据表明甲基化表观遗传多样性可能是生态地理结构,可能部分由气候和土壤因素决定。
背景
二粒小麦(小麦属植物turgidumssp.dicoccoides)是一种异源四倍体物种,具有两种不同的基因组(AA和BB),分布在近东部肥沃新月地带[1,2].二粒小麦是二粒小麦(t . turgidumssp.迪克姆),从中所有t . turgidumssp.硬质(面条小麦)t . aestivum(面包小麦)的起源。虽然最近大部分作物的产量都有所增加,但大多数重要粮食作物的遗传基础正在迅速缩小[3.].这是由于现代纯育种实践在全球范围内的扩展,这增加了遗传同质性[4].近几十年来,世界上一些作物遗传多样性的丧失速度大大加快,许多作物越来越容易受到疾病、虫害和环境压力的影响。野生谷物广泛适应所有这些压力因素。这就解释了为什么栽培小麦的野生亲缘,尤其是野生二粒小麦,t . turgidumssp。dicoccoides(小麦的母体),在过去的几十年里一直是作物研究者的兴趣和广泛研究的主题。
以往对野生二粒小麦遗传结构和分化的研究表明,遗传多样性具有生态地理结构,可能部分由气候和土壤因素决定[5- - - - - -11].以色列以色列微观地理位置的emmer小麦群体的先前研究,使用同酶和随机扩增的多态性DNA(RAPD)标记,在对比土壤,拓扑和气候中,在单一和多层水平下表现出可能的非random适应性遗传分化[6].利用等位酶标记区分一个中心和三个边缘区域,以及以色列种群内不同土壤类型[10].3个居群和2个土壤类群之间存在较强的SSR多样性T. dicoccoides.[6].有人建议,SSR变异受到遗传因素和生态力的影响[6].尽管多年来进行了大量的遗传学研究,但没有一项研究试图通过检查表观遗传因素(如胞嘧啶甲基化)来解释表型多态性。野生二粒小麦居群间和居群内的遗传变异显著高于栽培小麦[12].虽然在大多数情况下,观察到的遗传变异(DNA标记)可能是中性的,即它可能不会影响基因组功能,但表观遗传变异可能会对基因组功能产生直接影响,并通过这可能影响有机体对特定环境条件的适应性。
表观遗传调控是指通过DNA序列以外的修饰来改变基因产物的程度。它主要由CG和CHG位点的5-胞嘧啶甲基化组成[13].作为一般规则,高甲基化与基因表达的下调相关,而低甲基化与基因表达的上调相关[14].甲基化倾向于重复DNA,表明沉默转座子(TEs)是DNA甲基化的主要作用之一[15].的拟南芥基因组含有24%甲基化的CG位点,6.7%甲基化CHG位点(H = A,C或T)和1.7%甲基化CHH位点[16].所有转座子序列通常在拟南芥,在所有序列上下文中[15].考虑到转座元件序列的DNA去甲基化或甲基化分别与它们的激活或沉默有关,TEs在植物中与宿主基因相比是高甲基化的[17- - - - - -19].因此,对理解表观遗传过程在生态和演化中的作用增加的兴趣增加。然而,几乎没有任何熟知的野生植物群体的甲基化型表观遗传变异的结构和程度,特别是小麦群。使用甲基化敏感的扩增多态性(MSAP)测定[20.,21],两项研究报道了大麦野生群体CCGG位点甲基化变异的结构和数量[9] 和Viola Cazorlensis.[22].迄今为止,没有关于野生艾米麦类自然群体的结构和数量的广泛研究。
在这项研究中,我们的目的是通过胞嘧啶甲基化,评估野生二粒小麦种群内和种群间的表观遗传多样性,利用收集自5个地理隔离地区的不同气候条件(如:降雨水平、湿度、土壤类型和生物条件)[23].更具体地说,我们评估了:(1)利用MSAP分析,以全基因组方式评估CCGG位点胞嘧啶甲基化变异的结构和数量;(2)利用TMD分析转座元件侧边CCGG位点胞嘧啶甲基化变异的结构和数量[24].为此,我们观察到统计上显著的群体独特的遗传甲基化模式。讨论了野生二粒小麦表观遗传变异可能的适应价值。
结果
CCGG位点DNA胞嘧啶甲基化的全基因组分析
众所周知,植物中的甲基化模式可以代代遗传[22].这种可遗传的表观遗传变异可能在自然种群的适应和分化中发挥进化作用。为了减少不同种群的甲基化变化,我们同步了来自同一温室(普通花园)的5个种群的所有植物的生长。数字1说明了五个收集地点(黑门山、阿米德山、Tabgha山、贾巴山和Amasa山)的位置,并在附加文件中说明了所有五个收集地点的生态地理数据(包括海拔、年降雨量、年平均温度和土壤类型)1S1:表。从发芽1个月后的幼叶中提取DNA,并进行MSAP分析。分析是基于两种酶的裂解模式,下丘脑-垂体-肾上腺轴的二世和MSP.I,它们都能裂解未甲基化的CCGG位点。MSP.我(但不是下丘脑-垂体-肾上腺轴的ii)在内部胞嘧啶甲基化时切割(Cg甲基化状态)下丘脑-垂体-肾上腺轴的II(但不是MSP.I)当胞嘧啶外链发生甲基化(CHG甲基化状态)时,只有当甲基化发生在单链(半甲基化)时,胞嘧啶外链才会发生甲基化(CHG甲基化状态)[25].每个个体的甲基化水平可以通过多态带位点的数量来衡量MSP.我和下丘脑-垂体-肾上腺轴的ⅱMSAP位点总数中同一个体的MSAP反应。附加文件中显示了放射性标记和荧光标记MSAP模式的示例2:图S1。为此,对50份材料中447个MSAP位点进行了分析。值得注意的是,MSAP低质量的材料被排除在分析之外,与典型AFLP变异(遗传)相对应的多态带被排除在分析之外。也就是说,对于每个位点,只有那些源于胞嘧啶甲基化(多态性)的变异MSP.我和下丘脑-垂体-肾上腺轴的II MSAP反应)。
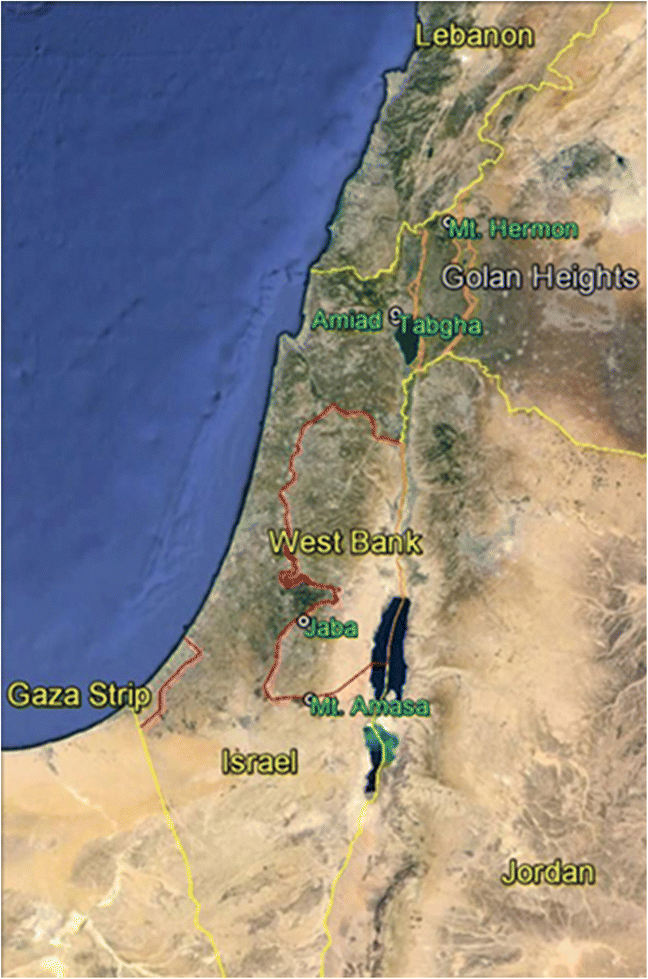
以色列和约旦河西岸周边地区、加沙地带以及约旦、黎巴嫩和叙利亚部分地区的地图。黑门山、亚米德山、塔布哈山、雅巴山和亚玛撒山五个野生二粒小麦采集点用绿色表示。这张地图是在谷歌Earth上创建的。见附加文件1:有关收集地点的生态地理性质的详情,请参阅表S1
甲基化的平均水平在所有五个群体中被测量,并发现在统计上是相似的(附加文件2图2):黑门山占65.2%,亚米德占66.8%,Tabgha占63.7%,雅巴占65%,亚玛撒山占71.3%。然而,对于四个种群(太黑门山、Amiad Tabgha和Jaba),甲基化的背景下,在大多数的网站(分别为62.3%、59.9%、65.2%和60.2%)发生在CHG职位(仅乐队出现在H通道),而对于Mt。亚玛撒的人口,CHG甲基化水平的类似于CG甲基化的水平。同样,这三个基因的甲基化水平T. dicoccoides.来自土耳其、伊朗和叙利亚的移民分别占76.4%、66.7%和62%。注意,我们不能得出结论,甲基化水平在土耳其T. dicoccoides.显著更高,因为只测试了一个加入。
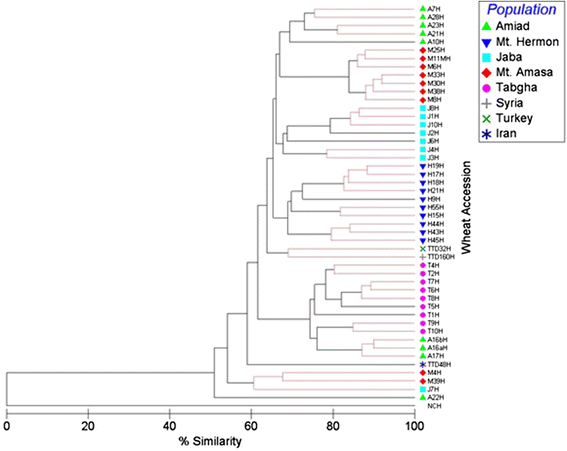
基于来自MSAP的447个CCGG位点的甲基化图案,构建了系统发育树,44个附加(图。2).系统进化树显著聚类(p< 0.05, global R = 0.638,两两R > 0.3),基于地理来源(种群)。在无花果。2结果表明,黑门山、雅巴山、亚玛撒山和Tabgha三种植物的甲基化模式均显著聚为一组(p < 0.05)2:图S3)。Amiad聚类分为2个主要类群,第1类群包含5个类群,第2类群包含3个类群,与Tabgha类群相似。这可能表明阿米德群体存在较高水平的表观遗传变异。一种解释是,Amiad遗址的收集物来自一个相对较大的地区,此前曾报道过该种群内的广泛变异[23].的T. dicoccoides.根据其CHG的甲基化状态,土耳其和伊朗的进入在一组中被显着聚集。有趣的是,叙利亚的加入类似于山。Hermon Cluster,在地理上更近。
通过使用447 MSAP频段的多维缩放产生的系统发育树,从五个群体的录取中获取:Mt.Hermon,Amiad,Tabgha,Jaba和Mt.阿马萨。加入TTD48,TTD32和TTD16分别从叙利亚,伊朗和土耳其收集,并用作该分析中的局外控制。索引(右上角)表示53种附加的每个中的收集站点。NCH,位于系统发育树的底部,为阴性对照(MSAP反应以水为模板)。黑线表示分离显著,红线表示分离不显著。表生相似性水平在底部显示。见附加文件2:图S3了解统计分析的更多细节
我们从放射性标记的MSAP (Tabgha材料)中随机提取了15个条带,重新扩增并进行了测序(附加文件)3.:表S1)。所有序列用作植物序列数据库中的查询(参见材料和方法),并且在15个序列中的10个中出现转换元素,而剩余的5个序列未击中注释基因或非编码序列。可转换元素被认为是有机体演变中的关键参与者,因为它们在基因组重排中发挥着突出的作用[26,27].在这里,我们评估了两个转座因子家族的作用,Veju(修剪Retrotransposon)和泰罗斯(一个螨虫从Tc1 /海员偷渡者超级家族)以野生麦米群的基于甲基化的表观遗传变异。
CCGG位点侧位甲基化模式分析Veju元素
众所周知,在植物中,TEs通常是甲基化的目标,因此,与其他基因组序列相比,它们被称为高甲基化[18].最近观察到te周围的甲基化明显高于随机基因组序列的甲基化[28,29].为此,甲基化的水平Veju-侧边CCGG位点测量每一个供试品,然后计算每个种群的平均甲基化水平(附加文件2:图S4)。值得一提的是,多态性带可能是一个转位事件的结果,并没有显示任何甲基化变化(多态性之间MSP.我和下丘脑-垂体-肾上腺轴的II TMD反应)被排除在分析之外。然而,一些显示甲基化变化的多态位点可能是TE插入位点多态性的结果。
基于290 TMD带的分析,CCGG网站侧翼的平均水平Veju黑门山为51.3%,亚弥德山为52.8%,Tabgha山为46.5%,雅巴山为50.9%,亚玛撒山为48.3%。种群间的平均甲基化水平在统计上是相似的(附加文件2:图S4)。此外,甲基化水平在基因组的T. dicoccoides.来自土耳其和伊朗的加入分别为55.3%和63.5%。
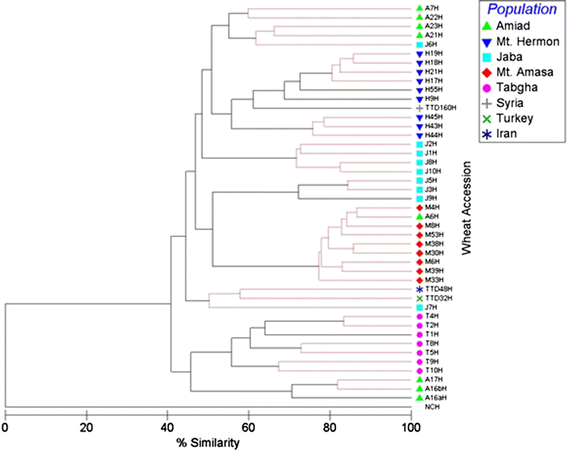
由此产生的系统进化树显著聚类(p < 0.05, global R = 0.651, pairwise R > 0.3) based on their geographical origin (Fig.3.).亚玛撒山和黑门山、Tabgha山和Jaba山的dna甲基化模式均显著聚为一组2:图S5),虽然来自AMIAD的加入在两个主要组中聚集,第一个组包含了3个载体,而第二组(也包含三个载体)群靠近Tabgha人口。此外,T. dicoccoides.来自土耳其和伊朗的加入集中在一个组中,而叙利亚的加入集中在黑门山组中。
采用290个TMD波段进行多维标度生成系统发育树Veju-CCGG侧边网站,来自5个群体的收录(见右上角索引)。NCH,位于系统发育树的底部,为阴性对照(MSAP反应以水为模板)。黑线表示分离显著,红线表示分离不显著。表生相似性水平在底部显示。见附加文件2:图S5为统计分析的详细信息
CCGG位点侧位甲基化模式分析泰罗斯元素
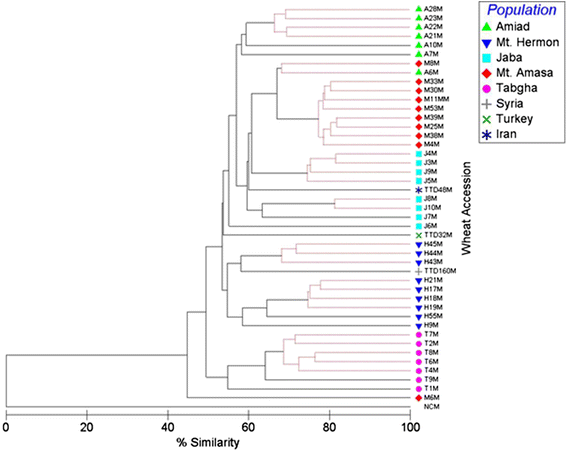
通过对401条TMD谱带的分析,得出CCGG位点侧翼的平均甲基化水平泰罗斯在群体中统计上类似(附加文件2图S6):黑门山60.1%,亚米德55.6%,Tabgha 50.1%,雅巴51%,亚玛撒山57.7%。此外,基因组的甲基化水平T. dicoccoides.来自伊朗和叙利亚的移民分别占52.9%和57.9%。系统进化树显著聚类(p < 0.05, global R = 0.642, pairwise R > 0.3) based on their geographical origin (Fig.4).黑门山和雅巴山、亚玛撒山和Tabgha的dna甲基化模式均显著聚为一组(p < 0.05)2:图S7)。此外,AMAD advance在10个含有10个载体中的一个主要组中被显着聚集在一起(见附加文件)2:图S7)。此外,T. dicoccoides.根据甲基化模式,来自土耳其、伊朗和叙利亚的物种聚为一组。
通过对应的401 TMD带产生的多维缩放产生的系统发育树泰罗斯-CCGG侧翼网站从5个人口的接入(见右上角索引)。NCM阴性对照。黑线表示分离显著,红线表示分离不显著。表生相似性水平在底部显示。见附加文件2:图S7有关统计分析的更多详细信息
讨论
在本研究中,我们对采集自5个地理隔离地区的野生二粒小麦的基因组CCGG位点进行了胞嘧啶甲基化的全基因组分析。更具体地说,我们对随机和te侧的CCGG站点进行了分析。我们发现胞嘧啶甲基化的变异相对较高,并观察到基于地理区域的群体特异性表观遗传模式。
利用无偏分析MSAP分析了来自5个地理隔离群体的50份野生二粒小麦基因组447个CCGG位点的甲基化状态。我们观察到,在所有材料中,63.7% - 71.3%的CCGG位点发生了甲基化,这表明野生二粒相对于驯化二粒具有较高的遗传甲基化比例t . turgidum~ 35%甲基化在硬粒小麦,[25])。当比较50种附加的甲基化模式时,大多数载体基于其地理位置显着聚集,表明每种人群的含量可能适应遗传性胞嘧啶甲基化的独特模式。另一种可能性是人群特异性甲基化模式可能是每种人群中创始人效应的结果。然而,在某些情况下,从一个人群的甲基化水平中的甲基化的缓解在其他人口中的豁免中相似。类似地,并使用与我们的研究中相同的方法,在野生种群中观察到群体特异性甲基化模式V. Cazorlensis.[22].重要的是,在我们的研究中,在共同的庭院条件下,在第二代中评估甲基化模式(每株植物的尖峰以确保自授粉),结果与第一代中观察到的结果非常相似,表明观察到的遗传群体特异性甲基化模式。重要的是要提到使用共同的花园条件允许我们不仅可以评估可遗传的甲基化模式,而且还要对甲基化数据进行的统计分析的准确性,尽管在某些情况下共同的庭院条件将与某些人口的自然条件不同。因此,常见的花园实际上可能导致轻微的表观遗传变化,但这不应该影响结论的真实性,因为普通的庭院条件对任何人口不合适。关键问题是群体的表观遗传分化是否与自适应遗传发散相关,因为与基于天然DNA序列变异的标记不同,基于甲基化的变异可能通过改变基因表达来影响基因组功能。为了对可能靶向甲基化的序列类型有一些暗示,我们已经随机测序和注释了15个MSAP条带,其在不同群体中的甲基化改变,并且发现它们中的大多数(15个)对应于转发元件,表明TES批量靶向甲基化,可能受到不同群体中的表观遗传因子(人群 - 独特的甲基化模式)的差异影响。
转座子附近的表观遗传变异
在这里,我们分析了与两个TE系列相邻的甲基化状态:Veju(修剪Retrotransposon)和泰罗斯(一个螨虫从Tc1 /海员偷渡者- 使用TMD测定的超家族)。分析包括一个随机的子集Veju和泰罗斯分别插入(CCGG网站侧翼290和401元件)。虽然没有关于确切拷贝数的报告Veju或泰罗斯二粒小麦的家族,我们估计在小麦基因组中包括成百上千的拷贝(数据未显示和[30.),分别)。与MSAP结果相似,TMD显示野生TE家族两侧CCGG位点的甲基化水平t . turgidum(野生二粒)的甲基化水平似乎高于驯化的t . turgidum(硬质)。侧翼CCGG位点的平均甲基化水平Veju野生二粒小麦的甲基化水平为~ 50%,而驯化硬粒小麦的甲基化水平为~ 40% [31].侧翼CCGG位点的平均甲基化水平泰罗斯在野生emmer小麦中〜54%,驯养杜兰姆的平均甲基化水平为约36%[29].之前的一项植物研究表明,在模式植物系统中,转座子的甲基化水平明显高于其他基因组区域的甲基化水平[18].当我们评估驯化小麦物种的甲基化水平时,这一观察得到了证实[25,29,31].然而,在本研究中,我们观察到基因组区域的甲基化水平甚至高于TE周围的甲基化状态,这表明表观遗传因素可能不仅在调节TE活性方面发挥了重要作用,而且在调节自然种群中其他功能序列方面也发挥了重要作用。此外,我们还观察了周围CCGG位点的群体特异性甲基化模式Veju和泰罗斯,表明TES的表观遗传调节可能是局部环境条件的特异性。在共同的庭院条件下,还观察到群体特异性模式。
结论
在这项研究中,我们使用MSAP和TMD技术来评估野生EMMER小麦天然群体的基于甲基化的表观遗传变异的结构和程度。在野生emmer小麦中,我们观察到CG和CHG位点的遗传性甲基化相对较高。注意,当分别分别分析CG或CHG位点时,观察到类似的系统发育树。平均而言,在共同的园林条件下,超过50%的经过50%的测试CCGG网站(对于MSAP和TMD测定)在两代经常甲基化。这种观察到的甲基化水平被估量,因为只有在CCGG位点的两个胞嘧啶中的一个甲基化时都检测到甲基化,而如果两个胞嘧啶都甲基化,则两种酶都不会切割甲基化和典型的遗传多态性之间的鉴别且典型的遗传多态性难以粘合.本研究提供了对DNA甲基化和转移元素对野生EMMER小麦种群的适应性遗传分歧的重要作用的暗示。未来的研究将允许评估人口特异性甲基化模式的潜力,以差异地影响不同的环境条件下的基因功能。
方法
植物材料
野生二聚体(t . turgidumssp。dicoccoide(s)在以色列五个地理上孤立的地点(图。1):黑门山,亚米得山,他迦山,雅巴山,亚玛撒山。种子材料(每个种群10-40份)由本-古里安大学的Sergei Volis博士好心提供。每个种群的植物(材料)在类似条件下的温室(普通花园)中种植。我们从土耳其、伊朗和叙利亚获得了额外的种子进行比较,由魏茨曼科学研究所的Moshe Feldman教授好心提供。大约在萌发后4周收集叶材料用于DNA提取[使用DNeasy植物迷你试剂盒(QIAGEN)]。
甲基化敏感扩增多态性
MSAP是先前描述的典型AFLP测定的修改[32].msap涉及两个isoschizomers [20.,21],下丘脑-垂体-肾上腺轴的二世和MSP.我均切割未甲基化的CCGG网站。尽管下丘脑-垂体-肾上腺轴的II是敏感的(不切割),如果一个或两个胞嘧啶甲基化,MSP.当内部胞嘧啶甲基化时,I就会分裂。在胞嘧啶的半甲基化(只有一条链被甲基化)的情况下,下丘脑-垂体-肾上腺轴的我会削减,但不会MSP.我(25].在这项研究中,我们遵循Shaked等人提供的协议。[25为分析小麦基因组而建立的。在MSAP模式中,之间的单晶带下丘脑-垂体-肾上腺轴的二世和MSP.我消化的DNA模板(来自相同的DNA样本)显示未甲基化的CCGG位点,而多态条带显示甲基化位点。每个个体的甲基化水平可以根据多态带之间的数量来测量MSP.我和下丘脑-垂体-肾上腺轴的II .同一个体MSAP反应中,多态频带数为MSAP频带总数中的多态频带数。在一个荧光标记的MSAP反应中可以筛选出200多个CCGG位点的甲基化状态,在一个放射性标记的MSAP反应中可以筛选出70多个CCGG位点的甲基化状态32P标记的MSAP反应。在这项研究中,在荧光MSAP中使用了两种引物组合:荧光标记的下丘脑-垂体-肾上腺轴的II /MSP.我引物(CatgagtcctGctcggtcag),一起与每个埃森I引物(GACTGCGTACCAATTCACG和GACTGCGTACCAATTCAAC)。为了提取感兴趣的MSAP波段,我们进行了一次放射性处理32p标记的msap反应,用a下丘脑-垂体-肾上腺轴的II /MSP.引物(CATGAGTCCTGCTCGGTCAG)埃森我引物(GACTGCGTACCAATTCACG)。
转座子甲基化显示
TMD允许以全基因组方式分析te侧翼CCGG位点的甲基化状态。该方法是按照先前发表的方法执行的[24,29,30.,33].该测定涉及使用一种Te特异性底漆和另一个汇集的互联网序列核心互补下丘脑-垂体-肾上腺轴的II /MSP.我的网站。因此,每个TMD带都是一个嵌合序列(TE/侧翼DNA)。在本研究中,我们分析了两个TE家族侧面的CCGG位点的甲基化状态:(1)一个微小的反向重复转座元件(MITE),称为泰罗斯(二类)29];(2)末端微型反向重复(TRIM) LTR逆转录转座子(class I),称为Veju[34,35].来自荧光标记的引物泰罗斯(GCTCCGTATGTAGTCACTTATTGA)和Veju(gacggtatgcctcggattta)termini与下丘脑-垂体-肾上腺轴的II /MSP.我入门(CatgagtcctGctcggtcag)。
构建系统发育树
通过在6%聚丙烯酰胺凝胶上电泳进行放射性标记的MSAP选择性PCR产物,然后暴露于X射线膜。将荧光标记的MSAP和TMD反应在3730xL DNA分析仪(施用的生物系统)中电泳,并使用Genemapper V4.0(应用生物系统)分析。MSAP和TMD频带用于创建总结所有样本中每个站点的每个频带(等位基因)的存在(1)或缺席(0)的Excel表。使用Primer6软件6.1.6(Primer-E;)进行具有Bray-Curtis的相似性和树木涡轮图(系统发育树)的相似性和构建的数据的分层凝聚聚类分析。[36]]。在每个节点上使用相似性配置文件(SIMPROF)测试以评估树木图的统计显着性。SIMPROF通过随机化每个变量的值来计算平均概况并重新计算配置文件。PI统计数据被计算为与平均分布的相似矩阵的实际相似性分布的偏差。将其与进一步随机产生的曲线的偏差进行比较,以测试意义。为此,在每个系统发育树中,统计学显着的簇由黑线表示,并通过红线表示无关头的簇。
使用Primer6软件进行额外的统计分析,以检验组(组)间MSAP或TMD模式的统计学意义。利用Jaccard相似性测度构建相似性矩阵,然后对定义种群之间的非度量多维尺度(MDS)和相似性(ANOSIM)进行分析。MDS根据距离或不同矩阵生成排序,相似组在二维图上聚集,而ANOSIM使用排列/随机化方法来测试组之间产生的差异p分离显著性的-值,分离强度的全局和两两R统计值(而R > 0.3表示分离显著性,R值范围在0 - 1之间)。
序列分析
来源于PlantGDB (http://www.plantgdb.org/prj/estcluster/)及NCBI (http://www.ncbi.nlm.nih.gov/nucest/).
提供支持数据的可用性
数据在Dryad存放:Doi:Doi:10.5061 / dryad.g31cv.
缩写
- TE:
-
转座因子
- 修剪:
-
终端反向重复微型
- 螨:
-
倒置重复转换元素
- AFLP:
-
扩增片段长度多态性
- msap:
-
Methylation-sensitive扩增多态性
- 战区导弹防御系统:
-
转座子甲基化显示器
- 美国东部时间:
-
表达序列标签
- NCBI:
-
国家生物技术信息中心
参考文献
- 1.
Feldman M,Millet E.发现野外emmer的贡献对对小麦进化和驯化和小麦改善的理解。以色列J植物SCI。2001; 49:S25-35。
- 2.
李志刚,李志刚,李志刚,等。中国野生谷物驯化的遗传学研究进展。[j] .地理科学进展,2002;3(6):429-41 .]
- 3.
艾弗里D.美国农场困境 - 全球坏消息是错误的。科学。1985; 230(4724):408-12。
- 4.
哦,我的灵魂。保护和发展。剑桥:剑桥大学出版社;1981.
- 5。
李永春,李永春,李永春,李永春,李永春,李永春。野生二粒小麦的微气候胁迫与适应性DNA分化。小麦属植物dicoccoides。应用计算机学报1999;98(6-7):873-83。
- 6。
李永春,王志强,李永春,等。以色列北部三个野生二粒小麦微卫星多样性与生态-土壤和遗传因子的相关性中国生物医学工程学报。2000;17(6):851-62。
- 7。
李永春,Fahima T, Roder MS, Kirzhner VM, Beiles A, Korol AB,等。以色列Yehudiyya微卫星点野生二粒小麦微卫星多样性的遗传效应遗传。2003;90(2):150 - 6。
- 8。
李永春,罗德敏,Fahima T, Kirzhner VM, Beiles A, Korol AB,等。气候对野生二粒小麦(Triticum dicoccoides)微卫星多样性的影响。遗传。2002;89:127-32。
- 9。
李亚东,单晓华,刘小明,胡丽娟,郭伟林,刘斌。基于甲基化敏感扩增多态性(MSAP)标记的短穗大麦DNA甲基化多态性和表观遗传群体结构检测。生态研究》2008;23(5):927 - 30。
- 10.
Nevo E,Beiles A.以色列和土耳其野生麦米群的遗传多样性 - 在繁殖中的繁殖和育种。Al Appl Genet。1989; 77(3):421-55。
- 11.
彭·雅,太阳DF,Nevo E.驯化进化,遗传学和小麦基因组学。mol品种。2011; 28(3):281-301。
- 12.
Joshi CP, Nguyen HT。随机扩增多态性DNA技术在野生和栽培四倍体小麦多态性检测中的应用。基因组。1993;36(3):602 - 9。
- 13.
Gruenbaum Y,Cedar H,Razin A.真核DNA甲基酶的衬底和序列特异性。1982年。
- 14.
冈萨雷斯·ML,琼斯PA。DNA甲基化的诱变和表观遗传效应。Mutat杂志1997;386(2):107 - 18。
- 15.
葛林,韩尼可夫。拟南芥DNA甲基化和去甲基化的研究,《拟南芥丛书》,第1-14页,美国植物生物学学会2008。
- 16。
Cokus SJ,Feng Sh,Zhang Xy,Chen Zg,Merriman B,Haudenschild CD,等。霰弹枪双硫酸盐序列拟南芥基因组显示DNA甲基化图案化。自然。2008; 452(7184):215-9。
- 17。
库马尔,贝内特岑JL。植物反转位子活动。Annu Rev Genet, 1999; 33:479-532。
- 18。
Rabinowicz PD, Palmer LE, May BP, Hemann MT, Lowe SW, McCombie WR等。基因和转座子在植物中有差异甲基化,但在哺乳动物中没有。基因组研究》2003;13(12):2658 - 64。
- 19。
Madlung A,Comai L.压力对基因组调控的影响。安乐伦敦。2004; 94(4):481-95。
- 20.
Reyna-lopez G,Simpson J,Ruiz-Herrera J.通过放大限制性多态性,在真菌的二态转变期间可检测到DNA甲基化图案的差异。Mol Gen Genet。1997年; 253(6):703-10。
- 21.
熊立忠,许刚刚,马鲁夫,张庆峰。利用甲基化敏感扩增多态性技术检测水稻杂种及其亲本的胞嘧啶甲基化模式。中国海洋大学学报(自然科学版)。
- 22.
紫堇菜离散居群的表观遗传分化及其与适应性遗传分化的关系。新植醇。2010;187(3):867 - 76。
- 23.
《野生二粒小麦和小麦改良的进化:群体遗传学、遗传资源和小麦先祖的基因组组织》,《小麦科学与商业》,2002。
- 24.
KASHKUSH K,Khasdan V.对RORCRANSPOSONS的胞嘧啶甲基化的大规模调查及来自长终端重复的读出转录对相邻水稻基因表达的影响。遗传学。2007; 177(4):1975-85。
- 25.
Shaked H,Kashkush K,Ozkan H,Feldman M,Levy AA。序列消除和胞嘧啶甲基化是基因组到小麦的宽杂交和全聚倍性的快速和可再现的反应。植物细胞。2001; 13(8):1749-59。
- 26.
Parisod C, Alix K, Just J, Petit M, Sarilar V, Mhiri C,等。转座因子对异源多倍体基因组组织和功能的影响。新植醇。2010;186(1):37-45。
- 27.
合成异源多倍体中转座元件的甲基化、转录和重排。国际植物遗传多样性杂志2011,doi:10.1155 / 2011/569826.
- 28。
Parisod C,Salmon A,Zerjal T,Tenaillon M,Grandbastien Ma,Ainouche M.在Spartina中杂交和异聚倍增素基因组转发元素附近的快速结构和表观遗传重组。新植物。2009; 184(4):1003-15。
- 29。
在一个新形成的小麦六倍体的前4代中,DNA转座子周围甲基化模式的大规模改变。基因组。2011年,54(1):湖人。
- 30。
小麦偷渡样螨全基因组分析揭示了高序列保守性、基因关联和基因组多样化。植物杂志。2013;161(1):486 - 96。
- 31.
小麦异源多倍体化后反转录转座子的遗传和表观遗传动态。遗传学。2010;186 (3):801 - u889。
- 32.
VOS P,Hogers R,Bleeker M,Reijans M,Vandelee T,Hornes M等。AFLP - DNA指纹识别的新技术。核酸RES。1995年; 23(21):4407-14。
- 33.
本- david S, Yaakov B, Kashkush K.全基因组分析表明,小麦核短分散元件SINES具有高度的序列保守性、基因关联和逆转录转座活性。植物j . 2013; 76(2): 201 - 10。
- 34.
Sabot F, Guyot R, Wicker T, Chantret N, Laubin B, Chalhoub B, et al.;小麦基因组大序列转座元件注释的更新揭示了不同的活性和基因关联。中国科学(d辑:地球科学)2005;
- 35.
SABOT F,Sourdille P,Bernard M.一个新的Retronsposon结构:长期的Veju元素。genetica。2005; 125(2-3):325-32。
- 36.
王志强。群落结构变化的非参数多元分析。中国生态学报。1993;18(1):117-43。
致谢
我们感谢Sergei Volis博士在收集植物材料方面的巨大帮助,感谢Beery Yaakov在统计方面的帮助,感谢他对手稿的批判性阅读。我们还要感谢海法大学的evviatar Nevo进行的建设性讨论。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
AV:设计实验,生成数据,分析数据,编写文稿,批准最终版本发表。AL-Z:设计实验,生成数据,分析数据,编写手稿,批准最终版本发表。VK:分析数据,准备稿件,批准最终版本出版。KD:对手稿进行数据分析和关键编辑,并批准最终版本出版。KK:对数据进行分析和解读,准备稿件并批准最终版本出版。
Anna Venetsky和Adva Levy-Zamir对这项工作做出了同样的贡献。
附加文件
附加文件1:表S1。
以色列五个野生Emmer小麦种群的生态图数据。
附加文件2:
图S1。野生二粒小麦MSAP带型的例子。(一个三种野生二粒小麦的MSAP谱。每一个样本的DNA都是用下丘脑-垂体-肾上腺轴的II(H Lane)或MSP.I (M lane)限制酶。在每个DNA样本中,H和M线之间的单形条带(黑色箭头)表示CCGG位点未甲基化,而多态条带(红色箭头)表示甲基化位点。每次加入的甲基化水平是通过将多态性位点总数(H和M车道之间)除以位点总数来衡量的。注意,单形带只被评分一次。(B荧光标记的MSAP图谱显示了一种野生二粒小麦的H和M车道。峰位(X轴)表示各条带PCR产物大小。峰值高度(Y轴)表示频带强度,这在定性分析中没有价值。MSAP产品在3730xl DNA分析仪(Applied Biosystems)中进行电泳,并使用GeneMapper v4.0 (Applied Biosystems)进行分析。所有的峰值存在数据被转移到一个excel文件进行进一步分析。图S2。利用MSAP分析了5个野生二粒小麦群体(每个群体10份,以不同颜色表示)CCGG位点的胞嘧啶甲基化水平。指出了标准误差。图S3。采用Primer6软件中的Jaccard相似性测度进行MSAP分析的非度量多维尺度(MDS)分析。MDS根据距离或不同矩阵生成一个排序,类似的组在二维图上聚集。右上角的指数显示了不同的群体(人口)。计算p-不同组之间的值是:0.001太黑门山和Amiad之间,0.02 Jaba和Amiad之间0.002 Jaba和太黑门山之间,0.004太亚玛撒和Amiad之间,0.001吨之间。亚玛撒太黑们,0.004吨之间。亚玛撒,Jaba 0.004 Tabgha和Amiad之间,0.001 Tabgha和太黑门山之间,0.004 Tabgha和Jaba之间和0.004之间Tabgha亚玛撒。。图S4。侧翼CCGG位点胞嘧啶甲基化的平均水平Veju通过TMD评估的Retrotroansposon在五个野生emmer小麦种群中(每群人的10种,由不同的颜色表示)。指出了标准误差。图S5。采用Primer6软件中的Jaccard相似性测度进行非度量多维尺度(MDS)分析VejuRetrotransposon。右上角的指数显示了不同的群体(人口)。计算p-不同组之间的值是:0.004太黑门山和Amiad之间,0.1 Jaba和Amiad之间0.004 Jaba和太黑门山之间,0.03太亚玛撒和Amiad之间,0.004吨之间。亚玛撒太黑们,0.008吨之间。亚玛撒,Jaba 0.2 Tabgha和Amiad之间,0.009 Tabgha和太黑门山之间,0.009 Tabgha和Jaba之间和0.02之间Tabgha亚玛撒。。图S6。侧翼CCGG位点胞嘧啶甲基化的平均水平泰罗斯利用TMD对5个野生二粒小麦群体(每个群体10份,颜色不同)的dna转座子进行了检测。指出了标准误差。图S7。采用Primer6软件中的Jaccard相似性测度进行非度量多维尺度(MDS)分析泰罗斯DNA转座子。右上角的指数显示了不同的群体(人口)。计算p-不同组之间的值是:0.009太黑门山和Amiad之间,0.02 Jaba和Amiad之间0.004 Jaba和太黑门山之间,0.1太亚玛撒和Amiad之间,0.001吨之间。亚玛撒太黑们,0.02吨之间。亚玛撒,Jaba 0.06 Tabgha和Amiad之间,0.009 Tabgha和太黑门山之间,0.02 Tabgha和Jaba之间和0.005之间Tabgha亚玛撒。。
附加文件3:表S1。
分离的MSAP带的分子表征。
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
本文中的图像或其他第三方材料都包含在本文的知识共享许可中,除非在该材料的信用额度中另有说明。如果资料不包括在文章的知识共享许可协议中,并且你的预期用途没有被法律规定允许或超过允许用途,你将需要直接从版权所有者获得许可。
如欲查阅本许可证副本,请浏览https://creativecommons.org/licenses/by/4.0/.
创作共用及公共领域专用豁免书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信贷额度中另有说明。
关于这篇文章
引用这篇文章
韦涅茨基,列维-扎米尔,哈士丹,V。et al。野生二粒小麦DNA甲基化表观遗传变异的结构和程度(t . turgidumssp。dicoccoides)的人口。BMC植物杂志15,200(2015)。https://doi.org/10.1186/s12870-015-0544-z
收到了:
接受:
发表:
关键字
- 二粒小麦
- DNA甲基化
- 转座的元素
- 生物多样性