- 研究文章GydF4y2Ba
- 开放获取GydF4y2Ba
- 出版:GydF4y2Ba
单子叶植物异位茎分生组织的产生GydF4y2Barpk1GydF4y2Ba突变体与SAM丢失和幼苗形态改变有关GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba15GydF4y2Ba文章编号:GydF4y2Ba171GydF4y2Ba(GydF4y2Ba2015GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
在双子叶植物GydF4y2Ba拟南芥GydF4y2Ba胚胎两个子叶大部分从茎顶端分生组织(SAM)自主发育。基因的隐性突变GydF4y2Ba拟南芥GydF4y2Ba受体样激酶GydF4y2BaRPK1GydF4y2Ba导致单子叶植物幼苗,由于复杂的功能冗余,外显率低(10%)GydF4y2Barpk1GydF4y2Ba大约10%的等位基因(即所有纯合子的1%)没有形成SAM。我们想知道GydF4y2BaRPK1GydF4y2Ba还可以控制除了在表皮上的细胞分裂和PINFORMED1(PIN1)极性其已知的随机冲击SAM基因表达和SAM产生。GydF4y2Ba
后果GydF4y2Ba
缺乏sam的幼苗发育出一种简单的形态,具有直而连续的下胚轴-子叶结构,缺乏可识别的上胚轴。根据GydF4y2Barpk1GydF4y2Ba令人惊讶的是,缺乏SAM的幼苗沿着下胚轴子叶结构向子叶叶片可变地表达必需的SAM特异基因。很少有幼苗能够在子叶顶部发育出异位茎分生组织(eSM)。GydF4y2Ba
结论GydF4y2Ba
结果突出了SAM与子叶的发展自主权和建议,主要GydF4y2Barpk1GydF4y2Ba缺陷不在于幼苗表达SAM基因或发育芽分生组织的能力,GydF4y2Barpk1的GydF4y2Ba在细胞分裂和生长素动态平衡已知的缺陷,由干扰PIN1极性,关于SAM和器官发生的影响。在早期胚胎阶段这种故障产生一个简化的单子叶形态。一旦产生,这可能需要的位置信息,反过来影响了SAM的时空发展的损失。SAM-轴承和SAM-少单子叶表型显示形态相似要么真实单子叶植物或双子叶植物,以种,其中只有一个开发子叶。具体子叶缺陷GydF4y2Barpk1GydF4y2Ba因此,突变体揭示了从两个子叶过渡到一个子叶的发育含义。GydF4y2Ba
背景GydF4y2Ba
作为双子叶被子植物的典型代表,GydF4y2Ba拟南芥GydF4y2Ba幼苗的体平面从上胚轴区域开始,该区域包含茎尖分生组织(SAM),两侧有两个子叶,然后是下胚轴,下胚轴结束于携带根尖分生组织(RAM)的根尖[GydF4y2Ba1GydF4y2Ba].子叶与SAM的起始在很大程度上是独立的,如删除SAM而不是子叶的突变所证明[GydF4y2Ba2 gydF4y2Ba那GydF4y2Ba3.GydF4y2Ba]反之亦然[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba].GydF4y2Ba
虽然被子植物正常子叶数的例外情况在几个属中是已知的[GydF4y2Ba6.GydF4y2Ba]子叶数是一个相对恒定的模式元素。现代分类学将具有两个子叶的真双子叶植物和具有一个子叶的单子叶植物视为单系群[GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba8.GydF4y2Ba].然而,这些器官与SAM一起“计数”和排列以建立根尖区域的机制尚不清楚。GydF4y2Ba
使用GydF4y2Ba拟南芥GydF4y2Ba具有子叶缺陷的突变体有助于更深入地了解这一发育过程。对已知的具有子叶缺陷的突变体进行仔细的分类,可以发现一个群体,这显然反映了更基本的扰动,如细胞分化GydF4y2Ba改变分生组织程序GydF4y2Ba[GydF4y2Ba9.GydF4y2Ba那GydF4y2Ba10GydF4y2Ba],分生组织细胞命运和侧器官发育的控制GydF4y2BadornroschenGydF4y2Ba[GydF4y2Ba11GydF4y2Ba]中的划分平面方向GydF4y2Ba法斯GydF4y2Ba[GydF4y2Ba12GydF4y2Ba].这使得一些苗突变体,其缺陷是子叶具体的。这些突变体有规则地链接到生长素合成和传输由所述极性生长素流出载体PIN1,其产生生长素最大值缺陷需要引起子叶原基[GydF4y2Ba13GydF4y2Ba那GydF4y2Ba14GydF4y2Ba].例如,AGC激酶的突变体GydF4y2Ba皮诺德GydF4y2Ba(GydF4y2BaPIDGydF4y2Ba)和d -肌醇-3-磷酸合酶(MIPS)经常产生异常的子叶多余数量[GydF4y2Ba15GydF4y2Ba那GydF4y2Ba16GydF4y2Ba而组合GydF4y2Ba松果体(pid)GydF4y2Ba与相关激酶、生长素合成基因和GydF4y2BaNPH3GydF4y2Ba-相似基因GydF4y2Ba松果体增强子GydF4y2Ba(GydF4y2Ba经验/经验GydF4y2Ba)导致子叶较少的幼苗保留功能SAM[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba5.GydF4y2Ba那GydF4y2Ba17GydF4y2Ba-GydF4y2Ba19GydF4y2Ba].相比之下,mutants specifically segregating a monocotyledonous phenotype are relatively rare and known from碳化硅GydF4y2Ba豌豆中的突变体和GydF4y2Ba拟南芥GydF4y2Ba受体样激酶GydF4y2BaRPK1GydF4y2Ba[GydF4y2Ba20.GydF4y2Ba那GydF4y2Ba21GydF4y2Ba].这种稀疏性的原因可能是由于编码的冗余基因功能GydF4y2Ba拟南芥GydF4y2Ba事实上,单子叶植物的表型GydF4y2Barpk1GydF4y2Ba突变体的最大外显率约为10%[GydF4y2Ba21GydF4y2Ba那GydF4y2Ba22GydF4y2Ba],它可通过在相关的突变增加升高GydF4y2BaTOAD2 / RPK2GydF4y2Ba然而,这种组合同时导致额外的严重模式效应和胚胎致死率高,因为GydF4y2BaTOAD2 / RPK2GydF4y2Ba在径向图案形成中采用了附加功能[GydF4y2Ba21GydF4y2Ba那GydF4y2Ba23GydF4y2Ba]和作为分生组织发育的调节器[GydF4y2Ba24GydF4y2Ba].GydF4y2Ba
避免这样的多效性GydF4y2Barpk1-7GydF4y2Ba和GydF4y2Barpk1-6GydF4y2Ba最近对单突变体进行了分析。这揭示了初选GydF4y2Barpk1GydF4y2Ba胚胎发生过程中表皮细胞分裂和PIN1极性随机降低[GydF4y2Ba22GydF4y2Ba].该缺陷是随机的,因为每次新细胞分裂的准确性取决于是否有冗余GydF4y2BaRPK1GydF4y2Ba类基因是否达到所需的RPK1功能阈值。这意味着GydF4y2Barpk1GydF4y2Ba缺陷可能在不同阶段(时间依赖性)和不同区域(空间依赖性)表现出来。子叶原基中表皮细胞分裂和PIN1极性的扰动可能干扰或消除生长素最大值的建立,并导致单子叶幼苗(为方便起见,现将单子叶植物幼苗命名为单子叶植物幼苗)。单子叶植物幼苗中SAM含量较低,这表明在强子叶的早期球状阶段,对子叶和SAM发育都有干扰GydF4y2Barpk1GydF4y2Ba等位基因。GydF4y2Ba
在这里,我们表明,SAM-少单子叶苗保留基本的SAM功能。然而,他们开发了连续的下胚轴,子叶组织缺乏这些结构之间的明确分离的简单形态。发达的叶片有时比野生型大。虽然这些单子叶苗最初有没有SAM,他们并没有失去产生一个容量。在子叶的近轴面的一些开发延迟的SAM甚至宫外孕拍摄分生组织(ESM)。我们的分析表明,这些单子叶苗的拓扑特点是链接到的SAM特定基因空间,及时协调表达的早期胚胎发育过程中的损失,指示由形态学改变的位置信息的丢失。GydF4y2Ba
后果GydF4y2Ba
坚强的GydF4y2Barpk1GydF4y2Ba等位基因产生少sam的单子叶幼苗GydF4y2Ba
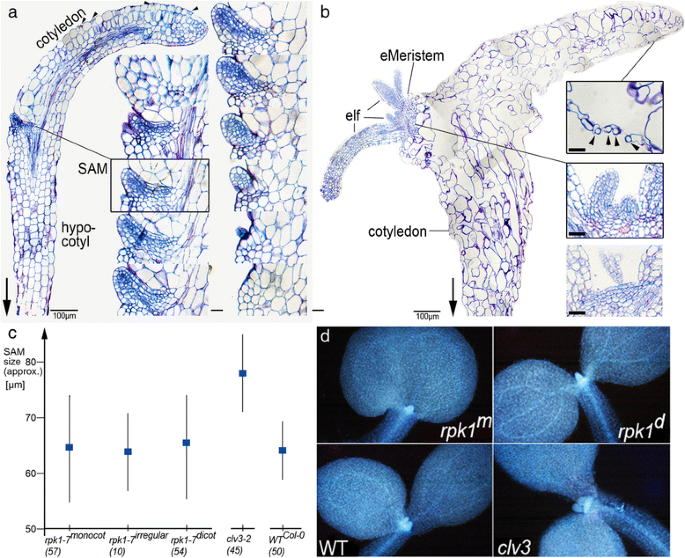
等位基因GydF4y2Barpk1-7GydF4y2Ba是由GydF4y2Bagl1GydF4y2Ba哥伦比亚背景,产生约10%的子叶异常幼苗,其中大多数缺少一个子叶[GydF4y2Ba22GydF4y2Ba].我们检测到,与单子叶植物的同胞相比,在萌发五天后,一些单子叶植物幼苗没有发育的SAM(图。GydF4y2Ba1A-1CGydF4y2Ba)这些幼苗的子叶形状和大小各不相同,叶片发育良好,具有可识别的正面和背面(图。GydF4y2Ba1GydF4y2Ba).无SAM单子叶植物经常出现在与具有不同遗传背景的植物杂交的系谱中,频率在所有幼苗的0.5%到1.8%之间(表1)GydF4y2Ba1GydF4y2Ba).进一步生长后,部分SAM缺失的幼苗在离子叶叶片一定距离处发育SAMs,表明分生组织发育滞后于含SAM的单子叶植物。我们认为SAM缺失表型可能是单子叶植物的一个特异性特征GydF4y2Barpk1-7GydF4y2Ba等位基因,这是快中子诱发的反转[GydF4y2Ba22GydF4y2Ba]因此,我们在独立产生的GydF4y2Barpk1-6GydF4y2Ba等位基因,这是在RPK1编码区的T-DNA插入[GydF4y2Ba22GydF4y2Ba]并发现SAM较少的幼苗,其频率与GydF4y2Barpk1-7GydF4y2Ba(表GydF4y2Ba1GydF4y2Ba).其他没有SAM的幼苗,只要在无菌1/2MS培养基中培养,就不会发育出正常的SAM,而是坏死的子叶和绿色的、持续生长的根(图。GydF4y2Ba1 dGydF4y2Ba).值得注意的是,在这些幼苗中,下胚轴和子叶叶柄形成了一个连续的结构,没有可识别的SAM区分离(图2)。GydF4y2Ba1c,eGydF4y2Ba和GydF4y2BaFGydF4y2Ba).这对于两个等位基因(图比较真实。GydF4y2Ba1c,e,gGydF4y2Ba),并表明在这些组织中细胞的分化已经从根本上改变。整装制剂GydF4y2Barpk1-7GydF4y2Ba幼苗表现出维管束缺陷GydF4y2BaRPK1GydF4y2Ba与PIN1极性和生长素运输的联系[GydF4y2Ba22GydF4y2Ba].在GydF4y2Barpk1GydF4y2Ba单子叶植物是一种野生型二拱形维管系统,分为两个子叶,其组织结构各异。要么两条维管都侵入剩余的子叶,要么一条维管终止于“下胚轴”。在其他情况下,形成了多个维管细胞档案(图。GydF4y2Ba1 fGydF4y2Ba;附加文件GydF4y2Ba1GydF4y2Ba:图S1)。GydF4y2Ba
形态SAM-少GydF4y2Barpk1GydF4y2Ba单子叶植物幼苗。GydF4y2Ba一种GydF4y2Ba单子叶部分的放大GydF4y2Barpk1-7GydF4y2Ba幼苗(GydF4y2Bagl1/gl1GydF4y2Ba背景),有SAM和初生叶(顶部),没有SAM(底部)。GydF4y2BaB.GydF4y2Ba和GydF4y2BaCGydF4y2Ba长根的整株植物(箭头所示)显示了连续的根生长。GydF4y2BaD.GydF4y2Ba长期培养的无茎单子叶幼苗显示出坏死的子叶,而根继续生长并变成绿色。GydF4y2BaE.GydF4y2Ba具有纯合基因的无SAM单子叶植物幼苗GydF4y2Barpk1-7 GL1GydF4y2Ba背景(携带GydF4y2BaPIN1:GFPGydF4y2Ba记者)。GydF4y2BaFGydF4y2Ba用Hoyers mount清除的幼苗在连续的下胚轴-子叶结构中可以看到维管系统,有中断(白色箭头)和多余的和/或盲目终止的维管成分(小箭头)。在野生型中,没有可识别的弯曲,这在顶部分离SAM/上胚轴和侧向放置的子叶。GydF4y2BaGGydF4y2Ba一种不含sam的单子叶幼苗,起源于GydF4y2Barpk1-6GydF4y2Ba等位基因GydF4y2Ba.GydF4y2Ba子叶(c),正常叶(lf)显示。比例尺:1mmGydF4y2Ba安妮GydF4y2Ba,0.5毫米GydF4y2BaGGydF4y2Ba,100μMGydF4y2BaFGydF4y2Ba
缺乏sam的单子叶幼苗能够在子叶上发育异位分生组织GydF4y2Ba
在分析GydF4y2Barpk1-7GydF4y2Ba在单子叶植物中,我们多次发现了缺乏sam的幼苗,它们可以通过在子叶正面发育eSM而进入另一条罕见的发育路线。GydF4y2Ba2 gydF4y2Ba).esm没有在任何其他sam轴承双子叶或单子叶上发展GydF4y2Barpk1GydF4y2Ba苗期和显示一些具体特点。首先,ESM被定位在所述可识别近轴未在子叶上(图1的背面部位。GydF4y2Ba2a-eGydF4y2Ba).其次,eSM出现在子叶的中间位置,即靠近中间裂口(图2)。GydF4y2Ba2 a、b e1-e5GydF4y2Ba).第三,eSM产生的初生叶具有不规则的分叶格局,没有额外的子叶(图2)。GydF4y2Ba2 a, bGydF4y2Ba).初生叶的原线携带着GydF4y2Baglabra1GydF4y2Ba突变并没有形成毛状体。然而,回交到GydF4y2Ba格拉布拉1GydF4y2Ba背景(表1)GydF4y2Ba1GydF4y2Ba)证明这些发育了叶特异性毛状体(图。GydF4y2Ba2 c, dGydF4y2Ba).eSMs产生单叶器官或(在另一个极端)甚至具有可育芽的莲座(图。GydF4y2Ba2E6GydF4y2Ba).由此产生的系谱表现出相似的子叶缺陷范围(图。GydF4y2Ba2 fGydF4y2Ba,附加文件GydF4y2Ba1GydF4y2Ba:图S1)。一个搜索的GydF4y2Barpk1-6GydF4y2Ba对于类似的异位生长,在737株幼苗中发现的病例不超过一例(图。GydF4y2Ba2 gGydF4y2Ba)显示这种特殊结构非常罕见。为了系统地评估esm的频率,我们增加了大量的(>10.000)GydF4y2Barpk1-7GydF4y2Ba其他遗传背景下的幼苗(表GydF4y2Ba2 gydF4y2Ba).携带SAM和不含SAM的单子叶植物的平均数量仍在已知范围内。然而,eSMs的发生非常罕见,在不同的系谱中没有可预测的频率,并且总是与不含SAM的单子叶植物相关。总之,我们的观察表明,不含SAM的单子叶植物幼苗是由不同基因突变引起的GydF4y2BaRPK1GydF4y2Ba.因此,下面我们集中的分析GydF4y2Barpk1-7GydF4y2Ba单独地GydF4y2Ba
SAM-少GydF4y2Barpk1GydF4y2Ba幼苗在子叶上产生异位枝分生组织。GydF4y2Ba一种GydF4y2Ba单子叶植物GydF4y2Barpk1-7GydF4y2Ba具有近轴异位茎分生组织(eSM)的幼苗,带有数片叶子(插图:澄清方案)。GydF4y2BaB.GydF4y2Ba同样的GydF4y2Barpk1-7GydF4y2Ba长期栽培的单子叶幼苗。子叶失去了绿色。箭头指向根。GydF4y2Bac - dGydF4y2Ba单子叶植物GydF4y2Barpk1-7GydF4y2Ba幼苗在GydF4y2BaGL1GydF4y2Ba具有正常定位SAM的背景GydF4y2BaCGydF4y2Ba还有eSMGydF4y2BaD.GydF4y2Ba分别注意正常初生叶和异位初生叶上的毛状体。特征性的组织生长携带eSM(箭头)。GydF4y2Bae1-e5GydF4y2Ba一个eSM(黑色箭头)在子叶上的生长GydF4y2Barpk1-7GydF4y2Ba头两周育苗。GydF4y2Bae6GydF4y2Ba一个月后也一样。GydF4y2BaFGydF4y2BaeSM的后代GydF4y2Barpk1-7GydF4y2Ba植物中所示GydF4y2Bae1-e6GydF4y2Ba.GydF4y2BaGGydF4y2Ba一种GydF4y2Barpk1-6GydF4y2Ba单子叶植物的幼苗,在异常增厚的子叶顶部有两片叶子的外生物(箭头)。箭头指向一个毛状体。显示子叶(c)、正常叶(lf)和异位叶(elf)。刻度条:1 mm,但在GydF4y2Bae6GydF4y2Bae6: 1厘米GydF4y2Ba
eSM显示了与野生型sam的组织相似性GydF4y2Ba
将具有eSM的植物与“正常”单子叶植物幼苗进行组织学比较(图GydF4y2Ba3.GydF4y2Ba).后者在子叶的基部发育一个SAM,其中包含了规则的细胞文件,属于表皮、栅栏、叶肉和木质部/韧皮部组织,非常像双子叶幼苗的SAM。在所有组织中,细胞的大小比例和液泡化均有规律。气孔位于小腔上方,被表皮细胞很好地分开(图2)。GydF4y2Ba3aGydF4y2Ba).SAM位于剩余子叶的基部,在正常情况下,它的组织由一组小的密集染色的细胞组成,这些细胞从侧面产生叶原基(图。GydF4y2Ba3aGydF4y2Ba)从维管系统看,子叶的起源是侧生的,而不是顶生的。GydF4y2Ba
分生组织的结构和单子叶植物的大小GydF4y2Barpk1-7GydF4y2Ba幼苗。GydF4y2Ba一种GydF4y2Ba带SAM的幼苗中间切片和插图显示通过SAM的一系列放大的切片(中间切片的部分为框架)。气孔由其他表皮细胞(箭头)分隔。注意子叶的似乎末端位置,而维管元件显示侧向起源。GydF4y2BaB.GydF4y2BaeSM幼苗(左)。插图显示放大图的细节(右):不规则间隔的气孔(顶部,箭头);有叶原基的规则形状的分生组织(中间);离前者几微米远的另一部分(底部)。箭头指向根部。比例尺:100 μm(左侧部分)GydF4y2Ba一种GydF4y2Ba和GydF4y2BaB.GydF4y2Ba)和20微米(插图)。GydF4y2BaCGydF4y2Ba的平均值和SDsGydF4y2Barpk1-7GydF4y2Ba苗被一个,两个不规则尺寸和两个正常子叶和野生型和的GydF4y2Baclv3GydF4y2Ba突变体(括号:分析的幼苗数量)。GydF4y2BaD.GydF4y2Ba不同苗木的代表(不规则苗木除外)GydF4y2Ba
叶片发育良好、叶片弯曲、连续的下胚轴-子叶结构形式、缺少真正的叶柄以及发育的单叶单子叶的位置均显示出近轴/近轴方向(图2)。GydF4y2Ba1GydF4y2Ba和GydF4y2Ba2 gydF4y2Ba).然而,组织和细胞在形状和大小(图显著不成比例。GydF4y2Ba3bGydF4y2Ba)表皮细胞的异常形状表明异常(非背斜)分裂。气孔有时彼此相邻(图。GydF4y2Ba3bGydF4y2Ba(顶部插图)和内部细胞可能非常大(> > 100 μm长),彼此松散连接。相比之下,eSM的规则(细胞)组织使人联想到野生型SAM或单子房兄弟姐妹的SAM(对比图。GydF4y2Ba3a和bGydF4y2Ba).一系列的叶原基从中央的一簇小的、富含浆的细胞中显现出来。出现的eSM可能引起了沿近远轴的张力,使子叶弯曲形成一个扣,这反过来在下面产生了一个空腔(图。GydF4y2Ba3bGydF4y2Ba,与图。GydF4y2Ba二维GydF4y2Ba).GydF4y2Ba
接下来,我们讨论了monocot中SAM的丢失GydF4y2Barpk1-7GydF4y2Ba是分生组织大小逐渐减小的极端。由于富含血浆,DAPI染色幼苗的茎尖分生组织细胞显示出强烈的荧光,这可以被视为分生组织大小的近似值[GydF4y2Ba25GydF4y2Ba].幼苗表型的samGydF4y2Barpk1-7GydF4y2Ba(即双子叶植物、单子叶植物、具有不规则子叶的幼苗,例如融合子叶)与野生型SAMs(Col-0生态型)以及突变体进行了比较GydF4y2Baclavata3GydF4y2Ba地空导弹(无花果。GydF4y2Ba3 c, dGydF4y2Ba).后者已被证明比野生型地对空导弹大得多[GydF4y2Ba26GydF4y2Ba].没有SAM的单子叶植物幼苗没有显示密集染色的SAM细胞簇(未显示)GydF4y2Barpk1-7GydF4y2Ba幼苗与野生型SAMs的大小显著重叠GydF4y2Baclavata3GydF4y2Ba突变体表现出显著更大的SAM(图。GydF4y2Ba3 c, dGydF4y2Ba).我们的结论是GydF4y2Barpk1-7GydF4y2Ba子叶变异体不是SAM大小逐渐减小的连续体的成员。这表明缺乏SAM的单子叶表型是由于无法达到建立SAM所需的阈值(例如,协调SAM基因表达的临界数量或活性)。GydF4y2Ba
无SAM单子叶植物的子叶GydF4y2Barpk1-7GydF4y2Ba幼苗表现出SAM特异性基因表达GydF4y2Ba
接下来,我们分析了sam特异性基因的表达,如GydF4y2BaWUS,STM,KNAT1GydF4y2Ba和GydF4y2BaKNAT2GydF4y2Ba(图。GydF4y2Ba4aGydF4y2Ba)的半定量RT-PCR(见GydF4y2Ba方法GydF4y2Ba).在本实验和其他实验中,注意到无SAM的幼苗实际上没有可识别的(晚期)SAM,并且使用分离的子叶组织进行的实验没有受到下胚轴和根组织的污染(参见GydF4y2Ba方法GydF4y2Ba).子叶和叶特异GydF4y2BaAS1GydF4y2Ba[GydF4y2Ba27GydF4y2Ba那GydF4y2Ba28GydF4y2Ba]作为对照(除了GydF4y2BaACT2GydF4y2Ba)在一个实验中,分别分析了两个SAM less和两个SAM轴承组的幼苗(包括图。GydF4y2Ba1a至1cGydF4y2Ba).不含SAM的幼苗表达四种SAM特异性基因中的三种,以及GydF4y2BaAS1GydF4y2Ba,表达强烈(图。GydF4y2Ba4aGydF4y2Ba).而GydF4y2Ba乌斯GydF4y2Ba在这些没有sam的幼苗中没有发现,GydF4y2BaSTM,KNAT1GydF4y2Ba和GydF4y2BaKNAT2GydF4y2Ba似乎相比于单子叶植物幼苗的SAM(图被异常表达。GydF4y2Ba4aGydF4y2Ba).两者的等价物GydF4y2BaAS1GydF4y2Ba和GydF4y2BaACT2GydF4y2Ba由于这些基因分别在子叶和幼苗的其余部分有整体表达,因此表现出明显较强的表达。测试GydF4y2Ba扫描隧道显微镜GydF4y2Ba和GydF4y2BaAS1GydF4y2Ba(及GydF4y2BaAS2GydF4y2Ba,未显示)在与身体其他部分分离的子叶池中,显示GydF4y2Ba扫描隧道显微镜GydF4y2Ba在无sam的幼苗子叶中表达,而在对照组子叶中不表达。GydF4y2Ba4bGydF4y2Ba).此外,GydF4y2Ba扫描隧道显微镜GydF4y2Ba表达也在SAM-少单子叶植物的其余部分中找到,并预期在两个对照(图GydF4y2Ba4bGydF4y2Ba)。所有条带均具有预期大小(来源于已知转录本)。此外,对代表性条带进行了序列验证GydF4y2Ba扫描隧道显微镜GydF4y2Ba在两组单子叶植物幼苗是可比性的。使用单株幼苗的材料也得到了类似的结果(附加文件)GydF4y2Ba1GydF4y2Ba:图S2)。GydF4y2Ba
单子叶植物的RT-PCR分析GydF4y2Barpk1-7GydF4y2Ba带SAM和不带SAM的幼苗。GydF4y2Ba一种GydF4y2Ba带(+SAM)和不带(+SAM)的完整幼苗分析(− 芽分生组织。RT-PCR扩增产物经过40个周期后与引物对基因如图所示GydF4y2BaKNAT1GydF4y2Ba和GydF4y2Ba2 gydF4y2Ba存在于SAM的幼苗中,但非常弱。GydF4y2BaB.GydF4y2Ba分析GydF4y2Barpk1-7GydF4y2Ba单子叶植物(− (山姆)和GydF4y2Barpk1-7GydF4y2Ba野生型双子叶植物幼苗(+SAM)分别分为子叶组织(Cot)和(表生和)下胚轴和根组织(其余)GydF4y2Ba
晚期单子叶植物的原位杂交分析GydF4y2Barpk1-7GydF4y2Ba胚胎检测到一种罕见的异位妊娠GydF4y2Ba扫描隧道显微镜GydF4y2Ba表达式GydF4y2Ba
我们监测了sam特异性(GydF4y2BaSTM,CLV3GydF4y2Ba)和子叶特异(GydF4y2BaPID,ENPGydF4y2Ba)基因,从非常早期的胚胎阶段开始。然而,与我们之前的研究相反[GydF4y2Ba22GydF4y2Ba]我们集中在后期胚胎阶段,有两个原因。首先,在胚胎发育晚期,GydF4y2BaPIDGydF4y2Ba和GydF4y2Ba恩普GydF4y2Ba在SAM中显示额外的表达式(例如[GydF4y2Ba5.GydF4y2Ba])。其次,我们希望增加在单子叶胚胎中发现这些基因之一预期罕见的异位表达的可能性,这些基因本身具有罕见的外显率。GydF4y2Ba
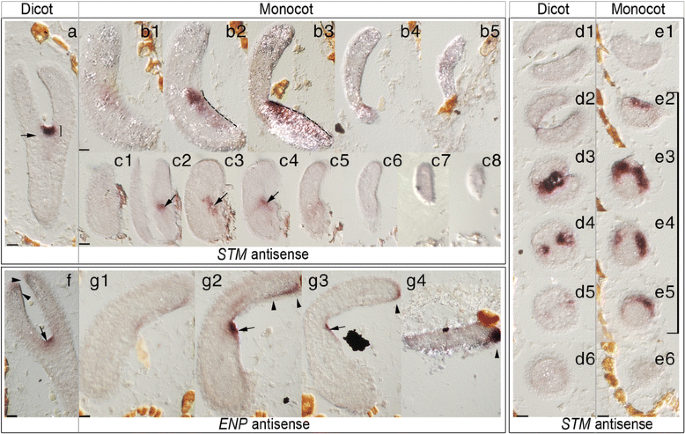
晚单子叶植物GydF4y2Barpk1GydF4y2Ba胚胎表现出“香蕉”样的外观,带有或多或少可识别的凹痕,推定为SAM区域。正如预期的那样,我们主要检测到正确的表达模式。GydF4y2Ba扫描隧道显微镜GydF4y2Ba显示了更长的时间GydF4y2BaCLV3GydF4y2Ba显示出一个已知的小表达域(图。GydF4y2Ba5A-E6GydF4y2Ba,附加文件GydF4y2Ba1GydF4y2Ba:对比图S3和S4)。同样的,GydF4y2Ba恩普GydF4y2Ba和GydF4y2BaPIDGydF4y2Ba子叶和SAM晚期表达正常(图。GydF4y2Ba5fGydF4y2Ba,G1-G4;附加文件GydF4y2Ba1GydF4y2Ba:图S5和S6的对比)。尽管这些探针中任何一个都可能检测到异常的表达模式,但我们在30个单子叶(328个)中只发现了一个GydF4y2Barpk1-7GydF4y2Ba鱼雷胚胎)。考虑到单子叶植物中少sam苗的频率为10%GydF4y2Barpk1-7GydF4y2Ba幼苗,这是在同一范围内。令人惊讶的是,在已鉴定的单子叶植物胚胎中,与GydF4y2Ba扫描隧道显微镜GydF4y2Ba探针几乎沿着完整的胚下胚轴延伸,但不进入子叶组织,在正常SAM位置的浓度最强(图。GydF4y2Ba5 b1-b5GydF4y2Ba;B2和B3中的点画线)。表示GydF4y2Ba扫描隧道显微镜GydF4y2Ba在该样本中,根尖基轴明显超过15-20μm,这是双子叶和单子叶SAM轴承中显示的尺寸GydF4y2Barpk1-7GydF4y2Ba鱼雷胚胎(无花果。GydF4y2Ba图5a,D1-D6,E1-E6GydF4y2Ba;括号)。这与随后观察到的一个结果一致GydF4y2BaKNAT2p:格斯GydF4y2Ba无SAM单子叶植物的表达模式变异GydF4y2Barpk1-7GydF4y2Ba苗(见下文)。GydF4y2Ba
单子叶植物的原位杂交分析GydF4y2Barpk1-7GydF4y2Ba所示为鱼雷胚胎(系列)切片(显示双子叶和单子叶胚胎)。GydF4y2Baa–e6GydF4y2Ba原位杂交GydF4y2Ba扫描隧道显微镜GydF4y2Ba调查。GydF4y2Baf-g4GydF4y2Ba原位杂交GydF4y2Ba恩普GydF4y2Ba探测比较。GydF4y2Baa-c8GydF4y2Ba和GydF4y2Baf-g4GydF4y2Ba显示纵断面和GydF4y2Bad1-6GydF4y2Ba;GydF4y2Bae1-6GydF4y2Ba分别显示截面。括号中GydF4y2Ba一种GydF4y2Ba和GydF4y2Bad2-5GydF4y2Ba那GydF4y2Bae2-5GydF4y2Ba指示15-20μm的距离(横截面厚度为3,5μm)。点画的线条GydF4y2Bab2GydF4y2Ba和GydF4y2Bab3GydF4y2Ba表示扩展名GydF4y2Ba扫描隧道显微镜GydF4y2Ba沿着SAM区域和下胚轴的信号。箭头指向GydF4y2Ba扫描隧道显微镜GydF4y2Ba(晚)GydF4y2Ba恩普GydF4y2Ba分别。箭头表示附加的GydF4y2Ba恩普GydF4y2Ba子叶表皮的信号。标尺:20μmGydF4y2Ba
SAM特定的GydF4y2Ba克纳特GydF4y2Ba2 gydF4y2Bap-GUSGydF4y2Ba活动是可变的,并异常分布在SAM-lessGydF4y2Barpk1-7GydF4y2Ba单子叶幼苗GydF4y2Ba
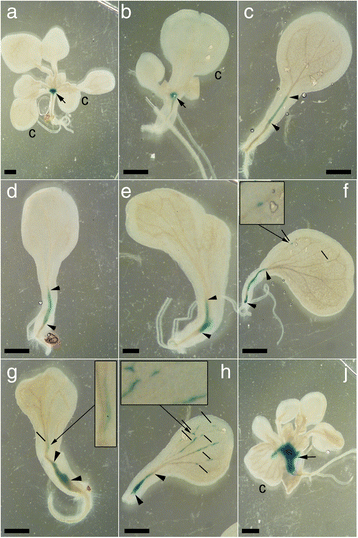
为了获得更多具有丰富信息的sams相关基因异位表达模式的标本,我们进行了分析GydF4y2Ba拟南芥GydF4y2Ba带菌的幼苗GydF4y2BaKNAT2p:格斯GydF4y2Ba记者[GydF4y2Ba29GydF4y2Ba].GydF4y2BaKNAT2GydF4y2Ba是一个GydF4y2Ba扫描隧道显微镜GydF4y2Ba-依赖的转录因子,其表达定位于SAM [GydF4y2Ba30.GydF4y2Ba](图。GydF4y2Ba6aGydF4y2Ba).单子叶植物的系谱GydF4y2Barpk1-7 X KNAT2p:格斯GydF4y2Ba杂交包含正常双子叶植物,有sam的单子叶植物和没有sam的单子叶植物幼苗。前两者在子叶基部的顶端显示GUS染色(图)。GydF4y2Ba6a,bGydF4y2Ba).缺乏sam的单子叶植物表现出一个变异谱GydF4y2BaKNAT2GydF4y2Ba许多幼苗表现得非常弱(图。GydF4y2Ba6cGydF4y2Ba)在融合的下胚轴子叶结构的中央(维管)组织中,GUS的表达更为强烈。这可能向子叶顶端或根尖方向延伸(图。GydF4y2Ba6d-hGydF4y2Ba).一些幼苗的变异性进一步增加,在子叶叶片中出现更小或更大的GUS染色斑(图。GydF4y2Ba6f-hGydF4y2Ba).单子叶植物的幼苗产生ESM表现出强GUS在子叶(图染色。GydF4y2Ba6jGydF4y2Ba).变量GydF4y2BaKNAT2GydF4y2Ba子叶中的表达与上述实验结果一致。因此,所有表达数据一起表明,无SAM的幼苗表现出异常SAM基因表达模式,导致eSM的产生是一个罕见事件,因为它需要多个SAM基因的协调和精确协调。GydF4y2Ba
分析GydF4y2BaKNAT2p:格斯GydF4y2Ba记者构造GydF4y2Barpk1-7GydF4y2Ba背景。显示的是野生型GydF4y2Ba一种GydF4y2Ba单子叶植物GydF4y2Barpk1-7GydF4y2BaB.GydF4y2BaSAM中有GUS染色(如箭头所示),无SAM单子叶植物GydF4y2Barpk1-7GydF4y2Ba幼苗GydF4y2Bac-jGydF4y2BaGUS表达弱(GydF4y2BaCGydF4y2Ba),在假定SAM位置具有可变扩展的GUS表达式(GydF4y2Bad-hGydF4y2Ba;箭头)和子叶(GydF4y2Baf-hGydF4y2Ba;短线),子叶中有eSMGydF4y2BajGydF4y2Ba插图以放大倍数显示细节。C:标记子叶GydF4y2Ba得了GydF4y2Ba和GydF4y2BajGydF4y2Ba.标尺:1毫米GydF4y2Ba
讨论GydF4y2Ba
结果表明:胚表皮细胞分裂和PIN1极性随时间和空间的随机变化GydF4y2Barpk1GydF4y2Ba突变导致子叶原基的发展变化,特别是一个子叶的指示早期发育事故完全丧失时球形胚阶段[GydF4y2Ba22GydF4y2Ba].后来我们发现在不同种类的单子叶植物中GydF4y2Barpk1GydF4y2Ba等位基因SAM的丢失频率较低但一致,似乎与缺乏可识别上胚轴区域的连续下胚轴子叶器官的产生同时发生。在本研究中,我们系统地分析了这一特殊表型。由于SAM缺失表型不是单一等位基因的特异性,因此我们重点关注继续GydF4y2Barpk1-7GydF4y2Ba当分析细胞形态和基因表达模式时。GydF4y2Ba
SAM-少GydF4y2Barpk1GydF4y2Ba在发育ESM时,幼苗缺乏可识别的器官分离,并显示出受损的细胞分化GydF4y2Ba
在心尖GydF4y2Ba拟南芥GydF4y2Ba是通过sam特异性对子叶/叶特异性基因的拮抗活性形成的[GydF4y2Ba31GydF4y2Ba].从本质上讲,在心尖GydF4y2Ba扫描隧道显微镜GydF4y2Ba激活GydF4y2BaKNAT1 / BPGydF4y2Ba和GydF4y2BaKNAT2GydF4y2Ba(及GydF4y2BaKNAT6GydF4y2Ba)直接或间接地通过压制GydF4y2BaAS1GydF4y2Ba和GydF4y2BaAS2GydF4y2Ba[GydF4y2Ba32GydF4y2Ba那GydF4y2Ba33GydF4y2Ba]相反,蛋白AS1(MYB蛋白)和AS2(LOB结构域蛋白)的复合物招募染色质重塑因子,尤其排除SAM特异性I类KNOX基因的活性GydF4y2BaKNAT1 / BPGydF4y2Ba和GydF4y2BaKNAT2GydF4y2Ba在叶和子叶组织中[GydF4y2Ba27GydF4y2Ba那GydF4y2Ba28GydF4y2Ba那GydF4y2Ba34GydF4y2Ba那GydF4y2Ba35GydF4y2Ba].因此,除了植物外,它们已经利用sam相关基因的重新激活来产生复叶[GydF4y2Ba36GydF4y2Ba],SAM基因活性从叶组织中排除。GydF4y2Ba
在SAM的子叶组织中较少GydF4y2Barpk1-7GydF4y2Ba幼苗时,我们检测到与sam相关的异位表达GydF4y2BaSTM,KNAT1GydF4y2Ba和GydF4y2BaKNAT2GydF4y2Ba基因及其子叶特异性表达GydF4y2BaAS1GydF4y2Ba.这意味着,在同一组织的邻近区域内检测到拮抗基因活性,并可能通过产生位置、大小和形状改变的组织和细胞而损害子叶组织。在异位表达单一SAM特异性基因的叶组织中也观察到类似的细胞形态的深刻变化(例如[GydF4y2Ba37GydF4y2Ba])。根据PIN1极性的缺陷,维管组织模式的紊乱表明生长素存在缺陷。有趣的是,eSMs产生的莲座具有不规则的叶序模式。在这种情况下,值得一提的是,生长素和细胞分裂素平衡的内环境平衡对茎发育和叶序的影响[GydF4y2Ba38GydF4y2Ba-GydF4y2Ba40GydF4y2Ba].下胚轴-子叶融合器官的发育,以连接下胚轴和子叶的叶柄为代价,表明正常细胞分化受到严重干扰。尽管细胞分裂,这个融合的下胚轴-子叶器官的形态清晰地保留了野生型ab和正面的极性GydF4y2Barpk1-6GydF4y2Ba和GydF4y2Barpk1-7GydF4y2Ba无SAM的单子叶植物。未观察到近轴和远轴同一基因突变体的辐射[GydF4y2Ba41GydF4y2Ba].GydF4y2Ba
monocot中的SAM损失和eSM增益GydF4y2Barpk1-7GydF4y2Ba幼苗可能是由于SAM特异性基因的及时和空间非协调表达GydF4y2Ba
先前的研究表明,尽管(单个)KNOX基因的异位(过度)表达可能导致异位SAM,但它们的稳定需要干细胞特性和其他SAM基因的平衡和协同活动[GydF4y2Ba30.GydF4y2Ba那GydF4y2Ba37GydF4y2Ba那GydF4y2Ba42GydF4y2Ba那GydF4y2Ba43GydF4y2Ba].我们的研究表明,这是缺乏sam的主要问题GydF4y2Barpk1-7GydF4y2Ba自分析基因以来,突变体往往表现出非协调和不平衡的活性。例如,在一个案例中GydF4y2Ba乌斯GydF4y2Ba在不含SAM的单子叶子叶中不表达,而GydF4y2BaSTM,KNAT1GydF4y2Ba和GydF4y2BaKNAT2GydF4y2Ba后者在突变体中的表达似乎比在野生型中的表达更强烈GydF4y2Ba乌斯GydF4y2Ba首先,SAM生成需要表达式[GydF4y2Ba44GydF4y2Ba,这就解释了为什么这些幼苗在表达其他与SAM相关的基因的同时却缺乏茎分生组织。此外,我们检测到表达在空间和时间方面的不一致。使用晚时间的地对空导弹的幼苗表现出一种时滞协调。这也被缺乏sam的幼苗证实,显示异位GydF4y2BaKNAT2GydF4y2BaP.GydF4y2Ba:格斯GydF4y2Ba而其他国家则几乎没有这种活动。前者也显示出空间缺陷,因为GUS染色可以发生在非常不同的位置和不同的延伸。这些观察结果解释了为什么esm是罕见的,并且没有可预测的频率。只有当所有必需的SAM相关基因都以一致的方式活跃并超过临界值时,它们才会巧合地发展。同样,“正常”单子叶幼苗的SAMs在大小上与野生型SAMs重叠,而不是连续不断地逐渐减小,直到达到没有SAMs的幼苗。GydF4y2Ba
SAM-少GydF4y2Barpk1GydF4y2Ba由于缺乏位置信息,而不是由于抑制了SAM特异性基因的活性GydF4y2Ba
这GydF4y2Barpk1GydF4y2Ba表型提出了RPK1是否通过直接控制相应基因诱导子叶原基和SAM启动的问题。这两种可能性都可以排除。首先,对于前者,GydF4y2Barpk1GydF4y2Ba突变体应该提供缺少两个子叶的幼苗GydF4y2Bapid enpGydF4y2Ba双突变体[GydF4y2Ba4.GydF4y2Ba]。在所有分析的个案中,情况并非如此GydF4y2Barpk1GydF4y2Ba纯合子(> > 10.000)。有趣的是,单子叶植物GydF4y2Barpk1GydF4y2Ba胚只发育一个原基,但同时形成两个子叶原GydF4y2Ba22GydF4y2Ba]这与以前的命运图实验是一致的,这些实验表明子叶是连续产生的[GydF4y2Ba45GydF4y2Ba].其次,我们的数据也排除了以下可能性:GydF4y2BaRPK1GydF4y2Ba由于SAM少,直接控制SAM基因的表达和发育GydF4y2Barpk1-7GydF4y2Ba幼苗保留了表达多种SAM特异基因甚至产生ESM的能力。这证实了子叶和SAM在很大程度上独立于发育的观点。GydF4y2Ba
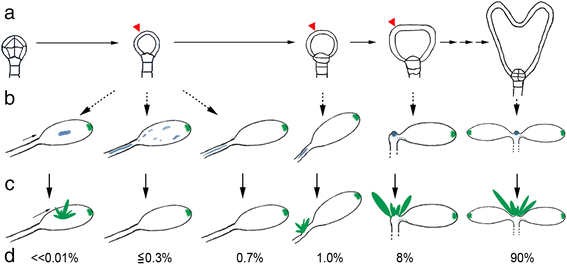
然而,是什么导致异位SAM基因表达和eSM发展?纯合子GydF4y2Barpk1GydF4y2Ba突变体不同于先前的例子,在转基因和复杂显性突变背景下分别诱导异位茎分生组织[GydF4y2Ba30.GydF4y2Ba那GydF4y2Ba37GydF4y2Ba那GydF4y2Ba42GydF4y2Ba那GydF4y2Ba43GydF4y2Ba那GydF4y2Ba46GydF4y2Ba].相比之下,GydF4y2Barpk1GydF4y2Ba突变体表示失功能的状态下和上子叶的顶部异位形成在正确位置或ESMS晚的SAM。这GydF4y2Barpk1-7GydF4y2Ba异位芽,虽然较大,令人想起叶上叶上的附生花序GydF4y2Bafil-5 yab3-1GydF4y2Ba突变体(GydF4y2Ba47GydF4y2Ba和异位叶芽GydF4y2Baas1GydF4y2Ba突变体(GydF4y2Ba27GydF4y2Ba].然而,这些基因都没有发生突变GydF4y2Barpk1GydF4y2Ba这些突变体中异位SAM基因表达(和eSMs)的唯一联系是改变的下胚轴-子叶融合形态。eSMs仅发生在形态改变的无SAM单子叶植物中的概率(10000分之6;表1)GydF4y2Ba2 gydF4y2Ba)的概率非常低(≤10)GydF4y2Ba−12GydF4y2Ba)。这就引出了一个模型,它集成了GydF4y2Barpk1GydF4y2Ba突变体,即表皮PIN1极性和细胞分裂障碍,及其表型(图。GydF4y2Ba7.GydF4y2Ba)事实上,PIN1极性和生长素内稳态的紊乱分别影响芽再生的启动[GydF4y2Ba39GydF4y2Ba那GydF4y2Ba48GydF4y2Ba那GydF4y2Ba49GydF4y2Ba].我们的模型考虑到,由于功能冗余,这些缺陷沿完整胚胎发育随机分散(图。GydF4y2Ba7.GydF4y2Ba).越早GydF4y2Barpk1GydF4y2Ba缺陷表现得越严重,后果越严重。极端的是融合的下胚轴子叶形态,SAM缺失,这是胚胎中最早的细胞承诺之一(图。GydF4y2Ba7.GydF4y2Ba)显然,连续下胚轴子叶的形态伴随着位置信息的丢失,因为胚胎学后,芽分生组织可以在不同的位置形成(晚SAMs,eSMs)。这种情况也反映在那些没有SAM的单子叶植物中可变的异位SAM基因表达模式中,这些单子叶植物不能形成芽分生组织(图。GydF4y2Ba7.GydF4y2Ba).GydF4y2Ba
早期解释模型GydF4y2Barpk1-7GydF4y2Ba缺陷。GydF4y2Ba一种GydF4y2Ba通过基因中的冗余基因未能实现足够的RPK1功能(红色箭头)GydF4y2Barpk1-7GydF4y2Ba突变体在时间和空间上是随机的。早期的变异对SAM-vs子叶组织细胞群的影响比晚期的更严重。GydF4y2BaB.GydF4y2Ba给出可能的表达式模式(蓝色)GydF4y2BaKNAT2GydF4y2BaP.GydF4y2Ba:格斯GydF4y2Ba以sam相关基因为例。GydF4y2BaCGydF4y2Ba芽分生组织的实现和维持依赖于所有必需SAM基因的精确定位和协调表达。GydF4y2BaD.GydF4y2Ba图中所示为带SAMs/ESM和不带SAMs/ESM的单声道和双声道天线的频率,主要基于GydF4y2Barpk1-7GydF4y2Ba数据(有关详细信息,请参阅文本和GydF4y2Ba方法GydF4y2Ba).绿点象征生长素最大值。需要注意的是,重复的PIN1极性和细胞分裂干扰会导致额外的最大子叶和裂叶(见[GydF4y2Ba22GydF4y2Ba])GydF4y2Ba
结论GydF4y2Ba
这项研究表明,RPK1并不主要控制SAM基因,即使是极端的GydF4y2Barpk1-7GydF4y2Ba表型保留了恢复茎分生组织发育(eSM)和产生全功能植株的能力。然而,RPK1确实通过其主要缺陷对芽和(子叶)器官的产生产生了良好的影响,表现出显著的形态可塑性。这种可塑性导致了与现存被子植物特别是真单子叶植物和单子叶双子叶植物属有趣的相似性GydF4y2Ba单叶GydF4y2Ba[GydF4y2Ba50GydF4y2Ba]及GydF4y2Ba链果GydF4y2Ba[GydF4y2Ba51GydF4y2Ba]分别。GydF4y2BaRPK1GydF4y2Ba突变体在某种程度上也很有启发性,它揭示了一个不太受关注的方面。这就是外显率问题。相比之下,突变体的子叶完全外显率降低GydF4y2Bapid enpGydF4y2Ba[GydF4y2Ba4.GydF4y2Ba,已知的单一或组合突变GydF4y2Ba拟南芥GydF4y2Ba,不能稳定地生产100%的单子叶植物[GydF4y2Ba22GydF4y2Ba那GydF4y2Ba23GydF4y2Ba].这一现象以前已经通过研究子叶数量的修饰基因来解决GydF4y2Ba金鱼草GydF4y2Ba(例如[GydF4y2Ba52GydF4y2Ba])。最近,协会研究使用GydF4y2Ba拟南芥GydF4y2Ba生态型已确定GydF4y2BaRPK1GydF4y2Ba作为芽器官再生的基本(但不是唯一)基因[GydF4y2Ba53GydF4y2Ba].因此,GydF4y2Barpk1GydF4y2Ba单子叶植物表型从两个方面加深了我们对被子植物发育的理解。第一,它指出了从双子叶植物中产生单子叶植物所需的组织和遗传特性。第二,它表明,寻找那些功能必须协同改变才能获得完全穿透的基因是有希望的单子轴的ce。GydF4y2Ba
方法GydF4y2Ba
植物品系及生长条件GydF4y2Ba
col0生态型作为野生型参考。强烈的GydF4y2Barpk1-7GydF4y2Ba等位基因源自胶原的快中子诱变种子自交/GydF4y2Bagl-1GydF4y2Ba背景,代表一种倒位突变[GydF4y2Ba22GydF4y2Ba].单子叶植物GydF4y2Barpk1-6GydF4y2Ba和GydF4y2Barpk1-7GydF4y2Ba幼苗分析在原线和不同背景后产生的不同(报告)线。在GydF4y2Barpk1-7GydF4y2Ba,GydF4y2Bagl-1GydF4y2Ba背景导致胚后叶片的毛状体特征丧失。因此,GydF4y2Barpk1-7GydF4y2Ba被交给GydF4y2BaGL-1GydF4y2Ba背景(藏匿GydF4y2BaPIN1p:PIN1::GFPGydF4y2Ba记者)。这个GydF4y2BaKNAT2p::GUSGydF4y2Ba记者[GydF4y2Ba29GydF4y2Ba]与…交叉GydF4y2Barpk1-7GydF4y2Ba为了检测异位SAM基因相关的表达模式。分离GydF4y2Bagl1/gl1GydF4y2Ba这种杂交缺乏的血统GydF4y2BaKNAT2p::GUSGydF4y2Ba报告者用于评估eSM频率GydF4y2Barpk1-6GydF4y2Ba等位基因是从NASC(诺丁汉拟南芥资源中心)获得的WS-2生态型中的ATG插入357 bp的T-DNA;有关更多详细信息,请参阅[GydF4y2Ba22GydF4y2Ba])。该等位基因要么作为原始系分析,要么作为含有GydF4y2BaPIN1p:PIN1::GFPGydF4y2Ba记者。幼苗在土壤上的生长基本上如所述[GydF4y2Ba22GydF4y2Ba].用次氯酸钙(约5%,15 min)对种子进行表面消毒,然后用H洗涤3XGydF4y2Ba2 gydF4y2BaO.无SAM单子叶植物幼苗的无菌培养最初在皮氏培养皿中进行0.5X MS,随后分别在连续光照和21°C下在洋红盒中进行。GydF4y2Ba
显微镜检查GydF4y2Ba
胚和苗的半薄切片和全株分析如前所述[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba12GydF4y2Ba那GydF4y2Ba54GydF4y2Ba].使用ZEISS Axiophot1显微镜、尼康数码相机(F5SLR)和相应软件(尼康相机控制Pro)进行拍照。Axiophot上的Epifluorescence显微镜使用HBO50紫外/光源和DAPI滤光系统(蔡司滤光组01,BP365/FT395/LP397)。GydF4y2Ba
GUS-StainingGydF4y2Ba
将带GUS报告载体的幼苗在真空渗透NaH溶液固定后进行染色GydF4y2Ba2 gydF4y2Ba阿宝GydF4y2Ba4.GydF4y2Ba(pH 7.0)中和在Eppendorf管中的1个%甲醛10分钟。将管放置在冰上20分钟后,将固定剂用50mM的NaH洗掉GydF4y2Ba2 gydF4y2Ba阿宝GydF4y2Ba4.GydF4y2Ba(pH值7.0)并按照前面所述进行染色[GydF4y2Ba55GydF4y2Ba].采用显示GUS染色的无SAM单子叶植物幼苗来估计子叶中异位表达的无SAM单子叶植物与仅在下胚轴中表达的单子叶植物的比例。GydF4y2Ba
rt - PCR、PCRGydF4y2Ba
按照常规方案分离植物DNA。根据供应商的说明,分别使用NucleoSpin®-RNA Plant(Macherey-Nagel)或PolyATract System IV试剂盒(Promega)进行RNA分离、反转录和PCR。使用TaqMan®试剂盒(罗氏应用生物系统公司)进行总RNA的反转录包括以下步骤:20分钟25°C,然后45分钟48°C,并在95°C时停止5分钟。RT-PCR分析是半定量的;即,对于要比较的探针,在RT反应中使用相同数量的RNA材料,和/或根据试验结果调整装载的PCR产物的数量GydF4y2BaACT2GydF4y2Ba反应图。GydF4y2Ba4aGydF4y2Ba无花果GydF4y2Ba4bGydF4y2Ba和附加文件GydF4y2Ba1GydF4y2Ba:图S2为独立实验,因为使用了三批不同的幼苗。特别注意使用离体子叶组织,将切面定位在离下胚轴-子叶融合区安全距离处。GydF4y2Ba
使用了以下正向和反向引物对(括号中的基因和片段大小):GydF4y2Ba
5′-GCCCATCATGATCACACAATC-3′和5′-CTTTAAGCTCTCATCCTCGCTTG-3′(GydF4y2Ba扫描隧道显微镜GydF4y2Ba;701 bp片段);5'-GGCACCGAGCTTGGGCAGAC-3'和5'-GAGACGGTTCAGGGGCGGTC-3(GydF4y2BaAS1GydF4y2Ba;322个基点);5 ' - tcagaagagattcaac -3 '和5 ' -AGGGCGAACTTCCGATTGG-3 ' (GydF4y2Ba乌斯GydF4y2Ba; 562 bp);5′-caccgtctctctctctta-3′和5′-attccgccaacgcctctctctct-3′(GydF4y2BaKNAT1GydF4y2Ba(534 bp),;GGAGCTGATCGCTTGATG-3′和5′-CACAATCGGAGCTCTGTC-3(GydF4y2BaKNAT2GydF4y2Ba;380个基点);5 ' -TTGTTCCAGCCCTCGTTTGT-3'and 5 ' -CCTGGACCTGCCTCATCATACT-3”(GydF4y2BaACT2GydF4y2Ba;323个基点)。PCR循环为:3 min 93°C, 40X (45 s 93°C, 60 s 60°C, 60 s 72°C), 3 min 72°C, 3 min 4°C。GydF4y2Ba
为了评估正确的基因身份,一些RT-PCR产物通过EUROFINS/MWG服务进行测序。GydF4y2Ba
原位杂交分析GydF4y2Ba
原位杂交、抗探针和正义探针的评估以及野生型表达模式与先前的报告和先前的确认相同[GydF4y2Ba4.GydF4y2Ba那GydF4y2Ba22GydF4y2Ba].在Contrast to the study of Luichtl et al. [22GydF4y2Ba],我们重点关注鱼雷早期阶段的胚胎。GydF4y2Ba
缩写GydF4y2Ba
- ACT2GydF4y2Ba:GydF4y2Ba
-
肌动蛋白2GydF4y2Ba
- AS1GydF4y2Ba:GydF4y2Ba
-
不对称叶1GydF4y2Ba
- AS2GydF4y2Ba:GydF4y2Ba
-
不对称叶2GydF4y2Ba
- BP.GydF4y2Ba:GydF4y2Ba
-
短花梗GydF4y2Ba
- CLV3GydF4y2Ba:GydF4y2Ba
-
棒状体3GydF4y2Ba
- clv3GydF4y2Ba:GydF4y2Ba
-
clavata3GydF4y2Ba
- Col-0:GydF4y2Ba
-
哥伦比亚-0GydF4y2Ba
- 恩普GydF4y2Ba:GydF4y2Ba
-
松果体增强子GydF4y2Ba
- 恩普GydF4y2Ba:GydF4y2Ba
-
增强剂的pinoidGydF4y2Ba
- eSM:GydF4y2Ba
-
异位茎分生组织GydF4y2Ba
- gl1GydF4y2Ba:GydF4y2Ba
-
glabra1GydF4y2Ba
- 格斯:GydF4y2Ba
-
β-葡萄糖醛酸酶GydF4y2Ba
- KNAT1GydF4y2Ba:GydF4y2Ba
-
打结的1-类拟南芥1GydF4y2Ba
- KNAT2GydF4y2Ba:GydF4y2Ba
-
打结的1-类拟南芥2GydF4y2Ba
- 高球GydF4y2Ba:GydF4y2Ba
-
外侧器官边界GydF4y2Ba
- MIPS:GydF4y2Ba
-
D-肌醇-3-磷酸合酶GydF4y2Ba
- MS:GydF4y2Ba
-
Murashige斯GydF4y2Ba
- NASC:GydF4y2Ba
-
诺丁汉拟南芥资源中心GydF4y2Ba
- NPH3GydF4y2Ba:GydF4y2Ba
-
非嗜光下胚轴3GydF4y2Ba
- PIDGydF4y2Ba:GydF4y2Ba
-
皮诺德GydF4y2Ba
- pidGydF4y2Ba:GydF4y2Ba
-
皮诺德GydF4y2Ba
- PIN1GydF4y2Ba:GydF4y2Ba
-
PINFORMED1GydF4y2Ba
- 内存:GydF4y2Ba
-
根顶端分生组织GydF4y2Ba
- RPK1GydF4y2Ba:GydF4y2Ba
-
受体蛋白质KINASE1GydF4y2Ba
- RPK2GydF4y2Ba:GydF4y2Ba
-
受体蛋白质KINASE2GydF4y2Ba
- SAM:GydF4y2Ba
-
茎尖分生组织GydF4y2Ba
- 碳化硅GydF4y2Ba:GydF4y2Ba
-
单子叶GydF4y2Ba
- 扫描隧道显微镜GydF4y2Ba:GydF4y2Ba
-
无茎分生组织GydF4y2Ba
- WS-2:GydF4y2Ba
-
Wassilewskija-2GydF4y2Ba
- 乌斯GydF4y2Ba:GydF4y2Ba
-
乌谢尔GydF4y2Ba
工具书类GydF4y2Ba
- 1.GydF4y2Ba
郑志刚,陈志刚,陈志刚,等。开花植物胚胎模式的形成。Annu Rev Genet, 1994; 28:51 - 71。GydF4y2Ba
- 2.GydF4y2Ba
Long JA, Moan EI, Medford JI, Barton MKGydF4y2Ba打结GydF4y2Ba一类同源结构域蛋白质,由GydF4y2Ba扫描隧道显微镜GydF4y2Ba基因的GydF4y2Ba拟南芥GydF4y2Ba《自然》1996;379:66-9。GydF4y2Ba
- 3.GydF4y2Ba
Mayer KFX,Schoof H,Haecker A,Lenhard M,Jürgens G,Laux T.角色GydF4y2Ba乌谢尔GydF4y2Ba在调节干细胞命运的过程中GydF4y2Ba拟南芥GydF4y2Ba芽分生组织。细胞。1998;95:805-15。GydF4y2Ba
- 4.GydF4y2Ba
王志强,王志强,王志强,等。的基因GydF4y2Ba松果体增强子GydF4y2Ba控制子叶发展的GydF4y2Ba拟南芥GydF4y2Ba胚胎.发育.2005;132:4063-74。GydF4y2Ba
- 5.GydF4y2Ba
Furutani M、Kajiwara T、Kato T、Treml BS、Stockum C、Torres Ruiz RA等。基因GydF4y2BaPINOID MACCHI-BOU4 /增强剂GydF4y2Ba编码一种NPH3样蛋白,并在分子水平上揭示器官发生和向光性之间的相似性。发展。2007;134:3849–59。GydF4y2Ba
- 6.GydF4y2Ba
《开花植物的进化和分类》,第二版,纽约布朗克斯:纽约植物园;1988年。GydF4y2Ba
- 7.GydF4y2Ba
Crane PR,Fris EM,Pedersen KR.被子植物的起源和早期多样化.自然.1995;374:27-33。GydF4y2Ba
- 8.GydF4y2Ba
被子植物系统发育组III.有花植物目和科被子植物系统发育组分类的更新:APG III.Bot J Linnean Soc.2009;161:105–21。GydF4y2Ba
- 9GydF4y2Ba
Chaudhury AM, Letham S, Dennis ES。GydF4y2Baamp1GydF4y2Ba-一种突变体,具有高细胞分裂素水平和改变的胚胎模式、更快的营养生长、组成性光形态发生和早熟开花。植物杂志1993;4:907–16。GydF4y2Ba
- 10.GydF4y2Ba
Vidaurre DP,Ploense S,Krogan NT,Berleth T.AMP1和MP拮抗性调节胚胎和分生组织的发育GydF4y2Ba拟南芥GydF4y2Ba. 发展2007;134:2561–7.GydF4y2Ba
- 11.GydF4y2Ba
Chandler JW,Cole M,Flier A,Grewe B,Werr W.AP2转录因子DORNRÖSCHEN和DORNRÖSCHEN样冗余控制GydF4y2Ba拟南芥GydF4y2Ba通过与Phavolla相互作用形成胚胎模式。发育。2007;134:1653-62。GydF4y2Ba
- 12.GydF4y2Ba
Torres Ruiz RA,Jürgens G.基因突变GydF4y2BaFASSGydF4y2Ba基因分离模式的形成与形态发生GydF4y2Ba拟南芥GydF4y2Ba发展。发展。1994;120:2967 - 78。GydF4y2Ba
- 13.GydF4y2Ba
张志强,张志强,张志强,等。作为植物器官形成的一个共同模块的本地,外排依赖的生长素梯度。细胞。2003;115:591 - 602。GydF4y2Ba
- 14.GydF4y2Ba
Friml J,Yang X,Michniewicz M,Weijers D,Quint A,Tietz O等GydF4y2Ba皮诺德GydF4y2Ba-依赖的二元开关的顶端-基底PIN极性靶向指导生长素外流。科学。2004;306:862-5。GydF4y2Ba
- 15GydF4y2Ba
Bennett SRM, Alvarez J, Bossinger G, Smyth DR. MorphogenesisGydF4y2Ba皮诺德GydF4y2Ba突变体的GydF4y2Ba拟南芥GydF4y2Ba《植物杂志》,1995年;8:505-20。GydF4y2Ba
- 16GydF4y2Ba
罗勇,秦刚,张军,梁艳,宋颖,赵敏,等。d -肌醇-3-磷酸影响磷脂酰肌醇介导的内膜功能GydF4y2Ba拟南芥GydF4y2Ba并且是生长素调节的胚胎发育是至关重要的。植物细胞。2011; 23:1352年至1372年。GydF4y2Ba
- 17GydF4y2Ba
关键词:生长素,器官发生,NPY基因,AGC激酶GydF4y2Ba拟南芥GydF4y2Ba美国国家科学院学报,2008;105:21017-22。GydF4y2Ba
- 18GydF4y2Ba
Dhonukshe P,Huang F,Galvan Ampudia CS,Mähönen AP,Kleine Vehn J,Quint A,等。质膜结合AGC3激酶磷酸化TPRXS(N/S)基序上的PIN生长素载体以指导顶端PIN循环。发展。2010;137:3245–55。GydF4y2Ba
- 19GydF4y2Ba
袁聪,沈X,马秀吉K,郑Z,戴X,程Y,等。拟南芥和丝瓜色氨酸氨基转移酶在植物体内转化色氨酸为吲哚-3-乙酸的研究GydF4y2Ba拟南芥GydF4y2Ba. 美国国家科学院学报,2011年;108:18518–23.GydF4y2Ba
- 20.GydF4y2Ba
刘春明,强生S,迪格雷戈里奥S,王TL。豌豆单子叶突变体及其在理解植物胚胎发育中的意义。发展遗传学。1999;25:11-22。GydF4y2Ba
- 21.GydF4y2Ba
Nodine MD、Yadegari R、Tax F.RPK1和TOAD2是两种受体样激酶,它们是基因表达的冗余必需酶GydF4y2Ba拟南芥GydF4y2Ba胚胎模式形成。Dev细胞。2007;12:943-56。GydF4y2Ba
- 22.GydF4y2Ba
Luichtl M,Fiesselmann BS,Matthes M,Yang X,Peis O,BrunnerÄ等。基因突变GydF4y2Ba拟南芥RPK1GydF4y2Ba基因通过调节表皮细胞的形状和极性来解偶联子叶原基和原基。Bio Open.2013;2:1093–102。GydF4y2Ba
- 23.GydF4y2Ba
Nodine MD,Tax F.两种受体样激酶共同建立GydF4y2Ba拟南芥GydF4y2Ba子叶原基。发展生物学。2008;314:161-70。GydF4y2Ba
- 24.GydF4y2Ba
Kinoshita A, Betsuyaku S, Osakabe Y, Mizuno S, Nagawa S, Stahl Y, et al.;RPK2是一种重要的类受体激酶,在细胞内传递CLV3信号GydF4y2Ba拟南芥GydF4y2Ba《发展》,2010;137:3911-20。GydF4y2Ba
- 25.GydF4y2Ba
Laux T,Mayer KFX,Berger J,Jürgens G.WUSCHEL基因是植物芽和花分生组织完整性所必需的GydF4y2Ba拟南芥GydF4y2Ba《发展》,1996;122:87-96。GydF4y2Ba
- 26.GydF4y2Ba
Clark SE,运行MP,Meyerowitz EM.CLAVATA3是芽和花分生组织发育的一种特殊调节因子,影响与CLAVATA1相同的过程。发育。1995;121:2057–67。GydF4y2Ba
- 27.GydF4y2Ba
Byrne ME、大麦R、Curtis M、Arroyo JM、Dunham M、Hudson A等。不对称叶1介导植物的叶型和干细胞功能GydF4y2Ba拟南芥GydF4y2Ba.大自然。2000;408:967 - 71。GydF4y2Ba
- 28GydF4y2Ba
郭M,托马斯J,柯林斯G,Timmermans MCP.非对称叶1复合体对KNOX基因座的直接抑制GydF4y2Ba拟南芥GydF4y2Ba《植物细胞》2008;20:48-58。GydF4y2Ba
- 29GydF4y2Ba
Laufs P,Dockx J,Kronenberger J,Traas J.MGOUN1和MGOUN2:植物茎尖和花分生组织原基起始所需的两个基因GydF4y2Ba拟南芥GydF4y2Ba《发展》,1998;125:1253-60。GydF4y2Ba
- 30GydF4y2Ba
Gallois JL、Woodward C、Reddy GV、Sablowski R.无分生芽和WUSCHEL组合激发了小鼠异位器官发生GydF4y2Ba拟南芥GydF4y2Ba.发展。2002;129:3207-17。GydF4y2Ba
- 31GydF4y2Ba
《诺克斯家族的故事》。植物生态学报。2009;12:593-8。GydF4y2Ba
- 32GydF4y2Ba
斯科菲尔德S,穆雷扎哈。在植物干细胞小生境KNOX基因的功能。植物mol biol。2006; 60:929-46。GydF4y2Ba
- 33.GydF4y2Ba
伯恩·梅,Simorowski J,Martienssen RA.不对称叶1揭示了GydF4y2Ba拟南芥GydF4y2Ba《发展》,2002;129:1957-65。GydF4y2Ba
- 34.GydF4y2Ba
Semiarti E,Ueno Y,Tsukaya H,Iwakawa H,Machida C,Machida Y.的不对称叶2基因GydF4y2Ba拟南芥GydF4y2Ba调控对称叶片的形成、脉序的建立和与分生组织相关的同源盒基因的抑制。发展。2001;128:1771 - 83。GydF4y2Ba
- 35.GydF4y2Ba
李Z,李B,沈和华,黄H,董A。TCP转录因子与AS2相互作用抑制小鼠I类KNOX基因GydF4y2Ba拟南芥GydF4y2Ba《植物杂志》2012;71:99–107。GydF4y2Ba
- 36.GydF4y2Ba
王志强,王志强,王志强,等。复叶发育的保守分子框架。科学。2008;322:1835-9。GydF4y2Ba
- 37.GydF4y2Ba
Chuck G,Lincoln C,Hake S.KNAT1在大肠杆菌中过度表达时诱导具有异位分生组织的裂片叶GydF4y2Ba拟南芥GydF4y2Ba《植物细胞》1996;8:1277-89。GydF4y2Ba
- 38.GydF4y2Ba
李志强,王志强,王志强,等。WUSCHEL通过直接调控细胞分裂素诱导的反应调节因子来控制分生组织功能。大自然。2005;438:1172-5。GydF4y2Ba
- 39.GydF4y2Ba
程志军,王磊,孙伟,张勇,周超,苏永华,等。生长素和细胞分裂素对茎分生组织诱导的响应模式是由生长素响应因子3调控细胞分裂素生物合成的结果。植物杂志。2013;161:240-51。GydF4y2Ba
- 40GydF4y2Ba
Besnard F,Refahi Y,Morin V,Marteaux B,Brunoud G,Chambrier P等。细胞分裂素信号抑制场对叶序分化具有鲁棒性。自然。2014;505:417–21。GydF4y2Ba
- 41GydF4y2Ba
金刚砂JF,弗洛伊德SK,Alvarez的Ĵ,Eshed Y,霍克NP,Izhaki A,等人。径向图案GydF4y2Ba拟南芥GydF4y2Ba由HD-ZIP三级和KANADI基因拍摄。当代生物学。2003;13:1768 - 74。GydF4y2Ba
- 42GydF4y2Ba
Sinha NR、Williams RE、Hake S.玉米同源框基因KNOTTED-1的过度表达导致细胞命运从确定转变为不确定。基因发展,1993年;7:787–95.GydF4y2Ba
- 43.GydF4y2Ba
Brand U,Grünewald M,Hobe M,Simon R.两个同源框基因对小鼠CLV3表达的调节GydF4y2Ba拟南芥GydF4y2Ba《植物物理学》2002;129:565-75。GydF4y2Ba
- 44.GydF4y2Ba
Gaillochet C,Dau G,Lohmann JU.O Cell,你在哪里?芽分生组织模式的机制。Curr Opin Plant Biol.2015;23:91–7。GydF4y2Ba
- 45.GydF4y2Ba
Woodrick R, Martin PR, Birman I, Pickett FB。这GydF4y2Ba拟南芥GydF4y2Ba胚胎射击命运图。发展。2000;127:813-20。GydF4y2Ba
- 46.GydF4y2Ba
麦康奈尔JR,巴顿MK.植物的叶极性和分生组织形成GydF4y2Ba拟南芥GydF4y2Ba.发展。1998;125:2935-42。GydF4y2Ba
- 47.GydF4y2Ba
Siegfried KR, Eshed Y, Baum SF, Otsuga D, Drews GN, Bowman JL。YABBY基因家族的成员决定了细胞的下轴命运GydF4y2Ba拟南芥GydF4y2Ba《发展》,1999;126:4117-28。GydF4y2Ba
- 48.GydF4y2Ba
Gordon SP, Heisler MG, Reddy GV, Ohno C, Das P, Meyerowitz EMGydF4y2Ba拟南芥GydF4y2Ba茎分生组织.发育.2007;134:3539-48。GydF4y2Ba
- 49.GydF4y2Ba
Atta R、Laurens L、Boucheron Dubuisson E、Guivarc'h A、Carnero E、Giraudat Pautot V等。细胞的多能性GydF4y2Ba拟南芥GydF4y2Ba木质部围周期是根和下胚轴外植体再生芽的基础GydF4y2Ba体外GydF4y2Ba《植物杂志》2009;57:626-44。GydF4y2Ba
- 50GydF4y2Ba
Tsukaya H.单叶植物子叶不平等命运的测定,GydF4y2Ba单叶纲GydF4y2Ba.发展。1997;124:1275 - 80。GydF4y2Ba
- 51GydF4y2Ba
Harrison J,Möller M,Langdale J,Cronk Q,Hudson A.KNOX基因在植物形态新颖性进化中的作用GydF4y2Ba链果GydF4y2Ba《植物细胞》2005;17:430-43。GydF4y2Ba
- 52GydF4y2Ba
Stubbe H.尤伯杯死Stabilisierung DES SICH variabel manifestierenden Merkmals“Polycotylie”冯GydF4y2Ba金鱼草GydF4y2BaL.Die Kulturpflanze.1963;XI:250-63。GydF4y2Ba
- 53GydF4y2Ba
Motte H,Vercauteren A,Depuydt S,Landschoot S,Geelen D,Werbrouck S,等。结合连锁和关联图谱鉴定GydF4y2Ba受体蛋白质KINASE1GydF4y2Ba作为一个重要的GydF4y2Ba拟南芥GydF4y2Ba拍摄再生基因。美国国立科学院。2014; 111:8305-10。GydF4y2Ba
- 54GydF4y2Ba
引用本文:王志强,王志强,王志强。拟南芥基因GydF4y2Ba茄瓜/ PASTICCINO2GydF4y2Ba是分生组织和非分生组织细胞增殖控制所必需的,并编码一种假定的抗磷酸酶。Dev Genes Evol.2002;212:542–50。GydF4y2Ba
- 55GydF4y2Ba
Jefferson RA,Kavanagh TA,Bevan MW.GUS融合:β-葡萄糖醛酸酶作为高等植物中一种敏感和多功能的基因融合标记物.欧洲微生物杂志,1987;6:3901-7。GydF4y2Ba
确认GydF4y2Ba
我们感谢F.Assaad对手稿的评论和批判性阅读以及H.Miller Mommerskamp和R.Radykewicz的帮助。这项工作的一部分得到了DFG的支持(R.A.T.R.获得134/8-1的拨款)。我们感谢Alfons Gierl对我们工作的支持以及NASC对工厂生产线的支持。作者声明没有利益冲突。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
通讯作者GydF4y2Ba
补充资料GydF4y2Ba
相互竞争的利益GydF4y2Ba
作者声明他们没有相互竞争的利益。GydF4y2Ba
作者的贡献GydF4y2Ba
BSF和ML进行突变体鉴定和原位分析,XY, MM和OP参与进一步的品系分子分析和鉴定,RATR设计项目,参与分子、表型和遗传工作并撰写论文。所有作者阅读并批准了最终的手稿。GydF4y2Ba
附加文件GydF4y2Ba
附加文件1:GydF4y2Ba
图S1。GydF4y2Ba单子叶植物eSM的后代GydF4y2Barpk1-7GydF4y2Ba植物。GydF4y2Ba图S2GydF4y2Ba:单株RT-PCR分析GydF4y2Barpk1-7GydF4y2Ba单子叶植物幼苗。GydF4y2Ba图S3GydF4y2Ba:双子叶植物的原位杂交GydF4y2Barpk1-7GydF4y2Ba胚胎具有GydF4y2Ba扫描隧道显微镜GydF4y2Ba调查。GydF4y2Ba图S4GydF4y2Ba:原位双子叶单子叶植物和杂交GydF4y2Barpk1-7GydF4y2Ba胚胎具有GydF4y2BaCLV3GydF4y2Ba调查。GydF4y2Ba图S5GydF4y2Ba:双子叶植物的原位杂交GydF4y2Barpk1-7GydF4y2Ba胚胎具有GydF4y2Ba恩普GydF4y2Ba调查。GydF4y2Ba图S6GydF4y2Ba:原位双子叶单子叶植物和杂交GydF4y2Barpk1-7GydF4y2Ba胚胎具有GydF4y2BaPIDGydF4y2Ba调查。GydF4y2Ba
权利和权限GydF4y2Ba
开放获取GydF4y2Ba本文根据知识共享署名4.0国际许可证获得许可,该许可证允许以任何媒体或格式使用、共享、改编、分发和复制,前提是您给予原作者和来源适当的信任,提供知识共享许可证的链接,并说明是否进行了更改。GydF4y2Ba
本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非该材料的信用额度中另有说明。如果该材料未包含在文章的知识共享许可证中,且您的预期用途未经法定法规许可或超出许可用途,您将需要直接获得版权持有人的许可。GydF4y2Ba
要查看此许可证的副本,请访问GydF4y2Bahttps://creativecommons.org/licenses/by/4.0/GydF4y2Ba.GydF4y2Ba
创作共用及公共领域专用豁免书(GydF4y2Bahttps://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本文提供的数据,除非在数据的信贷额度中另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
费塞尔曼,B.S.,路易赫特尔,M.,杨,X。GydF4y2Ba等GydF4y2Ba单子叶植物异位茎分生组织的产生GydF4y2Barpk1GydF4y2Ba突变体是与SAM损失和改变幼苗生长形态。GydF4y2Ba植物生物学GydF4y2Ba15,GydF4y2Ba171 (2015). https://doi.org/10.1186/s12870-015-0556-8GydF4y2Ba
收到GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
内政部GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-015-0556-8GydF4y2Ba
关键词GydF4y2Ba
- RPK1GydF4y2Ba
- 拟南芥GydF4y2Ba
- 拍摄分生组织GydF4y2Ba
- 山姆GydF4y2Ba
- 子叶GydF4y2Ba
- 单子叶植物GydF4y2Ba
- 双子叶GydF4y2Ba
- 植物胚GydF4y2Ba
- 被子植物进化GydF4y2Ba