摘要
背景
一般来说,在观赏植物中,双花品种比单花品种更有吸引力。龙胆草是日本最受欢迎的花卉栽培植物之一,是培育双花优良品种的理想品种。本研究对日本龙胆的一个双花突变体进行了性状鉴定。为了鉴定引起日本龙胆草双花表型的基因,我们对其进行了分离和鉴定MADS-box基因。
结果
14MADS-box分离到2个c类基因MADS-box基因(GsAG1而且GsAG2).这两个GsAG1而且GsAG2被归为PLE/SHP子组,而不是AG/FAR子组。在表达分析中,GsAG1在第二至第四花轮中检测到转录本,而在第二至第四花轮中检测到转录本GsAG2转录本仅在内侧两个轮齿中被检测到。转基因拟南芥表达GsAG1缺少花瓣,形成心皮器官而不是萼片。与单花龙胆品种相比,双花龙胆突变体表达量降低GsAG1但不变的表达GsAG2.的基因组结构分析GsAG1发现该基因有9个外显子和8个内含子,在基因的第6个内含子上插入了5150 bp的额外序列GsAG1在双花突变体中。这个插入物有典型的特征Ty3/吉普赛型ltr -逆转录转座子,并被指定为Tgs1.病毒诱导的基因沉默GsAG1由苹果潜伏球形病毒在表达拟南芥的早熟开花转基因龙胆草植株中,该载体导致雄蕊转化为花瓣状器官英国《金融时报》基因。
结论
这些结果表明GsAG1在雄蕊器官鉴定中扮演着一个c功能基因的关键角色。该基因的鉴定将为进一步研究日本龙胆花的形态发生奠定基础。
背景
双花植物往往是消费者的首选,因为它们比单花更大,更多花,更艳丽。1].双花品种比单花品种更常见的一些重要的花卉栽培植物包括康乃馨(石竹类植物caryophyllus),玫瑰(罗莎矮牵牛)和菊花(菊花×桑花).在其他花卉栽培植物中,培育双花品种是育种的主要目标之一,此外还有花色、大小、香味、花瓶寿命和抗病能力的改善。
一般来说,双子叶植物的花由四种器官组成;萼片,花瓣,雄蕊和雌蕊,排列在四个轮生。在杜鹃花中,花器官的特性可以用ABC模型来解释,该模型是通过对两种模式植物的研究建立的,拟南芥而且金鱼草majus[2].ABC模型包括许多编码MADS-box转录因子的基因。根据该模型,基因功能分为三类。a功能基因,APETALA1(AP1,SQUAMOSA(SQUA)答:majus),表达在第一和第二轮。b功能基因,APETALA3(AP3,缺点(DEF)答:majus),PISTILLATA(π,GLOBOSA(如果留意)答:majus)在第二和第三轮中表达,它们编码的蛋白质在形成异二聚体时获得b功能[3.].c功能基因表达在第三和第四轮,在雄蕊和雌蕊形成中起重要作用。男性和女性的器官特性是由单一的c功能基因决定的,无性生殖的(AG)),但由两个c功能基因,满(请耐心),FARINELLI(远),在答:majus[4].的A. majus ple突变体分别在雄蕊和心皮处形成花瓣和花瓣样器官[5,类似于拟南芥ag-1突变体。A. majus PLE是拟南芥的同源防碎的1/2(SHP1/2),它与成熟果实的开裂有关[6],但它不是AG的正交关系。AG/FAR和SHP/PLE是谬误,但不是由共同祖先中的重复事件派生出来的正交关系[7].
为了控制花器官的特性,B-和c -功能基因也需要SEPALLATA(9月),被定义为e功能基因[8].提出的“四重奏模型”直接将花器官的特性与由MADS-box蛋白组成的四聚体转录因子复合体的作用联系起来[9,10].佩妮FBP6而且FBP11在胚珠中表达,定义为d类MADS-box基因(11].最近,矮牵牛C-和d支基因被证明在胚珠鉴定和花终止方面有很大重叠的功能[12].d功能基因在百合(LMADS2, (13]),Eustoma羊藿(EgMADS2, (13])和拟南芥(STK, (14])。
c功能基因的缺失导致第三轮雄蕊转化为花瓣,第四轮雌蕊转化为萼片[15].这种萼片-花瓣-花瓣的模式重复了很多次,导致花有很多花瓣。AG除了在决定花器官身份方面起作用外,还在终止花的发育方面起作用[16,17].在大多数花卉植物中,双花表型是由c功能缺陷引起的,包括番薯零[18],蔷薇[19),佩妮矮牵牛[20.),仙客来persicum[21),而兰花ensifolium[22].因此,日本龙胆植物的双花很可能是由于c功能基因丢失或受损造成的,尽管这还没有得到实验的证实。
日本龙胆(作用研究,龙胆triflora,及其种间杂交品种)是日本最受欢迎的花卉植物之一,用作切花和盆栽[23].属龙胆包含超过400种,属于龙胆科,该科也包含龙胆属Eustoma,獐牙菜属,Tripterospermum.日本龙胆花有一个钟形花冠,有五个裂片,五个雄蕊部分与花瓣融合,和一个雌蕊。被称为皱襞的器官,位于花冠的裂片之间,是一个典型的特征龙胆属。日本龙胆的花瓣是鲜艳的蓝色,这是由聚酰基花青素龙胆海豚赋予的[24].日本龙胆中的黄酮类化合物、花青素和黄酮的结构以及与这些色素相关的生物合成结构和调控基因已经得到了很好的研究[25].最近,我们确定了黄酮类化合物的结构积累在叶子和花g . triflora并发现了一种新的参与黄酮-糖苷形成的糖基转移酶基因[26].
然而,在分子水平上对日本龙胆花形态发生的研究还很少。植物同源转化MADS-box基因已被分离和鉴定淫羊藿开花期,属龙胆科[27].尽管三叶等人[28孤立的四MADS-box基因g . triflora(GtMADS1- - - - - -GtMADS4;基因库登录号为AB189429-AB189432),这些基因尚未被详细描述。到目前为止,还没有系统的花形态特征MADS-box日本龙胆的基因。
在这里,我们试图描述一个双花突变g .作用研究与…有密切关系的物种g . triflora.我们分离并描述了MADS-box基因在龙胆花蕾中表达,主要集中在c类MADS-box基因。我们发现了14个MADS-box属于A、B、C、D、E类的基因;这些基因可能与花的发育和器官鉴定有关。对一个双花突变体的分析显示,该表型是由一种新的逆转录转座元件(Tgs1)转化为c功能基因之一,GsAG1.压制证实了这一点GsAG1使用苹果潜伏球形病毒(ALSV)向量。据我们所知,这是第一个报告的功能表征MADS-box与日本龙胆花形态发生有关的基因,以及与其双花表型有关的一个逆转录转座因子。
结果
隔离MADS-box日本龙胆的基因
日本龙胆草的碎片MADS-box基因用从AGAMOUS蛋白的保守结构域设计的简并引物进行扩增,如Kramer等人所描述的[29,30.].亚克隆后对96个克隆进行测序,鉴定出14个独立克隆。利用5 ' -RACE技术,我们获得了8个完整全长cDNA序列的独立克隆,而其他6个克隆对应的5 '上游片段没有得到。在系统发育分析的基础上推导氨基酸序列,这些日本龙胆MADS-box基因聚集成四个功能支。1,附加文件1:图S1和S2)。
C/ d类MADS-box蛋白的系统发育树。采用ClustalW近邻连接方法构建系统发生树,并用MEGA6进行可视化处理。用于系统发育分析的氨基酸序列的Genbank登录号如下:拟南芥AG (NP_567569)、SHP1 (NP_001190130)、SHP2 (NP_850377)和STK (NP_192734);金鱼草majusFAR (CAB42988)和PLE (AAB25101);阿奎利亚AG1(AAS45699)和AG2 (AAS45698);Cucumis巨大成功CUM1 (AAC08528)和CUM10 (AAC08529);作用研究GsAG1和GsAG2(本研究);非洲菊矮牵牛GAGA1 (CAA08800)和GAGA2 (CAA08801);陆地棉MADS3 (AAL92522)、MADS5 (ABM69043)和MADS7 (ABM69045);番薯零DP (BAC97837)和牡丹(BAC97838);百合longiflorumMADS2 (AAS01766)和MADS10 (AIJ29174);金蝶兰属植物矮牵牛MADS2 (AIJ29175)和MADS4 (AIJ29176);佩妮矮牵牛FBP6 (CAA48635), FBP11 (CAA57445), PFG (AAF19721)和pMADS3 (Q40885);罗莎玫瑰MASAKO C1 (BAA90744)和MADSKO D1 (BAA90743);Thalictrum dioicumThdAG1 (AAS45683)和ThdAG2 (AAS45682);玉米ZAG1 (AAA02933)和ZMM2 (NP_001104926)。分支旁边的数字表示1000次重复的引导值。标度条表示每个位点的氨基酸替换量为0.05
有两个龙胆草a枝MADS-box基因;GsAP1(Genbank登录号LC022772)和GsFUL(LC022780)。核心尤迪科特物种有两种a类MADS-box谱系基因,euAP1而且euFUL[31].GsAP1而且GsFUL被分类为euAP1而且euFUL(附加文件1:图S1)。的推导氨基酸序列GsAP1有63.9%的人认同GsFUL.
我们还发现了另外六个人MADS-box基因,被分类为b类基因(附加文件1:图S2)。的bMADS-box基因形成了三个亚群,euAP3 / DEF,TM6(paleoAP3),π/如果[32].GsAP3a(LC022769)和GsAP3b(LC022774)被分类为AP3 / DEF子群,GsPI1(LC022770),GsPI2(LC022771),GsPI3(LC022773)被分类为π/如果子群。GsTM6(LC022767)属于TM6亚群派生自AP3 / DEF子群。的推导氨基酸序列GsAP3a有78.0%和59.8%的人认同GsAP3b而且GsTM6,分别。推导出的GsAP3b的氨基酸序列与GsTM6的同源性为60.1%。GsAP3a与拟南芥AP3的同源性分别为60.3%、77.1%和72.4%,而GsAP3b与拟南芥AP3的同源性分别为56.7%、71.5%和73.1%。金鱼草属植物DEF和矮牵牛GP。GsTM6与番茄TDR6、矮牵牛TM6和玫瑰MADSKO B3的同源性分别为58.8%、57.3%和52.4%。GsPI1与GsPI2和GsPI3的同源性分别为93.7%和86.3%,GsPI2与GsPI3的同源性为80.2%。与拟南芥PI的同源性分别为55.7% - 58.9%、58.1% - 64.2%、68.1% - 70.8%、59.9% - 67.3%。金鱼草属植物GLO、矮牵牛pMADS2和矮牵牛GLO1。
的C-cladeMADS-box基因可以分为两个亚群,AG /远而且轴马力/请耐心[7].我们分离了两株拟南芥AG)/轴马力直接同源,GsAG1(LC022775)和GsAG2(LC022779),来自日本龙胆花蕾,且均属轴马力/请耐心子群(无花果。1).通过简并PCR或搜索Nakatsuka等描述的龙胆花归一化文库均未获得AG/FAR亚组的克隆。[33].的推导氨基酸序列GsAG1有63.9%的人认同GsAG2.GsAG1与矮牵牛FBP6的氨基酸序列同源性分别为68.8%、66.8%和65.2% [34),答:majus满(5),而即零牡丹(18],而GsAG2的同源性分别为68.4%、63.5%和66.4%。
GsSTK1 (LC022768)与STK (AGL11)序列相似性高,由d类编码MADS-box拟南芥中调控胚珠发育的基因35].推导出的GsSTK1的氨基酸序列与GsSTK1的同源性分别为85.1%、80.9%和64.9%Eustoma羊藿MADS1 [13,矮牵牛花FBP7 [36和拟南芥STK [14),分别。我们还分离出了三个9月矫形学,被指定为GsSEP1(LC022776),GsSEP2(LC022777),GsSEP3(LC022778),均为e -功能MADS-box基因(附加文件1:图S1)。
a功能基因包括AP1-likeMADS-box基因,以及含有两个连续AP2结构域的AP2样基因。我们分离了一个GsAP2来自Nakatsuka等人描述的龙胆花瓣归一化文库的同源(LC022781)。[33].的GsAP2cDNA长1813 -bp,编码一个含有456个氨基酸残基的蛋白质1:图S3)。的miR172的-目标核苷酸序列AP2是守恒的GsAP2编码区域。
空间表达分析MADS-box不同的花器官,叶子和茎中的基因
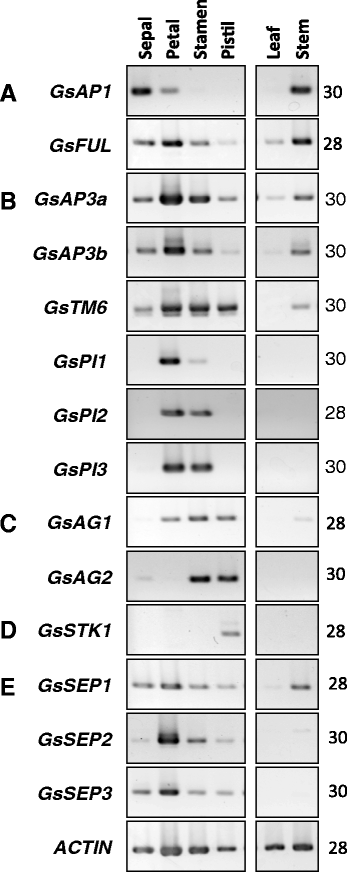
分离株的空间表达模式MADS-box用半定量RT-PCR方法对野生型日本龙胆的基因进行分析(图5)。2).在a系中MADS-box的基因,GsAP1表达局限于第一、第二轮和茎组织GsFUL在所有测试的组织中都检测到转录本。GsFUL强烈表达在第一和第二花轮和茎组织。
的表达GsAP3a GsAP3b,而且GsTM6,属于AP3/DEF亚家族,在花器官的四个轮中均检测到。有很高的转录水平GsAP3a而且GsAP3b在花瓣和雄蕊中,和高转录水平GsTM6在雌蕊器官中除了轮生2和3。成绩单的GsAP3a,GsAP3b,而且GsTM6在茎器官中检测到,但在叶片中几乎没有检测到。与AP3/DEF亚家族相比,PI/GLO亚家族基因GsPI1,GsPI2而且GsPI3仅在花瓣和雄蕊器官中表达。2).的转录水平GsPI2而且GsPI3在花瓣和雄蕊器官的转录水平大致相等,而GsPI1花瓣比雄蕊多。这三个GsPI基因在营养器官中的表达水平无法检测到。的表达式概要GsPIPI/GLO亚组的基因与AP3/DEF和TM6亚组的基因存在差异。
两个c级MADS-box的基因,GsAG1而且GsAG2,在第三轮(雄蕊)和第四轮(雌蕊)中强烈表达。成绩单的GsAG1也存在于花瓣中。两份成绩单GsAG1而且GsAG2在营养组织(叶和茎)中含量极低或未被检测到。成绩单的GsSTK1只在雌蕊中被检测到,而在其他轮生、叶或茎中没有。三个e级MADS-box的基因,GsSEP1,GsSEP2,而且GsSEP3在花器官中也有类似的表达谱。成绩单的GsSEP2,GsSEP3在叶和茎中均检测到花轮纹,而在GsSPE1在所有花旋体和茎中均检测到转录本。
异源表达GsAG1而且GsAG2在拟南芥
研究…的功能GsAG1而且GsAG2在美国,我们生产了4条和6条T2转基因拟南芥植物过表达GsAG1或GsAG2,分别。c类异位表达MADS-box拟南芥和烟草中的基因已被用于评价几种植物的AG同源基因的功能[37,38].异位表达AG)基因已被证明能诱发ap2突变表型;即雌蕊-雄蕊-雄蕊-雌蕊[39[英语背诵文选GsAG1 -过表达的拟南芥株系中,有3个株系形成了心皮器官而不是萼片,花瓣部分消失。3罪犯).六种细胞均未见形态学变化GsAG2 -过表达拟南芥系(图;3 e-f).这些结果揭示了拟南芥的生物功能同源性AG)是GsAG1,不GsAG2.
典型的花表型GsAG1 -而且GsAG2-表达转基因拟南芥植物。一个病媒控制花,萼片和花瓣器官正常。b- - - - - -d的花朵GsAG1-过表达的转基因株系2、3和6号,萼片和花瓣分别转化为雌蕊和雄蕊。e- - - - - -f的花朵GsAG2-过表达9号和13号花表型正常的转基因株系。基因在各T细胞中的表达2转基因植物在附加文件中说明1:图S4。Bar = 10mm
表达分析MADS-box双花突变体的基因
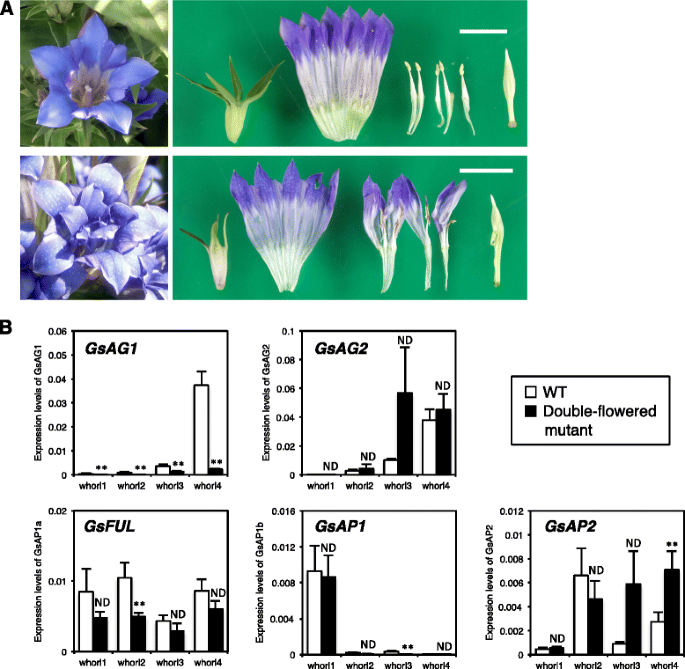
接下来,我们试图在龙胆草突变体中确定双花的原因。双花突变体在第三轮有瓣状器官,而不是雄蕊。4).花瓣状器官由融合在不育雄蕊上的花瓣结构组成。双花突变体的一些个体还形成了一个轻微异常的雌蕊,其中包含另一个不完整的雌蕊。
双花龙胆突变体的表型及空间表达分析MADS-box基因。一个单花cv的典型花表型。Alta(上图)和双花突变体(下图)。Bar = 2 cm。b花的qRT-PCR分析MADS-box单花变种(WT)和双花突变体的基因。在Nakatsuka等人定义的花发育第3阶段,从花蕾的每个轮生器官中分离出总rna。[58].数值为四个生物重复的平均值±标准差。白色条表示单花龙胆。阿尔塔。黑色条表示双花突变体。**和ND表示差异显著(P< 0.01),差异不显著(Student’st以及)
为了确定双花形成的候选基因,我们比较了c类的空间表达谱MADS-box双花突变体和典型的单花龙胆之间的基因。阿尔塔(无花果。4 b).的转录水平GsAG1在第三和第四轮中,双花突变体显著低于单花品种。相比之下,丰富的GsAG2野生型和双花突变体之间转录物差异不显著。的转录水平GsAP2在双花突变体中,内两个轮齿的含量高于野生型(图1)。4 b).野生型和双花突变型在其他a类的转录谱上也存在差异GsAP1而且GsFUL第二轮和第三轮的基因。部分基因表达模式的细微差异可能是由于单花品种和双花突变体的遗传背景不同造成的。然而,这些结果表明GsAG1, c级MADS-box基因,是最有可能负责双花表现型的候选基因。
基因组结构GsAG1而且GsAG2日本龙胆
日本龙胆草的空间表达分析MADS-box基因,减少GsAG1在双花突变体的雄性和雌性器官中检测到转录水平(图2)。4 b).因此,我们确定了基因组序列GsAG1而且GsAG2在双花突变体和对照植株中。
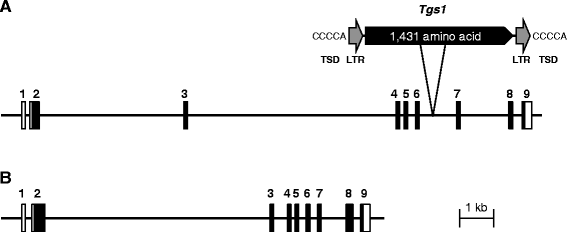
对应的基因组序列GsAG1cDNA全长15.3 kb,由9个外显子和8个内含子组成。5).在拟南芥中内含子的数量和位置是保守的AG)而且GsAG1.的第二和第三个内含子GsAG1(分别为4.3 KB和6.7 KB)的内含子长度远远大于AG)拟南芥的基因分别为2998 bp和102 bp。的基因组序列GsAG29.5 kb长,由9个外显子和8个内含子组成,像是GsAG1(无花果。5 b).的第二个内含子GsAG2内含子长6.6 kb,但第三个内含子比GsAG1。拟南芥的第二个内含子AG)包含转录调控区域[7,40].两者的第二个内含子区域GsAG1而且GsAG2有几个独联体元素;一个CArG盒子(CW8G),一个LFY结合位点(CCANTG)和一个70 bp区域(CCAATCA重复)(数据未显示)。
基因组结构GsAG1而且GsAG2在双花突变体中
接下来,我们比较了GsAG1而且GsAG2在野生型和双花突变型之间。基因组PCR分析针对第六内含子区域GsAG1从野生型中扩增出一个片段,但没有从双花突变体中(数据未显示)。因此,我们对第6个内含子进行了测序GsAG1在双花突变体中使用基因组行走技术。的第六个内含子GsAG1在双花突变体中有5150 bp的插入,这在野生型中是不存在的。该插入序列具有LTR-逆转录转座子的典型特征,包括5 bp的靶位点重复(TSD, CCCCA)和两端334 bp的完全匹配长末端重复(LTR)(图4)。5).插入被指定为Tgs1的可转座元素作用研究1)。Tgs1编码了1431个氨基酸序列的agag pol多蛋白属于Ty3/吉普赛-type逆转录转座子群。在基因组结构上没有差异GsAG2在双花突变体和野生型品种之间(数据未显示)。
抑制GsAG1通过病毒诱导的基因沉默
确认是否有不足之处GsAG1基因对日本龙胆草双花表型的影响,我们试图抑制其表达GsAG1使用中收取。我们使用苹果潜伏球形病毒(ALSV)载体,因为它们已在广泛的植物中用于可靠和有效的VIGS [41,42].
用pEALSR1和pEALSR2L5R5包覆的金颗粒轰击成在体外,种植过表达转基因日本龙胆草的植物AtFT[43].接种1个月后,通过RT-PCR分析证实ALSV在接种植株中的增殖。ALSV在几乎所有的植株中都被检测到增殖(数据未显示),证实了直接轰击质粒载体的方法适合于将ALSV接种到龙胆草中。
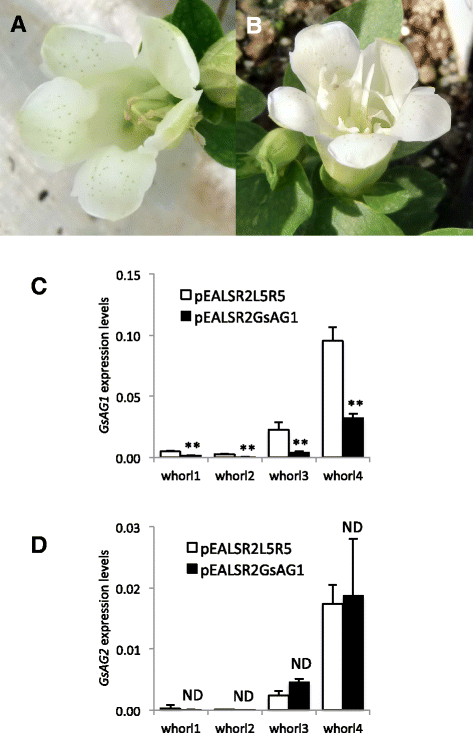
22岁和20岁AtFT分别用空ALSV载体(pEALSR1/pEALSR2L5R5)或ALSV- gsag1载体(pEALSR1/pEALSR2-GsAG1)接种过表达龙胆草植株。RT-PCR分析证实ALSV载体的生物接种导致90%的接种频率(数据未显示)。接种ALSV载体的龙胆植物在封闭温室中驯化,驯化1 ~ 3个月后坐花。野生型和接种空ALSV载体的植株在花表型上没有显著差异(图1)。6).接种了ALSV-GsAG1的14株幸存植株中有6株形成了花瓣,而不是雄蕊。6 b).qRT-PCR分析结果表明,ALSV-GsAG1侵染后表现出转化表型的植株明显受到抑制GsAG1与接种了空载体的植株的转录水平比较(图5)。6摄氏度).的转录水平GsAG2不受alv - gsag1感染的影响。接种alsv - gsag1的植株雌蕊形态变化不明显。
讨论
在这项研究中,我们分离了14个MADS-box花蕾中表达的基因g作用研究:两个a类基因(GsAP1而且GsFUL)、6个b类基因(GsAP1a,GsAP1b,GsTM6,GsPI1,GsPI2而且GsPI3)、两个c类基因(GsAG1而且GsAG2)、1个d类基因(GsSTK1)和三个e类基因(GsSEP1 GsSEP2,而且GsSEP3)(图。1,附加文件1:图S1、图S2)。三羽等人[28克隆的MADS-box的基因,GtMADS1- - - - - -GsMADS4,从g . triflora的近缘种g作用研究.我们的分析证实了GtMADS1-GtMADS4是同源的GsFUL,GsAG2,GsAG1,而且GsSEP1,分别。
在拟南芥中,AP1和FUL独立发挥作用;前者控制萼片和花瓣的特性,后者控制果实的发育和确定性[31].在其他有缺陷的植物中AP1基因形成叶状萼片,但其花瓣特性不受影响[44].因此,euFUL基因在促进生殖分生组织的过渡中起着早期的作用,在果实发育中起着晚期的作用。在日本龙胆中,GsAP1表达局限于花芽和茎的第一和第二轮,在萼片和茎中表达强烈。2).相反,GsFUL在所有被测器官中表达,在花瓣和茎中强烈表达(Fig。2).以及GsAP1而且富尔语,GsAP2也可能作为a功能基因(附加文件1:图S1)。GsAP2在第二轮中强烈表达(图。4 b).在拟南芥中,表达AP2由miR172通过翻译抑制调节[45].的核苷酸序列GsAP2包含一个保守的miR172目标序列(数据未显示)。因此,螺纹特异性表达GsAP2可能是由miR172控制龙胆,就像在其他植物一样。
在拟南芥和答:majus, b功能,指明花瓣和雄蕊的特性,由一个由一个AP3/DEF蛋白和一个PI/GLO蛋白组成的异二聚体决定[46,47].AP3/DEF血统可以分为两个子群;euAP3而且paleoAP3[29].euAP3广泛分布在高海拔地区,而paleoAP3分布于下被球子科、木兰双球子科、单球子科和基生被子植物中[48].此外,一些高级的eudiicot物种同时含有这两种euAP3而且paleoAP3(指定为TM6).AP3 / DEF属于euAP3 (GsAP3a而且GsAP3b)及TM6 (GsTM6)组从日本龙胆中分离得到1:图S2)。三个euAP3,一个TM6,和两个π/如果基因也从Eustoma羊藿在龙胆科[27].因此,似乎aTM6编码b类MADS-box蛋白的基因存在于龙胆科,而不在茄科[35或Asteraceae [49].格滕语和爱尔兰语[50]报道了PI/GLO谱系在茄科被复制并分离为GLO1和GLO2谱系。他们的研究结果还表明,龙胆属植物的GLO1谱系已经消失,而Lamiales植物的GLO2谱系已经消失。本研究结果表明日本龙胆中的GsPI1到GsPI3属于GLO2谱系1:图S2)。GsAP3a,GsAP3b,GsTM6在所有花旋中均有表达(图。2).高转录水平GsAP3a而且GsAP3b在第二轮(花瓣)和第三轮(雄蕊)中均有表达,GsTM6在第2 ~ 4轮中表达量较高。另一方面,三个人的表达GsPIs明显局限于第二和第三轮(图。2).这些表达谱的差异euAP3,TM6,π/如果在矮牵牛花中也有报告[48].在佩妮,PhTM6主要在第三和第四轮表达,参与雄蕊发育而不参与花瓣发育,而PhDEF参与花瓣和雄蕊的发育[51,48].
这两个GsAG1而且GsAG2被归为SHP/PLE亚组,而不归为AG/FAR亚组(图。1).在本研究中,我们没有发现任何属于AG /远简并PCR技术扩增亚群。在淫羊藿开花期,也属于龙胆科,三种轴马力/请耐心亚组基因(EgPLE1来EgPLE3),但没有AG)/远亚群基因[27].的AG /远c类子群MADS-box基因在一些植物物种中负责雄性和雌性器官的识别。这个基因亚群包括拟南芥AG)[52),佩妮pMADS3[53),而I.无重复(DP, (18])。SHP/PLE亚群成员在花器官鉴定中也起着重要作用答:majus[5].因此,AG /远龙胆科部分种的亚群基因可能已经消失轴马力/请耐心虽然还需要进一步的分析,如全基因组测序来证实这一假设。
只有一架c级飞机MADS-box吉恩,一个拷贝AG)在拟南芥中。然而,有两个AG)在一些植物物种中有类似现象,包括答:majus(请耐心/远,4]),牵牛花(pMADS3/FBP6, [34]),黄瓜(CUM1/CUM10, [34]),玉米(ZAG1/ZMM2, [54]),即零(DP /,18)和仙客来(CpAG1/CpAG2, [21])。在玉米、ZAG1转录本在发育中的耳朵中积累,而不是在流苏中ZMM2转录本在流苏中更为丰富[54].在请耐心单突变体答:majus,第四轮发育为两个萼片状/腕皮状/花瓣状器官。的第四轮器官请耐心/远双突变体发育为四个或五个形状良好的花瓣[4].因此,请耐心而且远似乎对男性和女性器官的发育有不一样的影响。
GsAG1内层三轮检测到转录本,而GsAG2转录本仅限于第三和第四轮(图。2).GsAG1RT-PCR分析中,在花瓣器官(螺旋2)中检测到转录本(图2)。2),但在qRT-PCR分析中没有发现。4).RT-PCR和qRT-PCR分别采用不同花发育阶段的花芽S1(未成熟花芽)和S3(开花前花芽)进行分析。一般来说,AG)表示为第三或第四轮[15].因此,GsAG1日本龙胆第二轮的表达似乎是一种独特的现象。这可能是因为日本龙胆的花瓣和雄蕊在下半部分融合在一起。因此,在花发育早期,年轻的花瓣器官可能含有雄蕊原基。qRT-PCR分析结果如图所示。4),没有GsAG1由于在花发育的后期,花瓣和雄蕊器官完全可区分,因此在第二轮中检测到转录本。
的异源表达GsAG1在转基因拟南芥中引起萼片向腕皮器官的转化,表明其具有一定的遗传特性AG)函数(无花果。3 b).相比之下,GsAG2-表达的拟南芥与空载体对照相比,形态发生没有显著变化(图1)。3 c).拟南芥异位表达AG)或金鱼草请耐心同种异体第一和第二轮器官的特定同种异体转化,导致萼片发育为心皮,花瓣发育为雄蕊[37,7].的异位表达金鱼草属植物FAR将花瓣转化为雄蕊,但不改变萼片的特性[7].因此,拟南芥异体表达分析并不总是正确评价c类的功能MADS-box来自其他植物物种的基因。
大多数双花表型是由于c功能基因的缺乏[2].qRT-PCR分析结果显示GsAG1与单花野生型龙胆相比,双花龙胆第三轮和第四轮转录本明显减少(图5)。4 b).没有GsAG1通过RT-PCR检测双花突变体中的转录本,使用了几个引物组合(数据未显示),没有截断GsAG13 ' -RACE检测转录本。测序分析显示,该双花突变体的第6个内含子插入了一个5150 bp的逆转录转座元件GsAG1(无花果。5).这个转置元素,Tgs1的典型特征Ty3/吉普赛-type逆转座子单元(图。5).在复制(dp)突变的即零,该突变是由于基因组结构的重排Em / Spm转座子[18].的金鱼草请耐心突变体中插入了Tam3的第二个内含子中的转座子请耐心,请耐心突变体的花器官中几乎检测不到mRNA [5].另据报道,一个双花毛茛属突变体与一个单独的LTR逆转录转座子插入到的第4外显子有关ThAG1[55].因此,很可能的表达是GsAG1会被插入第6个内含子中的长转座子元素打断。
VIGS是一种有用的工具,可用于分析对其他遗传转化方法不耐受的园艺植物基因的功能[56].矮牵牛属植物pMADS3而且FBP6被VIGS沉默后,在心皮处形成花瓣状器官,这取决于品种[57].大多数病毒载体被分生组织排除在外,因此,在大多数情况下,分生组织中的基因沉默是不可能的[56].在本研究中,我们使用VIGS来静音GsAG1观察到雄蕊转变为花瓣状器官(图5)。6 b).这些结果有力地表明GsAG1导致了这个突变体的双花表型。增强的转录水平GsAP2在双花突变体的第三和第四轮中检测到(图。4 b).与之相反,空间表达谱GsAP1而且GsFUL单花品种与双花品种间差异不大。水上和马[39]报道了AG拮抗AP2的功能。因此,我们推测GsAG1的特定于轮的表达式GsAP2.
在双花龙胆突变体中,第四轮雌蕊没有转化为花瓣,可能与GsAG2的作用有关。与单花龙胆相比,双花突变体表达量增加GsAG2在第三轮(图。4 b).也有增加的转录水平GsAG2在双花转基因龙胆中GsAG1被VIGS抑制(图。6 b).在金鱼草,请耐心是否需要充分表达远,而远负调控的表达请耐心[4].有可能GsAG1负调控的表达GsAG2在日本龙胆草的第三轮。不幸的是,没有GsAG2自然界中的-缺陷突变体;因此,要显示GsAG2的功能,抑制GsAG2应在未来的研究中尝试。在仙客来,CpAG1是参与雄蕊形成的,而缺乏CpAG1导致雄蕊同型转化为花瓣,产生双瓣表型[21].仙客来中嵌合抑制因子CpAG2-SRDX的过表达cpag1突变体导致多瓣表型,并且雌蕊转变为花瓣[21].因此,两个c级MADS矫形器有助于男性和女性器官的识别。努尔等人[57]证明了VIGS对两者的抑制MADS3而且FBP6导致雄蕊/心皮转变为花瓣/花瓣样器官,产生重瓣花。
目前的假设是GsAG1在雄性器官识别中起重要作用,而GsAG2在雌性器官识别和终止开花中起重要作用。为了证实这个假设,GsAG2- - -GsAG1 / GsAG2-日本龙胆草的敲除或敲除系应在进一步的研究中生成和分析。
结论
研究了日本龙胆中一株双花突变体的致病因素。我们分离并鉴定了14例MADS-box发现了一种新的逆转录转座因子(Tgs1插入到的第六个内含子GsAG1基因负责突变花表型。基于alv的VIGS系统结合拟南芥进行了验证英国《金融时报》-表达早开花的转基因龙胆植物。要全面了解日本龙胆花形态发生的发育规律,还需要进一步的研究。鉴于目前日本龙胆花形变异有限,我们相信这一信息将有助于今后培育具有花形变异的龙胆品种。
方法
植物材料
日本龙胆(作用研究)的简历。Alta是在岩手县农业研究中心(日本岩手县北上)的一块地里种植的。这种双花突变体从Iwasaki-Engai公司(日本北海道北广岛)购买,并作为盆栽植物种植在岩手生物技术研究中心的温室中。在发育阶段1(由Nakatsuka等人定义)收集花芽样本。[58],然后保存在−80°C直到RNA提取。
龙胆花蕾MADS-box基因的分离
从日本龙胆花蕾中分离总rna,并使用RNAiso Plus和Fruit-mate试剂盒(Takara-bio, Otsu, Shiga, Japan)纯化。这些cdna用RNA PCR试剂盒(AMV) Ver. 3 (Takara-bio)合成。候选龙胆草MADS-box按照Kramer等人的描述,使用简并引物分离基因。[29,30.].扩增片段亚克隆到pCR4TOPO TA克隆载体(Invitrogen, Carlsbad, CA, USA),并使用BigDye终止器进行测序。1.1循环测序试剂盒和ABI PRISM 3130xl DNA测序仪(Applied Biosystems, Foster City, CA, USA)。目的:获得各龙胆草的全长cDNAMADS-box基因,5 ' -快速扩增cDNA末端(5 ' -RACE)使用GeneRacer试剂盒与SuperScript III RT (Invitrogen)。扩增片段按上述方法进行亚克隆和测序。使用CLC Sequence Viewer 7 (CLC bio,奥尔胡斯,丹麦)将核苷酸序列翻译成推导的氨基酸序列,并使用国家生物技术信息中心的BLAST网络服务进行比较。采用ClustalW和邻居连接算法构建系统发生树,并使用MEGA ver进行可视化处理。6软件[59].
的GtAP2通过BLAST检索内部龙胆花瓣cDNA文库数据,发现了不属于MADS-box蛋白的同源蛋白[33],然后采用上述RACE技术获得全长cDNA。
基因表达分析
目的:研究龙胆植物的空间表达谱MADS-box对基因进行半定量逆转录- pcr (RT-PCR)和定量RT-PCR (qRT-PCR)分析。如上所述,从每个器官中分离总rna (1 μg),然后用gDNA Eraser和PrimeScript RT分别去除基因组DNA,合成cdna (Takara-bio)。
RT-PCR分析时,反应液(50 μL)为1 ×Taq交货缓冲液,0.2 mM dNTPs, 0.4 μM每个底漆,2.5 UTaq交货聚合酶(Takara-bio)和1 μL模板cDNA。PCR循环条件如下:94℃2 min, 95℃20 s, 55℃40 s, 72℃1 min, 72℃最后延伸10 min。PCR产物电泳在1.5%琼脂糖凝胶TAE缓冲液中,然后用溴化乙锭染色。
qRT-PCR分析采用StepOne Plus系统(Applied Biosystems),使用SYBR GreenER qPCR Super Mix (Invitrogen)进行,如前所述[33].简单地说,反应混合物(10 μL)由1 × Master Mix、每个引物0.2 μM和1 μL模板cDNA组成。循环条件如下:95°C 20 s,然后95°C 1 s和60°C 20 s循环40次。通过熔体曲线分析验证了每个扩增反应的特异性。在每个退火步骤结束时测量荧光。数据分析采用StepOne Plus软件2.2.2版本。计算每个基因相对于内参基因的转录水平GtUBQ.采用4个生物重复进行qRT-PCR分析,并用Student 's软件对数据进行统计分析t以及。本研究中所有引物的序列都列在附加文件中1:表S1。
转基因拟南芥植物的生产
GsAG1而且GsAG2CaMV35S启动子控制下的orf分别插入卡那霉素耐药的二元载体(NPTII)基因分别产生质粒pSkan-35S:: GsAG1和pSkan-35S:: GsAG2。每一个二进制向量都被转换成根癌土壤杆菌EHA101电穿孔(MicroPulser: Bio-Rad,东京,日本)。答:芥生态型col-1通过花浸法进行转化,如Clough和Bent [60].在含50 mg L的萌发培养基上选择阳性转化菌株−1卡那霉素。GsAG1- - -GsAG2表达T2采用自花授粉的方法获得纯合子转基因植株。观察到四种植物的花形态发生表型GsAG1-表示行和六GsAG2 -表达。
基因组结构的测定GsAG1而且GsAG2
的基因组核苷酸序列GsAG1而且GsAG2使用基因组行走技术和GenomeWalker Kit (Clontech, Takara-bio)获得。本研究从香椿幼叶中分离到基因组DNAg作用研究“Alta”和使用Nucleon PhytoPure (GE Healthcare Ltd,白金汉郡,英国)的双花突变体。将扩增片段进行亚克隆,然后按上述方法进行测序。
病毒诱导的基因沉默GsAG1龙胆植物中
研究…的功能GsAG1在美国,我们使用了病毒诱导基因沉默(VIGS)苹果潜伏球形病毒(ALSV)矢量[41].使用引物对触发片段进行扩增Xho我或BamHI站点(附加文件1:表S2),然后亚克隆到pGEM-T Easy向量(Promega, Madison, MI, USA)。用双消化法切除Xho我和BamHI,然后结扎到pEALSR2L5R5 [61用同样的酶消化。使用NuleoBond Xtra Midi plus试剂盒(machery - nagel, Takara-bio)进行大规模质粒纯化。
接种ALSV载体g .矮牵牛‘polno White’植物过度表达拟南芥开花位点t(AtFT)基因。的AtFT-表达龙胆植物比野生型龙胆植物开花早[43];因此,它们对植物形态发生的研究具有重要意义。龙胆植物表达AtFT被种植的在体外用PDS-1000/He粒子输送系统(Bio-Rad Laboratory)接种ALSV载体。0.5 mg金颗粒(直径1.0 μm;Bio-Rad Laboratories, Hercules, CA, USA)与含有5 μg pEALSR1和5 μg pEALSR2L5R5衍生物、10 μL 10 M醋酸铵和220 μL异丙醇的100 μL质粒溶液混合。−20℃保存至少1 h。包覆质粒DNA的金颗粒用1 mL乙醇洗涤3次,再用10 μL乙醇重悬。颗粒在距离微载体支架10cm处以1100 psi的压力轰击。经过轰击后,受病毒感染的植物被驯化,然后在一个封闭的温室中生长,直到开花。
支持数据的可用性
本研究中确定的基因的GenBank/EMBL登录数为:GsAP1(LC022772),GsFUL(LC022780),GsAG1(LC022775),GsAG2(LC022779),GsSTK1(LC022768),GsSEP1(LC022776),GsSEP2(LC022777),GsSEP3(LC022778)和GsAP2(LC022781)。
系统发育数据已经存储在TreeBASE存储库中,可以在URL下获得http://purl.org/phylo/treebase/phylows/study/TB2:S17877.
缩写
- AG:
-
无性生殖的
- ALSV:
-
苹果潜伏球形病毒
- AP1:
-
APETALA1
- AP2:
-
APETALA2
- 远:
-
FARINELLI
- 如果留意:
-
GLOBOSA
- LTR:
-
长终端重复
- 比如:
-
满
- 存在:
-
定量逆转录pcr
- rt - pcr:
-
半定量逆转录- pcr
- 9月:
-
SEPALLATA
- 轴马力:
-
防碎的
- STK:
-
SEEDSTICK
- TSD中:
-
目标站点复制
- 中收取:
-
病毒诱导的基因沉默
参考文献
- 1.
雷诺J,丹皮恩J,重瓣花。英国:Pembridge出版社;1983.
- 2.
《轮生的战争:控制花发育的基因相互作用》。大自然。1991;353(6339):主场。
- 3.
McGonigle B, Bouhidel K,爱尔兰VF。拟南芥核的定位APETALA3而且PISTILLATA同源基因产物取决于它们的同时表达。基因开发1996;10(14):1812-21。
- 4.
李晓明,李晓明,李晓明。PLENA和FARINELLI:两者之间的冗余和调控作用金鱼草属植物控制花发育的MADS-box因子。中华医学杂志1999;18(14):4023-34。
- 5.
Bradley D, Carpenter R, Sommer H, Hartley N, Coen e金鱼草属植物.细胞。1993;72(1):85 - 95。
- 6.
利耶格伦SJ,迪塔GS,伊舍德Y,萨维奇B,鲍曼JL,亚诺夫斯基MF。防碎的MADS-box基因控制着拟南芥种子的传播。自然。2000;404(6779):766 - 70。
- 7.
Causier B, Castillo R, Zhou J, Ingram R, Xue Y, Schwarz-Sommer Z,等。进化的作用:以下功能在复制花同源基因。植物生物学杂志2005;15(16):1508-12。
- 8.
佩拉兹S,迪塔GS,鲍曼E,威斯曼E,亚诺夫斯基MF。B、C花器官识别功能要求SEPALLATAMADS-box基因。大自然。2000;405(6783):200 - 3。
- 9.
Egea-Cortines M, Saedler H, Sommer H金鱼草属植物majus.中华医学杂志1999;18(19):5370-9。
- 10.
MADS-box蛋白复合物足以将叶片转化为花器官。大自然。2001;409(6819):525 - 9。
- 11.
科伦坡L, Franken J, Koetje E, van Went J, Dons HJ, Angenent GC,等。矮牵牛MADS盒子基因FBP11决定胚珠的同一性。植物细胞,1995;7(11):1859-68。
- 12.
李文华,李文华,李文华,等。重新定义矮牵牛ABC中的C和D。植物学报,2012;24(6):2305-17。
- 13.
曾涛,陈海燕,杨春华。百合和连珠花心皮特异性MADS box基因异位表达引起拟南芥萼片和花瓣的同源性转化。植物物理学报,2002;30(4):1827-36。
- 14.
Pinyopich A, Ditta GS, Savidge B, Liljegren SJ, Baumann E, Wisman E,等。测定心皮和胚珠发育过程中MADS-box基因的冗余度。大自然。2003;424(6944):85 - 8。
- 15.
Yanofsky MF, Ma H, Bowman JL, Drews GN, Feldmann KA, Meyerowitz EM.拟南芥同源基因agamous编码的蛋白质类似转录因子。大自然。1990;346(6279):35-9。
- 16.
王晓明,王晓明,王晓明。拟南芥花分生组织中wuchel和AGAMOUS相互作用对干细胞维持的影响。细胞。2001;105(6):805 - 14所示。
- 17.
Lohmann JU, Hong RL, Hobe M, Busch MA, Parcy F, Simon R,等。拟南芥中干细胞调控和花模式之间的分子联系。细胞。2001;105(6):793 - 803。
- 18.
将En/ spm相关转座元件插入花同源基因duplicate中,可导致日本牵牛花的双花表型。植物学报。2003;36(4):522-31。
- 19.
Dubois A, Raymond O, Maene M, Baudino S, Langlade NB, Boltz V等。修补c功能:栽培玫瑰双花选择的分子框架。科学通报,2010;5(2):e9288。
- 20.
卡普尔M,巴巴A,久保K,涩谷K,松井K,田中Y,等。转基因触发的,表观遗传调控的花同源基因异位表达pMADS3在佩妮。植物学报。2005;43(5):649-61。
- 21.
田中Y,大岛Y,山村T,杉山M,三田N,大坪N,等。AGAMOUS嵌合抑制子表达的仙客来多瓣花。Sci代表2013;3:2641。
- 22.
王青云,李鹏飞,李毅,肖莹莹,陈莹莹,潘志军,等。重复的c类MADS-box基因在植物的发育中起着不同的作用兰花ensifolium(兰科)。植物细胞学报,2011;52(3):563-77。
- 23.
西原M,中冢T,水谷福池M,田中Y,山村S.龙胆:从基因分离到分子育种。正确人选:达·席尔瓦·J,编辑。花卉栽培、观赏及植物生物技术。英国:全球科学图书;2008.
- 24.
Goto T, Kondo T, Tamura H, Imagawa H.龙胆海豚的结构,一种分离的酰基化花青素,在稀水溶液中稳定。四面体学报。1982;23(36):3695-8。
- 25.
黄酮生物合成的转录调控因子及其在龙胆花颜色修饰中的应用。植物生物技术,2014;31(5):389-99。
- 26.
佐佐木N,西崎Y,山田E,辰泽F,中冢T,高桥H,等。直接介导黄酮的糖基转移酶的鉴定C-glucosylation在龙胆triflora.中国生物医学工程学报2015;589(1):182-7。
- 27.
石森,王晓燕,王晓燕,等。植物同种异体MADS-box基因的保护与多样性Eustoma羊藿.中国园艺学报,2014;38(2):359 - 359。
- 28.
三叶K,西原M,中冢T,阿部Y,平野H,横井T,等。龙胆中35s驱动转基因的一致转录沉默。植物学报;2005;29(4):441 - 441。
- 29.
克莱默EM,多利特RL,爱尔兰VF。控制花瓣和雄蕊发育的基因的分子进化:植物内部的复制和分化APETALA3而且PISTILLATAMADS-box基因谱系。遗传学。1998;149(2):765 - 83。
- 30.
Kramer EM, Jaramillo MA, Di Stilio .被子植物中MADS box基因AGAMOUS亚家族多样化过程中的基因复制和功能进化模式。遗传学。2004;166(2):1011 - 23所示。
- 31.
Litt A,爱尔兰VF。复制和多样化APETALA1/FRUITFULL花同源基因谱系:花发育进化的意义。遗传学。2003;165(2):821 - 33所示。
- 32.
克莱默EM,爱尔兰VF。花瓣和雄蕊发育程序的演化:来自下胚珠科和基生被子植物比较研究的证据。植物生态学报,2000;29(6):369 - 369。
- 33.
龙胆草MYB1R转录因子异源表达抑制烟草花中花青素色素的形成。植物细胞学报2013;32(12):1925-37。
- 34.
Kater MM, Colombo L, Franken J, Busscher M, Masiero S, Van Lookeren Campagne MM,等。黄瓜和矮牵牛的多个AGAMOUS同源体诱导生殖器官命运的能力不同。植物细胞,1998;10(2):171-82。
- 35.
罗斯利前锋,迪塔前锋,亚诺夫斯基前锋。MADS箱型基因在拟南芥发育中的不同作用。植物细胞,1995;7(8):1259-69。
- 36.
Angenent GC, Franken J, Busscher M, van Dijken A, van Went JL, Dons HJ,等。一类新的MADS盒型基因参与矮牵牛胚珠的发育。植物细胞,1995;7(10):1569-82。
- 37.
Airoldi CA, Bergonzi S, Davies B.单个氨基酸的改变改变了指定男性或女性器官身份的能力。中国生物工程学报,2010;29(4):369 - 369。
- 38.
Mandel MA, Gustafson-Brown C, Savidge B, Yanofsky MF。拟南芥花同源基因APETALA1的分子特性研究。大自然。1992;360(6401):273 - 7。
- 39.
花同源基因AGAMOUS在转基因拟南芥植株中的异位表达改变了花器官的同源性。细胞。1992;71(1):119 - 31所示。
- 40.
Deyholos MK, Sieburth LE。可分离的螺纹特异性表达和细胞内增强子的负调控无性生殖的第二个内含子。植物学报,2000;12(10):1799-810。
- 41.
利用苹果潜在球形病毒载体高效沉默苹果、梨和日本梨病毒基因。植物学报,2011;7(1):15。
- 42.
用苹果潜伏球形病毒载体和生物接种高效诱导苹果和大豆基因沉默。方法Mol Biol 2013; 975:167-81。
- 43.
中冢T,阿部Y, Kakizaki Y,久保田A,岛田n M n拟南芥英尺基因缩短龙胆观赏植物的幼期,诱导其早落。Euphytica。2009;168:113-9。
- 44.
Pabón-Mora N, Ambrose BA, Litt A.罂粟APETALA1/FRUITFULL正交性状控制开花时间,分枝,花被特征和果实发育。植物生理学报,2012;38(4):369 - 369。
- 45.
陈XM。拟南芥花发育中作为APETALA2翻译抑制因子的microRNA。科学。2004;303(5666):2022 - 5。
- 46.
戴维斯B, Egea-Cortines M, de Andrade SE, Saedler H, Sommer H.花同源MADS盒蛋白的多重相互作用。中华医学杂志1996;15(16):4330-43。
- 47.
Krizek BA, Meyerowitz EM.拟南芥MADS结构域器官识别蛋白功能特异性蛋白区域的定位。中国科学(d辑:自然科学版)1996;
- 48.
范登bussche M, Zethof J, Royaert S, Weterings K, Gerats T.复制b类异二聚体模型:轮系特异性效应和复杂遗传相互作用佩妮矮牵牛花的发育。植物细胞,2004;16(3):741-54。
- 49.
Broholm SK, Pollanen E, Ruokolainen S, Tahtiharju S, Kotilainen M, Albert VA,等。B类MADS-box转录因子的功能表征非洲菊矮牵牛.中国生物医学工程学报2010;61(1):75-85。
- 50.
茄科植物花同源B基因的隐藏变异性为新功能的进化提供了分子基础。植物学报,2010;22(8):2562-78。
- 51.
Rijpkema AS, Royaert S, Zethof J, van der Weerden G, Gerats T, Vandenbussche m佩妮TM6MADS box基因揭示了DEF/AP3谱系的功能分化。植物细胞,2006;18(8):1819-32。
- 52.
王晓燕,王晓燕,王晓燕,等。拟南芥花同源基因的遗传互作。Dev。1991;112(1):1。
- 53.
土本S, van der Krol AR, Chua NH。异位表达pMADS3在转基因矮牵牛表型复制矮牵牛盲目的突变体。植物细胞学报。1993;5(8):843-53。
- 54.
Mena M, Ambrose BA, Meeley RB, Briggs SP, Yanofsky MF, Schmidt RJ。玉米花发育过程中c功能活性的多样性。科学。1996;274(5292):1537 - 40。
- 55.
Galimba KD, Tolkin TR, Sullivan AM, Melzer R, Theissen G, Di Stilio VS.双花毛毛菊突变体中高度保守的C类花同源基因功能和C-和e类蛋白相互作用的丧失。美国国家科学院。2012; 109 (34): e2267 - 75。
- 56.
Senthil-Kumar M, Mysore KS。植物功能基因组学中VIGS的新维度。植物科学进展2011;16(12):656-65。
- 57.
田秀珍,田秀珍,谷川勇,等。矮牵牛c类MADS-box基因沉默诱导的双花形成及其变异中国科学(d辑:自然科学版),2014;
- 58.
黄酮类生物合成相关基因的时间表达调控龙胆植物花色素的形成。植物科学,2005;168:1309-18。
- 59.
Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析6.0版。中华分子生物学杂志2013;30(12):2725-9。
- 60.
Clough SJ,弯曲AF。花浸:一种简化的方法农杆菌属-中介转化拟南芥芥.植物学报。1998;16(6):735 - 743。
- 61.
李春,佐佐木恩,李春梅,吉川勇。利用苹果潜在球形病毒RNA2载体在草本植物和苹果植物中稳定表达外源蛋白。中国寄生虫病杂志,2004;49(8):1541-58。
- 62.
Karlova R, Rosin FM, Busscher-Lange J, Parapunova V, Do PT, Fernie AR,等。转录组和代谢产物分析表明,APETALA2a是番茄果实成熟的主要调控因子。植物细胞学报,2011;23(3):923-41。
致谢
我们感谢各位女士。A. Kubota, Y. Abe和C. Yoshida提供技术支持。本研究得到了日本科学促进会KAKENHI(资助号21780028)和岩手县政府的支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
TN和MN设计了研究,TN、MS、EY、KF、N. Yamagishi和MN进行了研究,N. Yoshikawa帮助设计了ALSV, TN和MN撰写了论文。所有作者阅读并批准了最终稿件。
额外的文件
附加文件1:
表S1。用于RT-PCR和qRT-PCR分析的引物序列。表S2。ALSV载体构建引物序列。图S1。A-和e -类MADS-box蛋白的系统发育树。拟南芥, ap1 (np_177074), CAL (np_564243), ful (np_568929), sep1 (np_568322), sep2 (aau82009), sep3 (np_564214), sep4 (np_178466);金鱼草majusSQUA (CAA45228);作用研究GsAP1和GsFUL(本研究);佩妮矮牵牛FBP2 (Q03489)和FBP5 (AAK21248)。采用ClustalW近邻连接方法构建系统发育树,并用MEGA6进行可视化处理。分支旁边的数字表示1000次重复的引导值。标度条表示每个位点的氨基酸替换量为0.05。图S2。b类MADS-box蛋白的系统发育树。采用ClustalW近邻连接方法构建系统发生树,并用MEGA6进行可视化处理。用于系统发育分析的氨基酸序列的Genbank登录号如下:金鱼草majusDef (p23706), glo (q03378);拟南芥, ap3 (aad51903), PI (aad51984);菊花×鉴定Cdm86 (aa022986), cdm115 (aa022985);作用研究AP3a, AP3b, PI1, PI2, PI3, TM6(本研究);非洲菊矮牵牛Gdef1 (q9zs28), gdef2 (q9zs27), gdef3 (acv53813), gglo1 (q9zs26);Onchidium矮牵牛Mads3 (aa045824), mads5 (adj67234), mads8 (adj67236), mads9 (adj67235);栽培稻Mads2 (aab52709), mads16 (q944s9);佩妮×矮牵牛GLO1 (AAS46018), GP (CAA49567), pMADS2 (QO7474);蝴蝶兰属equestrisMads2 (aar26628), mad3 (aar26629), mads4 (aar26626), mads5 (aar26627), mads6 (aav83997);罗莎玫瑰MASAKO B3 (BAB63261), MASAKO BP (BAB11939), MASAKO euB3 (BAC79180);茄属植物lycopersicumTDR6 (XP_004232453);Torenia fournieriDef (bag24492), glo (bag24493)。分支旁边的数字表示1000次重复的引导值。标度条表示每个位点的氨基酸替换量为0.05。图S3。利用推导出的GsAP2和其他AP2同源氨基酸序列构建系统发生树。采用ClustalW近邻连接方法构建系统发生树,并用MEGA6进行可视化处理。分支旁边的数字表示1000次重复的引导值。如Karlova等人所述,AP2的氨基酸序列被用作数据集。[62].标度条表示每个位点的氨基酸替换量为0.05。图S4。基因在表达gsag1和表达gsag2的T细胞中的表达2拟南芥植物。四个GsAG1-表示行(编号2、3、5和6)和6GsAG2获得1、3、6、7、9、13号转基因植株表达系。VC,矢量控制植物(港二元矢量pIG121Hm)。半定量RT-PCR分析从叶片中分离的总rna。分析目标GsAG1,GsAG2,而且Actin2作为参考基因。基因名称和周期号分别显示在面板的左右。
权利与权限
开放获取本文遵循创作共用署名4.0国际许可协议(Creative Commons Attribution 4.0 International License),该协议允许在任何媒体或格式中使用、分享、改编、分发和复制,只要您给予原作者和来源适当的署名,提供创作共用许可协议的链接,并说明是否有更改。
本文中的图片或其他第三方材料包含在文章的创作共用许可中,除非在材料的信用额度中另有说明。如果材料不包含在文章的创作共用许可中,并且您的预期用途不被法律法规允许或超出了允许的用途,您将需要直接从版权所有者那里获得许可。
欲查看此许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
创作共用公共领域奉献放弃书(https://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非在数据的信用额度中另有说明。
关于本文
引用本文
中冢,男,斋藤,山田,E。et al。c类的分离与表征MADS-box日本龙胆双花形成的相关基因。植物生物学15日,182(2015)。https://doi.org/10.1186/s12870-015-0569-3
收到了:
接受:
发表:
关键字
- 无性生殖的
- 苹果潜伏球形病毒向量
- 花朵
- 日本龙胆
- LTR-type逆转录转座子
- MADS-box基因