摘要
背景
茶厂(山茶花Sinensis.)被用来生产世界上最重要的饮料之一。茶的营养价值和健康特性与茶多酚(主要是儿茶素)、茶氨酸和咖啡因这三种主要特征成分的大量含量密切相关。虽然油茶(山茶花oleifera)属茶花,这种植物缺乏这三种特征成分。通过RNA-SEQ对茶和油茶的比较分析将有助于揭示茶叶中生物合成的生物合成的遗传成分。
结果
我们发现,3,787和3,359个芽基因,以及4,042和3,302个叶片基因分别在茶叶和油茶中上调。高效液相色谱(HPLC)分析显示,与油茶中的茶叶中,茶中的所有类型儿茶素,Themine和咖啡因均显示出高水平的。通过RNA-SEQ分析检测参与这些特征化合物的生物合成的基因的激活。特别地,与油茶相比,在茶中表现出具有大量不同的表达水平的编码,也通过定量的RT-PCR(QRT-PCR)证实了茶中的显着不同的表达水平。
结论
基于转录组水平的差异,我们分别为茶和油茶组装了81,826和78,863个unigenes。在茶叶和油茶中的基因表达和CateChins和咖啡因的含量变异之间观察到潜在的连接。结果表明,在茶叶中的特征代谢物的积累期间激活了代谢,其在油茶中存在低水平。从分子生物学的角度来看,我们对转录om和相关代谢物的比较揭示了茶叶与油茶中次级代谢途径下面的差异调节机制。
背景
茶叶就是由这种植物生产出来的山茶花Sinensis.(L.)O. Kuntze在家庭中山茶科.茶是世界上最受欢迎的饮料之一,茶叶是许多具有生物活性的代谢物的重要来源,如类黄酮、茶氨酸和咖啡因[1,2].黄酮类化合物主要包括黄酮-3-OLS(儿茶素),EPICATECHIN(EC),GallocateChin(GC),EPIGALLOCATECHIN(EGC),儿茶素(C)及其各自的亲属酯,例如EPigallocateChin Gallate(EGCG)和EpicateChin(ECG)[3.].茶叶是生产茶叶的主要原料,茶叶中含有多种次生代谢产物。然而,调节茶中儿茶素、茶氨酸和咖啡因生物合成的分子机制尚不清楚。
巨大努力旨在阐明植物生长的潜在植物生长的分子机制[4,5]次级代谢产量[6]在茶中。这些研究中的大多数都集中于表征与次生新陈代谢相关的基因,其中大部分通过EST测序揭示[7[茶叶植物各种组织的转录组分析[8,9或在不同的压力条件下[10.,11.].最近,施等等。通过分析转录组数据发现涉及茶叶中途径的新型候选基因[12.].刘等等。据报道,在茶叶植物中发现参与较阳性儿茶素生物合成的新型酶[13.].然而,基因组信息的缺乏阻碍了对茶次生代谢产物生物合成分子机制的研究。转录组测序是获取功能基因组信息的一种有效方法。
RNA-SEQ是一种快速的基因组基因表达分析,广泛用于确定模型生物中的基因结构和表达谱。德诺维RNA-SEQ数据的组装使得可以在没有参考基因组的情况下进行基因分析[14.- - - - - -16.].已经进行了比较转录组研究以鉴定几种生物中的差异基因表达[17.- - - - - -20.].
另一个知名的成员山茶科是石油茶,山茶花oleifera亚伯,一棵树作为在中国种植的食用油的重要来源。油茶在茶叶上遗传地致力于茶,它们都属于属茶花.在这里,我们在芽和茶和油茶的第二叶上进行了RNA-SEQ,以表征这两种植物之间基因表达的差异。该比较转录组分析对茶叶中次级代谢物生物合成的分子机制提供了重要的见解,以及其主要代谢物的植物化学特征。
结果
儿茶素,Theanine和咖啡因含量分析
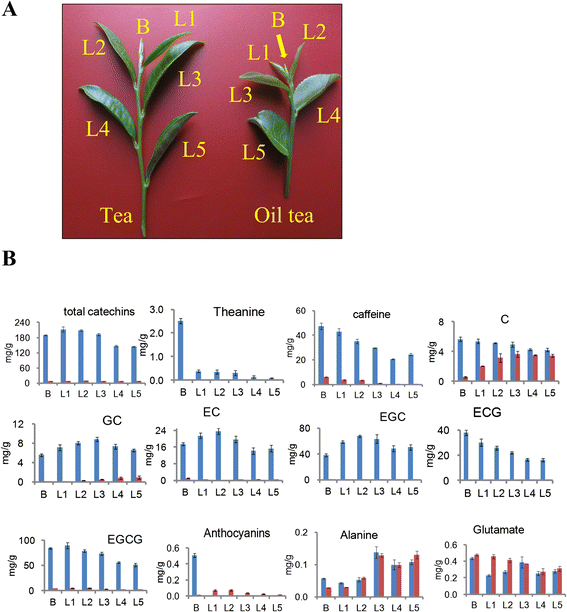
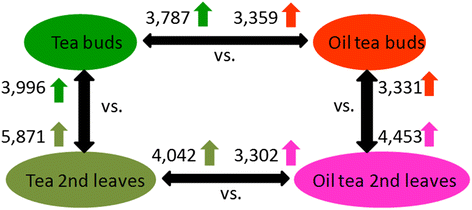
采用高效液相色谱法测定茶叶和油茶的芽和五片叶中儿茶素、茶氨酸、咖啡因及相关中间体的含量。1).所有标准化合物均呈良好的线性关系(R2 > 0.9991) in a relatively wide concentration range. Compared to oil tea, most of these metabolites were present at higher concentrations in tea (Fig.1B.).茶叶中三种特征成分(总儿茶素,茶酮和咖啡因)的平均含量比油茶叶中高1.5至173倍。特别是,茶叶在其叶子和芽中超过180mg / g的总儿茶素。唯一的例外是油茶叶中的花青素含量比茶叶的32倍。这些结果证实,茶叶含量丰富,茶园和咖啡因(表1).
此外,这些特征成分的内容在从芽的外观到五叶的外观时变化。GC,EGC和EC的水平从茶叶中的芽增加到第二或第三片叶子,而在茶叶中观察到咖啡因,总儿科,ECG和EGCG水平的一般下降。
从茶中的第一个叶片观察到茶水平的稳定降低,并且这种化合物的水平在芽中几乎比叶子更大。在油茶中检测到类似的变异,但绝对内容物质要低得多。由于三个初始叶片中大多数化合物(EC,EGC,GC和ECG)的含量的变化,我们选择了RNA-SEQ的第二叶和茶叶和油茶。
德诺维RNA-Seq数据的组装和比较分析
利用Illumina RNA-Seq技术对茶叶和油茶的芽和第二叶进行测序。在去除适配器序列、重复序列、模糊读和低质量读之后,总共生成了23.4 Gb干净读,平均每个样本5.85 Gb干净读2).
茶叶最终组装的unigenes为81,826个,N50长度为1,265 bp3.).功能性注释显示53,786,49,174,34,636,31,024,18,748和40,838 unegenes,与NR(非冗余蛋白质数据库),NT(非冗余核苷酸数据库),瑞士 - Prot(注释蛋白序列数据库),Kegg(Kyoto基因和基因组的百科全书),COG(蛋白质群组簇)和去(基因本体学)数据库。油茶的最终组装由78,863个ungenens组成,N50长度为1,254 bp。其中54,115,49,009,34,682,30,990,19,126和41,325 unegenes分别对齐NR,NT,瑞士 - Prot,Kegg,Cog和Go数据库(附加文件1).序列比较显示,茶和油茶共有17459个基因,其中9725个被定位到KEGG通路(http://www.genome.jp/kegg/)[21.].在茶叶和油茶之间的同源基因中发现高氨基酸序列同一性,占64%的基因,共用超过70%的同一性。我们还在茶叶中检测到64,826名特定成绩单和溢油中的61,863份。
分析差异表达基因(DEGS)
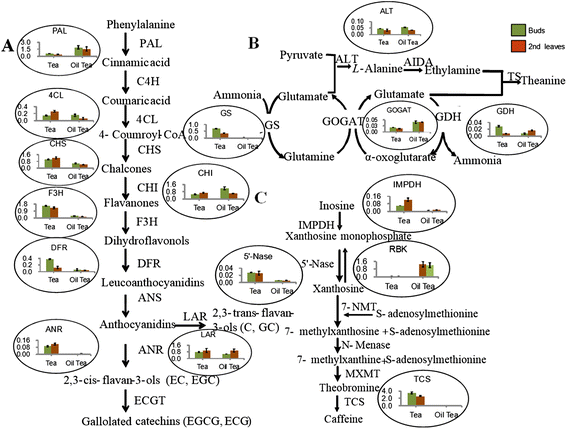
通过比较FPKM(外显子模型每千碱基片段/百万映射reads)值识别出差异基因[22.在log2 (Fold-change)大于1和FDR小于0.001的阈值下,在不同库之间进行比较。2和附加文件2).结果表明,茶和油茶在第二叶中转录水平较高的基因比芽中更多。与油茶相比,茶中含有更多的DEGs(芽中3,787,叶中4,042),芽中3,359,叶中3,302的表达量均高于油茶。随后,利用KEGG途径分析了4 226个来自茶芽与油茶芽(TBvsOTB)、4 174个来自茶芽与茶叶(TBvsTL)、4 334个来自茶叶与油茶(TLvsOTL)和3 418个来自油茶芽与茶叶(OTBvsOTL)的差异基因。其中TBvsOTB的483个(11.43%),TL2vsOTL2的503个(11.61%),TBvsTL的594个(14.23%),OTBvsOTL的482个(14.1%)。在TBvsOTB和TLvsOTL中,次级代谢的富因子(定位到某一途径的deg数量/定位到该途径的基因总数)估计为0.4-0.7(图)。3和b),而它们在TBVSTL和OTBVSOTL中为0.1-0.3(图。3 c和d).通过茶叶和油茶之间的比较鉴定的DEG在途径中的次生新陈代谢中聚集,表明这两个物种中存在不同的二级代谢途径。两个物种中的任何一个阶段之间的较低富因子意味着在此期间发生稳定的新陈代谢(附加文件3.).
基于对Swiss-Prot, COG和KEGG数据库的校准,e值截断小于1 × 10-30117,51和18茶叶基因和110,52和20种油茶叶分别参与儿茶素,茶氨酸和咖啡因的生物合成(附加档案4).我们检测到茶叶和油茶编码酶200多种同源基因,可能参与催化这些反应。茶叶和油茶含有类似数量的基因编码组装基因模型中的大多数酶,但它们的转录水平相当不同(表4).
涉及茶叶特征代谢途径的频率
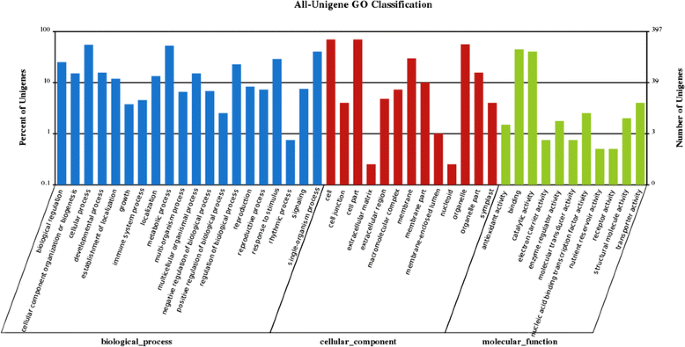
我们使用qRT-PCR确定儿茶素、茶氨酸和咖啡因生物合成中34个deg的差异表达水平,并量化了它们在茶和油茶中的最大转录水平(图)。4和附加文件5).在这些基因中,来自25例(34%的34%)的数据匹配了RNA-SEQ数据。从已发表的黄酮途径中确定[23.[CaTechin生物合成通过连续的酶促反应发生(图。4).有趣的是,苯丙氨酸解氨酶(PAL)和查尔酮异构酶(CHI)基因在上游苯丙氨酸途径中表达量高于茶。而在儿茶素的下游生物合成途径中,F3H (flavanone 3-hydroxylas)、DFR (dihydroflavonol 4-reductase)和ANR (anthocyanidin reductase)基因在茶中表达较高。值得注意的是,ANR基因编码一种酶,催化花青素转移到2,3-顺式黄烷-3-醇,这是儿茶素酯化合成的最后一步中间体。RNA-Seq和qRT-PCR分析表明,ANR基因在茶中有相当程度的激活,而在油茶中没有,这与EC、EGC、C和GC含量的HPLC分析结果一致。茶中的DFR、LAR和ANR基因负责非烯丙基儿茶素的生物合成[24.].F3H、DFR和ANR基因表达水平的差异可能是茶和油茶儿茶素组分检测水平差异的原因。
茶叶和叶子含有多达252倍和86倍油茶的茶叶(图。1),分别。然而,我们并没有鉴定出负责茶氨酸生物合成最终反应的酶的编码基因。qRT-PCR结果显示,GS(谷氨酰胺合成酶)和GDH(谷氨酸脱氢酶)基因在茶叶中的表达高于油茶(图2)。4 b).以前的研究表明,Theanine由TS(Theehine合成酶)从谷氨酸和乙胺合成,这对谷氨酰胺GS高度同源25.].植物化学分析表明,茶芽和茶叶中茶氨酸的含量远高于油茶,表明GS基因的激活与茶叶中茶氨酸的高水平存在潜在的联系。在我们的转录组数据中,在茶和油茶中分别发现了5个和7个GS ungenes。是否为TS基因的功能性拷贝还有待于进一步的酶反应分析来证实。
咖啡因生物合成途径中有三种关键酶:TCS(茶咖啡因合成酶),IMPDH(Inosine-5'-单磷酸脱氢酶)和SAMS(S-腺苷甲基乙硫醚合成酶)[26.].我们检测到涉及咖啡因途径的四个步骤的同源基因。TCS催化咖啡因生物合成的最后一步。TCS基因在茶叶中更高度表达,叶片(超过45倍)比油茶在茶中,尽管负责上游反应的基因具有较高的oil茶中的转录水平,通过QRT-PCR确认(图.4摄氏度).
综上所述,我们对茶中基因表达的研究揭示了与油茶相比相关代谢途径的激活。大多数基因在芽中的表达量略高于在叶中的表达量4).这些发现可能与HPLC揭示的代谢组分的差异有关。
讨论
在这项研究中,我们观察到与油茶相比,观察到茶叶中特征化合物的内容和基因表达模式的差异。我们发现茶叶含有更多有益的营养素,如儿茶素,茶氨酸和咖啡因,因为与这些代谢物相关的途径比茶叶相当有效。Theanine是一种独特的非蛋白质氨基酸,首先在茶中发现。另外两种化合物存在痕量的这种化合物茶花物种 (c .粳稻和C. Sasanqua.)和一种蘑菇(Xerocomus Badius)[27.].
在酚类化合物中,油茶中的类黄酮含量较高(140.06 mg/g干物质)[28.].黄酮类化合物是一类重要的二次代谢产物,包括黄烷酮,黄酮,二氢烷醇,黄酮酚和黄烷-3-醇(儿茶素)。这些化合物对茶品质很重要,对人类健康有益(特别是儿茶素)[29.].儿茶素,Theanine和咖啡因是茶中的主要特征化合物,我们对这些化合物的分析结果符合最近的报告[30.,31.].油茶在茶叶上遗传,但没有报告Theanine和咖啡因,除了以前的研究中的油茶叶中的黄酮类化合物[32.,33.].我们选择了来自同一环境的茶叶和油茶芽和植物的叶子,以揭示高水平儿科,茶园和咖啡因的茶叶背后的机制。我们的结果表明,茶中的儿茶素,Theanine和咖啡因也存在于油茶中,但金额较低。与油茶相比,我们检测到这三种代谢途径中一些关键基因的表达增加,这可能导致其内容物的差异。
我们的结果表明,在黄酮型途径中编码F3h,DFR和ANR的基因在茶中比在油茶中更高度表达。相反,PAL和Chi基因的表达水平比茶在茶中较低。这些观察结果与先前的结果一致[34.].PAL活性高与黄酮类和其他酚类化合物的积累有关[35.,36.], DFR、ANR和LAR在儿茶素的形成中起重要作用[3.].熊等等。发现F3H的稳定表达被保险成型二氢戊戊醇,个体儿茶素的前体[37.].在本研究中,我们没有观察到茶和油茶之间C4H基因表达水平的差异。
我们对茶和油茶中类黄酮、茶氨酸和咖啡因代谢相关基因的分析表明,茶和油茶具有共同的代谢途径,但这些途径中一些关键基因的表达水平可能导致儿茶素、茶氨酸和咖啡因的生物合成差异。
由于茶是自不亲和和顽强的遗传操作,很少遗传或基因组信息,目前可得到的这个物种。因此,我们的实验不是提供一个全面深入的茶转录组调查,而是为了生成一个快速的景观视图。此外,由于茶和油茶的一个芽和五片叶的主要成分含量存在显著差异,我们利用转录组数据来寻找这些代谢途径的关键基因,并揭示这种差异背后的因素。茶叶的质量在很大程度上取决于其代谢情况。因此,我们对儿茶素、茶氨酸和咖啡因的生物合成进行了额外的分析。我们能够检测到这些代谢途径中的几乎所有基因。这些基因中的许多似乎形成了多基因家族,这意味着茶的基因组,像许多其他高等植物的基因组一样,在进化过程中经历了一次或多次基因组复制[38.,这可能解释了为什么高水平的基因表达并不总是导致更高的酶活性在本研究中。在我们标注的茶和油茶转录组数据集中,我们鉴定了多个编码类黄酮、茶氨酸和咖啡因生物合成途径所有deg的转录本。
使用具有相对严格过滤器的互反最佳命中(RBH)方法,鉴定了13,025对推定的茶和油茶的正相关对。我们计算了它们的Ka(非同义)/Ks(同义)比值来估计基因进化的速率[39.,40].在这些原子对中,12,400(95.2%的13,025)的ka / ks值为1或小于1,而625(4.8%的13,025%)的ka / ks值超过1(附加文件6),表明它们处于正选择(PS)。功能氧化石墨烯分析显示,PS下的大多数基因分为氧化石墨烯术语细胞、细胞部分、结合和代谢过程(图)。5).在625年PS基因中,68种表现出组织之间的差异表达(附加文件7).值得注意的是,一些PS同源基因在类黄酮通路中编码CHI和DFR。CHI是类黄酮生物合成途径中产生儿茶素分支的限速酶,DFR是关键酶[41.,42.].由于Ka/Ks比值被广泛用于检测作用于蛋白质编码序列的选择压力[43.,44.[CHI和DFR基因的快速演化可能与植物中的自适应选择相关。没有PS Ortholog分配给Theanine或咖啡因途径。环境因素可能在类黄酮途径的演变中发挥着重要作用。实际上,来自日本的最高品质的绿茶(由Tencha制造的细粉末)在阴影中生长,含有高水平的氨基酸,但低水平的儿茶素[45.].
结论
在这项研究中,我们研究了与油茶相比茶叶中特征代谢物的水平,揭示了油茶中的痕量Theanine。主要代谢物的内容茶叶比油茶更高。这些途径中涉及的基因在茶中比在油茶中更高度表达,尤其是在这些途径的分支点上起作用的关键酶,这可能解释代谢物的差异生物合成(导致不同的组分)在茶叶与油茶中的茶叶.比较转录组分析证明了基因表达与儿茶素,茶氨酸和咖啡因的生物合成之间的联系。比较转录组分析比较茶和油茶之间代谢物水平的分析不仅使我们能够提供对基因表达谱的初步描述,而且还有助于阐明茶中特征生化生物化学生物化学生物化学的分子机制。本研究中获得的转录组数据将作为进一步研究茶和油茶的分子生物学和基因组进一步研究的宝贵平台。
方法
植物材料
六岁的茶叶植物(山茶花Sinensis.(L。Kuntze)和油茶(山茶花oleifera亚伯.)在本研究中使用的是在中国安徽的De Chang Baficrication Base中生长。从2013年夏天从每株植物收集一个芽和五片叶子(图。1).
儿茶素、茶氨酸和咖啡因的提取和高效液相色谱分析
从样品中提取儿茶素和咖啡因等等。[46]微小修改。简而言之,用砂浆和杵在液氮中研磨0.1g冷冻干燥的茶叶组织,并在超声波音器中用3ml 80%甲醇萃取10分钟,在4℃下萃取10分钟。在6000 rpm离心10分钟后,残留物按上述方法再提取两次。将上清液合并并用80%甲醇稀释至10mL的体积。在HPLC分析之前通过0.22μm有机膜过滤得到的上清液。
采用Waters 2695高效液相色谱系统和2489紫外可见检测器测定提取物中儿茶素和咖啡因的含量。采用反相C18色谱柱(Phenomenex 250 mm × 4.6 mm, 5微米),流速为1.0 mL/min。检测波长278 nm,柱温25℃。流动相为0.17% (v/v)乙酸(A)和100%乙腈(B),梯度洗脱如下:B从0到4分钟,6%到14%,16分钟,在22分钟,15%到18%在32分钟,在37分钟,29%到45%在45分钟,在50分钟,45%到6%在51分钟,6%在60分钟。然后,10μL滤液被注入到高效液相色谱系统进行分析。过滤后的样品(10 μL)进HPLC系统分析。对叶片发育各个阶段的样品进行3个重复分析。
用热水萃取氨基酸[47,48].取冻干后的茶叶0.15 g,用研杵在液氮中研磨,用5ml去离子水浸提,100℃水浴20 min。在6000 rpm离心10分钟后,残留物按上述方法再次提取一次。上清混合后用水稀释至10 mL。上清通过0.22 μm膜过滤后进行高效液相色谱分析。采用Waters 600E系列高效液相色谱系统,采用四元泵和2489紫外可见检测器检测茶叶中的茶氨酸。采用反相C18色谱柱(Phenomenex 250 mm × 4.6 mm, 5微米),流速为1.0 mL/min。柱箱温度设置为25℃。检测波长设置为199 nm进行分析[49].流动相由水中的0.05%(v / v)三氯乙酸(a)组成,50%乙腈(b),梯度洗脱如下:b 0%(v / v)至100%,40分钟,在45分钟至100%,60分钟达到0%[31.].然后,将5μl滤液注入HPLC系统中以进行分析。
采用Waters 600E系列高效液相色谱系统检测茶叶中的氨基酸,该系统配备四元泵、2475荧光检测器和2489紫外可见检测器。Waters AccQ•Tag方法[50]使用沃特斯柱(Nova-pak C18,4μm,150mm×3.9mm),根据ACCQ•氟试剂盒的协议检测各种氨基酸[51,52].为了确定色谱技术的线性,使用各种浓度(X)的溶液(Y)构建标准的标准校准图。所有图都在检查的范围内线性;不同浓度标准化合物的线性范围显示在图中(μgmL−1).r.2值是指计算化合物含量的等式的相关系数。从中国上海Winherb Medical Technology,Ltd.购买了标准化合物C,EC,EGC,ECG,EGCG,GC,Themeine和咖啡因。
花青素提取方法:将0.1 g冻干的茶叶组织在液氮中研磨,在室温下用5 mL提取液(80%甲醇:1%盐酸[HCl])超声超声提取10 min。在6000 rpm离心10分钟后,残留物按上述方法再提取两次。混合上清液,用萃取液稀释至10 mL,再用三氯甲烷萃取。在525 nm处用比色法测定花青素含量[53].
RNA提取,图书馆建设和RNA-SEQ
使用改性的CTAB方法单独提取来自茶和油茶的总RNA [54].用凝胶电泳和分光光度法(Nanodrop)测定RNA完整性。在cDNA制备之前,从三个生物复制中收集等量的RNA。北京基因组研究所工作人员对mRNA进行富集、片段中断、添加适配器、大小选择、PCR扩增和rna测序。深圳,中国)。首先,用Oligo (dT) 25 (Invitrogen)的磁珠从20 μg总RNA中富集mRNA,并将其裂解成短片段。其次,以这些短片段为模板,用随机引物(Japan, Takara)合成第一链cDNA,得到双链cDNA。第三,用T4 DNA聚合酶、Klenow DNA聚合酶和T4多核苷酸激酶(英国,NEB)对双链cDNA片段末端进行进一步修饰,用T4 DNA连接酶(Invitrogen,美国)将适配器连接到短片段上。经过末端修复和连接适配器的过程后,通过PCR富集产物,构建最终的cDNA文库。cDNA文库使用Agilent 2100 Bioanalyzer进行检测。 Finally, the four libraries were sequenced on an Illumina HiSeq™ 2000.
RNA-Seq序列的从头组装
4个样品经质量控制后均获得干净读数。其中,两种来自茶叶,两种来自油茶,它们分别使用转录组汇编器Trinity进行组合和组装[55].组装成簇的总长度是转录组质量的重要标准。取消冗余和从大会的短折叠后定义了未成年人。来自茶和油茶的unigenes迭代地对准两种物种中的同源基因的对方。在一对同源基因中的每个基因的超过80%的时间严格对准。
QRT-PCR分析所选基因
为了验证从组装的转录组中获得的unigenes的准确性,并通过RNA-Seq分析基因表达,我们进行了qRT-PCR分析。从样本中提取RNA样本,使用Prime-Script™1st Strand cDNA Synthesis Kit (TaKaRa, Dalian, China)从RNA中合成用于实时PCR分析的单链cDNA。监测34个转录本的表达模式。所选转录本的详细信息,包括其unigene id和本研究设计的引物对,请参见附加文件8.IQ5实时荧光定量PCR检测系统(Bio-Rad)如前所述。甘油醛-3-磷酸脱氢酶(GAPDH)基因被用作内部参考基因,并且使用2计算相对表达Δct.方法 [56].所有QRT-PCR分析都在三种生物学和三种技术复制中进行。
Unigene功能注释和分类
unigenes与蛋白质序列数据库NR对齐,瑞士 - prot蛋白质数据库和COG [57] Bellastx具有1×10的电子值阈值−5.unigenes被映射到Kegg代谢途径数据库[58].使用Kegg注释,可以获得unigenes的代谢途径注释,这有助于阐明基因的复杂生物学行为。使用COG数据库,可以对外观基因产品进行分类,并且可以预测unigenes的可能功能。基于NR注释,使用Wego软件获得未来的unigenes分类[59](http://wego.genomics.org.cn/cgi-bin/wego/index.pl)通过BLAST 2 GO计划注释(版本2.3.4)[60,以阐明一个物种的基因功能在宏观水平上的分布。
茶和油茶的核苷酸和蛋白质序列比较
通过Blast和Mummer比较来自茶和油茶的蛋白质序列(http://mummer.sourceforge.net/),同源性≥70%的序列保留。
主要次级代谢相关差异表达基因
进行Kegg途径分析,以鉴定具有不同表达水平的基因。使用FPKM方法计算Unigene表达。根据“数字基因表达谱的意义”进行差异表达基因(DEGS)[61],使用严格的算法修改。fdr≤0.001和日志的绝对值2选择比值≥1作为判断各基因差异表达显著性的阈值。对于一个给定的ungene,从四个转录组中分别生成四个FPKM值。使用聚类3执行分层聚类。通过ggplot2 (http://docs.ggplot2.org/current/geom_point.html)[62].在进一步研究代谢途径之后,选择几种代表性途径以进行更详细的分析,包括类黄酮代谢,茶氨酸代谢和咖啡因代谢。
茶叶与油茶同源基因的鉴定
为了鉴定茶叶和油茶之间的基因,RBH [63使用基于BLASTN程序的方法。以前的研究中使用了类似的方法和标准[64,65].此外,用WEGO比较了阴性选择(Ka/Ks < 1)和阳性选择(Ka/Ks > 1)下假定直系亲属的GO分类。
估计正交基因对之间的同义词和非同义替代率
为了计算每个正交基因对的KS和KA替代率,相当于非同义词对同义替代率Ka / Ks的生物测量[66],其中k和Ka由(PAML包的)codeml估计,采用似然法[67,68].
提供支持数据的可用性
从芽和叶子产生的Illumina RNA-SEQ数据山茶花Sinensis.和山茶花oleifera在NCBI SRA(http://trace.ncbi.nlm.nih.gov/Traces/sra),附件SRR1928149和SRR1928150。
缩写
- 高效液相色谱法:
-
高效液相色谱
- QRT-PCR:
-
定量实时-PCR
- 电子商务:
-
epicatechin.
- GC:
-
儿茶素
- EGC:
-
Epigallocatechin.
- C:
-
儿茶素
- EGCG:
-
eepigallocatechin gallate.
- 心电图:
-
epicatechin gallate.
- FPKM:
-
百万百万型映射的外显子模型的片段
- NR:
-
非冗余蛋白质数据库
- NT:
-
非冗余核苷酸数据库
- 瑞士科:
-
注释蛋白质序列数据库
- KEGG:
-
京都基因和基因组百科全书
- COG:
-
孤立蛋白质群体
- 走:
-
基因本体论
- 度:
-
差异表达基因
- 结核病:
-
茶蕾斯
- OTB:
-
油茶叶芽
- TL:
-
茶叶
- OTL:
-
油茶叶
- 朋友:
-
苯丙氨酸ammonia-lyase
- 气:
-
查耳酮异构酶
- F3h:
-
黄烷酮3-hydroxylas
- F3'5'H:
-
类黄酮3 ',5 ' -羟化酶
- DFR:
-
Dihydroflavonol 4-reductase
- ANR:
-
花青素还原酶
- GS:
-
谷氨酰胺合成酶
- 国民幸福指数:
-
谷氨酸脱氢酶
- TS:
-
茶氨酸合成酶
- TCS:
-
茶咖啡因合成酶
- IMPDH:
-
Inosine-5”一磷酸脱氢酶
- 山姆:
-
S-adenosylmethionine合成酶
- RBH:
-
互惠的最好的打击
- K a:
-
非同义
- ks:
-
同义词
- PS:
-
积极的选择
- HCl:
-
盐酸
- GAPDH:
-
甘油醛-3-磷酸脱氢酶
参考
- 1。
梁子,马力,卢杰,吴Y.化学成分的比较伊斯克斯拉脱陆拇指和山茶花Sinensis.食品化学。2001;75(3):339-43。
- 2。
Mamati Ge,Liang Y,Lu J.涉及茶多酚合成中涉及的基本基因的表达与CateChins积累和茶多酚的积累。J SCI食物农业。2006; 86(3):459-64。
- 3。
Punyasiri Pan,Abeysinghe Isb,Kumar V,Treouter D,Duy D,Gosch C等人。黄酮类生物合成在茶叶山茶花Sinensis.:表儿茶素和儿茶素主要途径的酶的特性。生物化学学报。2004;431(1):22-30。
- 4.
奥巴达M,Owuor Po。芽成熟度对克隆叶片挥发性香精化合物组成的影响。J SCI食物农业。1995年; 69(4):529-34。
- 5.
Owuor PO, Obanda M, Nyirenda HE, Mandala WL。产地对无性系红茶化学特性的影响。食品化学。2008;108(1):263 - 71。
- 6.
茶叶内源生长素在冬季休眠中的变化(山茶花Sinensis L.)O. Kuntze。Acta physiol植物。2006; 28(2):165-9。
- 7.
赵吕。CDNA文库施工茶厂(山茶花Sinensis.)和茶叶特异性基因的序列分析。北京:中国农业学院茶园研究所;2004年。
- 8.
Chen L,Zhao L,Gao Q.从嫩芽CDNA文库的表达序列标签的生成和分析(山茶花Sinensis.).植物科学。2005;168(2):359 - 63。
- 9。
Das A, Das S, Mondal TK。茶(Camellia sinensis (L.))幼根差异表达基因的鉴定利用抑制减法杂交对干旱胁迫的响应。植物学报。2012;30(5):1088-101。
- 10.
王XC,赵Qy,Ma Cl,张Zh,Cao HL,KONG YM等。全局转录组概况山茶花Sinensis.在冷驯化期间。BMC基因组学。2013; 14(1):415。
- 11.
Thirugnanasambantham K,Prabu G,Palanisamy S,Chandrabose SRS,Mandal Aka。分析休眠芽(BANJHI)茶叶特异性转录组(Camellia Sinensis(L.)O. Kuntze),发现休眠相关基因。生物工程学报。2013;169(4):1405-17。
- 12.
史春云,杨辉,魏春林,张振华,曹海林,孔玉明,等。深度测序山茶花Sinensis.转录组显示候选基因用于茶叶的主要代谢途径。BMC基因组学。2011; 12(1):131。
- 13。
刘yj,gao lp,liu l,杨q,lu zw,nie zy等。在茶叶植物中涉及CaCechin Galloylation的新型羊酰基转移酶的纯化和表征(山茶花Sinensis.).J Biol Chem。2012; 287(53):44406-17。
- 14。
袁勇,宋丽萍,李明华,刘光明,楚银英,马丽丽,等。遗传变异和代谢途径的复杂性决定着中药材活性成分的含量和质量Lonicera japonica thunb..BMC基因组学。2012;13(1):195。
- 15.
冯c,陈m,xu c,白l,yin xr,li x等。中国杨树的转录组分析(Myrica Rubra.)使用RNA-SEQ的果实开发和成熟。BMC基因组学。2012; 13(1):19。
- 16.
张j,梁某,段j,王俊,陈sl,cheng zs等。在种子发育过程中转录组的De Novo组装和表征,以及花生中的基因-SSR标记物的产生(arachis hypogaea l。).BMC基因组学。2012;13(1):90。
- 17.
郝大成,葛国宝,肖鹏,张媛媛,杨磊。基于Illumina第二代测序的红豆杉组织特异性转录组的首次研究。PLoS ONE。2011; 6 (6), e21220。
- 18.
太阳W,徐X,朱,朱HS,刘啊,刘L等。耐盐野生番茄物种和盐敏感番茄栽培品种的比较转录组分析。植物细胞生理。2010; 51(6):997-1006。
- 19。
Koenig D, Jiménez-Gómez JM, Kimura S, Fulop D, Chitwood DH, Headland LR,等。比较转录组学揭示了驯化和野生番茄的选择模式。中国科学院院刊。2013;110(28):E2655-62。
- 20.
吴志军,李晓华,刘志伟,徐志生,庄俊。德诺维组装和转录组特征:对儿茶素生物合成的新洞察山茶花Sinensis..BMC植物BIOL。2014; 14(1):277。
- 21.
Kanehisa M,Goto S,Sato Y,Furumichi M,Tanabe M.Kegg用于集成和解释大规模分子数据集。核酸RES。2012; 40(D1):D109-14。
- 22.
基于RNA-Seq的哺乳动物转录组的定位和定量研究。Nat方法。2008;5(7):621 - 8。
- 23.
Eungwanichayapant PD,Popluechai S.在茶中积累的CateChins累积与CateChin生物合成的基因的MRNA积累。植物理性生物化学。2009; 47(2):94-7。
- 24。
Ashihara H,Deng WW,Mullen W,Crozier A. Flavan-3-OLS的分布和生物合成山茶花Sinensis.编码生物合成酶的基因的表达。植物化学,2010;71(5):559 - 66。
- 25。
吴H,Chen D,Li J,Li JX,Yu B,Qiao Xy等。使用454次测序和茶叶中EST-SSR标记的叶片转录组的叶片转录组特征(山茶花Sinensis.).植物mol biol报告。2013; 31(3):524-38。
- 26。
咖啡因与相关嘌呤生物碱:生物合成、分解代谢、功能与基因工程。植物化学。2008;69(22):841 - 56。
- 27.
Li N,De Silva J. Theanine:茶叶中的发生和新陈代谢。年度植物评论第42卷:后基因组时代植物中的氮代谢。英国:牛津; 2010.P.171-206。
- 28.
张丽丽,王玉明,吴冬梅,徐敏,车建华。微波辅助提取山茶花oleifera水果船体。分子。2011;16(6):4428 - 37。
- 29.
茶多酚促进健康。生命科学。2007;81:519-33。
- 30。
Rusak G,Komes D,Likićs,Horžićd,KovačM.酚醛含量和绿色和白色茶提取物的抗氧化能力,取决于提取条件和所用溶剂。食品化学。2008; 110(4):852-8。
- 31.
Ying Y,Ho JW,Chen Zy,Wang J等。HPLC荧光检测茶叶中茶叶中的分析。J LIQ Chromatogr Relat Technol。2005; 28(5):727-37。
- 32.
陈建华,刘炳良,钟tt,张cmj。黄酮苷和山奈酚苷的提取和纯化山茶花鉴定)通过使用亲水异丙醇盐析种子。SEP Purif Technol。2009; 67(1):31-7。
- 33.
小速,张米,元XY,李德,杨玉。总黄酮的提取和纯化研究山茶花奥里西亚亚伯树叶。中国食品添加剂。2012; 4:93-7。
- 34.
杨德,刘y,孙m,赵l,王ys,陈xt,等。茶中的差异基因表达(山茶花Sinensis.L.)Calli具有不同的形态和儿茶素内容物。J植物理性。2012年; 169(2):163-75。
- 35.
红、金味苹果成熟过程中的布兰肯希普SM、不拉特CR、PAL和乙烯含量。植物化学。1988;27(4):1001 - 2。
- 36。
KataOka I,Kubo Y,Sugiura A,Tomana T.在三种葡萄品种的浆果成熟过程中L-苯丙氨酸氨酶活性和花青素合成的变化。J JPN SoC Hortic SCI。1983; 52:273-9。
- 37。
熊L,李继,李义,元L,刘某,黄杰等。白蛋白水平和儿茶素生物合成相关基因表达的动态变化(茶树L)。植物生理生化学报。2013;71(2):132-43。
- 38。
Sakuma S,Pourkheirandish M,Matsumoto T,Takashi K,Takato K,Takao。在大麦中复制过保守的同性恋肌亮氨酸 - 亮氨酸转录因子基因产生了更具体的功能的副本。Funct综合基因组学。2010; 10(1):123-33。
- 39.
Miyata T,Yasunaga T. mRNA的分子演变:一种估算同源核苷酸序列的同义和氨基酸取代的进化率及其应用方法。J Mol Evol。1980; 16(1):23-36。
- 40。
杨Z,Bielawski JP。检测分子适应的统计方法。趋势ECOL EVOL。2000; 15(12):496-503。
- 41。
廖建杰,安聪,吴胜,陈志林。查尔酮合成酶基因在高等植物抗病应答中的作用。北京大学学报(自然科学版). 2000;36(4):565-75。
- 42。
通过抑制查尔酮异构酶基因对转基因烟草类黄酮成分和花色的影响。2月。2005;579(27):6074 - 6078.2。
- 43.
杜艳艳,梁友英,王辉,王克荣,卢建林,张光辉,等。白化茶树品种化学成分的研究。生物技术学报。2006;81(5):809-12。
- 44.
冯磊,高明杰,侯瑞英,胡晓燕,梁铮,万晓春,等。白化茶品种幼叶质量成分的测定。食品化学。2014;155:98 - 104。
- 45.
Ku Km,Choi Jn,Kim J,Kim JK,Lee Sj,Lee Ch。代谢组科分析揭示了阴影茶叶的组成差异(山茶花Sinensis L.).JAgric Food Chem。2009; 58(1):418-26。
- 46.
于松,李文伟,王玉生,刘玉军,王红霞,王雪峰,等。茶树不同发育阶段儿茶素的合成与积累安徽农业大学学报,2011;38(4):600-5。
- 47.
王磊,龚丽华,陈家杰,韩海波,李洪辉。绿茶中多酚、咖啡因和茶氨酸的柱层析提取和分离。食品化学。2012;131(4):1539 - 45。
- 48。
颜俊杰,陈海英。不同茶提取物的抗氧化活性及其抗诱变性。农业食品化学。1995;43(1):27-32。
- 49。
朱晓玲,陈波,罗晓波,姚思华,等。反相高效液相色谱法测定茶叶中的茶氨酸。中国色谱学报。2003;21(4):400-2。
- 50。
Anderstam B, Katzarski K, Bergström J.血清中NG, NG-二甲基- l-精氨酸,一种潜在的内源性一氧化氮抑制剂在透析患者中的水平。中华医学杂志。1997;8(9):1437-42。
- 51。
倪娟,徐慧。茶叶中氨基酸测定方法的研究进展。J茶。2007;2:001。
- 52。
Heresztyn T,Worthley Mi,Horowitz JD。通过液相色谱法作为ACCQ-Fluor TM荧光衍生物测定L-精氨酸和N G,N G-和N G,N G'-二甲基-1-精氨酸的血浆。J Chromatogr B. 2004; 805(2):325-9。
- 53。
Lee J,Rennaker C,Wrolstad Re。两种花青素定量方法的相关性:HPLC和分光光度法。食品化学。2008; 110(3):782-6。
- 54。
石春英,万小春,姜长昌,孙军Camellia Sinensis(L.)O. Kuntze)]。安徽农业大学学报。2007; 34(3):360-3。
- 55.
Grabherr MG, Haas BJ, Yassour M, Levin JZ, Thompson DA, Amit I,等。没有参考基因组的RNA-Seq数据的全长度转录组组装。生物科技Nat》。2011;29(7):644 - 52。
- 56.
Livaka KJ, Schmittgen TD。利用实时荧光定量PCR技术分析相关基因表达数据——ΔΔCT方法。方法。2001; 25(4):402-8。
- 57.
Tatusov RL, Natale DA, Garkavtsev IV, Tatiana T, Uma S, Bachoti SR. COG数据库:全基因组蛋白质系统发育分类的新进展。核酸学报2001;29(1):22-8。
- 58.
Kanehisa M,Goto S,Kawashima S,Okuno Y,Hattori M.用于解密基因组的Kegg资源。核酸RES。2004; 32款4:D277-80。
- 59.
YE J,F牙,郑H,陈俊,张Z,王J,等。Wego:用于绘制GO注释的Web工具。核酸RES。2006; 34 34 SOPP 2:W293-7。
- 60。
Conesa A,Götzs,García-gómezJM,Terol J,TalónM,Robles M.Bast2Go:功能基因组学研究中的注释,可视化和分析的通用工具。生物信息学。2005; 21(18):3674-6。
- 61。
Audic S, Claverie JM。数字基因表达谱的意义。基因组研究》1997;7(10):986 - 95。
- 62。
Trapnell C,Hendrickson DG,Sauvageau M,Goff L,RINN J,Pachter L.用RNA-SEQ进行转录分辨率的基因调控差异分析。NAT BIOTECHNOL。2013; 31(1):46-53。
- 63。
夏娥,江jj,黄鹤,张立会,张赫,高lzh。石油丰富的茶厂的转录体分析,山茶花oleifera,揭示与脂质代谢相关的候选基因。PLoS ONE。2014; 9(8),E104150。
- 64。
王婷婷,李婷婷,张晓芳,张晓芳,孙晓伟。转录组分析揭示了鲤鱼基因组第四轮复制的时间(Cyprinus carpio).BMC基因组学。2012;13(1):96。
- 65。
张L,燕HF,吴W,Yu H,Ge XJ。比较转录组分析和两个密切相关的报春花物种的标记发育(樱草属植物poissonii和樱草属植物wilsonii).BMC基因组学。2013;14(1):329。
- 66。
关键词:进化计算,并行问题,进化速率,非同义-同义替换比,k a/k s2008.448 - 57页。
- 67.
Goldman N,Yang Z.蛋白质编码DNA序列的基于核苷酸替代的基于密码子的模型。mol Biol Evol。1994; 11(5):725-36。
- 68.
杨Z.PAML 4:通过最大可能性进行系统发育分析。mol Biol Evol。2007; 24(8):1586-159。
确认
我们欣赏李滨,魏陈和明明史(深圳,中国深圳北京基因组学院)为其技术支持和初始数据分析。我们感谢Xiangyu Meng进行材料集合。我们感谢Shancen Zhao在稿件上发表评论和修订。中国国家基本研究和发展的主要项目(2012厘米3222903号),中国安徽省科技项目(项目13Z03012),中国安徽省茶基因组项目,得到了这项工作得到了支持安徽省茶化学与健康领导团队的主要示范项目和中国(NSFC)项目(NSFC)项目(第31170283号,项目31300578和313005576),以及安徽农业大学学术骨干栽培项目(2014XKPY-34).我们也非常感谢Elixigen编辑服务(ID141224-4541)的未知编辑,用于英语抛光。
作者信息
从属关系
相应的作者
附加信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
YLT执行了实验并解释了序列数据。XCW构思和修订了手稿。CLW构思和设计了实验计划。HY设计了实验计划并修改了稿件。JZ参与了样品收集和RNA制备。LZ设计了HPLC方法。CTH修改了稿件。SW积极参与手稿修订和数据分析。CBF修订了稿件。WWD参与了实验设计。 QC provided valuable comments and suggestions for improving the quality of the manuscript. All authors read and approved the final manuscript.
Yuling Tai,Chaoling Wei和Hua Yang同样为这项工作贡献。
附加文件
额外的文件1:
茶叶和油茶的组装造林诠释。(XLSX 16149 kb)
附加文件2:
任何两种组织之间的DEGS的统计比较。将基因分为三类:红色表示上调基因,绿色表明下调基因和蓝色表示未差异表达的基因。茶叶,第二叶,油茶芽和油茶的第二片叶子分别缩写为TB,TL,OTB和OTL。(TIFF 2076 KB)
附加文件3:
从TBVSTL,OTBVSOTL,TBVSOTB和TL2VSOTL2中基因表达比较衍生的每种途径的丰富因子和基因数。TBvsOTB代表茶芽和油茶芽,TBvsTL代表茶芽和茶叶,TLvsOTL代表茶叶和油茶叶,OTBvsOTL代表油茶芽和叶子。(XLSX 16 KB)
附加文件4:
有关来自类黄酮,茶碱和咖啡因生物合成途径的基因的信息。参与三种代谢途径的未成年人通过与瑞士 - Prot,Cog和Kegg数据库的对齐进行注释,E值小于1×10-30.(XLSX 82 KB)
附加文件5:
qRT-PCR分析的deg列表。通过QRT-PCR分析了总共34种参与黄酮,茶氨酸和咖啡因生物合成途径的基因。(XLSX 16 KB)
附加文件6:
估计的Ka和ks值为625正交基因对(Ka / ks> 1)。显示序列长度,非同义替代率(KA),同义替代率(ks),ka / ks和p值。(XLSX 51 KB)
附加文件7:
注释途径阳性选择下的DEGs分布。(XLSX 12 KB)
附加文件8:
用于QRT-PCR的引物。(多克斯18 kb)
权利和权限
开放访问本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Tai,Y.,Wei,C.,Yang,H.等等。茶叶中特征成分生物合成的转录组和植物化学分析(山茶花Sinensis.)与油茶相比(山茶花oleifera).BMC植物杂志15,190(2015)。https://doi.org/10.1186/s12870-015-0574-6
收到了:
接受:
发表:
关键词
- 比较转录组
- 山茶花Sinensis.
- 山茶花oleifera
- 化学成分
- 代谢途径