摘要
背景
植物细胞壁是抵御病原入侵的主要屏障。植物病原菌的成功很大程度上取决于它克服这一障碍的能力。在感染过程中,植物寄生线虫除了用针刺穿外,还会分泌细胞壁降解酶(CWDEs)。CWDEs通常由纤维素酶、半纤维素酶和果胶酶组成,它们有助于线虫感染并建立取食结构或形成囊肿。线虫细胞壁降解酶的研究不仅加深了我们对线虫与宿主相互作用的理解,而且为其在生物燃料/生物制品工业中的潜在应用提供了新的酶源。虽然有关于细菌、真菌、白蚁和植物的CWDEs全基因组分析的综合信息,但是没有关于植物病原线虫的综合信息。在此,我们对植物病原线虫的基因组序列进行了全基因组分析,并建立了一个全面的公开数据库。
结果
在本研究中,我们对5种植物寄生线虫的3个属的CWDEs进行了全基因组测序即。布萨菲伦丘斯和根结线虫。利用各自基因家族的隐马尔科夫模型(HMM)保守结构域谱,我们鉴定出530个编码CWDEs的基因,它们分布在糖苷水解酶(412个)和多糖裂解酶(118个)的24个基因家族中。此外,还分析了这些基因在马铃薯包囊线虫整个生命周期中的表达谱。大部分基因在侵染初期和侵染后期均有中高表达,部分基因具有侵染阶段特异性,说明这些酶在侵染和侵染建立过程中发挥了重要作用。此外,我们还开发了一个线虫的植物细胞壁降解酶(NCWDE)数据库作为平台,以提供本研究的全面结果。
结论
我们的研究提供了来自五种不同植物病原线虫的不同CWDEs家族的集体信息。这项研究的结果将有助于制定更好的策略,以减少线虫感染,以及有助于确定新的细胞壁降解酶的生物燃料/生物产品工业。
背景
植物寄生线虫利用物理和生化策略成功地感染和建立在寄主植物。植物细胞被细胞壁包围,细胞壁是一种刚性结构,主要由基质生物聚合物和不同结构蛋白质组成的动态网络组成[1.–4.]. 细胞壁是植物细胞的一个独特特征,它不仅对维持细胞的形状、大小和生长具有重要意义,而且对细胞间和细胞与环境的相互作用也具有重要意义[2.].植物的细胞壁也作为主要的防御屏障,以抵御过多的植物病原体的攻击即。细菌、病毒、真菌和线虫[5.–7.]. 线虫的成功进入(感染)和存活(合胞体或巨细胞的形成)需要产生一系列协同作用的细胞壁降解酶。在各种植物病原中,寄生线虫松材线虫(松材线虫),苍白球绦虫(土豆囊肿线虫),Heterodera甘氨酸(大豆孢囊线虫)和不同的根结线虫物种(根结线虫)是造成主要作物损失和农业损失的罪魁祸首,每年高达1570亿美元[8.–10].为了建立与植物的寄生关系,这些线虫的大多数分泌协同活性细胞壁降解酶(CWDES)的混合物,以侵入植物细胞壁[11–13]. 在物理损伤后,这些酶混合物被注入植物细胞,通过用一个针(一种中空的口矛状结构)刺穿它们,这种针出现在外寄生虫和内寄生虫的头部[14,15].
细胞壁组成在线虫与植物的相互作用中起着重要的作用[16].植物细胞壁主要由纤维素(15 - 40%)、半纤维素(30 - 40%)、木质素(20 - 30%)和果胶生物聚合物以及基质蛋白(1 - 5%)组成[1.–4.]. 根据细胞壁的组成,线虫必须产生一组特定的CWDEs,以降解寄主特定的细胞壁,从而成功进入植物物种。线虫不能降解任何特定的细胞壁成分可能导致不成功的感染或在寄主植物中存活。改变植物细胞壁的组成,使细胞壁不易被线虫降解,从而提高植物对线虫的抗性是可行的。CWDEs在科学和商业上具有重要意义,特别是在以植物生物质为基础的生物燃料/生物产品工业中。利用植物生物质生产的木质纤维素材料,通过细胞壁衍生糖的发酵生产生物制品和生物乙醇[17]. 木质纤维材料通常需要昂贵的物理化学(蒸汽和化学)预处理来释放糖分子以生产生物乙醇[18]. 生物预处理需要高效的CWDEs,以降低物化预处理的成本和相关的化学污染。由细菌和真菌产生的CWDEs已被鉴定并用于生物燃料工业的生物质预处理[19]. 然而,线虫产生的CWDEs还没有被用于生物燃料的工业应用。线虫产生的酶可以为生物燃料工业提供一种新的酶源。
线虫中存在CWDEs的第一个实验证据是在囊性线虫食管腺体中鉴定出内源性β-1,4-内切葡聚糖酶(EC 3.2.1.4)g . rostochiensis和H甘氨酸[20.]. 随后,从不同的植物寄生线虫中鉴定了内切葡聚糖酶,如B嗜木菌(GH45) [21],非洲双翅目和Pratylenchus coffeae(gh5)[22].利用不同的生物信息学和湿实验室方法从植物寄生线虫中鉴定出了不同的半纤维素和果胶降解酶[9,20.,23,24].CWDEs基因组范围内的第一份鉴定报告来自于第一个测序的植物寄生线虫,M.Incognita.[9].此外,类似的研究表明CWDEs存在于B嗜木菌[25),g . pallida[26]. 有趣的是,植物寄生线虫h . schachtii产生一种纤维素结合蛋白,它与宿主的果胶甲基酯酶(PME)相互作用,从而改变细胞壁[27]. 转基因小鼠PME的过度表达拟南芥蒂利亚纳导致线虫易感性增加,表明线虫共同选择了用于细胞壁改性的宿主蛋白[27]. 因此,除了在生物燃料工业中的应用外,研究CWDEs对于制定有效的植物防御策略具有重要意义。
CWDEs在降解植物细胞壁中的作用已经从真菌中得到了很好的研究,并且已经建立了各种数据库,其中包含了关于植物细胞壁降解酶的全面信息[28,29].对于NEMATODE,即使基因组数据可用于五种主要种植的植物寄生线虫9,25,26].在提供此类信息的大多数平台中,Nematode的表示仅限于模型Nematode,秀丽隐杆线虫.在本研究中,我们收集了植物寄生线虫的全序列基因组资源,并分析了编码CWDEs的基因的存在,这些基因参与了纤维素、半纤维素和果胶的降解。利用碳水化合物-活性酶(CAZy)数据库中获得的CWDE基因家族的特定保守序列,通过HMM谱搜索将所鉴定的CWDE基因家族划分为24个基因家族[30.]. CAZy数据库定义了不同种类的细胞壁相关酶(http://www.cazy.org/).碳水化合物活性酶(副幼级)参与寡核苷酸和多糖的糖缀合物的生物合成/降解/改性[29]. 根据蛋白质催化结构域或功能结构域的不同,CAZymes可进一步分为糖苷水解酶(GHs)、多糖裂解酶(PLs)、糖基转移酶(GTs)、碳水化合物酯酶(CEs)和具有辅助活性的酶(AAs)[29,30.].Cazy数据库包含有关大约133 GH和23 PL基因家庭的信息。纤维素和半纤维素降解酶属于糖苷水解酶类的不同家族[11,30.]. 寄生虫产生的酶在细胞壁修饰和寄主-病原相互作用中起着重要作用[30.]. 为了了解这些酶的动态关系,我们进一步研究了内寄生马铃薯孢囊线虫在不同生命周期中CWDEs的表达谱,g . pallida. 我们发现CWDEs在侵染期有表达,在侵染期和建立期也有部分CWDEs被诱导表达,表明CWDEs在植物线虫的发病和存活中起着重要作用。CAZymes的表达是动态的,并随生命周期和感染的不同而变化。在此基础上,构建了线虫细胞壁降解酶数据库(NCWDE;http://www.pssc.ttu.edu/ncwde/index.html)以五种植物寄生线虫的基因组测序为平台,提供所有植物寄生线虫的综合信息。除了从本研究中鉴定出的CWDEs外,我们还包括了不同物种的已发表文献中的CWDEs,以扩大我们数据库的范围。
结果与讨论
五种不同线虫细胞壁降解酶基因的全基因组分析
生物体的基因组测序提供了关于不同基因、基因家族和染色体位置数量的综合信息。在这里,对于CWDEs的分析,我们集中在可以获得全基因组序列的线虫种类上。在几种植物病原线虫中,只有三个属的五种植物有全基因组序列(B嗜木菌[25],g . pallida[26],m . floridensis,m .差异和M.Incognita.[9])基因组大小为53.01 Mb(m .差异)至123.63 Mb(g . pallida). 为了对CWDEs进行全基因组分析,共从这五个物种下载了90314个蛋白质序列,每个基因组的平均蛋白质组大小为18063个蛋白质,范围为14420个(m .差异)至21038(m . floridensis)蛋白质(表1.).筛选下载的蛋白质序列用于编码植物细胞壁降解酶的蛋白质存在。
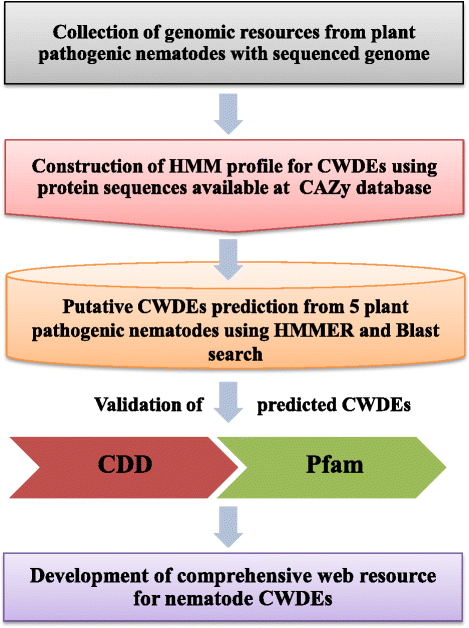
在根据不同数据库分析的总蛋白质序列中,共鉴定出530个CWDE相关蛋白质序列,平均每个分析物种的106个CWDE相关蛋白质(表1)1.,附加文件1.:表S1)。m .差异被发现有最少数量的CWDE编码基因(78),而M.Incognita.CWDE编码基因最多(131)。然而,每个物种存在的CWDEs的数量与基因组大小没有关系。本研究显示,不同线虫种类的CWDE编码基因数量高于以往个别报道[9,25,26].我们的分析显示有119个CWDE编码基因B嗜木菌与先前研究中发现的73个基因相比[25]. 同样地M.Incognita.和m .差异与已报道的90个和44个CWDE编码基因相比,我们发现了131个和78个CWDE编码基因[9]. 已鉴定的CWDE编码蛋白在不同基因家族中的鉴定和分布(表1)2.)使用从CAZy数据库上可用的序列信息构建的签名域配置文件执行[11]. 此外,还进行了blast相似性搜索以识别CWDE编码基因。去除多余的基因序列后,利用保守结构域数据库(CDD)和蛋白质家族(Pfam)进一步验证所有已鉴定的基因是否存在相关的保守结构域。用于鉴定CWDE基因的生物信息管道如图所示。1..
CAZy家族、基因分布与细胞壁降解酶
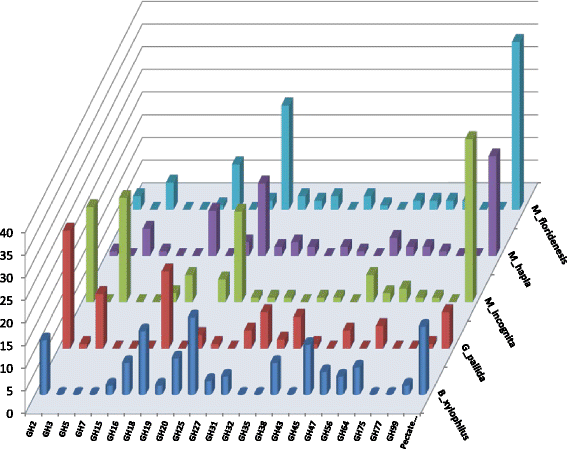
已鉴定的CWDE基因分为24个CAZymes基因家族(表1)2.和无花果。2.)其中23个与糖苷水解酶(GHs)有关,1个与多糖裂解酶(PLs)有关。GHs是负责水解碳水化合物之间或碳水化合物与非碳水化合物部分之间的糖苷键的酶,而PLs主要负责降解果胶和糖胺聚糖[29]. 所有分析的线虫种类都显示了可比较的CAZy基因家族的总数,其中最大的17个是CAZy基因家族M.Incognita.至少15英寸g . pallida(桌子2.). 虽然五种线虫的CAZy基因家族总数具有可比性,但所鉴定的CAZy家族类型不同(表1)2.和无花果。2.).此外,在线虫物种之间存在的每个家族中存在的CWDE基因数量的变化(例如,在五种不同的物种中的GH 27:3,0,1,2和3)。每个家庭的基因分布在物种内部和物种之间,表明植物寄生线虫的可能演变根据其饲养行为。观察到每个家庭的最高平均CWDE基因数量M.Incognita.平均每个家族有7.70个基因,而每个家族的最低基因数为4.88个m .差异(桌子1.).从24个家族(糖苷水解酶和多糖裂解酶)中鉴定出530个CWDEs,根据底物的特异性,进一步分为木质纤维素酶(纤维素分解酶、半纤维素分解酶和木质素分解酶)、果胶酶、几丁质酶和其他酶(表1)2.和无花果。2.).
木质纤维素酶
植物生物量的大部分是由木质纤维材料组成的。木质纤维材料基本上由纤维素、半纤维素和木质素组成。阿魏酸是木质素的一种成分,酯将纤维素和半纤维素多糖与木质素连接起来,形成一种复杂的木质纤维素细胞壁基质[31].纤维素是β-(1,4)葡萄糖单体的聚合物,是植物细胞壁的主要成分[32].每个纤维素合酶亚基都合成单个的葡聚糖链,葡萄糖单位相对于其他单位以180°排列,因此重复的单位是纤维素二糖而不是葡萄糖[32].单个葡聚糖链的葡萄糖单元与相邻单元形成氢键,产生纤维素微纤丝[33]. 纤维素原纤维与其他细胞壁基质聚合物如半纤维素、果胶和木质素有关[34].纤维素是葡萄糖单位的均聚物,而半纤维素是支链多糖、己糖和戊糖单体的杂聚物[35,36]. 半纤维素在高尔基体膜上合成并输出到细胞壁与其他壁多糖整合[37]. 半纤维素由木聚糖、木聚糖、甘露聚糖、葡甘聚糖和混合(β-1,4&1,3)葡聚糖组成[38].半纤维素的组成在双子叶和单子叶之间是不同的,分别分为I型和II型细胞壁[2.]. 双子叶植物的初生细胞壁中含有大量的木聚糖(XGs),而单子叶植物中以(葡萄糖醛酸)阿拉伯木聚糖(GAXs)为主[2.,35,36,38].
纤维素酶是通过破坏纤维素链中的β-1,4键来水解天然纤维素的酶。纤维素水解是通过三种纤维素酶的协同作用实现的:(1)内切葡聚糖酶(酶代码EC3.2.1.4),(2)外切葡聚糖酶(酶代码EC3.2.1.91)和(3)β-葡萄糖苷酶(酶代码EC3.2.1.21)[39]. 在本研究中,具有这类活性的CWDE编码基因主要分布在GH3(β-葡萄糖苷酶)、GH5(β-内切1,4-葡聚糖酶)、GH7(β-内切1,4-葡聚糖酶)和GH45(β-内切1,4-葡聚糖酶)家族(表1)2.和无花果。2.). 在纤维素分解基因家族中,GH5和GH45的基因数量最多。纤维素特异性GH45只在B嗜木菌这也与以前的报告一致[21,25](表2.). GH45纤维素酶家族与真菌基因具有很高的相似性,在其他线虫中没有发现,表明在线虫寄生进化过程中,真菌可能发生水平基因转移[21,25]. 半纤维素酶是另一类重要的酶,可降解细胞壁第二丰富的聚合物,即半纤维素。我们还鉴定了几个与半纤维素比活性相关的基因家族即。GH27 (α-半乳糖苷酶),GH31 (α-葡萄糖苷酶),GH35 (α-半乳糖苷酶),GH38 (α-甘露糖苷酶),GH43 (α-阿拉伯糖苷酶),GH47(外作用α-1,2-甘露糖苷酶),GH99(内作用α-1,2-甘露糖苷酶2.和无花果。2.). 在所分析的五种物种中都存在具有α-葡萄糖苷的GH31、具有α-甘露糖苷酶(II类)的GH38和具有外显作用α-1,2-甘露糖苷酶活性的GH47(图。3.). 一些GH3、GH5和GH45家族酶除具有纤维素活性外,还具有半纤维素酶活性[40,41].有报道称GH5家族对1,4-β链多糖的活性有限[41]. 据报道,GH45家族对松材线虫中的葡甘聚糖具有活性,B嗜木菌[40]. 类似地,具有木聚糖的GH16:木葡萄糖基转移酶也被分类为具有半纤维素活性。
除了纤维素、半纤维素和果胶外,木质素还沉积在某些类型的细胞中,这些细胞合成次生细胞壁。与由糖构成的纤维素和半纤维素不同,木质素是芳香化合物的聚合物。木质素是一种以三种芳香醇为主要原料合成的复合杂多酸即。辛那普利、松柏醇和香豆醇[42,43]. 单信号醇在胞质溶胶中合成并输出到质外体,在质外体中单信号醇的自由基偶联合成杂聚合物[42,43]. 不同单木素醇的比例决定了木质素的性质,也因物种而异,这取决于组织类型、年龄和环境条件[44]. 在本研究中,我们还寻找了编码酶的基因,这些酶可以降解木质素,木质素是细胞壁的一个重要组成部分,使细胞壁不易降解。木质素降解酶的存在使线虫降解富含木质素的次生细胞壁。根据CAZy数据库分类,木质素降解酶属于多铜氧化酶(AA1)家族,属于辅助活性(AA)酶[45]. 有趣的是,我们从松木和马铃薯胞囊线虫这两种线虫中鉴定出木质素降解酶、漆酶(Bux.s00116.660和gplin001134600)和类漆酶(gplin001134500)(附加文件2.:表S2)。根结线虫中木质素降解酶的存在表明了松材线虫中木质素降解酶侵入木质素含量较高的松材细胞壁的特殊需要。总的来说,分析表明,与木质素相比,存在相对大量的酶能够降解纤维素和半纤维素。线虫主要侵染根细胞,根细胞主要由富含纤维素和半纤维素的初生细胞壁组成。在大多数线虫物种中,木质素降解酶的缺失可能是由于其感染的作物根系中相对较少或完全缺乏木质素。提高原细胞壁木质素含量可作为提高作物线虫抗性的一种策略。
果胶酶
除纤维素和半纤维素外,果胶是植物初生细胞壁的主要成分[35,36]. 果胶主要位于中间层,与纤维素和半纤维素有关,在细胞黏附和壁孔隙率中起重要作用[16,35,36]. 与半纤维素类似,果胶多糖在高尔基体中合成为鼠李糖乳糖多糖-I(RG-I)、鼠李糖乳糖多糖II(RG-II)和高半乳糖多糖(HG)[35,36]. 已鉴定的线虫中有很大一部分与果胶裂解酶(PL)活性有关,而PL活性是导致细胞壁另一重要成分果胶降解的原因。在所分析的不同线虫种类中甲碘炔物种表现出较高数量的果胶降解(PL)酶(表2.和无花果。2.) 37 (M成花), 22 (m .差异)和36(M.Incognita.),而8和15被发现在g . pallida和B嗜木菌,分别。不同类型的果胶降解酶的存在(表3.),以及它们在线虫迁移过程中浸渍植物根部的重要性已被广泛报道[24,46–48].
如几丁质酶
几丁质是N-乙酰-β-D-葡萄糖胺的均聚物,在昆虫外骨骼、真菌细胞壁、线虫卵壳和其他生物基质中大量存在,为这些结构提供支撑和增强[49]. 除了木质纤维素和果胶降解酶外,我们还发现85个基因分布在5个已知具有几丁质酶活性的家族中。在这五个家庭中维兹. GH18(几丁质酶)、GH19(几丁质酶)、GH20(β-己糖胺酶)、GH75(β-1,4-壳聚糖酶)和GH77(α-淀粉酶)、GH18和GH20是在所有分析的五个基因组中发现的最丰富的几丁质酶(表2.还有无花果。2.和3.). 在自由生活的线虫中也发现了42个包含几丁质酶和N-乙酰氨基葡萄糖苷酶活性的基因,秀丽隐杆线虫[50].在线虫发育过程中,几丁质酶在卵壳几丁质重构中起着重要作用[51]. 此外,线虫体内几丁质酶的存在可能有助于利用土壤中真菌和昆虫衍生的几丁质聚合物作为额外的营养来源。几丁质酶也可以帮助线虫捕食土壤真菌。据报道,寄生线虫的土壤,菲伦丘斯以土壤中的真菌为食繁殖[52].认为植物寄生线虫种,泰伦希达,是由真菌寄生的线虫进化而来[52]表明这些基因在进化上是保守的。这些酶可能参与了对土壤中食线虫真菌的防御。
其他酶
除了这些酶,我们还鉴定了具有溶菌酶(GH25)和转化酶(GH32)活性的基因家族。转化酶在催化丰富的植物糖、蔗糖转化为单糖葡萄糖和果糖的过程中起着重要作用,植物寄生线虫可以利用转化酶作为碳源[9].总体而言,这些植物寄生线虫中存在的广泛宿主范围和底物特异性CWDEs已被报道在建立宿主-病原体相互作用时发挥重要作用[9,25,53].
辅助活性(AA)酶
辅助活性(AA)酶是与其他碳水化合物活性酶协同工作的氧化还原酶。随着这一领域的最新发现,CAZy数据库增加了13个亚类的AA酶作为一类新的酶,以扩大其应用范围[45]. 对所有五种线虫基因组进行AA类酶的挖掘,发现存在7个编码多铜氧化酶(AA1)的基因,7个编码GMC氧化还原酶(AA3)的基因,植物寄生线虫中存在编码香草醇氧化酶(AA4)的单基因和编码葡萄糖低聚糖氧化酶(AA7)的三个基因(附加文件)2.:表S2)。AA1亚类是一种多铜氧化酶,在木质素降解过程中起着重要作用。有趣的是,从这个亚类中鉴定出7个基因,其中2个被分类为漆酶(EC 1.10.3.2)(Bux.s00116.660和gplin001134600),而另一个被分类为漆酶样酶(EC 1.10.3.2)(gplin001134500)(附加文件2.:表S2)。AA1亚类已被报道存在于真菌基因组中,特别是子囊菌,并发挥多种作用,包括木质素降解和植物致病相互作用[54]. 该分析从所有5种植物寄生线虫中鉴定出7个与AA3亚类[葡萄糖-甲醇-胆碱(GMC)氧化还原酶]相关的基因,表明AA3的重要性这些酶可能起辅助作用(附加文件2.:表S2)。AA3酶是含有黄素腺嘌呤二核苷酸(FAD)结合域的黄素蛋白,据报道在纤维素、半纤维素和木质素的生物降解中起作用[55,56]. AA3亚类在木质纤维素降解真菌中也被报道在纤维素分解培养条件下产生一种细胞外血黄素酶,纤维二糖脱氢酶(ec1.1.99.18)[56]. 除这些亚类外,本研究还鉴定了一个编码香草醇氧化酶(AA4)的基因和三个编码葡萄糖低聚糖氧化酶(AA7)的基因B嗜木菌和g . pallida分别是。AA4亚类对木质素降解过程中产生的中间芳香族化合物具有活性[45]. 类似地,据报道,AA7亚类可氧化不同的碳水化合物,如D-葡萄糖、麦芽糖、乳糖、纤维二糖、麦芽糖和纤维低聚糖,并在木质纤维材料的解毒/生物转化中发挥作用[45,57].除了AA1和AA3亚类外,AA6、AA8和AA9在不同的植物寄生真菌基因组中也有报道[45]表明AA类酶通过辅助细胞壁降解酶建立植物与病原菌的相互作用具有重要作用。
碳水化合物结合模块(CBM)
碳水化合物结合模块(CBMs)是已知的与CWDEs的催化结构域相关联的非催化结构域,并有助于提高催化结构域的活性[58,59]. 根据序列相似性,共有71个CBM家系被列入CAZy数据库[30.]. 据报道,这些CBM显示出配体特异性的变化,并且已经显示出识别各种碳水化合物部分,例如结晶纤维素、非结晶纤维素、几丁质、β-1,3-葡聚糖和β-1,3-1,4-混合连接葡聚糖、木聚糖、甘露聚糖、半乳聚糖和淀粉[58].由于CBM模块在线虫的CWDEs中起着重要的作用,我们对CBM模块的存在进行了全基因组分析,在线虫基因组中鉴定出CBM2、CBM14、CBM20和CBM21四类CBM。在四个模块中,只有两个CBM2和CBM14被发现与CWDEs的GH5和GH18家族相关(附加文件2.:表S3)。共鉴定出18个与cmb亚类相关的基因,其中13个属于cmb亚类M.Incognita.而4和1基因属于g . pallida和M哈普拉,分别。类似地,在CBM14亚类的四个基因中,除了M.Incognita.(附加文件)2.:表S3)。先前已据报道CBMS与植物致病性真菌有关[60]以及植物寄生线虫[61]. CBM蛋白与宿主果胶甲基酯酶(PME)发生相互作用H甘氨酸[27].由于PME被报道参与细胞生长和扩张的调节,因此H甘氨酸CBM被认为在合胞体扩张中起作用[27].
线虫生命周期中CWDE基因的表达谱
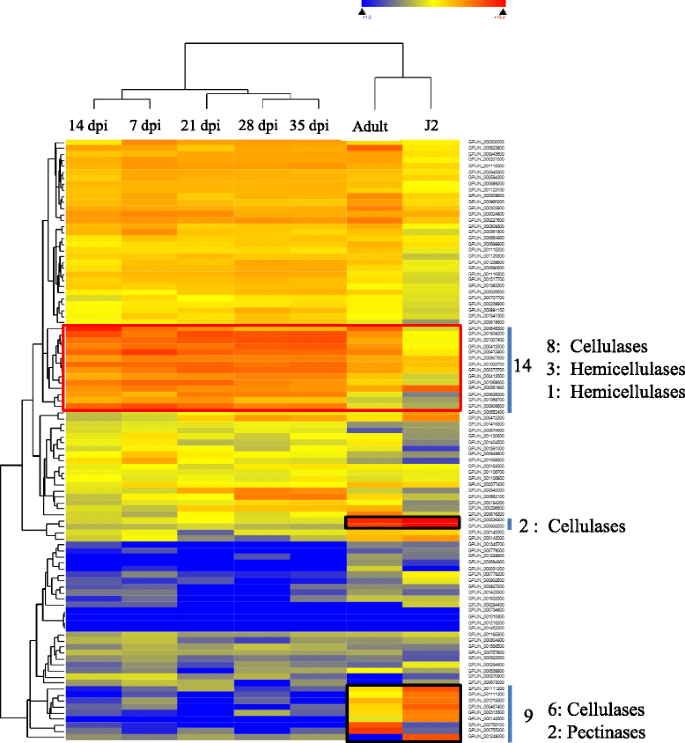
基因组宽表达分析将提供关于在特定阶段表达的基因的信息,或者在整个基因组序列提供有关生物体中存在的基因总数的综合信息。由植物病原导线产生的植物CWDES已经显示出在感染过程中与植物建立寄生关系的重要作用[9,10,25,26,62,63].及时表达这些基因是通过降解细胞壁来建立感染过程的必要条件,以便于进入和建立。内切糖酶HgEng1公司和HgEng2型,和GtEng1和GtEng2分别在大豆孢囊线虫和烟草孢囊线虫根内J2的渗透和细胞内迁移过程中表达[64,65]. 除了转录水平的证据,大豆孢囊线虫蛋白HgENG2已被证明是从线虫的腹下食管腺细胞合成的,并通过免疫定位研究分泌到大豆根组织中[66]. 研究表明,HgENG2在接种24小时后的移行过程中由花柱分泌[66]. 为进一步阐明CWDE基因在植物病原线虫中的作用,对这些CWDE编码基因在植物寄生线虫生命周期不同阶段的表达进行了分析。在公开可用的转录组存储库(SRA:Short-Read Archive dataset)中搜索了线虫生命周期不同阶段的转录组数据。马铃薯孢囊线虫,g . pallida是唯一用于整个生命周期的全面转录组数据的线虫,即侵入性幼虫阶段J2,成年幼术,1,7,14,28和35天发布后感染后(DPI)。下载数据并分析了从中鉴定的100个CWDE基因的表达g . pallida使用(附加文件2.:表S4)。所鉴定的CWDE基因大部分在线虫生命周期的不同阶段都有表达。4.,附加文件2.:表S5)。利用DNASTAR QSeq软件对CWDE基因的表达谱进行欧几里得距离分层聚类分析,可将其聚类为9个主要聚类。除J2阶段外,大多数簇1和簇2基因在生命周期的所有阶段都处于中等高表达的基因中,在J2阶段这些基因有中等表达。聚类3的所有基因都在感染早期到后期的高表达基因中。该聚类的14个基因中,8个与纤维素降解有关,4个与半纤维素降解有关(图1)。4.). 这些基因在感染早期和晚期的高水平表达也受到这种胞囊线虫内寄生取食习性的支持[10].GHs和PLs是细胞壁成分侵入、迁移或溶解细胞壁以形成合胞体所必需的[67]. 细胞壁降解酶在马铃薯胞囊线虫寄生关系中的重要作用已被RNAi敲除g . rostochiensis[68].β-1,4-内切葡聚糖酶的沉默降低了囊肿线虫感染马铃薯根的能力[68]证明了CWDEs在作物成功侵染中的重要性。通过改变细胞壁的组成,使其不易被线虫降解,从而培育出具有抗性的作物是可能的。在其他簇中,簇5和簇6相关基因在整个发育阶段都有中度表达,而簇7、簇8和簇9相关基因大部分被抑制或很少表达。尽管几乎所有的9个基因簇都被抑制,但观察到一组9个基因(6个纤维素酶和2个果胶裂解酶)在J2或生命周期的成体阶段有显著的高表达(图。4.).这些基因在感染性J2期间的具体表达表明,在寄生线虫感染期间,它们可能在植物细胞侵袭中具有重要作用。
线虫细胞壁降解酶数据库
CWDEs的所有可用数据库(CAZy和真菌植物细胞壁降解酶数据库)[11,28]我们有大量关于这些基因的信息,但是关于线虫的CWDEs的信息大多局限于秀丽隐杆线虫. 为了确保收集和方便获取与线虫CWDEs相关的信息,我们构建了一个线虫细胞壁降解酶数据库(NCWDE):一个提供与植物寄生线虫CWDEs相关的综合信息的网络资源(图。5.). 除了在全基因组范围内从五种线虫基因组中鉴定出CWDEs外,我们还搜索了来自不同线虫物种(基因组数据不可用)的单个CWDEs的可用文献,并将其纳入数据库以确保其代表性(表1)3.). 所有与这些数据库有关的信息均可在http://www.pssc.ttu.edu/ncwde/index.html.
线虫在生态、环境、生物燃料和土壤健康中的重要性
虽然植物寄生线虫破坏了各种具有重要经济意义的作物,造成了重大的农业损失,但这些潜在病原体在特定作物土地上的存在可被用作监测和管理土壤生态系统,即土壤健康的生物指标,生态平衡与环境状况[69]. 土壤健康是影响作物生产力的重要因素之一,与该地区的生态环境状况密切相关维兹. 微生物多样性、污染物和重金属[70].有趣的是,植物病原线虫可以通过过度放牧特定的细菌或真菌种群或通过释放限制生长的养分或向土壤传播特定的微生物繁殖体来促进它们,从而调节任何农田的微生物多样性[69,71]. 由此产生的农田微型动物将影响它们的养分循环能力,这是与作物生产力直接相关的因素。最终,分析植物寄生线虫的CWDE谱将提供它们的取食偏好,并有助于评估维持土壤健康所需的营养物质或线虫在土壤中存在的长期影响。线虫CWDE研究的另一个重要成果是发现用于生物产品/生物燃料生产的新酶。存在于植物细胞壁中的生物聚合物,如纤维素和木聚糖,是生产生物燃料,特别是生物乙醇的丰富碳氢化合物来源[12].木质纤维素生物质的顽强行为和所需的水解酶的高成本是成功利用这一丰富的可利用资源的主要障碍。本研究中鉴定的CWDEs显示出广泛的底物特异性(纤维素、半纤维素、木质素、果胶等)。考虑到这些植物病原线虫衍生的CWDEs具有广泛的底物覆盖范围,可以利用它们更有效地降解复杂的植物生物量。线虫的CWDEs是一种新的酶的来源,因为它们的功能在足底与广泛使用的真菌或细菌酶相比。
结论
在本研究中,我们对植物寄生线虫的CWDEs进行了全面的基因组测序分析,并建立了一个数据库来提供有关CWDEs的全面信息。虽然本研究的主要重点是识别编码植物CWDEs的基因,但由于这些基因从细菌和真菌向线虫的水平转移,我们也鉴定了细菌和真菌来源的CWDEs。我们的结果显示,在所有物种中都存在常见的CWDEs,以及一些特定物种的CWDEs。此外,这些基因在包囊线虫的不同阶段存在差异的或普遍存在的表达簇G. Pallida,表明这些酶在线虫的整个生命周期中起着重要的作用。基因组测序物种的数量较少限制了我们目前的研究,但随着未来更多的植物病原线虫基因组测序的可用性,我们将扩展数据库。CWDEs的重要性不仅限于与寄主物种建立寄生关系,而且它们还是新型和潜在更有效的酶的良好来源,用于降解生物燃料/生物产品工业中的顽固性植物细胞壁。此外,NCWDE数据库通过正向和反向遗传方法为线虫中这些酶的功能特性提供信息,最终可用于开发抗线虫作物。
方法
植物病原线虫基因组测序数据检索
公开的完全测序的植物致病性线虫基因组g . pallida来自威康信托桑格研究所(ftp://ftp.sanger.ac.uk/pub/project/pathogens/Globodera/pallida/Gene_Predictions),m . floridensis来自爱丁堡大学Braster实验室的线虫基因组http://nematodes.org/genomes/meloidogyne_floridensis/),其余三种。B嗜木菌(http://www.wormbase.org/species/b_xylophilus#01--10),m .差异(http://www.wormbase.org/species/m_hapla#01--10)以及M.Incognita.(http://www.wormbase.org/species/m_incognita#01--10)从WormBase下载,并通过管道进一步处理,以鉴定编码CWDEs的基因。
生物信息学细胞壁降解酶基因的鉴定
与CWDEs相关的保守结构域的氨基酸序列从CAZy数据库下载(http://www.cazy.org/) [11]并用hmmer v3.1b1包创建HMM配置文件(http://www.ebi.ac.uk/Tools/hmmer/). 利用HMMER软件包的hmmsearch程序对下载的每一个植物病原线虫蛋白质组进行CWDEs的搜索。此外,利用从CAZy数据库下载的蛋白质序列作为查询,通过Blast相似性搜索进一步筛选线虫蛋白质组。从两个分析中独立鉴定的蛋白质序列汇集在一起,检查冗余,并从进一步的分析中去除冗余的蛋白质序列。AA酶的分析是通过下载13个AA酶亚类的代表性蛋白质序列并执行BlastP相似性搜索来完成的。
采矿管道验证
为了验证该鉴定,我们使用NCBI的保守结构域数据库分析了所有非冗余的CWDE相关蛋白序列(GHs、PLs和AAs)是否存在保守结构域(http://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi) [72]和Pfam数据库(http://pfam.xfam.org/) [73]. 任何没有保守结构域或与CWDEs无关的保守结构域的蛋白质序列都被排除在进一步的研究之外。
植物病原线虫共有的CWDE基因家族
对5种植物病原线虫中已鉴定的所有CWDE基因家族进行比较,确定了所有物种中均存在的基因家族。为了使比较可视化,我们使用免费的在线工具(http://bioinformatics.psb.ugent.be/webtools/Venn/).
成绩单丰富的CWDES跨越生命周期的分析g . pallida
可公开获得的转录组数据集(PRJEB2896)涵盖了一种重要的植物病原线虫的整个生命周期(入侵幼虫期J2,成年雄性,感染后1、7、14、28和35天(dpi))G. Pallida,从NCBI的短读档案(SRA)数据库下载(http://www.ncbi.nlm.nih.gov/Traces/study/?acc=ERP001236)(附加文件)2.:表S4)。所有阶段的序列读取存档(SRA)文件都映射到g . pallida使用DNASTAR LasergeNe包装的QSEQ程序编码基因的CWDE(http://www.dnastar.com/t-nextgen-qseq.aspx.).为了可视化转录性丰度,使用QSEQ程序计算的自归一化RPKM(每百万读数)值来生成分层聚类热图。
线虫CWDE数据库的建立
为了确保从植物病原线虫中鉴定出的所有CWDE的可用性,使用Microsoft的expression web 4创建了线虫的细胞壁降解酶数据库,可在http://www.pssc.ttu.edu/ncwde/index.html. 序列数据以fasta格式下载。
缩写
- CWDEs公司:
-
细胞壁降解酶
- 唔:
-
隐马尔可夫模型
- SRA:
-
序列读取存档
- 卡兹:
-
碳水化合物活性酶数据库
- 巨大的:
-
碳水化合物活性酶
- “大酒店”:
-
糖苷水解酶
- 损益:
-
多糖裂解酶
- 燃气轮机:
-
糖基转移酶
- 总工程师:
-
碳水化合物酯酶
- Pfam公司:
-
蛋白质家族
- 客户尽职调查:
-
保守域数据库
- 公里数:
-
每千碱基每百万次读取的读取数
- NCWDE:
-
线虫细胞壁降解酶
- 机管局:
-
辅助活动
工具书类
- 1.
哈里斯PJ,石学士。植物细胞壁的化学和分子结构。在:生物质批量。牛津布莱克威尔出版有限公司;2009: 61–93
- 2.
卡皮塔北卡罗来纳州,吉博特DM。开花植物初生细胞壁的结构模型:分子结构与生长过程中细胞壁物理性质的一致性。植物杂志:细胞和分子生物学。1993;3(1):1–30.
- 3.
吉尔伯特HJ。植物细胞壁解构的生物化学和结构生物学。植物生理学。2010;153(2):444–55.
- 4.
纤维素小体:植物细胞壁降解酶复合物。微生物学杂志。2004;2(7):541-51。
- 5.
布里森LF,腾哈肯R,兰姆C。细胞壁结构蛋白氧化交联在植物抗病中的作用。植物细胞。1994;6(12):1703–12.
- 6.
赫马蒂K,切克C,萨默维尔S。寄主病原菌在植物细胞壁上的战争。植物生物学。2009;12(4):406–13.
- 7.
谢克平,Kazan K,JM,Anderson JP,Simpson RS,Wilson IW,等。拟南芥与油菜链格孢互作不亲和过程中的系统基因表达。植物生理学。2003;132(2):999–1010.
- 8.
奇特伍德DJ。美国农业部农业研究服务处进行的植物寄生线虫生物学研究。害虫管理科学。2003;59(6–7):748–53.
- 9
Abad P,Gouzy J,Aury JM,Castagnone-Sereno P,Danchin Eg,Deleury E等人。Metazoan植物 - 寄生线虫Meloidogyne的基因组序列。NAT BIOTECHNOL。2008; 26(8):909-15。
- 10
Bohlmann H,Sobczak M。胞囊线虫取食部位的植物细胞壁。植物科学的前沿。2014;5:89.
- 11
Lombard V, Golaconda Ramulu H, Drula E, Coutinho PM, Henrissat B. 2013年碳水化合物活性酶数据库(CAZy)。核酸研究2014;42(数据库版):D490-495。
- 12
King BC、Waxman KD、Nenni NV、Walker LP、Bergstrom GC、Gibson DM。植物细胞壁降解酶库反映了植物病原真菌对寄主的偏好。生物燃料的生物技术。2011;4:4.
- 13.
Trudgill DL,Blok VC。无融合生殖、多食性根结线虫:非常成功和有害的生物营养性根病原。植物病理学年鉴。2001;39:53–77.
- 14.
Sobczak M,Golinowski W,Grunder F.通过的饲养塞和饲养管的超微结构异皮线虫属schachtii. 线虫学。1999;1(4):363–74.
- 15.
拟南芥根系中根结线虫二期幼虫的寄生行为。Nematologica。1992;38(1):98 - 111。
- 16.
威佐雷克。线虫感染根的细胞壁改变。在:植物学研究进展。第73卷:学术出版社,圣地亚哥,加利福尼亚州,美国;2015. 61–90.
- 17
从木质纤维素原料通过生化途径生产生物乙醇:综述。能源研究与管理,2011;52(2):858-75。
- 18
Agbor VB、Cicek N、Sparling R、Berlin A、Levin DB。生物质预处理:应用基础。生物技术咨询,2011年;29(6):675–85.
- 19
迪克森·拉。微生物学:拆墙。自然。2013;493(7430):36–7.
- 20
Smant G,Stokkermans JP,Yan Y,de Boer JM,Baum TJ,Wang X等.动物内源性纤维素酶:从两种植物寄生胞囊线虫中分离β-1,4-内葡聚糖酶基因。美国国家科学院学报。1998;95(9):4906–11.
- 21
菊池T、琼斯JT、爱川T、小坂H、大仓N。松材线虫糖基水解酶家族45纤维素酶。费布斯莱特。2004;572(1–3):201–5.
- 22
海格曼A、雅各布J、凡霍姆B、肯特T、盖森G。迁移植物寄生线虫Radopholus similis中的一个GHF5内切-1,4-β-葡聚糖酶家族。植物病理学。2008;57(3):581–90.
- 23
Davis E,Hussey RS,Baum T。寄生基因:它们揭示了什么是寄生。作者:Berg RH,Taylor C,编辑。植物线虫寄生的细胞生物学,第15卷。柏林海德堡:施普林格;2009年。15–44.
- 24
作者:boeijus H, Overmars H, Jones J, Blok V, Goverse A, Helder J,等。线虫对植物细胞壁的降解大自然。2000;406(6791):36-7。
- 25.
Kikuchi T、Cotton JA、Dalzell JJ、Hasegawa K、Kanzaki N、McVeigh P等。新兴植物病原菌松材线虫寄生起源的基因组学研究。公共科学图书馆。2011;7(9):e1002219。
- 26.
Cotton JA、Lilley CJ、Jones LM、Kikuchi T、Reid AJ、Thorpe P等。苍白球绦虫的基因组和生命阶段特异性转录组阐明了胞囊线虫寄生植物的关键方面。基因组生物学。2014;15(3):R43。
- 27.
等。寄生线虫纤维素结合蛋白与拟南芥果胶甲基酯酶的相互作用:寄生期间细胞壁的协同修饰。植物细胞在线。2008;20(11):3080-93。
- 28.
崔杰,金杰,全杰,李一赫。真菌植物细胞壁降解酶数据库:真菌和卵菌比较和进化基因组学的平台。BMC基因组学。2013;14补遗5:S7。
- 29
赵Z,刘H,王C,许JR.纠正:真菌基因组的比较分析揭示了真菌不同的植物细胞壁降解能力。BMC基因组学。2014;15:6.
- 30.
Cantarel BL、Coutinho PM、Rancurel C、Bernard T、Lombard V、Henrissat B。碳水化合物活性酶数据库:糖基因组学的专家资源。核酸研究,2009年;37(数据库问题):D233–238。
- 31。
Harris P,Trethewey JK。酯键阿魏酸在被子植物细胞壁中的分布。植物化学版次。2010;9(1):19–33.
- 32
Somerville C.高等植物中的纤维素合成。Annu Rev Cell Dev Biol。2006; 22(1):53-78。
- 33
德尔默DP。纤维素生物合成:艰难研究领域的激动时刻。一年生植物生理学植物分子生物学。1999;50(1):245–76.
- 34
科斯格罗夫DJ。植物细胞壁的生长。Nat Rev Mol细胞生物学。2005;6(11):850–61.
- 35
奥乔亚·比利亚雷亚尔M、艾斯普鲁·埃尔南德斯E、巴尔加斯·阿里斯普鲁一世、马丁内斯·泰莱兹·马(2012). 植物细胞壁聚合物:其衍生物的功能、结构和生物活性,聚合,Ailton De Souza Gomes博士(编辑),第4章,63-86,克罗地亚因特赫。内政部:10.5772/46094.
- 36
伯顿RA,吉德利MJ,芬奇GB。植物细胞壁化学、结构和功能的异质性。自然化学生物。2010;6(10):724–32.
- 37.
卡皮塔NC,麦肯MC。玉米混合连锁(1 → 3), (1 → 4) -β-d-葡聚糖多糖在高尔基体膜上合成。植物生理学。2010;153(3):1362–71.
- 38.
舍勒HV,乌尔夫斯科夫P。半纤维素。植物生物学年鉴。2010;61(1):263–89.
- 39.
关键词:纤维素酶,胞外酶,水解,晶体度。1993;114(2):230 - 5。
- 40
涩谷,菊池。松材线虫重组内切葡聚糖酶的纯化及性质研究。生物技术生物化学。2008;72(5):1325–32.
- 41
Gao B,Allen R,Davis EL,Baum TJ,Hussey RS.大豆胞囊线虫胞囊结合蛋白基因的分子特征和发育表达。国际寄生虫学杂志。2004;34(12):1377–83.
- 42。
Boerjan W、Ralph J、Baucher M。木质素生物合成。植物生物学年鉴。2003;54(1):519–46.
- 43。
木质素生物合成的遗传:基因型与表型的连接。2010;44(1): 337-63。
- 44。
Mann DJ, Labbé N, Sykes R, Gracom K, Kline L, Swamidoss I等。柳枝稷木质素含量及结构的快速评价在不同的环境条件下生长。Bioenerg杂志2009;2(4):246 - 56。
- 45
Levasseur A, Drula E, Lombard V, Coutinho PM, Henrissat B. CAZy数据库的酶库扩展,以整合辅助氧化还原酶。Biotechnol生物燃料。2013;6(1):41。
- 46
Doyle EA,兰伯特KN。爪哇根结线虫食管腺特异性果胶裂解酶的克隆与鉴定。植物与微生物相互作用。2002;15(6):549–56.
- 47
Kudla U,Milac A-L,Qin L,Overmars H,Roze E,Holterman M,et al.马铃薯孢囊线虫Globodera rostochiensis一种新的、与寄主渗透相关的果胶裂解酶的结构和功能表征。植物病理学。2007;8(3):293–305.
- 48
Vanholme B、Van Thuyne W、vanhoutegem K、De Meutter JAN、Cannoot B、Gheysen G。沙赫提异孢囊线虫分泌果胶裂解酶的分子特征及其功能意义。植物病理学。2007;8(3):267–78.
- 49.
Funkhouser JD,Aronson Jr NN。几丁质酶家族GH18:从一个不同蛋白质家族的基因组历史中的进化观点。BMC进化生物学。2007;7:96.
- 50
Popovici C、Roubin R、Coulier F、Pontarotti P、Birnbaum D。秀丽隐杆线虫酪氨酸激酶受体家族:与哺乳动物受体的异同。基因组研究,1999年;9(11):1026–39.
- 51
Tachu B、Pillai S、Lucius R、Pogonka T。几丁质酶在卵黄棘球绦虫丝虫发育中的重要作用。感染免疫。2008;76(1):221–8.
- 52
冈田、原田、卡多塔一世。六个线虫分离物的取食习性。土壤生物化学。2005;37(6):1113–20.
- 53
Jones J,Furlanetto C,菊池T。细菌和真菌的水平基因转移是植物寄生线虫进化的驱动力。线虫学。2005;7(5):641–6.
- 54。
LevaSseur A,Saloheimo M,Navarro D,Andberg M,Pontarotti P,Kruus K,等。从Ascomycete Trichoderma Reesei探索漆酶样多球氧化酶基因:功能性,系统发育和进化研究。BMC Biochem。2010; 11:32。
- 55。
克莱默,伍德总理。黄孢原毛平革菌纤维素二糖氧化酶作为芬顿试剂的来源。生物化学学报,1992;
- 56。
Zamocky M、Ludwig R、Peterbauer C、Hallberg BM、Divne C、Nichols P等。纤维二糖脱氢酶——一种来自木材降解、植物病原和腐生真菌的黄细胞色素。当前蛋白质Pept Sci。2006;7(3):255–80.
- 57
Fan Z、Oguntimein GB、Reilly PJ。狭窄吖啶葡寡糖氧化酶的动力学和热稳定性表征。生物技术生物工程。2000;68(2):231–7.
- 58
博拉斯顿·阿利斯代尔B、博拉姆·大卫N、吉尔伯特·哈里J、戴维斯·吉迪恩J。碳水化合物结合模块:微调多糖识别。生物化学杂志。2004;382(第3部分):769–81。
- 59
Gilbert HJ,Knox JP,Boraston AB.碳水化合物结合模块识别植物细胞壁多糖的分子基础研究进展。货币结构生物学。2013;23(5):669–77.
- 60
库比切克CP、斯塔尔TL、格拉斯NL。植物病原真菌细胞壁降解酶及其分泌。植物病理学年鉴。2014;52(1):427–51.
- 61
Thorpe P、Mantelin S、Cock P、Blok V、Coke M、Eves van den Akker S等。马铃薯孢囊线虫pallida球囊线虫效应互补体的基因组特征。BMC基因组学。2014;15(1):923.
- 62
关键词:线虫,植物,细胞壁,降解见于:Jones J, Gheysen G, Fenoll C, editors。植物-线虫相互作用的基因组学和分子遗传学研究。荷兰:施普林格;2011.p . 255 - 72。
- 63
Klink V, Hosseini P, Matsye P, Alkharouf N,马修斯b基因表达差异振幅躺在守恒的转录组程序之间发生迅速而有效的抗局部反应的合胞体大豆基因型相比北京(π548402)的长期和强有力的抵抗反应π88788。中国生物医学工程学报,2011;
- 64
de Boer JM,Yan Y,Wang X,Smant G,Hussey RS,Davis EL,et al.分泌型β-1,4-内葡聚糖酶在大豆胞囊线虫腹下食管腺中的发育表达。分子-植物-微生物相互作用:MPMI。1999;12(8):663–9.
- 65
Goellner M、Smant G、De Boer JM、Baum TJ、Davis EL。烟粉虱β-1,4-内切葡聚糖酶基因的分离及其在寄生过程中的表达。线虫杂志。2000;32(2):154–65.
- 66。
Wang X,Meyers D,Yan Y,Baum T,Smant G,Hussey R,et al.大豆异胞菌分泌的β-1,4-内葡聚糖酶的植物定位。分子-植物-微生物相互作用:MPMI。1999;12(1):64–7.
- 67。
昆汀M,阿巴德P,法弗利B。植物寄生线虫效应器以寄主防御和核功能为目标,建立取食细胞。植物科学的前沿。2013;4:53.
- 68。
陈Q,瑞曼S,斯曼特G,琼斯JT。利用RNAi技术对马铃薯孢囊线虫致病蛋白的功能分析。分子-植物-微生物相互作用:MPMI。2005;18(7):621–5.
- 69
Ingham RE,Trofymow JA,Ingham ER,科尔曼特区。细菌、真菌及其食线虫者的相互作用:对养分循环和植物生长的影响。Ecol Monogr公司。1985;55(1):119–40.
- 70
王克海,麦克索利R:土壤生态系统管理对线虫害虫、养分循环和植物健康的影响。APSnet功能2005: doi:10.1094/APSnetFeatures/2005-0105.
- 71
雀斑人。食菌线虫与有机物分解。农业生态环境。1988;24(1–3):195–217.
- 72
Marchler-Bauer A, Lu S, Anderson JB, Chitsaz F, Derbyshire MK, DeWeese-Scott C等。CDD:一个用于蛋白质功能注释的保守域数据库。核酸研究2011;39(数据库版):D225-229。
- 73
关键词:碳源,碳源,碳源,碳源pam:蛋白家族数据库。核酸研究2014;42(数据库版):D222-230。
- 74
基恩特,海格曼A,盖森G。植物寄生线虫GHF5内切葡聚糖酶基因结构的进化:没有早期结构域洗牌事件的证据。BMC进化生物学。2008;8:305.
- 75
严Y,Smant G,Stokkermans J,Qin L,Helder J,Baum T,等.植物寄生胞囊线虫中4个β-1,4-内切葡聚糖酶基因的基因组结构及其进化意义。基因。1998;220(1–2):61–70.
- 76
Yan Y、Smant G、Davis E。功能性筛选产生一个新的β-1,4-内葡聚糖酶基因,该基因可能是最近基因复制的产物。植物与微生物相互作用。2001;14(1):63–71.
- 77
Gao B,Allen R,Maier T,Davis EL,Baum TJ,Hussey RS.一个新的ss-1,4-内切葡聚糖酶基因在甘氨酸异胞菌食管腹下腺细胞中表达的鉴定。线虫杂志。2002;34(1):12–5.
- 78。
Gao B,Allen R,Maier T,McDermott JP,Davis EL,Baum TJ,等。大豆异胞菌几丁质酶基因的特征和发育表达。国际寄生虫学杂志。2002;32(10):1293–300.
- 79。
De Meutter J、Vanholme B、Bauw G、Tytgat T、Gheysen G、Gheysen G。植物寄生线虫异口线虫咽腺分泌蛋白的制备及序列测定。植物病理学。2001;2(5):297–301.
- 80
Goellner M、Wang X、Davis EL。内切-β-1,4-葡聚糖酶在植物-线虫亲和互作中的表达。植物细胞。2001;13(10):2241–55.
- 81
Rehman S,Butterbach P,Popeijus H,Overmars H,Davis EL,Jones JT,et al.冠尾石斛花柱分泌物中最丰富纤维素酶的鉴定和特性。植物病理学。2009;99(2):194–202.
- 82
Rosso M-N,Favery B,Piotte C,Arthaud L,De Boer JM,Hussey RS,et al.南方根结线虫β-1,4-内切葡聚糖酶cDNA的分离及其在植物寄生过程中的表达分析。植物与微生物相互作用。1999;12(7):585–91.
- 83
Ledger TN、Jaubert S、Bosselut N、Abad P、Rosso M-N。南方根结线虫β-1,4-内葡聚糖酶基因的鉴定及植物线虫5族糖基水解酶的进化方案。基因。2006;382:121–8.
- 84
上原诚司、草田诚司、桃田诚司。利用PCR技术从根腐线虫中克隆两种Ξ-1,4-内葡聚糖酶;线虫学。2001;3(4):335–41.
- 85
吴本MJ,甘吉S,卡拉汉FE。肾形圆线虫β-1,4-内葡聚糖酶基因(Rr-eng-1)的鉴定及分子生物学特性研究。线虫杂志。2010;42(4):342–51.
- 86
Mitreva Dautova M,Roze E,Overmars H,de Graaff L,Schots A,Helder J,et al.植物寄生线虫南方根结线虫的一种与共生体无关的内切-1,4-β-木聚糖酶。植物与微生物相互作用。2006;19(5):521–9.
- 87
海格曼A,凡霍姆B,盖森G。迁移植物寄生线虫Radopholus similis中一种推测的内切木聚糖酶的特性。植物病理学。2009;10(3):389–401.
- 88
菊池T、涩谷H、爱川T、琼斯JT。松材线虫食管腺果胶裂解酶基因的克隆与鉴定。植物与微生物相互作用。2006;19(3):280–7.
- 89
De Boer JM、Davis EL、Hussey RS、Popeijus H、Smant G、Baum TJ。一个推测的果胶酸裂解酶基因的克隆,该基因在甘氨酸异胞菌的腹下食管腺中表达。线虫杂志。2002;34(1):9–11.
- 90
黄庚,董汝,艾伦R,戴维斯EL,鲍姆TJ,胡赛RS.两个南方根结线虫果胶裂解酶基因的发育表达和分子分析。国际寄生虫学杂志。2005;35(6):685–92.
- 91
Jaubert S、Laffaire J-B、Abad P、Rosso M-N。从南方根结线虫中分离的一种动物源性多聚半乳糖醛酸酶。费布斯莱特。2002;522(1–3):109–12.
确认
这项工作得到了德克萨斯理工大学和UDA-FAS的支持。
作者信息
从属关系
通讯作者
附加信息
竞合利益
提交人声明他们没有竞争利益。
作者的贡献
KMR进行了基因组广泛分析,数据解释,构建了网页并起草了手稿。VKB,CW,MP和MH写了稿件。VM构思了该研究,进行了数据分析并起草了手稿。所有作者阅读并认可的终稿。
其他文件
附加文件1:表S1。
已鉴定的CWDE编码基因的列表,这些基因分布到各自的基因家族中(XLSX(14 kb)
附加文件2:表S2。
植物病原线虫中辅助活性(AA)酶的详细信息。表S3各种细胞壁降解酶中确定的碳水化合物结合模块(CBM)的物种细节。表S4下载的SRA文件源的详细信息,这些文件来自g . pallida用于表达式分析。表S5生命周期不同阶段转录组数据映射的细节g . pallida. (DOCX(33 kb)
权利和权限
开放获取本文是基于知识共享署名4.0国际许可,允许使用、共享、适应、分布和繁殖在任何媒介或格式,只要你给予适当的信贷原始作者(年代)和来源,提供一个链接到创作共用许可证,并指出如果变化。
本文中的图像或其他第三方材料包含在文章的知识共享许可证中,除非在材料的信用额度中另有说明。如果材料未包含在文章的知识共享许可证中,并且您的预期用途不受法律法规的允许或超出允许的用途,您将需要直接获得版权持有人的许可。
要查看此许可证的副本,请访问https://creativecommons.org/licenses/by/4.0/.
知识共享公共领域放弃(https://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非信用额度中另有规定。
关于这篇文章
引用本文
Rai,K.M.,Balasubramanian,V.K.,Welker,C.M。等。植物寄生线虫细胞壁降解酶全基因组综合分析及网络资源开发。BMC植物杂志15,187(2015)。https://doi.org/10.1186/s12870-015-0576-4
已收到:
认可的:
出版:
关键词
- 细胞壁
- 细胞壁降解酶
- 纤维素
- 细胞壁降解酶
- 数据库
- 线虫
- 植物寄生
- 果胶酶