- 研究文章gydF4y2Ba
- 开放访问gydF4y2Ba
- 发表:gydF4y2Ba
R2R3-MYB转录因子的DSRNA沉默影响了一个花细胞形状gydF4y2Ba芽筋gydF4y2Ba杂交种gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba15.gydF4y2Ba文章编号:gydF4y2Ba194gydF4y2Ba(gydF4y2Ba2015年gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
的gydF4y2BaR2R3gydF4y2Ba-gydF4y2BamygydF4y2Ba基因调控花的色素沉着和形态发生,包括花的形状和细胞的形状,因此在兰花新品种的开发中具有重要意义。然而,由于兰花的繁殖时间较长,新品种的开发受到限制。在这项研究中,我们鉴定了一种cDNA,gydF4y2BaDhMYB1gydF4y2Ba,在杂交兰花的花发育期间表达,gydF4y2Ba石斛兰矮牵牛gydF4y2Ba(gydF4y2Ba芽筋gydF4y2BaBobby Messina X.gydF4y2Ba芽筋gydF4y2Ba然后直接应用dsRNA观察基因沉默对花表型和花表皮细胞形态的影响。gydF4y2Ba
结果gydF4y2Ba
花蕾开发gydF4y2Ba芽筋gydF4y2Ba杂交分为七个阶段,减数分裂的时间确定在第3至5阶段,此时芽约为成熟大小的一半。花被近轴表皮细胞的扫描电镜特征表明,花瓣和萼片根据细胞的形状和大小分别分为两个不同的结构域,唇瓣由7个结构域组成。32个部分cDNA片段代表gydF4y2BaR2R3-MYBgydF4y2Ba基因序列分离得到gydF4y2BaD.矮牵牛gydF4y2Ba.系统发育分析表明,其中9条翻译序列与已知参与细胞形态发育的MYB序列聚类,从中选择DhMYB1进行全长cDNA克隆和功能研究。直接应用3′区430bp的dsRNAgydF4y2BaDhMYB1gydF4y2Ba向新兴兰花花芽减少表达gydF4y2BaDhMYB1gydF4y2Ba与未处理的对照组相比。用扫描电镜观察了花唇状结构域内的近轴表皮细胞gydF4y2BaDhMYB1gydF4y2BadsRNA显示表皮细胞呈扁平状,而对照花表皮细胞呈圆锥形。gydF4y2Ba
结论gydF4y2Ba
DhMYB1gydF4y2Ba整个花芽发育表达和参与的表皮细胞的锥形细胞形态的发展gydF4y2Ba芽筋gydF4y2Ba矮牵牛花的唇瓣。dsRNA的直接应用改变花的细胞的表型,因此,该技术可能在花卉栽培生物技术应用。gydF4y2Ba
背景gydF4y2Ba
兰花gydF4y2Ba那gydF4y2Ba属于家庭gydF4y2Ba兰科,gydF4y2Ba开花植物中最大和进化最彻底的家族之一[gydF4y2Ba1gydF4y2Ba]全年拥有各种各样的迷人的形状和颜色,长的开花生命和可用性。这有助于兰花行业在马来西亚,新加坡,泰国,中国,荷兰,夏威夷和美国大陆的经济重要性[gydF4y2Ba2gydF4y2Ba],但为了满足消费者的需求,不断新颖的花卉颜色和形状是园艺行业所期望和非常渴望的。然而,不同颜色和形状的兰花新品种的发展受到繁殖时间长的限制(通常每一代需要三到四年)。鉴于这些限制,需要开发时间和成本有效的方法来操纵兰花的颜色和形状。gydF4y2Ba
决定花颜色的因素包括次生代谢物、pH值、金属离子、类黄酮辅助色素、环境温度和表皮细胞的形态[gydF4y2Ba3.gydF4y2Ba那gydF4y2Ba4.gydF4y2Ba].在本研究中,我们主要研究表皮细胞的形态。表皮细胞是生物和非生物环境的第一个接触点。几种类型的花表皮细胞的形状已被描述,例如,圆锥形,平或尖[gydF4y2Ba5.gydF4y2Ba-gydF4y2Ba9.gydF4y2Ba].细胞形状和花的形状一起影响植物表面的温度和光捕获,从而影响花的颜色[gydF4y2Ba6.gydF4y2Ba那gydF4y2Ba7.gydF4y2Ba那gydF4y2Ba10.gydF4y2Ba].例如,已经提出,通过增加进入表皮细胞的入射光的量来增强颜料的锥形细胞形状可以通过颜料增强光吸收[gydF4y2Ba10.gydF4y2Ba-gydF4y2Ba12.gydF4y2Ba].gydF4y2Ba
植物生理学(包括细胞形状)是遗传控制的。MYB转录因子调节植物发育和次生新陈代谢,光和激素信号,细胞形态发生和防御和应力响应[gydF4y2Ba13.gydF4y2Ba那gydF4y2Ba14.gydF4y2Ba].大多数植物MYB转录因子属于R2R3亚家族(也称为2R-MYB) [gydF4y2Ba15.gydF4y2Ba],类似于动物c-MYB蛋白的R2和R3重复序列[gydF4y2Ba16.gydF4y2Ba-gydF4y2Ba18.gydF4y2Ba].R2R3 MYB亚家族成员有一个MYB结构域,该结构域由两个不完全重复的约50-53个氨基酸组成。每个重复具有三个间隔有规律的色氨酸残基,编码三个α-螺旋和第二个和第三个螺旋,形成螺旋- turn - helix构象结合到目标DNA [gydF4y2Ba17.gydF4y2Ba-gydF4y2Ba20.gydF4y2Ba].然而,在某些例外情况下,一个苯丙氨酸残基取代了R3重复序列中的第一个色氨酸[gydF4y2Ba17.gydF4y2Ba].根据保守的氨基酸存在于羧基的MYB结构域的序列基序的AtMYB R2R3-MYB型转录因子已被分类为子群23 [gydF4y2Ba14.gydF4y2Ba那gydF4y2Ba17.gydF4y2Ba].在这项研究中,我们关注的是由基因代表的亚组9,gydF4y2Baammixta.gydF4y2Ba那gydF4y2BaAtMYB16gydF4y2Ba和gydF4y2BaPHMYB1.gydF4y2Ba据报道,控制细胞分化gydF4y2Ba金鱼草majusgydF4y2Ba那gydF4y2Ba拟南芥gydF4y2Ba和gydF4y2Ba矮牵牛织布达gydF4y2Ba分别激活花青素生物合成基因表达[gydF4y2Ba5.gydF4y2Ba那gydF4y2Ba12.gydF4y2Ba].R2R3 MYB亚群9的几个成员进一步与细胞形状发育有关,包括:gydF4y2BaAmMYBML1gydF4y2Ba-诱导花组织中毛状体和圆锥形细胞的产生[gydF4y2Ba21.gydF4y2Ba];AmMYBML2促进锥形花瓣表皮细胞生长[gydF4y2Ba12.gydF4y2Ba];AmMYBML3促进所有气生器官表皮细胞生长[gydF4y2Ba18.gydF4y2Ba]和的MIXTA相关R2R3 MYB基因gydF4y2Bathalictrum thalictroides.gydF4y2Ba促进花瓣和心皮表皮细胞的锥形细胞生长[gydF4y2Ba22.gydF4y2Ba].gydF4y2Ba
使用植物中的基因沉默(RNAi)在许多成功的例子中,已经使用了许多方法来改善花卉质量和数量[gydF4y2Ba23.gydF4y2Ba].尽管RNAi的修饰已被广泛应用gydF4y2Ba通过gydF4y2Ba转基因[gydF4y2Ba23.gydF4y2Ba]和基于病毒的(VIGS)方法[gydF4y2Ba9.gydF4y2Ba],农药过滤[gydF4y2Ba24.gydF4y2Ba]和直接机械接种双链rna [gydF4y2Ba25.gydF4y2Ba那gydF4y2Ba26.gydF4y2Ba],也成功地诱导基因沉默。与植物转化相比,DSRNA的直接应用是具有相对快速和低成本的方法,因此,在此选择这种方法,以研究沉默在兰花花开发过程中沉默MYB转录因子的效果。本研究的目的首先是描述花卉发育和表皮细胞形状和图案gydF4y2BaD.矮牵牛gydF4y2Ba,鉴定涉及细胞形状发育的MyB基因序列gydF4y2BaD.矮牵牛gydF4y2Ba第三,开发了一种简单、快速的兰花细胞形状修饰方法gydF4y2BaD.矮牵牛gydF4y2Ba作为学习模式。我们首先描述了花芽的发育gydF4y2Ba芽筋gydF4y2Ba杂交七个阶段,然后用扫描电镜确定花被近轴表皮细胞模式。分离得到部分R2R3-MYB基因序列gydF4y2BaD.矮牵牛gydF4y2Ba并且用于系统发育分析,以鉴定那些与已知参与细胞形状发育的MYB序列聚集的那些。直接施用DSRNA从选定的花卉特异性cDNA的3'区域到显影兰花花芽导致的花表格细胞形状改变。本报告证明使用DSRNA直接应用的简单方法研究转录因子在兰花中花发育调节的作用。gydF4y2Ba
结果gydF4y2Ba
分离和系统发育分析gydF4y2BaR2R3 MYB.gydF4y2Ba序列从gydF4y2BaD.矮牵牛gydF4y2Ba
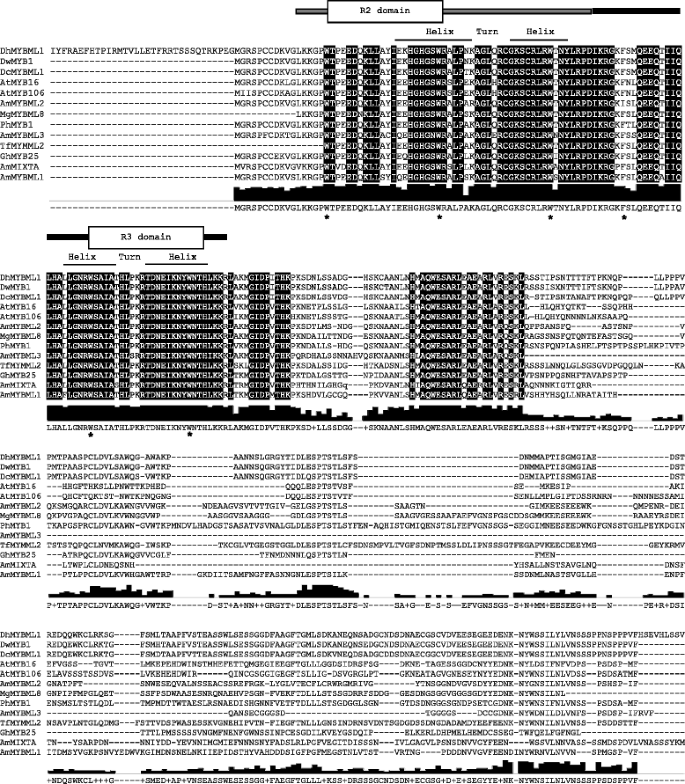
扩增出32个部分序列(~ 300bp)gydF4y2BaD.矮牵牛gydF4y2Ba用简并引物MYB鉴定基于保守氨基酸的存在和两个50氨基酸重复不完善区域[属于R2R3-MYB基因家族gydF4y2Ba27.gydF4y2Ba(图。gydF4y2Ba1gydF4y2Ba).R2重复序列有三个间隔规律的色氨酸残基,R3重复序列包括两个色氨酸和一个苯丙氨酸残基(如图中的箭头所示)。gydF4y2Ba1gydF4y2Ba斯特拉克所描述的gydF4y2Ba等等。gydF4y2Ba[gydF4y2Ba17.gydF4y2Ba].R2和R3结构域共同编码三个α螺旋,第二个和第三个螺旋形成一个螺旋- turn - helix DNA结合结构域。gydF4y2Ba
从32推定的氨基酸序列的比对gydF4y2BaD.矮牵牛gydF4y2BaR2R3-MYB克隆。对准用DWMYB1:Dendrobium sp。XMW-2002-1 MYB 1 [GENBANK:AAO49410]。比对上方的杆表示R2和R3结构域,分别在灰色和黑色中下划线。大多数共识序列被突出显示,并且每个氨基酸的共识显示在比赛下方。R2R3域的区域gydF4y2BaD.矮牵牛gydF4y2Ba序列根据DwMYB1定义:gydF4y2Ba石斛属gydF4y2Ba.XMW-2002-1 MYB 1 [GENBANK:AO49410]。箭头表明R2重复的保守定期间隔的三种色氨酸残留物和R3重复的两种色氨酸和苯丙氨酸残基gydF4y2Ba
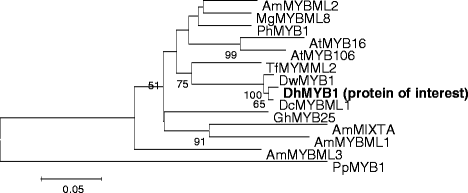
32分算率R2R3-MYB翻译氨基酸序列的系统发育分析gydF4y2BaD.矮牵牛gydF4y2Ba与来自其他植物的MYB蛋白形成22个亚群gydF4y2BaD.矮牵牛gydF4y2Ba分成六个子组。gydF4y2BaIE。,gydF4y2Ba子组1,4,9,10,11和14(附加文件gydF4y2Ba1gydF4y2Ba).随后,全长cDNA(gydF4y2BaDhMYB1gydF4y2Ba)被放大gydF4y2BaD.矮牵牛gydF4y2Ba利用部分R2R3 MYB序列(与AmMIXTA单系)和翻译的全长序列(用于系统发育分析),将其与DwMYB1和DcMYBML1组合在一起,而其姐妹组包含AmMIXTA和AmMYBML1(图2)。gydF4y2Ba2gydF4y2Ba).全长cDNA序列分析表明gydF4y2BaDhMYB1gydF4y2BacDNA的共享97%的同一性与gydF4y2Ba芽筋gydF4y2Basp. xmw -2002- MYB1 (gydF4y2BaDwMYB1gydF4y2Ba) mRNA、完整cds和73%的同源性gydF4y2Ba石斛蜡染gydF4y2BaMYBML1 mRNA,完整的cd。DhMYB1与9亚群中其他MYB序列的氨基酸比对显示,其n端R2R3结构域(氨基酸43 ~ 167)序列高度相似,如图所示。gydF4y2Ba3.gydF4y2Ba.在N-末端的R2R3结构域和基序AQWESARxxAExRLxRES的存在范围内,在亚组9那些MYBS一起翻译的全长序列DhMYB1的对准,表现出较高的序列相似性,以前由Stracke描述gydF4y2Ba等等。gydF4y2Ba[gydF4y2Ba17.gydF4y2Ba]在C终端域内。gydF4y2Ba
9亚群DhMYB1和R2R3-MYB蛋白氨基酸序列的系统发育关系所有氨基酸序列均为全长编码序列。AmMYBML1 [GenBank: CAA55725.1]、AmMYBML2 [GenBank: AAV70655]和AmMYBML3 [GenBank: AAU13905]来自中国gydF4y2Ba金鱼草majusgydF4y2Ba;AtMYB16 [GenBank: AED92146.1] and AtMYB106 [GenBank: AEE73615.1] fromgydF4y2Ba拟南芥gydF4y2Ba;PhMYB1 [GenBank登录号:CAA78386.1]从gydF4y2Ba矮牵牛织布达gydF4y2Ba;DcMYBML1 [GenBank: add645001] fromgydF4y2Ba石斛蜡染gydF4y2Ba, DwMYB1 [GenBank: AAO49410.1] fromgydF4y2Ba石斛属gydF4y2Ba;TFMYMML2 [GENBANK:ACT78694]来自gydF4y2BaThalictrum filamentosumgydF4y2Ba;mgmybml8 [Genbank:Adv29952.1]来自gydF4y2Ba沟酸浆属鱯弹出变IM62gydF4y2Ba;Dhmyb1来自gydF4y2Ba石斛杂交gydF4y2Ba[Genbank:JX846911]。引导值在分支的节点处指示(省略50%的值)。MYB 1来自gydF4y2Ba松果体松树gydF4y2Ba,PpMYB1 [GenBank登录号:ACA33839]作为外类群到根的树。比例尺代表每个站点0.05换人gydF4y2Ba
成长和发展gydF4y2BaD.矮牵牛gydF4y2Ba花蕾gydF4y2Ba
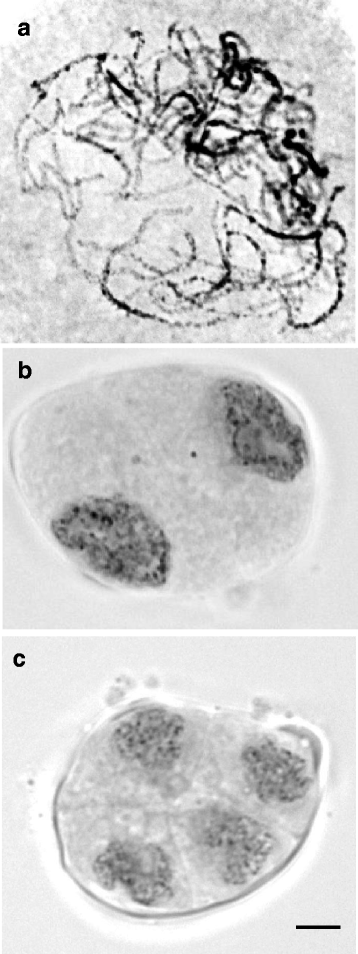
来自的花卉芽gydF4y2BaD.矮牵牛gydF4y2Ba根据物理特性,特别是图中所示的大小,将其分为从萌发芽到成熟芽的七个发育阶段。gydF4y2Ba4.gydF4y2Ba.gydF4y2BaD.矮牵牛gydF4y2Ba出芽通常需要6天才能长到5毫米;11天长到10毫米;15天长至15毫米,19天长至20毫米;22天,长度达到25毫米;25天,长度达到30毫米;29天,长度达到35毫米;花瓣和萼片展开需要30天,开花需要32天。对不同大小的花蕾的授粉进行了减数分裂阶段的研究。第1期和第2期花芽显示减数分裂前核,减数分裂前期在合子期/粗线期早期(图)。gydF4y2Ba5AgydF4y2Ba)在16毫米的芽(第4阶段)和糖尿病和三十岁的芽(图。gydF4y2Ba5 b和cgydF4y2Ba因此,我们假设减数分裂开始于花芽期3,发生于花芽期4 - 5(图5)。gydF4y2Ba4.gydF4y2Ba),并正常进行。gydF4y2Ba
花芽发育阶段gydF4y2BaD.矮牵牛gydF4y2Ba.第1阶段(0-5毫米),具有浅绿色表面的未成熟花蕾;第2阶段(6-10毫米),小尺寸芽,浅绿色表面;第3阶段(11-15毫米),中小小型芽,绿色相对型表面和ZHIENAIAL STAFE转灯紫色;第4阶段(16-20毫米),中等大小芽,具有平坦表面的浅紫色;第5阶段(21-25毫米),中大芽,绿色曲线表面和ZAAXIAL表面转动更多紫色和阶段6(26-30mm),大芽与呈紫色和附带的表面;第7阶段(31-35毫米),成熟芽,具有深紫在曲线和附加表面处。gydF4y2Ba一个gydF4y2Ba芽形态gydF4y2BabgydF4y2Ba芽被打开,分离,显示发育阶段;gydF4y2BacgydF4y2Ba不同发展阶段的柱/花药形态。(gydF4y2Ba一个gydF4y2Ba和gydF4y2BabgydF4y2Ba)b一个r = 50 mm, (cgydF4y2Ba)b一个r = 1 mm
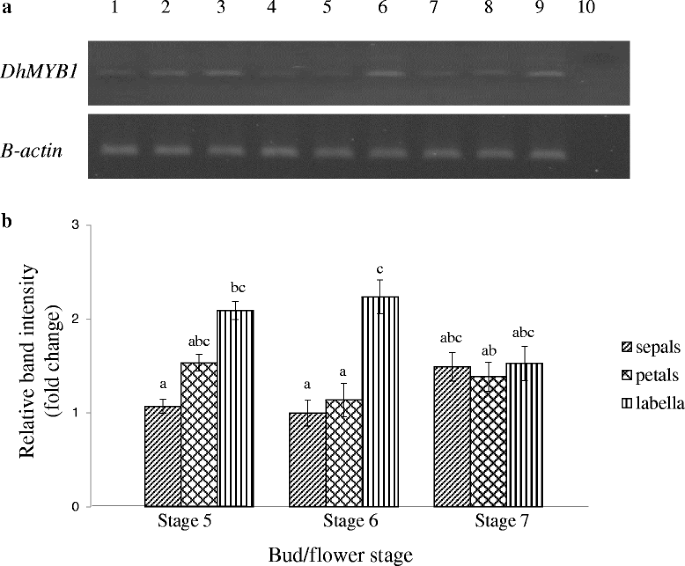
分析了表达层次gydF4y2BaDhMYB1gydF4y2Ba不同花芽阶段的cDNAgydF4y2Ba
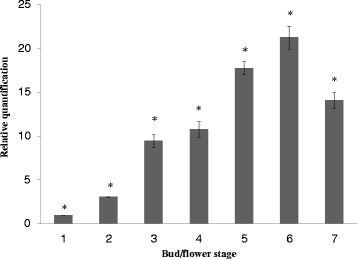
确定模式gydF4y2BaDhMYB1gydF4y2Ba基因表达,gydF4y2BaDhMYB1gydF4y2BacDNA通过实时PCR对所有花芽阶段(图定量。gydF4y2Ba6.gydF4y2Ba).的转录水平gydF4y2BaDhMYB1gydF4y2Ba从第1阶段(0-5mm芽长)逐渐增加至第6阶段(26-30mm)并在第7期(31-35mm)下降。一种方式ANOVA分析和多比较分析(Tukey HSD测试)在三个独立实验的平均结果上表现出显着的差异gydF4y2BaDhMYB1gydF4y2Ba第1期至第7期的表达差异有统计学意义(P < 0.05;无花果。gydF4y2Ba6.gydF4y2Ba).在对植物进行了仔细的检查之后gydF4y2BaDhMYB1gydF4y2Ba双链RNA,并指出,只有唇瓣细胞表现出改变的表型,水平gydF4y2BaDhMYB1gydF4y2BacDNA的萼片,花瓣和芽阶段5,6和7的labella通过半定量RT-PCR测定。表达式gydF4y2BaDhMYB1gydF4y2Ba唇瓣的表达量普遍高于萼片和花瓣,在第6阶段差异最大,分别是萼片和花瓣的2.2倍和2.0倍(图2)。gydF4y2Ba7.gydF4y2Ba).gydF4y2Ba
的表达水平gydF4y2BaDhMYB1gydF4y2Ba的cDNA在从阶段1点至7花芽。的相对表达gydF4y2BaDhMYB1gydF4y2Ba用cDNA的平均数除以gydF4y2BaDhMYB1gydF4y2Ba抄本副本按抄本编号gydF4y2Bad .矮牵牛β肌动蛋白gydF4y2Ba(内对照)对于相同的组织。最低的转录水平(gydF4y2BaDhMYB1gydF4y2Ba然后将第1阶段的cDNA)设定为1的值,并且随后的表达水平是相对于该数量的。条形图显示3个重复的标准误差gydF4y2BaDhMYB1gydF4y2BacDNA样品。每个酒吧顶部的星号突出显示差异gydF4y2BaDhMYB1gydF4y2Ba表达水平根据Tukey HSD比较测试(P <0.05)gydF4y2Ba
相对表达水平gydF4y2BaDhMYB1gydF4y2BaCDNA在花芽的不同花组织中。gydF4y2Ba一个gydF4y2Ba代表性半定量RT-PCR结果gydF4y2BaDhMYB1gydF4y2Ba和gydF4y2Baβ-肌动蛋白gydF4y2BacDNA的萼片,花瓣和第5阶段的labella至7个花芽。泳道1:第5个阶段萼片;泳道2:载物台5个花瓣;泳道3:阶段5 labella;泳道4:阶段6个萼片;泳道5:阶段6个花瓣;泳道6:第6阶段labella;泳道7:阶段7个萼片;泳道8:阶段7个花瓣;泳道9:阶段7 labella; lane 10: negative control.bgydF4y2BaPCR带的相对强度gydF4y2BaDhMYB1gydF4y2Ba归一化到本构gydF4y2Baβ-肌动蛋白gydF4y2Ba基因。各条表示与指示SE误差棒三次生物学重复的平均值。乐tters indicate significant differences using one way ANOVA followed by Tukey HSD multi-comparison analysis test (P < 0.05)
近轴表皮的细胞形状的花被gydF4y2BaD.矮牵牛gydF4y2Ba
为了表征花的近轴表皮细胞、唇瓣、花瓣和萼片的形状gydF4y2BaD.矮牵牛gydF4y2Ba通过扫描电子显微镜检查花序阶段的花朵。凸起in.gydF4y2BaD.矮牵牛gydF4y2Ba相比,萼片是更加复杂和花瓣其中的每一个被分成两个结构域:较大的上域1与扁平表皮细胞,而较小的基础结构域2与扁平矩形或不规则表皮细胞(图gydF4y2Ba8.gydF4y2Ba).与此相反,有七种不同类型的表皮细胞形状唇瓣(图的近轴表面上(其可以被描述为7个结构域)的。gydF4y2Ba8.gydF4y2Ba).gydF4y2Ba
说明Perianth中的adaxial表皮细胞的各种形状的图gydF4y2BaD.矮牵牛gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba花瓣的正面分为2域。D1:域1;D2:结构域2。gydF4y2BabgydF4y2Ba花瓣域1的正面-扁平的表皮细胞gydF4y2BacgydF4y2Ba花瓣域2的正面-扁平的表皮细胞具长方形的基部gydF4y2BadgydF4y2Ba萼片的正面表面分为2个域。D1:域1;D2:结构域2。gydF4y2BaegydF4y2Ba萼片域1的正面表面 - 扁平表皮细胞gydF4y2BafgydF4y2Ba萼片域2的正面-具不规则基部的扁平的表皮细胞gydF4y2BaggydF4y2Ba唇瓣的正面分为7个区域。D1:域1;D2域2;D3:域3;D4:域4;D5:域5:D6:域6;D7:域7。gydF4y2BahgydF4y2Ba唇瓣域1的正面表面 - 锥形表皮细胞gydF4y2Ba我gydF4y2Ba唇缘结构域2 - 扁平表皮细胞的曲线表面。gydF4y2BajgydF4y2Ba唇缘结构域3 - 表皮细胞的曲线表面显示出外部,切割壁的单一,中央生长。gydF4y2BakgydF4y2Ba唇缘域4 - 随机细胞生长的曲线表面。gydF4y2BalgydF4y2Ba唇缘结构域5的曲线表面5 - 表皮细胞内的规则条件。gydF4y2Ba米gydF4y2Ba唇瓣域的近轴面6 -扁平的表皮细胞具矩形的基部,表面上随机的圆锥形细胞。gydF4y2BangydF4y2Ba唇瓣域的近轴面7 -具矩形基部的扁平表皮细胞。用400倍放大的可变压力扫描电子显微镜在新鲜样品上捕捉近轴表皮细胞的形状gydF4y2Ba
表达分析gydF4y2BaDhMYB1gydF4y2Ba和表型gydF4y2BaD.矮牵牛gydF4y2Ba花芽用gydF4y2BaDhMYB1gydF4y2Ba极gydF4y2Ba
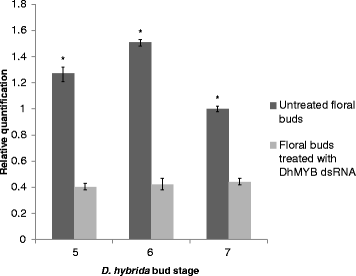
D.矮牵牛gydF4y2Ba芽与治疗gydF4y2BaDhMYB1gydF4y2Ba在第5、6和7期(分别在治疗后22天、25天和29天)将dsRNA与未接受治疗的对照组进行比较。处理花与对照花表型无明显变化,但显著降低(P < 0.05)gydF4y2BaDhMYB1gydF4y2BaRNA水平在第5阶段约为3.3倍,第6阶段约为4倍,第7阶段约为2.4倍(图5)。gydF4y2Ba9.gydF4y2Ba).gydF4y2Ba
双链rna处理后芽的基因表达。表达水平的量化gydF4y2BaDhMYB1gydF4y2Ba来自未治疗的芽和芽治疗gydF4y2BaDhMYB1gydF4y2Ba阶段5,6和7.相对表达的DsRNAgydF4y2BaDhMYB1gydF4y2Ba通过划分平均数来获得的gydF4y2BaDhMYB1gydF4y2Ba抄本副本按抄本编号gydF4y2Bad .矮牵牛β肌动蛋白gydF4y2Ba(内对照)对于相同的组织。的转录水平gydF4y2BaDhMYB1gydF4y2Ba将第7期未处理花芽的RNA设为1,随后的表达水平与此值相关。柱状图表示三次放大后的标准误差gydF4y2BaDhMYB1gydF4y2BacDNA样本(n = 3)。转录水平的gydF4y2BaDhMYB1gydF4y2Ba处理芽与对照芽的基因差异显著(P < 0.05)gydF4y2Ba
用芽处理芽的平坦性表皮细胞形状分析gydF4y2BaDhMYB1gydF4y2Ba极gydF4y2Ba
扫描电镜观察结果表明,处理后的花的萼片和花瓣的近轴表皮细胞形态无明显差异,而处理后的花唇1域细胞形态有明显差异gydF4y2BaDhMYB1gydF4y2BaDSRNA与匹配控制的DSRNA不同。处理的花朵具有相对扁平的表皮细胞,同时对照的那些是圆锥的(图。gydF4y2Ba10.gydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
MYB家族转录因子是生物发育的重要调控因子,在每个真核生物物种中以多个基因为代表,包括从单细胞藻类到多细胞植物的植物[gydF4y2Ba15.gydF4y2Ba].,旨在研究如果从MYB基因家族成员的dsRNA的直接应用可影响花的表型的发展中,我们首先确定的候选R2R3 MYB基因序列gydF4y2BaD.矮牵牛gydF4y2Ba,并证实这是一个庞大的基因家族,至少有32个不同的成员。例如,尽管MYB亚群9包含几个功能未知的基因gydF4y2Ba芽筋gydF4y2Basp。XMW-2002-1gydF4y2BaMYB1gydF4y2Ba和gydF4y2Bad . crumenatum MYBML1gydF4y2Ba[gydF4y2Ba27.gydF4y2Ba],被选为本研究的重点gydF4y2BaD.矮牵牛gydF4y2Ba由于一些MYB亚组9家庭成员与细胞形状和颜料开发有关,包括gydF4y2Baammixta.gydF4y2Ba[gydF4y2Ba5.gydF4y2Ba] 和gydF4y2BaAmMYBML1gydF4y2Ba[gydF4y2Ba21.gydF4y2Ba例如,在一些植物中细胞形状的调节gydF4y2BaPHMYB1.gydF4y2Ba在gydF4y2Ba矮牵牛织布达gydF4y2Ba[gydF4y2Ba12.gydF4y2Ba] 和gydF4y2BaTfMYMML2gydF4y2Ba在gydF4y2BaThalictrum filamentosumgydF4y2Ba[gydF4y2Ba22.gydF4y2Ba].然而,有关这些基因在不同花发育阶段表达谱的报道较少。gydF4y2Ba
花发育和细胞形态gydF4y2BaD.矮牵牛gydF4y2Ba
为了描述gydF4y2BaDhMYB1gydF4y2Ba在这项研究中,我们首先表现出花发育的阶段,从不成熟的芽到成熟的芽gydF4y2BaD.矮牵牛gydF4y2Ba根据花芽长度分为七个阶段(图。gydF4y2Ba5.gydF4y2Ba),也有类似的报道gydF4y2Ba芽筋gydF4y2BaX Jaquelyn Thomas ' Uniwai Prince ' (UH503) [gydF4y2Ba28.gydF4y2Ba] 和gydF4y2Ba芽筋gydF4y2Ba索尼娅“Earsakul” [gydF4y2Ba24.gydF4y2Ba].此外,我们确定了减数分裂的时间gydF4y2BaD.矮牵牛gydF4y2Ba作为之间后期3(在11至25毫米的范围内芽大小)与花粉形成最终级5的估计为26至30mm的范围内的阶段6(花蕾大小发生的图。gydF4y2Ba5.gydF4y2Ba).我们还通过SEM表征了花瓣的adaxial表皮细胞,发现每个花瓣和萼片分为基于细胞形状和尺寸的两个不同的结构域(图。gydF4y2Ba图8b,C,E和fgydF4y2Ba).先前对几种兰花的研究也根据细胞的形状和大小描述了不同的细胞类型,但没有涉及花瓣、萼片或唇瓣内的域[gydF4y2Ba29.gydF4y2Ba].仅在花瓣和萼片中仅存在平坦表皮细胞gydF4y2BaD.矮牵牛gydF4y2Ba(这项研究)是类似的报道gydF4y2BaD。gydF4y2Ba秋季蕾丝,gydF4y2BaD。gydF4y2Ba贝蒂藤,gydF4y2BaD. canaliculatum.gydF4y2BaXgydF4y2Bad . taurinumgydF4y2Ba那gydF4y2Bad . gouldiigydF4y2Ba和gydF4y2BaD. Lasianthera.gydF4y2Ba[gydF4y2Ba29.gydF4y2Ba].然而,最近的一项研究gydF4y2Ba蝴蝶兰属gydF4y2Ba牛红色鞋[gydF4y2Ba30.gydF4y2Ba],发现萼片上表皮细胞呈圆锥形,唇瓣上表皮细胞呈扁平状,提示不同种类的兰花gydF4y2Ba芽筋gydF4y2Ba和gydF4y2Ba蝴蝶兰属gydF4y2Ba,可能有不同的细胞形状模式。的唇瓣gydF4y2BaD.矮牵牛gydF4y2Ba在细胞形态上,是花被最复杂的部分,并被划分为七个不同的结构域(图。gydF4y2Ba8 h ngydF4y2Ba).唇瓣内仅见锥形细胞gydF4y2BaD.矮牵牛gydF4y2Ba和花瓣和萼片中的细胞形状gydF4y2BaD.矮牵牛gydF4y2Ba显然不变通过减少的表达gydF4y2BaDhMYB1gydF4y2Ba.gydF4y2Ba
锥形表皮细胞花瓣组织的共同特征,并已报道的昆虫和鸟类授粉的影响gydF4y2Ba通过gydF4y2Ba表面纹理和光线反射的变化,以及传粉者对颜色和表面面积的感知[gydF4y2Ba7.gydF4y2Ba那gydF4y2Ba10.gydF4y2Ba].锥形细胞在唇瓣中的花被的存在,并且不gydF4y2BaD.矮牵牛gydF4y2Ba因此,与吸引粉碎机对花的这一部分的作用相关。在我们的研究中,人体肉眼不能感知表皮细胞形状的变化,与对照花相比,处理的贴纸的形状或颜色没有明显的变化,即使这些可以被检测为减少gydF4y2BaDhMYB1gydF4y2Ba在电子显微镜下观察mRNA和细胞形态的变化。然而,花唇瓣细胞形状的变化也有可能被昆虫感知到gydF4y2Ba矮牵牛gydF4y2Ba与圆锥细胞野生型花相比,平板细胞突变型花更少被蜜蜂访问[gydF4y2Ba8.gydF4y2Ba].在兰花中使用Vigs为其他转录因子家庭使用Vigs,Bhlh和Mads盒子gydF4y2Ba蝴蝶兰属equestrisgydF4y2Ba[gydF4y2Ba9.gydF4y2Ba] 和gydF4y2BaPeSEP2gydF4y2Ba和gydF4y2BaPeSEP3gydF4y2Ba在gydF4y2Ba蝴蝶兰属gydF4y2Ba牛红色鞋[gydF4y2Ba30.gydF4y2Ba],导致细胞和花状的变化,同时也不改变花色。然而,据报道,来自兰花的R2R3 MyB转录因子OGMYB1的粒子轰击的瞬态表达gydF4y2BaOncidium Gower Ramsey.gydF4y2Ba,诱导花唇瓣中红色色素的形成[gydF4y2Ba31.gydF4y2Ba].在后者的研究中,仅在花瓣和萼片中发现了正常的表达模式,但当MYB在唇瓣异位表达时,色素通路的其余部分仍然活跃,可以被激活。因此,不出所料的是,似乎几个转录因子家族必须共同作用,从而形成花细胞和器官的形状和颜色,而那些人类看不到的变化可能仍然具有生物学和生态影响。除了吸引昆虫传粉者的作用,兰花唇瓣的独特和特殊性质是这些植物的重要商业品质和不同地区的特征,如在当前的研究中,如果扩展到兰花的其他物种和品种,可以作为分子育种中一种有用的形态标记,类似于豆科植物花的花瓣表皮细胞的特征,它已被用作不同花瓣身份的微形态标记[gydF4y2Ba32.gydF4y2Ba那gydF4y2Ba33.gydF4y2Ba].gydF4y2Ba
DhMYB1gydF4y2Ba是在花的发育过程中表达出来的吗gydF4y2Ba
在这项研究中,我们专注于来自MYB9亚组的候选人,并观察到这一点gydF4y2BaDhMYB1gydF4y2Ba通过成熟的芽芽不成熟的表现,是在花发育中的作用(图一致。gydF4y2Ba6.gydF4y2Ba).最大观察到的表达gydF4y2BaDhMYB1gydF4y2Ba在花蕾第6期,在开放前6 - 7天左右与完全形成的花相吻合(图。gydF4y2Ba4.gydF4y2Ba).在这个阶段,进一步的花发育主要包括细胞扩张和花开放,从而表达gydF4y2BaDhMYB1gydF4y2Ba可能与花朵成熟时细胞扩张过程中细胞形状的持续调节有关。MYB9亚群的成员已经被报道在花的发育中有不同的作用,在这里我们观察到直接应用dsRNA共享序列的身份gydF4y2BaDhMYB1gydF4y2Ba,显著降低的水平gydF4y2BaDhMYB1gydF4y2BaRNA(图。gydF4y2Ba9.gydF4y2Ba)并导致兰花花凸起中的细胞形状改变(图。gydF4y2Ba10.gydF4y2Ba).从(野生型)圆锥形细胞到扁平细胞的变化非常相似,与在花中报告的细胞非常相似gydF4y2BamixtagydF4y2Ba突变体中gydF4y2BaAnthirhinummajus.gydF4y2Ba[gydF4y2Ba5.gydF4y2Ba那gydF4y2Ba34.gydF4y2Ba] 和gydF4y2Baphmyb1gydF4y2Ba突变体中gydF4y2Ba矮牵牛织布达gydF4y2Ba[gydF4y2Ba12.gydF4y2Ba],支持外科职责gydF4y2BaDHMYB1,PHMYB1gydF4y2Ba和gydF4y2Baammixta.gydF4y2Ba.表达模式gydF4y2BaDhMYB1gydF4y2Ba在gydF4y2BaD.矮牵牛gydF4y2Ba与报道的有可比性吗gydF4y2BaPHMYB1.gydF4y2Ba在矮牵牛花[gydF4y2Ba12.gydF4y2Ba的成绩单水平gydF4y2BaDhMYB1gydF4y2Ba和gydF4y2BaPHMYB1.gydF4y2Ba随着花芽尺寸的增大而逐渐增大,当花芽尺寸达到最大值的70%左右时达到峰值。相反,报告的表达式模式gydF4y2BaAmMYBML2gydF4y2Ba和gydF4y2Baammixta.gydF4y2Ba在gydF4y2BaAnthirhinummajus.gydF4y2Ba不同,前者表达了相对较晚的表达,当花的花冠刚刚打开时达到峰值,并且当花在最终尺寸的一半大约有一半时,后者的表达稍微达到尖锐。有趣的是,该组的系统发生(图。gydF4y2Ba2gydF4y2Ba)也将PHMYB1和DHMYB1稍微更接近。dsRNA(和降低mRNA)对花细胞形状的影响,仅在标签中观察,而不是花瓣或萼片gydF4y2BaD.矮牵牛gydF4y2Ba(无花果。gydF4y2Ba10.gydF4y2Ba),因此,我们建议的功能gydF4y2BaDhMYB1gydF4y2Ba涉及圆锥形细胞的正常细胞发育整个花的成熟,并且我们观察到仅限于的labellagydF4y2BaD.矮牵牛gydF4y2Ba,但在两者的花瓣中被发现gydF4y2Ba矮牵牛gydF4y2Ba和gydF4y2BaAntirrhinum.gydF4y2Ba.的表达式模式也支持这一点gydF4y2BaDhMYB1gydF4y2Ba与缺乏圆锥形表皮细胞的花瓣和萼片相比,在标签上较高(图。gydF4y2Ba7.gydF4y2Ba).gydF4y2Ba
直接应用双链rna是研究花发育基因功能的有效途径gydF4y2Ba
过表达和RNA干扰(RNAi)技术已被证明是研究MYB家族蛋白在花发育中的作用和提高花的质量和数量的有用工具[gydF4y2Ba35.gydF4y2Ba].然而,在生长缓慢的种类,例如兰花,稳定转化方法是不实际的,因此VIGS和其他的瞬时表达和基因沉默的方法是更多的时间和成本有效的。VIGS已被证明作为用于MADS的基因沉默的一种有效方法框转录因子在gydF4y2Ba蝴蝶兰属gydF4y2Ba兰花[gydF4y2Ba9.gydF4y2Ba],静音效率可达95.8% [gydF4y2Ba36.gydF4y2Ba].最近的一项研究gydF4y2Ba芽筋gydF4y2Ba索尼娅(gydF4y2Ba24.gydF4y2Ba[展示了农药释放RNAI方法的效用,在兰花的花组织中测定基因功能。在我们的研究中,RNAi击倒了表达的gydF4y2BaDhMYB1gydF4y2Ba使用gydF4y2BaDhMYB1gydF4y2BadsRNA能够产生透明的功能表型(表皮细胞形状)的缺失,而不是实现的速度更快gydF4y2Ba通过gydF4y2Ba转基因方法,因此这可能在生物技术应用和研究方面有潜力。这种方法已经成功地应用于动物系统,例如gydF4y2BaCaenorhabditis elegans.gydF4y2Ba[gydF4y2Ba37.gydF4y2Ba],但在植物中,以前的报告仅限于用于病毒抗性,例如烟草[gydF4y2Ba38.gydF4y2Ba)、玉米(gydF4y2Ba39.gydF4y2Ba]和兰[gydF4y2Ba26.gydF4y2Ba].在目前的研究中,这种方法被发现可以降低转录水平gydF4y2BaDhMYB1gydF4y2Ba花芽的gydF4y2BaD.矮牵牛gydF4y2Ba成功。此外,利用细菌表达基因的机械接种RNA的方法比使用任何一种方法都简单快捷gydF4y2Ba体外gydF4y2Ba大量RNA的合成或将转基因引入植物。我们设想,对于一些候选基因,改变的表型也可以用肉眼看到,例如,色素沉着的丧失或减少或器官特性的改变。gydF4y2Ba
结论gydF4y2Ba
的发展gydF4y2Ba石斛兰矮牵牛gydF4y2Ba花芽被表征成七个阶段与阶段之间存在的3〜5(芽尺寸在11到25毫米的范围内)和花粉形成估计在阶段6(在26至30毫米的范围内芽大小)发生减数分裂。我们还表征了花花被的近轴表皮细胞通过SEM,发现该花瓣和萼片每个被分成基于细胞的形状和大小两个不同的结构域,而labella有七个域。我们发现并克隆全长gydF4y2BaR2R3-MYBgydF4y2Ba互补脱氧核糖核酸序列,gydF4y2BaDhMYB1,gydF4y2Ba已知涉及细胞形状开发和使用的MyB序列的OTOHOLOOLOUS。gydF4y2BaDhMYB1gydF4y2Ba基因序列,表明dsRNA的发展花芽的直接应用可减少内源性花转录水平。这导致我们建议的作用gydF4y2BaDhMYB1gydF4y2Ba在整个花卉发育中调节Labella表皮细胞的圆锥形状。与基于载体的遗传转化相比,该方法相对较快和廉价。我们认为DSRNA对花的直接应用可以是用于电池变换的替代方法,其可用于园艺,特别是关于花修饰。gydF4y2Ba
方法gydF4y2Ba
植物材料gydF4y2Ba
混合植物(gydF4y2Ba石斛兰矮牵牛gydF4y2Ba)无性繁殖从一个未登记的杂交gydF4y2Ba芽筋gydF4y2Ba鲍比梅西纳和gydF4y2Ba芽筋gydF4y2Ba湄南河用于所有实验。植物从谢氏华购买桑兰花农场莎阿南,雪兰莪,马来西亚和在花盆用活性炭作为根培养基中生长。gydF4y2Ba
PCR扩增MYB结构域,克隆和序列分析gydF4y2Ba
总RNA,用CTAB法花香和幼叶组织中提取[gydF4y2Ba40.gydF4y2Ba].采用高容量cDNA逆转录试剂盒(Applied Biosystem, USA),按照说明书进行第一链cDNA合成。i-Taq™DNA聚合酶PCR试剂盒使用2 μl的第一链cDNA反应,并使用两套简并引物(Dh1-MYB F: AAAGGTGCWTGGACYRMKGAAGAAGA和Dh1-MYB R: AGRTGRGTGTTCCARTARTTYTTGACRTC;Dh2-MYB F: AGGGCCATGGACWSYAGAMGAAGAYC和Dh2-MYB R: GAACTAYTGGAACACWCATYTAAAGAARCG)(由Intron Biotechnology,韩国定制合成)。PCR反应循环30次,94℃45 s, 58℃45 s, 72℃1 min。在1%琼脂糖凝胶上分离约300 bp的RT-PCR产物,提取并克隆到pGEM®-T Easy Vector (Promega, USA)。克隆插入物的DNA序列由Sanger测序公司(First BASE Laboratories Sdn Bhd, Malaysia)确定。gydF4y2Ba
cDNA末端快速扩增-聚合酶链反应(5 ' and 3 ' RACE-PCR)gydF4y2Ba
全长序列gydF4y2BaDhMYB1gydF4y2Ba根据制造商的说明,使用GeneRacer™Kit (Invitrogen™,USA),通过3 '和5 ' RACE获得cDNA。5’RACE-PCR采用dhmyb5’引物(CGACTGGAGCACGAGGACACTGA)和dhmyb3’引物(GCTTGCATACATTGAGAAGCATGGGC)扩增,而3’RACE-PCR采用dhmyb5’引物(AGACCACCTGTTGCCAAGGA)和GeneRacer™3’引物(GCTGTCAACGATACGCTACGTAACG)扩增。PCR产物采用Zero Blunt®TOPO®PCR Cloning Kit (Invitrogen™)克隆并测序。gydF4y2Ba
系统发育分析gydF4y2Ba
三十二个隔离gydF4y2BaD.矮牵牛gydF4y2BacDNA序列被翻译成使用EMBOSS Transeq(推定的部分氨基酸序列gydF4y2Bahttp://www.ebi.ac.uk/Tools/st/emboss_transeqgydF4y2Ba).[:32个的部分氨基酸序列与DwMYB1 [AF485892.1 GenBank登录]对准gydF4y2Ba27.gydF4y2Ba]使用embl-ebi clustalw2(gydF4y2Bahttp://www.ebi.ac.uk/Tools/msa/clustalw2/gydF4y2Ba).利用植物种间转录因子功能查找器IT3F进行系统发育分析(gydF4y2Bahttp://jicbio.bbsrc.ac.uk/IT3FgydF4y2Ba)与Genbank数据库中的32个分离推定的部分蛋白序列和其他植物MYB Superfamily R2R3成员(登录号和详细信息列于其他文件中gydF4y2Ba2gydF4y2Ba).来自聚簇R2R3 MYB基因序列的亚组9的一种候选基因(随后命名gydF4y2BaDhMYB1gydF4y2Ba),扩增全长cDNA用于功能研究。研究了DhMYB1与9亚群MYB蛋白、AmMIXTA [GenBank: CAA55725.1]、mixta -样MYB基因AmMYBML1 [GenBank: CAB43399.1]、AmMYBML2 [GenBank: AAV70655]和AmMYBML3 [GenBank: AAU13905]的氨基酸序列的系统发育关系gydF4y2Ba金鱼草majusgydF4y2Ba;AtMYB16 [GenBank: AED92146.1] and AtMYB106 [GenBank: AEE73615.1] fromgydF4y2Ba拟南芥gydF4y2Ba;PhMYB1 [GenBank登录号:CAA78386.1]从gydF4y2Ba矮牵牛织布达gydF4y2Ba;DcMYBML1 [GenBank: add645001] fromgydF4y2Ba石斛蜡染gydF4y2Ba, DwMYB1 [GenBank: AAO49410.1] fromgydF4y2Ba芽筋gydF4y2Basp .;TFMYMML2 [GENBANK:ACT78694]来自gydF4y2BaThalictrum filamentosumgydF4y2Ba;mgmybml8 [Genbank:Adv29952.1]来自gydF4y2Ba沟酸浆属鱯弹出变IM62gydF4y2Ba采用分子进化遗传学分析(mega4)(美国Tempe进化医学和信息学中心)进行。PpMYB1 [GenBank: ACA33839]作为根树的外群,通过邻域连接分析生成。gydF4y2Ba
质粒建设gydF4y2Ba
细菌表达矢量PL4440 /gydF4y2BaDhMYB1gydF4y2Ba的c端部分序列对应的双链RNAgydF4y2BaDhMYB1gydF4y2Ba双T7 RNA聚合酶启动子的控制下。该构建体含有的430bp的(NTS 769至1198)gydF4y2BaDhMYB1gydF4y2Ba[Genbank:JX846911],通过使用RNA的RT-PCR扩增gydF4y2BaD.矮牵牛gydF4y2Ba年轻花芽作为模板。生成PL4440 /gydF4y2BaDhMYB1gydF4y2Ba构建体,引物1,(gydF4y2BaGCGGCCGCgydF4y2BaCCTAGGAAGAGGATACACCATTGAC;gydF4y2Ba不是gydF4y2Ba我序列(下划线)加nts 769 - 794 ntgydF4y2BaDhMYB1gydF4y2Ba基因序列)和引物2(gydF4y2BaCCCATGGgydF4y2BaGGTGGCGGTGAATTTGGA);gydF4y2Ba以区域gydF4y2Ba我序列(下划线)加上nt1198到1181的gydF4y2BaDhMYB1gydF4y2Ba基因序列)被用来扩增该gydF4y2BaDhMYB1gydF4y2Ba基因片段是凝胶纯化和消化gydF4y2Ba不是gydF4y2Ba我和gydF4y2Ba以区域gydF4y2Ba我,那么之间连接gydF4y2Ba不是gydF4y2Ba我和gydF4y2Ba以区域gydF4y2BapL4440中的I克隆位点。将质粒导入缺失的RNase iii中gydF4y2Ba大肠杆菌gydF4y2Ba菌株HT115 (DE3) [gydF4y2Ba37.gydF4y2Ba]使用标准的CaclgydF4y2Ba2gydF4y2Ba转型协议[gydF4y2Ba41.gydF4y2Ba].gydF4y2Ba
含粗细菌裂解物的生产gydF4y2BaDhMYB1gydF4y2Ba极gydF4y2Ba
RNase III缺陷的克隆gydF4y2Ba大肠杆菌gydF4y2Ba载体pL4440/DhMYB的HT115 (DE3)菌株在添加100 μg/ml氨苄西林和12.5 μg/ml四环素的固体LB培养基中保持。的制备gydF4y2BaDhMYB1gydF4y2Ba的dsRNA是基于蒂蒙斯的方法该克隆在液体培养基中的感应gydF4y2Ba等等。gydF4y2Ba[gydF4y2Ba37.gydF4y2Ba]在刘如所描述的gydF4y2Ba等等。gydF4y2Ba[gydF4y2Ba26.gydF4y2Ba,但省略了RNA退火步骤。gydF4y2Ba
兰花植物的处理gydF4y2Ba
对于每种实验重复,含有粗细菌提取物gydF4y2BaDhMYB1gydF4y2BadsRNA接种到三个兰花植物为每个治疗,对照组用鲜花在花蕾长度0 - 5毫米(阶段1)。机械接种是由轻轻摩擦50μl含2μg /μl原油的细菌中提取到花蕾每隔5天使用latex-gloved手指。这些植物被放置30分钟,然后用缓慢流动的自来水冲洗掉任何碎片。然后在25°C和12小时的光周期下培养植株。处理和未处理的芽分别在芽期第5、6和7期收获,gydF4y2BaIE。,gydF4y2Ba治疗后22天(dpt), 25天和29天(dpt)。提取总RNA,测定其表达水平gydF4y2BaDhMYB1gydF4y2Bawere analysed by RT-qPCR in three independent experiments (n = 3 per experiment). Images of floral buds were captured prior to RNA extraction.
分析gydF4y2BaDhMYB1gydF4y2Ba基因表达gydF4y2Ba
使用CTAB方法分离的总RNA的样品[gydF4y2Ba40.gydF4y2Ba用DNase I (Invitrogen™)处理。使用随机六聚体,用高容量cDNA逆转录试剂盒(Applied Biosystems, USA)制备每个RNA样本两微克的cDNA。对于定量PCR实验,gydF4y2BaDhMYB1gydF4y2Ba采用两步逆转录-定量实时聚合酶链反应(RT-qPCR)对RNA进行定量gydF4y2BaDhMYB1gydF4y2Ba特异性引物(DhMYB F: TGCTGTCGGATAAAGCCAATG和DhMYB R: GGTGGCGGTGAATTTGGA)gydF4y2BaβgydF4y2Ba-肌动蛋白基因引物(gydF4y2BaβgydF4y2Ba肌动蛋白F:TGGGCACCTAAATCTCTCAGC和gydF4y2BaβgydF4y2Ba-actin R: gtcagggacatcaagagaag)在20 μL PCR混合物中,包含2 μL cDNA,每个引物0.5 mM和Power SYBR®Green PCR Master Mix kit (Applied Biosystems, USA)。扩增条件为:初始DNA聚合酶在95°C活化10分钟,然后使用7500 Real Time PCR系统(Applied Biosystems)进行40个扩增循环,其中95°C变性15秒,60°C退火延伸1分钟。使用SDS 1.3.1(序列检测软件)建立相对定量(ddCt)板和分离曲线。gydF4y2BaβgydF4y2Ba-actin作为目的CP基因表达水平正常化的内源性参考[gydF4y2Ba42.gydF4y2Ba]与未经处理的对照样品作为校准。相对定量最小值(RQmin)比相对定量最大(RQMAX)限制被设定在95%置信。gydF4y2Ba
使用含有2微升cDNA的,5皮摩尔各引物的20微升PCR混合物进行半定量PCR,1X PCR缓冲液,每种dNTP和1U的0.25毫gydF4y2BaI-的TaqgydF4y2BaDNA聚合酶(Intron Biotechnology,Inc.,韩国)。初始变性设定在94℃,2分钟,然后在94℃下的25个扩增循环,在94℃下,在60℃下退火10s,在72℃下延伸30秒,并最终延伸在72℃下5分钟。将扩增的产物在1.5%(W / V)琼脂糖凝胶上分离,然后使用alphainoTech - alphaIpiep分析软件使用alphaimager hp(alphainnotech,美国)进行图像捕获和带强度分析。gydF4y2Baβ-肌动蛋白gydF4y2Ba用作参考基因进行相对定量(使用如上所述的引物)。gydF4y2Ba
统计分析gydF4y2Ba
的相对定量gydF4y2BaDhMYB1gydF4y2Ba通过ANOVA一个尾验测试分析了不同芽阶(范围从0-35mm)和不同的花动器官(萼片,花瓣和标签)的cDNA,而相对量化gydF4y2BaDhMYB1gydF4y2Ba未处理的对照和处理的花蕾的cDNA之间级5,6和7(21-35毫米)通过ANOVA双尾测试使用STATISTICA版10的Windows(StatSoft推出,USA)进行分析。多重比较采用杜克HSD检验。P < 0.05 was considered to be significant.
细胞学gydF4y2Ba
不同阶段的花蕾在100%乙醇中固定:冰醋酸3:1在室温下为1小时,然后在-20℃下转移至70%乙醇中储存。在立体声显微镜下解开芽,并且在显微镜载玻片上置于一滴acetocarmine的porlinia。除去Meiocytes,在盖子滑动下挤压,通过光学显微镜分析为减数分裂阶段。使用冷却的CCD摄像头和NIS元素4.0成像包在尼康蚀I80显微镜上拍摄图像。gydF4y2Ba
扫描电子显微镜gydF4y2Ba
D.矮牵牛gydF4y2Ba唇瓣,花瓣和萼片被切成小块和固定在2% (w / v)戊二醛在4°C蒸馏水16 h,其次是2% (v / v)水四氧化锇在4°C蒸馏水16 h。然后,样本与蒸馏水洗两次,持续15分钟,通过一系列标准乙醇脱水。然后,用乙醇和丙酮混合物(3:1,1:1和1:3乙醇:丙酮)浸渍样品15分钟。然后,样品在丙酮中培养1小时,然后用CPD 7501仪器(Poloran, UK)在31.5°C, 1100 psi下进行临界点干燥。将干燥后的样品安装在样品根上,在真空干燥器中干燥16小时,然后涂上金,使用JSM 6400扫描电子显微镜(SEM) (Jeol Ltd, Japan)进行检测。在100倍、400倍和500倍的显微镜下分析细胞形状。新鲜的gydF4y2BaD.矮牵牛gydF4y2BaLabella,花瓣和萼片安装在标本存根上,并使用Leo 1455 VP-SEM(Angstrom Scientific Inc.,US)和倍增倍率检查。gydF4y2Ba
可获得的支持数据gydF4y2Ba
MYB蛋白的系统发育关系和亚群命名gydF4y2BaD.矮牵牛gydF4y2Ba(gydF4y2BaDHgydF4y2Ba)和R2R3 MYB蛋白的列表包括在附加文件中gydF4y2Ba1gydF4y2Ba和gydF4y2Ba2gydF4y2Ba.gydF4y2Ba
参考文献gydF4y2Ba
- 1。gydF4y2Ba
肖永勇,潘志军,徐春春,杨永平,徐永春,庄永春,等。兰花生物学与生物技术研究。植物生理学杂志。2011;52(9):1467-86。gydF4y2Ba
- 2。gydF4y2Ba
Khentry Y,Paradornuwat A,Tantiwiwat S,Phansiri S,大花蕙兰花叶病毒和齿兰环斑在石斛属病毒Thaveechai N.发生。在泰国。作物科。2006; 25(9):926-32。gydF4y2Ba
- 3。gydF4y2Ba
Grotewold E.花卉颜料的遗传和生物化学。Annu Rev植物Biol。2006; 57:761-80。gydF4y2Ba
- 4。gydF4y2Ba
田中勇,杨志强,杨志强,等。类黄酮生物合成途径工程修饰花色的应用前景。生物化学学报。2010;40(9):1760-9。gydF4y2Ba
- 5。gydF4y2Ba
花的颜色强度取决于由myb相关转录因子控制的特殊细胞形状。大自然。1994;369(6482):661 - 4。gydF4y2Ba
- 6。gydF4y2Ba
王志强,王志强,王志强,等。植物与颜色:花与授粉。光学激光技术。2011;43(2):282-94。gydF4y2Ba
- 7。gydF4y2Ba
Whitney HM, Bennett KMV, Dorling M, Sandbach L, Prince D, Chittka L等。为什么这么多花瓣有锥形表皮细胞?安机器人。2011;108(4):609 - 16。gydF4y2Ba
- 8。gydF4y2Ba
奥尔康K,惠特尼H,格洛弗B.运动花授粉增加偏爱的花朵更好的抓地力。功能该ECOL。2012; 26(4):941-7。gydF4y2Ba
- 9.gydF4y2Ba
谢M-H,潘Ž-J,赖P-H,路H-C,叶H-H,许C-C。,等人。病毒诱导的基因沉默揭开参与花卉生长发育蝴蝶兰花多种转录因子。J Exp Bot。2013; 64(12):3869-84。gydF4y2Ba
- 10。gydF4y2Ba
Papiorek S,容克RR,Lunau K.光泽度,颜色和抓地力:在bee-和鸟媒花多功能表皮细胞的形状。Plos一个。2014; 9(11):e112013。gydF4y2Ba
- 11.gydF4y2Ba
铁离子与喜玛拉雅蓝罂粟(Meconopsis grandis)的花色发育有关。植物化学。2006;67(10):992 - 8。gydF4y2Ba
- 12.gydF4y2Ba
鲍曼等。R2R3 MYB转录因子对细胞和花瓣形态发生的控制。发展。2007;134(9):1691 - 701。gydF4y2Ba
- 13。gydF4y2Ba
金海林,王志强,王志强。植物myb基因家族的多功能性和多样性。植物学报。1999;41(5):577-85。gydF4y2Ba
- 14。gydF4y2Ba
杜博斯,李志刚,李志刚,李志刚。拟南芥MYB转录因子的研究进展。植物学报,2010;15(10):573-81。gydF4y2Ba
- 15.gydF4y2Ba
杜华,王永波,谢勇,梁铮,姜世军,张树生,等。陆生植物myb相关基因的全基因组鉴定及进化与表达分析DNA研究》2013;20(5):437 - 48。gydF4y2Ba
- 16。gydF4y2Ba
陈志强,陈志强,陈志强,等。拟南芥R2R3-MYB基因家族成员的功能特征研究植物j . 1998; 16(2): 263 - 76。gydF4y2Ba
- 17。gydF4y2Ba
Stracke R,Werber M,Weisshaar B.拟南芥的R2R3-MYB基因家族。CurrOp植物BIOL。2001; 4(5):447-56。gydF4y2Ba
- 18。gydF4y2Ba
Jaffe FW, Tattersall A, Glover BJ。一截短的MYB转录因子调控表皮细胞的生长。中国生物医学工程学报。2007;58(6):1515-24。gydF4y2Ba
- 19.gydF4y2Ba
Ogata K, Morikawa S, Nakamura H, Sekikawa A, Inoue T, Kanai H,等。Myb DNA结合区域具有合作识别螺旋的特定DNA复合物的溶液结构。细胞。1994;79(4):639 - 48。gydF4y2Ba
- 20。gydF4y2Ba
Lipsick JS。10亿年的Myb。致癌基因。1996;13(2):223 - 35。gydF4y2Ba
- 21。gydF4y2Ba
Perez-Rodriguez M,Jaffe FW,Butelli E,Glover BJ,Martin C.三种不同细胞类型的开发与Antirrhinummus Flower的腹侧花瓣中特定MYB转录因子的活动有关。发展。2005; 132(2):359-70。gydF4y2Ba
- 22。gydF4y2Ba
MIXTA-like2的同源物控制Thalictrum花表皮细胞的形状。新植醇。2009;183(3):718 - 28。gydF4y2Ba
- 23。gydF4y2Ba
RNA干扰在植物改良中的作用。《自然科学》杂志上。2011;98(6):473 - 92。gydF4y2Ba
- 24。gydF4y2Ba
关键词:铁皮石斛(Dendrobium Sonia ' Earsakul '),瞬时发簪rna诱导沉默,快速测定花色植物细胞组织器官邪教。2014;1-12。gydF4y2Ba
- 25。gydF4y2Ba
Tenllado男,马丁内斯,加西亚B,巴尔加斯男,迪亚斯·鲁伊斯JR。细菌表达的dsRNA的粗提取物可用于保护植物免受病毒的感染。BMC Biotechnol。2003; 3。gydF4y2Ba
- 26。gydF4y2Ba
刘SE,素洁P,熙TW,宋ALA,奥斯曼RY,Harikrishna JA。从体外培养移植对大花蕙兰在花叶病毒细菌表达的dsRNA保护兰科植物粗提物。Ĵ园艺科学生物技术。2014; 89(5):569-76。gydF4y2Ba
- 27。gydF4y2Ba
吴小敏,林胜,杨伟。兰花R2R3-MYB基因的特征、表达及系统发育研究。植物学报。2003;51(6):959-72。gydF4y2Ba
- 28。gydF4y2Ba
Mudalige-Jayawickrama RG,香槟MM,Hieber Ad,Kuehnle Ar。二核兰花两种花青素生物合成基因的克隆与表征。J AM SoC园艺SCI。2005; 130(4):611-8。gydF4y2Ba
- 29。gydF4y2Ba
Mudalige RG, Kuehnle AR, Amore TD。石斛属植物及杂交种色素分布及表皮细胞形态。38 Hortscience。2003;(4):573 - 7。gydF4y2Ba
- 30.gydF4y2Ba
潘志军,陈永勇,杜建生,陈永勇,钟明昌,蔡文昌,等。蝴蝶兰花的发育涉及功能分化的萼片样基因。新植醇。2014;202(3):1024 - 42。gydF4y2Ba
- 31.gydF4y2Ba
赵志尧,叶家伟。Oncidium Gower Ramsey花组织中MYB基因(OgMYB1)的差异表达决定了颜色模式。植物学报。2008;66(4):379-88。gydF4y2Ba
- 32。gydF4y2Ba
奥赫达我,弗朗西斯科 - 奥尔特加Ĵ,克朗克QCB。豆科花瓣表皮微和其作为花瓣的身份的标志使用的演变。Ann Bot。2009; 104(6):1099-110。gydF4y2Ba
- 33。gydF4y2Ba
翁L,田Z,冯X,李X,徐S,胡X等。花瓣发展百脉根。ĴINTEGR植物生物学。2011; 53(10):770-82。gydF4y2Ba
- 34。gydF4y2Ba
acta botanyopsis chantyopsis chantyopsis chantyopsis chantyopsis chantyopsis chantyopsis chantyopsis chantyopsis chantyopsis chantyopsis chantyopsis chantyopsis;遗传。1998;80:778 - 84。gydF4y2Ba
- 35。gydF4y2Ba
陈旭。发育中的小rna -来自植物的见解。acta optica sinica, 2012;22(4): 361-7。gydF4y2Ba
- 36。gydF4y2Ba
谢明辉,卢宏昌,潘志军,叶宏辉,王淑珊,陈卫华,等。蝴蝶兰花叶病毒诱导基因沉默效率的优化植物科学。2013;201:25-41。gydF4y2Ba
- 37。gydF4y2Ba
在秀丽隐杆线虫中,摄取细菌表达的dsrna可产生特异性和强效的遗传干扰。基因。2001;263(1 - 2):103 - 12所示。gydF4y2Ba
- 38。gydF4y2Ba
Sun Z-N,YIN G-H,歌曲Y-Z,H-L,ZHU C-X,WEN F-J。细菌表达的双链RNA对烟草叶片病毒或马铃薯病毒Y基因组的热点序列具有不同的保护烟草免受病毒感染的能力。Appl Biochem Biotechnol。2010; 162(7):1901-14。gydF4y2Ba
- 39。gydF4y2Ba
张建军,姜洪,张涛,朱胜,程博。玉米单链rna对SCMV感染的保护作用。植物学报2010;29(11):1261-8。gydF4y2Ba
- 40.gydF4y2Ba
张永灿,陈文昌,陈志勇,李爱勇,等。表达转录本的从头组装和蝴蝶兰转录组的整体分析。植物生理学杂志。2011;52(9):1501-14。gydF4y2Ba
- 41.gydF4y2Ba
Sambrook J, Russell DW。利用氯化钙制备活性大肠杆菌及其转化。CSH Protoc。2005;2006(1):585 - 93。gydF4y2Ba
- 42.gydF4y2Ba
Livak KJ,Schmittgen TD。实时定量PCR的相对基因表达数据分析及2( - Delta Delta C)方法。方法。2001; 25(4):402-8。gydF4y2Ba
致谢gydF4y2Ba
这项工作得到了马来亚大学基础研究赠款计划(Grant No.FP042 / 2008C)的支持,马来亚大学(Grant No.: FL010-2012A和RU005E-2014)和研究官赠款计划(BR004-2014).JAH由高影响力研究总理授予UM.C / 625/1 / HIR / MOHE / SCI / 19来自马来撒大学。我们感谢莱斯特大学John Bailey博士进行细胞学辅助;马来亚大学李万士议员提供半量化PCR和Alena Lee Sanusi女士进行编辑援助。gydF4y2Ba
作者信息gydF4y2Ba
隶属关系gydF4y2Ba
通讯作者gydF4y2Ba
额外的信息gydF4y2Ba
利益争夺gydF4y2Ba
提交人声明他们没有竞争利益。gydF4y2Ba
作者的贡献gydF4y2Ba
SEL,TS:实验工作,数据分析,稿件写作。ryo,jah:项目的概念,数据分析,稿件的写作。所有作者阅读并认可的终稿。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:gydF4y2Ba
MYB蛋白的系统发育关系和亚群命名gydF4y2BaD.矮牵牛gydF4y2Ba(gydF4y2BaDHgydF4y2Ba).gydF4y2Ba种间转录因子功能查找器(IT3F)的系统发育图gydF4y2Ba:拟南芥gydF4y2Ba芥;gydF4y2BaOS.gydF4y2Ba:gydF4y2Ba栽培稻gydF4y2Ba那gydF4y2Ba我gydF4y2Ba:gydF4y2Ba金鱼草majusgydF4y2Ba那gydF4y2BaghgydF4y2Ba:gydF4y2Ba陆地棉gydF4y2Ba那gydF4y2BaF AgydF4y2Ba:gydF4y2Ba草莓ananassagydF4y2Ba那gydF4y2Ba例如gydF4y2Ba:gydF4y2Ba桉树枪gydF4y2Ba和gydF4y2Ba乐gydF4y2Ba:gydF4y2Ba地区香菇gydF4y2Ba.黑色:gydF4y2Ba拟南芥gydF4y2Ba;黄色:单子叶植物;绿色:豆类;红色:gydF4y2BaD.矮牵牛gydF4y2Ba从本研究;蓝色:功能已知的MYB基因;红点:基因复制;蓝点:基因串联。(邮政编码339 kb)gydF4y2Ba
额外的文件2:gydF4y2Ba
表S1。gydF4y2Ba在其他文件中使用的R2R3 MYB蛋白详细gydF4y2Ba1gydF4y2Ba.(多克斯40 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放访问gydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0gydF4y2Ba),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除非另有说明,否则适用于本文中提供的数据。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
刘,SE。那Schwarzacher, T., Othman, R.Y.等等。gydF4y2BaR2R3-MYB转录因子的DSRNA沉默影响了一个花细胞形状gydF4y2Ba芽筋gydF4y2Ba杂交种。gydF4y2BaBMC植物BIOL.gydF4y2Ba15,gydF4y2Ba194(2015)。https://doi.org/10.1186/s12870-015-0577-3gydF4y2Ba
已收到gydF4y2Ba:gydF4y2Ba
公认gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-015-0577-3gydF4y2Ba
关键词gydF4y2Ba
- 细胞形态发生gydF4y2Ba
- RNA干扰gydF4y2Ba
- RNA沉默gydF4y2Ba
- 生物技术gydF4y2Ba
- 基因沉默gydF4y2Ba
- 表皮细胞gydF4y2Ba