摘要
背景
碳的积累和转移是植物体内保证能量在不同功能或代谢需求的植物组织之间传递和支持下一代的基本机制。了解植物贮藏组织中碳分配到油类(三酰甘油)中的规律,对于开发新的高产油类作物具有重要的经济和环境意义。本文研究了瞬时表达5个转录因子同源物的叶片对整体基因表达和生理变化的影响WRINKLED1(WRI1)源自不同的物种和组织;拟南芥和土豆(茄属植物tuberosum)种子胚,杨树(杨树trichocarpa茎形成层,燕麦(燕麦属漂白亚麻纤维卷)粒胚乳和坚果苔(香esculentus)块茎薄壁组织,采用农渗法研究烟草benthamiana.
结果
所有WRI1同源基因在叶片组织中表达时诱导油积累。转录组测序显示,所有同源物诱导了相同的一般模式,叶片的基因表达谱从典型的源组织急剧转变为源有限的库样组织:编码磷脂烯醇丙酮酸、脂肪酸和油生物合成质体摄取和代谢酶的转录本上调,编码淀粉降解的转录本也上调。编码光合作用和淀粉合成酶的转录本反而被下调。此外,代表脂肪酸降解的转录本上调,表明脂肪酸降解可能是为了满足碳通道进入脂肪酸合成的增加需求,从而形成一个徒劳的循环。拟南芥表达叶片的RT-qPCR分析WRI1显示了作为关键代谢途径“标记”的转录本在农业浸润后1 ~ 5天的时间趋势。拟南芥表达叶片的叶绿素荧光测定WRI1虽然没有观察到对淀粉含量的影响,但光合作用显著下降。
结论
这一数据首次给出了wr1诱导油合成时叶片组织转录转变的总体观点。这就提供了关于wr1在种子和胚胎发育过程中对全局基因表达的影响的重要信息。这一结果提示了为什么单纯通过wr1的转录激活不能实现叶片组织的高含油量,这对新型高产油料作物的开发具有重要意义。
背景
在不同形式的碳储存中,三酰甘油(TAG;油)是能量密度最大的,与淀粉相比,每重量产生的能量是淀粉的两倍多。由于全球对植物油衍生产品的需求日益增加,不仅用于食品,还用于非食品应用,以减少我们对化石油的依赖,因此对植物存储组织中碳分配到油的调节机制的兴趣已经得到了很多关注,并在开发新的高产油料作物的过程中具有重大的经济和环境重要性[1,2].为了能够用于TAG合成,蔗糖中的碳必须首先通过细胞质或塑料糖酵解途径被转化为丙酮酸,并在某一时刻被导入质体产生乙酰辅酶A (CoA),该辅酶A用于碳骨干合成脂肪酸(FA)。FAs随后被运送到内质网,在那里进行TAG组装[3.].
种子特异性的,丧失功能的突变体wrinkled1的拟南芥酶学分析表明,成熟种子中含油量减少80%,蔗糖含量增加,但淀粉含量没有增加,这削弱了碳在糖酵解中的分配[4].相应的基因,AtWRINKLED1(AtWRI1,At3g54320)编码一个含有两个aptala2 -乙烯响应元件结合蛋白(AP2/EREBP)基序的蛋白,该蛋白是参与广泛发育过程的植物特异性转录因子的标志[5,6].利用微阵列技术进行基因表达分析,进一步揭示了一些下调的基因存在于小麦种子中wri1突变体参与糖酵解和FA合成,而不是TAG组装[7].此外,atwr1已被证明与FA合成和糖酵解相关的几个基因上游区域的AW-box序列结合[8- - - - - -10].
同源染色体,AtWRI1已在其他几种植物的富含油脂的胚胎组织中鉴定为油菜种子(芸苔属植物显著)和玉米(玉米)[11,12].一个同族体AtWRI1这也与油棕(Elaeis guineensis)和红枣(凤凰dactylifera)中果,前者主要储存碳作为油,后者主要储存糖[13].今天,全球植物油生产主要依赖油棕果实和大豆、向日葵和油菜胚胎的TAG存储能力[14].试图揭示油脂积累背后调控机制的研究主要集中在种子的胚胎组织[11,12,15],尽管对果实中果皮和种子胚乳组织也进行了研究[13,16,17].然而,在谷物胚乳和地下块茎或根薄壁等已经高产但通常不含油的组织中,通过基因工程将淀粉或糖的碳分配转化为油,从而产生油的潜力值得进一步关注,因为它具有重要的应用价值。
在生产地下块茎的植物中,只有一种已知的基因型含有大量的油(高达干重的30%),即。黄色nutsedge [18,19].在谷类中,燕麦是唯一已知的能在籽粒胚乳中储存较高油脂量(可达谷物重量的18%)的品种[20.,21].在这两种组织中,与AtWRI1分别在块茎实质和籽粒胚乳发育过程中表达(未发表数据,和[22])。另一个有趣的潜在产油组织来自树木,因为纸浆工业加工了大量木材,其中FAs已经是重要的副产品[23].对多年生植物的研究表明,脂质在转入休眠状态时可在形成层中短暂积累[24,25和the的同义词AtWRI1已从杨树的现有基因组资源中鉴定出[26].因此,作用WRI1定向碳流进入石油合成和积累的类基因可以扩展到包括不同类型的植物组织。
在拟南芥等油籽物种中,油脂积累是胚胎发育和种子成熟过程的一部分,由LEC1、LEC2、FUS3和ABI3等主调控因子调控[15,27].WRI1与这个上游调控网络相连,并被证明是下游靶点,并指定LEC2在FA合成中的作用[10,27].然而,在油棕的中果皮中并没有发现这些上游调控因子的同源物,这表明非胚组织中的调控网络与发育中的种子胚中的调控网络不同[13].在本研究中,我们研究了在油积累诱导的叶片中表达的基因对全局表达的影响WRI1同源物来源于不同的物种和组织(拟南芥和马铃薯种子胚,杨树茎形成层,燕麦籽粒胚乳,和坚果苔块茎薄壁组织),使用农业渗透的瞬时基因表达系统烟草benthamiana.拟南芥叶片中油脂、淀粉含量、RT-qPCR和光合作用测定的时间研究WRI1在浸润后1 - 5天进行进一步表征和补充在浸润后5天观察到的转录转变。
结果与讨论
同源染色体都是WRI1例如
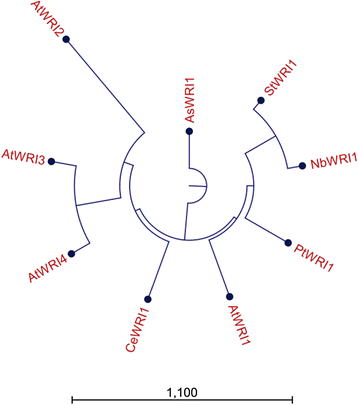
的WRI1本研究使用了来自拟南芥的基因和来自不同物种的另外四个同源物,代表三个双子叶和两个单子叶(完整的cDNA序列,见附加文件)1).这些选择的同源物在不同类型的组织中表达,这些组织在特定的发育或时间阶段都有诱导油积累的作用。拟南芥基因在种子发育过程中在胚胎中表达,与马铃薯的同源基因一样,杨树的同源基因在树的形成层中表达。燕麦同源体在籽粒胚乳中表达,坚果同源体在地下茎块茎中表达。从基于全长cDNA同源性的系统发育树中可以清楚地看到,新WRI1本研究的同源物更类似于拟南芥WRI1而不是拟南芥WRI2 WRI3,或WRI4[28它们彼此之间的相似度比任何其他的同源物都要高(图5)。1).从这个系统发育分析中也可以明显看出WRI1起源于单子叶的物种之间的相似性大于双子叶的相似性WRI1同源染色体。目前研究的wr1同源物和同源物在跨越两个AP2结构域区域的氨基酸水平上具有高度的同一性和相似性,但在n端和c端有高度的差异[29对于本研究的wr1同源物也是如此(附加文件2).然而,在DNA结合结构域之外,不同同源物之间的差异很大,尽管亲缘越近的物种具有更高程度的氨基酸同源性和同源性。这尤其适用于派生的氨基酸序列n benthamiana而且美国tuberosum与来自的同源物相比,wr1的同源物具有82%的同一性c . esculentus哪个只有45%的同一性n benthamiana.下文将对不同的同源词进行命名AtWRI1,StWRI1em,PtWRI1ca,AsWRI1es,CeWRI1tp缩写为起源的物种和组织(分别为胚、形成层、胚乳和块茎薄壁组织)。
所有的wr1样同源物都能诱导叶片中油脂的积累
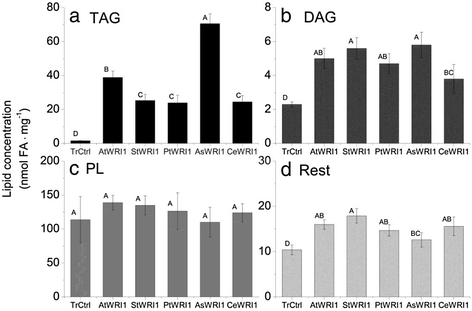
本研究中所有的WRI1同源物都被证明能显著诱导油(三酰基甘油;TAG)的积累,瞬时表达于n benthamianaagroinfiltration(无花果。2额外的文件3.).叶子表达AsWRI1es油分浓度最高(占叶重的2.2%,转化对照为0.05%),其次AtWRI1, StWRI1em,PtWRI1ca,和CeWRI1tp(无花果。2).这一结果表明,尽管不是典型的油密胚型,但wr1的功能在物种和存储组织中高度保守。同时,双酰基甘油的水平增加的叶片表达WRI1同源染色体(无花果。2 b).极性脂质(膜的重要成分)在叶片中含量最高,但在叶片之间没有表现出任何差异WRI1与转换控制的同源物(图。2摄氏度).叶子表示WRI1同源体因褪绿症而受到胁迫,尤其是叶片表达StWRI1em.叶片干物质含量与转化对照差异不显著(12%)AsWRI1es干物质含量较高(16%,见附加文件)4).
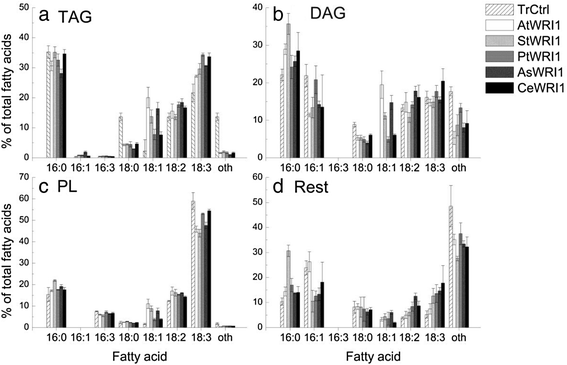
表达后,TAG的FA组成发生变化WRI1与转化对照相比,同系物18:0的比例较低,一般为18:1的比例较高(图。3).在叶片的极性脂质部分,观察到的FA谱差异最大的是表达WRI1同系物的比例总体上增加了18:1,减少了18:3(图。3 c).
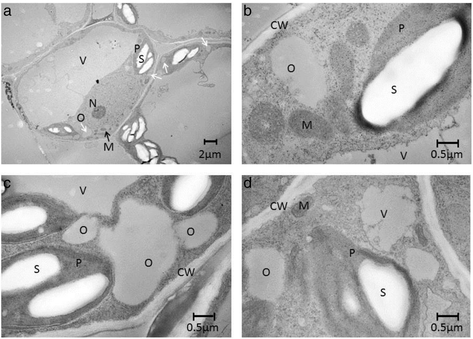
由于油积累量在表达叶中最高AsWRI1es而且AtWRI1,仅对其进行定位和结构性质分析(图1)。4得了)和变换后的对照叶(图。4 d).TEM分析表明,聚集的油主要集中在细胞质中,极有可能以油滴的形式存在,而不是由油体结合蛋白包围的组织明显的油体。这与在转录组数据中没有观察到编码油体蛋白的转录本上调是一致的(见下文)。然而,该方法不能清晰地显示出油量的差异。在已经表达磷脂的拟南芥叶片中,油苷的表达:双酰基甘油酰基转移酶促进油的积累,使叶片dw中有6.4%的油,并改变了结构存储形式为有组织的油体[30.,以及将油脂蛋白与wr1和二酰基甘油转移酶1结合n .烟草叶片含油量更高,dw为15% [31].这证明了将转录因子与参与TAG合成和防止动员的基因结合的潜力,以实现叶片的高含油量。为了澄清,我们的研究目的不是达到最高的油含量,而是绘制单独由WRI1在叶片组织中诱导的转录变化。
转录组测序数据
叶子表达了不同WRI1在农业浸润后5天对同源物和转化的对照组织进行转录组测序,这通常被用作充分短暂基因表达和影响代谢的合适时间[32- - - - - -35].在表达WRI1同源染色体的n benthamiana与转化对照相比,观察到叶片组织中差异表达基因数量的显著差异,但所有5个同源体在核心代谢通路中诱导了相似的模式。的表达StWRI1em叶片中上调转录本和下调转录本差异表达基因数量最多,其次为AtWRI1,PtWRI1ca,AsWRI1es,而且CeWRI1tp(附加文件5).但是,由于表达水平的不同WRI1叶片同源性差异显著(RPKM值CeWRI1tp;29382年,AsWRI1es;25132年,AtWRI1;7419年,StWRI1em;2712年,PtWRI1ca;1597),本研究无法得出不同同源物诱导的种特异性差异基因表达的结论。因此,这里给出的基因表达的折叠变化是表达不同wr1同源物的叶片的平均值。有趣的是,尽管,是不同的表达水平WRI1同源性与叶片含油量和差异表达基因数量均无相关性。事实上,差异表达基因的数量反而与不同基因的系统发育相似性相关WRI1同源染色体的n benthamiana WRI1这表明两者关系最为密切StWRI1em产量最高CeWRI1tp叶片中差异表达基因数量最少。
叶片中差异表达基因的列表(根据所选标准确定,参见方法)WRI1同源物在核心代谢途径上一般有类似的总体模式(差异表达基因在附加文件中发现6).在这里,我们描述了这些基本趋势,其中每个基因的功能对等是根据拟南芥最接近的同源体(at -所有讨论的基因的数量可以在附加文件中找到6).wr1同源体对叶片全局基因表达的影响普遍较强,许多基因表现出高度差异调控。一些基因实际上被“打开”了,从转化后的对照组织中几乎无法检测到,到转化后的对照组织中表达相对较高WRI1渗透到组织中。这说明了使用组成表达的转录因子来实现某一组织的基因表达程序的剧烈变化的强大效果。研究结果还揭示了来自本研究中包括的不同植物物种和组织的wr1同源体在转录调控作用上的显著相似性。值得注意的是,不可能区分在农业浸润5天后观察到的对叶片基因表达的影响是由于wr1表达的直接影响还是间接影响。此外,本研究仅讨论了转录水平的诱导变化,并不能说明这些变化是否也与蛋白质水平相关。
碳指向质体
wr1在拟南芥种子中的导油作用被归因于它增强了糖酵解和FA合成中编码酶的基因表达,而不是在TAG组装中[4,7,10,36].生物素羧化酶载体蛋白、KASI、烯酰-ACP还原酶、ACP、脂肪酸去饱和酶2、质体丙酮酸激酶、质体丙酮酸脱氢酶E1α等基因在拟南芥突变体中表达下调wri1与野生型种子相比,在参与FA合成和糖酵解的一组基因中,在野生型种子发育过程中显示出钟形表达模式[7].相反,参与TAG组装的基因在细胞中没有差异表达wri1种子和野生型基因不属于“钟形组”。对拟南芥种子的研究也表明,种子中几种糖酵解酶的活性大大降低wri1与野生型种子相比[4,37].因此,叶子的表达也就不足为奇了WRI1与转化对照相比,我们研究中的同源物确实有更高的糖酵解和FA合成途径相关基因的表达(图1)。5额外的文件6).WRI1表达还诱导糖酵解细胞器分布中转录水平的转移,碳通量被定向到质体。编码胞质糖酵解上半段酶的基因;蔗糖合酶(除了在叶片表达CeWRI1tp)、依赖于ppi的果糖-6-磷酸(Frc-6P) 1-磷酸转移酶和frc -二磷酸醛缩酶,以及塑料糖酵解的下部;磷酸甘油酸变形酶、烯醇化酶、丙酮酸激酶的α和β亚基以及丙酮酸脱氢酶的所有三个亚基(E1-E3)在表达的叶片中高度上调(平均折叠变化在4到46之间,可塑性磷酸甘油酸变形酶最高)WRI1.磷酸烯醇式丙酮酸质体转位子的转录本也上调(9倍),因此可能确保胞质糖酵解达到磷酸烯醇式丙酮酸,然后摄取到质体进行进一步的塑化糖酵解。有趣的是,这种糖酵解过程中细胞器转移的转录模式与拟南芥种子在发育过程中的细胞器转移非常相似[7],表明这可能是植物组织从光合作用来源向异养油积累转化的标志。这种模式也符合观察到的碳通量下降通过塑料糖酵解的下部从磷酸烯醇丙酮酸向下发展的胚胎wri1拟南芥突变体由13C代谢通量分析[36].
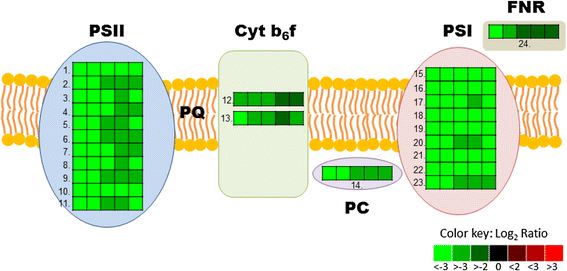
参与中枢碳代谢的差异基因表达热图。给出的值为log2表达叶的RPKM比值WRI1渗透五天后转化为控制组。叶样的顺序表达了五种不同WRI1对于编号为1的盒子,给出了同系物:AtWRI1,StWRI1em,PtWRI1ca,AsWRI1es,CeWRI1tp.缩写:E4P;赤藓糖4-phosphate Sucr;蔗糖、相关;葡萄糖,Frc;果糖,Frc6P;果糖6-phosphate Glc6P;葡萄糖6-phosphate Frc1 6英国石油(bp);果糖1 6-bisphosphate UDP;尿苷二磷酸,Glnt; gluconate, R5P; ribose 5-phosphate, Ru5P; ribulose 5-phosphate, Ru1,5BP; ribulose 1,5-bisphosphate, PGAL; phosphoglyceraldehyde, PGA; phosphoglycerate, DPGA; diphosphoglycerate, PEP; phosphoenolpyruvate, Pyr; pyruvate, OAA, oxaloacetate, Mal; malate, ADP; adenosinediphospho-, S7P; sedoheptulose 7-phosphate, S1,7BP; sedoheptulose 1,7- bisphosphate, Xu5P; xylulose 5-phosphate. Enzymes: 1. Sucrose synthase, 2. PPi-dependent fructose-6-phosphate 1-phosphotransferase, 3. Fructose-bisphosphate aldolase, 4. NADP-dependent glyceraldehyde-3-phosphate dehydrogenase, 5. Phosphoenolpyruvate carboxykinase, 6. Phosphoenolpyruvate carboxylase, 7. Triosephosphate/phosphate translocator, 8. Phosphoenolpyruvate/phosphate translocator, 9. Phosphoglycerate mutase, 10. Enolase, 11. Pyruvate kinase (alpha and beta subunit), 12. Pyruvate dehydrogenase (subunit E1, E2, E3), 13. Malic enzyme, 14. Phosphoglucomutase, 15. ADP-glucose pyrophosphorylase large subunit, 16. Starch synthase 4, 17. β-amylase, 18. Glucose-6-phosphate dehydrogenase, 19. Transaldolase, 20. Triose-phosphate isomerase, 21. Fructose-1,6-bisphosphatase, 22. Sedoheptulose 1,7-bisphosphatase, 23. Ribose-5-phosphate isomerase, 24. Phosphoribulokinase, 25. RubisCO, 26. Phosphoglycerate kinase, 27. Glyceraldehyde-3-phosphate dehydrogenase (subunit A and B), 28. Carboxyl transferase α (CT) subunit of acetyl-CoA carboxylase (ACC), 29. Biotin carboxylase (BC) of ACC, 30. Biotin carboxyl carrier protein 2 (BCCP) of ACC, 31. Acyl carrier protein (ACP), 32. Malonyl-CoA:ACP malonyltransferase, 33. 3-ketoacyl-ACP synthase III (KAS III), 34. 3-ketoacyl-ACP reductase, 35. Enoyl-ACP reductase, 36. 3-ketoacyl-ACP synthase I (KAS I), 37. 3-ketoacyl-ACP synthase II (KAS II)
增加存储合成
丙酮酸脱氢酶将糖酵解产生的丙酮酸转化为乙酰辅酶a,乙酰辅酶a是乙酰辅酶a的双碳前体新创FA在质体中的合成。许多编码FA合成酶的基因在表达FA的叶片中表达上调WRI1同源染色体(无花果。5额外的文件6),与其他研究结果也很一致(见上文)。编码乙酰辅酶a羧化酶(羧基转移酶、生物素羧化酶和生物素羧化酶载体蛋白)、酰基载体蛋白(ACP)、丙二酰辅酶a:ACP丙二酰基转移酶和3-酮酰基-ACP合成酶III (KASIII)、3-酮酰基-ACP合成酶I (KASI)的转录本在表达的叶片中均上调(4 ~ 7倍)WRI1同源染色体。脂肪酸合酶复合体的3-酮酰基- acp和烯酰- acp还原酶的上调幅度非常高(15倍)。一个转录本在表达WRI1在转化对照组织中表达极低的同源物被清楚地注释为KAS,但系统发育分析(基于DNA和氨基酸序列)不允许在拟南芥中明显指定为KASI或II。然而,其他KAS基因在n benthamiana因此这个转录本很可能编码了与拟南芥中KASII酶活性相对应的酶活性。该转录本的高度上调表明了16:0-ACP到18:0-ACP的延伸对增加TAG合成的重要性。
编码TAG装配中酶活性的基因以前通常与wr1调控无关(见上文)。然而,在本研究中发现了一些与TAG组装相关的转录本在叶片上上调WRI1表达式(额外的文件6).一个表达磷脂酰胆碱二酰甘油胆碱磷酸转移酶(PDCT)的转录本在表达磷脂酰胆碱的叶片中上调(5倍)WRI1同源染色体。PDCT通过催化二酰基甘油和磷脂酰胆碱的相互转化,参与了TAG组成的调节[38有趣的是,该编码基因在拟南芥的三突变体中被下调,表达减少WRI1,WRI3,WRI4[28].编码磷脂酶C和D的转录本也上调(平均变化倍数分别为27和2)。这两种脂肪酶(PDCT也是如此)被认为对磷脂酰胆碱转化为二酰甘油很重要[3.].因此,PDCT和/或磷脂酶可能是在诱导油脂积累时,定义TAG中观察到的FA组成变化的酶。此外,一个编码甘油- 3p脱氢酶的转录本上调了8倍,该转录本催化二羟基丙酮合成甘油- 3p (TAG的主干)。拟南芥中甘油- 3p脱氢酶的一个可塑性亚型(At2g40690)先前被证明对质体定位的甘油脂的代谢很重要[39并且可能与TAG合成(发生在质体外)无关。然而,在我们的研究中被上调的甘油- 3p脱氢酶(对应于At5g40610)编码的是另一种塑性亚型[40这可能对TAG主干的供应很重要,因为它与拟南芥种子发育过程中的基因表达有关7),甘油- 3p可以通过一种渗透酶通过质体包膜,这种渗透酶最近被证明对拟南芥胚胎的脂质含量起重要作用[41].有趣的是,在我们的研究中发现的编码可塑性甘油- 3p脱氢酶的基因也被确定为18个假定的玉米靶基因之一(玉米) WRI1 [42].
许多参与氨基酸代谢(合成、转运和蛋白质加工)的基因在表达时存在差异WRI1在我们的研究中同源物(附加文件6),这可能表明与蛋白质储存积累有关的活动增加了。编码液泡分选受体的转录物上调2倍,液泡处理酶的转录物上调1400倍。其他上调的转录本编码膜氨基酸转运蛋白(40倍)和内质网到高尔基囊泡介导的氨基酸转运蛋白(7倍)。编码天冬酰胺合成酶和谷氨酸合成酶的转录本上调(分别为85和4倍),而叶绿体谷氨酰胺合成酶的转录本下调(4倍)。注释为天门冬氨酸和丙氨酸氨基转移酶的转录本上调(2倍)。然而,由于在拟南芥种子发育过程中通路的上调或下调,因此很难完全解析这些差异表达基因的意义[43],这可以与WRI1虽然氨基酸代谢和氮再动员的表达变化也与其他模式一致,如应激或衰老。氨基酸代谢基因表达的变化也可作为叶片组织一般代谢变化的标记物[44].值得注意的是,在过度表达的玉米籽粒中观察到某些氨基酸水平的增加ZmWRI1a[42这表明wr1与贮藏蛋白合成有关。
减少光合作用和淀粉的形成
这项研究的一个重要发现是WRI1叶片中的同源物导致光合作用装置中转录本编码功能的严重下调6),在光依赖反应中(光系统I和II的亚基和支持蛋白,细胞色素b6f复合体,叶绿素,叶型铁氧还蛋白:NADP(H)氧化还原酶,ATP生成复合体的亚基,5 ~ 66倍变化,见图。6)和Calvin-Benson循环的所有三个相的固碳反应(磷酸金激酶,Rubisco,磷酸甘油酸激酶的塑料形式,甘油醛-3-磷酸脱氢酶,磷酸三糖异构酶,磷酸二磷酸醛缩酶,磷酸1,6-双磷酸酶和核糖-5-磷酸异构酶,3- 18倍的变化,见图。5).因此,整个卡尔文-本森周期连同光合器官的光收集和ATP的产生都被下调了(ATP合酶下调了8倍)。与此一致的是,编码质体定位的三磷酸/磷酸转位器的转录本具有底物特异性,允许二羟基丙酮-p、甘油醛- 3p和3-磷酸甘油酸的细胞器交换[45]也被下调(3倍)WRI1表达组织,表明每日光合固定碳从质体流出用于进一步的蔗糖合成的通量下降[46].
参与光合作用的差异基因表达热图。给出的值为log2表达叶的RPKM比值WRI1渗透五天后转化为控制组。叶样的顺序表达了五种不同WRI1对于编号为1的盒子,给出了同系物:AtWRI1,StWRI1em,PtWRI1ca,AsWRI1es,CeWRI1tp.1.集光复合光系统II亚基6,2。光系统II亚基P, 3。光系统II, 4中氧进化复合体的PsbQ亚基。光系统II亚基PsbX, 5。光系统II型I型叶绿素a/b结合蛋白,6。编码光合装置天线系统的捕光叶绿素a/b结合蛋白CP26的光系统II, 7。光系统II 5kd蛋白,8。参与光系统集光复合体II, 9。 Photosystem II BY, 10. Subunit of light-harvesting complex II, 11. Photosystem II type I chlorophyll a/b-binding protein, 12. Rieske FeS center of cytochrome b6f complex, 13. Cytochrome b6f complex subunit, 14. Plastocyanin, 15. Photosystem I subunit E2, 16. Photosystem I subunit F, 17. Subunit G of photosystem I, 18. Photosystem I, subunit H2, 19. Photosystem I subunit K, 20. Protein predicted by sequence similarity with spinach PsaD to be photosystem I reaction center subunit II, 21. Photosystem I reaction center, sub PSI-N, 22. Photosystem I subunit O, 23. P subunit of Photosystem I, 24. Leaf-type ferredoxin:NADP(H) oxidoreductase
酶活性的功能性对偶性变得明显的一个例子是frc -二磷酸醛缩酶,其中一个转录本上调,一个转录本下调(图。5).由于这种酶催化frc -二磷酸(在糖酵解和卡尔文循环中都有发现)和sedoheptulos -二磷酸(只在卡尔文循环中存在)转化为二羟基磷酸,因此可以推测,上调和下调的转录本(分别是最接近的同源物At2g01140和At4g38970)实际上分别代表了编码醛缩酶的基因,这些基因对糖酵解和卡尔文循环都很重要。
编码淀粉合成酶的转录本(ADP-Glc焦磷酸化酶和淀粉合酶4的大亚基——塑性磷酸葡萄糖合成酶)被下调(3 - 7倍),而对淀粉降解很重要的β-淀粉酶的转录本被上调6倍(图。5).之前在拟南芥和油菜的油籽发育过程中观察到β-淀粉酶基因表达和酶活性的增加,这表明淀粉降解在这些物种中产生油积累所需的碳前体的重要性[7,47].淀粉分解和糖酵解的增加也与白杨发育过渡到休眠时形成层转录本水平上FA合成的增加有关[25].
表达的不同WRI1叶片同源物诱导许多参与叶绿体FA去饱和和极长链FA (VLCFA)和角质生物合成的基因下调6).例如,转录本编码FAD5(负责叶绿体中半乳糖脂和硫脂的16:0去饱和),FAD7(负责叶绿体中的去饱和,到半乳糖脂、硫脂和磷脂酰甘油上发现的16:3和18:3 FAs), LACS1 (CER8), LACS2长链酰基辅酶a合成酶相关[48]、CER6(在产生26和28碳FAs中起主要作用[49]),以及一个类似于cer26的HXXXD酰基转移酶(它可能在长度超过30个碳的VLCFA的延伸中起作用[50])。此外,被注释为编码角质修饰因子功能的基因也像CER1一样被下调,这被认为是一种醛脱碳酶[51],以及DCR(缺陷角质层脊),这是一种HXXXD酰基转移酶[52].此外,一个与甘油-3-磷酸酰基转移酶同源的基因被证明对角质生物合成中的酰基转移至关重要[53)被抑制。可能编码P450蛋白的基因与角质层发育的重要功能相对应,如CYP86A2 [54]也是叶片表达中被下调的基因之一WRI1同源染色体。其中,编码FAD5的转录本下调最为严重(53倍),其他转录本则出现4 ~ 7倍的变化。有趣的是,与我们的结果一致的是,编码叶绿体去饱和酶之一FAD7的基因表达减少,之前在叶片组织表达中被观察到AtWRI1[31].在同一份出版物中指出,在TAG合成增加的情况下,表面脂质严重减少。我们的结果表明,他们观察到的表面脂质的减少不是由于对底物的竞争,而是与表面脂质合成相关的转录本的基因表达减少的功能WRI1。
所有这些变化都是由WRI1表达表明,许多编码酶的转录本具有来源组织的典型特征(光合作用、淀粉合成和叶表面脂质合成)被高度下调,表明向光合作用贡献低的异营养组织转变。这也许可以解释观察到的叶片表达的褪绿现象WRI1.可以推测,在种子发育过程中,wr1也介导了光合源功能的抑制。
石油中的碳回收成质体
在像种子这样的聚油汇组织中,光合作用的叶子产生的蔗糖将为生长中的种子提供养分,使碳源源不断地流入贮藏产物的积累中。然而,当表达一个转录因子,直接或间接地不仅诱导油合成,还减少光合作用,可用于增加FA合成的蔗糖很可能变得有限。事实上,编码具有TAG脂肪酶活性的α/β水解酶(产生甘油和游离FAs)的转录本被高度上调(192倍),而甘油激酶(被认为在发芽后生长和叶片衰老过程中对甘油的分解代谢起作用[55]),一些参与FAs β-氧化的酶(酰基辅酶a氧化酶,多功能蛋白,和3-酮酰基辅酶a巯基酶)也上调了3到6倍(附加文件6).此外,一个编码苹果酸合成酶的转录本也被高度上调(78倍),该转录本参与了从降解的FAs中产生苹果酸的紧密相连的乙醛酸循环。为了使苹果酸可以用于FA的合成,苹果酸可以被转移到质体中以换取磷酸盐[56,57在那里它可以被苹果酸酶转化为丙酮酸,或由苹果酸脱氢酶在胞质中转化苹果酸,磷酸烯醇式丙酮酸羧酸激酶产生磷酸烯醇式丙酮酸,可被磷酸烯醇式丙酮酸/磷酸盐转运器运输到质体。在这两种途径中编码酶活性的转录本(磷酸烯醇式丙酮酸羧激酶、磷酸烯醇式丙酮酸/磷酸盐转位器和苹果酶,图。5)上调(3 ~ 9倍)WRI1表达与转化对照相比的叶组织。因此,我们的结果表明,新的水槽组织诱导的叶片WRI1正在经历碳源限制。在没有蔗糖输入的情况下,这可能会触发叶片中TAG和FA降解的转录本的上调,以试图产生可以回收的碳,以苹果酸或磷酸烯醇丙酮酸的形式,进入糖酵解。另一种解释可能是,叶肉细胞中TAG含量的增加,如果没有油体蛋白的适当包装,就更容易动员,从而诱导编码TAG降解酶的转录本上调。这反过来又会产生游离FAs,如果积累起来对细胞是有毒的。58],这可以解释FA降解过程中转录本编码功能的上调。(与此相关,参见下面关于树叶中游离FA水平的时间研究的讨论)。
如前所述,在我们的研究中,叶片总含油量最高(dw为2.2%,图。2)相对于其他转录因子组合稳定表达的研究来说是相对较低的WRI1与其他参与TAG组装和存储的基因(“推拉保护”方法)的研究表明,在大豆中可以达到更高的含油量(dw为15%)n .烟草叶子(31].有趣的是,被选中的发起人AtWRI1该研究的基因表达为拟南芥rubisco的基因,具有日表达规律。然而,光合作用的下调和卡尔文-本森循环的诱导WRI1本研究表明,WRI1本身可能衰减来自rubisco启动子的WRI1的表达。有可能这种看似合理的自我调节效应AtWRI1在该研究中,表达可能是TAG积累高水平而对植物活力没有明显负面影响的另一个关键。
对种子发育具有潜在重要性的其他差异表达基因
许多基因在叶片中存在差异表达WRI1在拟南芥种子发育过程中表达最接近同源物或相应蛋白的表达对种子的正常发育具有重要意义。例如,注释为编码海藻糖-6-磷酸合酶的转录本上调了30倍6).海藻糖-6-磷酸被认为是植物贮藏组织中糖状态的信号,该合成酶对拟南芥胚胎发育至关重要[59- - - - - -61].我们发现了编码功能完全未知的蛋白质的转录本,但在种子发育过程中表达了最接近的拟南芥同源物,例如一个注释为At2g22660 (DUF1399)最接近的同源物的转录本(附加文件)8的高度上调(16倍)WRI1表达组织(附加文件6).
另一个转录本也高度上调(215倍),在拟南芥中最接近的同源物是编码SEUSS的At1g43850, SEUSS是一种对胚胎发育非常重要的转录适配器[62].在拟南芥中,虽然功能未知,且基因家族庞大,很难识别最接近的同源物,但也有附加的转录本被注释为核酸结合或转录因子。只有一个与油体蛋白相关的转录本被油体蛋白上调WRI1最接近的同源物是At1g178101,编码一种推测的水通道蛋白[63].
叶片表达的时间研究AtWRI1
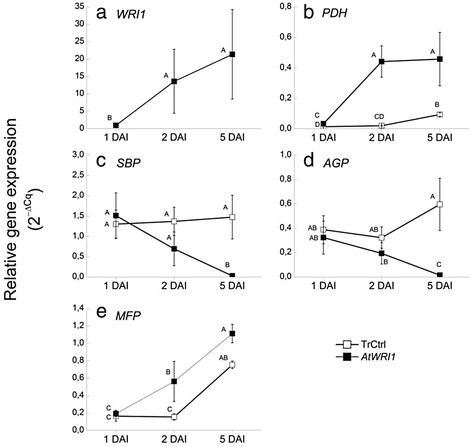
在叶片中观察到的一些由所有不同的WRI1同源物的瞬时表达直接或间接诱导的转录转变是出乎意料的,如对编码光合作用、淀粉代谢和脂肪酸降解的转录本的影响。因此,对瞬态效应的表达AtWRI1在n benthamiana在渗透后1 ~ 5天的时间研究中,对叶片的生理特征进行了更详细的研究。在这个时间研究中,还对未转化对照叶进行了分析,以证实其在生理上与转化对照叶(与对照叶)没有差异p19而且绿色荧光蛋白构造)。的表达水平AtWRI1用RT-qPCR方法测定了一些编码酶的基因子集,这些酶被选为核心代谢途径(糖酵解、卡尔文循环、淀粉合成和脂肪酸降解)的“标记”。7).基因表达水平的确定相对于基因L23,最近被认为是一个合适的参考n benthamiana叶子(64],也来自我们的转录组数据集,被证实在不同治疗之间是稳定的,与目标基因相比,其表达水平在合适的范围内。
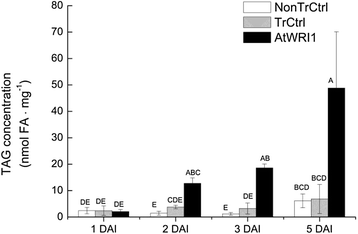
增加AtWRI1表达式和TAG内容来自两个DAI
AtWRI1与转化对照和非转化对照相比,在1个DAI的叶片中几乎检测不到表达,但在2个DAI的叶片中表达已经大幅增加,并且在5个DAI时仅略有增加(但不具有统计学意义)(图1)。7一个).表达叶的三酰甘油含量AtWRI1已经显著增加了2个DAI,即使它继续增加到5个DAI(图5)。8).这让我们了解了叶片中组成表达的转录因子产生的代谢效应有多快。作为糖酵解标志物的丙酮酸脱氢酶基因的表达水平与糖酵解酶的表达模式非常相似AtWRI1(无花果。7 b),这与该基因被认为是atwr1的直接转录靶相一致[10].
叶片光合能力下降
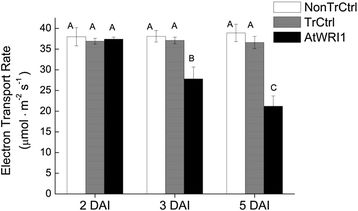
荧光效率测量清楚地表明表达叶片的光合能力下降AtWRI1与三种DAI的非转化叶和转化对照相比(图1)。9),这与我们观察到的许多编码光合作用依赖光反应不同部分的转录本的严重下调(见上文)以及用作卡尔文循环标记的基因(sedoheptulose-bisphosphatase,图)的下调非常一致。7 c).这一结果也验证了转化控制(叶渗透只有p19而且绿色荧光蛋白结构,见方法)在生理上与非转化对照没有区别(图。9).淀粉含量随时间的变化而变化(附加文件9),但没有检测到明显的下降。这意味着之前描述的在五个参与光合作用反应(光收获反应和卡尔文循环)和淀粉代谢(合成减少和降解增加)的DAI上观察到的转录变化在淀粉代谢水平上没有被检测到,至少在研究的时间段内没有。与此一致的是,编码ADP-Glc焦磷酸化酶(催化淀粉合成的第一步)的转录本水平与转化对照只有5个DAI的统计学差异(图1)。7 d).因此,对表达wr1的叶片淀粉水平的影响可能要等到研究的时间段之后(即在5个DAI之后)才会出现。
叶片中游离FAs水平没有增加
如前所述,观察到的参与TAG和FA降解的转录本编码酶的上调可能有几种不同的解释。树叶是否会表达是很有趣的WRI1会产生负面生理影响的游离FAs水平增加[58].这可能是在FA降解过程中观察到转录本编码功能上调的原因。在我们的研究中,从总脂质分析可以认识到,除了极性部分外,所有脂质在表达时都增加WRI1叶五DAI的同源物(图。2).因此,“休息”部分中脂质的增加可能包括游离FAs的增加,即使在薄层色谱板上肉眼无法检测到3.).然而,对叶片中表达的游离FAs的分析AtWRI1在1到5个DAI之间没有显著增加(补充文件10),表明游离游离脂肪酸水平要么没有增加,要么随着游离游离游离脂肪酸的释放而降低,从而保持较低水平。作为FAs β-氧化标志的多功能蛋白基因表达量在叶片表达中显著增加AtWRI1与转换后的控制相比(图5)。7 e),这表明叶片对wr1介导的变化有相对快速的反应。
结论
本研究首次概述了转录因子wr1表达在叶片组织中的转录转变。的表达WRI1来自5个不同物种和叶片组织的同源物都能诱导油积累和基因表达程序的相同普遍变化,编码典型源组织功能的转录本下调,编码典型库组织功能的转录本上调。生理上证实了编码光合功能的转录本的严重下调,并观察到表达叶片的光合能力显著下降AtWRI1.总的来说,这项研究揭示了由WRI1直接或间接引起的影响范围比之前认为的更广。这些变化让人联想到在拟南芥种子发育和成熟的营养阶段之间检测到的转录和代谢转变;在种子发育过程中,从高光合作用贡献、淀粉积累和磷脂烯醇性丙酮酸的胞质代谢,到磷脂烯醇性丙酮酸的光合作用和质体吸收代谢降低的油脂生物合成[7,15,44,47].然而,叶子WRI1表达不仅积累了油,而且转录变化表明编码TAG和FA降解的功能上调了,可能是为了试图将增加的碳需求提供给FA和油的合成,从而创造了一个徒劳的循环。这可以解释为什么高含油量的叶组织不能通过wr1的高转录激活和本构激活来实现。这种反应很可能是由于从源组织到汇组织的不完全转移和缺乏蔗糖导入的诱导。
的表达很有趣WRI1可以诱导叶片中这些较大的转录和生理变化,未来的研究需要从功能上剖析之前认为的一般参与种子发育的wr1和上游转录作用体的不同作用[65].此外,鉴定存在于其他类型的储油植物组织中,已知WRI1在其中起作用的调控网络,将对未来高产油料作物的发展至关重要。
方法
植物材料
所有植物都在控制生长室(Biotron, SLU-Alnarp,瑞典)中在荧光光(200 μmol∙m)下生长−2∙年代−1)及符合下列条件:n benthamiana;15.5/8.5小时明暗光周期,25/20°C,湿度60%。燕麦(燕麦属漂白亚麻纤维卷L,简历。Matilda, Lantmännen, Svalöv,瑞典)在谷物中含有10%的油;16/8小时光/暗,21/18°C,湿度60%。黄色nutsedge (香esculentusl . var。巨大成功Boeck)是在先前描述的气培系统中生长的[18].
基因的克隆
WRI1从籽粒胚乳和块茎实质中分别克隆了燕麦和坚果的同源体。燕麦的胚乳在胚乳油沉积活跃的中期(大约在花后14天)从籽粒中挤压出来(为了减少组织污染,首先从籽粒中去除胚乳和胚层)。在油沉积活跃期间,果苔块茎开始萌发后15天收割[18].使用植物RNA试剂(Invitrogen, Carlsbad, USA)从组织中提取总RNA,从中合成cDNA并使用现有试剂盒进行扩增,使用5 ' -3 ' -RACE方法(用于oat, Clontech, Mountain View, USA)或使用标准程序,使用修饰引物,随后用于454测序(用于nutsedge, Invitrogen, Carlsbad, USA)。基因特异性引物的设计是基于标记的同源转录本序列AtWRI1来自先前的454测序[未发表的结果,22]。的AtWRI1根据现有基因组资源,对马铃薯和杨树的两个同源物(Eurofins, Ebersberg, Germany)进行了综合排序。全身的WRI1同源物分别插入到35S启动子后面的二进制载体(pART27, pK2GW7,或pXZP393),并转化为根癌土壤杆菌(应变GV3101)。基因的构造p19病毒抑制蛋白,改善基因表达和绿色荧光蛋白基因表达的阳性对照和视觉定位,由C. Wood博士提供[35].各自的全长cDNA序列皱纹同源物在默认设置下进行CLUSTAL 2.1多序列比对,并在CLC Main Workbench 7.1.6 (CLC bio,奥尔胡斯,丹麦)上使用邻居连接和自引导构建树形图,在1000个重复中创建圆形子包。
烟草叶的农业渗透
按照Wood等人先前的描述,对叶片(6周龄,进入光照期6小时)进行农渗处理。[35].的WRI1同源物被单独结合p19而且绿色荧光蛋白培养,转化的对照只包含p19而且绿色荧光蛋白.每个植株只使用一个叶片来代表相同的发育阶段(直径约7 cm),每个构建组合使用3个生物重复。所有化学品均来自Duchefa (Haarlem, Netherlands)或Sigma-Aldrich (St Louis, USA)。将约3毫升的培养混合物渗透到叶片中,然后在生长室中培养5天。只对在紫外线下可见的显示GFP表达的叶片区域进行取样(进入光照期6小时),并将其分成两部分;一种用于RNA提取(约150毫克FW),另一种用于脂质分析(约900毫克FW)。用于叶片表达的时间研究AtWRI1,则将表达GFP的叶面积分为三块;一个用于淀粉分析,一个用于RNA提取,一个用于脂质分析。样品在液氮中快速冷冻,并在- 80°C保存,直到进一步分析。在取样之前,使用Mini-PAM叶绿素荧光计(Walz, Effeltrich, Germany)测量叶片的光合能力作为电子传输速率。
脂质分析
叶片样品冷冻干燥,测定干重。提取总脂类[66]和对应10 mg dw的等分用薄层色谱法分离,如前所述用七烷酸甲酯作内标气相色谱法定量[67].
淀粉的分析
干燥的植物材料(80°C 48小时)用臼和杵磨成细粉末。使用总淀粉测定试剂盒(K-TSTA 07/11, Megazyme, Wicklow, Ireland),按照推荐的程序在每个生物重复约20 mg叶子dw上酶法测定淀粉浓度,但首先用80%乙醇在80°C洗涤样品以去除可溶性糖。
透射电子显微镜法
的叶子n benthamiana表达燕麦和拟南芥WRI1同系物被选择用于透射电子显微镜(TEM)。浸渍5天后,进入光照期6 h后采集叶片样品。一个叶片样本用于TEM和脂质分析,以确定如上所述的TAG含量(约为DW的1%)AtWRI1而且AsWRI1叶样品)。在固定介质(2%多聚甲醛(w/v), 2.5%戊二醛(v/v), 0.1 M Sorensen 's磷酸钠缓冲液pH 7.2)下从叶片上切下小片,以减少空气接触。用干燥器反复抽真空将固定剂渗透到叶片中。如前所述,对瞬变电磁法进行进一步处理[68].
RNA提取和测序
根据说明书(Invitrogen, Carlsbad, USA)使用塑料杵在植物RNA试剂中均质提取冷冻叶片材料中的总RNA。使用Experion RNA StdSens分析试剂盒(BioRad, Hercules, USA)测量RNA完整性和浓度,然后从两个生物重复中按比例收集RNA量。总RNA采用DNAse处理(Turbo DNAse, Ambion, Carlsbad, USA),稀释至最终浓度为500-1000 ng∙μL−1,送往Illumina测序(华大基因,深圳,中国)。库的准备工作在华大基因按照常规进行,测序在Illumina HiSeq™2000上完成。
生物信息学和数据分析
从各自的库中通过的高质量阅读被映射到下载的Niben基因组v0.4.4转录本(ftp://ftp.solgenomics.net/genomes/Nicotiana_benthamiana/annotation/Niben044).叶表达的总读数从22,801,552到24,386,511不等PtWRI1ca而且CeWRI1tp,分别用叶子表示另一个WRI1同源物在它们之间有很多读。的映射序列读取的比例n benthamiana叶片的参考基因组从最低的63.8%到最高的79.6%不等AsWRI1es而且StWRI1em,分别。中每个转录本的RPKM(每千碱基读数和百万映射读数)值的两两比较(比率)WRI1与转化对照同源的表达叶组织产生一个包含FDR≤0.001转录本和一个log的初始文件2比≥1)。差异基因表达以对数表示2叶片中RPKM的比值表示WRI1与转换后的控件(log2+3的比率意味着抄本是23.= 8倍高表达)。类的转换控件与显示差分表达式的文本进行比较P-value接近零(<10−307)被提取到一个单独的表(附加文件6与日志2其中还包括所有其他叶子样本的差异表达式值(即使有一个粗体)P-value高于此阈值,log2在附加文件中以斜体显示的比率6).对于本研究中讨论的所有基因,华大基因所做的注释与最接近的同源物进行了补充n benthamiana拟南芥基因的转录[69].
测定WRI1表达,各自WRI1在一个新的参考文件中引入了Niben基因组v0.4.4转录本中用于渗透的序列。Illumina序列读取代表转录本的每个叶片样本表达WRI1随后,使用默认设置下的RNA-Seq分析模块,使用CLC Genomics Workbench 7.0.4 (CLC bio, Aarhus, Denmark)将同源物映射到新的参考文件。
RT-qPCR
从叶片表达时间研究中提取的冷冻叶片样品AtWRI1(三次生物重复)在搅拌机(MM400,雷茨,德国Haan)中使用金属球将1.5 mL塑料管中研磨成细粉末,注意不要让材料在任何时候解冻。提取总RNA, 10 μg dna酶处理(使用与上述相同的试剂盒)。对于cDNA合成,1.2 μg DNase处理的总RNA使用Superscript III First-Strand synthesis Supermix反转录RT-qPCR (Invitrogen, Life Technologies, Carlsbad, CA, USA)。记录了量化BIO-RAD C1000热周期计,排名96实时系统(美国加州)使用Maxima SYBR绿色/火箭qPCR大师混合(2 x) (Thermoscientific,生活技术,卡尔斯巴德、钙、美国),2.5μL(1:10稀释cDNA和0.3μM引物在最后反应体积25μL运行在白色PCR管(流动、SaveenWerner Limhamn,瑞典)使用一个程序和初始95°C 10分钟紧随其后40 95°C的周期15秒,60°C 30年代,30年代的72°C。使用的引物列在附加文件中11向前引物被设计成跨越外显子边界(除了L23而且AtWRI1这在技术上是不可能或没有意义的)来减少基因组DNA的扩增。所有引物均通过琼脂糖凝胶电泳目视检测得到单一PCR产物。C问使用Bio-Rad CFX Manager中的自动单阈值计算值,18-30个周期之间的值被认为是适当的量化窗口。检测PCR产物的熔化曲线,以确定每个特定产物的熔化温度相同。计算转录本的表达水平L23[64根据等式相对表达式= 2——ΔCqΔC在哪里问= C问(目标)- C问(参考)。三个技术重复的平均值,用于每个生物重复。
数据的统计分析
对化学分析和RT-qPCR数据的处理效果进行方差分析(ANOVA),采用一般线性模型(MINITAB 16;Minitab, State College, PA, USA),其中所有因素都是固定的。通过与Tukey 's检验在水平上的两两比较,计算出处理之间的显著差异P≤0.05。必要时,先对数据进行对数变换,然后进行方差分析和Tukey检验,以稳定方差,获得有效统计推断所需残差的近似正态分布。
支持数据的可用性
本研究中使用的序列已经提交到NCBI的序列读取档案(登录号:SRX1079394(转换的控制叶),SRX1079397(叶表达AtWRI1), SRX1079426 (StWRI1em), SRX1079428 (PtWRI1ca), SRX1079429 (AsWRI1es)和SRX1079431 (CeWRI1tp).
缩写
- 机场核心计划:
-
酰基载体蛋白
- 费尔南多-阿隆索:
-
脂肪酸
- 内:
-
Ketoacyl-ACP合酶
- PDCT:
-
磷脂酰胆碱二酰基甘油cholinephosphotransferase
- 标签:
-
三酰甘油
- VLCFA:
-
非常长链的脂肪酸
- WRI1:
-
WRINKLED1
参考文献
- 1.
Vanhercke T, Wood CC, Stymne S, Singh SP, Green AG。用作工业原料的植物油和蜡的代谢工程。植物生态学报,2013;11(2):197-210。
- 2.
Carlsson AS, Yilmaz JL, Green AG, Stymne S, Hofvander P.用新鲜石油取代化石油——用什么?脂质科学与技术,2011;13(7):812-31。
- 3.
Li-Beisson Y, Shorrosh B, Beisson F, Andersson MX, Arondel V, Bates PD等。Acyl-lipid新陈代谢。拟南芥的书。2010;8(10):11。
- 4.
皱纹1:一种新的低籽油拟南芥突变体,缺乏种子对碳水化合物代谢的特异性调节。植物杂志。1998;118(1):91 - 101。
- 5.
Cernac A, Benning C。WRINKLED1编码一个AP2/EREB结构域蛋白,参与控制拟南芥中贮藏化合物的生物合成。植物j . 2004; 40(4): 575 - 85。
- 6.
植物转录因子AP2/EREBP家族研究。生物化学杂志。1998;379(6):633 - 46所示。
- 7.
Ruuska SA, Girke T, Benning C, Ohlrogge JB。拟南芥种子灌浆过程中基因表达的对位网络。植物细胞。2002;14(6):1191 - 206。
- 8.
毛雄K,德田T,绫A,三井N, Kawai T, Tsukagoshi H,等。拟南芥ap2型转录因子皱纹1与脂肪酸合成相关基因近上游保守的AW-box序列结合。植物j . 2009; 60(3): 476 - 87。
- 9.
Baud S, Wuilleme S, To A, Rochat C, Lepiniec L.皱结1在拟南芥糖酵解和脂肪酸生物合成基因转录调控中的作用。植物j . 2009; 60(6): 933 - 47。
- 10.
Baud S, Mendoza MS, To A, Harscoet E, Lepiniec L, Dubreucq B.皱纹1指定了在拟南芥种子成熟过程中叶子叶don2对脂肪酸代谢的调节作用。植物j . 2007;(5): 825 - 38。
- 11.
刘杰,华伟,詹刚,魏峰,王旭,刘刚,等。通过过表达甘蓝型油菜wr1 -like基因增加转基因拟南芥种子质量和含油量。植物生理与生物化学。2010;48(1):9-15。
- 12.
沈斌,Allen WB,郑鹏,李晨,Glassman K, Ranch J,等。ZmLEC1和ZmWRI1的表达增加了玉米种子油的产量。植物杂志。2010;153(3):980 - 7。
- 13.
Bourgis F, Kilaru A, Cao X, Ngando-Ebongue GF, Drira N, Ohlrogge JB,等。碳分配差异显著的油棕和红枣中果皮的转录组和代谢物比较分析。中国生物医学工程学报,2011;29(5):369 - 369。
- 14.
FAOSTAT。ProdSTAT,作物加工。罗马:联合国粮食及农业组织;2012.
- 15.
李国强,李国强。种子油生产的生理和发育调控。脂质学报2010;49(3):235-49。
- 16.
Troncoso-Ponce MA, Kilaru A, Cao X, Durrett TP, Fan J, Jensen JK,等。四种发育中的油料种子的深度转录谱分析比较。植物j . 2011; 68(6): 1014 - 27所示。
- 17.
Tranbarger TJ, Dussert S, Joët T, Argout X, Summo M, Champion A,等。油棕果实中果皮成熟、成熟和脂质和类胡萝卜素代谢功能专业化的调节机制。植物杂志。2011;156(2):564 - 84。
- 18.
Turesson H, martila S, Gustavsson KE, Hofvander P, Olsson ME, Bulow L,等。沙莎草块茎中油脂和淀粉积累的特性:研究非种子组织中油脂储量的新模型系统。中国生物医学工程学报,2010;37(6):694 - 694。
- 19.
Linssen JPH, Cozijnsen JL, Pilnik W. Chufa:一种新的膳食纤维来源。食品与农业学报,1989;49(3):291-6。
- 20.
Banas A, Debski H, Banas W, Heneen WK, Dahlqvist A, Bafor M,等。燕麦籽粒组织中的脂质(燕麦属漂白亚麻纤维卷):含量、沉积时间和脂肪酸组成的差异。实验学报2007;58(10):2463-70。
- 21.
彼得森DM,伍德DF。高油燕麦的组成和结构。中国粮食科学1997;26(1):121-8。
- 22.
Hayden DM, Rolletschek H, Borisjuk L, Corwin J, Kliebenstein DJ, Grimberg A,等。Cofactome分析显示,碳进入石油的通量增强,可用于潜在的生物燃料生产。植物j . 2011; 67(6): 1018 - 28。
- 23.
Norlin LH。高油。选自:乌尔曼的工业化学百科全书。卷35:Wiley-VCH Verlag GmbH & Co.;2002: 583 - 596。
- 24.
杨文华,王文华。植物静息和活性形成层超微结构的比较研究柳树fragilisl .足底。1969;84:239-49。
- 25.
drart N, Johansson A, Baba K, Schrader J, Sjodin A, Bhalerao RR,等。形成层分生组织中活动-休眠周期的环境和激素调控涉及到转录和代谢网络的阶段性调节。植物j . 2007;(4): 557 - 73。
- 26.
Sjödin A, Street NR, Sandberg G, Gustafsson P, Jansson S.杨树基因组综合探索者(PopGenIE):杨树基因组探索的新资源。新植醇。2009;182(4):1013 - 25所示。
- 27.
穆军,谭辉,郑强,付芳,梁勇,张杰,等。叶子叶don1是拟南芥脂肪酸生物合成的关键调控因子。植物杂志。2008;148(2):1042 - 54。
- 28.
To A, Joubes J, Barthole G, Lecureuil A, Scagnelli A, Jasinski S,等。皱折转录因子在拟南芥中调节脂肪酸生物合成的组织特异性。植物细胞,2012;24(12):5007 - 23所示。
- 29.
Ma W, Kong Q, Arondel V, Kilaru A, Bates PD, Thrower NA,等。WRINKLED1它是一种无处不在的油积聚组织的调节剂拟南芥油棕中果皮的胚胎。PLoS ONE。2013; 8 (7): e68887。
- 30.
范健,闫超,张旭,徐聪。磷脂的双重作用:二酰基甘油酰基转移酶:促进拟南芥叶片脂肪酸合成,并将脂肪酸从膜脂转移到三酰基甘油。植物细胞。2013;25(9):3506 - 18。
- 31.
Vanhercke T, El Tahchy A,刘强,周晓瑞,Shrestha P, Divi UK,等。生物质的高能量密度代谢工程:从植物叶子中产生油籽样三酰甘油。植物生态学报。2014;29(2):369 - 369。
- 32.
霍弗R,董磊,Andre F, Ginglinger JF, Lugan R, Gavira C,等。细胞色素P450酶的CYP76家族的香叶醇羟化酶和羟基香叶醇氧化酶的活性,以及工程(seco)环烯醚酮通路早期步骤的潜力。金属底座Eng。2013;20:221-32。
- 33.
刘强,Manzano D, Tanic N, Pesic M, Bankovic J, Pateraki I,等。植物重构中孤雌醇内酯生物合成途径的阐明。金属底座Eng。2014;23:145-53。
- 34.
Petrie JR, Shrestha P, Mansour MP, Nichols PD, Liu Q, Singh SP.利用海洋微藻微单胞菌中具有omega3偏好的酰基辅酶a delta6去饱和酶对植物中omega-3长链多不饱和脂肪酸的代谢工程。金属底座Eng。2010;12(3):233 - 40。
- 35.
Wood CC, Petrie JR, Shrestha P, Mansour下院议员,Nichols PD, Green AG,等。一种基于树叶的检测方法,使用可互换设计原则快速组装多步重组途径。植物学报,2009;7(9):914-24。
- 36.
杨晓东,王晓东,王晓东,等。两种拟南芥种子贮存脂质合成严重受损突变体的代谢通量表型分析。植物杂志。2009;151(3):1617 - 34。
- 37.
波特S,格雷厄姆IA。拟南芥野生型和突变型胚胎碳代谢相关酶活性的时空分析。植物j . 2006; 46(1): 155 - 69。
- 38.
吕超,辛铮,任铮,Miquel M, Browse J.拟南芥ROD1基因编码的一种调节三酰甘油组成的酶。中国生物医学工程学报,2009;36(6):633 - 636。
- 39.
拟南芥二羟基丙酮磷酸还原酶基因suppressor OF FATTY ACID DESATURASE deficiency ency1是甘油脂代谢和系统获得性抗性激活所必需的。植物细胞。2004;16(2):465 - 77。
- 40.
魏勇,周丽娟,周丽娟,张丽娟。拟南芥中甘油-3-磷酸脱氢酶的分子生物学特性。植物生理与生物化学。2001;39(10):841-8。
- 41.
河合H,石川T,三井T,是枝裕和S,山田河合M,大西J-i。拟南芥甘油-3-磷酸渗透酶4定位于质体,参与种子油的积累。植物生物技术,2014,31(2):159 - 65。
- 42.
波弗罗B,波特S,弗诺德V,莫兰V, Py C, Gendrot G,等。重复玉米皱纹1转录因子激活参与种子油生物合成的靶基因。植物杂志。2011;156(2):674 - 86。
- 43.
Winter D, Vinegar B, Nahal H, Ammar R, Wilson GV, Provart NJ。一个“电子荧光象形文字”浏览器,用于探索和分析大规模生物数据集。PLoS ONE。2007; 2 (8): e718。
- 44.
王晓燕,王晓燕,王晓燕,等。拟南芥种子贮存储备的积累:代谢与发育的调控。《拟南芥书》2008;6:e0113。
- 45.
连接质体:质体包膜的转运蛋白及其在连接质体与胞质代谢中的作用。植物学报,2011;62:53-77。
- 46.
王晓燕,王晓燕,王晓燕,等。植物叶绿体中转运蛋白的研究进展。中国生物医学工程学报,2011;32(6):369 - 369。
- 47.
Da Silva PMFR, Eastmond PJ, Hill LM, Smith AM, Rawsthorne S.油菜胚胎发育过程中的淀粉代谢。足底。1997;203(4):480 - 7。
- 48.
卢S,宋T,科斯马DK,帕森斯EP,罗兰O,詹克斯MA。拟南芥CER8编码长链酰基辅酶a合成酶1 (LACS1),在植物蜡和角质合成中与LACS2具有重叠功能。植物j . 2009; 59(4): 553 - 64。
- 49.
Fiebig A, Mayfield JA, Miley NL, Chau S, Fischer RL, Preuss D.与CUT1相同的CER6基因的改变对花粉和茎表面长链脂质含量的影响是不同的。植物细胞。2000;12(10):2001 - 8。
- 50.
Pascal S, Bernard A, Sorel M, Pervent M, Vile D, Haslam RP,等。拟南芥的cer26突变体和cer2突变体一样,在超长链脂肪酸延伸过程中受到特别的影响。植物j . 2013; 73(5): 733 - 46所示。
- 51.
王晓燕,王晓燕,王晓燕。拟南芥蜡质生物合成和花粉育性相关基因CER1的分子分析。植物细胞。1995;7(12):2115 - 27所示。
- 52.
Panikashvili D, Shi JX, Schreiber L, Aharoni a .拟南芥DCR编码一种可溶的BAHD酰基转移酶,是角质聚酯形成和种子水化特性所必需的。植物杂志。2009;151(4):1773 - 89。
- 53.
李勇,裴松F,古志强,李志强,李志强,李志强。角质生物合成所需的酰基转移酶的鉴定及亚蛋白样角质单体的合成。中国生物医学工程学报,2007;29(6):369 - 371。
- 54.
肖F, Goodwin SM,肖Y,孙铮,Baker D,唐X,等。拟南芥CYP86A2抑制丁香假单胞菌III型基因,是角质层发育所必需的。EMBO j . 2004; 23(14): 2903 - 13所示。
- 55.
Eastmond PJ。甘油不敏感拟南芥突变体:gli1幼苗缺乏甘油激酶,积累甘油,更能抵抗非生物胁迫。植物j . 2004; 37(4): 617 - 25所示。
- 56.
在蓖麻种子胚乳发育过程中,苹果酸盐/无机磷酸盐交换转位器跨白质包膜输入碳以合成脂肪酸的证据。植物杂志。1997;114(3):851 - 6。
- 57.
Neuhaus HE, Emes MJ。质体的非光合代谢。植物生理学报2000;51:11 11 - 40。
- 58.
谢弗我。脂肪毒性:当组织过度进食。中华医学杂志。2003;14(3):281-7。
- 59.
Eastmond PJ, van Dijken AJ, Spielman M, Kerr A, Tissier AF, Dickinson HG,等。海藻糖-6-磷酸合成酶1催化了海藻糖合成的第一步,是拟南芥胚胎成熟所必需的。植物j . 2002; 29(2): 225 - 35。
- 60.
李志强,李志强,李志强。拟南芥海藻糖-6-磷酸合成酶1突变体胚胎发育延迟与细胞壁结构改变、细胞分裂和淀粉积累减少有关。植物j . 2006; 46(1): 69 - 84。
- 61.
戈麦斯LD,波特S,格雷厄姆IA。海藻糖-6-磷酸合酶在拟南芥胚胎发育中的作用。生物化学学报2005;33(Pt 1): 280-2。
- 62.
包F, Azhakanandam S, Franks RG。SEUSS和SEUSS- like转录适配器调控拟南芥花和胚胎发育。植物杂志。2010;152(2):821 - 36。
- 63.
朱丽薇P,鲁克斯E, d 'Andrea S,达万图尔M,内格罗尼L,翟维M,等。拟南芥WS生态型油体的蛋白质组成。植物生理与生物化学。2004;42(6):501-9。
- 64.
刘东,石磊,韩超,于娟,李东,张勇。病毒感染基因表达研究的内参基因验证烟草benthamiana使用实时定量PCR。PLoS ONE。2012; 7 (9): e46451。
- 65.
Santos-Mendoza M, Dubreucq B, Baud S, Parcy F, Caboche M, Lepiniec L.拟南芥种子发育和成熟的基因调控网络。植物j . 2008; 54(4): 608 - 20。
- 66.
布莱EG,戴尔WJ。一种快速提取纯化总脂的方法。生物化学与物理学报。1959;37(8):911-7。
- 67.
Leonova S, Shelenga T, Hamberg M, Konarev AV, Loskutov I, Carlsson AS。燕麦品种和野生种的油成分分析。农业食品化学,2008;56(17):7983-91。
- 68.
Leonova S, Grimberg Å, martila S, Stymne S, Carlsson AS。燕麦(Avena sativa L.)是一种富含胚乳油的谷物,在萌发过程中脂质储备的调动。科学通报,2010;61(11):3089-99。
- 69.
Lamesch P, Berardini TZ, Li D, Swarbreck D, Wilks C, Sasidharan R,等。拟南芥信息资源(TAIR):改进的基因注释和新工具。核酸学报,2012;40(D1): D1202-10。
确认
我们赞赏基因构建的贡献p19而且绿色荧光蛋白来自克雷格·伍德博士(澳大利亚CSIRO)。John Ohlrogge教授(美国密歇根)因合作对坚果块茎进行了454次测序而获得表彰,Kerstin Brismar教授在TEM方面提供了帮助。这项工作得到了SSF(瑞典战略研究基金会)、VINNOVA(瑞典政府创新系统机构)和FORMAS(瑞典环境、农业科学和空间规划研究委员会)的经济支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
本研究采用PH进行设计,实验设置由PH、AC和ÅG进行规划和执行。基因的分子克隆由AC、PH、ÅG和RB完成。用PH进行序列比对。其他实验程序、提取和分析用ÅG、PH和AC进行。TEM和SM对照片进行解释。PH和ÅG在AC的帮助下对转录组数据进行解读并起草稿件。所有作者阅读并批准了最终稿件。
附加文件
额外的文件1:
完整的cDNA序列WRI1同源染色体。序列来自马铃薯胚胎(StWRI1em)、杨树茎(PtWRI1ca)、燕麦胚乳(AsWRI1es)、及花生薄壁(CeWRI1tp).(多克斯15 kb)
额外的文件2:
wr1同源物的氨基酸同源性。比较拟南芥(AtWRI1、3和4)、杨树茎(PtWRI1ca)、马铃薯胚(stwr1em)、燕麦胚乳(aswr1es)、坚果块茎实质(cewr1tp)和烟草(nbwr1)中跨越AP2/EREBP dna结合结构域的WRI同源物。黑色表示相同,阴影表示相似。与拟南芥的wr1序列进行同源性测定。(JPEG 236 kb)
额外的文件3:
薄层色谱板照片。瞬时表达的叶片总脂质提取物的脂质等级为10mg dwWRI1来自拟南芥胚(AtWRI1)、马铃薯胚(StWRI1em)、燕麦胚乳(AsWRI1es)、杨树茎(PtWRI1ca)、及花生薄壁(CeWRI1tp)渗入后五天。红色箭头表示极性脂类(PL),二酰基甘油(DAG)和三酰基甘油(TAG;油)。结果来自三次生物重复。(TIFF 181 kb)
额外的文件4:
叶片干物质含量。叶片鲜重的干物质% dw瞬时表达WRI1来自拟南芥胚(AtWRI1)、马铃薯胚(StWRI1em)、燕麦胚乳(AsWRI1es)、杨树茎(PtWRI1cm)、及花生薄壁(CeWRI1tp)渗入后五天。结果为三次生物重复的平均值±标准差。根据Tukey 's检验,在P≤0.05水平,字母区分显著不同的平均数。(JPEG 2142 kb)
额外的文件5:
差异表达基因数(DEGs)。叶片表达上调和下调的基因WRI1来自拟南芥胚(AtWRI1)、马铃薯胚(StWRI1em)、燕麦胚乳(AsWRI1es)、杨树茎(PtWRI1ca)、及花生薄壁(CeWRI1tp)与渗入后5天的转化对照进行两两比较。(JPEG 4995 kb)
额外的文件6:
日志2差异表达基因的比值和RPKM值。在叶片表达中被差异调节的基因表(根据选择的标准,参见材料和方法)WRI1来自拟南芥胚(AtWRI1)、马铃薯胚(StWRI1em)、燕麦胚乳(AsWRI1es)、杨树茎(PtWRI1cm)和花生块茎薄壁组织(Ce)与转化对照进行两两比较。基因被分为功能类别(CAR;碳水化合物,CYT;细胞色素,DEF;国防、FAS;脂肪酸合成,GLY;糖酵解,唇;脂质,绝笔;线粒体呼吸,另外一些;其他基因,越南河粉; photosynthesis, PPP; pentose phosphate pathway, STA; starch, STR; stress, TRA; transport, TRF; transcription factors, UNK; unknown. At numbers represent closest Arabidopsis gene homologs ofn benthamiana来自TAIR数据库的文本。(XLSX 329 kb)
额外的文件7:
拟南芥At2g40610基因表达谱。根据设置为绝对模式的拟南芥eFP浏览器发育系列的输出图像,研究不同组织的表达模式。(JPEG 84 kb)
额外的文件8:
拟南芥At2g22660 (DUF1399)基因表达谱根据设置为绝对模式的拟南芥eFP浏览器发育系列的输出图像,研究不同组织的表达模式。(JPEG 91 kb)
额外的文件9:
表达叶片淀粉浓度的时间研究AtWRI1.浓度以渗透后1 - 5天干重(dw)的百分比表示。TrCtrl转换控制。结果为三次生物重复的平均值±标准差。根据Tukey 's检验,在P≤0.05水平,字母区分显著不同的平均数。(JPEG 2863 kb)
额外的文件10:
叶片表达中游离脂肪酸浓度的时间研究AtWRI1.在渗透后1 - 5天内,每毫克干重给予nmol脂肪酸(FA)。结果为三次生物重复的平均值±标准差。根据Tukey 's检验,在P≤0.05水平,字母区分显著不同的平均数。(JPEG 1958 kb)
额外的文件11:
RT-qPCR分析中的引物。(多克斯14 kb)
权利和权限
开放获取本文根据创作共用署名4.0国际许可协议发布(http://creativecommons.org/licenses/by/4.0),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于这篇文章
引用这篇文章
Grimberg,。,C一个rlsson, A.S., Marttila, S.et al。转录转换中烟草benthamiana通过来自不同物种和组织的皱纹1同源物诱导叶片合成油脂。BMC植物杂志15日,192(2015)。https://doi.org/10.1186/s12870-015-0579-1
收到了:
接受:
发表:
关键字
- 种子发展
- 脂肪酸合成
- 酰基载体蛋白
- 磷酸甘油酸酯变位酶
- 脂肪酸降解