摘要
背景
RNA胞嘧啶残基转录后甲基化为5-甲基胞嘧啶(m5.C)是一个重要的修饰,调节RNA代谢,并发生在真核生物和原核生物。然而,到目前为止,还没有对m5.C网站已在植物中进行。植物提供了一个独特的比较系统,用于调查M的起源和演变5.C,因为它们含有三种不同的基因组,细胞核,线粒体和叶绿体。在这里,我们使用RNA的亚硫酸氢盐转化结合高通量Iilumina测序(RBS-SEQ)以识别M的单核苷酸分辨率5.包括单细胞藻类在内的六种不同物种的所有三个亚细胞转录组的非编码核糖体rna和转移rna的C位点Nannchloropsis Oculata,宏观藻类Caulerpa Taxifolia以及多细胞高等植物拟南芥那Brassica Rapa.那Triticum杜伦姆和银杏毕洛巴巴.
结果
使用植物模型拟南芥,我们鉴定了39个高度甲基化的m5.C位点预测核tRNAs和7 m的结构位置5.来自核、叶绿体和线粒体转录组的rnas中的C位点。tRNAs和rnas的核苷酸位置和甲基化百分比均为m5.C位点在所有被分析的物种中都是保守的,从单细胞藻类N. Oculata.多细胞植物.有趣的是,编码trna的线粒体和叶绿体缺乏m5.C in.A. Thaliana.这通常是保守的植物界.这表明,在动物和植物中,细胞器甲基化是独立进化的,因为动物线粒体trna具有m5.C网站。在这里,我们将5名RNA 5-甲基胞嘧啶家族的成员表征拟南芥扩展TRDMT1和NOP2A/OLI2的功能表征。我们证明,核tRNA的甲基化需要两个进化上保守的甲基转移酶,TRDMT1和TRM4B。trdmt1 trm4b.双突变体对抗生素潮霉素B过敏,证明了TRNA甲基化在调节翻译中的功能。另外,我们证明核大亚基25s rRNA甲基化需要保守的RNA甲基转移酶NSUN5。我们的结果还表明了至少两个NOP2副病毒的功能冗余拟南芥。
结论
我们的数据表明,非编码RNA甲基化在王国中广泛发生和保存植物界,提示这种转录后修饰具有重要和高度保守的作用。
背景
5-methylcytosine (m5.c)是在DNA和RNA上发生的修饰。在DNA,M5.C因其易于检测而被广泛研究,DNA甲基化在真核生物中的功能作用已被证明可用于转座子和转基因的转录沉默、基因组印记和X染色体失活(综述于[1])。而DNA似乎缺乏其他修饰[1[RNA有100多种不同的修饰,这些修饰已经在不同的三个域中的不同物种中鉴定[2-4.].转移RNA(TrNAS)的修饰被稳定稳定二次结构的修饰,影响密码子鉴定和TRNA氨基酰化[5.-8.].这些修改,m5.TRNA中的C站点通常在可变区和反致循环中识别。响应于氧化应激,m5.C已被证明在酵母中动态调制[9.那10)和m5.C在控制条件下调节小鼠的TRNA稳定性和翻译方面发挥着重要作用[11].此外,M.5.C是果蝇热应激和氧化应激条件下tRNA稳定所必需的[12].在核糖体RNA(rRNA),m5.C站点被认为在翻译中发挥作用,RRNA处理和结构[13-15].
在真核生物中,转移RNA m5.C甲基化由两个RNA甲基转移酶(RMTASES)催化;第一类RMTase分别称为TRNA特异性甲基转移酶4(TRM4)或NOP2 / SUN域蛋白2(NSUN2),分别在酵母和动物中[11那16那17].NSUN2人类的突变与遗传性智力残疾有关,这被认为是由核糖核酸血管生成素对trna切割增加介导的[18-22].在小鼠中,nsun2突变体较小,并且具有降低的男性生育率,并揭示了干细胞自我更新和分化中的作用[23那24].使用系统发育分析,两个推定的TRM4 / NSUN2副病虫剂,TRM4A和TRM4B,都是在拟南芥基因组[25那26但是,这些基因尚未在植物中表征。第二类真核rmtase;转移RNA天冬氨酸甲基转移酶1(TRDMT1),也称为DNA甲基转移酶2(DNMT2),已显示为甲基化物TRNA果蝇那拟南芥和HOMO SAPIENS..在植物中,只有1米5.C网站在TRNA中ASP(GTC)在位置C38已被显示为Trdmt1的甲基化[27].尽管果蝇,rabidopsis trdmt1突变体在标准实验室条件下出现野生型,斑马鱼在TRDMT1中缺乏体积减少,特定组织的分化受损减少[27那28].在核编码真核Trnas,m5.C甲基化通常被报道在六个胞嘧啶位置;C34、C38、C48、C49、C50及C72 [2那3.那18那29-31].在MitoCondrialedededed Trnas上发现甲基化在若干TrNA上的线粒体编码的TrNA上发现了位于C48,C49和C72的几个TrNA上的母牛[29那32].然而,先前尚未报道叶绿体编码的TrNA和RRNA的甲基化状态。
与trna一样,核糖体rna高度保守,在翻译中发挥重要作用。核糖体由两个亚基组成,大亚基(LSU)和小亚基(SSU)。LSU在真核生物中由三种rRNA组成,在原核生物中通常有两种rRNA,而SSU在原核生物和真核生物中都只包含一种rRNA [33-35].rRNA序列是保守的,尽管rRNA物种的名称通常不是。虽然rRNA甲基化在植物中还没有被研究过,但一些甲基化的位置和酶的要求5.选择有机体的C站点已经确定。例如,人核LSU RRNA(28s和5s)甲基化。28s rRNA在C3782和C4447中含有两个位点,而5S rRNA在C92甲基化[30.那31那36].正交酵母LSU 25s rRNA含有C2278和C2870的两个位点[13那15),大肠杆菌LSU 23S rRNA at C1962 [37]和C967的SSU 16S rRNA [38]及C1407 [39].仓鼠线粒体SSU 13S rRNA也含有1 m5.C网站[40],同样,小鼠线粒体SSU 12S rRNA在C911位点被甲基化[41].在真核生物中已经鉴定出两种甲基化核糖体RNA的rmtase是NOP2 (nucleolar protein 2)和RCM1 (rRNA cytosine methyltransferase 1)。在LSU 25S rRNA中,NOP2和RCM1的甲基化位置分别为C2870和C2278酿酒酵母[13那15].正确的RRNA生物合成和加工需要酵母NOP2 [14),nop2突变体是致命的。相比之下,酵母RCM1.突变体是可行的,然而它们对大茴香霉素过敏,这被认为是由于rRNA甲基化引起的结构变化[15].而RCM1同源物只有一个拷贝,在这里称为NSUN5拟南芥,有三个谬误NOP2在拟南芥基因组,oli2(nop2a)那NOP2B和NOP2C[26].其中的一个,NOP2A/OLI2在涉及细胞尺寸补偿的基因的前瞻性遗传筛查中鉴定出[42].甲基化活性或m5.C位点是由三个拟南芥NOP2 Paralogs和NSUN5是未知的。最近鉴定出与细菌FMU rRNA mTase相关的另一种RMTase拟南芥[43].拟南芥rnmt(RNA甲基转移酶)突变体降低了整体RNA甲基化,表明它可能甲基化高度丰富的rRNA转录本。
与动物不同,植物细胞含有三种进化的不同基因组;核,线粒体和叶绿体,从而为调查M提供独特的模型5.C催化和生物学功能。线粒体是一种引人注目的例子,即原核转化机械如何适应从真核转化机械作为核,需要进口到线粒体中的真核特征,因为线粒体不再具有完全补充TRNA [44那45].植物中的tRNA序列是动态的,因为每个tRNA isodecoder都有多个副本,这些副本可能在基因组中丢失,或从叶绿体和线粒体基因组转移到细胞核[46].这引起了核编码的TRNA具有细胞器样序列的事件。尚不清楚这些“转移”TrNAs在整合到新的基因组后表达,因为尚未进行植物中的TRNA表达的系统分析[47-49.].
在该研究中,通过将RNA亚硫酸氢盐转化与第二代Illumina测序(RBS-SEQ)组合,描述了植物RRNA和TrNA中转录后修饰的胞嘧啶残基的单核苷酸分辨率。我们报告了新型改性胞嘧啶的鉴定A. Thaliana.这些位点依赖于rmtase TRDMT1和之前未描述的拟南芥TRM4B。此外,我们在核网络中显示这些修改的网站通过单细胞藻类的演变保守Nannochloropsis oculata多细胞高等植物。有趣的是,没有米5.C位点在拟南芥叶绿体或线粒体tRNAs,与动物线粒体tRNAs相反。tRNA甲基化在调节翻译中的作用被证明如下trdmt1 trm4b.双突变体对抗生素潮霉素B过敏。此外,我们识别核,线粒体和叶绿体RRNA中的新型改性胞嘧啶。在拟南芥核lsu 25s rrna,m5.C2268位点的C依赖于NSUN5,但C2860位点的甲基化不依赖于任何特定的NOP2同源物拟南芥.此外,负责tRNAs甲基化的RMTase并非rRNA甲基化的必要条件,反之亦然,这表明RMTase家族的功能专门化。这些数据是第一次对tRNA和rRNA修饰的高分辨率描述Plantae.并创造了一个平台来开始理解非编码RNA甲基化的功能、意义和进化。
结果
检测和富集转录的TRNA拟南芥
识别转录的TRNAA. Thaliana.我们实施了一项两步的方法。首先,构建了TRNA异基分析物共有列表以促进表达分析和第二种,与Illumina深序联合的TRNA富集方案类似于最近描述的那些[50.].采取了TRNA IsodeCoder共有方法,因为存在超过640个预测的TRNA基因A. Thaliana,源自核,线粒体和叶绿体基因组通常具有多个相同的异代序列,使得将Iilumina序列分配给单独转录的TRNA基因座挑战。使用这种共识方法,预测A. Thaliana.TRNA被解析为100个参考共识序列(附加文件1:表S1)。
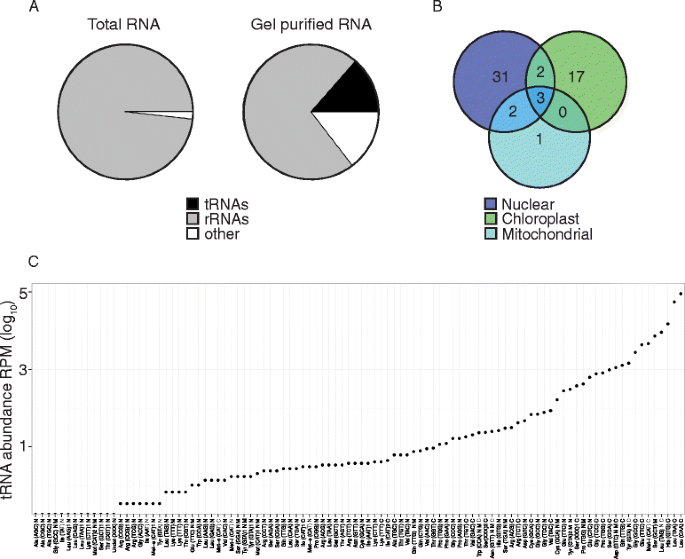
为了鉴定转录的tRNA,我们首先使用总RNA构建Illumina文库,对文库进行深度测序,并将测序reads与我们的tRNA共识列表进行比对。只有0.0007%的序列读取与tRNAs使用传统方法对齐。因此,我们开发了一种在Illumina测序之前富集tRNA的方法,类似于最近描述的方法(见Methods)。简单地说,总RNA在聚丙烯酰胺凝胶上分离后,与tRNAs相对应的区域被切除,RNA被纯化,然后亚硫酸氢盐处理或直接作为构建库的模板。使用这种富集方法,与使用总RNA相比,观察到与trna对齐的序列读值增加了近2万倍(图。1).使用我们的RBS-SEQ数据观察来自所有三种基因组,核,叶绿体和线粒体的100种异黄素共识序列中的56种的表达。其中,七个TRNA序列与两个或更多个基因组尤其对准(图。1 b).从我们的RNA-seq数据中可以观察到广泛的tRNA转录本丰度,其中叶绿体和线粒体来源的tRNA的丰度最高(图2)。1 c).这很可能反映了每个叶肉细胞的质体和线粒体细胞器的高拷贝数。
有效的检测拟南芥聚丙烯酰胺凝胶纯化和RNA-SEQ的TRNA。一种从总RNA或凝胶纯化的RNA读取的Illumina测序读数的比较显示出分别从0.0007至13.58%的读取映射的读取。显示了来自一个代表性生物复制的数据。B.维恩图显示从细胞核、叶绿体和线粒体基因组中检测到凝胶纯化的tRNA一致序列。在我们的分析中,100个已知的tRNA共识序列中鉴定出56个。重叠的圆圈表明trna可能起源于一个以上的基因组(N= 3个生物复制)。C一致trna的表达水平广泛,其中叶绿体(C)编码序列的表达水平高于核(N)和线粒体(M)序列(1个重复)。其中3个trna具有未确定的反密码子序列,如(XXX)所示。少数等译码器与多数等译码器具有不同的序列,由反密码子后的数字1或2指定。RBS-seq用于(一种) 和 (B.)和RNA-SEQ用于(C)
RBS-seq分析鉴定5-甲基胞嘧啶(m5.c)TRNA中的网站A. Thaliana.
识别M.5.在单核苷酸分辨率下的TRNA中的C位点,我们在野生型中进行了亚硫酸氢盐(BS)转化富集的TRNA拟南芥和an结合在体外Renilla Luciferase (R-Luc) mRNA BS conversion control缺失m5.C.完全BS转化R-LUC控制的结果在没有胞嘧啶中,并用作重要的内部控制。在BS转换后,Illumina文库被构建,深序并对齐在Silico.将BS转化,胞嘧啶到胸腺嘧啶,内源性拟南芥tRNA一致序列和R-Luc对照。为了使BS转换样品通过我们的质量控制标准,R-Luc控制要求在R-Luc mRNA BS转换控制中的178个胞嘧啶中至少98%的转化率(附加文件)1:图S1A)。通过R-Luc质量控制后,我们测定了整体内源胞嘧啶丰度。在所有链的RBS-seq文库中,总体内源性胞嘧啶丰度小于~ 1%,而非bs处理的RNA-seq样本的胞嘧啶丰度为~ 22%(附加文件)1:图S1B,S1C)。这些结果表明,使用我们的方法,RNA胞嘧啶的二硫酸氢盐转化高效。
识别M.5.核、叶绿体和线粒体中的C位点拟南芥trna,我们将Illumina的RBS-seq读数与在Silico.转换的tRNA共识列表。在Silico.转化包括将所有胞嘧啶转化为胸腺嘧啶。5-甲基胞嘧啶位点被鉴定为抗亚硫酸氢盐转化的胞嘧啶。这些地点应作为候选者m注明5.C位点,作为其他类型的改性胞嘧啶也可能抵抗亚硫酸氢盐转化[29那51.].我们采用的阈值为至少5个reads,与单个tRNA一致,且至少20%的甲基化。利用这些参数,我们从总共56个tRNAs中鉴定出24个甲基化tRNAs和32个未甲基化tRNAs(图2)。2额外的文件1:表S2)。有趣的是,发现只发现核编码的TRNA包含m5.C位点,而非甲基化TrNA被所有三种基因组编码。
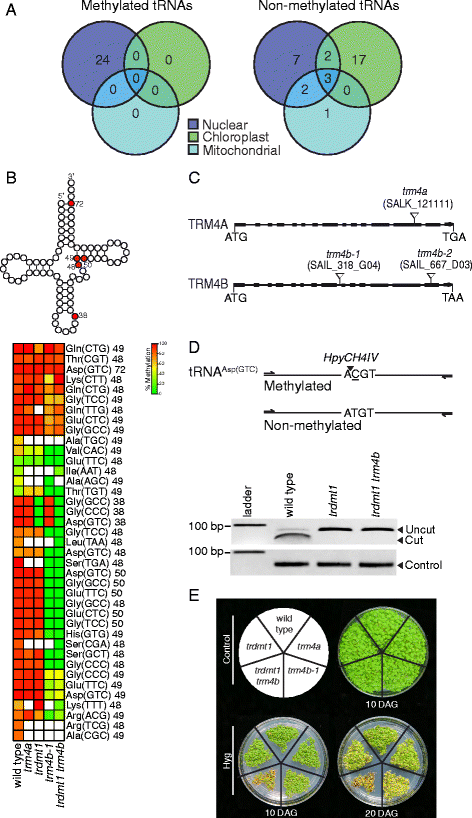
TRDMT1和TRM4B甲酸酯拟南芥核编码转移RNA。一种甲基化和非甲基化tRNAs的基因组起源。甲基化的tRNAs仅从核基因组中检测到(3个生物重复)。B.以上:三宝叶代表二次结构的TRNA表明为红色,五种胞嘧啶位置在野生型中甲基化。下面:Heatmap显示在野生型核网络中检测到的所有细胞瘤的百分比,和突变体trdmt1那trm4a那TRM4B-1和trdmt1 trm4b.使用RBS-seq。胞嘧啶的位置显示在tRNA等解码器的旁边。白框表示覆盖小于5个读数的胞嘧啶位置。野生型3生物复制,突变N= 1)。C基因组的结构trm4a和trm4b在外显子(填充盒)中显示T-DNA插入(三角形)的突变体。D.BS处理后TRDMT1在C38位置的RNA甲基化分析ASP(GTC)模板。以上:PCR扩增产物的限制性图,显示甲基化和非甲基化模板的预期消化模式。以下:HPYCH4IV的PCR扩增产物的切割证实了野生型中的C38甲基化,而不是非甲基化的C38trdmt1导致HPYCH4IV限制性位点丢失。加载控制是未消化的PCR产物。E.湿霉素B胁迫试验。Trdmt1 trm4b双突变体,在较小程度上,TRM4B-1与对照相比,突变体显示在发芽(DAG)后10天和20天对潮霉素B(HYG)的敏感性增加
胞嘧啶甲基化拟南芥核trna的含量在23 ~ 100%之间,3个生物复制之间一致。39米5.在5个结构位置鉴定C位点,并在置位C38,C48,C49,C50和C72处的代表性TRNA二级结构上示出(图。2 b).这些位点的甲基化与其他非植物物种的观察结果一致[2那3.那18那29-31].接下来,我们检查了个体TRNA异料中甲基化的模式。在仅1个结构位置甲基化鉴定十七种TRNA,而另一个剩余的7个TNAS含有2-5米5.每个tRNA的C个位点。最频繁的甲基化位点对应于C48、C49和C50的结构位置,这表明该区域的甲基化可能对tRNA的结构或稳定性很重要。tRNAASP(GTC)是甲基化程度最高的tRNA,也是唯一一个在所有5个结构位置都存在甲基化的tRNA。tRNA的结构ASP(GTC)可能需要这些额外的m5.C位点具有更大的稳定性或抗裂解性。
识别TRM4B和TRDMT1受依赖的m5.核网络中的C站点
确认m5.C站点拟南芥核trna和确定甲基化所需的RMTases,我们确定了预测的突变体拟南芥对RMTases TRM4和TRDMT1的同源物进行RBS-seq检测。
两个TRM4谬误在拟南芥基因组[25],我们称之为TRM4A和TRM4B。本文分别突变TRM4A或TRM4B.被鉴定,纯合突变体,其特征在于半定量RT-PCR以证明无效表达(图。2摄氏度和额外的文件1:图S2C)和显示突变体是最可能的功能损失。突变体trm4a和两个分离的T-DNA突变体TRM4B.;trm4b-1和trm4b-2在土壤上生长,呈现与先前特征的RMTase突变体类似的野生型相似trdmt1[27](附加文件1:图S2A)。为了测试TRM4A和TR4MB的发散功能,m5.在突变体中测定了trna的C单核苷酸谱(图。2 b).在trm4a, 他们5.C型材与野生型相同,表明无需检测到的TRNA的甲基化不需要TRM4A。相反TRM4B-1和trm4b-2,与野生型相比,共有18个位点没有检测到甲基化,7个位点甲基化减少(图2)。2 b和额外的文件1:图S3A)。甲基化或未降低甲基化的位点对应于与动物研究一致的结构位置C48,C49和C50 [2那3.那18那29-31].
通过序列比对,进一步研究TRM4A和TRM4B的功能基序,发现TRM4A缺失基序I (Additional file)1:图S4A)。Motif I是甲基转移酶活性必需的,也是AdoMet结合和催化所必需的[52.].TRM4A基序I的缺失很可能解释了为什么tRNA m没有减少5.观察到C水平trm4a.然而,我们不能排除TRM4A具有其他功能角色的可能性。由于TRM4B包含RMTase活性所需的所有预测基序,m5.c tRNA甲基化trrm4b这表明TRM4B是TRM4/NSUN2的功能同源物拟南芥.
TRDMT1在之前的报道中被甲基化三个tRNAs, tRNAASP(GTC), tRNAgly(gcc)和trna.val(aac)在结构位置C38,在动物中[11那12那27那30.]和trna.ASP(GTC)在拟南芥[27].RBS-SEQ野生型分析拟南芥和trdmt1不仅确认位置C38甲基化需要TRDMT1ASP(GTC)但C38甲基化的TRNA也需要GLY(CCC)和trna.gly(gcc)因为这些位点在植物中没有可检测到的甲基化trdmt1.与动物相比,tRNA的C38位置val(aac)在拟南芥(附加文件1:表S2)。所有其他检测到的trna在C38位置未被甲基化。
9米5.核tRNAs中的C位点没有显示出甲基化的减少trm4a-1, trm4b-1或trdmt1与野生型相比,是单突变体。这些位点出现在C47、C48、C49和C72的结构位置,并在热图顶部集中显示(图2)。2 b).为了排除TRM4B和TRDMT1存在功能冗余的可能性,我们构造了atrdmt1 trm4b.双突变体,然后进行RBS-SEQ。所有9位点在双突变体中甲基化,因此我们得出结论,TRM4B和TRDMT1没有用于甲基化的特异性胞嘧啶残基的功能冗余拟南芥.我们不能排除这9个位点是带有其他RNA修饰的胞嘧啶的可能性,如m5.C,也抵抗亚硫酸氢盐转化,因此与TRM4A,TRM4B或TRDMT1甲基化无关。
为了进一步证明我们TRNA甲基化数据的再现性,我们开发了一种快速的PCR消化测定来调查单个M5.C位点来源于BS处理的RNA。tRNA的C38位置ASP(GTC)与限制性内切酶的酶切位点ACGT,HPYCH4IV.C38的甲基化保护位点不被BS转化,维持甲基化tRNA中的HpyCH4IV位点ASP(GTC)衍生的PCR产品.因此,HPYCH4IV仅切割tRNAASP(GTC)C38位点甲基化时的PCR产物。tRNA的甲基化ASP(GTC)通过对野生型和野生型的酶切测定,证实了TRDMT1在C38位点的活性trdmt1BS处理的RNA(图。二维).正如预期的那样,TRNA的C38ASP(GTC)在trdmt1或trdmt1 trm4b.双突变体并在BS治疗后的HPYCH4iv未切割。快速消化测定证实了我们的RBS-SEQ数据。
检测tRNA m的作用5.C位点在调节翻译,抗生素湿霉素B,以下描述为湿霉素,被用来干扰翻译。潮霉素改变核糖体中a位点的构象,增加trna与a位点的结合,抑制易位并降低翻译保真度[53.].trna.RMTases TRDMT1 and TRM4B mutants are expected to be more sensitive to hygromycin, as the loss of methylation is predicted to weaken the structural integrity of select tRNAs and increase the ability of hygromycin to bind and ‘lock’ tRNAs in the A-site, stopping translocation. Therefore we tested this expectation by growing wild type and mutants on control and hygromycin containing plates. Bothtrm4b和Trdmt1 trm4b与对照相比,双突变体在发芽(DAG)后的10天和20天内对潮霉素的敏感性增加(图。2 e).敏感性trm4b潮霉素的突变体在20天DAG比10 DAG更明显。随着许多TRNA失去甲基化trm4b和Trdmt1 trm4b突变体(无花果。2 b)和之前的报道,甲基化的缺失会影响tRNA结构,我们将突变体对潮霉素的敏感性归因于修饰的tRNA结构以及这些tRNA与核糖体还原翻译a位点之间的相互作用增加。
m的识别5.C站点拟南芥核,叶绿体和线粒体核糖体RNA
识别M.5.rnas中的C位点A. Thaliana.,我们首先构建了一个rRNA序列列表,以代表来自核、线粒体和叶绿体基因组的所有rRNA(附加文件1:表S3)。然后,我们在Silico.在对准RBS-SEQ数据之前,亚硫酸氢盐将所有细胞苷转化为胸腺量。RBS-SEQ从总RNA转录组种植体文库测序,如前所述确定胞嘧啶残基的有效亚硫酸氢盐转化(附加文件1:图S1A, S1B和方法)。
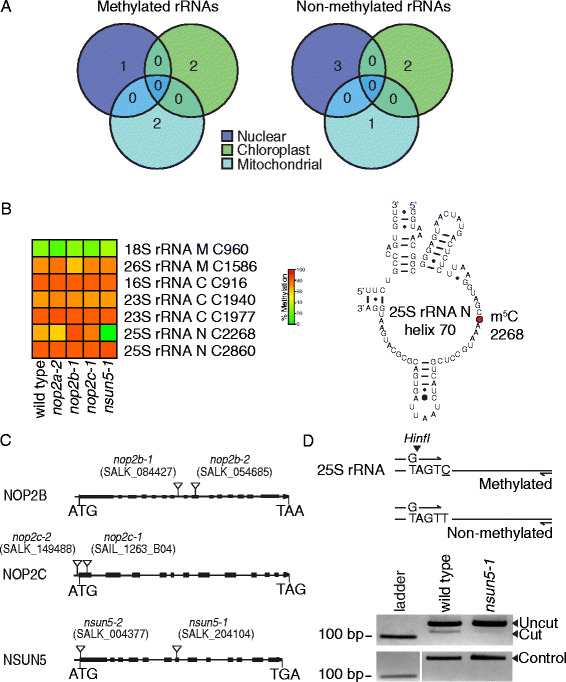
我们共识别出7米5.C核LSU 25S的C位点RRNA,叶绿体SSU 16S,LSU 23s和线粒体SSU 18s和LSU 26s RRNA(图。3a,b).这种模式与tRNA甲基化相反,tRNA甲基化只在核tRNA上检测到(图)。2).每个甲基化的rRNA含有一个m5.C网站除核LSU 25s和叶绿体LSU 23s rrnas,每个rrnas都包含两个m5.C站点(图。3B.).7米的5.C Sites,6在所有三种生物学重复中高度甲基化,平均野生型甲基化水平范围为66至82%。相比之下,一个米5.C位点,线粒体SSU 18S rRNA中的C960较低甲基化,平均甲基化平均为28%(图。3B.).有6种rRNA未被甲基化(图。3A和额外的文件1:表S3)。
NSUN5甲基酯C2268拟南芥LSU 25S rRNA。一种甲基化和非甲基化rRNA物种的基因组起源。从所有三种基因组检测到甲基化的rRNA(3个生物重复)。B.左:野生型和突变体中核(n),叶绿体(c)和线粒体(c)rRNA序列中胞嘧啶的百分比甲基化百分比nop2a-2那nsun5-1那nop2b-1和nop2c-1.胞嘧啶的位置显示在rrna的旁边(3个生物重复)。右图:LSU rRNA的25S核螺旋70 (domain IV)部分二级结构,红色显示胞嘧啶位置2268,该位置被NSUN5甲基化。C基因组的结构nop2b那nop2c和nsun5在外显子(填充盒)中显示T-DNA插入(三角形)的突变体。D.在BS处理的LSU 25S rRNA模板上,NSUN5在C2268位的RNA甲基化分析。上图:dCAPS扩增产物的限制性图谱显示甲基化和非甲基化模板的预期消化模式。当C2268甲基化时,25S_rRNA_F dCAPS引物在第4位包含一个G不匹配,产生一个hini限制性位点。以下是HinfI对PCR扩增产物的裂解,证实了野生型C2268的甲基化,而非非甲基化nsun5-1导致hini限制位点的丢失。加载控制为未消化的PCR产物
nsun5是m的5.C位于LSU 25S rRNA的C2268位
在我们的RBS-seq数据集中,LSU 25S rRNA的两个核位点C2268和C2860被高度甲基化,这两个位点分别位于螺旋70和89的大rRNA亚基的保守结构域IV。最近,对于酵母核LSU 25S rRNA中同源位置C2278和C2870, RMTases RCM1和NOP2分别被证明是甲基化所必需的[13那15].因此,我们预测拟南芥m需要RCM1的同系物,这里描述为NSUN5, NOP2的类似物,这里描述为NOP2A/OLI2, NOP2B和NOP2C5.C在这些地点[25那42].为了测试这些预测,我们进行了RBS-seqnsun5那nop2a那nop2b和nop2c突变体(无花果。3C额外的文件1:图S2B, S2C)。
测试m是否需要NSUN55.C在核LSU 25s的位置C2268,RRNA我们在总RNA上进行了RBS-SEQnsun5-1和野生型(图。3B.).甲基化从野生型66%降低至2%NUSN5-1在位置C2268,甲基化在任何其他RRNA M中没有减少5.C网站。另一个独立的等位基因也得到了类似的结果,nsun5-2(附加文件1:图S3D)。C2268的甲基化率降低到29%nsun5-2.低水平的背景甲基化nsun5-2可能是由于该突变体中的低水平的NSUN5表达。虽然没有检测到跨越T-DNA插入位点的转录物(附加文件)1:图S2C)杂散拼接可能以低频率发生以产生少量功能性截断的蛋白质。确认在核25s rRNA中的C2268位置的降低甲基化nsun5利用从BS处理过的25S rRNA中提取的dCAPs (derived cleaved amplified polymorphsequences)引物,我们开发了一种限制性内切酶酶切PCR产物。在野生型中,C2268的胞嘧啶甲基化保留了hini酶切位点,并将PCR产物裂解(图)。3d和额外的文件1:图S3E)。减少C2268甲基化nsun5-1和NUSN5-2通过PCR产物的还原裂解来观察。这些结果表明,c226825s rRNA被NSUN5在拟南芥.
接下来,我们通过RBS-seq检测突变体LSU 25S rRNA的C2860位点甲基化是否需要NOP2A、NOP2B或NOP2C(图)。3B.和额外的文件1:图S3D)。所有突变体,nop2a那nop2b和nop2c在C2860 25s rRNA具有野生型甲基化水平,表明这些RM酶不会甲酸盐本地或功能冗余。要解决这个问题,我们试图识别nop2a nop2b双突变体,但是不能从分离群体中鉴定这些双突变体。这表明NOP2A和NOP2B可以偿还,对植物活力至关重要。NOP2A,NOP2B和NOP2C的序列比对显示NOP2B缺失基序IV,预计将从酶中释放甲基化RNA [54.那55.NOP2C具有改变的基序N1,其参与RNA结合,但对于RMTase活性不是必需的,因为TRM4同源物不包含该基序[56.](附加文件1:图S4B)。需要进一步的研究来发现引起这个m的RMTase5.C位点与NOP2平行对数的冗余拟南芥.我们还测试了tRNA RMTases TRM4A、TRM4B和TRDMT1是否将剩余的6 m甲基化5.通过RBS-seq检测突变体的rrna C位点,trm4a那trm4b-1, trdmt1, trdmt1和野生类型(附加文件1:图S3C)。如预期,7米的RRNA甲基化水平没有减少5.在突变体中观察到C位点。类似地,为了证明NOP2A和NSUN5是rRNA特异性的,不甲基化tRNAs,我们对两者进行了RBS-seqnop2a-2和nsun5-2。没有减少m5.观察到C tRNA位点(附加文件1:图S3B)。
trna和rrna m5.C位点从单细胞藻类对多细胞植物保存
为了检测核tRNA和细胞器rrna的甲基化位点是否在进化过程中被保守,我们从6个生物体中构建了tRNA富集的RBS-seq文库;单细胞藻类,N. Oculata,多细胞宏观藻类C. Taxifolia,四种维管植物,单子叶植物T.杜伦姆,二象植物A. Thaliana.和B. Rapa.和进化的鲜明Ginkgophyte Plant G. Biloba.首先,识别非 - 识别转录的TRNAArabidopisis我们将RNA-seq和RBS-seq映射到我们的拟南芥tRNA isodecoder consensus sequences(附加文件1:表S1)和来自PlantRNA数据库的最接近的相对的唯一TRNA序列[49.].类似地构建特异性rRNA参考文献,我们从五种生物中从总RNA进行了RNA-SEQ,并将读取的读数保持一致拟南芥rRNA参考,物种特异性rRNA参考,或拟南芥-rRNA引导的汇编引用(附加文件1:表S3)。然后利用这些特异性rRNA参考文献对齐和注释随后的RBS-SEQ读数。
检验m的守恒5.对tRNA富集文库进行RBS-seq筛选N. Oculata,C. Taxifolia那杜鲁姆那B. Rapa.那A. Thaliana.,g . biloba分别检测到35、30、51、48、56和34个tRNA等译码器(图5)。4.额外的文件1:表S2和表S4)。在这些tRNAs中,30个是核tRNAs,在所有6个物种中大部分都被甲基化了,剩下的8个是假定的叶绿体或线粒体tRNAs在两个物种中的一个中被甲基化了,杜鲁姆或N. Oculata..由于这些TRNA仅在六种物种之一中仅甲基化,这可能反射叶绿体或线粒体TRNA最近纳入核基因组杜鲁姆或N. Oculata..这些数据一起表明叶绿体或线粒体编码的TrNA的甲基化在王国中很少见植物界和M.5.tRNAs的C甲基化通常局限于核编码tRNAs。
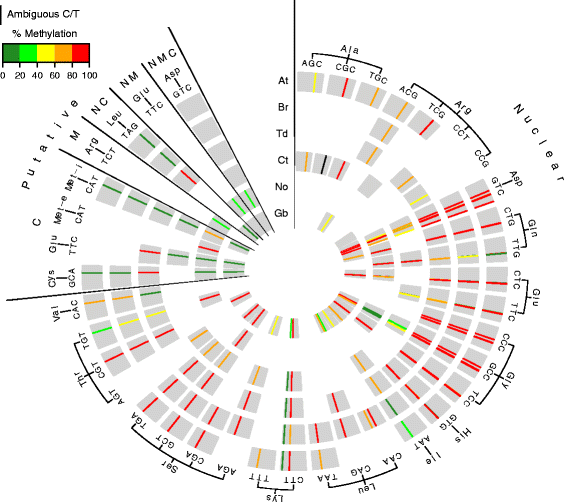
王国中tRNA甲基化的保护植物界。一种来自外部代表的同心圆拟南芥(在),Brassica Rapa.(Br),Triticum杜伦姆(TD),Nannochloropsis oculata(没有),Caulerpa Taxifolia(Ct)和银杏毕洛巴巴分别(Gb)图示。这些圆环分为两个主要部分,分别是核编码的trna和推测来自基因组的trna(核n,叶绿体c,线粒体m)。在每个圈中,单个tRNA的一致序列以厚灰色弧线表示,并按氨基酸字母顺序排列,然后按反密码子排列。根据72 bp的代表性tRNA结构对应的结构位置,对每个物种的特定tRNA序列进行比对。在分析的6个物种中,至少有一个被甲基化的胞嘧啶以颜色编码的甲基化百分比条显示。所使用的甲基化百分比,绿色=低甲基化(0 - 40%),红色=高甲基化(80 - 100%)。甲基化条的缺失表明该物种的tRNA中相应位置不包含胞嘧啶。在tRNA的49号位置有一条黑条ALA(CGC)在Ct中代表一个模糊的核苷酸,在这个位置可能是C或T。在RBS-seq中未检测到的trna未显示(拟南芥 -3生物重复和所有其他植物物种1复制)
对30个保守的tRNA等解码器进行详细分析,共发现51个甲基化位置。这51个地点被分为3类,第一类包括所有6个物种的35个高度保守的地点,第二类包含5个高度保守的位点,在5个物种中,其他物种包含一个单核苷酸多态性(SNP),第三类包含11个位点,这些位点在至少一个物种中甲基化,而在其他物种中没有甲基化。第二类包含SNPs,要么是甲基化位置的转换(C > T),要么是转换(C > G)。一个例子就是tRNAASP(GTC).在tRNA的C50位置ASP(GTC)在C. Taxifolia.从C到G的转换,去掉了一个高度保守的m5.C网站。通过使用RNA-SEQ确认G转化。三级的一个例子,m5.C网站降低一种物种,是TRNA的位置C48glu(CTC).尽管t.durum.和G.Biloba.在C48的甲基化水平较低(22 - 40%),其他三个物种在该位点没有甲基化,尽管在非bs转化的RNA中存在胞嘧啶残基。
在第3类中,至少有一个物种含有甲基化的保守胞嘧啶残基,一个值得注意的例子是tRNAgln(ttg)然而,在所有物种中含有甲基化的位置然而,不保守位点。例如,在杜鲁姆和N. Oculata.位置C48和C49均为甲基化,但在其他测试物种中,只有C48或C49甲基化,但尽管存在这些位置的胞嘧啶。Blanco等人也识别了该网站变异性.[18],因为小鼠在TRNA中的一个位点甲基化gln(ttg),而人类在两个地点甲基化。更清楚地了解这些TRNA位置附近的其他核糖核苷酸修饰可以进一步了解这些观察结果。
我们还确定了两个额外的m5.C结构位置,C34和C68在tRNA低浓缩铀(CAA)和trna.赖氨酸(总部)的B. Rapa.和G. Biloba,分别那在其他物种中没有甲基化。tRNA低浓缩铀(CAA)C34位甲基化仅在B. Rapa.和g . biloba分别为89%和20%。这个位置的甲基化变化可能是由于环境因素,因为酵母中这个位置的甲基化以前被证明在氧化应激条件下会发生改变[10].据预测,tRNA低浓缩铀(CAA)C34位甲基化拟南芥但我们没有发现拟南芥tRNA低浓缩铀(CAA)在我们的数据集中。对于trna.赖氨酸(总部)C68位置,g . biloba有25%的甲基化而A. Thaliana.那B. Rapa.和杜鲁姆甲基化非常低(低于20%的甲基化阈值)。类似地,其他tRNAs中C67和C69附近结构位置的甲基化也在人类中被报道[30.].
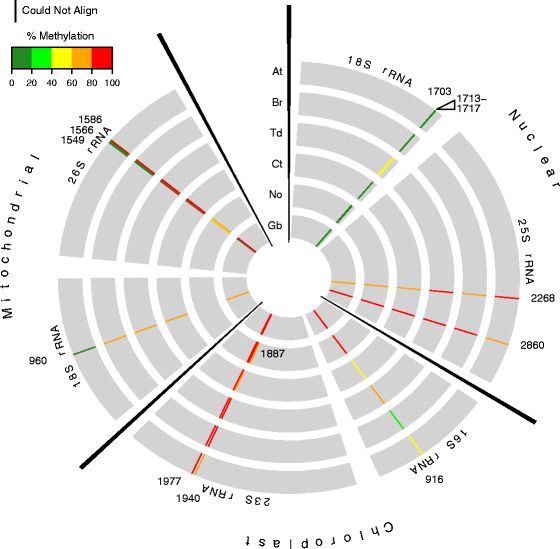
rrnas m的保护5.对所有六种生物进行了C位点测试,N. Oculata,C. Taxifolia那杜鲁姆那B. Rapa.那A. Thaliana.,G. Biloba,通过RBS-SEQ从总RNA。共有8个高度保守的m5.LSU和SSU rrna的核、叶绿体和线粒体结构位置的C位点被鉴定(图。5.和额外的文件1:表S3和表S5)。有趣的是,LSU 25S rRNA胞嘧啶C2268和C2860的甲基化在所有6个物种中都是保守的,它们分别依赖于NSUN5和NOP2A/NOP2B/NOP2C的同源物[13那15].这8百万中有6个5.在SSU 16S中的所有测试物种外,C位点高度保存在甲基化百分比和位置,除了SSU 16s中的C916,叶绿体rRNA,其物种的甲基化范围为31至87%。剩下的两个高度保守的位点,在SSU 18S rRNA和LSU 26s RRNA中的C1549中的线粒体C960在六种测试物种中的四种中高度甲基化.再往前8米5.其中C1703和C1713-1717位点发生在15 bp范围内杜鲁姆核SSU 18S rRNA和其他两个甲基化位点,C1566线粒体SSU 18S rRNA和C1887叶绿体LSU 23S rRNA只发生在N. Oculata。五个聚类的m5.18S rRNA的C位点可能与BS非转化事件有关,这可能是rRNA强二级结构的结果。剩下的物种特定的地点N. Oculata.可能反映了物种特异性因子通过核糖体调节翻译。
王国植物中rRNA甲基化的保护。一种来自外部代表的同心圆拟南芥(在),Brassica Rapa.(Br),Triticum杜伦姆(TD),Nannochloropsis oculata(没有),Caulerpa Taxifolia(Ct)和银杏毕洛巴巴分别(Gb)核糖体rna。这些圆圈分为三个部分,分别是核、叶绿体和线粒体编码的rnas。在每个圆圈中,单个rRNA序列用灰色粗条表示。每个rRNA种类的核苷酸位置是基于与相应的排列拟南芥共识序列。在分析的6个物种中,至少有一个被甲基化的胞嘧啶以颜色编码的甲基化百分比条显示。在使用的甲基化方案中,绿色=低甲基化(0-40%),红=高度甲基化(80-100%)。不存在甲基化棒表明RRNA中的相应位置不含该物种中的胞嘧啶。打开三角形表明连续的细胞瘤甲基化Triticum杜伦姆.1703时的黑色甲基化棒Nannochloropsis oculataSSU 18S rRNA显示其序列无法与拟南芥参考序列(在3个重复和其他物种1复制)
讨论
在这里,我们发现转录后修饰5-甲基胞嘧啶只在植物核编码的tRNAs上检测到,而rnas的甲基化发生在所有三个细胞器的转录本上.在从单细胞藻类到多细胞植物的种类范围内观察到TRNA和RRNA甲基化位点的强守恒。此外,在拟南芥,研究发现,RNA甲基转移酶TRM4B和TRDMT1是多个核苷酸位点上tRNA甲基化的必需酶,而NSUN5特异地在C2268位点上甲基化LSU 25S rRNA。
我们的研究检测了39个5-甲基胞嘧啶候选位点拟南芥核Trnas和额外的20米5.在不同的植物物种和所有网站上检测到C位点,除了一个是植物中的新发现。大多数m5.C位点位于动物已知含有5-甲基胞嘧啶的tRNA二级结构中的位置[2那3.那18那29-31,广泛支持对m作用的现有预期5.C调节tRNA功能[2].在植物和动物中,tRNA生物学的一个新兴方面是它们加工成更小的调节rna [57.-61.和TRDMT1介导的m5.C已经被证明可以保护tRNAs免受热和氧化应激介导的裂解果蝇[12].同样,TRM4/NSUN2在人类和小鼠中的甲基化已被证明可以保护tRNAs免受氧化应激诱导的切割[18].总之,这些数据提供了丰富的m5.CTDMT1和TRM4B介导的C站点现在可以询问这种现象在植物中的作用。未来的实验将确定在RMTase突变体中观察到增加的切割的TRNA片段,并在各种环境条件下测试这些突变体可突出这些基因在调节应激反应时突出额外的作用。
检测M.5.C位点只在tRNAs上拟南芥与线粒体和叶绿体基因组来源于α -变形菌的说法一致[62.]和蓝细菌祖先[63.),分别。补充我们的数据,m5.细菌tRNAs上未检测到C位点大肠杆菌和枯草芽孢杆菌[3.].相比之下,牛的六个线粒体TrNA [32人类中的五个线粒体Trnas [29那64.]在位置C48,C49和C72处含有甲基化。这些数据表明,自植物与动物之间的最后一个共同的祖先以来,线粒体TrNA的甲基化可能在动物中独立进化。缺乏线粒体和叶绿体TrNAS的甲基化通常在不同的植物物种上保守。三个值得注意的例外是叶绿体状的tRNAcys(gca), tRNAglu(TTC)和trna.雷乌(标签)在杜鲁姆我们检测到甲基化但在其他植物种类的同源物中没有观察到甲基化。对这些观察结果的一种解释是三种叶绿体样Tre杜鲁姆代表最近的DNA整合事件进入细胞核。在核整合和转录后,这些tRNAs被RMTases(推测为TRM4B、TRDMT1或RCMT9)甲基化。
许多线粒体基因和trna经常被纳入核基因组,因此随着时间的推移从细胞器基因组中丢失[46].因此,要获得线粒体编码蛋白翻译所需的全部tRNAs,需要从细胞核导入tRNAs。预计有9个tRNA同受体从细胞核导入到线粒体拟南芥[44其中几个TRNA,如TRNAGLY(CCC)在我们的数据中被甲基化。我们推测m5.这些线粒体导入核trna的TRM4B和/或TRDMT1的C甲基化在导入线粒体之前发生在细胞质中。导入线粒体的核真核转移rna的甲基化表明它们与原核线粒体翻译机制并非天生不相容。
包括TRDMT1 / DNMT2的九种推定的胞嘧啶RMTase酶被编码拟南芥我们证明TRM4B和TRDMT1甲基化tRNAs而不是rrna [25那26].TRM4的重复导致了两个副病虫戈,TRM4A和TRM4B拟南芥。TRM4B保留tRNAs上的甲基转移酶活性,而TRM4A含有目标胞嘧啶结合所需的motif I缺失[52.].我们不能排除TRM4A还包含其他调控功能,例如调控m5.m的稳定性或调制可达性5.C点到RNA结合蛋白。TRM4B在位置C48,C49和C50的TRNA的甲基化与动物和酵母同源物也是甲基化这些TRNA结构位置的事实一致[2那3.那16那18那29-31].人体中的NSUN2 / TRM4已经发现在C72的位置甲酸盐TRNA [30.].相比之下,我们在tRNA中鉴定了一个C72甲基化位置ASP(GTC),它独立于TRM4B。TRDMT1以前被描述为一个tRNA C38特异性RMTase,在动物和甲基化tRNAASP(GTC), tRNAgly(gcc)和trna.val(aac)[11那12那30.].我们在拟南芥不仅检测先前描述的tRNAASP(GTC),也是两个新的trnas,trnagly(gcc)和trna.GLY(CCC).trna中这些甲基化位点的重要性在其他生物体中得到了证实,TRM4和TRDMT1的缺失导致小鼠成熟trna丰度的降低和翻译效率的降低[11].此外,tRNA m5.酵母中TRM4介导的C位点是耐受抗生素巴龙霉素所必需的,巴龙霉素是一种氨基糖苷,类似于湿霉素B [65.].同样地,我们的数据trm4b与野生型相比,突变体对潮霉素B的敏感性增加,这表明TRM4B甲基化的tRNAs在翻译效率中发挥了作用。有趣的是,TRDMT1和TRM4B的缺失导致了对潮霉素b的严重敏感性5.C介导的这三种trna结构对翻译具有重要意义。翻译被严格控制,以便生物体快速适应环境压力,如氧化和热压力[10那66.].翻译的变化拟南芥trdmt1 trm4b突变体可能影响逆境条件下的翻译调控,降低植物的适应性。
我们的识别m5.在TRNA结构位置C48,C49,C50和C72的C位点与TRM4B或TRDMT1无关,使用RBS-SEQ在鼠标中的最近观察结果类似,并提高另一个RMTase甲基化这些位点的可能性[18].这与人类相反,人类所有的tRNA m5.C站点依赖于TRM4或TRDMT1 [18].我们提出植物中的另外的TRNA RMTase是最接近的TRM4同源物RCMT9(AT5G66180)。可以通过鉴定来测试这个假设rcmt9突变体和对富集的tRNAs进行RBS-seq。另一种假设是TRM4和TRDMT1独立于m5.C站点不是m5.C位点,但其他对BS转换的其他胞嘧啶修饰[29那51.].这可以通过对植物中纯化的tRNAs进行质谱分析来验证trm4b trdmt1.双突变体,并确定m5.C.在nsun2 trdmt1双突变小鼠,RNA m5.与野生型小鼠相比,C水平降低至少90%[11].目前尚不清楚这是否表明额外的m5.C位点在tRNAs中保留,或者如果检测到m5.C来自污染的rRNA。我们支持第一种假设,即这些TRM4B和TRDMT1独立位点是善意m5.C站点,因为它们处于TRNA结构位置,通常包含m5.C,这些位点被拟南芥RCMT9甲基化,其与TRM4同源物分享序列同源性[25].
我们的方法不仅检测rna中的甲基化位点,而且还提供了具有这种修饰的转录本百分比的定量测量。这使得我们能够对不同植物中200多个tRNAs和50个rnas的甲基化位点进行定量比较分析。有趣的是,在六种植物中,tRNAs和rnas的甲基化百分比和特定位点都是广泛保守的。这种强烈的守恒有力地支持了这些m的功能重要性5.C位点在调控rrna和trna的结构和稳定性等方面的作用[2].
我们的研究检测了5-甲基胞嘧啶的7个候选位点拟南芥核,叶绿体和线粒体LSU和SSU RRNA,所有这些都在植物中进行了新颖。在已知的rRNA区域内的阵地内发现许多高击中位点在动物和细菌中具有5-甲基胞嘧啶[2那12那14那33-36].值得注意的是,我们在分析的任何植物物种中都没有检测到LSU 5S rRNA的甲基化,而相比之下,在HeLa细胞中,这种rRNA物种被TRM4/NSUN2甲基化[30.那31].它很有趣,而植物叶绿体和线粒体TrNA没有M5.C,细胞器rrna含有m5.C.尚不清楚rRNAs是否在叶绿体和线粒体内甲基化,或者如果出口以允许在进入细胞器之前添加来自核衍生修饰酶的修饰。拟南芥RMTases NOP2B和RNMT/FMU均预测定位于叶绿体[26].这表明这些rmtase使细胞器内的rRNA甲基化。需要对RMTases的位置进行进一步的研究,以证实这些发现,并评估m5.C发生。
有五个rmtase在拟南芥根据与其他生物rRNA rmtase的序列相似性,预测rRNA会被甲基化。在本研究中,我们研究了rRNA m5.C位点需要RCM1同源物,NSUN5和NOP2同源物NOP2A, NOP2B和NOP2C。这里我们展示了拟南芥核LSU 25s rRNA中C2278的甲基化需要NSUN5。有趣的是,酵母nop2 orthologin拟南芥,没有发现NOP2A是必需的5.C在核LSU 25s rRNA的C2860。我们假设这可能是由于功能冗余与其他NOP2副病拟南芥基因组,NOP2B和NOP2C。不确定Paralogs NOP2B和NOP2C是否是功能性RMTASE的。NOP2B缺乏基序IV,其参与MOTIF VI甲基化后甲基化后的靶RNA [54.那55.].在酵母中,保守残留Cys的主题IV中的点突变424在NOP2中导致突变体的积累nop2蛋白质- rna复合物与细胞死亡[54.那67.].NOP2B有可能利用高度分化、不符合基序IV中的Cys残基来避免细胞死亡。另一种可能性是,尽管m5.C位点被保守,即基因组中的另一个RMTase负责本地位点的甲基化。这种可能性最有前途的候选人是拟南芥细菌Fmu的同源物,RNMT,它被预测将rRNA甲基化[25那43].
跨rRNA中的酶和甲基化位点的保护表明功能守恒。可能的功能包括调节蛋白质合成,rRNA和平移保真度的稳定性和成熟。如果表型,它仍然可以看到nop2a可以连接到任何特定的m5.C站点或rRNA处理的改变。rRNA M.5.C位点和在本工作中发现的突变体提供了一个平台,以启动研究特异性rRNA m的作用5.C在不同环境条件下的网站。
结论
植物中TRNA和RRNA甲基化谱的这种综合表征未覆盖TrNA的核特异性甲基化,而RRNA从所有三种基因组甲基化。富含RBS-SEQ在野生类型和突变体中富集的方法使我们能够识别m5.C站点依赖于NSUN2 / TRM4,并将TRDMT1的已知目标范围扩展到植物中的位置C38处的附加两个TRNA。我们还确定了MSUN55.在LSU 25S rRNA的C2278位点上发现了功能冗余拟南芥NOP2谬误,NOP2A, NOP2B和NOP2C,因为这三种酶中的任何一种的缺失都不足以去除任何rRNA m5.C网站,虽然丧失NOP2A和NOP2B出现了致命的。拟南芥RMTase酶在核基因组中编码。这表明核编码的RMTase酶与细胞器的转运或转运和重新导入细胞器RRNA。我们赞成前假设拟南芥预测fmu样RNMT和NOP2B位于细胞器中[26这表明它们甲基化了线粒体和叶绿体内的rRNA, NOP2B与NOP2A和NOP2C存在冗余作用。而在脊椎动物中,一些线粒体trna被甲基化[29那32那64.,我们的数据表明,像细菌的trna一样,植物线粒体和叶绿体trna没有甲基化[3.].这表明脊椎动物在进化过程中获得了甲基化线粒体tRNAs的能力。我们发现,在不同的植物物种中,TRDMT1、TRM4B和NSUN5的甲基化位点都得到了高度的保护拟南芥,表明这些酶最可能在其他地区的甲基化中负责甲基化植物界.RMTases和m5.C网站强烈建议重要,保守的功能,值得调查。我们调查了trna m的功能5.TRDMT1和TRM4B的缺失导致突变体对抗生素湿霉素B的敏感性增加,表明tRNA m5.C位点以组合的方式影响tRNA结构。我们的数据提供了基础和特征拟南芥需要进一步研究RNA m的功能5.c在植物中。
方法
植物材料及生长条件
A. Thaliana.(哥伦比亚生态型)和B.rapa植物在凤凰生物系统控制的环境室中生长,温度为21°C,金属卤化物灯提供了110 μmol照片/m的PAR(光合有效辐射)水平2/ s。植株在土壤(Debco育苗混合料)或添加1%蔗糖的½MS培养基上生长,光照16 h、黑暗8 h。g . biloba在阿德莱德的植物园(34.9181°S,138.6107°E,澳大利亚)种植。C. Taxifolia.在25°C的人工海水中,在荧光灯下生长,PAR为80 μmol /m2/ s。N. Oculata.在添加氮磷的人工海水中,在荧光灯照射下,PAR为40 μmol /m2/ s对数阶段。为了拟南芥潮霉素B测定,种子播种在控制和潮霉素B [15 ug / ml]用1%蔗糖补充½ms培养基。Hygromycin B购自A.G. Scientific,Inc ..在发芽后10和20天的植物用佳能Powershot G15相机拍摄。
所描述的突变等位基因为;nop2a-2 (oli2-2)(SALK_129648),nop2b-1(Salk_084427),nop2b-2(SALK_054685) nop2c-1 (SAIL_1263_B04),nop2c-2(SALK_149488),nsun5-1(SALK_204104),nsun5-2(Salk_004377),trdmt1(SALK_136635),trm4a(SALK_121111),TRM4B-1(sail_318_g04)和TRM4B-2(sail_667_d03)。这trdmt1 trm4b.双突变体是用trdmt1和TRM4B-1突变的等位基因。这nop2a nop2b双突变体是用nop2a-2 (oli2-2)和nop2b-1突变的等位基因。提供了用于鉴定纯合子T-DNA突变体的引物(附加文件)1:表S6)。
从拟南芥信息资源数据库(TAIR)中可获得以下基因的核苷酸序列数据,登录号如下:NOP2A/OLI2 (At5g55920)、NOP2B (At4g26600)、NOP2C (At1g06560)、NSUN5 (At5g26180)、TRDMT1 (At5g25480)、TRM4A (At4g40000)、TRM4B (At2g22400)。
RNA的RNA分离和亚硫酸氢盐转化
从任何10天的老人都分离了RNA总量A. Thaliana.苗,或A. Thaliana.植物的花蕾,杜鲁姆旗叶,B. Rapa.和g . biloba拍尖端,C. Taxifolia.复叶或对数期生长N. Oculata.使用DNA酶(Sigma-Aldrich)除去筛选总RNA试剂盒(Sigma-Aldrich)和污染DNA的细胞。为了富集TrNA,将10μg的总RNA分离在10%聚丙烯酰胺凝胶上,除去含有65-95ntn的区域,纯化RNA。根据制造商的说明,使用Illumina的Truseq RNA样品套件V2使用总RNA或纯化的TRNA用于图书馆结构。随着亚硫酸氢盐处理的RNA被剪切,在加入碎片缓冲液后,快速加工亚硫酸氢盐处理的样品。用于亚硫酸氢盐转换,200 pg控制在体外转录的Renilla荧光素酶(R-Luc) RNA加入到2 μg总RNA或200 ng纯化tRNAs中,并如前所述用焦亚硫酸钠(SIGMA-ALDRICH)转换[29那51.].以亚硫酸氢盐处理过的总RNA或纯化的tRNAs为模板进行Illumina文库构建,如前文所述。Illumina测序在阿德莱德ACRF的MiSeq平台上进行。有关排序库的描述,请参阅(附加文件)1:表S7)。
序列读取映射和甲基化分析
使用CLC Genomics Workbench (Qiagen)对序列进行修剪,用于适配器,并对低质量reads进行过滤。为了识别tRNA,并减少映射的模糊性,我们从拟南芥信息资源[Arabidopsis thaliana Information Resource]中分解了相同和高度相似的tRNA isodecoder序列[68.,以创建包含100个tRNA isodecoders的参考共识列表(附加文件1:表S1)。对于来自其他物种的TrNA,拟南芥参考共识列表和从PlantRNA数据库中最近的相对获得的独特的TRNA序列[49.],被使用了。从NCBI Refseq数据库获得RRNA序列,在那里可用。对于没有可用的RRNA序列的物种,RNA-SEQ读数对齐拟南芥相应rRNA亚基的RNA参考序列和共识,以获得物种特异性SNPs(附加文件)1:表S3)。将tRNAs和rrna的RBS-seq reads映射到在Silico.转换的参考序列,而RNA-SEQ读数被映射到未转化的序列。CLC基因组学工作台(QIAGEN)用于对准序列读取对应的TRNA和RRNA参考序列。为了将TRNA中的结构位置与不同的序列和长度进行比较,使用代表性结构模型[69.].对于rrna,分析的所有植物的参考序列都与rrna进行了比对拟南芥参考文献和编号是根据相应的核苷酸位置拟南芥核糖体rna参考序列。
为了鉴定甲基化的胞嘧啶,读取序列中的胞嘧啶的未转化被取出表明存在m5.c . Renilla荧光素酶在体外转录的mRNA缺乏m5.C用于确保转化效率大于98%。为了确保TrNA和RRNA中的甲基化位点的鲁棒检测,需要最少5次读取覆盖,最低甲基化水平为20%(转化率≤80%)。计算特定位置的百分比甲基化作为映射胞嘧啶的数量除以映射的胞嘧啶和映射胸腺量的组合总数。在r中产生显示甲基化百分比的热量[70,使用R包“Pretty heatmaps”[71.].
甲基剁PCR甲基化测定
使用来自亚硫酸氢盐处理的RNA的cDNA,用于使用引物正向ASP TRNA_AT_FWD和反向ASP TRNA_AT_FWW和催化转发25s_rRNA_F和反向25s_rrna_r的PCR核rRNA的PCR产物。25s_rrna_f dcaps引物在3'端的位置载有g不匹配,以产生HinFi限制性位点。PCR产物分别用HPYCH4IV或HINFI限制酶(新英格兰Biolabs)消化。trna.ASP(GTC)72bp PCR产物经酶切Hpy如果C38被甲基化,CH4IV会产生35bp和37bp的两种消化产物,如果C38没有被甲基化,则CH4IV不被消化,通过亚硫酸氢盐处理转化为T38,导致HpyCH4IV限制性内切酶位点丢失。25S rRNA PCR产物全长155bp。当C2268甲基化后,限制性内切酶HinfI将PCR产物裂解为29bp和126bp的两个片段。经过亚硫酸氢盐处理后,非甲基化的25S rRNA在2268位有一个T,这就消除了HinfI限制性内切酶位点,使产物处于155bp,未被消化。未消化PCR产物作为加载对照。提供了使用的引物序列(附加文件1:表S6)。
半定量聚合酶链反应
根据制造商的建议,使用Invitrogen SuperScript III试剂盒进行半定量PCR,提取2 μg总RNA和oligo-dT引物cDNA合成。半定量PCR检测TRM4A,TRM4B,NSUN5,NOP2B和NOP2C使用提供的引物进行mRNA(附加文件1:表S6)。对于RNA输入控制,与引物正向PDF2_RT-PCR_F和反向PDF2_RT-PCR_R一起使用家务基因PDF2A的扩增。进行定量PCR以使用Roche Lighcycler480和Syber Green测试Nop2C mRNA丰度。
提供支持数据的可用性
支持本文结果的数据集可以在NCBI的GEO数据库存储库中找到,可以通过GEO系列登录号GSE68444、GSE68445、GSE68447和GSE68448访问。
缩写
- 核糖体rna:
-
核糖体RNA
- tRNA:
-
转移核糖核酸
- m5.C:
-
5-methylcytosine
- RMTase:
-
RNA甲基转移酶
- TRM4:
-
转移RNA甲基转移酶4
- TRDMT1:
-
转移RNA Asp甲基转移酶1
- RNA-SEQ:
-
Illumina RNA测序
- RBS-SEQ:
-
Illumina RNA Bisulfite测序
- NOP2:
-
核仁的蛋白2
- OLI2:
-
Oligocellula 2
- NSUN2:
-
NOP2 / Sun域蛋白2
- NSUN5:
-
NOP2 / Sun域蛋白5
- BS:
-
亚硫酸铝
- R-Luc:
-
Renilla荧光素酶
- RCMT9:
-
RNA胞嘧啶甲基转移酶9
- Adomet:
-
S-adenosyl-L-methionine
- DCAPS:
-
衍生的裂解扩增的多态性序列
- 帕特:
-
光合有效辐射
参考文献
- 1.
Suzuki MM,鸟A. DNA甲基化景观:表观组织的挑衅性见解。NAT Rev Genet。2008; 9:465-76。
- 2.
RNA中的5-甲基胞嘧啶:检测、酶的形成和生物学功能。核酸学报2010;38:1415-30。
- 3.
细菌、古生菌和酵母中5-甲基胞苷RNA修饰的全转录组mapping揭示了古生菌mrna中的m5C。公共科学图书馆。2013;9,e1003602。
- 4.
Jackman Je,Alfonzo JD。转移RNA修饰:自然的组合化学游乐场。导线RNA。2013; 4:35-48。
- 5。
Motorin Y,通过修饰的核苷酸来稳定TRNA稳定性。生物化学。2010; 49:4934-44。
- 6。
等。tRNA的快速衰变可能是由于缺乏非必要的修饰。摩尔细胞。2006;21:87 - 96。
- 7。
Agris PF。将订单换算:转移RNA抗逆转录域修改的贡献。Embo Rep。2008; 9:629-35。
- 8。
RNA的转录后核苷酸修饰和选择性折叠。核酸学报2006;34:721-33。
- 9。
Chan CT,Dyavaiah M,Demott Ms,Taghizadeh K,Dedon PC,Begley TJ。定量系统方法揭示了在细胞应力期间TRNA修饰的动态控制。Plos Genet。2010; 6,E1001247。
- 10.
陈中泰,彭玉杰,邓文杰,Babu IR, Dyavaiah M, Begley TJ,等。tRNA修饰的重编程通过蛋白质的密码子偏误翻译控制氧化应激反应。Nat Commun。2012;3。
- 11.
Tuorto F,Lieber R,Musch T,Schaefer M,Hofmann S,Kellner S等人。DNMT2和NSUN2的RNA胞嘧啶甲基化促进了TRNA稳定性和蛋白质合成。NAT STRUCT MOL BIOL。2012; 19:900-5。
- 12.
陈志强,陈志强,陈志强,等。Dnmt2的RNA甲基化保护转移RNA免受应激诱导的切割。基因Dev。2010;24:1590-5。
- 13.
Gigova A, Duggimpudi S, Pollex T, Schaefer M, Kos M. 25S rRNA结构域IV的一簇甲基化是核糖体稳定性所必需的。RNA。2014; 20:1632-44。
- 14.
洪B,吴鹏,李志强。在酵母中,Nop2p是rrna前处理和60S核糖体亚基合成所必需的。细胞生物学杂志1997;17:378-88。
- 15.
Sharma S, Yang J, Watzinger P, Kotter P, Entian KD。酵母Nop2和Rcm1分别甲基化25S rRNA的C2870和C2278。核酸Res. 2013; 41:9062-76。
- 16。
酵母菌的多位点特异性tRNA: m(5) c -甲基转移酶(Trm4):基因的鉴定和底物特异性。RNA。1999; 5:1105-18。
- 17。
Auxilien S,Guerineau V,Szweykowska-Kulinska Z,Golinelli-Pimpaneau B.人体TRNA M(5)C甲基转移酶MISU是多等特异性的。RNA Biol。2012; 9:1331-8。
- 18。
Blanco S, Dietmann S, Flores JV, Hussain S, Kutter C, Humphreys P, et al.;tRNAs异常甲基化将细胞应激与神经发育障碍联系起来。EMBO j . 2014; 33:2020-39。
- 19。
Khan Ma,Rafiq Ma,Noor A,Hussain S,Flores JV,Rupp V等人。编码RNA甲基转移酶的NSUN2中的突变导致常染色体隐性智力残疾。我是j嗡嗡声的遗传。2012; 90:856-63。
- 20.
Abbasi-Moheb L, Mertel S, Gonsior M, Nouri-Vahid L, Kahrizi K, Cirak S,等。NSUN2突变导致常染色体隐性智力残疾。Am J Hum Genet. 2012; 90:847-55。
- 21.
马丁内斯FJ,李JH,李我,布兰科年代,Nickerson E,加布里埃尔年代,et al。整个外显子组测序确定NSUN2的剪接突变是杜波维茨样综合征的一个原因。医学遗传学杂志。2012;49:380-5。
- 22。
Fahiminiya S, Almuriekhi M, Nawaz Z, Staffa A, Lepage P, Ali R, et al.;全外显子组测序揭示卡塔尔近亲家庭的致病基因。麝猫。2014;86:134-41。
- 23。
mirna -methyltransferase Misu (NSun2)可诱导表皮干细胞分化。公共科学图书馆。2011;7,e1002403。
- 24。
等。小鼠胞嘧啶-5 RNA甲基转移酶NSun2是染色质体的一个组成部分,是睾丸分化所必需的。生物谷bioon . 2013; 33:1561-70。
- 25。
王志刚,王志刚,王志刚。真核生物RNA(胞嘧啶-5)-甲基转移酶的系统发育分析。基因组学。2009;93:350-7。
- 26.
陈鹏,郑波。拟南芥转运RNA修饰及酶修饰基因的克隆。BMC Plant Biol. 2010;10:201。
- 27.
Goll Mg,Kirpekar F,Maggert Ka,Yoder Ja,Hsieh Cl,张Xy等。DNA甲基转移酶同源物DNMT2的TRNA(ASP)的甲基化。科学。2006; 311:395-8。
- 28.
Rai K, Chidester S, Zavala CV, Manos EJ, James SR, Karpf AR,等。Dnmt2在斑马鱼的细胞质中起促进肝脏、大脑和视网膜发育的作用。基因Dev。2007;21:261-6。
- 29。
挤je,patel hr,nousch m,sibbritt t,humphreys dt,parker bj等。人编码和非编码RNA中的5-甲基胞嘧啶的广泛发生。核酸RES。2012; 40:5023-33。
- 30。
霍达米五世,凯恩斯BR。RNA胞嘧啶甲基转移酶的直接靶标和修饰碱基的鉴定。生物科技Nat》。2013;31:458 - 64。
- 31.
Hussain S,Sajini AA,Blanco S,Dietmann S,Lombard P,Sugimoto Y等。NSUN2介导的胞嘧啶-5穹窿NONCODING RNA的甲基化将其加工成调控小RNA。细胞批准。2013; 4:255-61。
- 32.
哺乳动物线粒体trna转录后修饰的完整景观。核酸学报2014;42:7346-57。
- 33.
陈志强,陈志强,陈志强,等。植物叶绿体翻译机制的研究进展。Annu Rev Genet 1998; 32:437-59。
- 34.
Granneman S, Baserga SJ。核糖体生物发生:旋钮和RNA加工。实验细胞Res. 2004; 46:43 - 50。
- 35.
林达尔,曾格尔。大肠杆菌的核糖体基因。Annu Rev Genet 1986; 20:297-326。
- 36.
Maden是。葛根和男人Xenopus rRNA中甲基的位置。聚集在分子的保守核心中。J Mol Biol。1988; 201:289-314。
- 37.
Purta E, O’connor M, Bujnicki JM, Douthwaite S. YccW是23S rRNA核苷酸1962特异的m5C甲基转移酶。中华医学杂志。2008;33:641 - 51。
- 38.
顾XR,Gustafsson C,Ku J,Yu M,Santi DV。从大肠杆菌鉴定16S rRNA M5C967甲基转移酶。生物化学。1999年; 38:4053-7。
- 39。
Andersen NM, Douthwaite S. YebU是一种特异性16s rRNA核苷酸1407的m5C甲基转移酶。中国生物医学杂志。2006;359:777-86。
- 40.
Baer RJ, Dubin DT。仓鼠线粒体核糖体RNA的甲基化区域:结构和功能相关。核酸Res. 1981; 9:323-37。
- 41.
Metodiev MD, Spahr H, Loguercio Polosa P, Meharg C, Becker C, Altmueller J,等。NSUN4是一种双重功能的线粒体蛋白,在12S rRNA的甲基化和有丝核糖体组装的协调中都需要。公共科学图书馆。2014;10,e1004110。
- 42.
Fujikura U,Horiguchi G,Ponce Mr,Micol JL,Tsukaya H.细胞增殖和细胞扩张的协调,核糖体相关过程中的核糖组植物叶片中的叶片。工厂J. 2009; 59:499-508。
- 43.
Hebrard C, Trap-Gentil MV, Lafon-Placette C, Delaunay A, Joseph C, Lefebvre M, et al.;春化过程中差异甲基化区域的鉴定揭示了RNA甲基转移酶在抽薹中的作用。J Exp Bot. 2013; 64:651-63。
- 44.
关键词:trna,氨基酰化,trna合成酶,线粒体咕咕叫麝猫。2009;55:1-18。
- 45.
Marechaldrouard L,Weil Jh,Dietrich A.植物中的转移RNA和转移RNA基因。annu rev植物phys。1993年; 44:13-32。
- 46。
亚当斯kl,palmer jd。线粒体基因含量的演变:基因丧失和转移到细胞核。mol phylocyet evol。2003; 29:380-95。
- 47。
植物基因组中tRNA基因的研究进展。植物j . 2011; 66:80 - 93。
- 48。
利用RNA聚合酶iii依赖的体外转录系统研究拟南芥I号染色体上表达的tRNA基因。基因。2007;392:7-13。
- 49。
Cognat V, Pawlak G, Duchene AM, Daujat M, Gigant A, Salinas T, et al.;植物trna,光合真核生物trna数据库。核酸学报2013;41:D273-279。
- 50.
周卫东,王志强,王志强,王志强,王志强。植物叶绿体功能的研究进展。公共科学图书馆。2015;10,e0120533。
- 51.
Schaefer M,Pollex T,Hanna K,Lyko F.通过亚硫酸氢盐测序进行RNA胞嘧啶甲基化分析。核酸RES。2009; 37,E12。
- 52。
Bujnicki JM,Feder M,Ayres Cl,Redman KL。TRNA的序列结构功能研究:M(5)C甲基转移酶TRM4P及其与DNA的关系:M(5)C和RNA:M(5)U甲基转移酶。核酸RES。2004; 32:2453-63。
- 53。
Borovinskaya Ma,Shoji S,Fredrick K,Cate JHD。潮霉素B抑制蛋白质生物合成的结构基础。RNA。2008; 14:1590-9。
- 54。
王我,雷德曼kl。RNA甲基转移酶在形成5-甲基胞嘧啶的形成中使用两个半胱氨酸残基。生物化学。2002; 41:11218-25。
- 55。
刘yq。Santi DV:M(5)C RNA和M(5)C DNA甲基转移酶使用不同的半胱氨酸残基作为催化剂。PROC NATL ACAD SCI。2000; 97:8263-5。
- 56.
Foster PG, Nunes CR, Greene P, Moustakas D, Stroud RM。RNA m(5)C甲基转移酶的第一个结构Fmu,提供了对催化机制和RNA底物特异性结合的深入研究。结构。2003;11:1609-20。
- 57.
韧皮部传递的RNA库包含小的非编码RNA并干扰翻译。植物杂志。2009;150:378 - 87。
- 58.
损失-Morais G,Waterhouse PM,Margis R.植物TRNA衍生的RNA片段(TRF)与Argonaute和其推定靶标的鉴定相关。Biol Direct。2013; 8。
- 59.
Haussecker D, Huang Y, Lau A, Parameswaran P, Fire AZ, Kay MA。人类trna衍生的小RNA在RNA沉默的全球调控。RNA。2010; 16:673 - 95。
- 60.
Burroughs AM, Ando Y, de Hoon MJ, Tomaru Y, Suzuki H, Hayashizaki Y, et al.;人类Argonaute相关小RNA的深度测序为miRNA的分类提供了线索,并揭示了不同来源的RNA片段与Argonaute的关联。RNA杂志。2011;8:158 - 77。
- 61.
Sobala A,Hutvagner G.来自TRNA的5个末端的小RNA可以抑制人细胞中的蛋白质翻译。RNA Biol。2013; 10:553-63。
- 62.
灰色MW,汉堡G,朗男友。线粒体进化。科学。1999;283:1476 - 81。
- 63.
Rodriguez-Ezpeleta N,Brinkmann H,Burey Sc,Roure B,Burger G,Loffelhardt W等。初级光合素的一体化,绿色植物,红藻类和肺青茎状物。Curr Biol。2005; 15:1325-30。
- 64.
Suzuki T,Nagao A,铃木T.人体线粒体TrNAs:生物发生,功能,结构方面和疾病。Annu Rev Genet。2011; 45:299-329。
- 65.
吴鹏,brokenbrough JS, Paddy MR, Aris JP。酿酒酵母非必需核蛋白新基因NCL1。基因。1998;220:109-17。
- 66.
Carpentier MC, Park S, Favory JJ, Descombin J, et al.;热诱导的核糖体暂停引发拟南芥mRNA共翻译衰变。核酸学报2015;43:4121-32。
- 67.
国王M,吨D,Redman KL。酵母核仁蛋白NOP2P中的保守基序含有必需的半胱氨酸残基。Biochem J. 1999; 337(PT 1):29-35。
- 68.
Lamesch P,Berardini Tz,Li D,Swarbreck D,Wilk C,Sasidharan R等人。拟南芥信息资源(TAIR):改进的基因注释和新工具。核酸RES。2012; 40:D1202-1210。
- 69.
Sprinzl M,喇叭C,棕色M,ioudovitch A,Steinberg S. TRNA序列的汇编和TRNA基因的序列。核酸RES。1998年; 26:148-53。
- 70.
R核心团队。R:统计计算的语言和环境。R版本3.1.0版。奥地利维也纳:统计计算R基金会;2014.
- 71.
Kolde R. Pheatmap:很漂亮的热手套。R包版本0.7.7版;2013年。
- 72.
Goujon M,McWilliam H,Li W,Valentin F,Squizzato S,Paern J等人。Embl-Ebi的新生物信息学分析工具框架。核酸RES。2010; 38:W695-699。
- 73.
Alonso JM,Stepanova An,OiseSe TJ,Kim CJ,Chen HM,Shinn P等人。拟南芥的基因组型插入诱变。科学。2003; 5633:653-7。
确认
我们感谢Qian Qin(弗林德斯大学,澳大利亚)N. Oculata.Cell,Carlos Gurgel(阿德莱德大学,澳大利亚)C. Taxifolia.根茎和基因组学和生物信息学核心设施(IMVS ACRF,Adelaide)用于illumina测序。我们感谢Joy Raison和Simon Baxter(Adelaide大学,澳大利亚),同时协助生成圆形图和批判性读取手稿。该研究得到了ARC Grants DP0988846和DP110103805的支持支持。和APA和GRDC PHD充值奖学金授予AB。
作者信息
从属关系
相应的作者
额外的信息
利益争夺
提交人声明他们没有竞争利益。
作者的贡献
实验由AB,RD设计。通过AB和RD同样进行实验和分析。由AB,RD和AB同样准备和编辑稿件。所有作者阅读并认可的终稿。
作者的信息
AB和RD是共同的第一作者。
爱丽丝·路易斯·伯吉斯和拉凯什·大卫对这项工作做出了同样的贡献。
额外的文件
额外的文件1:
图S1.非甲基胞嘧啶残基的有效亚硫酸氢盐转换。图S2.表征拟南芥T-DNA突变体。图S3.TRNA和RRNA MTases的特异性。图S4.甲基转移酶基序的多序列比对拟南芥RMTases。拟南芥中RM酶的两个亚壳的氨基酸序列;(a)TRM4A和TRM4B;(b)NOP2A / OLI2,NOP2B和NOP2C使用CLUSTAL OMEGA对齐[72.].表S1.独特的tRNA isodecoder共识序列用于tRNA表达和甲基化分析。表S2.多种植物中检测到的tRNA等解码器序列注释表。表S3.核糖体RNA序列用于不同植物种类和数量的甲基化分析5.C网站。表S4.来自的甲基化%A. Thaliana.那B. Rapa.那杜鲁姆那C. Taxifolia.那n occulata和g . biloba.表S5.甲基化百分比来自A. Thaliana.那B. Rapa.那杜鲁姆那C. Taxifolia.那n occulata和g . biloba.表S6.本研究使用的引物序列[73.].表S7.阅读图书馆的覆盖顺序。(邮政编码5681 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
5-甲基胞嘧啶(5-甲基胞嘧啶)在植物界的保护。BMC植物BIOL.15,199(2015)。https://doi.org/10.1186/s12870-015-0580-8
收到了:
公认:
发表:
关键字
- RNA 5-methylcytosine
- 非编码RNA
- 核糖体RNA(rRNA)
- 转移核糖核酸
- 拟南芥
- trdmt1
- dnmt2.
- TRM4
- NOP2
- NSUN5