摘要
背景
栽培花生(落花生hypogaea花生是世界上最重要的油料作物之一。开花后,花生植株在地上形成雌蕊柄这种生殖方式被称为地果皮,使花生区别于大多数其他植物。花生地果皮荚发育的分子机制尚不清楚。
结果
为了深入了解地果形成的机制,我们从空中的雌蕊、地下的未膨胀的雌蕊和刚刚开始膨胀成荚的雌蕊中提取了蛋白质。我们通过结合1 DE和nanoLC-MS/MS方法分析了这些样品中的蛋白质谱。3个样品中分别鉴定出2766、2518和2280个蛋白。对蛋白质组和转录组数据的综合分析显示,在mRNA和蛋白质水平上,在不同发育阶段有特异性或差异表达的基因。在地心引力反应、光和机械刺激、激素生物合成和运输过程中,共鉴定出69个蛋白质参与了地果的形成。此外,我们还鉴定了91个特异或大量表达的基因,包括果胶甲基酯酶和膨化蛋白,推测它们促进了气生雌蕊的伸长。此外,我们还鉴定了35个参与代谢、防御、激素生物合成和信号转导、固氮和转运的蛋白,这些蛋白在地下未隆起的雌蕊中积累。此外,在早期膨化豆荚中鉴定了26种与脂肪酸代谢、淀粉合成和木质素合成相关的特异性或高度丰富的蛋白质。
结论
我们在花生的气生雌蕊、地下雌蕊和早期膨大荚中鉴定了数千种蛋白质。本研究为探讨花生地果荚发育的分子机制奠定了基础。
背景
栽培花生(落花生hypogaea花生是世界上最重要的油料作物之一。花生种子由大约50%的优质食用油和大约30%的植物蛋白组成。地果皮荚的发育,或地下荚的发育,使花生区别于大豆(大豆),豌豆(豌豆)和许多其他豆科植物。地果皮的发育使地下豆荚能够吸收土壤养分,保护果实免受地面动物和极端天气的损害。然而,地下发育的种子更容易受到土传病原体的感染,例如黄曲霉,随后与黄曲霉毒素的污染[1].
施肥后,牙龈形式,伸长朝向地面的阳性方式。羊皮伸长连续,位于羊皮尖的卵巢,直到羊皮渗透到土壤中,不会膨胀。以前的研究表明,光,机械刺激和激素是启动荚肿胀的关键因素[2]雌蕊柄土壤渗透前后,光敏色素蛋白质含量变化显著[3.,4,而光照被认为是阻止花生荚发育的主要因素[5]雌蕊柄侵入土壤后,内源乙烯和IAA含量发生变化。与空中绿色雌蕊柄相比,地下所谓的白色雌蕊柄释放的乙烯量是空中绿色雌蕊柄的两倍。然而,IAA含量在气生雌蕊柄中较高,在膨大荚果期较低[6].据推测,这些生理变化重启原胚的发育,随后启动荚的发育过程,并抑制雌蕊的伸长[7].除了以上三个因素,重力、钙和pH值也可能对豆荚的生长很重要[2,8].
近年来,在分子水平上对豆荚形成和发育的机制进行了研究。Chen et al.(2013)利用454测序分析了花生雌蕊柄和幼荚的基因表达谱。他们发现了两个与衰老相关的基因,这两个基因在气生雌蕊中显著上调,并提示这些基因可能导致了气生雌蕊中的胚胎流产[9].在我们最近的研究中,我们构建了转录组库,并分析了空中生育的绿色床道,深种白色羊肉和深色羊肉中的整体基因表达谱,使用Hiseq2000使用小豆荚(长度为2-3毫米)系统。我们在荚膜增长开始之前和之后确定了基因表达的全局变化[10].Zhu et al.(2013)利用二维电泳(2-DE)结合质谱技术对花生地上雌蕊和地下荚果进行了蛋白质组学比较分析,鉴定出与荚果膨胀相关的几种候选蛋白[11].另一项研究使用2-DE蛋白质组学分析,确定了27种在空气雌蕊、地下雌蕊和经受各种处理的雌蕊中差异表达的蛋白质[12]这些结果为花生荚膨大前后蛋白质组的变化提供了有价值的信息。然而,由于所鉴定的蛋白质数量有限,这些研究未能对花生地果皮形成的分子机制提供全面的解释。为了深入了解这一uniq的分子网络在复杂的发育过程中,需要进行更全面的蛋白质组学分析研究。
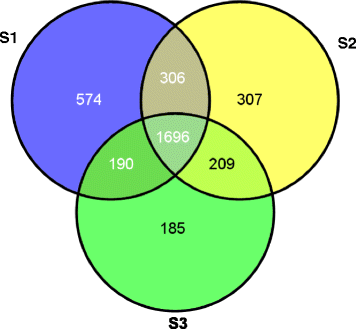
在这里,我们报告的鉴定参考蛋白质组由2766年,2518年和2280年从阶段1 (S1)雌蕊柄独特的蛋白质(例如,空中雌蕊柄绿色或紫色,3 - 5厘米长),第二阶段(S2)雌蕊柄(也就是说,雌蕊柄已经深埋在土中时间约为3天;雌蕊柄为白色,子房不明显增大)和第3期(S3)雌蕊柄(深色生长的雌蕊柄,荚果长2-3毫米)。1).在已鉴定的蛋白中,与重力反应、光和机械刺激、激素合成和运输、钙相关蛋白等相关的本体蛋白比较突出。本研究为从蛋白质水平了解花生雌蕊和荚果的发育机制奠定了基础。
结果
蛋白质鉴定及统计分析
为了获得豆荚发育早期的蛋白质组结构,我们将1 DE与nanoLC-MS/MS(液相色谱-串联质谱)相结合。共分析了14337个肽段,分别鉴定出S1、S2和S3雌蕊体中2766个、2518个和2280个独特蛋白。这些蛋白的相对分子质量在3.5 ~ 136.8 kDa之间,S1、S2和S3雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇雌二醇1).用多肽绘制的蛋白质序列的覆盖范围分布如图所示。2我们分别在S1、S2和S3雌蕊柄中鉴定了574、307和185种特异蛋白(图。3.额外的文件1:表S1,附加文件2:表S2和附加文件3.:表S3)。三个样品共有1696种常见蛋白质(图)。3.额外的文件4:表S4)。在附加文件中总结了所有鉴定的蛋白质的最佳选择,分子量,相应的蛋白质描述和序列1:表S1,附加文件2:表S2,附加文件3.:表S3和附加文件4:表S4。所鉴定蛋白组的肽和光谱的数量也在附加文件中说明1:表S1,附加文件2:表S2,附加文件3.:表S3和附加文件4:表S4。如果鉴定的蛋白质与至少两个肽匹配,则将其定义为可复制蛋白质。总共检测到1049个蛋白质,每个蛋白质至少有两个匹配肽。sugges说,其中16个蛋白质,如ATP合酶、热休克蛋白和WD-40重复序列家族蛋白,至少检测了10次ting认为它们相对丰富。这些相对丰富的蛋白质可能参与雌蕊柄和荚果发育过程中的基本功能。许多蛋白质通过单个肽检测到,这表明它们在三个样本中的丰度较低(补充文件1:表S1,附加文件2:表S2,附加文件3.:表S3和附加文件4:表S4)。
蛋白质分类及功能注释
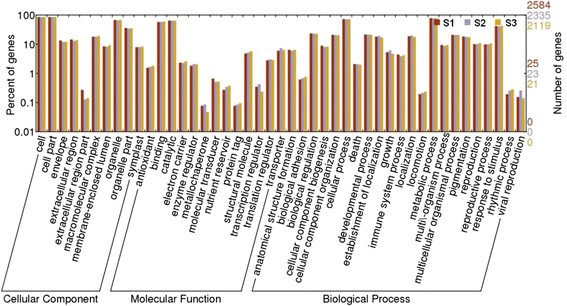
为了研究从3个样品中获得的蛋白质的不同功能,我们使用基因本体论(GO)分析预测了鉴定的蛋白质的生物学功能(http://www.geneontology.org)根据序列同源性,S1、S2和S3雌蕊柄样品的2584、2335和2119蛋白质被分为45个功能组(图。4).在某些情况下,一种特定的蛋白质可以分为不止一类,这表明该蛋白质在多个生物过程中发挥作用。涉及细胞、细胞部分、代谢过程、细胞过程、细胞器、结合、催化活性和对刺激的反应的蛋白质在所有三个样本中都有高度代表性。
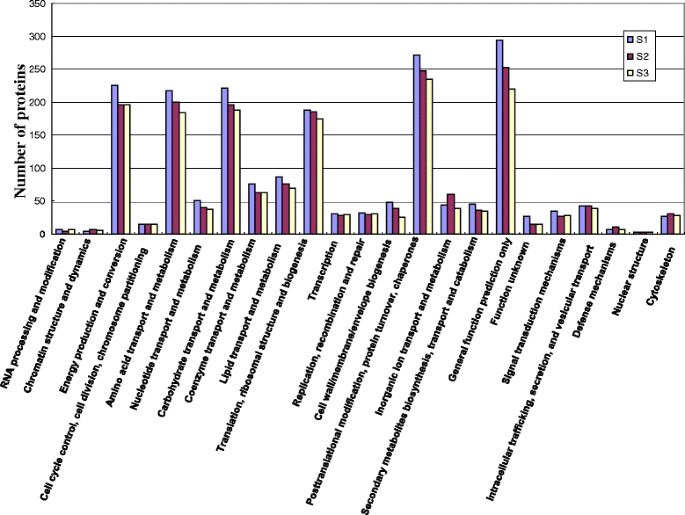
为了进一步评价鉴定的蛋白,我们进行了同源组聚类(COG)分类分析。在23个COG类目中,一般功能预测类目仅分别包含S1、S2、S3中271、247、234个蛋白,占比最大,其次是翻译后修饰类目、能量生产与转化类目、碳水化合物运输与代谢类目、翻译类目、核糖体结构类目。和生物转化。核结构、染色质结构和动力学、RNA加工和修饰代表最小的组,每组只包含少数蛋白质(图)。5).
为了识别S1、S2和S3雌性激素中活跃的生物通路,我们将识别的蛋白质映射到京都基因和基因组百科全书(KEGG)数据库中的参考标准通路[13].总共290,282和278kegg途径分别由S1,S2和S3癌症中鉴定的蛋白质表示,这些途径包括代谢途径,植物 - 病原体相互作用途径,植物激素信号转导途径和脂肪酸生物合成途径(附加文件5:表S5)。这些注释为研究花生雌蕊和荚果发育的具体过程和途径提供了有价值的资源。
与花生荚发育相关的蛋白质
以前的研究表明,花生豆荚的地理坐标发展受到若干因素的调节,例如光,机械刺激,激素和重力。为了鉴定涉及花生POD开发的蛋白质的同源物,我们对NCBI NR数据库进行了BLASTP搜索(E-VALUE <= 10−5).共鉴定出69个与上述关键因子密切相关的调控花生早期荚果发育的蛋白(表1)2).其中13种蛋白与激素代谢和转运有关。其中,生长素结合水解酶、生长素诱导蛋白、生长素结合蛋白、生长素外排载体等10种蛋白参与生长素的生物合成、调控和转运。一个蛋白参与乙烯生物合成,一个蛋白参与油菜素内酯生物合成,一个蛋白参与赤霉素调控。此外,我们在花生蛋白质组数据集中鉴定了26个与重力刺激相关的蛋白,其中一半是热休克蛋白(见表)2)共鉴定出26种参与光和机械刺激的蛋白质,其中一半(13)被标注为过氧化物酶。此外,还鉴定了五种钙相关蛋白,即钙调素5、钙结合蛋白、内质网型钙转运ATP酶4、钙依赖性蛋白丝氨酸/苏氨酸激酶和钙结合EF-hand家族蛋白(表1)2).
花生蛋白质组和转录组的比较分析
在之前的研究中,我们对花生雌蕊和荚果(包括S1、S2和S3样品)进行了转录组分析,并生成了一个整体基因表达谱,为S1、S2和S3雌蕊和荚果发育过程中的基因表达变化提供了有价值的信息[10].通过RPKM (reads per kb per million reads)计算基因表达量。为了评估基因表达在雌蕊发育的这三个阶段的转录后调控,我们将蛋白鉴定结果与基因表达数据进行了比较。所鉴定蛋白与mRNA表达的相关性如表所示2.在数字基因表达谱结果中,共检测到69个关键蛋白中的38个,包括激素合成、重力响应、光、机械刺激和钙的关键蛋白。有趣的是,在蛋白质水平上被发现高度丰富的一些蛋白质(即被多肽检测到的蛋白质)对应的基因转录水平非常低或未被检测到。例如赤霉素调控蛋白(Unigene10067)、热休克蛋白70 (Unigene71426)、热休克蛋白60 (Unigene19291)、液泡H+- atp酶B亚基(Unigene58237, Unigene70168)和过氧化物酶(Unigene57343)。相比之下,花生蛋白组数据中未检测到一些高表达的转录本。例如,PDR-type ABC transporter 2转录本(Unigene71859)在S2 (RPKM 188.56)和S3 (RPKM 91.96)雌花柄中的表达水平高于S1 (RPKM 48.56)。而PDR-type ABC transporter 2蛋白仅在S1雌蕊中检测到,提示相应基因发生了转录后调控。
讨论
蛋白质组学技术是鉴定植物蛋白质的有效方法[14- - - - - -18].近年来,利用二维电泳和质谱联用技术,发现了花生气生雌蕊、地下雌蕊和早期膨大豆荚之间的一些差异表达蛋白[11,12].在目前的研究中,我们将1 DE与nanoLC MS/MS shotgun蛋白质组学分析相结合,提供了花生雌蕊和早期荚果发育过程中的蛋白质组学概况。与传统方法相比,LC - MS/MS分析前的分馏显著增加了鉴定蛋白的数量和单个蛋白的覆盖率[19].我们在花生S1、S2和S3雌蕊柄中成功鉴定了2766、2518和2280个蛋白,其中69个蛋白与重力反应、光和机械刺激以及激素生物合成和转运有关,这些蛋白被认为是花生雌蕊柄伸长和早期荚果发育的重要过程。
与花生其他地上器官不同,气生雌蕊是向下向地面生长的。因此,在地理生长中发挥积极作用的蛋白质可能参与雌蕊发育。据报道,ABC转运体、热激蛋白、微管和微管相关蛋白在植物对重力刺激的反应中起重要作用[20,21].我们在花生蛋白质组数据集中鉴定了26个与重力刺激相关的蛋白质,其中一半是热休克蛋白(见表)2)光和机械刺激是影响花生荚果发育的关键因素[2- - - - - -5,7]在本研究中,我们总共鉴定了26种参与光和机械刺激的蛋白质,其中13种被注释为过氧化物酶。此外,我们还鉴定了5种钙相关蛋白质,即钙调素5、钙结合蛋白、内质网型钙转运ATP酶4、钙依赖性蛋白丝氨酸/苏氨酸激酶、,和钙结合EF-hand家族蛋白(表2).
土壤渗透后,雌蕊柄在黑暗中短时间内继续伸长。而S2雌蕊与S1雌蕊表现出形态和生理上的差异,表明部分蛋白的表达水平发生了变化。在这里,我们检测到574个蛋白特异性表达于S1雌蕊。通过将我们的蛋白质组数据与之前发表的RNA-seq数据集进行比较[10,我们鉴定了91个转录水平高或特异性表达于S1雌蕊的蛋白(附加文件6:表S6)。对其他鉴定的蛋白,相应的基因表达数据与蛋白积累模式不一致。我们根据这91种蛋白质的功能将它们分为11组。在S1雌蕊的特异性蛋白中,有11个蛋白被注释为细胞结构相关蛋白,包括4个果胶甲基酯酶家族成员,2个参与聚半乳糖醛酸酶的蛋白,1个扩张蛋白,1个聚半乳糖醛酸酶抑制蛋白和2个绒毛蛋白。果胶甲基酯酶在花粉萌发、花粉管生长和茎伸长过程中细胞壁伸长中起重要作用[22].膨胀蛋白参与细胞增大,可导致细胞壁不可逆的扩张[23],并与生长素的作用有关[24].推测果胶甲基酯酶和膨化蛋白的积累促进了S1雌蕊的伸长。通过将我们的蛋白质组学数据与之前发表的RNA-seq数据集进行比较,我们还发现了S1 gynophores中其他有趣的蛋白质(附加文件)6:表S6)。例如,拟南芥中与乙烯信号蛋白相关的gdsl基序脂肪酶[25,仅在S1雌蕊中发现。在转录水平上,GDSL-motif脂肪酶unigene 69514在S1 (466.64 RPKM)中表达较强,而在S2 (4.57 RPKM)和S3 (0.18 RPKM)中表达较低。
我们鉴定了307个蛋白质,其在S2床上特别或强烈表达(附加文件2:表S2)。其中35个蛋白的蛋白积累模式与其在S2雌蕊中的转录水平一致(附加文件)7:表S7)。而其他蛋白的积累趋势与其转录本不一致。功能注释和分类结果表明,蛋白积累模式与其转录本一致的蛋白中有1 / 3为代谢和次级代谢相关酶,如花青素- o -酰基转移酶、咖啡酸o -甲基转移酶和植酸酶。此外,还鉴定出3种与疾病和防御相关的蛋白,即III类过氧化物酶、过氧化物酶1前体和过氧化物酶样蛋白。过氧化物酶是植物中发现的一类同工酶,其功能包括去除H2O2,细胞壁木质素的生物合成和降解,生长素的分解代谢,对伤害的防御反应,以及对病原体或昆虫攻击的防御[26].我们认为过氧化物酶在地下雌蕊发育中起重要作用。在S2雌蕊中特异性鉴定出4种转运相关蛋白,即氨基酸/多胺转运体II、MATE外排家族蛋白、pdr型ABC转运体2和糖转运体ERD6-like 6。
与RNA-seq数据集相比[10],我们发现有26个S3蛋白在蛋白和mRNA水平上都有高表达或特异性表达(附加文件8:表S8)。其中7种酶参与代谢和次级代谢,包括肉桂酸4-羟化酶(C4H)。C4H是木质素和花青素生物合成途径中4-羟基肉桂酸合成的关键催化酶。此外,在S3雌花柄和荚果中发现脂肪酸和淀粉合成相关蛋白,如脂氧合酶、fad结合域蛋白和淀粉分支酶I等,表明干物质积累和种子发育在这一阶段开始。在早期膨大豆荚中鉴定了5种细胞生长、分裂和细胞结构蛋白。当荚果开始膨胀时,雌蕊柄的伸长停止。高水平的肌动蛋白和微管相关蛋白的积累表明S3雌蕊的细胞骨架发生了剧烈的变化。S2和S3雌蕊柄中特异性和高度丰富的蛋白质的鉴定为深入了解地果荚发育的分子机制提供了有价值的信息。
结论
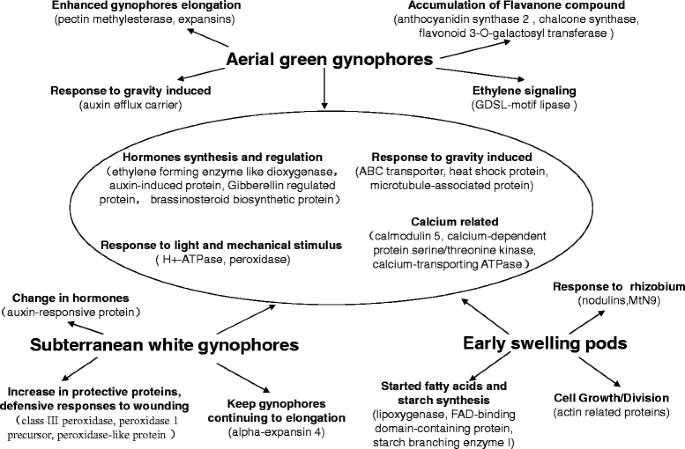
我们对蛋白质组和转录组数据的综合分析为调控雌蕊柄和荚果发育的机制提供了有用的信息。6).在空中生长过程中,果胶甲基酯酶和扩张素的积累促进了雌蕊的生长和伸长。S1雌蕊柄中鉴定的ABC转运体、热激蛋白、微管相关蛋白和生长素外排载体对控制雌蕊柄的生长方向具有重要作用。土壤渗透后,新的环境和土壤摩擦导致保护蛋白水平增加,如III类过氧化物酶、过氧化物酶1前体和过氧化物酶样蛋白。S2样品中检测到α -expansin 4,在雌蕊柄土壤渗透后,可能会促使雌蕊柄在短时间内继续伸长。当S3雌荚形成后,脂肪加氧酶、fad结合域蛋白、淀粉分支酶i等与脂肪酸代谢和淀粉生物合成相关的酶水平升高,肌动蛋白相关蛋白在荚果发育早期积累。有趣的是,我们观察到结瘤蛋白和相应的蛋白在荚果早期形成过程中都有强烈的表达,这表明结瘤和荚果早期发育可能有相似的机制。我们的蛋白质组分析结果为花生荚发育的控制机制提供了有用的见解。
方法
植物材料
“鲁花14”是中国北方广泛种植的品种,于5月初在山东省农业科学院实验农场播种,10月初收获。S1、S2和S3雌蕊柄从农场种植的植物中收集(图。1).从S1、S2、S3雌蕊中切除最尖端1 cm,立即用液氮冷冻提取蛋白。
蛋白质的提取
根据以下方法进行蛋白质萃取。简而言之,将样品研磨到液氮中的粉末,然后悬浮在萃取溶液中(7M尿素,2μm,4%CHaps,40mM Tris-HCl(pH 8.5),1mM PMSF,2mM EDTA和10mm dithriothreitol(dtt))。5分钟后,将上述悬浮液在200W中超声处理15分钟,然后在4℃下以30,000g离心15分钟。仔细收集上清液,加入含有10%(v / v)TCA的5×体积的冷却丙酮,并将样品井井混合并在-20℃下温育过夜。在4℃下以30,000g离心15分钟后,弃去上清液,用冷却的丙酮洗涤沉淀物三次。在风干后,将沉淀物溶解在含有7M尿素,2M硫脲,4%NP40和20mM Tris-HCl(pH8.0-8.5)的裂解缓冲液中。将悬浮液在200W中超声处理15分钟,并在4℃下以30,000g离心15分钟。收集上清液并转移到新管中以进一步分析。
聚丙烯酰胺凝胶电泳和凝胶消化
从花生样品中提取的蛋白与SDS负载缓冲液混合,在100℃变性5分钟。蛋白在100 V下用12%聚丙烯酰胺凝胶电泳(SDS- page)分离。电泳后,按照制造商的说明用考马斯亮蓝R-250 (Pierce,美国)对凝胶进行染色。将蛋白条带依次垂直切成10片,每片置于单独的Eppendorf管中。每个凝胶片被切成大约1毫米3.并使用含有50%乙腈(ACN)的50 mM碳酸氢铵彻底去除在37°C下,将凝胶切片与含有25 mM碳酸氢铵的10 mM DTT在60°C下孵育1 h以减少二硫键,然后在黑暗中在室温下与含有25 mM碳酸氢铵的55 mM碘乙酰胺烷基化45 min。通过添加0.01μg/μL胰蛋白酶金(Promega,美国)进行凝胶内消化消化后,在50%ACN中使用0.1%甲酸(FA)进一步提取肽两次。提取的肽干燥并储存在干燥的环境中−80°C用于LC-MS/MS分析。
LC-MS / MS实验
胰酶消化的肽样品在缓冲液A (5% ACN和0.1% FA)中重新溶解,在4°C和20 000 g离心10分钟,以去除不溶性物质。肽的最终浓度约为0.5 μg/μl。然后,按照说明书将10 μl上清液装入纳米高效液相色谱体系(日本岛津)。分离过程如下。首先,将多肽装入10厘米C18捕获柱(内径75 μm;水域,美国)。8点在分离过程中,样本加载μL / min 4分钟,然后44-min梯度是运行在300 nL /分钟开始2 - 35%缓冲B FA ACN(98%和0.1%),其次是2分钟的线性梯度80%缓冲B,和维护在80%缓冲B为4分钟,最后恢复到5%的缓冲B / 1分钟的时间。对多肽进行纳米电喷雾电离,然后串联质谱分析。
分离的多肽经LTQ Orbitrap Velos (Thermo, USA)串联质谱(MS/MS)与高效液相色谱系统在线耦合。在Orbitrap中以60000的分辨率扫描完整的多肽,并进一步选择碰撞诱导解离(CID)操作,其标准化碰撞能量设置为35% [27].在LTQ中检测到离子碎片。应用了一个数据依赖的程序,在一次MS扫描和10次MS/MS扫描之间交替进行,使用以下动态排除设置检测超过阈值离子计数5000的10个最强烈的离子:重复计数2;重复持续30秒;排除时间为120秒。施加电喷雾电压为1.5 kV。采用自动增益控制(AGC)防止离子阱和1 × 10过充4离子在离子阱中积累,生成CID光谱。对于MS扫描,m/z扫描范围为350 ~ 2000 Da。
数据分析和统计
从Orbitrap获得的原始数据文件使用蛋白质组发现者1.2(Thermo,USA)转换为MGF文件。使用吉祥物搜索引擎(Matrix Science,UK;版本2.3.02)对花生转录组数据库进行蛋白质注释,该数据库包含72527个单基因[10].蛋白质鉴定的参数列在附加文件中9:表S9,肽和蛋白质的错误发现率(FDR)设置为0.05。
利用Blast2 GO程序对NCBI的非冗余蛋白数据库进行功能注释[28].KEGG通路分析通过与KEGG数据库进行比较(http://www.genome.jp/kegg/).COG分类通过将鉴定的蛋白与Orthologous Groups的Cluster数据库(http://www.ncbi.nlm.nih.gov/COG/).
可获得的支持数据
蛋白质组学的质谱数据已存入ProteomeXchange联盟(http://proteomecentral.proteomexchange.org) [29通过使用数据集标识符PXD002579-81和DOI 10.6019/PXD002579-81的PRIDE合作伙伴存储库。本文讨论的RNA-Seq数据已保存在NCBI的基因表达集[30],并可透过GEO系列接入号GSE70972 (http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE70972).”
缩写
- S1:
-
空中种植雌蕊柄
- S2:
-
地下生长的不肿胀的雌蕊
- S3:
-
地下生长的雌蕊具早期膨大荚
- PRKM:
-
读取每kb /百万次读取
- 质/女士:
-
液相色谱-串联质谱法
- 走:
-
基因本体论
- 齿轮:
-
同源群的群集
- Kegg:
-
京都基因和基因组百科全书
参考
- 1.
Vijayasamundeeswari A、Vijayanandraj S、Paranidharan V、Samiyappan R、Velazhahan R.黄曲霉毒素B.J植物交互作用的综合管理。2010;5(1):59–68.
- 2.
Zharare GE, Blamey F, Asher CJ。花生的形成和形态发生(花生l .)溶液培养中的豆荚。安Bot-London。1998年,81(3):391 - 6。
- 3.
Thompson LK, Ziv M, Deitzer GF。花生的光控(落花生hypogaeaL.)体外胚胎和胚珠发育。植物理性。1985; 78(2):370-3。
- 4.
Thompson LK, Burgess CL, Skinner EN。花生光敏色素的定位(落花生hypogaea)雌蕊柄和胚珠发育。Am J Bot. 1992; 79:828-32。
- 5.
《花生的角色》(海生花生)胚珠组织在胚胎光形态发生反应中的作用。《植物科学》1988;57(2):159-64。
- 6.
Shlamovitz N,Ziv M,Zamski E.光、暗和生长调节剂与花生的关系(落花生hypogaea荚果发育。植物生长规律。1995;16(1):37-42。
- 7.
花生荚果的形成及其各向异性,落花生hypogaea,与光和机械刺激有关。安Bot-London。40 1976;(3): 631 - 6。
- 8.
Murata MR,Zharare GE,Hammes PS.荚果区的pH值影响花生的生殖生长.植物营养杂志.2007;31(1):69-79。
- 9.
陈X,朱W,Azam S,李H,朱F,李H,等。花生地上和地下幼荚转录组的深度测序分析确定与早期胚胎败育相关的候选基因。植物生物技术杂志。2013;11(1):115-27。
- 10.
夏H,赵C,侯L,李A,赵S,毕Y,等。花生雌蕊柄转录组分析揭示了黑暗条件下早期荚果发育过程中基因表达的全局重编程。BMC基因组学。2013;14(1):517。
- 11.
朱伟,张鹗,李洪,陈旭,朱峰,洪勇,等。花生地上和地下荚果发育过程中荚果膨大相关蛋白的比较蛋白质组学分析。J蛋白质组。2013;91:172 - 87。
- 12
孙勇,王强,李智,侯磊,戴胜,刘伟。暗刺激和机械刺激下花生雌蕊发育的蛋白质组学比较。蛋白质组学杂志2013;12(12):5502-11。
- 13
Kanehisa M,Goto S,Kawashima S,Okuno Y,Hattori M.破解基因组的KEGG资源。核酸决议,2004年;32补充资料1:D277-80。
- 14
杨敏,刘艳,刘艳,陈辉,陈飞,沈胜。麻疯树种子萌发及萌发后发育过程中油脂动员的蛋白质组学分析。中国蛋白质组学杂志2009;8(3):1441 - 1446。
- 15
杨鹏,李旭,王旭,陈辉,陈飞,沈胜。水稻种子萌发过程的蛋白质组学分析。蛋白质组学,2007;7(18):3358 - 68。
- 16
黄志强,王志强,王志强,等。大豆蛋白质组学在大豆非生物胁迫反应中的应用。蛋白质组学杂志2013;12(11):4670-84。
- 17.
Kosová K, Vítámvás P, Prášil IT, Renaut J.非生物胁迫下的植物蛋白质组变化J蛋白质组。2011;74(8):1301 - 22所示。
- 18.
李X,白吨,李,,阮X,李海。富含镰刀虫F的蛋白质组学分析。sp。立方体热带种族4-接种对香蕉根细胞中镰刀菌的反应。蛋白质组SCI。2013; 11(1):41。
- 19.
陈家强,张志强,朱立文,等。强阳离子交换法和SDS-PAGE法分析多蛋白复合物的比较。中国蛋白质组学杂志2010;9(12):6696-704。
- 20
Collings Da,冬天H,Wyatt SE,艾伦NS。茎成熟期间生长动力学和细胞骨架组织弯曲玉米《植物志》,1998;207(2):246-58。
- 21
太空飞行与拟南芥组织培养细胞中的热休克蛋白和其他分子伴侣基因相关。acta botanica yunnanica(云南植物研究). 2013;100(1):235-48。
- 22.
姜湖,杨某,谢莉,三浦C,张X,杨开,等。Vanguard1编码果胶甲基酯酶,可增强拟南芥风格和传递道的花粉管生长。植物细胞。2005; 17(2):584-96。
- 23.
麦昆梅森SJ, Cosgrove DJ。细胞壁上的作用模式(分析细胞壁水解、应力松弛和结合)。植物杂志。1995;107(1):87 - 100。
- 24
Cho H,Cosgrove DJ。拟南芥根发引发和扩张基因表达的调节。植物细胞。2002; 14(12):3237-53。
- 25
权世杰,陈建中,李胜,南MH,郑智华,权思,等。在拟南芥中,GDSL脂肪酶‐like 1调节与乙烯信号相关的系统性抗性。植物j . 2009; 58(2): 235 - 45。
- 26
Yoshida K,Kaothin P,Matsui T,Kawaoka A,Shinmyo A.植物过氧化物酶基因的分子生物学和应用.应用微生物生物学.2003;60(6):665-70。
- 27
李国栋,李国栋,李国栋,等。通过锁定质量注入到c阱的轨道rap质谱仪的百万分之一质量精度。细胞蛋白质组学杂志。2005;4(12):2010-21。
- 28
Conesa A,Götz S,GarcíA-Gómez JM,Terol J,Talón M,Robles M.Blast2GO:功能基因组学研究中注释、可视化和分析的通用工具。生物信息学。2005;21(18):3674–6。
- 29.
Vizcaíno JA, Deutsch EW, Wang R, Csordas A, Reisinger F, Ríos D,等。ProteomeXchange提供全球协调的蛋白质组学数据提交和传播。生物科技本质》。2014;30(3):223 - 6。
- 30
埃德加R,多姆拉切夫M,鞭笞AE。基因表达综合:NCBI基因表达和杂交阵列数据库。核酸学报2002;30(1):207-10。
致谢
中国科学技术部(2013AA102602,2011BAD35B04,2012BAD3B07),国家自然科学基金(31101427),山东省省中青年科普科研基金(山东省台山学者基金会(BS2014SW017),中国科学技术研究基金会)山东省种质创新与利用项目和“山东省农业科学院青年人才培养计划”。
作者信息
隶属关系
通讯作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
XW和XZ设计了这项研究。CZ、SZ、LH、HX、JW、CL、AL和TL进行了大部分实验和数据分析,并编写了手稿的材料和方法部分。XW和CZ编写了手稿,生成了数字,并完成了表格。所有作者都阅读并批准了最终手稿。
附加文件
附加文件1:表S1。
S1雌蕊柄中鉴定的特异性蛋白。(XLS 247 kb)
附加文件2:表S2。
在S2牙科树上鉴定的特异性蛋白质。(XLS 147 KB)
附加文件3:表S3。
S3雌蕊柄中鉴定的特异性蛋白。(XLS 91 kb)
附加文件4:表S4。
在S1、S2和S3雌蕊中发现的常见蛋白。(XLSX 419 kb)
附加文件5:表S5。
S1、S2和S3雌蕊柄中鉴定的蛋白的通路分析。(XLS 778 kb)
附加文件6:表S6。
S1雌蕊柄中特异性蛋白的转录组和功能分析。(医生205 kb)
附加文件7:表S7。
S2雌蕊柄特异蛋白的转录组和功能分析。(医生94 kb)
附加文件8:表S8。
S3雌蕊柄中鉴定的特定蛋白质的转录组和功能分析(DOC 70kb)
附加文件9:表S9。
吉祥物参数(文档28KB)
权利和权限
开放存取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条中提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
赵,C.,赵,S.,侯,L。et al。蛋白质组学分析揭示了花生雌蕊在不同发育阶段的不同激活途径。植物生物学15,188 (2015). https://doi.org/10.1186/s12870-015-0582-6
收到:
接受:
发表:
关键字
- 棒曲霉素
- 果胶Methylesterase
- 重力刺激
- 植物激素信号转导途径
- 蛋白质积累模式