摘要
背景
GRAS转录因子通常作为多种生长调控和环境信号的整合者,包括腋芽分生组织形成、根径向模式、植物激素、光信号和非生物/生物胁迫。然而,人们对番茄(茄属植物lycopersicum),肉质水果的作物种类最重要的模型植物。
结果
本研究根据番茄全基因组序列及其染色体分布,鉴定并重新命名了53个GRAS基因,其中19个基因保留原有名称。多序列比对显示这些蛋白具有典型的GRAS结构域。番茄GRAS蛋白的系统发育分析拟南芥,杨树,P.mume和水稻透露,Slgras蛋白可分为至少13个亚壳。SlGRAS24和SlGRAS40利用5 ' -RACE (cDNA末端快速扩增)技术鉴定为miR171的靶基因。qRT-PCR分析显示,该基因在组织/器官和发育阶段具有特异性表达模式Slgras.基因。此外,还研究了它们在不同激素和非生物胁迫下的表达模式。
结论
本研究首次对番茄基因组中GRAS基因家族进行了全面分析。这些数据无疑将有助于更好地了解GRAS基因的潜在功能,以及它们在介导番茄及其他相关物种激素交互作用和非生物胁迫中的可能作用。
背景
转录因子(TFS)是功能基因组学的重要组成部分。由于在玉米中发现了第一个转录因子[1],大量的转录因子已被证实参与高等植物的各种生理过程和调控网络。GRAS蛋白以GAI、RGA和SCR命名[2- - - - - -4,是这个家族中在功能上确定的前三个成员。通常,该家族蛋白在其c端具有相当的序列同源性,其中LHR I、VHIID、LHR II、PFYRE和SAW等基序可依次识别[5- - - - - -7].相反,GRAS系列的N-末端的长度和序列变化,似乎是每个基因功能特异性的主要贡献者[6,8].
到目前为止,GRAS基因家族已经在几种植物中进行了全基因组的探索,包括杨树,拟南芥、大米、大白菜、李属却已,松木[9- - - - - -12].然而,只有少数GRAS蛋白的功能特征,包括在玉米,矮牵牛织布达,Medicago truncatula,百合longiflorum[13- - - - - -16].这些基因在植物生长发育的各种基本过程中发挥着重要作用。例如,广为人知的GRAS蛋白的一个分支,在其n端具有氨基酸序列DELLA,因此被称为DELLA蛋白,其功能是赤霉素信号转导的阻遏因子[4].属于Gras系列的两个不同子分支的SCR和SHR均涉及通过形成SCR / SHR复合物的根源的径向组织[17].两项独立的研究表明,内胚层表达的SCL3作为GA/DELLA和SCR/SHR通路下游的整合者,介导了GA促进根发育过程中的细胞伸长[18,19].另一个子分支,其中包含4个高度同源拟南芥,Pat1,SCL5,SCL13和SCL21涉及光信号通路。有趣的是,Pat1,SCL5,SCL21是Phytochrome-A信号转导的正稳压因子,而SCL13主要参与Phytochrome-B信号转换[20.- - - - - -22].两种GRAs蛋白,NSP1和NSP2可以形成DNA结合复合物,这对于豆类中的结节信号传导至关重要[23].MOC1主要在腋芽中表达,在控制水稻分蘖中起着关键作用[24].Ls和拉斯维加斯,番茄中MOC1的同源基因拟南芥,也在番茄腋生分生组织形成过程中起作用[25,26].此外,lisl是一些减数分裂相关基因的转录激活子,参与百合花药小孢子发生[16].HAM介导分化细胞的信号,控制芽分生组织的维持佩妮[14].和三个拟南芥orthologs佩妮HAM、SCL6/SCL6- iv、SCL22/SCL6- iii和SCL27/SCL6- ii,也被认为是miRNA170/171转录后降解的靶点,已被证明在分生组织细胞的增殖、极性组织和叶绿素合成中发挥重要作用[27- - - - - -29].
番茄(茄属植物lycopersicum)是一种重要的作物,具有很高的营养价值和商业价值,也是肉质果实发育的良好模式植物。随着番茄全基因组序列的释放[30.],现在对整个基因家族进行综合分析非常方便。迄今为止,转录因子家族如ERF、WRKY、SBP-box、IAA、ARF和TCP已经在番茄中被鉴定[31- - - - - -36].在这里,考虑到GRAS蛋白在植物生长调节中的重要作用以及作物中缺乏关于该基因家族的信息,我们描述了番茄中整个GRAS基因系列转录因子的第一次表征。目前的工作确定了53个推定Slgras.基因,并分析其基因分类、染色体分布、系统发育比较和外显子-内含子组织。此外,还进行了表达式剖面分析Slgras.利用实时定量pcr技术对不同营养和生殖发育阶段的基因进行了检测,并研究了它们在不同激素和非生物胁迫下的转录丰度。本研究提供了GRAS基因家族的详细信息,有助于进一步进行功能鉴定克拉斯基因在番茄。
结果
鉴定和多序列分析Slgras.基因
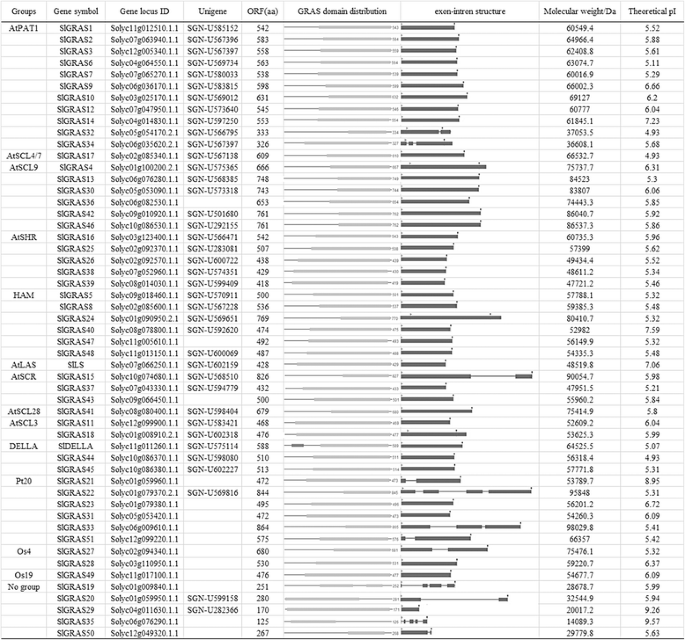
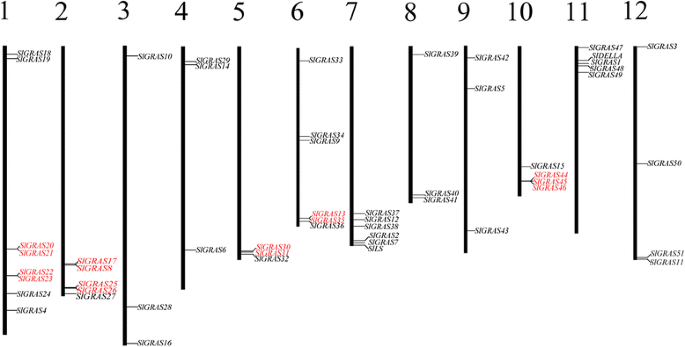
Phytozome搜索工具(http://www.phytozome.net/search.php),使用“GRAS”进行关键词搜索,根据pfam GRAS隐马尔可夫模型(PF03154)搜索得到54个基因。但其中Solyc09g090830.2.1被排除在外,因为它仅代表部分GRAS结构域,且在Tomato Genome数据库中被注释为BolA-like蛋白(ITAG2.4 Release: genomics annotations)。同时,利用特征AtGRAS蛋白的氨基酸(AA)序列进行BLASTP分析,获得了51个之前注释过的番茄WGS染色体(SL2.50) GRAS成员,均包含在这53条染色体中克拉斯基因识别。随后,在线生物信息学工具ExPASy-PROSITE (http://prosite.expasy.org/)和NCBI的TBLASTN显示,所有序列均含有GRAS结构域,进一步证实了所鉴定序列的真实性Slgras.基因。在番茄基因组中共鉴定出53个不同的GRAS转录因子。1和额外的文件1).53个番茄克拉斯基因映射到12种番茄染色体上,然后基于它们的分布和相对线性序列中的各染色体中的相对线性序列(图。2),其中,SlDELLA和SlLs保留了他们已经存在的名字,还有SlGRAS1来SlGRAS17, Mayrose等人曾对此进行过描述[37]. 西红柿克拉斯基因在染色体上的分布不均匀。, Chr1占最大数量克拉斯基因(n = 8), 4, 4, 5, 5, 6和6克拉斯在Chr10、chr12、Chr2、Chr11、chr6和Chr7上分别发现了3个基因,其余5条染色体各有3个克拉斯基因。此外,还有15个Slgras.基因(SlGRAS20,SlGRAS21,SlGRAS22,SlGRAS23,SlGRAS17,SlGRAS8,SlGRAS25,SlGRAS26,SlGRAS30,SlGRAS31,SlGRAS13,SlGRAS35,SlGRAS44,SlGRAS45,SlGRAS46)聚集成番茄染色体1(2个簇),2(2个簇),5(1个簇),6(1簇)和10(1簇)上的七个串联复制事件区域(图。2和额外的文件2).推导出的GRAS蛋白质的大小差别很大,从125个氨基酸(SlGRAS35)至864氨基酸(SlGRAS33).分子量在14 ~ 98 kDa之间变化,预测的理论pI也在4.93 ~ 9.57之间变化。这些事实表明,不同的SlGRAS蛋白可能在不同的微环境中发挥作用。大多数成员都有一个可变的n端和一个高度保守的c端GRAS结构域。然而,三名成员(SlGRAS20,SlGRAS29,SlGRAS35)在n端呈现GRAS结构域,而SlGRAS19,包含两个GRAS域。有趣的是,发现了41个只有一个外显子的GRAS基因,这似乎是该基因家族在许多植物物种中普遍存在的现象[9- - - - - -12].其他的外显子数克拉斯基因范围从两到五。有关每个的更多详细信息克拉斯基因如图所示。1,包括克拉斯基因组名、基因座数、编码序列长度、GRAS结构域示意图、外显子-内含子结构、分子量及理论pI信息。
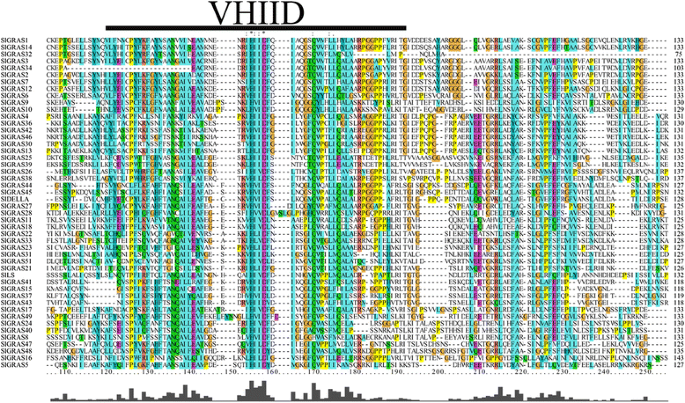
通过对预测的GRAS结构域序列进行比对,我们发现部分成员含有缺失基序的部分GRAS结构域,其中一些基序被严重截断。例如在番茄中,SlGRAS35的GRAS结构域可能短至85个氨基酸,而典型的GRAS结构域的最小长度约为350个氨基酸(如At4g00150, SlGRAS38),因此有5个非标准GRAS蛋白(SlGRAS19, SlGRAS20, SlGRAS29, SlGRAS35,SlGRAS50)被排除在下面的一些分析(多序列比对和系统发育分析)中,因为这些片段的合并可靠性较低。此外,虽然对48个分析的SlGRAS蛋白进行多序列分析,总体同源性较低,但在它们的GRAS结构域可以观察到5个最显著的基序,包括富亮氨酸区I (llr I)、VHIID、富亮氨酸区II (llr II)、PFYRE和SAW(图)。3.和额外的文件3.).
系统发育分析和GRAS成员分类拟南芥和番茄
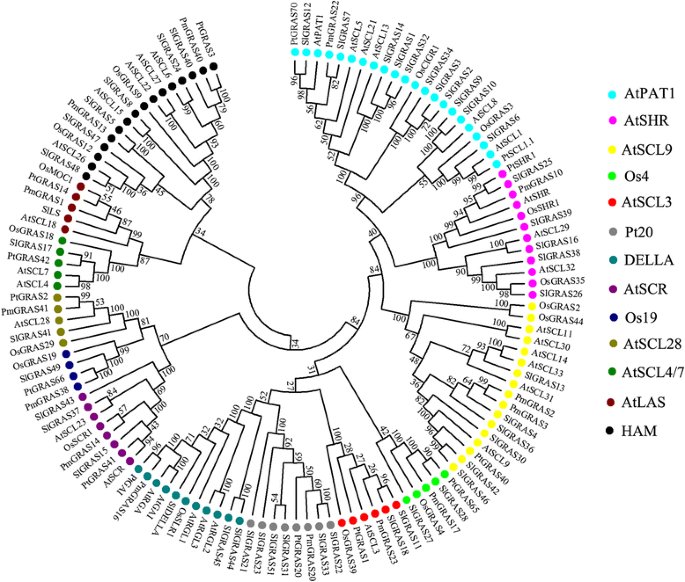
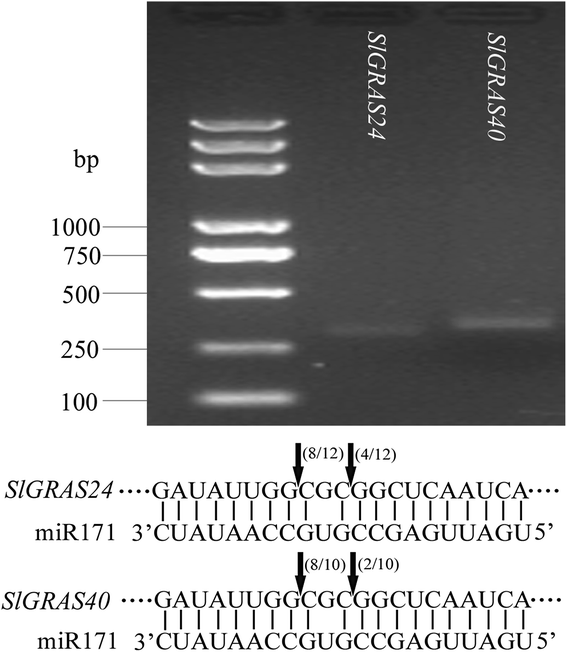
为了揭示番茄GRAS基因家族的进化史,并帮助对其进行分类,共收集了124个GRAS蛋白,其中32个来源于番茄拟南芥,来自番茄48,14来自李属却已, 14杨树利用MEGA6.0软件,利用neighbor - joining (NJ)方法构建无根系统发生树(图6)。4).根据系统发育树,GRAS蛋白可分为13个亚家族:AtPAT1, AtSCL4/7, AtSCL9, AtSHR, HAM, AtLAS, AtSCR, AtSCL3, AtSCL28,DELLA, Pt20, Os4,和Os19。9].值得注意的是,一些在以前的出版物中被认为是种特异性的GRAS蛋白在番茄中有同源性。例如,6个西红柿Slgras.基因(SlGRAS21,SlGRAS22,SlGRAS23,SlGRAS31,SlGRAS33,SlGRAS33),与PmGRAS20和PtGRAS20,属于“PT20”亚家族,以前被认为是杨树特殊技能组(9].两个(SlGRAS27,SlGRAS28)和一个(SlGRAS49) 番茄克拉斯基因分别聚集成“OS4”和“OS19”亚家族,以前被报告为米米蛋白组[9].这三个亚家族不包括任何一个拟南芥基因,暗示谱系特异性基因丢失拟南芥.其他10个亚家族都有庇护克拉斯5个物种的基因都有1到11个Slgras.每组基因。迄今为止,SlLS和SlDELLA蛋白在番茄中的功能已经被清楚地阐明[25,38- - - - - -40].ATPAT1亚家族包括来自番茄的11个成员,两个SLGRAS蛋白(SLGRAS7和SLGRAS12)和三个SLGRAS蛋白(SLGRAS1,SLGRAS14,SLGRAS32)分别与ATPAT1和ATSCL13分别具有高序列相似性,其分别与PHYTOCHROME A和B信号相关[22],表明番茄GRAS同源物在植物中的信号转导中可能具有类似的功能。将六种蛋白质(SLGRAS4,SLGRAS13,SLGRAS30,SLGRAS36和SLGRAS42)聚集到ATSCL9亚家族中。虽然是生物学作用拟南芥这个组的GRAS蛋白大部分是未知的,这个组的一个成员在百合longiflorum在微孢子发生期间被鉴定为转录调节剂的命名为riscl [16].5个(SlGRAS16、SlGRAS25、SlGRAS26、SlGRAS38、SlGRAS39)和3个(SlGRAS15、SlGRAS37、SlGRAS43)蛋白分别属于AtSHR和AtSCR亚家族。考虑AtSHR和AtSCR蛋白在根、茎径向模式中的重要作用[17,我们预测这些同源基因可能与番茄根和茎的发育有关。有两个蛋白(SlGRAS11和SlGRAS18)属于AtSCL3亚家族,通过整合多种信号调控根细胞的伸长拟南芥[18,19].SlGRAS41是番茄AtSCL28亚家族的唯一成员,在水稻中发现了一个同源基因,OSGRAS29.(也称为DLT),通过调节油菜素内酯信号来控制植株高度[41].有6个SlGRAS蛋白(SlGRAS5、SlGRAS8、SlGRAS24、SlGRAS40、SlGRAS47和SlGRAS 48)聚集在HAM亚家族中。在拟南芥,该组3个GRAS蛋白受miR171的转录后调控(ATSCL6.,22,27) [42,43]. 这里,这些最接近的同系物拟南芥番茄里有两个基因,SlGRAS24和SlGRAS40这两种基因都有可能与Sly-miR171结合。因此,我们进行了5 ' -RACE来确认它们之间的关系。正如预期的那样,5 ' -RACE产品的预测尺寸将由裂解产生SlGRAS24和SlGRAS40模板可以被放大。随后,克隆了这些产品,并确定了几个独立插入物的序列。测序结果显示,每个基因与Sly-miR171成熟序列的互补序列以及剪切位点完全相同(图。5).有趣的是,在网上分析(http://plantgrn.noble.org/psRNATarget/)显示HAM亚家族的另一个成员,SlGRAS8,也能结合Sly-miR171成熟序列,并被预测通过翻译抑制而不是mRNA切割来调控,提示Sly-miR171及其靶基因在番茄中的调控机制复杂。
另外,进一步探索番茄与茄科其他作物GRAS基因的同源关系,50和30克拉斯马铃薯基因(茄属植物tuberosum)胡椒粉(一年生辣椒分别选择构建另一个系统发育树(附加文件4).我们发现几乎每一个成员Slgras.基因(不包括SlGRAS17在马铃薯和辣椒基因组中有一个或两个同源基因,表明马铃薯和辣椒之间的进化保守和更密切的同源关系克拉斯近亲物种的基因。
表达分析Slgras.不同组织和器官的基因
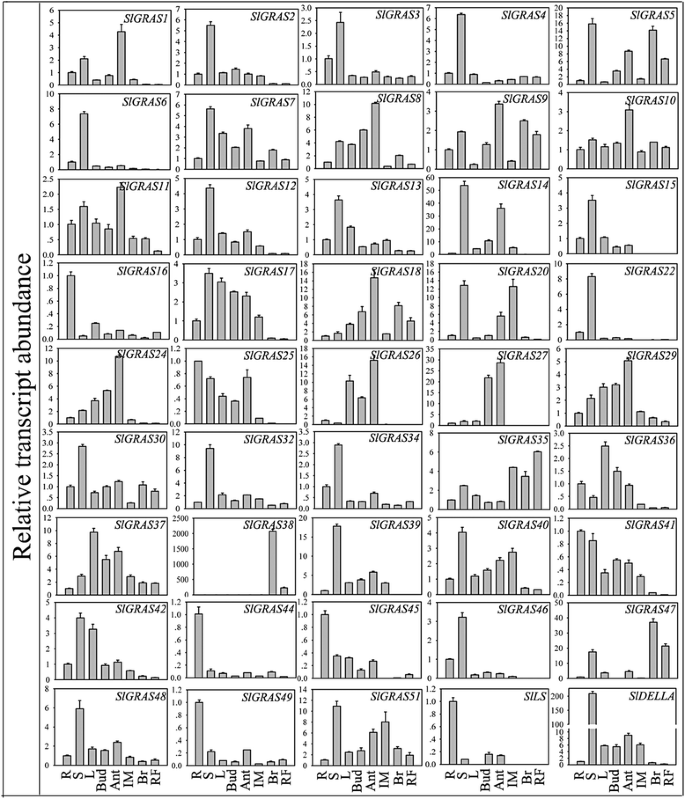
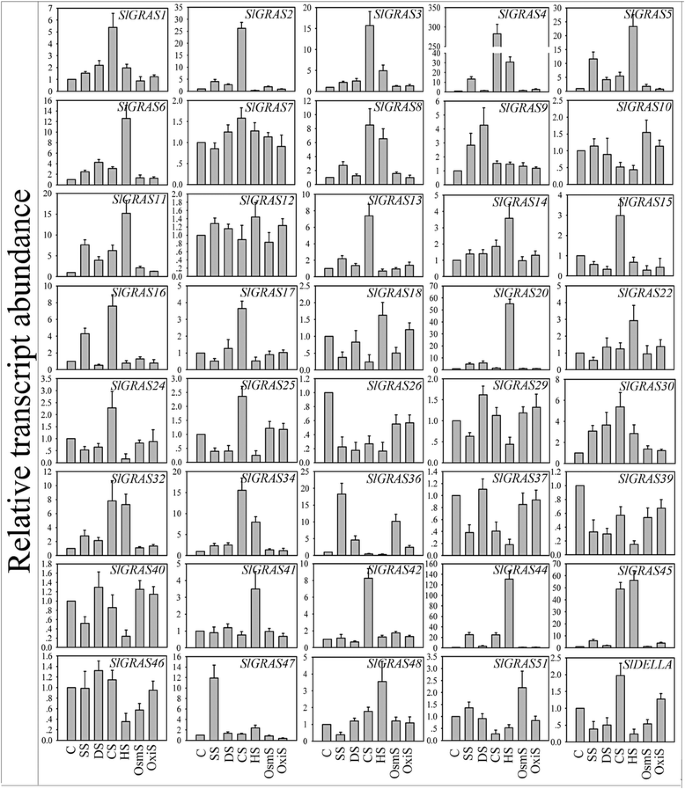
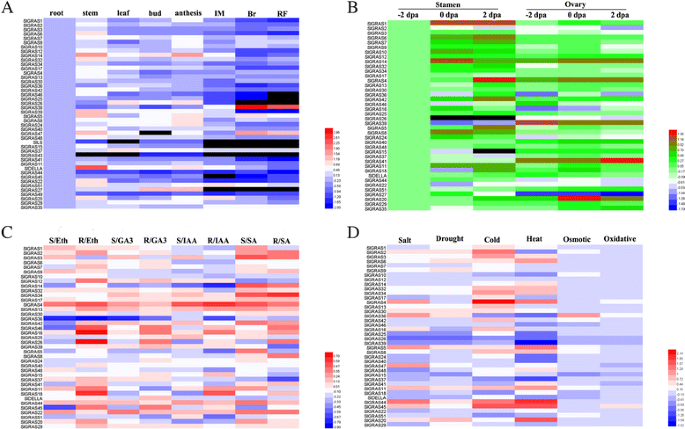
研究…的势函数Slgras.利用qRT-PCR技术,对其在番茄根、茎、叶、芽、花等不同组织和果实发育三个阶段的表达模式进行了分析。在qPCR分析中,Ct值为> 36的基因被视为非表达基因。如图所示。6和10,共45岁Slgras.获得基因转录物,而8其他Slgras.由于其低表达水平或可能是假药,因此无法检测到基因。显然,不同组织中的表达水平在番茄中的差异很大克拉斯基因,以及个体的不同组织中克拉斯基因。其中23个基因在茎中表达量最高,10个基因在花中表达量最高,8个基因在根中表达量最高。在果实发育过程中,未成熟果实的转录本丰度普遍高于成熟果实,提示这些基因可能与果实早期发育有关。然而,与未成熟期相比,一些基因在破茧期表现出戏剧性的增加。例如,SlGRAS38,SlGRAS35,SlGRAS47在果实成熟过程中表现出较强的特异性表达,表明它们在果实成熟过程中可能具有重要的功能意义。
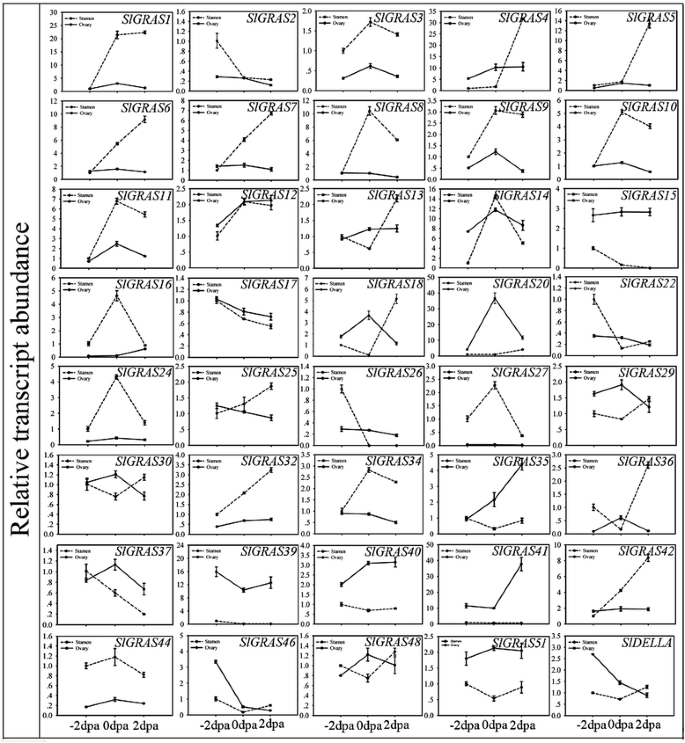
大量的Slgras.基因在花中表达量较高,表明这些基因在花组织中具有重要作用。由于许多GRAS蛋白参与调控赤霉酸(GA)反应,GA是坐果过程中的关键植物激素之一[44,45],我们分析了基因的表达谱Slgras.在花 - 果过渡过程中的基因(图7和10 b).在这40人中Slgras.其中,16个基因在雄蕊中表达量较高,12个基因在子房组织中表达量较高,表明GRAS基因家族成员在番茄花器官中的功能专门化,至少在雄蕊和子房中是这样。数据表明,大多数Slgras.这表明GRAS家族成员在授粉/受精过程中发挥着不同的作用。
表达分析Slgras.基因对激素治疗的反应
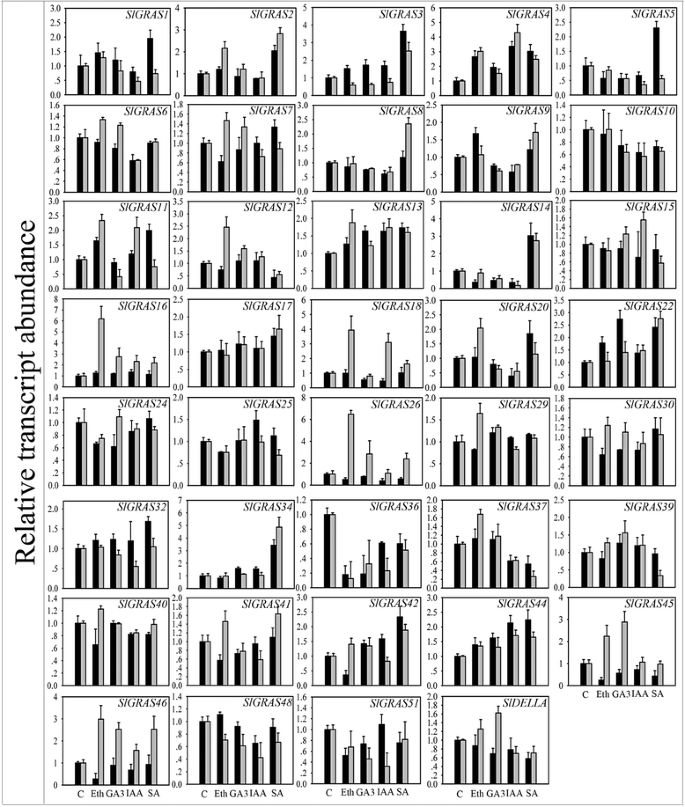
植物激素在植物发育的各个方面的调控作用已经得到了广泛的研究。在这项研究中,激素治疗导致了各种各样的Slgras.基因表达谱(图。8和10 c).39克拉斯检测到的基因在对不同激素处理的反应以及对单个激素处理的不同组织的反应中存在显著差异,这表明Slgras.基因的信号选择性不仅在不同激素之间存在差异,而且在番茄幼苗的不同组织之间也存在差异。在乙烯利(Eth)处理中,分别为15和12Slgras.基因分别诱导和抑制。其中,最上调的基因是SlGRAS26在根中,下调最多的基因是SlGRAS36在拍摄。同样,GA治疗导致10和9Slgras.显然基因分别诱导和抑制,最上调的基因是最上调的基因SlGRAS26在根中,而最暗的基因是SlGRAS36在根。在IAA治疗中,是6和17Slgras.分别显著诱导和抑制,和SlGRAS4和SlGRAS14而在根中则表现出最多的上调和下调。至于SA治疗,20和9Slgras.基因分别出现急剧增加和减少,SlGRAS34和SlGRAS37在根中经历了最大的增加和减少。值得注意的是,在应对相同的激素治疗时,几种基因甚至在根和芽中表达相反表达。例如,SlGRAS3对Eth、GA3和IAA处理,地上部表达上调,根系表达下调。相似的表达模式在SlGRAS18,SlGRAS26,SlGRAS41,SlGRAS45,SlGRAS46.研究结果表明,这些基因对番茄激素的响应具有复杂的调控机制。综上所述,这些表达变异表明SlGRAS基因家族成员受到广泛的激素信号的共同调控。因此,我们有理由推测,这些相关基因可能在激素的相互作用中发挥关键作用,并应在该领域进行进一步研究。
表达分析Slgras.基因对非生物治疗的反应
进一步评估职能Slgras.我们分析了可能参与植物对非生物胁迫防御的基因的表达Slgras.基因对盐、干旱、冷、热、渗透和氧化应激的响应(图。9和10 d).虽然只有两个基因(SlGRAS26,SlGRAS36)对所有处理均表现出高度反应,所有被分析基因在至少一种非生物胁迫处理中表现出差异表达。总的来说,在这六种受压条件下,总共有30种Slgras.基因被显著诱导,暗示它们在胁迫耐受性中的作用。18岁和13Slgras.在盐处理下,基因表现出明显的增加和减少,其中,SlGRAS44和SlGRAS26分别经历了最大的mRNA水平变化。同样,干旱处理后17个基因表达上调,7个基因表达下调,基因表达变化最大SlGRAS20和SlGRAS26,分别。有趣的是,大多数成员对热表现出强烈的敏感性(30Slgras.基因)和冷处理(27Slgras.基因),并且当对这两种治疗之一作出反应时,通常观察到最大的差异表达。例如,转录本的积累SlGRAS4与对照植物相比,在冷胁迫下表现出超过250倍的变化SlGRAS20在热处理后显示出超过50倍的变化。相比之下,在大多数情况下没有观察到太多的变化Slgras.当渗透和氧化应激进行时。这些数据显示了一些潜力Slgras.用于提高逆境抗性能力的基因,特别是考虑到番茄是一个极其温度敏感的作物。
的表达式概况Slgras.以不同组织的热图显示的基因(一个)、花器官(b)、激素治疗(c)和压力治疗(d).基于系统发育树的同一亚科成员(图。4)被分组在一起。颜色缩放表示log10表达式值。根,-2 dPA雄蕊和未处理对照样品的相对表达水平标准化为0
讨论
到目前为止,已经进行了几次尝试,将GRAS家族的成员分组为反映其进化关系的亚家族[6- - - - - -12].虽然进行了一些微调,但这些树状图基本一致。对GRAS蛋白的生物信息学分析显示,在同一物种内,GRAS蛋白具有较高的相似性,这表明这些谱系之间的分裂发生了基因重复。相比拟南芥,番茄中出现的GRAS蛋白数量越多,表明在番茄中发生的基因复制事件越多或复制后保留拷贝的频率越高。以串联重复事件为例,2/34、10/45、15/53、17/60、40/106克拉斯基因被鉴定为串联复制基因拟南芥[6],P.mume[11),番茄(图。2)、大米(6),而杨树[9,进一步证实复制事件是导致不同物种GRAS基因家族成员快速扩增的最常见机制。同时,外显子-内含子组织分析显示77.4%Slgras.基因在番茄中是无内含子的。1)的比例分别为82.2%、67.6%、55%和54.7%P.mume,拟南芥,米饭和杨树分别为(9- - - - - -12].植物GRAS基因家族中无内含子基因的比例较高,说明GRAS蛋白的进化关系密切。除GRAS基因家族外,无内含子基因在其他一些大型基因家族中也富集,如F-box转录因子基因家族[46,死盒RNA解旋酶[47和小的生长素向上rna (SAUR)基因家族[48].一般来说,内科基因在原核基因组中是原型的,并且有三种解释是为了形成真核基因组中的内部基因:古代原核生物的水平基因转移,现有的内部内基因的重复,以及内含子的基因的述词[49].Zhang等[50最近报道了植物的起源克拉斯细菌原核基因组的基因水平转移。这可能是GRAS基因家族中存在大量无内含子基因的原因,这可能是其原核起源,随后在进化史上发生了大量重复事件。
内在无序蛋白(IDPs)是真核生物蛋白质组中含量丰富的蛋白质,对细胞功能具有重要作用。一个IDP内部的IDR(本质无序区域)在绑定到不同的伙伴时,通常会经历从无序到有序的转换,允许IDP在不同的绑定接口上识别和绑定不同的伙伴[8,51,52].通过计算和生物信息学工具,Sun等.[8证明GRAS蛋白在本质上是无序的。肝蛋白质的特点之一是它的变量n端,它将包含全(分子识别特性),短interaction-prone段位于印尼盾和被接受能够识别他们的互动伙伴disorder-to-order转换在绑定到这些具体的合作伙伴(51,52].在番茄中,除少数不规范的GRAS蛋白外,对番茄GRAS蛋白的多序列分析表明,该家族大多数成员具有高度可变的n端结构域,表明该基因家族在番茄中的功能多功能性。大多数SlGRAS蛋白均存在高度保守的c -末端结构域(GRAS domain)。通常,富含亮氨酸的区域I (llr I)和II (llr II)位于VHIID motif的侧面,形成存在于大多数GRAS蛋白中的LR I- vihiid -LR II模式。对于许多GRAS蛋白,lri - vihid - lrii模式或模式中的单个基元用于与蛋白质伴侣的相互作用已被广泛和实验证实[17,23,51- - - - - -54].
由于功能多样性克拉斯基因,这个基因家族的许多成员需要进一步的功能特征。的表达模式Slgras.基因可以帮助我们评估它们可能的功能。8Slgras.在任何组织/器官中无法检测到的基因表明,在基因复制或进化过程中丧失功能后,这些基因有退化的趋势。总体而言,不同成员之间的表达模式差异很大,甚至同源对基因之间的表达模式差异也很大(SlGRAS1和SlGRAS32,SlGRAS11和SlGRAS18,SlGRAS42和SlGRAS46)(图。6).以前,表达简介克拉斯基因在杨树和P.mume也在不同的组织中显示了相当广泛的表达模式,不仅在亚科中,而且在同一分支的成员中[9,11].这些结果表明克拉斯在许多高等植物中,基因可能发生新功能化或亚功能化。然而,一些GRAS基因具有极高的序列同源性(SlGRAS1和SlGRAS14,SlGRAS2和SlGRAS3,SlGRAS7和SlGRAS12,SlGRAS9和SlGRAS10)(图。6)表现出保守的表达模式,这意味着它们通过遗传冗余和选择对遗传网络的稳稳性做出了贡献。SlGRAS25,SlGRAS39和SlGRAS15根和茎中mRNA水平较高,表明其同源基因具有保守功能AtSHR[17] 和AtSCR[55,这与根和芽的径向分布有关拟南芥.的强卵巢优先表达SlGRAS41通过调控油菜素内酯信号在果实发育中的作用[45].的同系物atscl3.(SlGRAS11,SlGRAS18)在开花花朵中显示出高mRNA水平,表明它们可以通过调制GA信号传递在授粉/受精期间发挥新功能[18,19].我们的结果已经证明了这一点SlGRAS24和SlGRAS40可被miR171裂解(图。5)是植物中最保守的mirna之一,表明它们可能与其他物种的同源基因具有相似的功能拟南芥[43].但是,的表达模式SlGRAS24和SlGRAS40这表明miR171-GRASs调控网络在番茄中的功能复杂而广泛。值得注意的是,根据番茄基因组联盟附录表75 [27,有14个Slgras.基因(SlGRAS1,SlGRAS2,SlGRAS8,SlGRAS9,SlGRAS12,SlGRAS13,SlGRAS14,SlGRAS17,SlGRAS18,SlGRAS24,SlGRAS32,SlGRAS38,SlGRAS40,SlGRAS48)在成熟绿期和破果期有差异表达。我们的结果与上述数据一致,表明这些基因在果实成熟过程中的关键作用。其中两个,SlGRAS18和SlGRAS38主要在断路器和红色成熟阶段果实中表达,已被报告为rin的靶基因[56,57,是果实成熟过程中关键的转录调控因子。此外,时空表达模式表明,大多数成员Slgras.在授粉/受精过程中,雄蕊和子房中的一种或两种都出现急剧增加或减少(即,SlGRAS8,SlGRAS11,SlGRAS14,SlGRAS16,SlGRAS18,SlGRAS20,SlGRAS24,SlGRAS27,SlGRAS36)(图。7),表明它们在子房和花药发育过程中可能发挥积极作用。考虑到克拉斯我们推测该基因家族的成员参与了花-果转化过程中GA的调控。
植物的生长和发育是由一组化学和结构上不同的激素调控的。许多已知的生长和发育对激素的反应是由于基因表达的调节,这些反应是迄今为止最具特征的[58].一般来说,激素通过调节两种类型的基因调节蛋白,转录因子和转录抑制因子的丰度来控制基因的表达。据我们所知,除了众所周知的赤霉素(gibberellin)外,GRAS蛋白和激素之间的关系仍然很少见[3.,54],仅有少数报道涉及生长素和油菜素内酯信号转导的成员[41,59,60]. 在这里研究的四种激素中,生长素(吲哚3-乙酸,IAA)几乎参与植物生长发育的所有方面,从胚胎发生到衰老,从根尖到茎尖[61].赤霉酸还调节多种发育过程,如种子发育和萌发、器官伸长和开花时间的控制[62]. 乙烯和水杨酸在生物胁迫中起重要作用[63],而乙烯也是肉质果实成熟期间的关键调节剂[45].据报道,BnSCL1是一种GRAS蛋白芸苔栗鸟,表现出对芽和根部植物蛋白的差异剂量反应[59].目前的结果表明,大多数Slgras.这里检测到的基因在不同激素处理后表现出明显的变化,有些基因在根和茎中甚至表现出相反的趋势,说明GRAS转录因子通过复杂的网络调控植物激素信号通路来调控基因表达(图)。8).此外,一些研究表明克拉斯基因在压力反应中发挥潜在的调节作用。PeSCL7的成员克拉斯基因杨树,被认为是工程抗旱耐盐树木的有用材料[64].表达的BnLAS基因拟南芥可以增强其抗旱能力[65].DELLA蛋白被证实参与了许多非生物胁迫,如低温、磷酸盐饥饿和高NO浓度[66- - - - - -68].至于GRAS蛋白在番茄植物防御反应调控中的证据:对应于克拉斯耐药植物致病细菌感染的抗性番茄植物的基因不同[69,70].qRT-PCR分析结果表明,该菌株的表达量明显高于番茄克拉斯与植物抗病和机械胁迫反应相关的基因[36].许多转录因子家族在不同胁迫处理下都表现出显著的应激反应基因表达重叠,表明参与不同胁迫的信号通路之间存在相互关联。的感应Slgras.在目前的工作中,对多种应激处理的响应基因突出了广泛的参与克拉斯环境适应的基因(图9).我们观察到,Slgras.与其他三种治疗相比,基因在盐,冷和热处理下积累较大,这表明了Slgras.基因家族成员可能在应对这三种胁迫条件中发挥更重要的作用。综合分析所有qPCR数据(图。6,8,9和10),我们发现4个高度同源基因属于AtPAT亚家族(SlGRAS2,SlGRAS3,SlGRAS7,SlGRAS34)在响应激素和非生物处理时表现出类似的表达水平,这意味着这些基因也可以参与激素信号传导和应激反应。始终如一地,来自米饭的两个亚科的两种基因,CIGR1和CIGR2,据报道是赤霉素和压力相关的[71].SlGRAS36在4种非生物胁迫下,其mRNA水平均显著升高,但在所有激素胁迫下均显著降低。同样的,SlGRAS4是由所有激素处理诱导的,并且在冷胁迫下其转录本的强烈上调表明有巨大的冷胁迫耐受潜力。有趣的是,SlGRAS36和SlGRAS4与AtSCL14有很强的序列相似性,AtSCL14是一种GRAS转录因子,对应激诱导启动子的激活至关重要[41].的同源基因ATSCL14从大米,OSGRAS23.,通过调节应激反应基因的表达参与干旱胁迫反应[72].因此,我们推测SlGRAS36和SlGRAS4可能在诱导番茄胁迫响应基因中发挥重要作用。此外,几Slgras.基因在激素和非生物胁迫处理下都受到显著的调控,表明这两个决定因素的协调响应。
结论
尽管GRAS转录因子的一些经典功能已经在一些植物物种中得到了表征,但在农业作物中,尤其是在那些有肉质果实的作物中,GRAS家族的更多成员仍有待进一步研究。在这项工作中,在番茄中鉴定了53个GRAS转录因子。关于SlGRAS蛋白质结构的信息将有助于对其进行功能分析。GRAS成员的比较、系统发育和表达分析将有助于全面描述GRAS基因家族的功能,并更好地理解它们在介导激素串扰和非生物胁迫中的可能作用。毕竟,这里显示的数据应该在未来的研究中加以考虑,以改善番茄和其他茄科植物的农艺性状和/或耐逆性。
方法
植物材料和生长条件
番茄植物(茄属植物lycopersicum简历。在光照/黑暗循环14/10 h,昼夜温度25/20℃,相对湿度60%的温室土壤上种植微型tom),植物营养液每周灌一次。在两个月龄的植株上采集根、茎和叶,在适当的时间采集花(芽、花)和果实(未成熟、破碎期和红果)。雄蕊和子房分别于开花前2 d (-2 dpa)、开花第1天(0 dpa)和开花后2 d (2 dpa)采集。在上午9点至10点之间,从6株生长良好的植物中采集所有组织,充分混合后立即用液氮冷冻,每个组织/器官分别取样3次。
番茄鉴定克拉斯基因
首先,我们使用“GRAS”作为关键词S.lycopersicum基因组被选择为初始查询,共有54个推定的GRAS基因从植物血红素血型数据库获得(http://www.phytozome.net.).同时,利用从美国国家生物技术信息中心(NCBI)获得的32个AtGRAS蛋白的氨基酸序列,对国际番茄注释组发布的2.4番茄蛋白(2.40)(BLASTP,E值≤1 × 10-5)和番茄WGS染色体(2.50)(TBLASTN,E值≤1 × 10-5)(胡志明市http://solgenomics.net/tools/blast/).加在一起,有53种可能性克拉斯基因是从现有的基因组数据库中确定的。随后,在线生物信息学工具ExPASy-PROSITE (http://prosite.expasy.org/)和NCBI的TBLASTN (http://blast.st-va.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=tblastn&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome)用于进一步证实得到的序列中的GRAS结构域的存在。
番茄的生物信息学分析克拉斯基因
53个假定的克拉斯基因根据其染色体位置重新命名,除了19个成员保留为他们已经存在的名字(SlGRAS1-SlGRAS17,SlDELLA,SlLS).GRAS蛋白的功能域分布和外显子系统结构是从植物血红素中获得的(http://www.phytozome.net.).串联复制基因被定义为两个或两个以上的基因序列Slgras.Smith-Waterman配对e值≤1 × 10的基因-25年在350-kb距离范围内,由Lehti-Shiu等人提出[73].我们下载了GRAS蛋白序列杨树、大米和P.mume根据以往两份刊物[11,12],并根据系统发育树选择每个亚科中至少1个基因。然后,连同所有的32个拟南芥Atgras蛋白和48个番茄Slgras蛋白,使用默认设置使用Clustalx2.0程序进行多序列对齐。使用Mega6.0通过NJ(邻接)方法构造了基于对准的系统发育树,通过Bootstrap测试复制1000次。
修改了5 ' -RACE来识别的切片位置SlGRAS24和SlGRAS40
根据制造规范,5'-Full Race Kit(Takara,Japan)用于RNA连接酶介导的CDNA末端(RLM-血液)测定的快速扩增。简而言之,从野生型番茄的幼苗中提取总RNA,将聚(a)mRNA直接连接到5'族族适配器(60个核苷酸)。使用逆转录酶来使用寡核苷酸(DT)引物用于使cDNA合成。PCR根据每个GSP引物的TM进行(附加文件5),设计在成熟miRNA序列互补位点的预测3′产物处。最后,将PCR产物纯化,克隆到豌豆钝克隆载体(转基因)中,并对每个产物进行测序。
激素和凋亡胁迫处理
激素处理:将12日龄番茄幼苗分别用20 μM乙烯利(Eth)、20 μM赤霉素(GA3)、20 μM吲哚乙酸(IAA)、20 μM水杨酸(SA)的MS液体培养基浸泡3 h。处理样品的根和芽分别收获。以不含任何激素的MS液体培养基浸泡的幼苗作为对照。
对一个月左右的番茄植株进行了各种非生物胁迫处理。将温室栽培的番茄植株分别移入4±1℃的冷室或42±1℃的培养箱中进行冷处理或热处理。在叶片上喷施200 mM NaCl、100 mM甘露醇和100 mM双氧水进行盐胁迫、渗透胁迫和氧化胁迫处理。处理6 h后采集叶片,以未处理植株作为对照。干旱处理包括长达15天不浇水。通过每天浇水来维持浇灌良好的植物作为对照。
在每个处理中,来自6个独立幼苗/植株的材料被组合成一个样品,所有处理实验都在3个独立的时间内进行。所有样本均立即在液氮中冷冻,-80℃保存至RNA提取。
RNA分离及实时荧光定量PCR分析
采用TRIzol试剂(Invitrogen公司,美国)按照说明书提取总RNA。用1.2%琼脂凝胶电泳验证RNA的完整性,用NanoDrop 1000 (Thermo, USA)测定RNA浓度。的PrimeScript™使用带有gDNA橡皮擦(TaKaRA,日本)的RT试剂试剂盒去除任何基因组DNA污染,并按照制造商的协议合成第一链cDNA。每20 μL反应约使用2 μg RNA。采用SsoAdvanced进行实时定量PCR™通用Sybr Green SuperMix(Bio-rad,USA)在CFX96触摸上™Real-Time PCR检测系统(BIO-RAD,美国)。每个反应混合物中含有10 μl SYBR Green Supermix、1 μl cDNA模板、0.5 μl引物和8 μl无菌蒸馏水2O. PCR扩增循环如下:95℃,30℃,40℃,5℃,58℃。熔化曲线分析测定60至95℃以验证每个引物对的扩增子的特异性。基于使用2的比较CT方法计算相对折叠差异-△△Ct方法与Slubi.作为内部参照基因。所有qPCR引物均根据番茄WGS染色体2.50的参考序列设计(附文件)5).
提供支持数据的可用性
支持本文结果的系统发育数据(比对和系统发育树)已保存在TreeBASE存储库中,并可在URL中获取http://purl.org/phylo/treebase/phylows/study/TB2:S18045.
参考文献
- 1.
玉米调控c1位点编码的蛋白与myb原癌基因产物同源,与转录激活子结构相似。EMBO j . 1987; 12:3553-8。
- 2.
引用本文:王志强,王志强,王志强,等。的稻草人基因调控不对称的细胞分裂,这对产生放射状组织至关重要拟南芥根。细胞。1996年; 86:423-33。
- 3.
彭建军,王志强,王志强,等。拟南芥的盖基因定义了负调控赤霉素反应的信号通路。基因Dev。1997;11:3194 - 205。
- 4.
Silverstone AL, Ciampaglio CN, Sun T. The拟南芥RGA基因编码压制胃纤维素信号转导途径的转录调节剂。植物细胞。1998年; 10:155-69。
- 5.
Pysh LD、Wysocka Diller JW、Camilleri C、Bouchez D、Benfey PN。中国的GRAS基因家族拟南芥:序列表征和基本表达分析SCARECROW-LIKE基因。植物j . 1999; 18:111-9。
- 6.
田春春,万平,孙树华,李建勇,陈ms .水稻和玉米GRAS基因家族的全基因组分析拟南芥.acta botanica sinica(云南植物学报)2004;54:519-32。
- 7.
植物信号转导和发育中GRAS蛋白的作用。足底。2004;218:683 - 92。
- 8.
Sun XL, Xue B, Jones WT, Rikkerink E, Dunker AK, Uversky VN。植物界的功能需要展开:GRAS蛋白的n端结构域在植物发育过程中参与分子识别。植物学报。2011;77:205-23。
- 9.
刘学军,王学军。GRAS基因家族的全基因组比较分析杨树,拟南芥和米饭。植物生物学代表2014;32:1129-45。
- 10.
宋旭,刘涛,段伟,马强,任军,王震,等。大白菜GRAS基因家族的全基因组分析(甘蓝型油菜。北京).基因组学。2014; 103:135-46。
- 11.
陆建新,王婷,徐志德,孙立德,张庆新。中国人群GRAS基因家族的全基因组分析李属却已. 摩尔基因基因组学。2015;290:303–17.
- 12.
Abarca D, Pizarro A, Hernandez I, Sanchez C, Solana SP, Amo AD,等。松树GRAS基因家族:与形成不定根能力的成熟相关下降相关的转录本表达模式BMC Plant Bio. 2014;14:354。
- 13.
Lim J,Helariutta Y,Specht CD,Jung J,Sims L,Bruce WB等。分子分析稻草人玉米基因揭示了不同分生组织中径向模式的共同基础。植物细胞。2000;12:1307-18。
- 14.
斯图尔曼J,Jäggi F,库勒迈耶C。茎分生组织的维持是由克拉斯基因介导的信号来自差异细胞。基因开发。2002; 16:2213-8。
- 15.
金GB,南YW。一种新的GRAS蛋白基因MtSymSCL1在规范结核数量中发挥作用Medicago truncatula.植物生长调节。2013; 71:77-92。
- 16.
Morohashi K, Minami M, Takase H, Hotta Y, Hiratsuka K中国生物化学杂志。2003;278:20865-73。
- 17.
崔春生,李春生,李春生,等。一种进化上保守的机制界定了SHR运动在植物中的单层内皮层。科学。2007;316:421-5。
- 18.
张泽,ogawa m,舰队cm,zentella r,hu jh,heo jo,等。稻草人样的3通过拮抗母血压抑制器Della促进胃肠杆菌素信号传导拟南芥.美国国家科学院学报。2011; 108:2160-5。
- 19.
许卓,张克明,金亚,李明华,李思安,宋sk,等。通过GRAS转录调控因子稻草人样3在紫杉醇中介导赤霉素信号通路拟南芥根。美国国家科学院学报。2011; 108:2166 - 71。
- 20.
蔡志强,蔡志强。PAT1是GRAS家族的新成员,参与光敏色素a信号转导。基因Dev。2000;14:1269 - 78。
- 21
GRAS蛋白SCL13是光敏色素依赖性红光信号的正调控因子,但也能调控光敏色素a的反应。基因组学杂志。2006;276:13-30。
- 22
两个GRAS蛋白稻草人- like21和光敏色素A信号转导1在光敏色素A信号转导中起协同作用。植物杂志。2013;161:291 - 304。
- 23
Hirsch S, Kim J, Munoz A, Heckmann AB, Downie JA, olddroyd GED。在结瘤信号转导过程中,GRAS蛋白形成DNA结合复合物诱导基因表达Medicago truncatula.植物细胞。2009;21:545-57。
- 24
李晓燕,钱强,付志明,王玉华,熊广生,曾东东,等。水稻分蘖的控制。大自然。2003;422:618-21。
- 25
舒马赫K,施密特T,罗斯伯格M,施密特G,有K侧抑制器(Ls番茄的基因编码了vhiid蛋白家族的新成员。美国国家科学院学报。1999; 96:290-5。
- 26
王志强,王志强,王志强,等。分子分析侧抑制器拟南芥的基因揭示了腋生分生成的保守控制机制。基因开发。2003; 17:1175-87。
- 27。
Schulze S,Schafer Bn,Parizotto EA,Voinnet O,Theres K.失去的分生组织基因调控中央区后代的细胞分化拟南芥分生组织。植物j . 2010; 64:668 - 78。
- 28。
王志强,王志强,王志强,等。拟南芥佩妮的同类多毛分生组织保持茎和根的不确定性需要基因。植物生理学。2011;155:735–50.
- 29。
马志新,胡小平,蔡文军,黄文辉,周旭,罗强,等。拟南芥MiR171靶向稻草人样蛋白质与GT顺式元素结合,并在轻条件下介导嗜酸甘油蛋白调节的叶绿素生物合成。Plos遗传学。2014; 10:E1004519。
- 30.
番茄基因组财团。番茄基因组序列提供了深入了解肉质水果的进化。大自然。2012;485:635-41。
- 31.
Sharma MJ,Kumar R,Solanke Au,Sharma R,Tyagi Ak,Sharma Ak。番茄中发育和非生物胁迫治疗期间ERF家族基因的鉴定,系统发育和转录物分析。Mol Genet基因组学。2010; 284:455-75。
- 32.
黄SX,高YF,刘JK,彭XL,NIU XL,FEI ZJ等。基因组 - 衣服转录因子分析茄属植物lycopersicum.基因组学杂志。2012;287:495-513。
- 33.
关键词:番茄,转录因子,SBP-box,基因组,系统发育,差异表达足底。2012;235:1171 - 84。
- 34.
Audran-Delalande C, Bassa C, Mila I, Regad F, Zouine M, Bouzayen M.全基因组鉴定,功能分析和表达谱分析辅助/ IAA番茄的基因家族。植物生理学杂志。2012;53(4):659-72。
- 35.
王海涛,王海涛,王海涛,等。番茄ARF基因家族的特征揭示了包括可变剪接在内的多水平转录后调控。《公共科学图书馆•综合》。2014;9:e84203。
- 36.
引用本文:王志强,王志强,王志强,等。番茄TCP转录因子家族的鉴定、克隆和鉴定。BMC Plant Biol. 2014;14:157。
- 37.
关键词:番茄,GRAS基因,抗病性,机械胁迫反应植物学报2006;7:593-604。
- 38.
张志强,张志强,张志强,等。DELLA沉默对番茄果实单性结实的影响。植物j . 2007; 52:865 - 76。
- 39.
巴塞尔GW, Mullen LT, Bewley JD。Procera.是番茄(茄属植物lycopersicum):对种子和营养植物的影响。J Exp Bot. 2008; 59:585-93。
- 40.
Jasinski S,Tattersall A,Piazza P,Hay A,Martinez-Garcia JF,Schmitz G等人。Procera编码了一种介导对番茄中解剖叶形形式的控制的Della蛋白。工厂J. 2008; 56:603-12。
- 41.
佟慧娜,金勇,刘文斌,李飞,方军,尹永华,等。矮秆和低分蘖是GRAS家族的新成员,在水稻油菜素内酯信号转导中起着积极的作用。植物j . 2009; 58:803-16。
- 42.
Llave C, Xie ZX, Kasschau KD, Carrington JC。劈理的scarecrow-likeMRNA目标由一类指导拟南芥microrna。科学。2002;297:2053-6。
- 43.
王玲,麦应祥,张永昌,罗琦,杨华强。MicroRNA171c-targetedSCL6-II,SCL6-III,SCL6-IV基因调控拟南芥的分枝。摩尔。2010;3:794 - 806。
- 44.
德容M,马里亚尼C,维里森WH。生长素和赤霉素在番茄坐果中的作用。J Exp Bot. 2009; 60:1523-32。
- 45
Kumar M, Khurana A, Sharma AK。植物激素在肉质果实发育和成熟中的作用及其相互作用。[J] .机器人。2014;65(16):4561-75 .]
- 46
Jain M,Nijhawan A,Arora R,Agarwal P,Ray S,Sharma P等。水稻中的F-box蛋白。全基因组分析、分类、穗和种子发育期间的时空基因表达以及光和非生物胁迫的调控。植物生理学。2007;143:1467–83.
- 47
拟南芥死亡盒RNA解旋酶家族的研究。核酸Res. 1999; 27:628-36。
- 48
Jain M, Tyagi AK, Khurana JP。水稻生长素反应早期SAUR基因家族的全基因组分析、进化扩展和表达。基因组学。2006;88:360 - 71。
- 49
邹敏,郭斌,何胜。后口动物中内含子缺失基因的作用及进化模式。基因组学。2011;1 - 8。
- 50.
张丹丹,李志刚,李志刚。细菌GRAS结构域蛋白对赤霉素响应机制的研究进展。生物信息学。2012;28:2407-11。
- 51.
GRAS蛋白:内在紊乱蛋白在植物信号转导中的多功能作用。j . 2012; 442:1-12。
- 52.
Sun XL, Rikkerink E, Jones WT, Uversky VN。蛋白质内禀紊乱的多种作用说明了它对植物生物学的广泛影响。植物细胞。2013;25:38-55。
- 53.
作者简介:Fode B, Siemsen T, Thurow C, Weigel R, Gatz C拟南芥GRAS蛋白SCL14与II类TGA转录因子相互作用,对应激诱导启动子的激活至关重要。植物细胞。2008;20:3122-35。
- 54.
侯XL,李耀,夏克夫,严y,yu h. dellas通过与jazs的竞争对手调节茉莉酸甲态信号传导。DEV细胞。2010; 19:884-94。
- 55.
王志强,王志强,王志强,等。的SHORT-ROOT基因通过径向信号调控拟南芥根的径向模式。细胞。2000;101:555 - 67。
- 56.
引用本文:Fujisawa M, Shima Y, Higuchi N, Nakano T, Koyama Y, Kasumi T, et al.通过转录组和染色质免疫沉淀分析鉴定番茄成熟调节剂RIN的直接靶点。足底。2012;235:1107-22。
- 57.
Fujisawa M, Nakano T, Shima Y, Ito Y.大规模鉴定了番茄MADS box转录因子成熟抑制因子的直接靶标,揭示了番茄果实成熟的调控机制。植物细胞。2013;25:371 - 86。
- 58.
植物激素是植物生长的通用化学调节剂。自然化学生物2009;5:301-7。
- 59.
一种生长素应答的稻草人样转录激活物与组蛋白去乙酰化酶相互作用。acta botanica sinica(云南植物学报)2004;55:417-31。
- 60.
Rovere FD, Fattorini L, D’angeli S, Veloccia A, Del Duca S, Cai G, et al.;拟南芥SHR、SCR转录因子和AUX1生长素流入载体控制着植株和离体培养的薄细胞层的不定根和木质素发生的切换。安机器人。2015;115:617-28。
- 61.
植物生长素的调控、作用和相互作用。安机器人。2005;95:707-35。
- 62.
赤霉素的生物合成及其调控。j . 2012; 444:11-25。
- 63.
Fujita M, Fujita Y, Noutoshi Y, Takahashi F, Narusaka Y, Yamaguchi-Shinozakl K,等。非生物和生物应激反应之间的串扰:当前从应激信号网络收敛的观点。植物学报。2006;9:436-42。
- 64.
马海生,梁丹,帅鹏,夏晓丽,尹伟林。盐和干旱诱导的杨树GRAS蛋白SCL7具有耐盐和耐旱能力拟南芥.J Exp Bot. 2010; 61:4011-9。
- 65.
杨明民,杨启元,傅道东,周永明。过度的芸苔属植物显著BnLAS基因拟南芥影响植物开发并增加耐旱性。植物细胞代表2011; 30:373-88。
- 66.
基于冷诱导CBF1因子依赖的信号通路通过影响赤霉素代谢调控生长抑制DELLA蛋白的积累。植物细胞。2008;20:2117-29。
- 67.
姜春发,高晓华,廖丽丽,哈伯纳培,付晓东。磷素饥饿、根结构和花青素积累反应是由赤霉素- della信号通路调控的拟南芥.植物杂志。2007;145:1460 - 70。
- 68.
姚涛,白少林,李敏,张永昌,何玉康。DELLA有助于抗氧化应激拟南芥幼苗。Chin Bull Bot. 2011; 46:481-8。
- 69
Bonshtien A, Lev A, Gibly A, Debbie P, Avni A, Sessa g、黄AvrRxv效应体及其在抗性番茄植株中的表达所决定的全球转录变化。微生物与植物的相互作用。
- 70.
Mysore KS, crsta OR, Tuori RP, Folkerts O, Swirsky PB, Martin GB。Pto和prf介导的宿主对感染的防御反应的综合转录谱两pv。番茄。植物j . 2002; 32:299 - 315。
- 71.
田边等。两个响应n -乙酰壳寡糖诱导子的水稻GRAS家族基因被植物活性赤霉素诱导:水稻细胞中诱导子和赤霉素信号之间的交互信号的证据。acta botanica sinica(云南植物学报),2004;54:461 - 472。
- 72.
徐凯,陈淑娟,李凤凤,马新新,梁晓辉,丁晓峰,等。OSGRAS23.是一个水稻GRAS转录因子基因,通过调控胁迫应答基因的表达参与干旱胁迫响应。BMC Plant Biol. 2015;15:141。
- 73.
李春华,邹春华,赵绍华。植物类受体激酶/微球基因的进化历史和胁迫调控。植物杂志。2009;150:12-26。
致谢
国家高技术研究发展计划项目(no . 2012AA101702);国家重点基础研究发展计划项目(no . 2013CB127101);国家自然科学基金项目(no . 31071798, no . 31272166);中央高校基本科研业务费专项资金资助(CDJXS10231118)。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
WH、ZGL和ZQX设计了本研究。WH从数据库中收集数据集,并对数据进行分析,然后编写初稿。WH、ZQX、XK提取总RNA并进行qRT-PCR实验。WH和NT完成了5 ' -RACE实验。所有作者阅读并批准了最终的手稿。
附加文件
额外的文件1:
所有53种基因的核苷酸和蛋白质序列信息Slgras.基因。各蛋白GRAS结构域的氨基酸序列均显示在红色的.(PDF 372 kb)
额外的文件2:
串联复制事件53Slgras.基因。(PDF 111 kb)
额外的文件3:
序列比对显示GRAS结构域的其他4个最显著的基序分别为:llr I、llr II、PFYRE、SAW。(PDF 202 kb)
额外的文件4:
番茄、马铃薯和辣椒GRAS蛋白的系统发育分析。对番茄、马铃薯和辣椒的48、50和30个GRAS氨基酸序列进行ClustalX比对,采用Neighbor-Joining法构建系统发育树。(PDF 291 kb)
额外的文件5:
本工作中使用的引物。(PDF 159 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
黄伟,西安,康旭。et al。番茄GRAS基因家族的全基因组鉴定、系统发育及表达分析。BMC植物杂志15日,209 (2015). https://doi.org/10.1186/s12870-015-0590-6
收到了:
接受:
发表:
关键字
- etephon.
- 肉质水果
- 番茄基因组
- Intronless基因
- 肝基因