抽象的
背景
农杆菌属广泛用于产生转基因植物的感染通常伴随着T-DNA连接的突变和开花植物中的转子。不知道如果是农杆菌属感染还会影响点突变,体细胞同源重组(SHR)和框架移位突变(FSM)的速率。我们检查了效果农杆菌属使用一组突变检测器线感染五种类型的体细胞突变拟南芥蒂利亚纳.为了验证分泌因子的作用,我们将植物暴露于不同的农杆菌属菌株那包括野生型(ACH5),其衍生物缺乏vir基因,诱发剂或T-DNA,和感染后48小时的热杀死形式;此外,对于较小的菌株,我们在多个时间点检查了三种类型的突变的速率。突变检测器线携带非功能性β-葡糖醛酸酶基因(格斯)和突变的逆转格斯其功能形式导致蓝斑。基于植物中可见的蓝斑的数量进一步两周,我们估计了突变频率。
结果
与植物共培养48 h农杆菌属如果压力能控制住的话vir2周后检测到的转位率、SHRs和FSMs均低于未感染对照组。相反,与任何一种培养基共培养48 h农杆菌属菌株的转座率高于对照水平。多时间点研究表明,与野生型Ach5共培养的幼苗,颠换的降低利率和月48 h后co-cultivation代表一个明显抑制早期短暂的突变率的增加(峰值为植物co-cultivated 3 h)。增加3 h后co-cultivation也看到利率的颠换(但不是月)幼苗暴露于压力缺乏vir基因,致癌基因和T-DNA。然而,与该菌株共培养较长时间的植物的突变率随后降至未感染对照的水平以下,这与单时间点研究的结果一致。
结论
各种类型的突变率农杆菌属感染取决于感染的持续时间和菌株所具有的病原体源性因子(如Vir蛋白、癌蛋白或T-DNA)的类型。压力与vir基因,包括用于植物转化的类型,被抑制了各种体细胞突变的类别。我们的研究还提供了一种病原体的证据,其可以至少部分地抵消感染植物中的突变诱导。
背景
农杆菌肿瘤,将基因转移到植物中的原始和杰出工具,在基本研究和许多有用的转基因植物的发展中发挥了核心作用[1-3.].准备好的利用性农杆菌属对于植物转化来源于其本质上,将其自身的面料致统计体DNA(Ti质粒)的细分(T-DNA)转移到各种植物的核DNA中[4.].在实验室,撤防菌株农杆菌属可以设计利用具有新的T-DNA的一种或多种感兴趣的外来基因代替质粒的大部分T-DNA片段。Upon co-cultivation with the target plant, this T-DNA will be transferred, with the involvement of a number of virulence (Vir) proteins encoded on the plasmid’s non-T-DNA portion or on another plasmid in the same bacterium, to the plant’s nuclear DNA [5.那6.].
取代了T-DNA农杆菌属通过新型T-DNA可以以极大的精确度进行,整体转化过程引起了对遗传或表观遗传(以下,基因组)完整性的许多不可预测和不需要的影响。这些是由新型T-DNA引入引起的某些类型的体细胞突变(缺失,插入,易位)[7.-11.].可以鉴定T-DNA诱导的突变,因为它们与T-DNA插入物的边界区域相关联。农杆菌属-介导的植物转化与解除武装的菌株也被发现(a)增加另一类突变的频率,即转位(在拟南芥,[12.-14.]);(b)改变生物体的甲基化状态[15.];(c)导致RNA沉默[15.].也有可能农杆菌属介导的具有撤防应变的转化具有许多其他对基因组完整性的尚未报告的影响。例如,与其他植物病原体的自然感染导致更高的重组速度,双链断裂和转座16.-23.].即使植物被一种解除武装的菌株转化农杆菌属未诱导生长肿瘤(新型T-DNA通常缺乏必要的癌症),有几个原因为什么撤防菌株的突变效应可能模仿自然感染的突变。细菌与植物的接合应该足以诱导通用防御响应:它必须连接到细胞,突破墙壁和质膜,并将T-DNA递送到细胞中[3.那5.].另外,除了新颖的T-DNA之外,宿主植物暴露于其他分泌因子农杆菌属如vir蛋白和伴随(微生物相关分子模式)。最后,感染是一种植物的应激形式,并且已知是已知生物应激导致已经提到的一些基因组的影响,以及一些额外的类型(例如,点突变的频率增加,微卫星稳定性降低)[24.那25.[那么具有天然或撤防菌株的转化应力分量,也可以具有可比意外的效果。但是,正如已经暗示的那样,对于我们的知识,没有关于可能影响的研究农杆菌属- 在点突变的频率(即转变和横向),帧间移位突变(未与T-DNA连接)的频率导明的转化(任何类型),也不是在体细胞同源重组(SHR)的频率上。
更强大的转型调查的重要性超越了理解第一代变形例的意外变化。在拟南芥例如,由于农杆菌属已经发现导明的转化持续到至少六代[12.].已知病原体感染的植物具有改变遗传学(例如SHR [16.那17.那26.])和/或表观遗传(例如甲基化,[17.])痕迹。一般来说,体细胞突变也被证明是可遗传的[27.-30.].
在这项研究中,我们确定了五种不同类别突变的频率(横向,过渡,施李;换位和帧移位突变(微卫星不稳定性的量度)[31.]) 在拟南芥幼苗暴露于四种不同的菌株A. Tumefaciens.(桌子1),大肠杆菌以及热杀死的野生型菌株A. Tumefaciens.和大肠杆菌.的菌株农杆菌属使用(表1),因为它们携带野生型的三个特征的不同组合,即:毒性(vir)基因(v),癌基因(O)和T-DNA(t)。一个菌株具有所有三个特征(下文,票),缺少癌症(VXT)的第二个特征,缺乏癌肠和T-DNA(Vxx)的第三个特征,并且第四个具有三个特征(XXX)。通过比较这些菌株(以及大肠杆菌和热杀死的细菌)影响突变频率,我们可以挑逗通用植物防御反应的相对贡献农杆菌属- 特异性因素。我们的方法论,包括使用两天的旧,易消化的幼苗,降低了几种不需要的实验和生物变异性来源的影响。出乎意料的是,我们发现了农杆菌属菌株与用于产生转基因植物的菌株抑制或不影响,研究了四种突变中的四种突变率。在观察到抑制的三类突变中,存在vir基因足以使菌株引起反应。除了其与生物工程的相关性之外,我们的研究还提供了能够抑制宿主植物中的细胞突变的植物病原体的证据。
结果
感染vir基因窝藏农杆菌属菌株抑制了横转化率,但没有过渡拟南芥
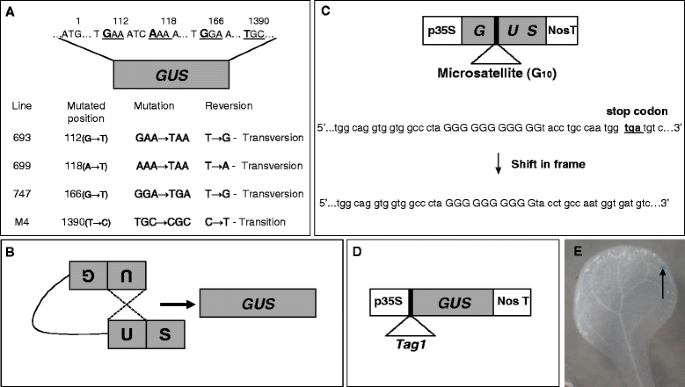
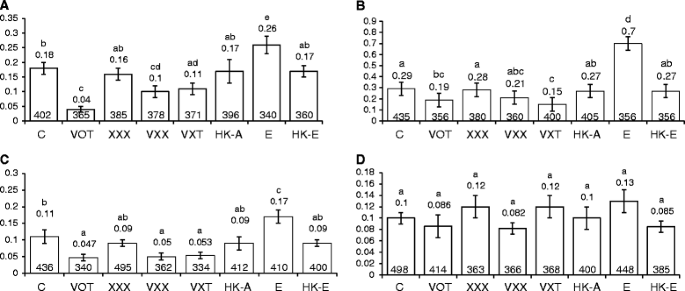
为了检查感染是否选择性地改变自发转变或颠倒速率,拟南芥植物(加入哥伦比亚)携带不同版本的点变异格斯报告基因[编码β-葡糖醛酸酶(GUS)]由CAMV-35S启动子驱动[32.那33.(图。1A)被使用。使用线路693,699和747分析颠转率,其中引入了止挡密码子格斯打开阅读框(ORF)在三个不同的位置(112G→T.166.G→T.118.A→T.分别(无花果。1A)[32.].使用错误感应检查过渡率格斯突变系M4 (T→C),其中碱基T在1390位点突变为CTH.orf的位置格斯(图。1A;[33.])。转化和转化检测系的2日龄幼苗同时与之共培养农杆菌属菌株VOT,VXT,VXX和XXX(表1),热杀死的票,大肠杆菌和热杀死大肠杆菌.XXX感染对颠转率没有影响(P. > 0.05) in any line when compared to uninfected controls (Fig.2 a, b, c).但是,用任何一个感染植物vir-窝藏菌株(VOT, vct, VXX)导致三个株系的横移频率均降低(图3)。2 a, b, c).当三条检测线被感染时大肠杆菌,颠倒率急剧增加(P. < 0.05), but heat-killed VOT and大肠杆菌没有影响(图。2 a, b, c).我们观察到C→T过渡频率没有显着变化(P.> 0.05)农杆菌属紧张,生活大肠杆菌,或热杀菌株(图。2D).因此,农杆菌属港口的菌株vir基因有选择性地抑制转位(T→G和T→A),但没有菌株对转位(C→T)率有影响。
感染vir基因窝藏农杆菌属菌株降低了血管统体体细胞重组率拟南芥
累积血栓瘤突变体SHR频率拟南芥行651(加入C24)和R2L1(加入哥伦比亚)。线651带有截断的反转重复格斯在倒置重复区域中具有566bp的序列同源性(图。1B.;[34.])。在两个截短的区域之间改造了用于潮霉素抵抗的基因。在R2L1线中,格斯基因盒被两个倒置的过氧化氢酶内含子(589 bp)打断,同源区域之间的重组恢复功能格斯活动 [35.].651线和R2L1的两天幼苗共同培养农杆菌属菌株VOT,VXT,VXX和XXX(表1),热杀死的票,大肠杆菌和热杀死大肠杆菌两天。在两个探测器线中,XXX感染对SHR率没有影响(P. > 0.05; Fig.3A和B.),而对任何一个感染的同时感染vir基因窝藏菌株(VOT,VXT,VXX)导致了RAT率的显着降低(P.< 0.05;无花果。3A和B.),与未受感染的植物相比。热灭活VOT处理不影响SHR率(P.> 0.05),也不侵染植株大肠杆菌或其热杀死的形式(P. > 0.05) (Fig.3A和B.).因此,除了横向之外,还有vir基因农杆菌属似乎足以诱导抑制第二种类型的突变,即细胞同源重组。
感染vir基因窝藏农杆菌属菌株在植物中抑制框架移位突变(FSM)率
为了评分FSM速率,我们使用突变检测器线G10,携带微卫星插入10gs内格斯基因([36.];无花果。1C).存在止码顿的存在渲染格斯在G10植物中不活跃。在复制过程中,微卫星区域容易发生错误,因此,在DNA复制过程中,微卫星区域内核苷酸的添加或删除会改变阅读框,消除终止密码子;内部的逆转格斯基因恢复功能形式。G10幼苗侵染2天(见表)1).用XXX感染对框架移位突变率没有影响(P. > 0.05; Fig.4A),而对任何一个感染的同时感染vir基因携带株(VOT、vct、VXX)显著降低(图2)。4A).热杀死的选储治疗对框架移位突变率没有显着影响(P. > 0.05), nor did infecting the plants with大肠杆菌或其热杀死的形式(P. > 0.05; Fig.4A).因此,框架换档响应的模式与用shRS看到的相同,添加了第三类突变vir基因农杆菌属似乎足以诱导抑制。
感染后的高转位率农杆菌,它的衍生物和大肠杆菌
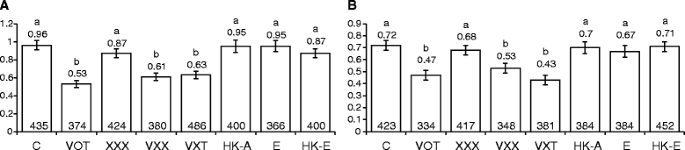
虽然农杆菌属早期的研究是使用含有T-DNA的非致瘤菌株进行的vir基因[12.].我们检查了致癌菌株(VOT)和非致癌菌株(VXT,VXX,XXX)的影响大肠杆菌和热杀死大肠杆菌和VOT,在置换率上。我们用了一条线标签1在CAMV-35S启动子之间设计的元素和格斯基因(图。1D;[37.)和的换位标签1恢复了功能性GUS活性。幼苗感染2天。与未感染对照组相比,所有菌株的转位率都增加了(XXX的转位率高达5倍),所有这些增加都是显著的(P. < 0.05), except in the case of VXX. From highest to lowest mean rates, the sequence of strains was: XXX,大肠杆菌,VOT,VXT,热杀死的票,热杀死大肠杆菌,VXX(这些响应之间的显著性和非显著性差异见图。4B.).转位率的普遍增加代表了对其他三种突变的一种非常不同的反应类型,在这三种突变中,转位率几乎总是降低或保持不变(除了由活突变引起的转位率的增加e .coli.).使幼苗感染农杆菌属菌株携带vir基因(VOT,VXX和VXT)诱导少于菌株的丢圈而没有vir基因(XXX)。这可以用菌株代表其他突变(横向,SHR和FSM)的表观抑制的不太完整形式vir基因。
农杆菌属感染影响的转换率,而不是转变,在拟南芥与共同种植时间相同
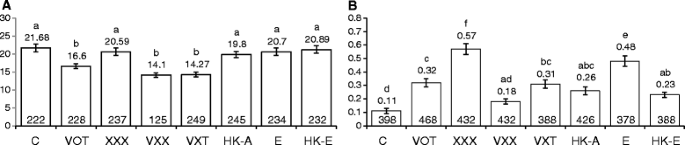
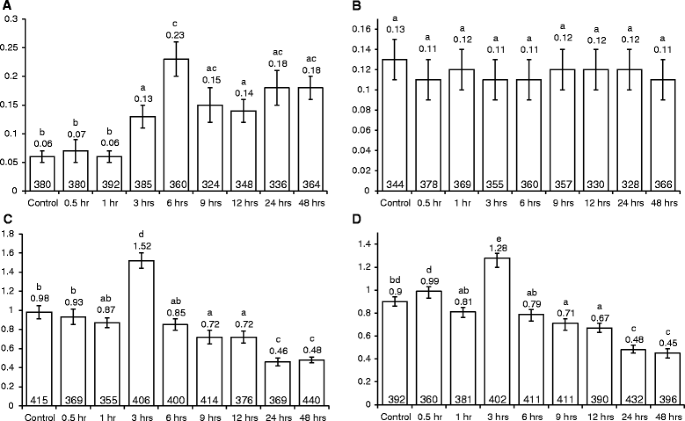
检查横转化率是否取决于共培养的持续时间农杆菌属,我们感染了747和699株系(携带突变格斯意味着分别分析(T→G)和(T→A)横向,其中两个“极端”农杆菌属菌株(VOT和XXX),不同的时间段(0.5小时,1小时,3小时,6小时,9小时,12小时,24小时和48小时)。对于感染,使用了两天的幼苗,并且在感染两周后,GUS染色。有趣的是,在三个小时内,两条线的横向速率突然和显着增加(2〜2.7倍之间)(P.<0.05;无花果。5a,b,c,d).这种增加具有短暂性:在所有处理中,到6 h时,转化率都下降到对照水平(图2)。5a,b,c,d).对于暴露于菌株XXX的植物,在实验的剩余时间内,速率保持在控制水平(图。5C,D).然而,对菌株VOT暴露的植株,其速率在24 h前继续呈现下降趋势,在747行中,24 h和48 h的水平显著低于对照,约为对照的2倍(P.< 0.05;无花果。5A,B).使用与上述类似的实验设计,我们还检查了点突变检测器线M4中菌株VOT和XXX对(C→T)转换速率的影响。与未感染的控件相比,我们观察到任何一种菌株的过渡率没有显着变化(见附加文件1).
这些结果表明,在转换的情况下,一个(或多个)因素农杆菌属除了vir基因,诱发剂和T-DNA可以在约3小时内引起横向速率的短暂升高,但是,这些因素中的一种或多种因子以后减少到低于控制水平的速率。
大肠杆菌 -诱导率随共培养时间的不同而不同
这拟南芥对点突变检测器线,747和M4进行大肠杆菌不同时间段的感染(0.5小时,1小时,6小时,9小时,12小时,24小时和48小时)。T→升迁率显着增加(P. < 0.05) when line 747 was co-cultivated with大肠杆菌对于3小时,6小时,9小时,12小时,24小时和48小时(图。6A)和最高的传感速率被观察到6小时感染后。但是,没有重大变化(P. > 0.05) in the transition rates when M4 seedlings were co-cultivated with大肠杆菌(图。6B.).
速度诱导的体细胞同源重组(SHR)速率随共培养时间而变化
确定SHR率是否随着共培养的持续时间而变化农杆菌属,第651行和R2L1被感染农杆菌属菌株VOT, XXX和大肠杆菌与VOT对转化速率的影响一样,在VOT胁迫下,植株的SHR速率也表现出短暂的增加,在3 h时达到最大值(P.< 0.05);SHR速率开始下降,在9 h时降至对照水平以下,并在24 h时进一步下降(图1)。6C和D.).与对XXX的转化率的反应不同,在经过XXX处理的植物中,与未受感染的对照相比,SHR率没有随时间变化(见附加文件)2).同样,共同栽培大肠杆菌在48小时的感染时间内没有改变SHR率(见附加文件3.).
讨论
鉴于转型由撤防伤害介导的农杆菌属是生产转基因植物的最常见手段,重要的是要尽可能多地理解这种方法的任何意外后果的可能性和性质。我们系统地检查了影响农杆菌属接种五种类型的自发体细胞突变的频率(表2)拟南芥.出乎意料的是,我们的结果表明,主要的影响是对突变的整体抑制,只有一类突变(转位)表现出增加的速率。有趣的是,我们的研究结果还表明,当突变频率减少时,这代表最终vir-基因,涉及抑制较早的、短期的突变率增加。
感染后48小时,2天后拟南芥幼苗暴露为野生型农杆菌属(菌株票)或具有类似于用于转化(VXT)的特征的菌株表现出三类突变的降低率:横向,shrs和框架偏移突变(表2).在暴露于野生型野生型菌株的植物中没有看到这种反应农杆菌属或缺乏野生型三种特征的活菌株(XXX):毒力(vir)基因,癌基因和T-DNA。在这两种情况下,在感染后48小时内每种三种突变类别中的每一个的速率与未感染的对照相同。因此,为了减少突变率,活农杆菌属感染是必要的,很可能对MAMPs没有反应农杆菌属.在早期的研究中,MAMPS没有诱导DNA双链[23.].关于野生型的三个特征,存在vir基因是充分的。什么可能vir基因是在做什么?当我们的时间过程实验的结果考虑到植物的一般防御反应,以及感染和胁迫对植物基因组的影响,提出了一种可能性。
首先,植物感染的特征,或实际上任何压力事件,是植物防御基因的初始诱导。例如,当烟草细胞被感染时农杆菌属他们拥有的菌株有所不同vir基因和T-DNA,显示用于携带的菌株vir基因和T-DNA,防御基因的表达增加了3 - 6小时[38.].其次,预期诱导植物防御基因的感染或非生物压力源与诱导几类突变有关(例如[20.那21.那23.])。第三,植物防御机制有助于抑制DNA损伤[23.].有趣的是,在我们的研究中,我们也研究了转换、SHRs和转变速率的时间过程(表)2),野生型菌株,票据,在速率下降到3小时,在速率下降到低于或等于未感染的控制的速度之前,导致这些类别中的前两个短暂的增加。然而,观察到突变的抑制从感染后6小时,而在烟草细胞培养物中,在感染后6小时的防御基因的表达最高[38.].这种变化可能是由于所使用的模型系统的不同。在任何时候,转换的速率都与对照植物的速率没有什么不同。
我们想提出以下型号农杆菌属感染:(1)早期反应拟南芥用野生型感染农杆菌属(也许任何菌株)是植物防御基因的诱导[38.那39.];在这个初始阶段(大约3小时),植物通过增加某些体细胞突变(转位和SHRs;也许在FSMs) [20.那21.],增加了基础水平的非诱导的自发突变(甚至在未感染的对照组中也能观察到)。(2)如果植物被感染6小时或更长时间,那么暴露时间更长的净效应是对体细胞突变的整体抑制。这可能是因为短时间接触的刺激效应现在没有发生,或者非诱发的自发突变的基础水平降低了,或者两者都有。自发突变的抑制可能是由于,如前所述,某些未知的(和持久的)因子在宿主对感染的反应中表达[23.].在解释结果时,重要的是要意识到我们正在使用脉冲追逐设计。感染相对较短(大多是3小时或6小时),并在两天的幼苗上进行,然后在GUS染色完成前两周消毒并离开。在感染6小时或更高的植物中,突变率较低(与3 H植物相比)可能在很大程度上代表初始3 H组分的突变突变的突变突变的突变。虽然自发突变的持续抑制足以解释暴露于植物中的损伤率低农杆菌属对于6小时以上,如果感染在两周的生长期间,可以发生净突变率进一步降低净突变率(暴露24小时或更多或更多)暴露的植物中)在测量之前。
无论是否有负责对照中所见的总体突变率的最终抑制的具体机制,重要的是要注意,这种减少可能具有用于生物工程的撤防菌株的类型。完全毒性的菌株(VOT)引起比无毒(XXX)菌株更大的抑制;在后一种情况下,长期感染导致总速率低于3小时暴露的率,但率从未降低了控制水平。
我们模型的几个步骤以前曾被认为是在感染期间发生的拟南芥,在那里烟草花叶病毒和油菜油菜病毒与诱导植物防御基因和shrs有关[20.].诱导shrs by烟草花叶病毒和油菜油菜病毒例如,是持久的,无抑制的增加,甚至持续到后代[17.那20.];在我们的研究中,通过LIVE诱导横向大肠杆菌也持续到48小时测试期结束,可能是诱导植物防御基因的结果。PR1[39.]).感染研究拟南芥与两pv。揭示了植物的防御机制确实有助于抑制DNA损伤[23.].自发突变的抑制是对经受的植物的较小程度大肠杆菌,与XXX相比,这可能是因为主机对任何一种病原体的差异响应。这也是合理的,这些突变为植物提供了益处[24.对像这样的病原体来说可能是不利的农杆菌属并且具有抑制自发性突变的菌株可能产生优势。我们的研究提供了一种病原体的证据,可能能够对抗受感染的植物的突变诱导策略。农杆菌属是最复杂的植物病原体之一,突变抑制能力可能代表其阿森纳中的另一个强大的工具。
没有菌株农杆菌属要么大肠杆菌在任何时间点上,测试对转移速率有任何影响(表2).一种可能的原因可能是由于幼苗的CPG二核苷酸中的低甲基化水平农杆菌属和大肠杆菌感染。甲基胞嘧啶在基因组中更容易脱氨[40]甲基化水平始终增加拟南芥发展(从子叶到营养组织)[41.].感染在两天的幼苗上进行,这可能没有足够的甲基化CpG水平以显示C→T过渡的显着变化。
转子是一类突变,其中受感染植物的速率在48小时较高,而不是对照植物。所有菌株都是如此农杆菌属要么大肠杆菌测试,包括热杀菌株的两种细菌;然而,在不同菌株的增加幅度上有高度显著的差异。在缺乏时间过程数据的情况下,很难正确解释观察到的变化的模式。例如,任何菌株转位的净增加都可能取决于早期诱导转位信号强度之间的平衡(例如诱导的植物防御基因[20.])和后续转座抑制信号的强度(例如vir基因,正如上面为其他突变类所提出的)。一种潜在的(但在本例中是不完全的)转位抑制作用vir基因与我们的结果是一致的,因为一旦我们排除了热致死菌株(我们的证据表明,这种菌株不太可能是任何类型突变的强诱导剂),那么与转位率最低相关的菌株就是三种vir基因。相反,与最高换位率相关的菌株是vir基因缺乏,生活,农杆菌属应变,XXX。为什么农杆菌属将无法正确抑制诱导换位,这可能是由于细菌病原体的异常强烈诱导细菌病原体,和/或与显然反击其他突变类型的那些抑制机制较小的抑制机制。菌株有vir基因(VOT,VXX和VXT)在它们影响点突变,施联FSM的能力方面没有差异。然而,由于T-DNA的存在(在菌株VOT和VXT中),血管生成似乎似乎没有导致更高的转置速率似乎增加。
值得注意的是,我们的方法已经经过了微调,以减少来自几个可能来源的不需要的可变性。通过使用两天的幼苗作为初始感染,我们可以分析感染对整个植株的影响,而不仅仅是对任何特定器官的影响。例如,以前有报道说,在拟南芥叶比花和茎[42.].此外,当植物在同一年龄的年龄时,我们的所有测量都是如此。以前,已经发现微卫星不稳定性的速率增加了[43.]和shr减少[44.]随着年龄的增长拟南芥植物。幼苗的小尺寸也允许我们操纵和感染植物而不会伤害它们[45.,这在处理成年植物时几乎是不可避免的。伤口会引起宿主防御反应,我们无法将其与单纯感染引起的防御反应区分开来。受伤的植物也会优先增强表达vir携带病毒的基因vir与此相比的基因(VOT,VXT,VXX)vir基因缺乏XXX菌株。增强的Vir蛋白的表达伴有细菌附着,一种菌株XXX缺乏的性质。植物的小尺寸也让我们在我们选择后感染后易于消毒植物。通过将消毒的植物移至另外两周,我们的突变计数更可靠:而不是需要检测单个蓝色细胞(改变的后果格斯突变灶为易于识别的蓝色斑点。Ulker et al. (2012) [46.]对突变报告线和记者序列的可靠性提高了令人担忧格斯恢复,由Puchta和Hohn解决(2012年)[47.].有几篇论文使用这些线来对不同情况下的体细胞突变进行评分[48.那49.].此外,其他几个小组也培育出了大量转基因植物拟南芥分量逆转的行采用相同的方法[33.那35.那50.].因此,现在识别体细胞逆转的方法是稳健的和完善的。Kovalcuk等人(2000)[32.]从那些蓝色斑点中分离DNA,并确定了原始突变的逆转,因此确实可以确认逆转。除了细菌不存在于培养基之外,我们将控制幼苗与受感染的幼苗相同的条件。每种治疗筛查400-500株植物,这比以前的建议(〜30-100种植幼苗〜30-100种 - Puchta和Hohn,2012)[47.].我们观察到的突变频率非常低(例如,每植物每株摄取时0.03至0.5个事件),因此筛选大群是必要的。
结论
1.感染拟南芥幼苗与野生型菌株农杆菌属或者具有类似于用于生物工程LED的特性(感染48小时后的特性的武装菌株,或者对抑制或没有影响,或者没有影响,其中四种突变中的四种突变中测量[横向,shrs,fsm(抑制)和转变(不变)]。
2.只有换位频率增加,所有菌株农杆菌属在不同的菌株中,增加的幅度有很大的不同。
3.的存在vir基因在农杆菌属使用的菌株出现足以导致抑制突变(在其发生的那些类中)。没有抑制(低于在未感染的对照中观察到的速率),当植物感染缺乏的伤害时,观察到vir基因,致癌基因和T-DNA。
4.对于横向和shRS,用野生型菌株感染48小时的植物中观察到的抑制代表了频率早期短暂的短寿命增加的逆转,并且当植物感染缺乏的伤害时,未观察到这种逆转vir基因,癌基因和T-DNA。
5.总的来说,研究表明基于转化的生物工程具有农杆菌属除了T-DNA连接的突变和转置之外,可能不一定导致细胞突变的更大率。我们的研究还提供了一种病原体的第一种证据,其可以至少部分地通过感染的植物诱导突变,进一步指示农杆菌属一股复杂的感染能力。
方法
拟南芥转基因线
使用转基因测定点突变频率A. Thaliana.(加入哥伦比亚)第693号线693,699,747和M4。在693,699和747中,引入了止挡密码子格斯ORF在三个不同的位置G→T.166.G→T.118.A→T.分别(无花果。1A);这些转基因素由Igor Kovalchuk(加拿大Lethbridge大学)提供[32.].Line M4由Anna Docicker(格伦大学,比利时)提供[33.].在线M4中,一个错误义突变体格斯将基因插入基质T在1390突变到C的位置TH.位置(图。1A).使用线651和R2L1对体细胞同源重组进行评分,其中重组基材是截短的格斯基因(图。1B.).651系(C24生态型)由芭芭拉·霍恩(瑞士弗里德里希·米歇尔研究所)赠给[34.].我们获得了R2L1(哥伦比亚生态型)的线[35.],以及G10株系(哥伦比亚生态型)[36.]来自Francois Belzile(加拿大拉夫尔大学)。LINE G10在微卫星(延伸10gs)内格斯ORF(无花果。1C).这标签1线是奈杰尔克劳福德(加利福尼亚州加利福尼亚大学)提供的[37.].所有实验均在纯合子苗上进行。
细菌菌株
感染采用野生型进行A. Tumefaciens.菌株Ach5(在论文的主体中称为VOT)及其衍生物(表1)以及大肠杆菌.这农杆菌属K.Veluthambi(Madurai Kamaraj University,India)提供菌株ACH5和LBA4404(称为纸张主体中的VXX)[51.].LBA4404是Ach5的衍生物,带有去武装的Ti质粒pAL4404,因此,它只有vir和oriTi质粒的区域,但不包括致癌基因和T-DNA [52.].通过将LBA4404用二进制向量PCAMBIA2300电穿过LBA4404,我们生成了LBA4404(PCAMBIA2300)(称为VXT)。从Paul J. Hoooykaas(莱顿大学,荷兰)获得了LBA4002(称为XXX)的菌株LBA4002(称为XXX)。LBA4002是没有Ti质粒的ACH5衍生物[53.].所有农杆菌属在28℃下在Luria-Bertani(LB)培养基上生长菌株。LBA4404(PCAMBIA2300)在含有100mg / L卡那霉素的培养基上生长。大肠杆菌(菌株,DH5α)在37℃下在LB培养基中生长。通过在70℃下加热30分钟来获得热杀死的细菌[39.[通过在适当的介质中再次验证,验证热杀死的形式。在感染之前,将细菌在液体LB培养基中用适当的抗生素培养,并将悬浮液(0.6至0.9光密度为600nm)以1,100×g离心10分钟,并用等体积的液体萌发介质洗涤,以消除痕迹LB.
植物生长条件和感染方法
拟南芥种子表面用500 μl 70%乙醇消毒,用无菌水冲洗,用0.5%漂白剂处理2分钟。随后,用无菌水冲洗种子四次。感染拟南芥根据Li等人的协议进行幼苗.[54.]修改最小。将种子涂在萌发培养基(无菌Murashige和Skoog(MS)培养基上,具有3%蔗糖,pH5.7)。通过将MS板在黑暗中保持MS板,在4℃下保持28小时,通过将MS板保持在晶粒中同步。然后将板移动到生长室(USA),在16-H光/ 8-H暗循环下具有8000勒克斯单元的均匀光强度。在整个实验中,温度在22℃下保持,湿度设定为80%。两天后,将幼苗在含有细菌的液体萌发培养基中冲洗,并在萌发介质上共培养适当的时间(0.5小时至48小时)。除了液体介质缺乏细菌之外,对照幼苗与受感染的幼苗类似。然后用含有250mg / l头孢噻肟和0.05%植物防腐剂(Biogenuix Medsystem PVT)的液体MS培养基对感染和对照幼苗进行表面灭菌。使用宽口移液管轻轻地将这些幼苗轻轻滴落在含有250mg / L头孢噻肟和0.05%植物防腐剂的萌发培养基上。为所有实验维持幼苗之间的均匀间隔。 These plates were kept in the plant growth chamber in the same conditions mentioned above for two weeks and then used for GUS histochemical staining.
β-葡萄糖苷酶(GUS)组织化学染色
根据杰斐逊的协议进行GUS组织化学染色[55.].染色缓冲液(100mM磷酸钠缓冲液[pH7.0])含有1mm 5-溴-4-氯-3-吲哚基葡糖醛(X-Glucth)(Biosynth,瑞士),0.1%Triton X-100和50μg/ml kanamycin。将GUS染色溶液(10mL)加入到含有约50个植物的六孔板中。将这些板真空渗透10分钟,并在37℃下温育48小时。随后将这些植物用70%乙醇漂白。蓝斑(图。1E)使用光学显微镜(Leica KL300)计算反射突变逆转。
估算突变频率
每次试验重复3次,每次处理约400-500株。对于FSM的研究,大约采集了200-250株植物。突变频率表示为每株观察到的平均斑点数[33.].比较了感染植株和对照植株的自发突变频率。对突变频率数据集进行正态性检验[56.[variances的平等[57.那58.,并进一步进行单因素方差分析(ANOVA, α = 0.05),以确定显著影响(P. < 0.05), if any. Duncan´s multiple range test [58.-60.[当ANOVA显示出显着差异时,就业P. < 0.05). All the statistical analyses were performed using STATISTICA version 8 software (Stat Soft Inc.). The data sets were plotted in MS Office - Excel software (Microsoft Inc.).
缩写
- 月:
-
体细胞同源重组
- FSM:
-
帧移位突变
- 格斯:
-
β葡萄糖醛酸酶基因
- H:
-
小时
- 女士:
-
Murashige和斯库
- MAMP:
-
微生物相关的分子模式
- 磅:
-
Luria-Bertani.
参考文献
- 1。
Zupan J,Muth Tr,Draper O,Zambryski P.转移DNA来自根癌土壤杆菌进入植物:对基本洞察力的盛宴。工厂J. 2000; 23:11-28。
- 2。
木DW,SETUBAL JC,Kaul R,Monks de,Kitajima JP,Okura VK等人。自然遗传工程师的基因组根癌土壤杆菌C58。科学。2001;294:2317-23。
- 3.
圆形质粒dna之间的基本发现和简单的重组导致了广泛的使用根癌土壤杆菌作为植物基因工程的广义载体。Int J Dev Biol. 2013; 57:449-52。
- 4.
Escobar Ma,Dandekar Am。根癌土壤杆菌作为疾病的媒介植物科学进展。2003;8:380-6。
- 5.
植物寄主和细菌因子在植物生长中的作用农杆菌属- 介导的遗传转化。int j dev biol。2013; 57:467-81。
- 6。
Gelvin SB。植物蛋白涉及农杆菌属- 介导的遗传转化。Annu Rev phytopathol。2010; 48:45-68。
- 7。
FORSBACH A,SCHUBERT D,LECHTENBERG B,GILS M,SCHMIDT R.全面表征单拷贝T-DNA插入拟南芥蒂利亚纳基因组。植物mol biol。2003; 52:161-76。
- 8。
税费,vernon dm。T-DNA相关复制/易位拟南芥.突变体分析和功能基因组学的意义。植物杂志。2001;126:1527-38。
- 9。
Majhi BB,Shah Jm,Veluthambi K.一种新型T-DNA集成在涉及两种间同胞形元易位的水稻中。植物细胞代表2014; 33:929-44。
- 10。
Van Lijsebettens M,Vanderhaeghen R,Van Montagu M.插入诱变 拟南芥蒂利亚纳:分离改变叶形形态的T-DNA连接的突变。Al Appl Genet。1991; 81:277-84。
- 11.
C, C, C, C, d, C, d, C, d拟南芥.遗传学。1998年; 149:641-50。
- 12.
Bhatt AM, Lister C, Crawford N, Dean C标签1元素在转基因中增加拟南芥行。植物细胞。1998;10:427-34。
- 13。
法院B, Feuerbach F, Eberhard S, Rohmer L, Chiapello H, Camilleri C, et al.;Tnt1转位事件是由体外转化引起的拟南芥蒂利亚纳,转置副本整合到基因中。Mol Genet基因组学。2001; 265:32-42。
- 14。
刘德,克劳福德纳姆。推定转座酶mRNA的表征标签1,普遍存在于拟南芥并且可以诱导农杆菌属-介导的转化与d标签1DNA。遗传学。1998;149:693 - 701。
- 15.
Dunoyer P,Heatber C,Voinnet O.诱导,抑制和RNA沉默途径在毒性中的诱导和要求根癌土壤杆菌感染。NAT Genet。2006; 38:258-63。
- 16。
Kathiria P,Sidler C,Golubov A,Kalischuk M,Kawchuk LM,Kovalchuk I.烟草马赛克病毒感染导致重组频率和抗感染烟草后代病毒,细菌和真菌病原体的重组频率和抗性。植物理性。2010; 153:1859-70。
- 17。
Boyko A,Kathiria P,Zemp Fj,Yao Y,Pogribny I,Kovalchuk I.转基因感染植物基因组稳定性和甲基化的转基因变化:(病毒诱导的植物基因组不稳定性)。核酸RES。2007; 35:1714-25。
- 18。
Dellaporta SL,Chomom PS,Mottinger JP,Wood Ja,Yu Sm,Hicks JB。与玉米病毒感染相关的内源转移元素。冷泉Harb Symp量子Biol。1984; 49:321-8。
- 19。
Johns Ma,Mottinger J,Freeling M.一种低拷贝数,Copia样Transposon在玉米中。Embo J. 1985; 4:1093-101。
- 20。
Kovalchuk I,Kovalchuk O,Kalck V,Boyko V,Filkowski J,Heinlein M,等。病原体诱导的全身植物信号触发DNA重排。自然。2003; 423:760-2。
- 21。
系统植物信号触发基因组不稳定性。植物j . 2004; 38:1-11。
- 22。
Lucht JM,Mauch-Mani B,Steiner Hy,Metroaux JP,Ryals J,Hohn B.病原体应力增加了体细胞复合频率拟南芥.Nat麝猫。2002;30:311-4。
- 23。
歌曲j,弯曲af。微生物病原体触发宿主DNA双链休息,植物防御反应降低了丰富。PLOS POAROG。2014; DOI:10.1371 / journal.ppat.1004030.
- 24。
张志强,张志强,张志强,等。胁迫对水稻基因组结构的影响。安机器人。2004;94:481 - 95。
- 25.
陈志强,王志强,陈志强,等。非生物胁迫对水稻基因组同源重组频率、点突变频率和微卫星稳定性的影响拟南芥植物。mutatres。2011; 707:61-6。
- 26.
Molinier J,Ries G,Zipfel C,Hohn B.在植物中应力的转换记忆。自然。2006; 442:1046-9。
- 27.
Baake E,Gabriel W.通过突变,选择和漂移生物进化:介绍审查。ANN REV COMP PHY。2000; 7:203-64。
- 28.
Hancock Am,Brachi B,Faure N,Horton MW,Jarymowycz LB,Sperone FG等。适应气候的适应拟南芥蒂利亚纳基因组。科学。2011;334:83-6。
- 29.
华梵,勒·瓦·勒省A,Boutin Ts,Filee J,Capy P.基因组自私建筑师的生活斗争。Biol Direct。2011; 6:19。
- 30。
Ca,Johnston Mo。在确定突变的原因时向前移动:使其适合评估环境因素和细胞年龄的影响的植物的特征。J Exp Bot。2006; 57:1847-55。
- 31。
Sia Ea,Jinks-Robertson S,Petes Td。微卫星稳定性的遗传控制。mutatres。1997年; 383:61-70。
- 32。
Kovalchuk I,Kovalchuk O,Hohn B.转基因植物中躯体突变频率的基因组范围。Embo J. 2000; 19:4431-8。
- 33。
van der Auwera G,Baute J,Bauwens M,Peck I,Piette D,Pycke M等。新建构建体的开发和应用得分C:G-TO-T:过渡和同源重组拟南芥.植物理性。2008; 146:22-31。
- 34。
植物染色体内同源重组的研究。EMBO j . 1994; 13:484-9。
- 35。
李丽丽,陈志强,陈志强,等。染色体内同源重组的新报道拟南芥蒂利亚纳.工厂J. 2004; 40:1007-15。
- 36。
Azaiez A,Bouchard Ef,Jean M,Belzile FJ。长度,取向和植物宿主影响微卫星中的突变频率。基因组。2006; 49:1366-73。
- 37。
Frank MJ,Liu D,Tsay YF,Ustach C,Crawford NM。标签1是一种自主转换元素,在两者中都显示了体细胞切除拟南芥和烟草。植物细胞。1997;9:1745-56。
- 38。
通过对T-DNA和Vir蛋白转移到植物细胞的研究根癌土壤杆菌诱导参与介导转化的宿主基因的表达,抑制宿主防御基因表达。工厂J. 2003; 35:219-36。
- 39。
Pruss GJ,Nester EW,Vance V.渗透根癌土壤杆菌在渗透区诱导宿主防御和依赖性反应。Mol植物微生物相互作用。2008; 21:1528-38。
- 40.
Mugal CF, Ellegren H.人类CpG位点替代率的变化与非CpG差异、甲基化水平和GC含量相关。基因组医学杂志。2011;12:R58。
- 41.
Ruiz-Garcia L,Cervera Mt,Martinez-Zapater Jm。DNA甲基化始终增加拟南芥发展。Planta。2005; 2:301-6。
- 42。
植物同源重组是器官特异性的。Mutat杂志2006;595:145-55。
- 43。
Golubov A,Yao Y,Maheshwari P,Bilichak A,Boyko A,Belzile F,等。微卫星不稳定性拟南芥随着植物开发增加。植物理性。2010; 154:1415-27。
- 44。
Boyko A,Zemp F,Filkowski J,Kovalchuk I.植物中的双链休息修复是发育管制。植物理性。2006; 141:488-97。
- 45。
麦卡伦,宾斯AN。根癌土壤杆菌和植物细胞相互作用和相互作用型大分子转移所需的活动。Annu Rev Cell Dev Biol。2006; 22:101-27。
- 46。
Ulker B,Hommelsheim Cm,Berson T,Thomas S,Chandrasekar B,Olcay Ac,等。重新评估体细胞同源重组报告系列的可靠性和有用性。植物细胞。2012; 11:4314-23。
- 47。
Puchta H,Hohn B.在Planta躯体躯体同源重组测定中重新判断:一种成功和多功能,但精致的工具。植物细胞。2012; 11:4324-31。
- 48。
Bashir T,Sailer C,Gerber F,Loganathan N,Bhoopalan H,Eichberger C,等。杂交以父母依赖于原始依赖的方式改变自发突变率拟南芥.植物理性。2014; 165:424-37。
- 49.
Singh Ak,Bashir T,Sailer C,Gurumoorthy V,Ramakrishnan Am,Dhanapal S等人。父母年龄会影响开花植物后代的躯体突变率。植物理性。2015;DOI:10.1104 / pp.15.00291.
- 50。
Bollmann SR, Tominey CM, Hoffman PD, Hoffman TMC, Hays JB。分析所有6个碱基替代途径拟南芥.植物杂志。2011;155:1286 - 300。
- 51。
Krishnamohan A,Balaji V,Veluthambi K.高效vir基因诱导根癌土壤杆菌需要Vira,Virg和vir来自同一Ti质粒的盒子。J细菌。2001; 183:4079-89。
- 52。
Hoekema A, Hirsch PR, Hooykaas PJJ, Schilperoort RA。基于分离的二元植物矢量策略vir-t区根癌土壤杆菌 Ti-plasmid. Nature. 1983;303:179–80.
- 53。
hoykaas PJ, den Dulk-Ras H, Ooms G, Schilperoort RA。章鱼素和非帕氨酸质粒的相互作用根癌土壤杆菌.J细菌。1980; 143:1295-306。
- 54。
李家福,冯·阿里尼姆·埃格兰省,NebenführA.快速技术:简化农杆菌属基于幼苗瞬态基因表达分析的转化方法拟南芥和其他植物物种。工厂方法。2009;6。
- 55。
杰斐逊ra。GUS,报告基因系统。自然。1989; 342:837-8。
- 56。
Shapiro SS,Wilk MB。正常性差异试验分析(完整样品)。Biometrika。1965年; 52:591-611。
- 57。
Hartley Ho。使用范围在分析方差分析中。Biometrika。1950; 37:271-80。
- 58。
Snedecor GW,Cochran WG。统计方法。第8辑。阿梅省,爱荷华州:爱荷华州立大学出版社;1989. p。503。
- 59。
Cochran WG,Cox Gm。实验设计。第二次。纽约:Wiley;1992. p。100-2。
- 60.
邓肯DB。多个量程和多个F测试。生物识别技术。1955;11:1-42。
致谢
JMS感谢印度技术学院 - 印度马德拉斯,博士后奖学金。我们感谢Igor Koverchuk(Lethbridge大学),Francois Belzile(UniversitéAval),安娜代表(根特大学),芭芭拉·霍恩(Friedrich Miescher Institute)为报告线提供种子。我们感谢印度政府的生物技术(DBT)和科学技术部(DST),为他们的经济援助。
作者信息
隶属关系
通讯作者
额外的信息
利益争夺
提交人声明他们没有竞争利益。
作者的贡献
构思和设计实验:JMS和RB。执行实验并编译数据:JMS,AMR,SR,AJ,NB和SD。分析了数据:JMS,UU,AMR,AKS,GH和RB。写论文:JMS,AMR,AK,UU,GH和RB。所有作者都读过了最后的手稿。
附加文件
附加文件1:图S1。
C→T转化速率拟南芥线m4,用不同的感染后农杆菌属不同时期的紧张。A. VOT感染后。B. XXX感染后。条形图表示三个生物重复的平均误差标准,每个重复约包含140-160个植物。条形图上方的数字显示了各自的平均值,没有显著差异(P. > 0.05), as analysed by Duncan’s multiple range test. Vertical axis shows the mutation rates. (PPT 125 kb)
附加文件2:图S2。
转基因中的血管瘤瘤组体躯体同源重组率拟南芥行(第651行和R2L1行)。A.线路651 B.线路R2L1条形图表示三个生物重复的平均误差标准,每个重复约包含140-160个植物。条形图上方的数字显示了各自的平均值,没有显著差异(P. > 0.05), as analysed by Duncan’s multiple range test. Vertical axis shows the mutation rates. (PPT 127 kb)
附加文件3:图S3。
转基因中的血管瘤瘤组体躯体同源重组率拟南芥感染后的线条大肠杆菌在不同的时期。A.线路651 B.线路R2L1条形图表示三个生物重复的平均误差标准,每个重复约包含140-160个植物。条形图上方的数字显示了各自的平均值,没有显著差异(P. > 0.05), as analysed by Duncan’s multiple range test. Vertical axis shows the mutation rates. (PPT 128 kb)
权利和权限
开放访问本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Shah,J.M.,Ramakrishnan,A.M.,Singh,A.K.et al。抑制不同类型的体细胞突变拟南芥经过vir基因表达农杆菌属菌株。BMC植物BIOL.15,210(2015)。https://doi.org/10.1186/s12870-015-0595-1
已收到:
公认:
发表:
关键字
- 躯体突变
- 农杆菌属菌株
- 未受感染的控制
- 农杆菌感染
- 换流率