摘要
背景
茶(茶树长期以来,它以其令人惊叹的风味和香气闻名于世。茉莉酸甲酯(MeJA)是植物界中一种有效的激发剂,主要通过促进茶叶中的风味挥发物来改善茶叶的香气质量。虽然已经确定了各种有助于香气质量的挥发性次生代谢物,但我们对这些化合物的生物合成途径的理解在很大程度上仍然不完整。因此,为了更好地了解MeJA介导的挥发物生物合成的生物学机制,需要了解有关茶叶转录组的信息,特别是基因表达在MeJA作用下的变化细节。此外,MeJA处理可以夸大次生代谢物的反应和一些基因的表达,这为弄清其机制提供了更好的机会。
结果
二维气相色谱-质谱分析结果表明,meja处理后的茶叶中萜类化合物含量明显增加,其中芳樟醇、香叶醇和苯乙醇含量最高。更重要的是,我们通过RNA-seq鉴定了MeJA处理(0 h、12 h、24 h和48 h)诱导茶叶挥发物生物合成途径的差异表达基因(DEGs)。在MeJA_12h、MeJA_24 h和MeJA_48 h样品中分别鉴定出19245、18614和11890℃。α-亚麻酸降解途径首先被响应,导致茶叶内部ja途径被激活,MEP/DOXP途径被显著夸大。值得一提的是,与中枢JA生物合成途径相关的茉莉酸o -甲基转移酶在MeJA_24 h茶叶中的表达量增加了7.52倍。此外,与未处理叶片相比,萜类主干生物合成途径相关基因的表达模式有所不同。1-脱氧-d -木醛糖-磷酸合成酶(DXS)、全反式壬戊烯基二磷酸合成酶、香叶香叶基还原酶、香叶香叶基二磷酸合成酶(II型)、羟甲基戊二酰辅酶a还原酶和4-羟基-3-甲基丁-2-烯基二磷酸还原酶的表达量增加了约2- 4倍。
结论
二维气相色谱-质谱分析结果表明,外源施加MeJA可以诱导茶叶中挥发性成分的含量,尤其是香叶醇、芳樟醇及其氧化物的含量。此外,转录组分析显示,MeJA处理后,产生大量茉莉酸并快速激活茶叶内部整体ja通路的α-亚麻酸降解通路基因表达增加,萜类主干生物合成通路也受到显著影响。总的来说,MeJA可以极大地激活次生代谢途径,特别是挥发物。该结果将加深我们对MeJA作用下茶叶挥发性代谢物生物合成途径的理解。
背景
茶树(茶树)主要用于饮料生产。茶叶的品质对其市场价值很重要,主要取决于它的味道和香气。通常,酚类化合物负责茶的颜色和味道,而风味挥发性化合物是茶香气的基础[1- - - - - -4]。茶叶中存在多种挥发性有机成分(VOCs),尽管这些挥发性有机成分的含量极低(即占总干重的0.01%)。由于它们的低阈值和高气味单位,它们对茶的香气有显著的影响。一般来说,在茶树的种植、生产和加工过程中,茶叶的化学和生化转化形成了冲泡茶的香气。到目前为止,研究人员在确定茶叶香气的主要成分及其在制造过程中的形成方面取得了进展。茶叶中的主要挥发物主要来自萜类途径,如芳樟醇及其氧化物,这是泡茶中甜味的原因;或者通过脂肪酸、类胡萝卜素和一些氨基酸的氧化,如顺式3-己烯醇导致了新鲜和水果的香气,香豆素导致了泡茶中甜樟脑的香气。这些香气成分共同决定了茶叶的香气品质。根据大量文献,这些研究进展主要集中在茶树栽培、育种和加工对茶叶香气的影响上。然而,关于这些气味挥发物生物合成的具体代谢途径和分子机制的数据有限[5- - - - - -8],这阻碍了确定潜在机制的进展。因此,识别与香气相关的代谢途径相关的基因是茶叶香气研究的重要内容。
根据文献,鉴定次生代谢途径相关基因最方便、最有效的方法是胁迫或外源激发子处理后的转录组结合代谢分析。植物具有合成、积累和释放低分子次级代谢物的能力,这些代谢物主要来自碳水化合物、饱和和不饱和脂肪酸以及一些氨基酸[9,10]。特别是,当植物经历包括外源激发子在内的生物和非生物胁迫时,次生代谢物生物合成途径被触发,以帮助植物适应具有挑战性的环境[11,12]。这些外源性刺激可以直接或间接地诱导防御信号,以及随后可能广泛改变挥发性代谢物谱的反应[13,14]。为了构建一个理想的模型,重要的是选择合适的刺激。植物激素茉莉酸甲酯是整个植物界次生代谢物产生的有效刺激物,特别是那些参与发育过程和防御反应的植物[15,16]。几项研究表明,MeJA处理可以通过植物代谢的广泛转录重编程,触发挥发性次生代谢物(萜类化合物和脂肪酸衍生的风味化合物)和非挥发性次生代谢物(生物碱、氨基酸和植物抗毒素)的生物合成[17- - - - - -19]。此外,MeJA在提高农产品质量方面发挥着重要作用,特别是改善某些水果和蔬菜的香气品质,如苹果和草莓[20.- - - - - -22]。根据我们之前的研究,最重要的结果是23],用meja处理过的茶叶制成的红茶的香气品质得到了极大的提升。然而,MeJA处理茶叶的具体机制尚不清楚。
与其他植物相比,茶中挥发物产生的分子机制数据有限。最近开发的深度测序技术代表了迄今为止最有效的转录本分析方法。其中,RNA-seq可以比较茉莉酸甲酯处理前后茶叶的整个转录组。比较MeJA处理前后的转录组可能有助于鉴定香气相关代谢物生物合成的候选基因。因此,我们使用高通量Illumina Miseq测序进行转录组分析,并使用二维气相色谱-飞行时间质谱(GC*GC - tof /MS)进行挥发性代谢物分析,以确定meja响应茶的挥发性次级代谢途径。鉴定的独特基因用于后续的注释分析,为茶叶基因的转录组信息提供了一个平台。在本研究中,我们重点鉴定了MeJA诱导的茶叶中萜类和其他一些挥发性代谢相关基因。这将为进一步提高茶叶香气品质提供依据。
结果与讨论
MeJA处理后挥发性代谢谱的变化
二维GC-TOF/MS结果显示,meja处理后的茶叶挥发性代谢物发生了显著变化。我们将鉴定出的代谢物分为三组:C6- c9C10- c30.,其他主要包括一些酸。我们可以清楚地看出,处理12 h和24 h后,风味挥发物的主要含量发生了显著变化。C中的大部分挥发性化合物6- c9与ck_12h相比,MeJA_12h处理的茶叶中叶绿素含量有所增加。2-己烯醛对茶叶香气有重要影响,间接响应非生物胁迫;根据表12-己烯醛含量增加到9.62 μg/g,表明MeJA处理后,这种小分子挥发性代谢物大量生物合成。在C10- c30.类别。芳樟醇、香叶醇、水杨酸甲酯和苯乙醇被认为是泡茶中花香的贡献者。MeJA_12h处理的4种挥发性代谢物含量分别增加1.91、4.4、0.91和9.25 μg/g, MeJA_24 h处理的4种挥发性代谢物含量分别增加1.65、3.58、5.54和5.09 μg/g。这些结果表明,在MeJA治疗期间,这四种代谢物的持续增加。
更有趣的是,我们发现大多数酸前体,如水杨酸、反式肉桂酸、香草酸、反式对香豆酸,其中大多数与挥发性生物合成途径有关,在meja处理24 h的茶叶中减少。我们假设这些酸在合成挥发物中作为前体被消耗的速度比它们被生物合成的速度快,导致挥发物含量增加而酸前体含量减少。
茉莉酸甲酯处理后,十八烷酸的含量也显著降低,它是α-亚麻酸代谢途径的中间产物,最终合成大量茉莉酸和茉莉酸甲酯(表1)1).
Illumina测序和数据分析
8个样本的RNA测序产生了超过2700万个100 bp的成对端reads,平均每个样本有300万个reads。对原始数据进行了清洗和质量检查。共获得1800多万条修剪过的reads,有用数据百分比在58.96% ~ 72.23%之间,每个reads的平均长度为195 bp(附加文件)1:表1)。与正式平台产生的reads相比,Illumina Miseq测序reads的较长长度有助于随后重新组装的准确性,尽管缺乏可用的茶参考基因组。de novo组装使用Trinity (http://trinityrnaseq.github.io/).所有的短reads被组装成625,574个contigs,平均大小为290.15 bp, N50为382 bp;11.13%的样本读数大于500 bp。对这些组合进行进一步的组装,生成用于构建de Bruijn图的组件。最后,通过优化de Bruijn图,我们构建了320573个转录本,平均大小为796 bp, N50为1392 bp(表1)2).然后用BLAST搜索了所有的文字记录拟南芥数据库。对于那些没有BLAST命中(非blastable转录本)的序列,我们使用e值阈值为1E-5的BLASTx程序对NCBI非冗余(nr)数据库进行搜索。为了区分冗余序列和同源序列,本研究中使用了unigenes来减少冗余:根据nr数据库中最匹配的同源物的加入号为每个唯一序列分配一个unique ID。共获得50732个unigenes,平均长度为1151 bp(表1)2).编译了contigs, transcripts和unigenes的大小分布(附加文件)2:图S1)。
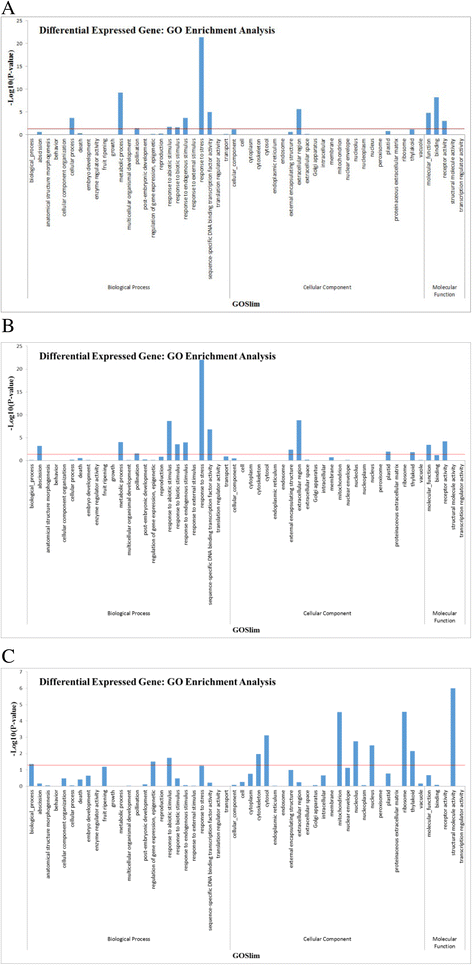
EggNOG (genetic genealogy of genes: Non-supervised Orthologous Groups)是一个数据库,提供943种细菌、69种古细菌和121种真核生物的同源类群。根据先前的研究,蛋白质可分为25个功能类别[24]。在本研究中与nr数据库显著同源的45745个unigenes中,40245个可以被划分为26个eggNOG类(附加文件3.:图S2)。“功能未知”(8513,21.15%)和“一般功能预测”(7383,18.35%)是eggNOG类别中最大的两个功能群。归类为“仅用于一般功能预测”的单一基因的高比例与其他物种的转录组研究相似[25- - - - - -28]。将如此多的差异表达单基因分配到未知功能组,表明MeJA处理茶叶过程中存在未知的次生代谢变化机制。其次是“信号转导机制”(3330个,8.27%)、“翻译后修饰”、“蛋白质转换”、“同伴”(3259个,8.10%)、“翻译”、“核糖体结构和生物发生”(1964年,4.88%)、“转录”(1847个,4.59%),而涉及“细胞运动”和“细胞外结构”的组共有80个unigenes(0.2%),除了两个未确定的unigenes外,是最小的eggNOG分类。值得注意的是,1734个unigenes(4.31%)和1312个unigenes(3.05%)分别被划分为碳水化合物代谢和次级代谢物生物合成基团,包括挥发性化合物生物合成。
差异表达基因分析
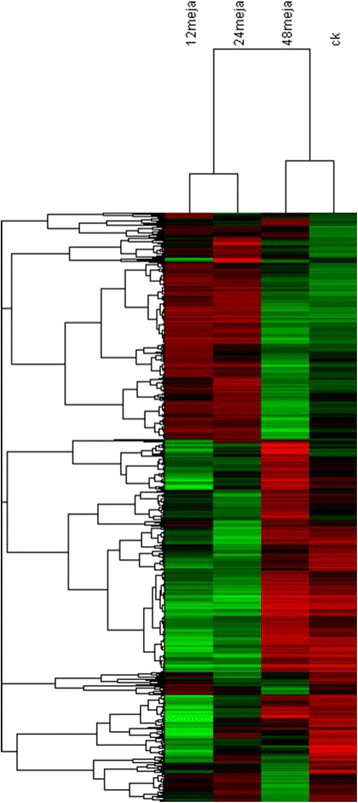
为了鉴定meja处理的茶叶样品中的deg,我们将它们相互比较,并鉴定出两个样品之间至少有2倍的上调或下调的独特基因p-value小于0.05。然后,使用分层聚类来获得deg的全局视图(图2)。3.).MeJA_12h处理样品的DEGs分析结果与MeJA_24h处理样品相似。MeJA_12h、MeJA_24h样品中共鉴定出19245、18614个deg(图2)。1).这两个和未经meja治疗的更不一样。因此,很明显,MeJA对茶叶的转录组有显著的影响。然而,从热图中也可以推断出MeJA_48 h样品更为特殊。与其他样品不同的是,与其他样品相比,在MeJA_48 h样品中鉴定出11890个deg(图2)。1),对于三个主要术语,分别显示了上调和下调deg的GO类别。
经MeJA处理后48 h内各基因均受到较大影响。然而,在12、24 h-MeJA样品中,大多数deg与48 h-MeJA和CK样品完全不同。大多数情况下,DEGs的表达在24 h内先升高,然后下调。我们也知道MeJA处理与食草动物攻击非常相似,最终导致大量消耗植物。基因表达、蛋白质表达和代谢组学含量先提高后消耗,最后恢复到正常水平。
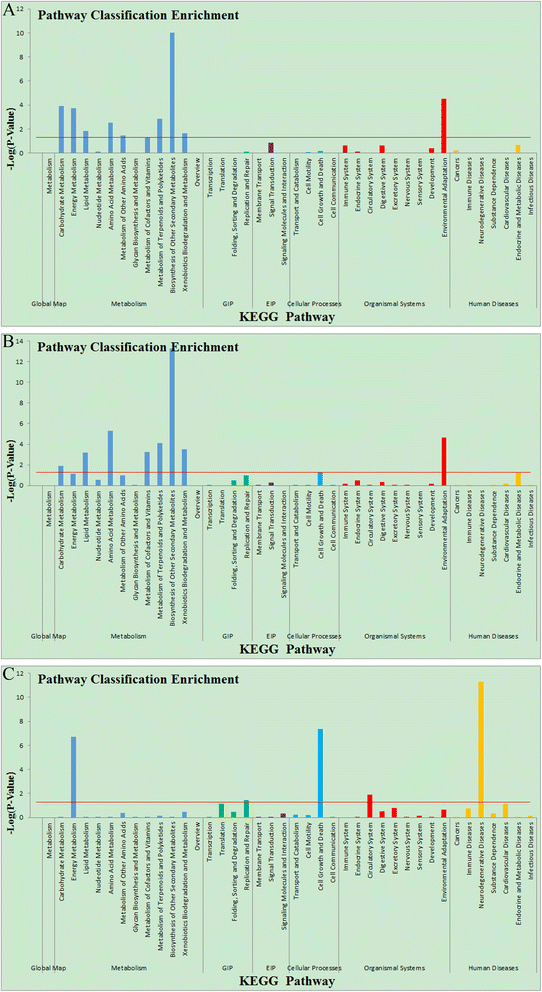
KEGG(京都基因和基因组百科全书)是一个数据库,通过收集代表细胞过程和标准化基因注释的当前知识的手动绘制的途径图,将基因组信息与高阶功能信息联系起来。为了获得由MeJA调节的茶代谢途径的概述,根据京都基因和基因组百科全书(KEGG;http://www.genome.jp).分析显示总共45个KEGG通路包含20404个指定的unigenes(附加文件)4表2)。分配单基因数量最多的途径是“代谢”、“人类疾病”和“遗传信息处理”。此外,我们对MeJA_12h、MeJA_24h和MeJA_48h样品中鉴定的deg分别与meja未处理的样品进行KEGG富集分析,筛选出1406、1443和1695个在挥发相关途径中重要的deg(图2)。2).
表中列出了由unigenes代表的次级代谢途径3..有趣的是,在次生代谢过程中,萜类和苯丙类途径是最具代表性的4:表S2;表格1).奇怪的是,这些挥发性次生代谢物类型在MeJA处理后的茶叶中很少有高水平积累的报道;显然,参与这些代谢物生物合成的deg尚未被明确鉴定。
meja诱导的茶叶JA反应途径
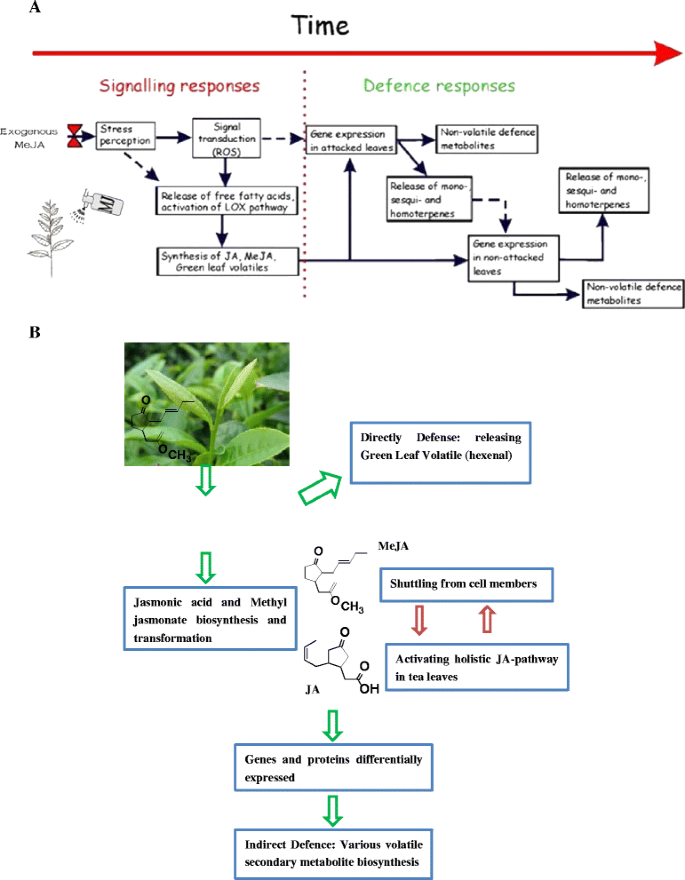
有趣的是,6种deg与α-亚麻酸代谢密切相关,最终导致JA的生物合成(表1)3.;无花果。3.).JA信号通路是响应捕食和病原体攻击的最重要的信号转导通路,起着“总开关”的作用[7,29- - - - - -31]。脂氧合酶(EC:1.13.11.12)、乙酰辅酶a酰基转移酶1 (EC: 2.3.1.16)、两种氧化酶(EC:1.3.3.6;EC:5.3.99.6)和茉莉酸o -甲基转移酶(EC:2.1.1.141)。先前的报告表明,基因可以感知并响应外部刺激产生的局部和系统信号,包括MeJA本身[32- - - - - -36]。在外源MeJA处理过程中,直接催化(−)-JA生物合成底物的茉莉酸o -甲基转移酶(jasmonate O-methyltransferase)的表达量比对照上调了7.52倍(附加文件)2:图S1,附加文件5:图S3;表格3.).由于其酸性性质,自由酸JA可能无法在没有载体的情况下穿过细胞膜;然而,MeJA可以通过气相或细胞间迁移扩散到植物的远端部位[37,38]。外源MeJA有可能转移到茶叶中,在茶叶中触发一系列脂肪酸途径,导致更多JA和JA-结合体的生物合成。最后,JA连接可能触发整个植物的JA通路[39- - - - - -42]。
风味挥发性化合物生物合成途径对MeJA的响应
MeJA影响脂肪酸代谢途径
茉莉酸及其挥发性甲酯作为植物激素,参与植物对逆境的响应和发育过程。在MeJA处理过程中,脂肪酸途径首先响应,产生低分子挥发物。至少有13种酶参与导致挥发物形成的生物合成途径,包括脂氧合酶(LOX) (EC:1.13.11.58),乙酰辅酶a酰基转移酶1 (ACAA1) (EC:2.3.1.16),烯氧化物环化酶(EC:5.3.99.6)和酰基辅酶a氧化酶(EC:1.3.3.6)(补充文件)2:图S1)。
在植物中,脂肪酸以甘油三酯的形式储存;因此,脂质的酶氧化降解是在酰基水解酶的作用之前进行的,酰基水解酶将游离脂肪酸从酰基甘油中释放出来。饱和和不饱和挥发物C6和C9醛和醇是茶特有香气的重要组成部分,被描述为一种“清新的绿色”气味。短链醛类和醇类主要是植物在应对外界胁迫时产生的,在植物的防御策略中起着重要作用3.:图S2A) [43- - - - - -47]。从数量和质量上看,植物挥发物的大部分来源于饱和脂肪酸和不饱和脂肪酸。在茶树中,我们发现了许多脂肪酸衍生的直链醇、醛、酮、酸、酯和内酯,它们通过三个基本过程形成:α -氧化、β-氧化和脂氧合。根据表1C6- c9挥发性物质:2-乙氧基丁烷、1-乙氧基丁烷、环己烷、1-乙氧基戊烷、2-甲基癸烷和2,2-二甲基丙烷在meja诱导的茶叶中立即增加。此外,与未经meja处理的茶叶相比,还合成了大量的挥发物,如:2-乙基-1-己醇、2-甲基-癸烷、乙醛、2,4-二甲基-庚烷、4-甲基-辛烷、1-甲氧基-3-甲基-丁烷。结果如表d所示1提示这些挥发物在识别外源威胁后迅速释放到外界环境中。特别是2-己烯醛是脂肪酸途径合成的具有代表性的挥发性化合物,与对照相比,MeJA处理12 h后,2-己烯醛含量大幅增加;随后,24 h后恢复到正常水平。有趣的是,在这个过程中,2-己烯醛从茶叶中迅速释放出来,这表明它对非生物应激有重要影响。
综上所述,在受到MeJA处理的非生物胁迫的茶叶中,JA通路刺激上调了脂肪酸通路,导致C6- c9挥发物概要文件。
MeJA影响萜类化合物的生物合成途径
最多样化的天然产物家族是萜类化合物,有超过40,000种不同的结构。各种植物产生萜类化合物,包括挥发性和非挥发性。挥发性萜类化合物[C]5], monoterpenoids [C10],倍半萜类化合物[C15[C]20.])在植物和昆虫食草动物之间的相互作用中很重要,并且涉及外源诱导剂诱导的一般防御或应激反应(图2)。2和4) [48- - - - - -52]。尽管种类繁多,但所有萜类化合物都是由共同的构建单元二磷酸异戊烯基(IDP)及其异构体二磷酸二甲基烯基(DMADP)衍生而来。一般来说,两个5C构建块(DMADP和IDP)是通过两个独立的途径形成的:甲羟戊酸(MEV)途径和2c -甲基- d -赤藓糖醇-4-磷酸(MEP)途径。来自细胞质MEV途径的IDP和DMADP可以作为倍半萜(C15)和三萜(C30.),而质体MEP途径为单萜化合物的生物合成提供了前体(C10),二萜(C20.)和四萜(C40) [53- - - - - -55]。
RNA-Seq结果显示,MeJA处理后,与萜类主干生物合成途径相关的10个DEGs的表达上调(表1)3.).羟甲基戊二酰辅酶a还原酶(HMG-CoA) (EC:1.1.1.34) mRNA表达水平的提高促进了二磷酸异戊烯基的含量,MeJA_24h处理后,其表达水平提高了2.88倍。ispH (EC:1.17.1.2) mRNA的表达增加可促进IDP和DMADP的生物合成。高表达的GGPS (EC:2.5.1.1 2.5.1.10 2.5.1.29) mRNA在MeJA处理后增加了4.79倍,也可以促进GDP、GGDP和FDP的合成(附加文件)6:图S4,附加文件7:图S6)。
根据我们的代谢物结果,我们发现处理后的样品中上述风味香气化合物的含量高于未处理的样品(表1)1).尤其是对茶叶香气品质有显著贡献的芳樟醇和香叶醇,分别增加了1.91和2.63 μg/2 g。
GDP、GGDP和FDP的积累可以促进萜类化合物的生物合成(C10- c40).在meja处理的茶叶中,释放茶叶香气的重要水解酶萜烯合成酶(terpene synthase, TPS)的表达量与对照组无显著差异。芳樟醇和香叶醇由GDP、GGDP和FDP前体合成;因此,推测这些前体的含量是茶叶香气挥发物释放的限制因素。MeJA处理通过上调萜类主干生物合成途径相关基因的表达,显著增加了萜类生物合成。
MeJA影响苯丙素和一些氨基酸衍生挥发物的生物合成途径
支链氨基酸和芳香氨基酸降解产生的醛类和醇类是茶叶中含量丰富的挥发物;然而,它们的代谢途径几乎没有被分析过。氨基酸的分解代谢已被详细分析,并由氨基转移酶引发,形成2-酮酸,作为三个生化反应的底物:(i)氧化脱羧成羧酸;(ii)脱羧生成醛;(3)还原为2-羟基酸。苯丙氨酸衍生的化合物,如苯乙醛和2-苯乙醇,大量存在于各种水果中,如草莓、番茄和葡萄,以及茶中[17,56]。
苯丙素/苯类化合物和挥发性化合物,主要来源于苯丙氨酸,有助于许多植物物种的香气和气味,并在植物与环境的交流中发挥重要作用[57,58]。MeJA处理影响了苯丙素的生物合成途径。苯丙氨酸解氨酶(EC:4.3.1.24)的表达量增加了2.14倍,这可能直接导致肉桂酸的产生;这种前体的高含量保证了有足够的底物来生产苯甲醛和苯甲醇。β -葡萄糖苷酶在该途径中的高表达可导致香豆素含量的大幅增加(表2)3.;额外的文件5:图S3,附加文件8:图5)。此外,苯乙醇和水杨酸甲酯是植物中常见的花香成分[59]。在前12小时,这两种化合物大量合成,会影响茶叶的香气质量。
MeJA影响类胡萝卜素衍生挥发物的生物合成途径
类胡萝卜素衍生的挥发物也有助于茶的香气和品质。转录组结果显示,MeJA处理至少影响了7个参与类胡萝卜素途径的deg。与对照相比,meja处理24 h后,crtB、PDS和NCED的表达分别增加了2.76倍、3.45倍和6.16倍。这三种deg的表达增加会导致-胡萝卜素的生物合成上调(表2)1和3.).
使用RT-qPCR验证一些重要的deg分析
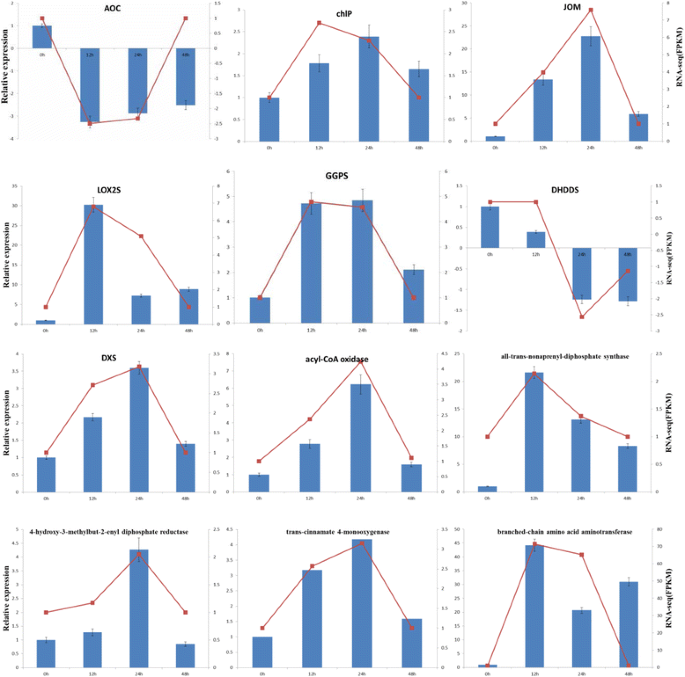
为了实验验证从转录组组装和RNA-Seq数据获得的基因表达谱中获得的这些重要差异表达基因的可靠性,我们共收集了11个参与α-亚麻酸降解生物合成的关键基因(LOX2S、AOC、JOM、酰基辅酶a氧化酶)和萜类主干生物合成的关键基因(chlP、GGPS、DHDDS、DXS、rt - qpcr选择了4-羟基-3-甲基-2-烯基二磷酸还原酶)和其他一些重要途径(全反式-壬戊烯基二磷酸合成酶、反式-肉桂酸4-单加氧酶和支链氨基酸转氨酶)。5).
结果表明,组装的转录本是可靠的,设计的引物对适合后续的表达实验。基于delta-delta Ct (2-ΔΔCt)方法,计算并比较所选单基因在四种不同组织中的相对表达量。大多数情况下,RT-qPCR检测到的这些基因的表达模式与RNA-Seq数据基本一致。总的来说,RT-qPCR实验证实,从组装的转录组中获得的单基因是可信的,RNA-Seq数据的基因表达谱应该是可信的。
结论
在本研究中,我们对meja诱导的转录变化进行了RNA-Seq分析,以确定参与茶叶次生代谢物生物合成,特别是挥发物生物合成的候选基因。在MeJA_12h, MeJA_24h和MeJA_48h样品中,我们总共获得了19245,18614,11890的温度。我们在KEEG通路中发现的deg除了与MeJA生物合成和植物胁迫反应相关的转录本外,大部分涉及次生代谢途径,特别是萜类和苯丙类途径。
一些MeJA上调转录本是茉莉酸生物合成调控的潜在候选者。其中茉莉酸o -甲基转移酶变化较大,为7.52倍。此外,还鉴定了c -酰基转移酶和氧化酶。这些数据还表明,MEP和MEV途径的MeJA响应性为多种萜烯代谢物的生物合成提供了5C个构建块。我们发现,1-脱氧-d -木醛糖-磷酸合成酶(DXS)、全反式壬戊烯基二磷酸合成酶、香叶基香叶基还原酶、香叶基二磷酸合成酶(II型)、羟甲基戊二酰辅酶a还原酶和4-羟基-3-甲基丁-2-烯基二磷酸还原酶的表达水平提高实际上改变了挥发性代谢物。然而,我们没有发现meja诱导的萜类合成酶的表达,如:芳樟醇合成酶、丁香酚合成酶和多酚氧化酶,因此,无法证实先前报道的meja诱导的茶叶中相应代谢物的生物合成。然而,我们确实首次发现了meja诱导的萜类主干生物合成相关基因的上调。
该研究将使我们更全面地了解茶叶对MeJA处理导致茶叶挥发性化合物变化的反应,这些结果也代表了茶叶挥发性生物合成的大量遗传资源,并将为该领域的基因组研究提供全新的见解。
方法
植物材料和MeJA处理
2岁金旋茶树品种(茶树),种植在中国农业科学院茶叶研究所温室内。样品在春季处理和制备。所有实验分三次进行,分别在3月、4月和5月进行。用8 L 0.25% (v/v) MeJA水溶液均匀喷洒2000株茶树,并将其预溶于25 ml乙醇中作为处理样品。分别在处理12 h、24 h和48 h(一芽带第二叶)后采摘新鲜茶叶。对照植株(CK)喷洒8l纯净水(预溶25ml乙醇),然后处理与MeJA处理样品相同的程序。采摘后的茶叶立即放入液氮中进行总RNA的分离。
为了最大限度地减少生物差异,每个样本在三个独立的等重生物重复中收集,随后合并进行测序和挥发性分析。RNA-seq分析2次,meja处理的样品标记为meja_12h-1、meja_24h-1、meja_48h-1;Meja_12h-2, meja_24h-2, meja_48h-2对照样品标记为ck-1、ck-2(对照样品为与meja处理茶叶同时采摘0、12、24、48 h 4个样品的混合物),进行3个重复的挥发性分析。
GC * GC-TOF / MS分析
样品制备
将2克(新鲜物质)的叶组织在液氮中粉碎,用Multi-Beads Shocker (2000 rpm, 15 s, Yasui Kikai Corporation,日本)粉碎,用含有42 nmol n-癸酸乙酯的5毫升乙醚作为内标,在室温下黑暗中提取17小时。提取物通过无水硫酸钠的短塞过滤。取滤液1微升进行Leco GC*GC- tof /MS分析。
GC条件
使用LECO Pegasus 4D GC*GC - tof /MS仪器(LECO Corporation, St. Joseph, MI, USA)和Agilent 6890 N (Agilent, PaloAlto, CA, USA)对这些茶叶样品的提取物进行分析。第一维(1D)色谱柱为DB-5MS柱,尺寸为30 m × 250 μm × 0.25 μm;第二维(2D)色谱柱为DB-17HT柱,尺寸为10 m × 100 μm × 0.10 μm (J&W Scientific, Folsom, CA, USA)。GC入口和传输线的温度分别设置为280℃和270℃。载气为恒压模式下99.9995%的高纯氦。塔头压力为200kPa。采用低温调制,调制周期5.0 s。采用Agilent 7683B自动进样器,进样量为1.0 μl,无分裂模式。第一柱的烘箱温度在60℃下保持3 min,然后上升到280℃(4℃/min),最后温度保持5 min。第二柱的初始烘箱温度在70℃下保持3 min,然后按照第一柱相同的程序进行。总分析时间为40.75 min。
女士的条件
离子源温度设定为220℃。MS范围为m/z 50 ~ 650,每秒采集50个光谱。溶剂延迟时间为150 s。探测器电压为1.67 kV,电子能量为- 70 eV。对C10-C20正构烷烃系列进行了分析,以确定其在一维分离中的保留指数。化合物的初步鉴定基于NIST05(美国国家标准与技术研究所,Gaithersburg, MD, USA)中标准质谱的相似性比较。
数据分析
原始数据采用LECO chrooftm工作站(版本4.44)进行预处理。提取信噪比(S/N)大于100的峰,利用提取的离子色谱图计算相应的峰面积。软件通过背景校正和反褶积,自动确定提取的各峰离子色谱图。两个重要参数,一维和二维峰宽,可能会影响峰的数量;分别设定为25秒(5次心脏切割× 5 PM时间)和0.4秒。该软件以65%的MS相似度执行峰合并,所有子峰的最小要求信噪比为6。这有助于将同一分析物的所有切片放在一起生成峰值表。
总RNA的分离和cDNA文库的构建
根据制造商的说明,使用RNAprep Pure Plant Kit (Tiangen bio-tek, China)分离每个样品的总RNA。使用Nanodrop ND-1000 (Nanodrop technologies, Wilmington, DE, USA)、凝胶电泳和Agilent 2100分析仪评估总RNA的数量和质量。采用28S:18S比大于1.5,吸光度260/280比在1.7 ~ 2.0之间的优质RNA进行文库构建和测序。
cDNA文库使用Illumina的试剂盒,按照制造商的协议(TruSeq RNA Sample Preparation Kits v2, Illumina, San Diego, CA, USA)构建。用附着聚A寡核苷酸的磁珠从总RNA中纯化mRNA。加入片段缓冲液将mRNA切割成短片段。利用随机六聚体引物从cDNA片段中生成首链cDNA,利用rase H和DNA聚合酶i转化为双链cDNA,利用Genomic Sample Prep Kit (Illumina)构建成对端文库。所需长度的片段使用QIAquick PCR提取试剂盒(QIAquick PCR纯化试剂盒(50),德国)纯化,末端修复并与测序适配器连接。使用AMPureXP珠去除不合适的片段,然后用PCR扩增构建测序文库。采用Pico绿染色和荧光分光光度法检查文库的完整性,并用Agilent 2100进行定量。然后以10nM的标准化浓度将多重DNA文库以等体积混合。文库在Illumina Miseq平台上测序(由上海个人生物技术有限公司提供)。中国上海)。
数据过滤和从头组装
所有样品的原始测序读数混合在一起,使用严格的过程和随后的从头组装进行过滤。去除污染接头,使用5 bp窗口从3 '到5 '筛选到质量评分(Q) <20的修剪碱基;最终长度小于50 bp的Reads被去除。这些序列中的所有碱基都被定义。从头组装转录组一步一步进行,Trinity软件执行(http://trinityrnaseq.github.io/).简而言之,这一过程主要有三个步骤:首先,我们称之为尺蠖,它将RNA-seq数据组装成独特的转录本序列,通常会为显性同种异构体生成全长转录本,但随后只报告选择性剪接转录本的独特部分。其次,蛹将尺蠖集群成簇,并为每个集群构建完整的de Bruijn图。每个簇代表一个给定基因(或一组共享相同序列的基因)的完整转录复杂性。然后,Chrysalis将整个读集划分到这些不相交的图中。最后,Butterfly可以并行处理单个图,跟踪图中读取和成对读取的路径,最终报告可选择剪接同种异构体的全长转录本,并梳理出与旁系基因对应的转录本。
每个样本的高质量读数被重新映射到转录本,以估计转录本的丰度。所有样本中没有读取的转录本被认为是错误的,并被删除。所有的笔录都被搜查过了拟南芥数据库,然后对NCBI非冗余(nr)数据库进行BLAST搜索,截止e值<1E-5。选择顶端命中的转录本作为统一基因。对于未与数据库中任何条目对齐的unigenes,使用GetORF软件预测其开放阅读帧(orf)并确定其序列方向,除参数“-find”设置为1外,使用默认设置。
基因注释与比较表达分析
利用NCBI非冗余(nr)数据库、同源蛋白群(COG)数据库、京都基因与基因组百科全书(KEGG)数据库和基因本体(GO)数据库对独特序列进行BLAST检索和注释,截止e值为1E-5。与nr数据库的序列相似度隐含功能注释,序列相似度最高且功能注释清晰的第一个序列的注释与对应的唯一序列相关联。在GO数据库中分析GO的功能标注,并利用GO数据库中命中的内部KEGG信息检索路径标注。
通过BLAST搜索人工识别主要风味挥发物生物合成相关基因。这些查询全部来自近亲物种,如果有的话,基因来自拟南芥芥(TAIR,www.arabidopsis.org),如果它们是未知的,则使用茶树.然后将茶叶中e值小于1E-5的所有结果作为查询再次搜索GenBank nr数据库,如果它们编码的蛋白质也被注释为参与挥发物生物合成的酶,则保留这些结果。
RT-qPCR在候选基因和基因表达水平验证中的应用
选择了11个可能参与一些重要次生代谢物生物合成途径的重要单基因进行qRT-PCR实验。采用primer primer 5.0软件(Premier Biosoft International)设计基因特异性引物对,采用改良的CTAB法分别从制备的茶叶样品中分离总RNA。用DNase I (Tiangen, China)处理后,使用SuperScript VILO cDNA合成试剂盒(Invitrogen)进行1微克RNA的反转录,按照制造商的指南。每个基因的标准曲线在多次稀释的cDNA中进行,然后使用Bio-Rad多色实时荧光定量PCR检测系统进行实时荧光定量PCR,所有反应条件为95°C 10 min, 95°C 15 s, 60°C 30 s, 40个循环。通过熔化曲线和琼脂糖凝胶电泳分析证实了PCR的特异性。选取18S RNA基因作为归一化内标,每个基因完成3次生物重复。采用delta-delta Ct (2-ΔΔCt)方法计算各单基因在不同组织中的相对表达量。所有数据归一化后均以均数±SD表示。
支持数据的可用性
支持本文结果的数据集可在NCBI SRA (Sequence read archive),http://www.ncbi.nlm.nih.gov/sra/)负责,编号为SRP060335。
改变历史
2017年8月9日
这篇文章的勘误表已经出版。
缩写
- 惩罚:
-
甲基jasmonate
- 议员/ DOXP:
-
Non-Mevalonate (2 c-methyl-d-erythritol-4-phosphate)途径
- dx:
-
1-deoxy-D-xylulose-phosphate合酶
- GC * GC-TOF /女士:
-
二维气相色谱仪质谱法
- 挥发性有机化合物的仪器:
-
挥发性有机成分
- 是:
-
茉莉酸
- 液态氧:
-
脂氧合酶
- ACAA1:
-
乙酰辅酶a酰基转移酶
- 国内流离失所者:
-
Isopentenyl二磷酸
- DMAPP:
-
Dimethylallyl二磷酸
- 兆电子伏:
-
甲羟戊酸途径
- β-:
-
Hydroxymethylglutaryl-CoA还原酶
- 国内生产总值:
-
香叶二磷酸
- 自由:
-
通过焦磷酸
- GGPP:
-
Geranylgeranyl焦磷酸
- ggp:
-
香叶基焦磷酸合酶
参考文献
Rawa R, Gulati A, Babu GDK, Acharya R, Kaul VK, Singh B.气相色谱-质谱法测定康格拉正统红茶挥发性成分。食品化学。2007;105:229-35。
李建军,李建军,李建军,等。植物性风味化合物的生物合成研究。植物学报,2008;34(4):562 - 562。
Gohain B, Borchetia S, Bhorali P, Agarwal N, Bhuyan LP, Rahman A,等。从分子的角度认识大吉岭茶的风味。植物化学学报,2012;38(6):597 - 597。
杨子银,杨淑娜,王直晴。茶叶中挥发性物质的研究进展。食品科学与技术,2013;53:585-99。
Misra RC, Maiti P, Chanotiya CS, Shanker K, Ghosh S.茉莉酸甲酯诱导的甜罗勒转录响应和五环三萜的生物合成。植物生理学报,2014,31(2):1028 - 1044。
Brendolise C, Yauk YK, Eberhard ED, Wang M, Chagne D, Andre C,等。一种独特的植物三萜合成酶,具有主要的α -淀粉生成活性,通过表征来自家苹果的氧化角鲨烯环化酶鉴定。[j] .中国科学:自然科学,2011;31(4):389 - 391。
黄磊,李军,叶辉,李超,王辉,刘斌,等。玫瑰花五环三萜生物合成途径的分子特征。足底。2012;236(5):1571 - 81。
Yu F, Thamm AM, Reed D, Villa-Ruano N, Quesada AL, Gloria EL,等。花楸叶表皮中参与熊果酸生物合成的amyrin合成酶的功能研究。植物化学。2013;91:122-7。
李建平,李建平。萜类化合物生物材料。植物学报,2008;34(4):656 - 669。
王晓明。植物次生代谢生物化学研究进展。植物学刊,2011;40.
Croteau R, Kutchan TM, Lewis NG。天然产物(次生代谢物)。植物生物化学与分子生物学。2000; 24:1250 - 319。
李建军。植物次生代谢的研究进展。植物化学。2007;68(22 - 24):2831 - 46所示。
Naoumkina MA, He X, Dixon RA。短叶紫花苜蓿次生代谢代谢重编程的激发子诱导转录因子。植物学报,2008;8(1):481 - 481。
Mishra S, Triptahi V, Singh S, Phukan UJ, Gupta MM, Shanker K,等。创面诱导苯异喹啉通路的转录调控及木瓜创面诱导PsWRKY转录因子的鉴定。科学通报,2013;8(1):52784。
高晓明,高建平,高建平,高建平。在拟南芥中,一个快速的伤口信号激活了生物活性茉莉酸盐的系统合成。植物学报,2009;59(6):974 - 986。
王晓明,王晓明,王晓明,等。茉莉素诱导植物次生代谢的转录机制研究。植物科学进展,2012;17(6):349-59。
张建军,崔永远。茉莉酸甲酯在植物中的重要作用。趋势研究。2003;19(7):409-13。
paul L, Inze D, Goossens A.茉莉素诱导基因的研究进展?植物科学进展,2009;14(2):87-91。
孙刚,杨勇,谢峰,温建峰,吴杰,Wilson IW,等。深度测序揭示了红豆杉(Taxus x medium)细胞转录组重编程为茉莉酸甲酯激发。科学通报,2013;8(4):e62865。
刘建军,刘建军,刘建军,等。乙烯在哈密瓜脂肪酯香气挥发物生物合成途径中的作用。[J] .生物医学工程学报,2009;32(1):1 - 6。
金海军,陈峰,王旭,Rajapakse NC。茉莉酸甲酯对甜罗勒次生代谢产物的影响。中国农业科学学报,2006;35(6):1227 - 1232。
de la Peña Moreno F, Blanch GP, Flores G, Ruiz del Castillo ML.采后茉莉酸甲酯处理对草莓挥发性成分和黄酮醇含量的影响。食品农业学报,2010;90(6):989-94。
石静,王丽,马云云,吕海平,陈志明,林志。茉莉酸甲酯处理茶树红茶香气变化研究。浙江大学学报(自然科学版);2014;15(4):313-21。
王晓明,王晓明,王晓明,等。茉莉酸zm结构域蛋白NaJAZd调控花中茉莉酸的表达及对花脱落的影响。科学通报,2013;8(2):57868。
阿亚拉-扎瓦拉JF,王世祥,王永勇,Gonzalez-Aguilar GA。茉莉酸甲酯配合乙醇处理可提高草莓果实的抗氧化能力、挥发性化合物和采后寿命。食品科学与技术,2005;22:731 - 8。
陈立荣,陈云杰,李春云,林天云。meja诱导的柴胡不定根转录变化。植物科学。2007;17(3):12 - 24。
邱东,潘鑫,Wilson IW,李飞,刘敏,滕伟,等。高通量测序技术揭示了类杉启动子茉莉酸甲酯调控中国红豆杉microRNA的表达。基因。2009;436(1 - 2):37-44。
高军,于鑫,马峰,李军。西兰花种子和芽中转录组和硫代葡萄糖苷代谢的RNA-seq分析。科学通报,2014;9(2):888 - 888。
Ketchuma REB, Horiguchi T,邱D, Williams RM, Croteaua RB。用早期前体喂养培养的红豆杉细胞揭示了类红豆杉生物合成途径的分支。植物化学。2007;68(3):335 - 41。
Bruinsma M, Posthumus MA, Mumm R, Mueller MJ, van Loon JJ, Dicke M.茉莉酸诱导的甘蓝挥发物对寄生蜂的引诱作用。[J] .生物医学工程学报,2009;60(9):2575-87。
Diallo AO, Agharbaoui Z, Badawi MA, Ali-Benali MA, Moheb A, Houde M,等。一个mvp突变体的转录组分析揭示了全球基因表达的重要变化以及茉莉酸甲酯在小麦春化和开花中的作用。实验学报,2014;65(9):2271-86。
John T, Christeller GI。a-亚麻酸浓度和不伤害本身是水稻叶片十八烷酸(氧脂)途径活性的关键调节因子。植物生理学报,2014;43(3):1177 - 1177。
Ziosi V, Bonghi C, Bregoli AM, Trainotti L, Biondi S, suthiwal S,等。茉莉酸诱导的转录变化提示桃果成熟综合征的负干扰。实验学报。2008;59(3):563-73。
Zubo YO, Yamburenko MV, Kusnetsov VV, Borner T.。茉莉酸甲酯、赤霉素和生长素对大麦叶绿体基因转录和转录积累的影响。植物生理学报,2011;32(1):1 - 4。
Shetty SM, Chandrashekar A, Venkatesh YP。茄子多酚氧化酶1基因启动子分析和转录谱分析揭示了茄子对外源茉莉酸甲酯和水杨酸的差异反应。植物生理学报,2012;32(1):1 - 7。
魏军,van Loon JJ, Gols R, Menzel TR,李宁,康磊,等。茉莉酸盐和水杨酸盐防御信号通路之间的相互串扰调节植物挥发性释放和草食动物的寄主选择行为。实验学报,2014;65(12):3289-98。
周超,张丽,段杰,Miki B,吴凯。拟南芥HISTONE DEACETYLASE19参与茉莉酸和乙烯病原应答信号通路的研究。植物学报,2005;17(4):1196-204。
Tytgat TO, Verhoeven KJ, Jansen JJ, Raaijmakers CE, Bakx-Schotman T, McIntyre LM,等。植物知道它的伤害:根和茎茉莉酸诱导在甘蓝中引起不同的反应。科学通报,2013;8(6):662 - 662。
冯荣,王勇,王超,Smith DL, Gross KC, Tian m。MeSA和MeJA提高甜椒(Capsicum annuum L.)替代氧化酶稳态转录本水平和抗寒性。植物科学。2004;16(6):711 - 9。
Fonseca S, Chini A, Hamberg M, Adie B, Porzel A, Kramell R,等。(+)-7-iso- jasmonoyl - l-异亮氨酸是一种内源性茉莉酸盐。生物化学学报,2009;5(5):344-50。
Hentrich M, botcher C, Duchting P, Cheng Y, Zhao Y, Berkowitz O,等。茉莉酸信号通路通过调节YUCCA8和YUCCA9基因表达与生长素稳态相关。植物科学学报,2013;39(4):444 - 444。
李建军,李建军,李建军,等。绿茶低温贮藏过程中气味化合物的特征及其生化形成。食品科学与技术,2014;38(4):387 - 398。
Moreno JE, Shyu C, Campos ML, Patel LC, Chung HS, Yao J,等。JAZ10可选剪接变体对茉莉酸盐信号的负反馈控制。植物生理学报,2013,32(2):1006-17。
Matthes MC, Bruce TJ, Ton J, Verrier PJ, Pickett JA, Napier JA。拟南芥顺式茉莉素诱导抗性转录组及其在间接防御中的作用。足底。2010;232(5):1163 - 80。
Rodriguez A, San Andres V, Cervera M, Redondo A, Alquezar B, Shimada T,等。橙子中萜烯的下调揭示了水果香气在介导昆虫、草食动物和病原体相互作用中的作用。植物生理学报,2011;36(2):793-802。
贾丹,魏立斌,闫华,王珍,等。棉花脂肪酸降解相关基因的克隆及对非生物胁迫的响应[J] .植物营养学报,2013;12(4):582 - 888。
沈杰,Tieman D, Jones JB, Taylor MG, Schmelz E, Huffaker A,等。13-脂氧合酶TomloxC是合成番茄C5风味挥发物所必需的酶。实验学报,2014;65(2):419-28。
Tholl D, Boland W, Hansel A, Loreto F, Rose US, Schnitzler JP。植物挥发性分析的实用方法。植物学报,2006;45(4):559 - 561。
Tikunov YM, de Vos RC, Gonzalez Paramas AM, Hall RD, Bovy AG。利用代谢数据融合方法发现了番茄果实中苯丙醇挥发物的差异糖缀合作用。植物生理学报,2010;32(1):55-70。
张建军,张建军,张建军,等。一种非靶向方法研究桃树果实的挥发性网络。科学通报,2012;7(6):e38992。
邢峰,梁松,王锐,王爱良,韦凤丽,张明文。灵芝三萜合成乙酰辅酶a乙酰转移酶基因的克隆、表征及功能分析。Mycoscience。2013;54:100-5。
Schmelz EA, Huffaker A, Sims JW, Christensen SA, Lu X, Okada K,等。单子叶萜类植物抗毒素的生物合成、激发及其作用。植物学报,2014;39(4):659 - 678。
王晓东,王晓东,王晓东,等。甲基赤藓糖醇磷酸途径在细菌和质体中合成类异戊二烯的研究进展。通过基因组学实现的代谢里程碑。植物生理学报,2002;13(3):1079-89。
Rohdich F, Hecht S, Gartner K, Adam P, Krieger C, Amslinger S,等。非甲羟戊酸萜生物合成途径的研究:IspH (LytB)蛋白的代谢作用。科学通报,2002;19(3):558 - 563。
类异戊二烯生物合成的不依赖于甲羟戊酸的甲基赤藓糖醇磷酸途径。应用化学学报。2003;25(5):357 - 357。
李建军,李建军,李建军,等。液-液微萃取法测定香精挥发性成分的研究进展。在甜瓜、桃子、葡萄、草莓和西红柿香气分析中的应用。中国农业科学学报,2005;33(3):591 - 591。
张建军,张建军。花香代谢途径的研究进展。见:Dudareva N, Pichersky E,编辑。花香生物学。博卡拉顿,佛罗里达州:CRC出版社;2006.55-8页。
李建军,李建军,李建军,等。植物香气的化学多样性研究。见:Dudareva N, Picher- sky E,编辑。花香生物学。博卡拉顿,佛罗里达州:CRC出版社;2006.27-52页。
杜达雷娃N, Andersson S, Orlova I, Gatto N, Reichelt M, Rhodes D,等。非甲羟戊酸途径支持单萜和倍半萜在金鱼龙花的形成。科学通报,2005;30(3):333 - 338。
资金
国家自然科学基金(NSFC)(31270734)、中国农业科研体系(CARS-23)专项基金和浙江省科技计划项目(2007C12G3020014)资助。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们没有竞争利益。
作者的贡献
构思设计实验:JS, CYM, ZL。实验:JS、CYM、DDQ、TY、HPL、ZMC、QHP、ZL。提供的试剂/材料/分析工具:DDQ, TY, HPL。撰写论文:JS, ZYM, ZL。所有作者都阅读并批准了最终的手稿。
作者的信息
不适用。
石江和马成英对这项工作也有同样的贡献。
附加文件
附加文件1:表S1。
过滤后原始日期的统计信息。(DOC 56kb)
附加文件2:图S1。
茶叶中氨基酸、转录本和单基因的分布。(DOCX 83kb)
附加文件3:图S2。
茶叶转录组的EggNOG分类。(DOCX 138kb)
附加文件4:表S2。
茶叶的途径分类。(DOC 58kb)
附加文件5:图S3。
MeJA处理对α-亚麻酸代谢的调控。(DOCX 34kb)
附加文件6:图S4。
MeJA处理对萜类主干生物合成代谢的调控。(docx52kb)
附加文件7:图S6。
植物挥发性和非挥发性胁迫代谢产物生物合成途径相互作用的简化方案。(DOCX 262kb)
附加文件8:图S5。
MeJA处理对苯丙类生物合成代谢的调控。(docx52kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非另有说明。
关于本文
引用本文
石杰,马,C,齐,D。et al。茉莉酸甲酯处理茶叶的转录响应和风味挥发物的生物合成。BMC Plant Biol15,233(2015)。https://doi.org/10.1186/s12870-015-0609-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-015-0609-z
关键字
- 芳樟醇
- 惩罚处理
- 挥发性代谢物
- 苯乙醇
- 脂肪酸途径