- 研究文章
- 开放获取
- 发表:
番茄组蛋白H2B单泛素化酶SlHUB1和SlHUB2有助于抗病灰葡萄孢通过调制SA和JA / ET介导的信号通路之间的平衡
BMC植物生物学体积15,商品编号:252(2015)
摘要
背景
已显示组蛋白H2B单突衔接途径在调节拟南芥中调节生长/发育和应力反应方面发挥关键作用。在本研究中,我们探讨了番茄组蛋白H2B单体宿主在防御反应中的参与灰葡萄孢通过拟南芥Athub1 / Athub2的Slhub1和Slhub2的功能分析。
方法
我们使用基于trv的基因沉默系统敲除表达水平SLHUB1.或SLHUB2.在番茄植株中,比较了沉默植株和对照植株侵染后的表型B. Cinerea和假单胞菌含油pv。番茄(Pst)DC3000型。蛋白质的生化特性和相互作用特性用酶联免疫吸附法进行了研究体外组蛋白单泛素化和酵母双杂交试验。采用实时荧光定量PCR (qRT-PCR)检测基因转录水平。
结果
番茄SlHUB1和SlHUB2具有H2B单泛素化E3连接酶活性体外和表达SLHUB1.和SLHUB2.是由病毒感染引起的B. Cinerea和太平洋标准时间DC3000和用水杨酸(SA)和1-氨基环丙烷-1-羧酸(ACC)处理。沉默的SLHUB1.或SLHUB2.在番茄植物中表现出增加的易感性B. Cinerea,而SLHUB1.导致了抗性的增加太平洋标准时间DC3000。SLMED21,介质复合亚基,与SLHUB1相互作用,但沉默SlMED21型没有影响疾病抵抗力B. Cinerea和太平洋标准时间DC3000型。这个SLHUB1.- - -SLHUB2.-沉默植物细胞壁变薄,但活性氧(ROS)积累增加,胼胝质沉积增加,苯丙素途径及ROS生成和清除系统相关基因表达改变。sa介导的信号通路基因表达显著上调,茉莉酸(JA)/乙烯(ET)介导的信号通路基因表达显著下调SLHUB1.- - -SLHUB2.-沉默植株感染后B. Cinerea.
结论
基于Vigs的功能分析表明,SLHUB1和SLHUB2都有助于抵抗B. Cinerea很可能是通过调节SA-和JA/ et介导的信号通路之间的平衡。
背景
为了抵御潜在病原体的攻击,植物进化到具有多层免疫反应[1.].第一层是通过植物细胞外表面的模式识别受体检测到病原体或微生物相关分子模式(PAMPs/MAMPs)而触发的,称为PTI (pamp触发免疫)[2.].为了规避PTI,病原体进化产生大量效应子,这些效应子被送入植物细胞抑制PTI并促进发病[2.,3.]. 作为一种应对措施,植物获得了额外的细胞内受体,称为抗性(R)蛋白,以识别病原体效应物,从而启动第二层防御,称为效应物触发免疫(ETI)[1.,4.–6.].一般而言,ETI在数量上强于PTI,且持续时间更长;然而,PTI和ETI的启动通常都需要大量基因的表达重编程[7.–10].近年来,广泛的遗传学和生化研究表明,泛素介导的蛋白质修饰在植物免疫应答中起着关键作用[8.,11–15].
泛素介导的蛋白质改性已经证明在增长,发育,衰老的调节中发挥关键作用[16–18]非生物应激反应[19,激素信号[20.–22,以及对病原体的免疫反应[23–25].泛素化可以分为两种主要类型,即单倍素化和多化,这取决于单遍突粘蛋白部分或聚合的泛素链是否附着在靶蛋白上[24].络泛素通常通过26s蛋白酶体导致靶蛋白的降解[26]而靶蛋白的单泛素化不会导致蛋白酶体的降解。相反,单泛素化是一种内源性信号[27].
组蛋白单泛素化和其他类型的翻译后修饰可以调节核小体/染色质结构和DNA可及性,从而调节不同的DNA依赖过程[28–32]. 单泛素化组蛋白H2B(H2Bub1)广泛存在于从酵母到人类和植物的真核生物中[29,30.,33,34].在拟南芥中,H2Bub1与分布在整个基因组的活性基因相关,并标记染色质区域,特别是与组蛋白H3三甲基化的K4 (H3K4me3)和/或H3K36me3结合[35].在早期光学发生期间,发现基因上调与H2bub1富集相关[36].最近的研究表明,组蛋白Monoubiquitination1(Athub1)和Athub2介导的组蛋白H2B在拟南芥生长和发育中的参与。已经证明Athub1和Athub2在相同的途径中起非制备,并在提前叶和根生长的调节中起重要作用[37,角质层组成[38,种子休眠[39]、营养和生殖发育[40,光形态发生36,41.]开花和花的过渡期[42.–44.].
最近的研究表明,组蛋白H2B单泛素化是一种重要的染色质修饰类型,在植物免疫应答中起调节作用。拟南芥的阿图布1突变植株表现出更强的易感性灰葡萄孢和十字花格孢,两种典型的坏死性真菌病原体,但没有改变对假单胞菌含油pv。番茄(太平洋标准时间) DC3000 [13]. AtHUB1和AtHUB2均直接介导组蛋白H2B的单泛素化SNC1., 这抑制npr1-1, CONSTITUTIVE1基因,和失去AtHUB1或AtHUB2功能降低上调SNC1.表达和抑制bon1自身免疫表型(45.].结果表明AtHUB1与茉莉酸无关,但乙烯(ET)反应和水杨酸(SA)参与了抗性阿图布1坏死营养真菌的突变体[13]. 此外,AtHUB1与拟南芥介体复合体的一个亚单位AtMED21相互作用,并通过RNAi介导抑制细胞凋亡AtMED21型表达也增加了对B. Cinerea和A.芸薹属提示AtMED21在AtHUB1介导的抗坏死性真菌免疫应答中发挥重要作用[13]. 最近的研究还表明,AtHUB1和AtHUB2参与了植物对干旱胁迫的防御反应大丽叶黄萎病毒素通过调制微管的动态[46.].
在本研究中,我们研究了番茄SlHUB1和SlHUB2(拟南芥AtHUB1和AtHUB2的同源系)在抗病过程中的作用B. Cinerea并探讨了可能的分子机制。我们发现两者的病毒诱导基因沉默(VIGS)SLHUB1.或SLHUB2.在番茄植株中导致了增加的敏感性B. Cinerea并导致细胞壁较薄,随着反应性氧物质(ROS)的积累增加,并围绕感染部位调用,表明两个SLHUB1和SLHUB2都是防御反应的正调节器B. Cinerea很可能是通过调节细胞壁和ROS平衡来实现的。虽然SlMED21是介体复合体的一个亚单位,它与SlHUB1相互作用,沉默了SlMED21型不影响对该病的抗性反应B. Cinerea表明SlHUB1和SlHUB2在防御反应中的作用机制不同B. Cinerea从拟南芥中的Athub1。
方法
植物生长,治疗和疾病测定
西红柿(茄属植物lycopersicum)的简历。本研究的大部分实验均采用苏红2003。MicroTom用于全株接种测定。种子在培养皿中潮湿的滤纸上刻痕3天,然后转移到珍珠岩:蛭石:植物灰(1:6:2)的混合物中。番茄植株在200 μE m的荧光灯下生长2.S−1.), 22 ~ 24℃,相对湿度60%,光照时间14小时/黑暗时间10小时。以4周龄番茄为研究对象,分别叶面喷施10 μM茉莉酸甲酯(MeJA)、100 μM 1-氨基环丙烷-1-羧酸(ACC)、100 μM SA和100 μM水作为对照,并在处理后指定时间采集样品进行基因表达分析。
接种B. Cinerea使用两种不同的方法,全植物接种和分离的叶片接种进行,如前所述[47.–49.]. 简要地,B. Cinerea在2×V8琼脂上生长(36%V8果汁,0.2%Caco3.和2%琼脂),收集孢子,用1%麦芽糖缓冲液重悬至2 × 105.孢子/mL为全株接种,1 × 105.孢子/mL用于离体叶片接种。孢子悬浮液的浓度在以前报道的研究中被广泛使用[47.–50.].在全株接种试验中,4周龄植株采用叶面喷施孢子悬浮液或缓冲液接种。在离体叶片接种试验中,将5 μL孢子悬浮液滴入叶片表面接种完全展开的叶片。接种后的叶片和植株通过在22°C的托盘或棕黄中覆盖塑料薄膜来保持湿度,以促进病害的发展。对接种后不同时间点的全株叶片进行接种试验,分析基因表达和表达在足底真菌生长。通过qRT-PCR检测真菌的生长情况B放线菌作为生长指示剂的基因[51.使用一对引物BcActin-F和BcActin-R(附加文件1.). 通过测定病斑大小来估计离体叶片接种试验中的病害。
疾病测定太平洋标准时间DC3000如前所述[13,48.,52.].太平洋标准时间DC3000在王的B液体培养基中生长过夜,重新悬浮于10毫米MgCl2.在OD600= 0.0002。将4周大的植株用细菌悬浮液真空渗透,然后放在高湿度的生长室内。为了测定细菌生长曲线,将6株单株的叶冲床在70%乙醇中表面灭菌10 s,然后在200 μL的10 mM MgCl中均质2.,在10 mM MgCl中稀释2.,置于含100 μg/mL利福平的KB琼脂平板上。28°C孵育3天后计数菌落。
克隆SLHUB1.,SLHUB2.和SlMED21型
使用SMARTer RACE cDNA扩增试剂盒(Clontech, Mountain View, CA, USA)进行cDNA末端快速扩增(RACE)实验,含巢式引物(附加文件)1.)获取5'结束序列信息。将种族产品通过T / A克隆到PMD19-T载体(Takara,大连,中国)并进行测序。基于测序结果,设计了对基因特异性引物(附加文件1.的全长cdnaSLHUB1.,SLHUB2.和SlMED21型克隆到载体pMD19-T中,分别得到质粒pMD19-SlHUB1、pMD19-SlHUB2和pMD19-SlMED21。这些质粒经测序确认,并用于以下所有实验。
载体的构建及VIGS测定
碎片大小为300-400 bpSLHUB1.,SLHUB2.和SlMED21型使用基因特异性引物扩增(附加文件1.),分别从pMD19-SlHUB1、pMD19-SlHUB2和pMD19-SlMED21中克隆到pTRV2载体[53.),收益率pTRV2 -SLHUB1.pTRV2 -SLHUB2.和pTRV2-SlMED21型.然后将这些结构引入根癌土壤杆菌使用GENE PULSER II电穿孔系统(Bio-Rad Laboratories, Hercules, CA, USA)对菌株GV3101进行电穿孔。杆菌携带pTRV2 -格斯(作为阴性对照),pTRV2-SLHUB1.pTRV2 -SLHUB2.或pTRV2 -SlMED21型在28°C连续振荡的yeah培养基(50 μg/mL利福平、50 μg/mL卡那霉素和25 μg/mL庆大霉素)中培养24 h。细胞离心后在渗透缓冲液(10 mM MgCl)中重悬2., 10 mM MES, 200 μM乙酰丁香酮,pH5.7)。杆菌携带pTRV2 -格斯pTRV2 -SLHUB1.pTRV2 -SLHUB2.或pTRV2 -SlMED21型与携带PTRV1的农杆菌以1:1的比例混合,并调整到OD600 = 1.5. 用1ml无针注射器将混合的农杆菌悬浮液渗入2周龄幼苗的背面。根据前面描述的方法,使用植物烯去饱和酶(PDS)基因作为番茄植株沉默的标记,研究了沉默方案的效率[53.].
SlHUB1和SlHUB2蛋白的纯化
编码序列SLHUB1.和SLHUB2.使用基因特异性引物扩增(附加文件1.),克隆到pET-32a (NovaGen, Madison, WI, USA)不我和Xho我的网站。同时,截断突变体SlHUB1Δ环和slhub2.Δ环在缺失环结构域的情况下,分别用基因特异性引物扩增SlHUB1和SlHUB21.)并克隆到PET-32A不我和Xho我的网站。SlHUB1 SlHUB2 SlHUB1Δ环和slhub2.Δ环融合蛋白表达大肠杆菌Rosetta细胞(Novagen,Madison,WI,USA)和1 mM异丙基-a-硫代半乳糖苷在30℃下诱导4-6 h。他的标签是SlHUB1,SlHUB2,SlHUB1Δ环和slhub2.Δ环融合蛋白采用Ni-NTA His-Bind Resin纯化,遵循制造商的协议(Merck BioSciences, Nottingham, UK)。纯化后的蛋白在重折叠缓冲液(50 mM Tris-HCl, 1 mM DTT, 0.5 M NaCl, 0.5% Triton-X-100, 1 mM PMSF, 4 M尿素,pH8.0)中透析,在4℃下透析2天。使用Bio-Rad蛋白检测试剂盒(Bio-Rad, Hercules, CA, USA)测定蛋白浓度。
体外组蛋白monoubiquitination化验
化验的体外按照前面的描述进行了单倍素化[37]. 简要地,The refolded proteins were incubated with 0.1 μg E1 (BostonBiochem, Cambridge, MA, USA), 0.2 μg Rad6 (BostonBiochem, Cambridge, MA, USA), 10 μg ubiquitin proteins (Merck BioSciences, Nottingham, UK) and 1 μg recombinant H2B (New England Biolabs, Ipswitch, MA, USA) in 30 μL buffer (5 mM MgCl2., 4毫米ATP, 50毫米Tris-HCl, 2毫米DTT)。37°C孵育3 h,加入SDS-PAGE缓冲液终止反应,12.5% SDS-PAGE分离。通过使用抗泛素抗体(Merck BioSciences, Nottingham, UK)进行免疫印迹检测信号,然后根据制造商的建议使用ECL试剂盒(Thermo Fisher Scientific, Waltham, MA, USA)进行化学发光检测。
酵母双杂化测定
根据制造商的说明(Clontech,Mountain View,CA,USA),使用Matchmaker Gold酵母双杂交系统检查SlHUB1或SlHUB2与SlMED21之间的相互作用。编码序列SLHUB1.,SLHUB2.和SlMED21型使用基因特异性引物扩增(附加文件1.)分别来自PMD19-SLHUB1,PMD19-SLHUB2和PMD19-SLMED21并将其克隆到PGADT7和PGBKT7载体中。将所得质粒转化到酵母菌株Y187和Y2HGOLD中并通过菌落PCR证实。转化的酵母在SD / TRP上栽培−和SD/Trp−伊斯−在30℃下培养3天,然后添加X-α-Gal(5-溴-4氯-3-吲哚-a-D-吡喃半乳糖苷)。根据转化酵母细胞在SD/Trp上的生长情况,评价了SlHUB1/SlHUB2与SlMED21的相互作用−伊斯−以pGBKT7-53和pGADT7-T共转化为阳性对照。
活性氧积累检测
检测H.2.O2.叶片组织中的超氧阴离子按照上述步骤进行处理[50.].用于H的染色2.O2.将样品浸入3,3-二氨基联苯胺(DAB)(Sigma-Aldrich,St.Louis,MO,USA)溶液(1mg/mL,pH3.8)中,并在室温下在黑暗中培养8h。对于超氧阴离子染色,将叶片浸入含有10 mM NaN的10 mM磷酸钾缓冲液(pH 7.5)中3.0.1 %硝基蓝四氮唑(NBT) (Sigma-Aldrich, St. Louis, MO, USA)在室温下放置1小时。为了去除叶绿素,将叶子放入95%的乙醇中,在水浴中煮沸,然后数次改变溶液。在50%的乙醇浓度和H2.O2.用数码相机拍下了树叶中的超氧阴离子。
胼胝质染色
如前所述进行胼胝质染色[54.].叶片在65°C酒精性乳酚溶液中清除30 min,转移到新鲜酒精性乳酚溶液中,室温孵育过夜。清除后的叶子在50%乙醇中短暂冲洗,然后是水,用0.01%苯胺蓝(Sigma-Aldrich, St. Louis, MO, USA)在150 mM磷酸钠缓冲液中染色45分钟,在黑暗中,然后用新鲜的磷酸钠缓冲液清洗。在徕卡CTR5000显微镜下观察叶子样本(徕卡微系统,中国香港),其激励滤光片为365±25 nm, 400 nm的二色镜和450 nm的长通发射滤光片,在深蓝色背景下观察到胼钙沉积为浅蓝色斑点[54.].照片显示感染部位周围的胼胝质沉积物是在类似的暴露条件下拍摄的。用ImageJ软件(http://rsb.info.nih.gov/ij/download.html.).对所有感染样本和对照组分别使用相同的阈值来定义荧光区和非荧光区。计算模拟接种对照上方感染组织中显示荧光的面积(以百分比计)。
透射电子显微镜
收集来自4周龄植物的叶子,并使用如前所述的微波方法进行固定[13]. 简要地,The samples were immersed in primary fixation buffer (2 % paraformaldehyde and 2.5 % glutaraldehyde in 0.1 M potassium phosphate buffer, pH 6.8) overnight, followed by a secondary fixation with reduced osmium (1 % OsO4.和1.5% K3.铁(CN)6.)后用0.1 M磷酸钾缓冲液洗涤。固定叶片样品用乙醇系列和环氧丙烷脱水,然后埋入Epon812树脂中。超薄切片分别用醋酸铀酰和碱性柠檬酸铅染色15分钟,在日立H-7650透射电子显微镜下观察(日立,东京,日本)。
实时定量RT (qRT)-PCR分析基因表达
使用TRIzol试剂(Invitrogen,中国上海)提取总RNA,并根据制造商的说明用无RNase DNA酶(TaKaRa,中国大连)处理以去除RNA样品中的任何基因组DNA。为了进行qRT-PCR分析,RNA样本用oligo(dT)反转录,使用带有gDNA擦除器的PrimeScript试剂盒(TaKaRa,大连,中国)。qRT-PCR在CFX96实时PCR检测系统(BioRad,Hercules,CA,USA)上使用SYBR Premix-Ex-TaqTM试剂盒(TaKaRa,大连,中国)进行。西红柿肌动蛋白1基因(糊精)作为qRT-PCR数据标准化的内标。进行了三次独立的生物复制。相对表达水平用2-ΔCT方法。用于QRT-PCR的引物在附加文件中列出1..
统计分析
所有实验均为3个重复,数据以3个独立实验的平均值±SD表示。根据学生的资料进行统计分析T-检验与概率值P< 0.05为显著性差异。
结果
番茄SlHUB1和SlHUB2的鉴定
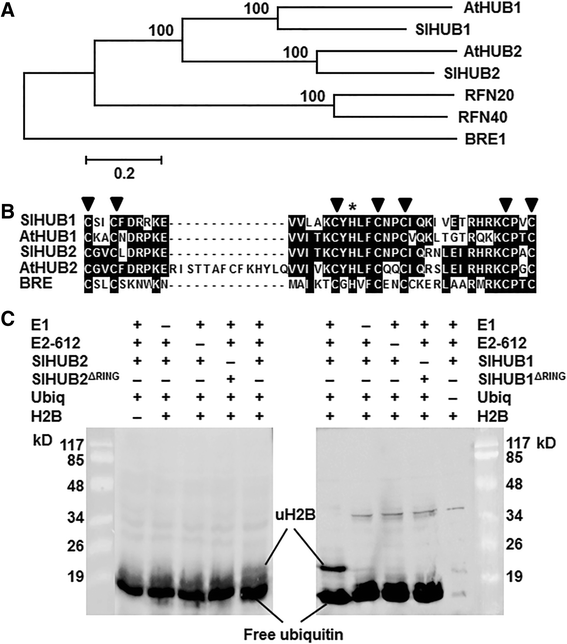
为了鉴定拟南芥AtHUB1和AtHUB2在番茄中的同源基因,我们以AtHUB1和AtHUB2蛋白的氨基酸序列为查询对象,对番茄基因组数据库(ITAG release 2.31)进行了BlastP搜索,获得了三个预测位点(Solyc11g013370、Solyc11g013370、Solyc11g013370、Solyc11g013370、Solyc11g013370、Solyc01g006030和Solyc01g006040)具有高度的序列相似性或同一性。进一步分析确定了位点Solyc11g013370SLHUB1.而预测位点Solyc01g006030和Solyc01g006040均为假定位点SLHUB2..的全长cdnaSLHUB1.和SLHUB2.克隆并测序证实。SLHUB1.编码847个氨基酸的蛋白质SLHUB2.编码883个氨基酸的蛋白质。序列比对和系统进化树分析表明,番茄SlHUB1和SlHUB2与酵母BRE1的同源性为56 ~ 76% [55.]人RNF20和RNF40[56.]和拟南芥AtHUB1和AtHUB2 [37] (图。1),在c端均包含一个保守的C3HC4环结构域(SlHUB1位于795-833 aa, SlHUB2位于831-869 aa)(图1)。1 b).因此,克隆SLHUB1.和SLHUB2.是拟南芥中的AtHUB1和番茄中的AtHUB2同源物。
SlHUB1和SlHUB2是功能性组蛋白H2B单泛素化E3连接酶。A.SlHUB1和SlHUB2与酵母BRE的系统发育树分析(GenBank登录号:Q07457)、拟南芥AtHUB1 (Q8RXD6)和AtHUB2 (NP_564680)、人类RFN20 (NP_062538)和RFN40 (NP_001273501)。用ClustalX 1.81程序进行序列比对,用MEGA 6.06构建系统发育树并可视化。BSlHUB1和SlHUB2 RING结构域与拟南芥AtHUB1和AtHUB2以及酵母BRE的RING结构域的氨基酸比对。填充三角形表示保守的半胱氨酸残基,星号表示保守的组氨酸残基。C重组SlHUB1(右)和SlHUB2(左)蛋白具有组蛋白H2B单泛素化活性体外. 重组SlHUB1和SlHUB2及其突变体SlHUB1Δ环和slhub2.Δ环分别与E1酶、E2酶(Rad6)、H2B底物和泛素孵育,SDS-PAGE分离,使用抗泛素抗体Western blotting检测。H2B、E1、E2或泛素缺失均为阴性对照
SlHUB1和SlHUB2具有组蛋白H2B单泛素化活性体外
为了确定SlHUB1和SlHUB2是否具有组蛋白H2B单泛素化E3连接酶活性SLHUB1.和SLHUB2.原核表达并纯化重组His标记的SlHUB1和SlHUB2蛋白。为了研究环结构域在E3连接酶活性中的重要性,我们对SlHUB1和SlHUB2的截短突变体,SlHUB1Δ环和slhub2.Δ环,其中,删除了RING域,也生成了(图。1 c). 在组蛋白2B、E1酶、E2(Rad6)酶和泛素存在下[37,57.),这两个重组SlHUB1和SlHUB2 ubiquitinate组蛋白2 b,所显示的两个乐队~ 8 Kd ~ 23 Kd,负责免费泛素和ubiquitinated组蛋白,分别反应ubiquitin-specific抗体,而只有一个~ 8 Kd绑定,指自由泛素的反应,在不存在E1、E2或SlHUB1或SlHUB2的情况下检测(图。1 c).截断的突变体,SLHUB1Δ环和slhub2.Δ环,未在反应中显示E3连接酶活性(图。1 c). 这些结果表明,SlHUB1和SlHUB2都是功能性组蛋白H2B单泛素化E3连接酶,并且SlHUB1和SlHUB2的环结构域对其组蛋白H2B单泛素化活性至关重要。
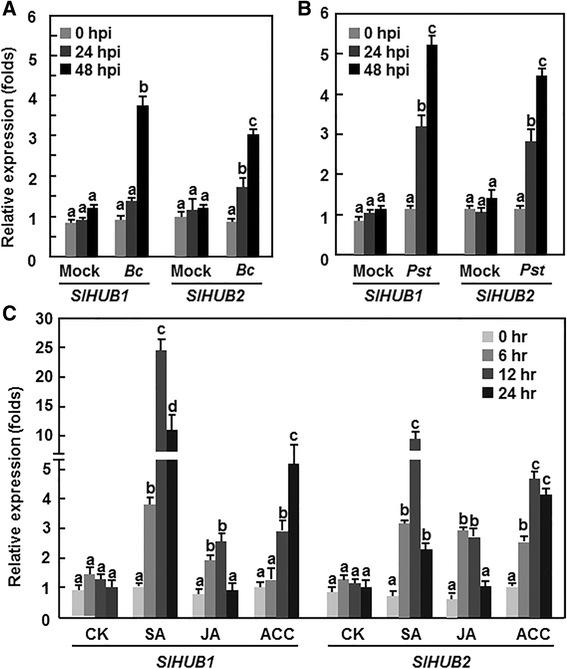
表达SLHUB1.和SLHUB2.是由病原体和激素引起的
探讨可能的作用SLHUB1.和SLHUB2.在番茄抗病性方面,我们首先分析了SLHUB1.和SLHUB2.对病原体和防御信号相关激素的反应。的表达SLHUB1.和SLHUB2.在试验期间,模拟接种的植株保持不变(图。2).但是,表达水平SLHUB1.和SLHUB2.增加后B. Cinerea在接种48h后,与模拟接种的植株相比,增加了约4倍(图。2).相似的表达动力学SLHUB1.和SLHUB2.在接种了太平洋标准时间DC3000,但诱导速度远快于对照组B. Cinerea接种植物(图。2 b).表达水平SLHUB1.和SLHUB2.接种后24小时显著增加,48小时进一步增加,比模拟接种植株增加了约3倍,但在接种后24小时增加了约3倍SLHUB1.和SLHUB2.48h时,在模拟接种的植株中也观察到表达(图。2 b).的表达SLHUB1.和SLHUB2.被不同水平的防御信号相关激素诱导。SA显著诱导SLHUB1.和SLHUB2.,表现出约10倍和6.5倍的增长SLHUB1.和SLHUB2.处理后12 h,分别高于对照植株(图1)。2摄氏度).的表达水平SLHUB1.在acc处理的植物中,在对照植物中治疗后24小时显示4.2倍,而表达水平SLHUB2.在ACC处理的植株中,在处理后的12和24小时内,其表达量显著增加,分别是对照植株的2.1倍和3.2倍(图。2摄氏度). 然而,在表达水平上没有明显的诱导作用SLHUB1.和SLHUB2.的表达量,并与对照植株的表达量进行比较(图。2摄氏度). 这些结果表明SLHUB1.和SLHUB2.可以由B. Cinerea和太平洋标准时间DC3000和通过防御信令相关的激素,如SA,JA和ACC。
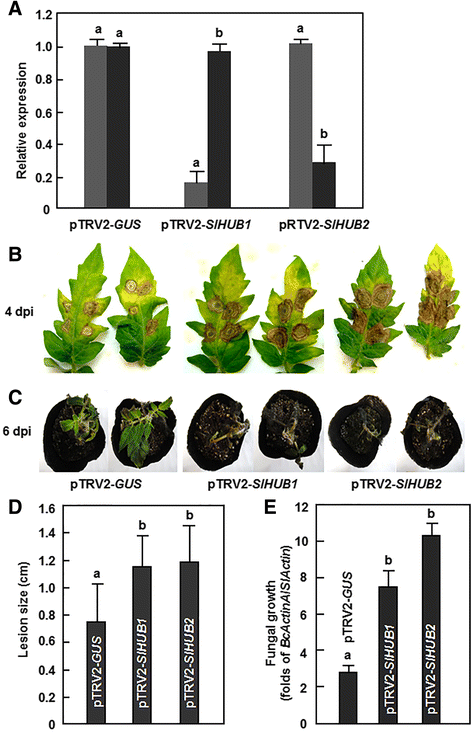
沉默SLHUB1.或SLHUB2.增加了对B. Cinerea
探索SLHUB1.和SLHUB2.在抗病方面B. Cinerea我们利用TRV基因沉默系统来降低基因的表达水平SLHUB1.或SLHUB2.在番茄植株中,比较了沉默植株和对照植株侵染后的表型B. Cinerea.在我们的标准VIGS实验中,根据pTRV-中出现的漂白表型判断,VIGS程序效率被确认为> 80%PDS-渗透植物(附加文件2.).采用标准的VIGS程序,通过比较pTRV2-的转录本水平来估计沉默效率SLHUB1.或者pTRV2SLHUB2.-渗透植物与那些在pTRV2-格斯- 分别为植物,分别为约80%SLHUB1.〜70%SLHUB2.(图。3A). 重要的是SLHUB2.和SLHUB1.在pTRV2中-SLHUB1.-和pTRV2-SLHUB2.分别与ptrv2-的植物分别与那些相当格斯-渗透植物,表示沉默SLHUB1.或SLHUB2.不影响另一个的表达。只有当同一批的VIGS程序效率>80%且靶基因(SlHUB1或SlHUB2)的沉默效率>70%时,pTRV才能被抑制-SLHUB1.-或pTRV-SLHUB2.-所有试验均在VIGS渗透后4周进行。
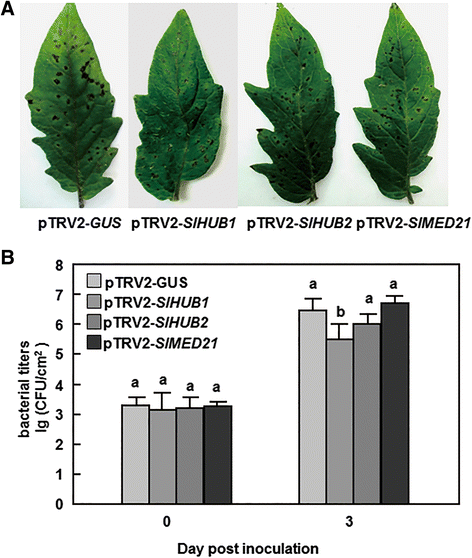
沉默SLHUB1.和SLHUB2.导致了对B. Cinerea.用携带pTRV2的农杆菌对2周龄幼苗进行渗透-SLHUB1.pTRV2 -SLHUB2.或pTRV2 -格斯在渗透渗透后4周进行构建体和疾病测定。A.沉默的效率SLHUB1.和SLHUB2.在VIGS建设渗透工厂。转录本水平SLHUB1.或SLHUB2.pTRV2 -SLHUB1.或pTRV2 -SLHUB2.-用qRT-PCR方法对入侵植株进行分析,并与pTRV2进行比较-格斯-infiltrated植物,设置为1。B,D疾病表型(B)病灶大小(D)在pTRV2的离体叶片上-SLHUB1.pTRV2 -SLHUB2.或pTRV2 -格斯滴下接种后的过滤植物B. Cinerea分别是。接种后4天(dpi)拍照。在每个实验中,在4 dpi和至少30片叶子上测量损伤大小。C,E疾病表型(C)和真菌生长(E)pTRV2的-SLHUB1.pTRV2 -SLHUB2.或pTRV2 -格斯植株浸润后喷洒用B. Cinerea分别是。照片拍摄于6 dpi。生长B植物灰霉病通过分析转录水平在3 dpi下测量Bcactina基因与糊精基因作为内部控制。提供的数据是手段 ± 三个独立实验的标准差和列上不同的字母表明,在P < 0.05水平
我们首先研究了SlHUB1或SlHUB2沉默是否影响抗病能力B. Cinerea在西红柿里。首先用从PTRV2-收集的完全膨胀的叶片进行分离的叶片测定。SLHUB1.-和pTRV2-SLHUB2.渗透到植物。在我们的疾病分析条件下,典型的疾病症状,如坏死病变,观察到从pTRV2-叶SLHUB1.、pTRV2SLHUB2.-和pTRV2-格斯-被渗透的植物2 dpi然而,从pTRV2-叶片病变SLHUB1.或者pTRV2SLHUB2.-渗入的植株迅速扩展,比pTRV2的植株大-格斯-渗透植物(图。3B.).在4 dpi时,从pTRV2-叶的病变大小SLHUB1.-和pTRV2-SLHUB2.-渗入植物的平均直径分别为11.5mm和12.1mm,比pTRV增加了66.7%和75.4%-格斯-浸润植物(平均6.9 mm)(图。3d). 此外,还进行了全株接种试验,以确认从离体叶片接种试验获得的结果。如图。3C,ptrv2-SLHUB1.或者pTRV2SLHUB2.渗透了简历。与pTRV2-相比,MicroTom植株遭受的病害更为严重格斯渗透了简历。在接种6天后,约90%的pTRV2-SLHUB1.或者pTRV2SLHUB2.pTRV2-格斯-渗入的植物仍然活着。量化的在足底真菌生长的qRT-PCR分析B. Cinerea Bcactina.基因作为增长率的指示表明,由折叠判断的真菌生物量Bcactina/糊精在pTRV2中-SLHUB1.-和pTRV2-SLHUB2.-渗入植株显著高于pTRV2-格斯- 共热植物,分别导致2.3和3.4倍(图。3E).总的来说,这些数据表明,两者中任何一个的沉默SLHUB1.或SLHUB2.恢复番茄中的抗病抗性B. Cinerea从而证明SLHUB1.和SLHUB2.是需要抵抗的吗B. Cinerea在西红柿里。
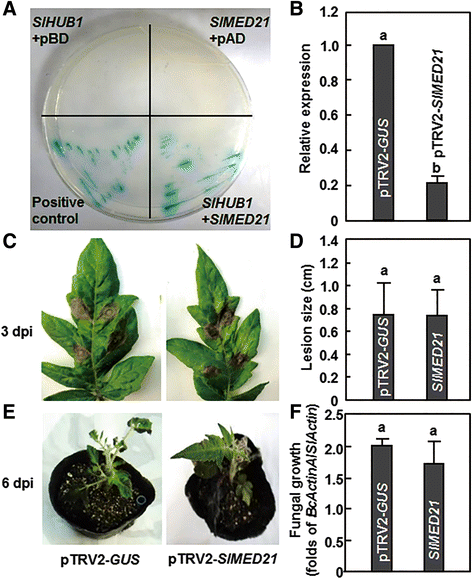
Slmed21与Slhub1互动但沉默SlMED21型有没有影响到抵抗力B. Cinerea
在拟南芥中,AtMED21被证明与AtHUB1有强烈的相互作用,并在对抗坏死营养真菌病原体的防御反应中发挥作用[13]. 因此我们克隆了SlMED21型,拟南芥的番茄同源物AtMED21型基因(附加文件)3.),并检查番茄SLMED21还可以与SLHUB1或SLHUB2相互作用,从而在抵抗力中发挥作用B. Cinerea.在我们的酵母双杂交实验中,当诱饵载体中的SlHUB1 (pBD-SlHUB1)和猎物载体中的SlMED21 (padd -SlMED21)在酵母中共表达时,SlMED21和SlHUB1之间存在很强的相互作用。当SlHUB1和SlMED21与pAD或pBD空载体共表达时,SlHUB1和SlMED21均不能激活报告基因的转录,说明SlHUB1和SlMED21不具有自激活活性。此外,SlHUB2和SlMED21之间没有明显的相互作用(数据未显示)。接下来,我们研究了SlMED21是否在抗药中起作用B. Cinerea通过基于vigs的功能分析。的静音效率SlMED21型在我们的实验条件下估计约为80%(图。4B.),通过qRT-PCR分析SlMED21型在pTRV2中-SlMED21型与pTRV2-渗透植株相比,pTRV2-渗透植株具有较强的渗透性格斯渗透到植物。从ptrv2-叶片的疾病严重程度SlMED21型-渗入的植物与pTRV2相当-格斯-渗透植物(图。4C和E).pTRV2-叶片的病变大小和真菌生长速度SlMED21型-营养不良的植株也和pTRV2的叶片相似-格斯-渗透植物(图。4D.和F).这些结果表明,沉默SlMED21型不影响植株对番茄的抗性B. Cinerea,尽管SLMED21与SLHUB1相互作用。
SlMED21与SlHUB1相互作用,但不影响耐药B. Cinerea.A.在酵母双杂交试验中,SlMED21与SlHUB1相互作用。携带SlMED21型在猎物向量和SLHUB1.在选择性培养基(SD/Leu−Trp−阿德−伊斯−)和添加X-α-Gal后的β-半乳糖苷酶活性。同时检测阳性对照pGADT7-T + pGBKT7-53及空载体与SlHUB1/SlMED21的其他适应症组合。B沉默的效率SlMED21型在VIGS建设渗透工厂。沉默效率通过比较SlMED21型pTRV2 -SlMED21型在pTRV2-格斯-浸润植物,设为1。C离体叶片3 dpi时的病害症状。D在6dpi时,全株的疾病表型分别为。E在3 dpi的分离的叶片接种测定中的选定叶子上的病变尺寸。在每个实验中最少30个叶片测量病变尺寸。F生长B. Cinerea接种植株从全株接种试验在3 dpi。真菌的相对生长表现为转录水平的折叠肌动蛋白相比糊精.所提供的数据为三个独立实验的平均值±SD,列上不同字母表示差异显著P < 0.05水平
Pst DC3000的抗性受SlHUB1沉默的影响,而SlHUB2和SlMED21沉默的影响较小
探索可能的参与SLHUB1.,SLHUB2.和SlMED21型我们进一步研究了SlHUB1、SlHUB2或SlMED21的沉默是否会影响对其他病原菌的抗性太平洋标准时间DC3000型。在我们的实验中,在接种pTRV2的叶片中观察到坏死损伤-SLHUB1.、pTRV2SLHUB2.、pTRV2SlMED21型-和pTRV2-格斯渗透到植物。然而,pTRV2-叶片上的病变SLHUB1.与pTRV2-相比,pTRV2-的渗透植株更少、更小格斯-而pTRV2与对照无显著差异-SLHUB2.、pTRV2SlMED21型-和pTRV2-格斯-渗透植株经真空接种后太平洋标准时间DC3000(图。5A).在3 dpi时,接种的pTRV2-叶片中的细菌种群数量SLHUB1.-渗透植物(5.49 × 105.cfu /厘米2.)比pTRV2低10倍-格斯-infiltrated植物(6.45×106.cfu /厘米2.),而pTRV2-接种叶片的细菌生长无显著差异SLHUB2.- (6.01 × 106.cfu /厘米2.),pTRV2型-SlMED21型- (6.69 × 106.cfu /厘米2.)和ptrv2-格斯-渗透植物(图。4B.).这些结果表明,沉默SLHUB1.导致了抗性的增加太平洋标准时间DC3000,但沉默SLHUB2.或SlMED21型有没有影响抵抗太平洋标准时间DC3000,意味着SlHUB1参与了防御反应太平洋标准时间DC3000。
沉默SLHUB1.导致抵抗力增强P. inringae.pv。番茄DC3000型。用携带pTRV2的农杆菌对2周龄幼苗进行渗透-SLHUB1.pTRV2 -SLHUB2.pTRV2 -SlMED21型或pTRV2 -格斯采用真空渗滤法进行疾病分析太平洋标准时间DC3000在VIGS浸润后4周。A.疾病的典型症状太平洋标准时间DC3000 4 dpi。BpTRV2-接种叶片中的细菌生长SLHUB1.、pTRV2SLHUB2.、pTRV2SlMED21型或者pTRV2格斯-渗入的植物。在接种后第0天和第4天采集叶片样品并测定细菌生长。提供的数据是手段 ± 三个独立实验的标准差和列上不同的字母表明,在P < 0.05水平
沉默SLHUB1.和SLHUB2.通过调节苯丙素途径导致细胞壁厚度减少
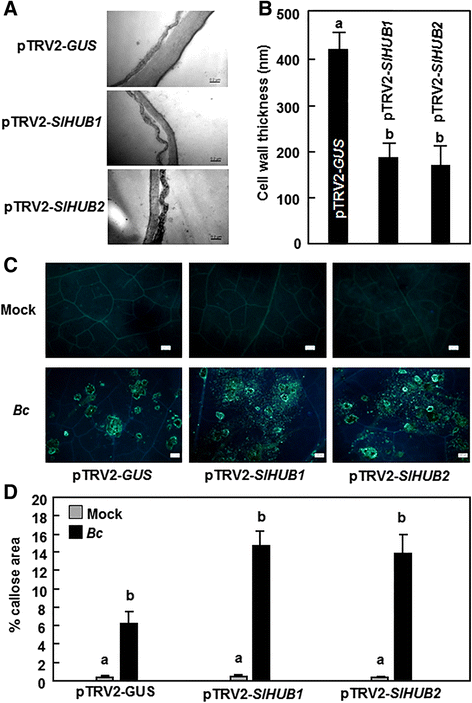
此前发现,拟南芥AtHUB1的突变参与了细胞壁厚度和胼胝质沉积的调控[13].因此,我们通过研究SlHUB1-和SlHUB2沉默植物叶片细胞壁和胼叶沉积的差异,研究了SlHUB1和SlHUB2在番茄中的作用机制是否与拟南芥中的AtHUB1类似。透射电镜观察表明,pTRV2-在叶片细胞壁中存在SLHUB1.或者pTRV2SLHUB2.-渗透植株明显比pTRV2-渗透植株更薄格斯-渗透植物(图。6A).PTRV2的叶片中的细胞壁的厚度 -SLHUB1.或者pTRV2SLHUB2.-结果表明,与pTRV2的421nm相比,经渗透处理后的植株分别减少了55.8%和59.9%,为185.6nm和168.9nm-格斯-渗透植物(图。6B.).我们比较了pTRV2-中胼胝质的沉积SLHUB1.-和pTRV2-SLHUB2.-渗透到了植物体内-格斯-感染前和感染后渗入植物B. Cinerea.模拟接种植株无明显胼胝质沉积,pTRV2-之间胼胝质沉积无差异SLHUB1.、pTRV2SLHUB2.-和pTRV2-格斯-渗透植物(图。6c和d). 感染B. Cinerea显着诱导PTRV2围绕感染网站周围的细胞中的胼沉积SLHUB1.、pTRV2SLHUB2.-和pTRV2-格斯-渗透植物(图。6C.和D);然而,在pTRV2-中有胼胝质的沉积SLHUB1.-和pTRV2-SLHUB2.-浸润的植株比pTRV2-浸润的植株明显格斯-渗透植物(图。6c和d). 这些数据表明SLHUB1.或SLHUB2.导致细胞壁变薄,但引起更多胼胝质的沉积B. Cinerea.
沉默SLHUB1.和SLHUB2.细胞壁厚度减小,胼胝质积累增加B. Cinerea感染.用携带pTRV2的农杆菌对2周龄幼苗进行渗透-SLHUB1.pTRV2 -SLHUB2.pTRV2 -SlMED21型或pTRV2 -格斯构造。A.,B显示细胞壁的代表性温度照片(A.)和细胞壁厚度(B)在pTRV2-SlHUB1-、pTRV2-SlHUB2-或ptrv2 - gus浸润植物中。在VIGS渗透后4周采集叶片样品进行透射电镜分析。bar = 200 nm。数据代表20个样本的平均值±标准差。C有硬块的积累。接种VIGS结构渗透植株B. Cinerea接种后0 h和24 h分别采集6株单株至少6片叶片进行胼胝质积累检测。上面一行表示模拟接种的叶片中胼胝质染色,而下面一行表示中胼胝质染色B. Cinerea- 植物的叶子。条=100μm。呼叫数据显示在(D)使用图像分析程序进行量化,如中所述方法
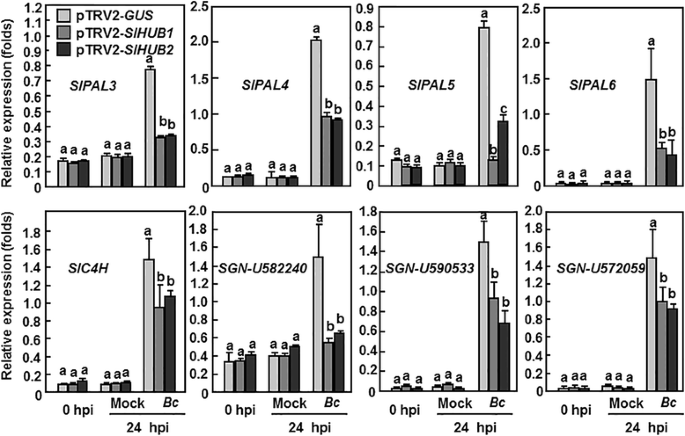
众所周知,苯丙素途径参与了细胞壁生物合成[58.].因此,我们分析并比较了苯丙氨酸氨酶(PAL)编码基因的表达变化[59.],肉桂酸4-羟化酶(C4H)[60.]肉桂酰醇脱氢酶(CAD)在pTRV2-SLHUB1.-和pTRV2-SLHUB2.-渗透到了植物体内-格斯-感染前和感染后渗入植物B. Cinerea. 在健康(接种后0小时)和模拟接种植株(接种后24小时)中,检测到SlPALs(SlPAL3,SlPAL4和SlPAL6),SLC4H.和三个SlCAD(SGN-U582240,SGN-U590533,SGN-U572059)pTRV2基因具有可比性-SLHUB1.、pTRV2SLHUB2.和pTRV2 -格斯-渗透植物(图。7.). 值得注意的是SlPAL5在pTRV2中-SLHUB1.-和pTRV2-SLHUB2.与pTRV2-相比,pTRV2-的渗透植株显著降低了60 - 84%格斯- 无菌没有感染的植物B. Cinerea(图。7.).后B. Cinerea感染,表达水平SlPALs,SLC4H.和Slcads.在pTRV2中明显上调-格斯-浸润植株与模拟接种植株相比;然而,B. Cinerea-诱导表达SlPALs,SLC4H.和Slcads.在pTRV2中显著降低了40–80%-SLHUB1.-和pTRV2-SLHUB2.与pTRV2-的渗透植株进行了比较格斯-渗透植物(图。7.). 这些数据表明SLHUB1.或SLHUB2.衰减B. Cinerea在苯丙素途径中诱导一系列基因的表达。
沉默SLHUB1.和SLHUB2.增加活性氧生成B. Cinerea感染
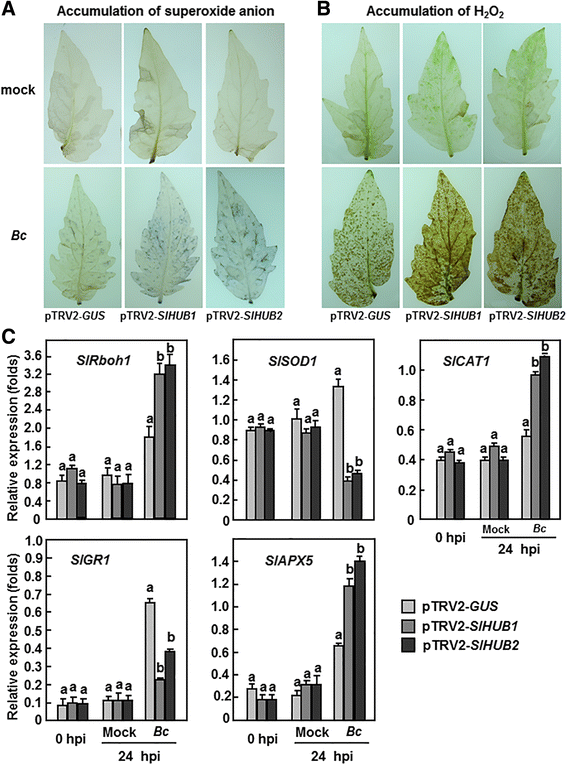
考虑到反应性氧物种(ROS)已参与植物的易感反应,从诸如的病养真菌病原体感染B. Cinerea[61.,我们还检查了是否沉默SLHUB1.或SLHUB2.侵染番茄对ROS平衡的影响B. Cinerea. 健康植株(接种后0h)和模拟植株(接种后24h)的h积累量无显著差异2.O2.在pTRV叶片中检测到超氧阴离子-SLHUB1.-,右心室-SLHUB2.和pTRV格斯-渗透植物(图。8和B),表示沉默SLHUB1.或SLHUB2.不影响番茄ROS的积累。相反,接种后24小时B. Cinerea超氧阴离子和H2.O2.在pTRV2-的叶子中SLHUB1.、pTRV2SLHUB2.和pTRV2 -格斯-与模拟接种的植株相比,渗入的植株明显增加(图。8和B).但是,在PTRV2中累积ROS-SLHUB1.-和pTRV2-SLHUB2.-浸润的植株比pTRV2-浸润的植株明显格斯-渗透植物(图。8和B).我们进一步比较了ROS生成和清除系统所涉及的基因的表达变化。ROS生成相关基因的表达水平,SlRboh1[62.,63.]和一些活性氧清除相关的基因,如SlSOD1(超氧化物歧化酶),SlCAT1(过氧化氢酶),SlGR1(谷胱甘肽还原酶)和拍打x5(抗坏血酸过氧化物酶)在pTRV2中具有可比性-SLHUB1.、pTRV2SLHUB2.和pTRV2 -格斯-渗透的健康和模拟接种的植株(图。8和B).在PTRV2中观察到这些基因的两个不同的表达模式SLHUB1.、pTRV2SLHUB2.和pTRV2 -格斯-渗透植株接种后B. Cinerea(图。8和B).在接种24 h后B. Cinerea的表达水平SlRboh1,SlCAT1和拍打x5明显增加75-120%,而表达水平SlSOD1和SlGR1pTRV2-SLHUB1.-和pTRV2-SLHUB2.与ptrv2中的相应水平相比, - 过滤植物格斯-渗透植物(图。8和B). 这些数据表明SLHUB1.或SLHUB2.可能通过影响机体ROS生成和清除系统相关基因的表达,促进ROS的生成和积累B. Cinerea感染。
沉默SLHUB1.和SLHUB2.导致ROS的积累,并影响ROS生成和清除相关基因的表达B. Cinerea.用携带pTRV2的农杆菌对2周龄幼苗进行渗透-SLHUB1.pTRV2 -SLHUB2.或pTRV2 -格斯构建和接种孢子悬浮液B. Cinerea或在VIGS浸润4周后以缓冲液作为模拟接种控制。接种0(对照)和24 h后收集6株单株至少6片叶片。A.积累超氧化物阴离子。BH的积累2.O2..具有代表性的NBT-或daba染色的叶片显示,并从重复实验中获得类似的结果。CROS生成和清除相关基因感染前后的表达B. Cinerea.相对表达水平显示为肌动蛋白转录值的折叠。所提供的数据为三个独立实验的平均值±SD,列上不同字母表示差异显著P < 0.05水平
沉默SLHUB1.或SLHUB2.减弱JA/ et介导的信号转导和防御反应,激活sa介导的信号转导和防御反应B. Cinerea感染
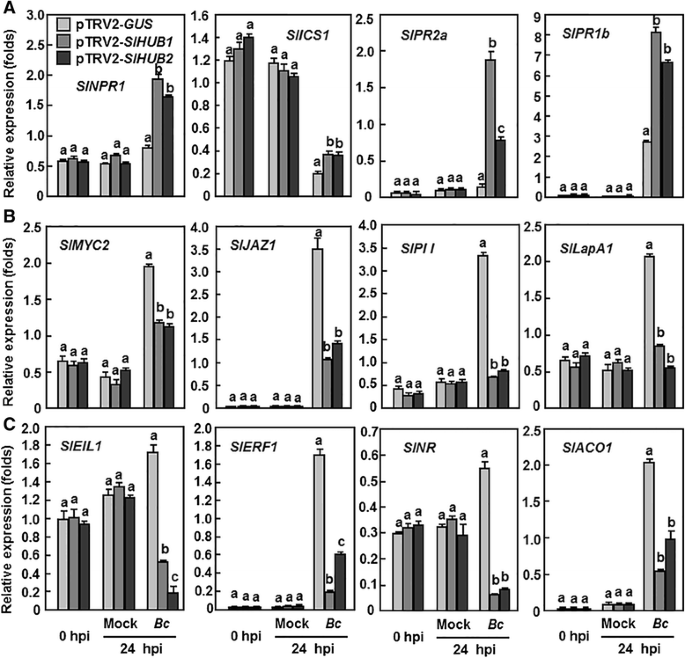
探讨SlHUB1和SlHUB2在水稻抗病性中的信号转导途径B. Cinerea,我们进一步分析并与PTRV2中的JA / ET-和SA介导的信号传导基因及其相应的防御相关基因进行了比较并进行比较SLHUB1.、pTRV2SLHUB2.-和pTRV2-格斯-渗透植株感染前后B. Cinerea. 四个基因,例如。SlNPR1,SlICS1,SLPR1B.和SlPR2b,与SA生物合成和信号传导相关,或受SA介导的信号传导调控[64.,65.];四个基因,如。SlMYC2,SlJAZ1型,SlPII公司和SlLapA1,参与或受ja介导的信号传导调控[66.–68.]和四个基因,例如。SlEIL1,SlERF1型,SlNR和SlACO1,由ET介导的信号传导参与或调节[69.,70],被选中。在健康(接种后0h)和模拟接种植株中,受试基因在pTRV2中的表达水平-SLHUB1.-和pTRV2-SLHUB2.-渗入的植株与正常植株相似,但表达水平不同SlICS1高于pTRV2-格斯-渗透植物(图。9). 接种后B. Cinerea的表达水平SlNPR1和SlPR2a表达量略有增加,但SLPR1B.大幅增加> 100倍和SlICS1在pTRV2中显著降低了约5倍-格斯与嘲弄接种植物中的那些(图。9). 然而,四个SA介导的信号转导基因的表达水平SlNPR1,SlICS1,SlPR2a和SLPR1B.在pTRV2中-SLHUB1.-和pTRV2-SLHUB2.与pTRV2-相比,-渗透植株显著增加格斯-渗透植物(图。9). 值得注意的是SlICS1在pTRV2中-SLHUB1.-和pTRV2-SLHUB2.经-渗透处理的植株也减少了约3倍B. Cinerea但仍显著高于pTRV2-格斯渗透到植物。相比之下,ja介导的信号传导相关基因的表达SlMYC2,SlJAZ1型,SlPII公司和SlLapA1et介导的信号转导相关基因SlEIL1,SlERF1型,SlNR和SlACO1在pTRV2中-格斯-当病毒感染时,渗入的植物被强烈地诱导B. Cinerea,与模拟接种的植株相比(图2。9 b和c). 然而,这些基因在pTRV2中的表达水平-SLHUB1.、pTRV2SLHUB2.-渗入植株明显减少,为0.5 ~ 与pTRV2相比减少了10倍-格斯接种后24小时 - 过滤对照植物B. Cinerea(图。9 b和C).这些结果表明,沉默两者之一SLHUB1.或SLHUB2.显著减弱JA/ET介导的信号转导和防御反应,但选择性激活SA介导的信号转导和防御反应B. Cinerea.
沉默SLHUB1.和SLHUB2.在后面影响了SA-,JA和ET介导的信号传导和响应基因的表达Botrytis.感染。用携带pTRV2的农杆菌对2周龄幼苗进行渗透-SLHUB1.pTRV2 -SLHUB2.pTRV2 -SlMED21型或pTRV2 -格斯构建并接种孢子悬浮液B. CinereaVIGS浸润后4周。在接种后0和24小时,从6株植物中采集至少6片叶片,用于基因表达分析。A.sa介导的信号传导和应答基因的表达,(B) ja介导的信号和应答基因的表达及(C)内皮素介导的信号和应答基因的表达。相对表达水平显示为肌动蛋白转录值的倍数。数据显示在(B)是来自三个独立实验的平均值±SD,列上方的不同字母表示显着差异P < 0.05水平
讨论
SLHUB1和SLHUB2在疾病抵抗中的差分要求和不同功能B. Cinerea和太平洋标准时间DC3000
最近的研究表明拟南芥组蛋白H2B单泛素化E3连接酶AtHUB1和AtHUB2在调节生长发育中发挥关键作用[36,37,39–44.]以及调节针对病原体和病原体衍生毒素的免疫反应[13,45.,46.]. 在本研究中,我们对拟南芥AtHUB1/AtHUB2、SlHUB1和SlHUB2的番茄直系同源物进行了表征(图。1).SlHUB1和SlHUB2均表现出组蛋白H2B单泛素化E3连接酶活性体外(图。1 c)它们的表达可能是由诸如B. Cinerea和太平洋标准时间DC3000和通过防御信令相关的激素(图。2.). 在拟南芥中,最近发现拟南芥AtHUB1是抗病所必需的B. Cinerea和十字花格孢另外一种虚张症真菌病原体,而Athub2在疾病抵抗中的功能仍然尚不清楚[13].我们在目前的研究中发现,使两者中的任何一个保持沉默SLHUB1.或SLHUB2.导致了疾病的严重程度和在足底真菌生长(图。3.).在我们的研究中,序列的VIGS片段为SLHUB1.和SLHUB2.在核苷酸水平和转录水平上差异很大SLHUB1.和SLHUB2.在里面SLHUB2.- - -SLHUB1.-沉默植物与对照植物相似(图。3A),表明在小麦中观察到的疾病表型增加SLHUB1.- - -SLHUB2.-沉默的植物并不是由两者同时沉默引起的SLHUB1.和SLHUB2..因此,这两者都很可能SLHUB1.和SLHUB2.是否需要抵抗B. Cinerea在西红柿里。另一方面,与拟南芥不同AtHUB1和AtHUB2没有抵抗力的功能太平洋标准时间DC3000与专性真菌病原菌erysiphe cichoracearum.,粉末的致病因素[13,45.),沉默的SLHUB1.导致疾病的严重程度降低太平洋标准时间DC3000(图。5.),表明SlHUB1至少在抗性中起作用太平洋标准时间DC3000。sa介导的信号转导被认为是调节抗病能力的观察进一步支持了这一点太平洋标准时间DC3000,可以激活在SLHUB1.——或者SLHUB2.-感染病毒后沉默的植物B. Cinerea(图。9).本研究提出的证据表明,番茄SlHUB1和SlHUB2正向调节抗性B. Cinerea而只有SlHUB1负调控抗太平洋标准时间DC3000型。此外,发现拟南芥AtHUB1和AtHUB2可调节某些基因的表达R基因如抑制npr1-1, CONSTITUTIVE1(SNC1.)以及抗霜霉病4,表明Athub1和Athub2对拟南芥免疫应答的影响[45.].综上所述,植物HUB1/HUB2和HUB1/HUB2介导的H2B单泛素化可能在抗病拮抗中发挥不同的作用。
最近报道拟南芥的AtHUB1和AtHUB2可以形成同型二聚体和异型二聚体体内[42.]在调节基因表达方面不具有重叠功能SNC1.[45.].这种性质可能部分地解释了SLHUB1.和SLHUB2.在抗病方面B. Cinerea和太平洋标准时间D3000,即SlHUB1和SlHUB2的异二聚体或同二聚体的形成对入侵病原体的不同刺激或信号的反应,可能在抵抗病原体中起不同的作用。另一种是拟南芥AtMED21,一种进化上保守的介体复合体的亚单位,被认为在调节RNA聚合酶II活性中起关键作用[71.]发现,被发现与Athub1相互作用,并在疾病抵抗力对病症的抗病性真菌和胚胎发育中发挥关键作用[13]. 在本研究中,我们发现番茄SlMED21确实与SlHUB1相互作用,但与SlHUB2没有相互作用(图。4A)还有那沉默的SlMED21型是否影响了疾病的表型引起的B. Cinerea和太平洋标准时间DC3000(无花果。4.和5.). 因此,SlMED21很可能在抗肿瘤方面不起作用B. Cinerea和太平洋标准时间DC3000,从拟南芥的AtHUB1中提供了SlHUB1在抗病中的独特作用机制[13].然而,SLHUB1是否与介质复合物的其他亚基相互作用是值得进一步检查的,因为提出与介质复合物的相互作用作为Athub1在疾病抵抗中所需的重要模式[13].
SlHUB1和SlHUB2调控番茄植株的多重防御反应B. Cinerea
在感染过程中,坏死营养型真菌B. Cinerea经常分泌一系列细胞壁降解酶,破坏植物细胞的细胞壁屏障,造成营养物质的泄漏,从而被入侵的病原体提取,用于生长繁殖[72.–74.]. 在这方面,植物细胞壁的完整性和强度被认为在抗病性中起着重要作用B. Cinerea[72.].发现番茄叶接受B. Cinerea在真菌进入的部位诱导细胞壁的强化[75.].在本研究中,我们发现细胞壁厚度SLHUB1.——或者SLHUB2.-与对照植物相比,沉默植物明显减少(图。6A和B). 在拟南芥中也获得了类似的观察结果阿图布1突变株,细胞壁厚度减少[13].最重要的是,在感染B. Cinerea,病原体诱导的苯丙素途径相关基因的表达(例如:SlPALs和SLC4H.)和细胞壁的形成(例如:Slcads.) 在里面SLHUB1.——或者SLHUB2.-沉默的植物被显著抑制(图。7.),表示沉默SlHU1型和SLHUB2.可能导致这些细胞壁相关基因的有效反应性缺陷,从而导致致病性感染期间的细胞壁形成缺陷。另外,还发现拟南芥叶片的角质层阿图布1和阿图布2突变植物不规则紊乱,并且在Cutin和Wax生物合成中涉及的一些基因的表达在下调阿图布1和阿图布2突变体[38]. 细胞壁的形成与苯丙酸途径密切相关[58.,它负责木质化,以加强细胞壁[76.]因此,我们得出结论,细胞壁的缺陷SLHUB1.——或者SLHUB2.-沉默的植物可以解释,至少部分地,抵抗力下降B. Cinerea. 除了细胞壁的生物合成,朋友基因对SA生物合成也很重要[77.].然而,大多数病原体诱导的SA产生是通过一个独特的途径,即异索酸合酶(ICS1) [77.].无论朋友这里参与进一步研究SA生物合成的基因。
大量研究表明,ROS在一些坏死性病原体的感染过程中起着重要的作用B. Cinerea[72.]. 以前的研究表明B. Cinerea可以利用ROS建立感染[78.–80]但虽然还报告了抵抗力B. Cinerea在里面sitiens,ABA缺乏番茄突变体,涉及及时生产H.2.O2.[75.].在本研究中,我们观察到H2.O2.和超氧化物阴离子SLHUB1.——或者SLHUB2.-沉默植株感染后B. Cinerea,虽然积累H2.O2.和超氧化物阴离子SLHUB1.——或者SLHUB2.- 没有感染的植物与对照没有明显的差异(图。7A和B),表示沉默SLHUB1.或SLHUB2.可能会损失对病原体感染的ros生成和清除的控制。该假设支持参与ROS生成和清除的基因的表达变化SLHUB1.——或者SLHUB2.沉默的植物。的表达式级别SlRboh1,可以减少H的积累2.O2.沉默时[45.,63.的表达量显著增加SlSOD1和涉及ROS清除的SLGR1减少SLHUB1.——或者SLHUB2.-沉默植株感染后B. Cinerea(图。7C.).上调的表达SlCAT1和拍打x5在里面SLHUB1.——或者SLHUB2.-沉默植株感染后B. Cinerea可能是由于ROS在细胞内的过度积累所产生的反馈调节(图。7A和B).似乎很可能会沉默SLHUB1.或SLHUB2.促进了B. Cinerea- 通过对ROS产生和清除的基因表达的扰动产生ROS的积累,从而衰减对该病原体的疾病抗性。
与先前在番茄中的观察一致-B. Cinerea相互作用[75.,81.,我们在这项研究中发现感染B. Cinerea在感染部位诱导胼胝质的显著积累(图。6c和d). 在本研究中我们还发现SLHUB1.或SLHUB2.导致胼胝质的增加积累在感染部位SLHUB1.——或者SLHUB2.-沉默植株感染后B. Cinerea(图。6c和d). 这与拟南芥阿图布1突变株侵染后胼胝质的积累增加B. Cinerea[13].然而,调用抗病患者的作用似乎是复杂的73.]. 然而,胼胝质积累量的减少被发现与增加对糖尿病的易感性有关A.芸薹属,呼失的呼失没有对抗性的影响B. Cinerea[13].似乎SlHUB1和SlHUB2,以及拟南芥AtHUB1 [13],可以具有在感染部位进行调节胼unce的作用;然而,这些积累的核糖不太可能有助于抵抗B. Cinerea. 这与先前支持胼胝质积累作为防御反应的一部分的观察形成对比B. Cinerea在西红柿里[75.,82.].
SlHUB1和SlHUB2有助于番茄抗虫性B. Cinerea通过平衡SA-和JA/ET介导的通路
SA、JA和ET都以不同的方式独立地对番茄的抗性产生影响B. Cinerea.Arabidopsis Athub1和Athub2在疾病抵抗中的参与已经记录了[13,42.]. AtHUB1独立于JA发挥作用,但ET和SA参与调节AtHUB1突变体对坏死性真菌的抗性[13]. 然而,AtHUB1和AtHUB2可能参与的信号通路目前还不清楚。在本研究中,参与SA-、JA-和ET-介导的信号通路的基因的表达在细胞中表现出不同的模式SLHUB1.- - -SLHUB2.-感染病毒后沉默的植物B. Cinerea(图。9),为可能的SlHUB1-和slhub2调控信号通路提供了新的见解。SA是一种防御分子,调节植物对多种病原体的抗性,但SA的增加被证明与对坏死性真菌病原体的敏感性有关,包括B. Cinerea[61.]. 在本研究中SlICS1,编码一种参与SA合成的异chorisate合成酶[81.],被B. Cinerea在对照植物中(图。9)说明番茄植株能抑制SA的生物合成,从而降低内源SA水平,从而防御番茄的侵染灰霉病菌.然而,在SlHUB1-和slhub2沉默的植物中,sa介导的信号调节基因的表达SlICS1和SlNPR1和防御基因SlPR2b和SLPR1B.在感染病毒后显著上调灰霉病菌(图。9),暗示sa介导的信号转导增强,这可能会减弱防御反应到b灰质.最近的一些观察结果部分支持了这一点B. Cinerea能够操纵和利用sa介导的信号通路促进番茄病害的发展[83.,84.]SA通过NPR1促进疾病的发展,NPR1可以被B. Cinerea[83.].另一方面,人们普遍认为,抵制B. Cinerea在拟南芥中需要JA-和et介导的信号通路[85.,86.].在番茄中,JA/ et依赖的防御途径的激活也是抗性所必需的B. Cinerea[83.,87.]. 在本研究中,JA-和ET-介导的信号转导和应答基因的表达明显地被诱导B. Cinerea在对照植物中(图。9 b),表明可以在感染时启动活性Ja和eT介导的信号传导途径B. Cinerea.相比之下,这些JA-和et介导的信号传导和响应基因的表达SLHUB1.- - -SLHUB2.-在病毒感染后,沉默植株被显著抑制B. Cinerea(图。9 b和C). 这意味着沉默SLHUB1.或SLHUB2.导致JA-和et介导的信号转导减弱,从而降低防御反应,导致抗性降低B. Cinerea证明了JA-和ET-介导的信号通路在SlHUB1-和SlHUB2-调节抗肿瘤中的重要性B. Cinerea. 然而,JA和ET介导的信号通路在SlHUB1和SlHUB2的功能中是独立作用还是联合作用尚不清楚。JA的作用与ET无关B. Cinerea在西红柿里[87.].此外,像拟南芥那样,SA-,JA和ET介导的信号传导途径中的拮抗串扰于番茄抗性B. Cinerea也有报道[83.].总的来说,我们的数据支持SlHUB1和SlHUB2在抵抗中发挥作用B. Cinerea通过调制JA / ET-和SA介导的信号传导途径之间的平衡。
结论
总之,我们提出的证据支持SlHUB1和SlHUB2都有助于抗肿瘤B. Cinerea通过调节SA-和JA/ et介导的通路之间的平衡,在番茄中发挥重要作用。进一步的研究,例如,基因表达谱之间SLHUB1.——或者SLHUB2.-沉默植物和非沉默植物感染后B. Cinerea在特定基因位点的组蛋白H2B单次素化分析,将有助于SLHUB1和SLHUB2在番茄抗性中的机制B. Cinerea.
支持数据的可用性
参考
- 1.
Jones JD,Dangl JL。植物免疫系统。自然。2006; 444:323-9。
- 2.
Boller T, He SY。植物的先天免疫:植物的模式识别受体和微生物病原体的效应者之间的军备竞赛。科学。2009;324:742-4。
- 3.
冯硕,周杰米。植物细菌病原体相互作用型III型效应介导。CurrOp植物BIOL。2012; 15:469-76。
- 4.
Chisholm ST, Coaker G, Day B, Staskawicz BJ。宿主与微生物的相互作用:塑造植物免疫反应的进化。细胞。2006;124:803-14。
- 5。
多兹PN, Rathjen JP。植物免疫:朝向植物-病原体相互作用的综合观点。Nat Rev Genet, 2010; 11:539-48。
- 6。
Nishimura Mt,Dangl JL。拟南芥和植物免疫系统。工厂J.2010; 61:1053-66。
- 7。
Buscaill P,Rivas S.植物防御反应的转录控制。CurrOp植物BIOL。2014; 20:35-46。
- 8。
关键词:泛素化,植物,防御,防御机制植物生物学。2003;6:307-11。
- 9.
Doehlemann G,Wahl R,Horst RJ,Voll Lm,Usadel B,Poree F等人。重新编程玉米植物:真菌生物醇诱导的转录和代谢变化玉米黑粉菌.植物j . 2008; 56:181 - 95。
- 10.
拟南芥防御转录组调控。植物科学,2005;10:41 - 45。
- 11.
Berr A、McCallum EJ、Alioua A、Heintz D、Heitz T、Shen WH。拟南芥组蛋白甲基转移酶组域8介导茉莉酸/乙烯途径基因在植物对坏死营养真菌防御反应中的诱导。植物生理学。2010;154:1403–14.
- 12.
郑YT,李X。NB-LRR介导免疫中的泛素化。植物生物学。2012;15:392–9.
- 13.
Dhawan R,Luo H,Foerster AM,Abuqamar S,Du HN,Briggs SD等。组蛋白单泛素化1与介体复合物的亚单位相互作用,并调节机体对坏死性真菌病原体的防御拟南芥.植物细胞。2009;21:1000-19。
- 14.
March Diaz R、Garcia Dominguez M、Lozano Juste J、Leon J、Florencio FJ、Reyes JC。组蛋白H2A.Z和SWR1复合物的同系物是控制拟南芥免疫所必需的。植物J。2008;53:475–87.
- 15.
夏S,Cheng Yt,Huang S,Win J,Soards A,Jinn TL等。核苷酸结合幼氨酸少量重复基因转录调节SNC1.和RPP4.通过H3K4 trimethylation。植物杂志。2013;162:1694 - 705。
- 16。
关键词:泛素-蛋白酶体,植物生长发育,泛素-蛋白酶体植物细胞。2004;16:3181 - 95。
- 17。
piniro M, Jarillo JA。泛素化在控制光周期开花中的作用。植物科学。2013;198:98 - 109。
- 18。
植物生物学中的泛素-26S蛋白酶体系统。Nat Rev Mol细胞生物学。2009;10:385–97.
- 19。
李杰,金wt。拟南芥中E3泛素连接酶的非生物应激信号转导。mol细胞。2011; 31:201-8。
- 20.
泛素-蛋白酶体系统调节植物激素信号转导。植物j . 2010; 61:1029-40。
- 21.
泛素连接酶E3与脱落酸信号转导。植物信号行为。2011;6:34 44 - 8。
- 22.
王飞,邓晓文。植物泛素-蛋白酶体通路及其在赤霉素信号转导中的作用。细胞研究》2011;21:1286 - 94。
- 23.
德雷赫K,卡利斯J。泛素、激素与植物的生物胁迫。安·博特。2007;99:787–822.
- 24.
Trujillo M,Shirasu K。植物免疫中的泛素化。植物生物学。2010;13:402–8.
- 25.
植物免疫信号转导中的泛素化。植物杂志。2012;160:15-27。
- 26.
赫里德C,乌伯S,克莱格MJ。泛素代码组装和反汇编。电流生物学。2014;24:R215–20。
- 27.
细胞制造单泛素信号的策略。中国生物医学工程学报,2012;
- 28.
张燕:组蛋白泛素化和去泛素化对转录的调控。基因Dev。2003;17:2733-40。
- 29.
Shilatifard A.通过甲基化和泛素化的染色质修饰:对基因表达调控的影响。annu rev biochem。2006; 75:243-69。
- 30
削弱VM,Workman JL。组蛋白泛素化:触发基因活性。摩尔细胞。2008;29:653–63.
- 31.
布劳恩斯,Madhani HD。塑造景观:染色质泛素改性的机械后果。Embo Rep. 2012; 13:619-30。
- 32.
读、写和修复:泛素和泛素样蛋白在DNA损伤信号传导和修复中的作用。麝猫。2013;4:45。
- 33.
张凯,朱军,周涛,谷川等。组蛋白H2B去泛素化控制DNA甲基化和异色沉默。大自然。2007;447:735-8。
- 34.
Zhang K、Sridhar VV、Zhu J、Kapoor A、Zhu JK。细胞中独特的核心组蛋白翻译后修饰模式拟南芥.《公共科学图书馆•综合》。2007;2:e1210。
- 35.
主要研究方向为:生物化学、生物化学、生物化学、生物化学、生物化学和生物化学。整合表观基因组定位定义了拟南芥的四种主要染色质状态。EMBO j . 2011; 30:1928-38。
- 36.
作者简介:布尔布塞(1987 -),男,博士,主要研究方向为计算机辅助设计。在拟南芥光形态建成过程中,组蛋白H2B单泛素化促进了基因表达的快速调控。公共科学图书馆麝猫。2012;8:e1002825。
- 37.
Fleury D, Himanen K, Cnops G, Nelissen H, Boccardi TM, Maere S等。的拟南芥酵母的同源物BRE1在叶和根的早期生长中具有细胞周期调节的功能。植物细胞。2007;19:417–32.
- 38.
梅纳德R、维迪尔G、奥尔斯M、埃尔哈特M、贝松F、沈WH。组蛋白H2B单泛素化参与了角质和蜡组成的调节拟南芥.植物生理学杂志。2014;
- 39。
Liu Y,Koornneef M,Soppe WJ。组蛋白H2B单泛素化的缺失拟南芥hub1(rdo4)突变体揭示了染色质重塑在种子休眠中的作用。植物细胞。2007;19:433-44。
- 40.
llolas IB, Himanen K, Gronlund JT, lyngaard C, Houben A, Melzer M等。转录延长因子FACT影响拟南芥的营养和生殖发育,并与HUB1/2基因相互作用。植物j . 2010; 61:686 - 97。
- 41.
Himanen K, Woloszynska M, Boccardi TM, De Groeve S, Nelissen H, Bruno L等。拟南芥中需要组蛋白H2B单泛素化才能达到最大的生物钟基因转录水平。植物j . 2012; 72:249-60。
- 42.
关键词:组蛋白H2B单泛素化开花轨迹C调节开花时间拟南芥.植物细胞。2008;20:2586 - 602。
- 43.
Xu L, Menard R, Berr A, Fuchs J, Cognat V, Meyer D等。E2泛素缀合酶AtUBC1和AtUBC2起冗余作用,参与活化FLC公司花期的表达与抑制拟南芥.植物j . 2009; 57:279 - 88。
- 44.
顾X,江D,王Y,巴赫迈尔A,何Y。通过组蛋白H2B单泛素化抑制花过渡。植物J。2009;57:522–33.
- 45.
邹B,杨德尔,史Z,董H,华J。拟南芥抗病基因座组蛋白2B的单泛素化调控其表达并影响免疫应答。植物生理学。2014;165:309–18.
- 46.
胡明,裴碧儿,张汝夫,李奕。组蛋白H2B的单泛素化参与调节微管在免疫应答过程中的动力学大丽叶黄萎病在拟南芥毒素。植物杂志。2014;164:1857 - 65。
- 47.
李X,张y,黄l,欧阳z,洪y,张h等。番茄SLMKK2和SLMKK4有助于对Botrytis Cinerea的抗病抗性。BMC植物BIOL。2014; 14:166。
- 48.
acta photonica sinica, 2011, 38(5): 732 - 736 .李鑫,黄磊,张勇,欧阳志洪,张宏,等。番茄SR/ CAMTA转录因子SlSR1和SlSR3L负向调控抗病性,SlSR1L正向调控抗旱性。中国生物医学工程学报,2014;
- 49.
关键词:番茄蛋白激酶1b,坏死真菌,昆虫,信号转导植物细胞。2008;20:1964 - 83。
- 50.
Mengiste T、Chen X、Salmeron J、Dietrich R。番茄灰霉病易感基因1编码拟南芥生物和非生物胁迫反应所需的R2R3MYB转录因子蛋白。植物细胞。2003;15:2551–65.
- 51
Benito E, 10 Have A, van ' t Klooster J, van Kan JL。番茄灰霉病同步侵染过程中真菌和植物基因的表达。植物病理学杂志1998;104:207-20。
- 52
Katagiri F, Thilmony R, He SY。拟南芥-丁香假单胞菌的相互作用。拟南芥的书。2002;1:e0039。
- 53
刘永平,刘永平,刘永平,等。番茄病毒诱导基因沉默的研究进展。中国农业科学,2014,45(5):557 - 564。植物j . 2002; 31:777 - 86。
- 54
安德伍德W,张S,他SY。丁香假单胞菌Ⅲ型效应子酪氨酸磷酸酶HopAO1抑制拟南芥的天然免疫。植物J。2007;52:658–72.
- 55.
Wood A, Krogan J, Dover J, Schneider J, Heidt J, Boateng MA, et al.;Bre1是一种E3泛素连接酶,用于启动子上Rad6的招募和底物选择。摩尔细胞。2003;11:267 - 74。
- 56.
Kim J,Guermah M,McGinty RK,Lee JS,Tang Z,Milne TA等。RAD6介导的转录偶联H2B泛素化直接刺激人类细胞中H3K4甲基化。牢房。2009;137:459–71.
- 57.
朱斌,郑勇,范亚平,Mandal SS, erdjumet - bromage H, Tempst P,等。人组蛋白H2B的单泛素化:相关因素及其作用霍克斯基因调控。摩尔细胞。2005;20:601–11.
- 58.
Bhargava A,Mansfield SD,Hal HC,Douglas CJ,Ellis是。MYB75在拟南芥花序茎中调节次级细胞壁形成的功能。植物理性。2010; 154:1428-38。
- 59.
Gayoso C,Pomar F,Novo-uzal E,Merino F,De Ilarduya OM。番茄的VE介导的抗性反应大丽叶黄萎病包括H2.O2.,过氧化物酶和木质素和驱动器朋友基因的表达。中国生物医学工程学报。2010;10:232。
- 60
等。肉桂酸4-羟化酶(cinnamate 4-hydroxylase, CYP73A24)在转基因番茄植株中的表达对进入茎木质素和果实类黄酮的通量有相反的影响。植物化学,2007;68:1497 - 509。
- 61
陈建平,陈建平,陈建平,等。的membrane-anchored葡萄球菌诱导的激酶1扮演着不同的角色拟南芥对坏死性和生物营养性病原体的抗性。植物细胞。2006;18:257 - 73。
- 62
Miller G,Schlauch K,Tam R,Cortes D,Torres MA,Shulaev V等。植物NADPH氧化酶RBOHD介导对多种刺激的快速系统信号传导。Sci信号。2009;2:ra45。
- 63.
聂武夫,王明明,夏旭杰,周一赫,施克,陈子珍,等。番茄的沉默RBOH1和MPK2废除brassinosteroid-induced H2.O2.一代和压力耐受性。植物细胞环境。2013; 36:789-803。
- 64.
陈莹莹,林义明,超涛涛,王俊峰,刘爱科,何菲,等。病毒诱导的基因沉默揭示了乙烯、水杨酸和丝裂原激活蛋白激酶相关防御通路在番茄抗青枯病中的作用。杂志。2009;136:324-35。
- 65.
Uppalapati SR,Ishiga Y,Wangdi T,Kunkel BN,Anand A,Mysore KS,et al.植物毒素coronatine有助于病原菌的适合性,是抑制水杨酸在番茄中积累所必需的假单胞菌含油pv。番茄DC3000。植物微生物的相互作用。2007;20:955-65。
- 66.
Fowler JH、Narvaez Vasquez J、Aromdee DN、Pautot V、Holzer FM、Walling LL。亮氨酸氨基肽酶调节茉莉酸下游番茄的防御和伤害信号。植物细胞。2009;21:1239–51.
- 67.
Gupta N, Prasad VB, Chattopadhyay S. LeMYC2作为蓝光介导的光形态形成生长的负调控因子,促进了番茄成体的生长。中国生物医学工程学报,2014;
- 68.
Ishiga Y、Ishiga T、Uppalapati SR、Mysore KS。茉莉酸ZIM结构域(JAZ)蛋白调控番茄和番茄中寄主和非寄主病原菌诱导的细胞死亡烟草benthamiana. 公共科学图书馆一号。2013;8:e75728。
- 69.
Tieman DM,Ciardi Ja,Taylor Mg,Klee HJ。番茄成员里尔(EIN3类)基因家族在功能上是冗余的,在植物发育过程中调节乙烯的反应。植物J。2001;26:47–58.
- 70。
张立,贾c,刘升,张z,李c,王问。茉莉酸盐和乙烯的参与交链孢f . sp。黄瓜毒素诱导的番茄细胞死亡。J Exp Bot。2011; 62:5405-18。
- 71.
Hallberg M,Hu GZ,Tronnersjo S,Shaikhibrahim Z,Balciunas D,Bjorklund S等。酵母介体中间域的功能和物理相互作用。分子遗传学。2006;276:197–210.
- 72.
门吉斯特T。植物对坏死滋养细胞的免疫力。植物病理学年鉴。2012;50:267–94.
- 73.
植物细胞壁:抵御病原体入侵的动态屏障。植物科学,2012;
- 74.
【关键词】全基因组转录谱灰葡萄孢在不同宿主的感染期间靶向植物细胞壁的基因。前植物SCI。2014; 5:435。
- 75
Asselbergh B,Curner K,Franca Sc,Audenaert K,Vuylsteke M,Van Breusegem F,等。抵抗力灰葡萄孢在里面sitiens这是一种脱落的缺酸番茄突变体,它涉及过氧化氢的及时产生和表皮细胞壁的修饰。植物杂志。2007;144:1863 - 77。
- 76
Vance CP,Kirk TK,Sherwood RT.木质化作为抗病机制。植物病理学年鉴。1980;18:259–88.
- 77
Pajerowska Mukhtar K.Boatwright路。水杨酸:一种古老的荷尔蒙有了新的窍门。植物病理学。2013;14:623–34.
- 78
Desmond OJ、Patteries JM、Stephens AE、Maclean DJ、Schenk PM、Gardiner DM等。镰刀菌真菌毒素脱氧雪腐镰刀菌烯醇诱导小麦过氧化氢产生、细胞程序性死亡和防御反应。植物病理学。2008;9:435–45.
- 79.
超敏反应促进植物被坏死病原菌感染灰葡萄孢.咕咕叫医学杂志。2000;10:751-7。
- 80
Rossi FR, Garriz A, Marina M, Romero FM, Gonzalez ME, Collado IG等。倍半萜葡萄球菌由灰葡萄孢诱导植物组织的超敏反应,其作用受水杨酸和茉莉酸信号调节。植物与微生物相互作用。2011;24:888–96.
- 81
吴刚,奥苏贝尔调频。异索酸酯合酶是合成水杨酸用于植物防御的必需酶。大自然。2001;414:562-5。
- 82
Scalschi L、Sanmartin M、Camanes G、Troncho P、Sanchez Serrano JJ、Garcia Agustin P等。基因沉默opr3.在番茄中揭示了OPDA在胼胝质的沉积中所起的作用灰葡萄孢.植物j . 2015; 81:304-15。
- 83
El Oirdi M,El Rahman Ta,Rigano L,El Hadrami A,Rodriguez MC,Daayf F等人。灰葡萄孢调控免疫途径之间的拮抗作用,促进番茄病害的发展。植物细胞。2011;23:2405-21。
- 84
Rahman Ta,Oirdi Me,Gonzalez-Lamothe r,Bouarab K.虚构养殖病原体使用水杨酸信号通路来促进番茄中的疾病发展。Mol植物微生物相互作用。2012; 25:1584-93。
- 85
格拉泽布鲁克J。生物营养型和坏死营养型病原体防御机制的对比。植物病理学年鉴。2005;43:205–27.
- 86
格兰特先生,琼斯JD。激素(不)协调影响植物的健康和病害。科学。2009;324:750-2。
- 87.
迪亚兹J,十点,范甘佳。乙烯和伤口信号在番茄抗病性中的作用灰葡萄孢.植物理性。2002; 129:1341-51。
确认
本研究得到了国家基础研究计划(2009CB119005)、国家高技术研究开发计划(编号2012AA101504)和国家高等教育博士点研究基金(20101110070)的资助。
作者信息
从属关系
相应的作者
额外的信息
利益争夺
提交人声明他们没有竞争利益。
作者的贡献
YZ、DL和FS设计了实验。YZ、DL、HZ、YH、LH、SL、XL和ZO进行了大部分的实验。DL进行生物信息学分析。FS和DL写了这篇论文。所有作者阅读并批准最终稿件。
附加文件
额外的文件1:
本研究中使用的引物用途不同。(PDF 50 kb)
附加文件2:
PTRV2的沉默效率slpds.渗透番茄植物。用携带pTRV2的农杆菌对2周龄幼苗进行渗透-slpds.或pTRV2 -格斯叶片样品在VIGS处理3周后采集。(a)PTRV2-的表型 -slpds.或者pTRV2格斯渗透番茄植物。(B)的文字记录slpds.qRT-PCR分析(PDF(3931 kb)
附加文件3:
SlMED21是AtMED21的同源。(A)番茄SlMED21蛋白与拟南芥AtMED21蛋白的比较。(B)番茄和其他真核生物SlMED21邻接树。利用不同生物的MED21氨基酸序列构建系统发育树。序列比对由ClustalX程序进行。采用MEGA6程序的邻域连接(neighbor-joining, NJ)方法,以p-distance和完全删除选项参数构建系统发育树。获得的树的可靠性用1000个重复的bootstrapping方法进行了检验。MED21序列来自Sorgum二色的(SbMED21 AAL73528),选用Sative(OSMED21,BAD03057),拟南芥(ATMED21,AAD03443,AT4G04780),茄属植物lycopersicum(SLMED21,AK328398),亩骶(MmMED21,AAH12286),智人(HSMED21,NP_004255),鲐鱼类(DrMED21 NP_998588),美国cervisae(ScMED21 P47822),Schizosaccharomyces Pombe(SpMED21 CAA22343),Physcomitrella金属盘(PpMED21 XP_001763794)冈比亚按蚊(AgMED21 XP_307937)。AtMED21和SlMED21用红色标记。(PDF 3007 kb)
权利和权限
开放获取本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
张勇,李东,张宏利。等。番茄组蛋白H2B单泛素化酶SlHUB1和SlHUB2有助于抗病灰葡萄孢通过调节SA-和JA/ET介导的信号通路之间的平衡。BMC植物BIOL.15,252(2015)。https://doi.org/10.1186/s12870-015-0614-2
收到了:
认可的:
发表:
关键词
- 灰葡萄孢
- 防御反应
- 组蛋白H2B泛素化
- 环E3连接酶
- 信号通路
- 西红柿(茄属植物lycopersicum)