- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
在体外gydF4y2Ba线粒体ATP/磷酸盐载体的分析gydF4y2Ba拟南芥gydF4y2Ba出乎意料的CagydF4y2Ba2 +gydF4y2Ba影响gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba15gydF4y2Ba,文章号:gydF4y2Ba238gydF4y2Ba(gydF4y2Ba2015gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
来自哺乳动物和酵母的腺嘌呤核苷酸/磷酸载体(apc)通常被认为能根据细胞需求调整线粒体腺嘌呤核苷酸库。它们催化腺嘌呤核苷酸——尤其是ATP-Mg——和磷酸盐的交换,它们的活性受钙的调节。我们目前关于植物中相应蛋白质的知识相对有限。最近,三辆装甲运兵车来自gydF4y2Ba拟南芥gydF4y2Ba显示可以恢复APC酵母功能丧失突变体的特定生长表型,并通过其n端EF-hand基基与钙相互作用gydF4y2Ba在体外gydF4y2Ba.在本研究中,我们对所有三种APC亚型进行了生化表征gydF4y2Ba答:芥gydF4y2Ba为了进一步了解它们的功能特性gydF4y2Ba.gydF4y2Ba
结果gydF4y2Ba
重组植物APCs被功能重组为脂质体,并通过使用放射性标记底物的运输测量确定其生化特性。所有三种植物apc都能进行ATP、ADP和磷酸盐的交换,但不检测到对ATP- mg的高度偏好,如同源载体所示。相比之下,获得的数据表明,在脂质体系统中,植物APCs更倾向于ATP-Ca作为底物。此外,对一个具有代表性的突变APC蛋白的研究表明,钙对ATP转运的影响主要/本质上不涉及钙gydF4y2Ba2 +gydF4y2Ba-绑定到载体n端域的EF-hand motif上。gydF4y2Ba
结论gydF4y2Ba
生物化学特征表明,植物apc可以介导腺嘌呤核苷酸的净转运,因此,就像它们来自动物和酵母的垂坠一样,可能参与线粒体腺嘌呤核苷酸库的改变。然而,ATP-Ca被认为是植物apc的一个明显的输入底物gydF4y2Ba在体外gydF4y2BaATP-Ca的形成以及相应的转运是否能够发生还存在争议gydF4y2Ba在活的有机体内gydF4y2Ba.gydF4y2Ba
背景gydF4y2Ba
线粒体载体家族(MCF)由结构相关但功能多样的蛋白质组成,这些蛋白质是真核生物特有的,通常仅限于真核生物[gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba5gydF4y2Ba].MCF蛋白是线粒体内膜的主要溶质载体,并催化各种代谢物的转运,如核苷酸、辅因子、羧酸盐、氨基酸等(综述见[gydF4y2Ba6gydF4y2Ba])。gydF4y2Ba
线粒体ATP- mg /磷酸盐载体(APCs)代表了一个特定的MCF亚群,由来自不同真核生物的载体组成,这些载体与线粒体能量传递所需的特征良好的ADP/ATP载体(AACs)在系统发育上相关(有关综述见[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba])。在过去的几年里,研究了单酵母APC亚型Sal1p(∆gydF4y2Baaac2gydF4y2Ba致命性)以及各种哺乳动物同源物的情况变得越来越清楚[gydF4y2Ba8gydF4y2Ba].最初,Sal1p被证明可以抑制线粒体能量传输受损的酵母的生长表型(由于AAC缺失或抑制)。以类似的方式,AAC补偿功能Sal1p的损失[gydF4y2Ba8gydF4y2Ba].随后的研究表明,Sal1p及其哺乳动物同源物介导腺嘌呤核苷酸和磷酸盐的反向交换[gydF4y2Ba9gydF4y2Ba- - - - - -gydF4y2Ba13gydF4y2Ba].因此,Sal1p和AAC的冗余生理功能可能主要不是能量交换,而是腺嘌呤核苷酸易位,最有可能是ATP进入线粒体[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba].gydF4y2Ba
研究表明,腺嘌呤核苷酸与磷酸盐交换改变线粒体腺嘌呤核苷酸库可影响不同的生理过程,如酵母或哺乳动物的葡萄糖代谢、氧化磷酸化、线粒体生物发生和DNA维持[gydF4y2Ba9gydF4y2Ba- - - - - -gydF4y2Ba13gydF4y2Ba].APC蛋白明显偏爱双重负电荷底物,即ATP与Mg复合物gydF4y2Ba2 +gydF4y2Ba(ATP-MggydF4y2Ba2−gydF4y2Ba),质子化ADP (HADPgydF4y2Ba2−gydF4y2Ba)或HPOgydF4y2Ba4gydF4y2Ba2−gydF4y2Ba,使催化输运呈电中性[gydF4y2Ba15gydF4y2Ba].载体基质侧和细胞质侧不同底物的组成(各自的浓度)决定了腺嘌呤核苷酸是优先输出还是输入[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba15gydF4y2Ba].gydF4y2Ba
有趣的是,Ca的加入gydF4y2Ba2 +gydF4y2Ba分离线粒体以及代谢情况,导致游离胞质钙的增加gydF4y2Ba2 +gydF4y2Ba显示通过刺激哺乳动物和酵母中的APC活性来提高线粒体腺嘌呤核苷酸水平[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba16gydF4y2Ba- - - - - -gydF4y2Ba18gydF4y2Ba](请参阅[gydF4y2Ba19gydF4y2Ba])。一方面,APC蛋白在结构上与典型的MCF蛋白有很大的不同;它们被一个暴露于线粒体膜间空间的结构域扩展到n端,该结构域包含多达4个假定的CagydF4y2Ba2 +gydF4y2Ba-binding EF-hand motifs [gydF4y2Ba20.gydF4y2Ba- - - - - -gydF4y2Ba22gydF4y2Ba].最近对人类APC亚型1(也称为SCaMC1,简称Ca) n端结构域的结构研究gydF4y2Ba2 +gydF4y2Ba线粒体载体1)表明CagydF4y2Ba2 +gydF4y2Ba-束缚态相当致密和刚性,而载波(CagydF4y2Ba2 +gydF4y2Ba自由)态更灵活[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].此外,研究了与两个单独的SCaMC1结构域CagydF4y2Ba2 +gydF4y2Ba-结合部分和c端跨膜区域,导致假设n端结构域的载脂蛋白状态形成一个闭合易位通路的帽,而CagydF4y2Ba2 +gydF4y2Ba-结合导致帽层移除/打开,从而激活转运蛋白[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].gydF4y2Ba
与酵母和哺乳动物相比[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba23gydF4y2Ba- - - - - -gydF4y2Ba25gydF4y2Ba关于植物中线粒体的净腺嘌呤核苷酸运输的分析仍然是初步的。以前的研究导致了有争议的结果,但已表明植物线粒体能够吸收腺嘌呤核苷酸[gydF4y2Ba26gydF4y2Ba- - - - - -gydF4y2Ba31gydF4y2Ba].gydF4y2Ba拟南芥gydF4y2Ba拥有三种推测的APC蛋白(gydF4y2Ba在gydF4y2BaAPC1-3)表现出与人类和酵母对应物相似的高氨基酸序列。MCF蛋白的系统发育分析表明,apc聚集在一起,植物apc与人类和酵母的同源物形成姐妹基团[gydF4y2Ba6gydF4y2Ba].与酵母或哺乳动物apc类似,植物吊坠包含一个n端延伸,有四个假定的EF-hand基序,最近被证明与Ca相互作用gydF4y2Ba2 +gydF4y2Ba至少gydF4y2Ba在体外gydF4y2Ba[gydF4y2Ba32gydF4y2Ba].此外,3种植物亚型均能挽救∆的特定生长表型gydF4y2Basal1pgydF4y2Ba酵母突变体[gydF4y2Ba32gydF4y2Ba].因此,gydF4y2Ba在gydF4y2BaAPC1-3亚型被认为是Ca的代表gydF4y2Ba2 +gydF4y2Ba-调节的ATP-Mg/磷酸盐转运体。初步了解三种apc的生化特性gydF4y2Ba答:芥gydF4y2Ba我们将异源表达蛋白重组成脂质体,并研究了它们转运腺嘌呤核苷酸的能力。我们的数据表明,植物APCs介导ATP、ADP和磷酸盐的反配位,因此可能参与线粒体腺嘌呤核苷酸库的改变。此外,确定的输运特征表明,在gydF4y2Ba在体外gydF4y2Ba系统中,植物APCs优先进口CagydF4y2Ba2 +gydF4y2Ba而不是MggydF4y2Ba2 +gydF4y2Ba- ATP复合体形式。gydF4y2Ba
方法gydF4y2Ba
表达式构造的生成gydF4y2Ba
的编码序列gydF4y2Ba在gydF4y2BaAPC1-3扩增gydF4y2Ba拟南芥gydF4y2BacDNA与特异性引物通过gydF4y2Ba空斑形成单位gydF4y2Ba-polymerase-mediated PCR。用于截断的生成gydF4y2Ba在gydF4y2BaAPC2突变蛋白缺乏CagydF4y2Ba2 +gydF4y2Ba在n端选择了一个意义引物,该引物与相应的全长序列进行内部杂交,得到了从第四个预测EF-hand motif编码区之后的164氨基酸位置开始的重组蛋白。异丙基β- d -巯基半乳糖吡喃苷(IPTG)诱导T7 RNA聚合酶pet载体/Rosetta™2表达系统(Merck Biosciences, Novagen®,Darmstadt, Germany)用于异体蛋白合成。因此,对引物进行修饰,使其可以插入组氨酸标记编码序列的表达载体pET16b。的编码序列gydF4y2Ba在gydF4y2BaAPC1通过NdeI(义引物)和XhoI(反义引物)插入,其余序列通过XhoI(义引物)和BamHI(反义引物)插入。通过测序验证了各自表达结构的正确性。gydF4y2Ba
异源蛋白的合成与检测gydF4y2Ba
为了合成异体蛋白,将表达构建物转化Rosetta™2细胞,并在50 mL标准Terrific Broth (TB)培养基中培养,37°C,剧烈震动。外径gydF4y2Ba600gydF4y2Ba0.5,加入1 mM IPTG诱导表达。诱导后2小时,离心浓缩细胞(3000 g, 5分钟,4℃),快速冷冻(液氮中)。将冷冻细胞颗粒重悬在缓冲液R(25%蔗糖,50 mM Tris, pH 7.0, 1.5% Triton X-100, 18.75 mM EDTA)中,补充1 mM PMSF,少量DNAse和RNAse,并在37℃下孵育约30分钟,以刺激细胞在冷冻/解冻过程中释放的内源性溶菌酶的自溶。随后的超声检查也支持细胞破坏。从细胞匀浆的可溶性蛋白和膜蛋白中分离包涵体gydF4y2BaggydF4y2Ba, 15分钟,4°C)。gydF4y2Ba
为了记录异体蛋白合成,使用包涵体部分进行SDS-PAGE、Western-blotting和免疫检测。为此,在缓冲液R中重悬包涵体,并加入适当体积的6倍浓缩样品缓冲介质(375 mM Tris/HCl, pH 6.8, 0.3% SDS, 60%甘油,1.5%溴酚蓝)。蛋白质分离是在一个不连续的变性系统中进行的,其中有3%的堆叠和12%的分离聚丙烯酰胺凝胶[gydF4y2Ba33gydF4y2Ba].电泳后,凝胶进行考马斯氏染色或用于Western-blotting。免疫检测采用单克隆抗多聚His IgG (Sigma;gydF4y2Bahttp://www.sigmaaldrich.comgydF4y2Ba)与二次碱性磷酸酶偶联抗小鼠IgG (Sigma)结合。用硝基蓝氯化四唑/5-溴-4-氯-3 ' -吲哚磷酸甲苯胺盐染色检测碱性磷酸酶活性。gydF4y2Ba
包涵体的纯化gydF4y2Ba
基本上,包涵体的纯化及其增溶、复折叠和整合成脂质/洗涤剂胶束的过程是根据[gydF4y2Ba34gydF4y2Ba].为此,将包涵体部分的细胞颗粒在缓冲液W1 (20 ml 1 M尿素,1% Triton X-100和0.1% β-巯基乙醇)中洗涤。离心后(20,000gydF4y2BaggydF4y2Ba, 15 min, 4℃),将包合体再在缓冲液W2 (20 mM Tris, pH 7.0, 0.5% Triton X-100, 1 mM EDTA, 0.1% β-巯基-乙醇)中洗涤,最后在缓冲液W3 (50 mM Tris, pH 7.0, 1 mM EDTA, 0.1% β-巯基-乙醇)中洗涤。通过在含有1.67%洗涤剂n-月桂醇肌氨酸的缓冲介质S (10 mM Tris, pH 7.0, 0.1 mM EDTA, 1 mM DTT, 0.05%聚乙二醇4000)中重新悬浮,并在冰上孵育15分钟,实现了纯化包涵体蛋白的增溶。用10 mM Tris (pH 7.0)稀释蛋白质部分(三倍),最后,通过离心(12000 g, 4分钟,4°C)将溶解的蛋白质从不溶性聚集物中分离出来。gydF4y2Ba
蛋白质脂质体的制备及转运量的测定gydF4y2Ba
为制备蛋白脂质体,将100 μg可溶性蛋白与20 mM Hepes、pH 7.0和1 mM PMSF混合。为了获得具有内部反交换底物的囊泡,在蛋白质混合物中加入5 mM的磷酸盐或腺嘌呤核苷酸。混合洗涤剂-脂质胶束的制备(100 mM PIPES, pH 7.0, 20 mg磷脂酰胆碱,1.6 mg心磷脂,28 mg CgydF4y2Ba10gydF4y2BaEgydF4y2Ba5gydF4y2Ba)和琥珀石XAD-2珠去除洗涤剂完全按照Heimpel给出的方法进行gydF4y2Ba等gydF4y2Ba, (gydF4y2Ba34gydF4y2Ba].与生物珠孵育一夜完成蛋白质折叠和蛋白质脂质体的形成。用NAP-5柱脱盐,从囊泡(500 μL)中除去外部缓冲介质和负载底物(GE Healthcare;gydF4y2Bahttp://www.gehealthcare.comgydF4y2Ba).平衡色谱柱,用进口缓冲液(50 mM NaCl, 10 mM PIPES, pH 7.5)洗脱脂质体。将50 μL这些蛋白脂质体与50 μL补充了指示浓度[α]的输入缓冲液混合,进行输运测量gydF4y2Ba32gydF4y2BaP] atp,[αgydF4y2Ba32gydF4y2BaP] adp, [gydF4y2Ba45gydF4y2BaCa), MgClgydF4y2Ba2gydF4y2Ba和CaClgydF4y2Ba2gydF4y2Ba30℃孵育。在给定的时间点,通过真空过滤去除外部进口介质而终止进口,详见[gydF4y2Ba35gydF4y2Ba].简单地说,脂质体被装载到预湿过滤器(混合纤维素酯,孔径为0.45 μm;然后用磷酸盐缓冲液快速清洗。输入放射性采用闪烁计数(Beckman LS6500;贝克曼库尔特)。对于[gydF4y2Ba45gydF4y2Ba钙摄取测量进口终止和非进口钙gydF4y2Ba2 +gydF4y2Ba加入EGTA (2 mM),孵育15 s,然后真空过滤和洗涤。gydF4y2Ba
结果gydF4y2Ba
重组植物APCs起ATP、ADP和P的作用gydF4y2Ba我gydF4y2Ba逆向转运gydF4y2Ba
确定不同apc的功能特性gydF4y2Ba答:芥gydF4y2Ba我们用了异源gydF4y2Ba大肠杆菌gydF4y2Ba表达系统生产各自的异构体,并进行运输测量后,载体重组成人工脂囊泡,因此称为脂质体。该方法先前已成功应用于几种MCF蛋白的生物化学特征,包括两种选定的人类SCaMC亚型[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba36gydF4y2Ba- - - - - -gydF4y2Ba38gydF4y2Ba].gydF4y2Ba
3个植物apc均以n端His-tag融合异质表达。就像之前观察到的许多MCF蛋白一样[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba34gydF4y2Ba,gydF4y2Ba36gydF4y2Ba- - - - - -gydF4y2Ba38gydF4y2Ba植物apc也被大量合成,并以不溶性包涵体的形式积累(附加文件gydF4y2Ba1gydF4y2Ba:图S1A和B)。聚集的蛋白质在整合成脂质体的过程中被富集、纯化、增溶并最终重新折叠。gydF4y2Ba
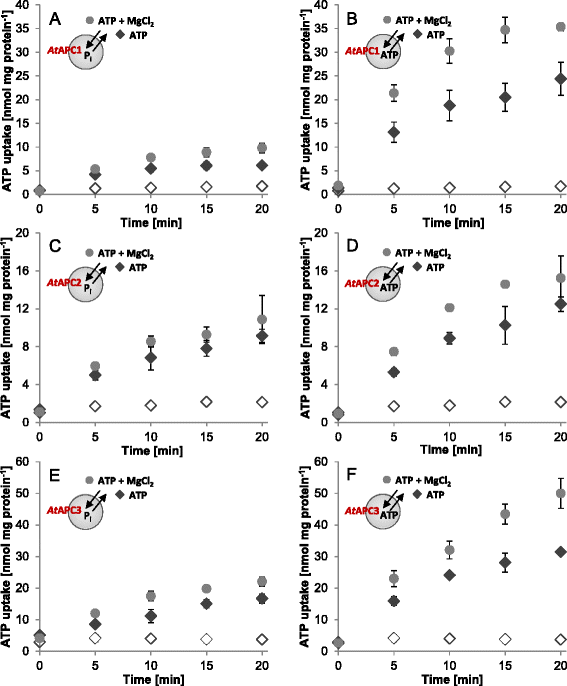
在管腔中对含有或缺乏选择的可能的反交换底物的蛋白质脂质体进行输入测量(图。gydF4y2Ba1gydF4y2Ba,附加文件gydF4y2Ba2gydF4y2Ba:图S2)。这使得调查gydF4y2Ba在体外gydF4y2Ba运输活动,因此重组蛋白的功能以及催化运输模式。所有重组植物APCs均介导[α]的时间依赖性摄取gydF4y2Ba32gydF4y2BaP]-ATP转化为磷酸(PgydF4y2Ba我gydF4y2Ba)负载脂质体(图;gydF4y2Ba1gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba(黑色菱形),在相应的囊泡缺乏磷时,没有观察到类似的放射性积累gydF4y2Ba我gydF4y2Ba在腔内(图;gydF4y2Ba1gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,开菱形)。这一观察已经证明了植物apc可以作为反转运体;ATP / PgydF4y2Ba我gydF4y2Ba不同APC亚型之间的交换至少在5分钟内呈线性gydF4y2Ba在gydF4y2Ba6 nmol/mg蛋白的APC1在10 ~ 15 min后达到(图;gydF4y2Ba1gydF4y2Ba,黑菱形),而gydF4y2Ba在gydF4y2BaAPC2和gydF4y2Ba在gydF4y2BaAPC3表现出略微或相当高的转运速率,分别在20分钟后接近最大值~ 9 nmol/mg蛋白和≥17 nmol/mg蛋白(图2)。gydF4y2Ba1 cgydF4y2Ba而且gydF4y2BaegydF4y2Ba,黑色菱形)。gydF4y2Ba
时间依赖性ATP运输通过gydF4y2Ba在gydF4y2BaAPC1-3。50 μM [αgydF4y2Ba32gydF4y2Ba-ATP变成PgydF4y2Ba我gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba)和进入ATP (gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba)负载重组蛋白脂质体gydF4y2Ba在gydF4y2BaAPC1 (gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba),gydF4y2Ba在gydF4y2BaAPC2 (gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba),gydF4y2Ba在gydF4y2BaAPC3 (gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba).在无500 μM外施MgCl时(黑色菱形)和有500 μM外施MgCl时(灰色圆圈)测量ATP摄取gydF4y2Ba2gydF4y2Ba.无负载脂质体(无填充菱形;阴性对照)仅显示少量的放射性积累,相应的速率不受MgCl的影响gydF4y2Ba2gydF4y2Ba加法。数据代表至少三个独立重复的平均值,并给出标准误差gydF4y2Ba
酵母Sal1p和哺乳动物SCaMCs对游离ATP作为底物有区别,或至少对Mg有偏好gydF4y2Ba2 +gydF4y2Ba-复合物形式的ATP比自由ATP [gydF4y2Ba12gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba39gydF4y2Ba].为了验证这是否也适用于植物apc, MggydF4y2Ba2 +gydF4y2Ba对ATP转运的影响进行分析。为此,在ATP转运介质中添加500 μM MggydF4y2Ba2 +gydF4y2Ba转化~ 80%的游离ATP (ATPgydF4y2Ba4−gydF4y2Ba)变成MggydF4y2Ba2 +gydF4y2Ba-配合形式(ATP-MggydF4y2Ba2−gydF4y2Ba) (gydF4y2Bahttp://maxchelator.stanford.edu/CaMgATPEGTA-TS.htmgydF4y2Ba[gydF4y2Ba40gydF4y2Ba])。ATP-MggydF4y2Ba2−gydF4y2Ba和HPOgydF4y2Ba4gydF4y2Ba2−gydF4y2Ba交换产生电中性输运。如果gydF4y2Ba在gydF4y2BaAPC1和gydF4y2Ba在gydF4y2BaAPC3 Mg的加入gydF4y2Ba2 +gydF4y2Ba引起腺嘌呤核苷酸/P中度(~1.6倍至2.0倍)增加gydF4y2Ba我gydF4y2Ba与ATP之间的交换gydF4y2Ba2 +gydF4y2Ba(表gydF4y2Ba1gydF4y2Ba;无花果。gydF4y2Ba1gydF4y2Ba而且gydF4y2BaegydF4y2Ba,比较灰色圆圈和黑色菱形),而运输由gydF4y2Ba在gydF4y2BaAPC2受到较小程度的刺激(表gydF4y2Ba1gydF4y2Ba;无花果。gydF4y2Ba1 cgydF4y2Ba,比较灰色圆圈和黑色菱形)。gydF4y2Ba
目的:揭示镁的刺激作用gydF4y2Ba2 +gydF4y2Ba对ATP摄取的影响是由于对ATP-Mg作为底物的普遍偏好,或者更确切地说,由于我们研究Mg的相应运输过程的电中性gydF4y2Ba2 +gydF4y2Ba对ATP同质交换的影响。ATP的同位交换是电中性的,但当ATP- mg时发生电致反应gydF4y2Ba2−gydF4y2Ba与ATP交换gydF4y2Ba4−gydF4y2Ba.传输速率的比较表明gydF4y2Ba在gydF4y2BaAPC1高度,gydF4y2Ba在gydF4y2BaAPC3显著和gydF4y2Ba在gydF4y2Ba与相应的ATP/P相比,APC2稍微偏向于ATP同质交换gydF4y2Ba我gydF4y2Bahetero-exchanges(表gydF4y2Ba1gydF4y2Ba;比较图。gydF4y2Ba1gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba与gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,黑色菱形)。此外,三种ATP都有同质交换gydF4y2Ba在gydF4y2BaMg进一步增强了APCsgydF4y2Ba2 +gydF4y2Ba(无花果。gydF4y2Ba1 bgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,比较灰色圆圈和黑色菱形)和Mg的含量gydF4y2Ba2 +gydF4y2Ba依赖性刺激与ATP/P几乎相同gydF4y2Ba我gydF4y2Bahetero-exchange(表gydF4y2Ba1gydF4y2Ba).观察了镁的刺激作用gydF4y2Ba2 +gydF4y2Ba在ATP / PgydF4y2Ba我gydF4y2BaATP/ATP转运表明gydF4y2Ba在gydF4y2BaAPC1和3一般以ATP-Mg为底物gydF4y2Ba在gydF4y2BaAPC2显然只略微偏向MggydF4y2Ba2 +gydF4y2Ba复杂的形式。gydF4y2Ba
因为ADP代表酵母Sal1p和人类SCaMCs的额外底物[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba39gydF4y2Ba我们验证了这种核苷酸是否也由我们的植物同源物运输gydF4y2Ba在体外gydF4y2Ba系统。为此,测量了放射性标记的ADP进入差异负载脂质体的摄取。所有植物APCs均与磷进行异交换,转运ADPgydF4y2Ba我gydF4y2Ba以及与ADP同质交换,无导入发生在未加载的囊泡中(附加文件gydF4y2Ba2gydF4y2Ba:图S2)。ADP运输速率(与PgydF4y2Ba我gydF4y2Ba或ADP)在很大程度上类似于相应的Mg的速率gydF4y2Ba2 +gydF4y2Ba-刺激ATP运输(与PgydF4y2Ba我gydF4y2Ba或ATP)gydF4y2Ba1gydF4y2Ba;比较附加文件gydF4y2Ba2gydF4y2Ba:图S2和图2gydF4y2Ba1gydF4y2Ba).就像观察到的ATP转运一样,所有植物apc都倾向于ADP的同质交换,而不是相应的ADP/PgydF4y2Ba我gydF4y2Ba异交换,这种偏好是非常明显的gydF4y2Ba在gydF4y2BaAPC1之后gydF4y2Ba在gydF4y2Ba最后是APC3gydF4y2Ba在gydF4y2BaAPC2(表gydF4y2Ba1gydF4y2Ba).此外,ATP和ADP同位交换速率与相应的PgydF4y2Ba我gydF4y2Bahetero-exchanges(表gydF4y2Ba1gydF4y2Ba)表明gydF4y2Ba在gydF4y2BaAPC2的对比gydF4y2Ba在gydF4y2BaAPC1和3在核苷酸和P之间没有明显的区别gydF4y2Ba我gydF4y2Ba作为内部计数器交换基板。无负载囊泡诱导ATP或ADP显著导入的无效也表明囊泡不允许标记化合物的载体独立通过。gydF4y2Ba
钙对植物APCs ATP和ADP转运特性有差异影响gydF4y2Ba
多种生理数据表明CagydF4y2Ba2 +gydF4y2Ba-依赖性调节线粒体净腺嘌呤核苷酸传代[gydF4y2Ba16gydF4y2Ba- - - - - -gydF4y2Ba18gydF4y2Ba,gydF4y2Ba39gydF4y2Ba,gydF4y2Ba41gydF4y2Ba].在天然环境中,腺苷酸激酶活性、钙离子活性等因素都有影响gydF4y2Ba2 +gydF4y2Ba-诱导代谢过程,线粒体膜电位,呼吸,MggydF4y2Ba2 +gydF4y2BaATP络合作用等影响内源性和外源性腺苷酸和PgydF4y2Ba我gydF4y2Ba线粒体腺嘌呤核苷酸易位一般也会发生池[gydF4y2Ba42gydF4y2Ba- - - - - -gydF4y2Ba45gydF4y2Ba].gydF4y2Ba
利用重组APCs进行转运研究,为克服干扰性代谢和生理效应,研究Ca的影响提供了一种合适的工具gydF4y2Ba2 +gydF4y2Ba对这个过程有更详细的介绍。然而,值得一提的是,Ca并没有刺激重组的人类SCaMC1的转运gydF4y2Ba2 +gydF4y2Ba除了[gydF4y2Ba12gydF4y2Ba]也gydF4y2Ba在gydF4y2BaAPC1-3在缺乏Ca的情况下已经活跃gydF4y2Ba2 +gydF4y2Ba(图。gydF4y2Ba1gydF4y2Ba和附加文件gydF4y2Ba2gydF4y2Ba:图S2)。这些发现表明CagydF4y2Ba2 +gydF4y2Ba并不是载体激活所必需的,或者说CagydF4y2Ba2 +gydF4y2Ba缓冲介质中存在污染。阳离子的测定(通过离子色谱法)显示,实际上痕迹的两种,CagydF4y2Ba2 +gydF4y2Ba和毫克gydF4y2Ba2 +gydF4y2Ba,分别存在于介质中(~9 μM)。gydF4y2Ba
如果CagydF4y2Ba2 +gydF4y2Ba是载体激活所必需的,并且假设蛋白质脂质体仍然含有一定量的非活性(CagydF4y2Ba2 +gydF4y2Ba-free) APC蛋白,额外添加的CagydF4y2Ba2 +gydF4y2Ba应该会导致运输刺激。研究一种可能的CagydF4y2Ba2 +gydF4y2Ba我们在添加和不添加200 μM Ca时进行了摄取研究gydF4y2Ba2 +gydF4y2Ba.高钙gydF4y2Ba2 +gydF4y2Ba可利用性通常刺激所有三种植物apc的核苷酸摄取(表gydF4y2Ba2gydF4y2Ba).这个观察结果可能指向CagydF4y2Ba2 +gydF4y2Ba-诱导先前不活跃的激活(CagydF4y2Ba2 +gydF4y2Ba自由的)载体蛋白。对人类SCaMC1的两个单独表达的子结构域(n端结构域和跨膜部分)的研究得出结论,n端结构域作为一个盖子,在Ca反应中打开或关闭易位通路gydF4y2Ba2 +gydF4y2Ba可用性(gydF4y2Ba22gydF4y2Ba].已知CagydF4y2Ba2 +gydF4y2Ba仅引起n端结构域的移除,从而激活先前封闭的载流子,同样程度的刺激将与交换底物的种类无关。然而,直接比较CagydF4y2Ba2 +gydF4y2Ba对不同交换的影响表明,对于重组的植物APCs, ATP的刺激程度高于ADP或ATP- mg摄取(表gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
由此我们测定了ATP/P的表观生化参数gydF4y2Ba我gydF4y2Ba和ADP/ATP交换gydF4y2Ba在gydF4y2Ba更详细的装甲运兵车(表gydF4y2Ba3.gydF4y2Ba).随着ATP或ADP浓度的增加,所有重组载体的运输速度接近饱和,并符合简单的Michaelis-Menten动力学(附加文件)gydF4y2Ba3.gydF4y2Ba:图S3)。个人gydF4y2Ba在gydF4y2BaAPC亚型在各自的ADP亲缘关系上存在差异(gydF4y2Ba在gydF4y2BaApc1: 180 μm,gydF4y2Ba在gydF4y2BaAPC2: 374 μM和gydF4y2Ba在gydF4y2BaAPC3: 72 μM),而ATP的亲和性更相似(在68 ~ 113 μM之间)。紧密联系的gydF4y2Ba在gydF4y2BaATP和ADP的APC1或多或少不受Ca的影响gydF4y2Ba2 +gydF4y2Ba而ATP的亲和性gydF4y2Ba在gydF4y2BaAPC2和gydF4y2Ba在gydF4y2BaAPC3增加(1.6倍和2.0倍),ADP亲和力下降(1.4倍和1.9倍)。所有gydF4y2Ba在gydF4y2BaAPC亚型通常表现出较低的最大速度(VgydF4y2Ba马克斯gydF4y2Ba)对ATP转运的影响大于对ADP转运的影响(表gydF4y2Ba3.gydF4y2Ba).因为VgydF4y2Ba马克斯gydF4y2Ba与主动运输载体蛋白的数量成正比,CagydF4y2Ba2 +gydF4y2Ba-依赖的apc激活应反映为V的相同增加gydF4y2Ba马克斯gydF4y2BaADP和ATP的转运。然而,添加额外的CagydF4y2Ba2 +gydF4y2Ba只导致最大ADP V的适度增加(大约增加1.2- 1.5倍)gydF4y2Ba马克斯gydF4y2Ba但刺激了相应的ATP VgydF4y2Ba马克斯gydF4y2Ba(2.0- 2.5倍)的所有三个装甲运兵车,以更大的扩展。gydF4y2Ba
CagydF4y2Ba2 +gydF4y2Ba对ATP和ADP输运特性的研究表明,Ca除具有去除帽层和激活载流子的功能外,还具有一定的活性gydF4y2Ba2 +gydF4y2Ba在衬底传输/识别中发挥额外的作用。gydF4y2Ba
CagydF4y2Ba2 +gydF4y2Ba影响覆盖MggydF4y2Ba2 +gydF4y2Ba对ATP转运的影响gydF4y2Ba
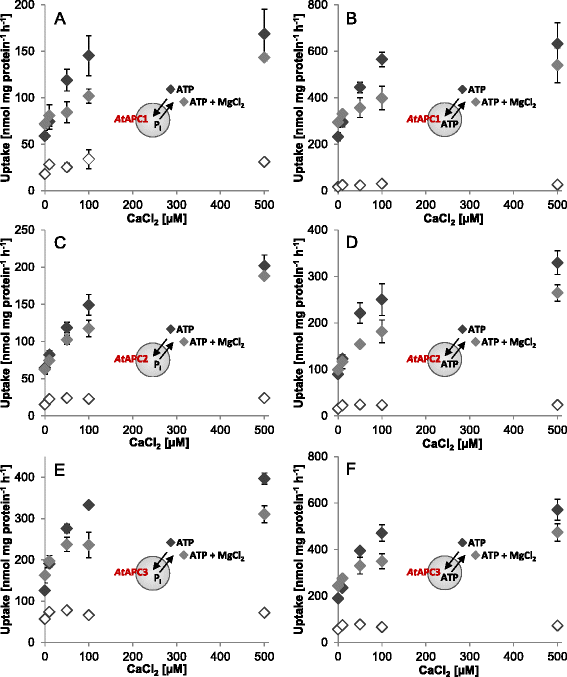
探讨钙的作用gydF4y2Ba2 +gydF4y2Ba在植物APC介导的转运过程中,重要的是要记住ATP可以与Mg形成复合物gydF4y2Ba2 +gydF4y2Ba以及与CagydF4y2Ba2 +gydF4y2Ba因此,可以想象植物装甲运兵车能够转运ATP-CagydF4y2Ba在体外gydF4y2Ba.gydF4y2Ba
Ca的比较gydF4y2Ba2 +gydF4y2Ba对ATP和ATP- mg运输的影响确实揭示了支持这一假设的有趣结果。毫克gydF4y2Ba2 +gydF4y2Ba加法导致边际(gydF4y2Ba在gydF4y2BaAPC2)至中度(gydF4y2Ba在gydF4y2Ba不增加Ca时,APC1和3)ATP转运增加gydF4y2Ba2 +gydF4y2Ba存在(图;gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba).随着Ca的上升gydF4y2Ba2 +gydF4y2Ba浓度对Mg的正向影响gydF4y2Ba2 +gydF4y2Ba被废除,甚至恢复到一个消极的(图。gydF4y2Ba2gydF4y2Ba).更准确地说,有更高的CagydF4y2Ba2 +gydF4y2Ba浓度(>10 μMgydF4y2Ba在gydF4y2BaAPC2;> 50 μmgydF4y2Ba在gydF4y2BaAPC1和3)缺乏Mg时ATP转运速率gydF4y2Ba2 +gydF4y2Ba大于Mg存在时相应的交换速率gydF4y2Ba2 +gydF4y2Ba.因此,Mg存在时gydF4y2Ba2 +gydF4y2Ba高浓度CagydF4y2Ba2 +gydF4y2Ba显然是达到atp传输饱和所必需的。gydF4y2Ba
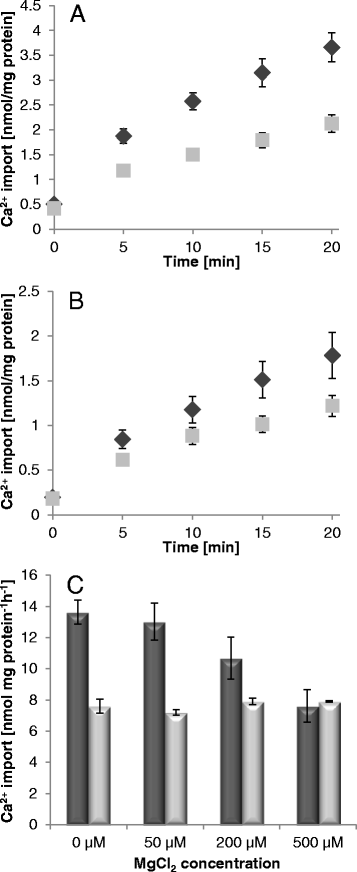
CagydF4y2Ba2 +gydF4y2Ba-对ATP转运的影响gydF4y2Ba在gydF4y2BaAPC1-3。Ca上升效应gydF4y2Ba2 +gydF4y2Ba-浓度(0 ~ 500 μM)对重组蛋白介导转运的影响gydF4y2Ba在gydF4y2BaAPC1 (gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba),gydF4y2Ba在gydF4y2BaAPC2 (gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba),gydF4y2Ba在gydF4y2BaAPC3 (gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba).50 μM [αgydF4y2Ba32gydF4y2BaP]-ATP在不存在(黑菱形)和存在补充MgCl的情况下进行gydF4y2Ba2gydF4y2Ba(灰色菱形)。允许运输5分钟,并给予nmol mg蛋白gydF4y2Ba−1gydF4y2BahgydF4y2Ba−1gydF4y2Ba.CagydF4y2Ba2 +gydF4y2BaATP/P依赖性刺激gydF4y2Ba我gydF4y2Bahetero-exchanges (gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba)和ATP/ATP同质交换(gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba).无负载脂质体(无填充菱形;阴性对照)显示ATP仅少量积累,相应的速率不受MgCl的影响gydF4y2Ba2gydF4y2Ba加法。数据表示三个独立重复的平均值,给出了标准误差gydF4y2Ba
Ca刺激ATP转运gydF4y2Ba2 +gydF4y2Ba不涉及n端畴gydF4y2Ba
我们选择gydF4y2Ba在gydF4y2BaAPC2对所提出的ATP-Ca转运进行了更详细的分析,因为这种转运体的ATP摄取明显受到Ca的刺激gydF4y2Ba2 +gydF4y2Ba特别是因为CagydF4y2Ba2 +gydF4y2BaMg对刺激的影响很小gydF4y2Ba2 +gydF4y2Ba(图。gydF4y2Ba2gydF4y2Ba).研究ATP-Ca传输与可能的Ca断开gydF4y2Ba2 +gydF4y2Ba依赖于载波激活,我们生成了一个gydF4y2Ba在gydF4y2BaAPC2突变蛋白缺乏预测的n端结构域(附加文件gydF4y2Ba4gydF4y2Ba:图S4A和B)。ATP摄取测量验证了截断gydF4y2Ba在gydF4y2BaAPC2功能正常(附加文件gydF4y2Ba4gydF4y2Ba:图S4C),但摄取率略低于全长蛋白。gydF4y2Ba
钙的测定gydF4y2Ba2 +gydF4y2BaATP/P对转运活性的影响gydF4y2Ba我gydF4y2Ba钙的增加显著促进了突变载体间的交换gydF4y2Ba2 +gydF4y2Ba浓度(~三倍)。此外,CagydF4y2Ba2 +gydF4y2Ba依赖性刺激和相应运输的一般过程与全长蛋白基本相似(图2)。gydF4y2Ba3.gydF4y2Ba,黑色方块)。研究ADP吸收到负载ATP脂质体显示低钙对全长蛋白的轻微运输刺激gydF4y2Ba2 +gydF4y2Ba浓度(~ 35%,在50 ~ 100 μM CagydF4y2Ba2 +gydF4y2Ba),在较高浓度(+ 60%)时接近饱和(图。gydF4y2Ba3gydF4y2Ba(灰色圆圈),而截断载流子版本的相应输运基本不受适量Ca的影响gydF4y2Ba2 +gydF4y2Ba浓度(+/−10%直到200 μM CagydF4y2Ba2 +gydF4y2Ba),只在较高Ca时才会受到刺激gydF4y2Ba2 +gydF4y2Ba浓度(+ 50%)gydF4y2Ba3 bgydF4y2Ba(灰色圆圈)。gydF4y2Ba
CagydF4y2Ba2 +gydF4y2Ba-对全长和n端截断的ATP和ADP转运的影响gydF4y2Ba在gydF4y2BaAPC2。重组转运gydF4y2Ba在gydF4y2BaAPC2 (gydF4y2Ba一个gydF4y2Ba),并通过缺少n端结构域的突变版本(gydF4y2BabgydF4y2Ba).[α]的进口gydF4y2Ba32gydF4y2Ba-ATP变成PgydF4y2Ba我gydF4y2Ba负载蛋白脂质体(黑色方块)和[αgydF4y2Ba32gydF4y2BaP]-ADP进入装载ATP的囊泡(灰色圆圈)5分钟gydF4y2Ba2gydF4y2Ba被设置为100%,在外部添加的氯化钙浓度上升的情况下运输gydF4y2Ba2gydF4y2Ba(0 ~ 500 μM)。数据代表ATP/P的净值gydF4y2Ba我gydF4y2Ba以及三个独立重复的ADP/ATP摄取减去各自的对照(无负载囊泡)。给出了标准误差gydF4y2Ba
尽管CagydF4y2Ba2 +gydF4y2Ba-冲击均可检测,Ca的影响较高gydF4y2Ba2 +gydF4y2Ba在ATP上比在ADP上的导入明显独立于n端结构域的存在与否。这一结果验证了所观察到的CagydF4y2Ba2 +gydF4y2Ba依赖于ATP转运的刺激主要不是由载体激活引起的,而是由ATP- ca形成和底物可用性增加引起的。gydF4y2Ba
ATP而不是ADP的输入gydF4y2Ba在gydF4y2BaAPC2需要二价阳离子的存在gydF4y2Ba
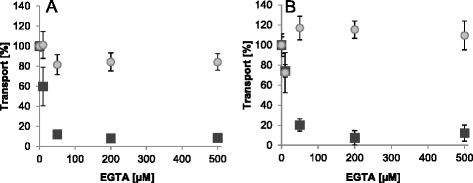
因为全身的gydF4y2Ba在gydF4y2BaAPC2已经显示基本的ATP/PgydF4y2Ba我gydF4y2Ba没有额外Ca的交换活动gydF4y2Ba2 +gydF4y2Ba特别是因为ADP的吸收不会受到Ca上升的高度刺激gydF4y2Ba2 +gydF4y2Ba浓度(无花果。gydF4y2Ba3.gydF4y2Ba)时,可以认为由于Ca污染,大多数重组载体已经被打开/激活gydF4y2Ba2 +gydF4y2Ba.gydF4y2Ba
阳离子螯合剂EGTA能有效螯合钙gydF4y2Ba2 +gydF4y2Ba与Mg的亲和度显著高于MggydF4y2Ba2 +gydF4y2Ba),并相应去除残留CagydF4y2Ba2 +gydF4y2Ba从媒介。因此,我们使用EGTA添加到运输介质中来研究CagydF4y2Ba2 +gydF4y2Ba耗竭影响载体活动。ATP / PgydF4y2Ba我gydF4y2Ba全长交换gydF4y2Ba在gydF4y2Ba加入10 μM EGTA后,APC2显著降低,浓度增加后,APC2完全抑制(图2)。gydF4y2Ba4gydF4y2Ba,黑色方块)。有趣的是,截断载体版本也观察到类似的抑制作用(图2)。gydF4y2Ba4 bgydF4y2Ba,黑色方块)。考虑到n端结构域形成一个盖子,实际上关闭了Ca释放时的易位途径gydF4y2Ba2 +gydF4y2Ba是缺失的,高效CagydF4y2Ba2 +gydF4y2Ba-移除应妨碍运输活动gydF4y2Ba在gydF4y2BaAPC2,而不是“无帽”突变体。此外,全长和截短的ADP/ATP交换,gydF4y2Ba在gydF4y2Ba添加EGTA后,APC2变体或多或少保持不变(图2)。gydF4y2Ba4gydF4y2Ba而且gydF4y2BabgydF4y2Ba(灰色圆圈)。因此,CagydF4y2Ba2 +gydF4y2Ba从介质中去除并不会使重组载体失活而导致整体运输能力的抑制。gydF4y2Ba
EGTA浓度升高对全长和n端截断腺嘌呤核苷酸转运的影响gydF4y2Ba在gydF4y2BaAPC2。重组转运gydF4y2Ba在gydF4y2BaAPC2 (gydF4y2Ba一个gydF4y2Ba),并通过缺少n端结构域的突变版本(gydF4y2BabgydF4y2Ba).[α]的进口gydF4y2Ba32gydF4y2Ba-ATP变成PgydF4y2Ba我gydF4y2Ba负载蛋白脂质体(黑色方块)和[αgydF4y2Ba32gydF4y2Ba允许P]- adp进入ATP负载的囊泡(灰色圆圈)5分钟。无EGTA的转运量设置为100%,并相应计算外部添加的EGTA浓度上升(0 - 500 μM)时的转运量。数据代表ATP/P的净值gydF4y2Ba我gydF4y2Ba和ADP/ATP输入减去三个独立重复的各自对照(无负载囊泡)。给出了标准误差gydF4y2Ba
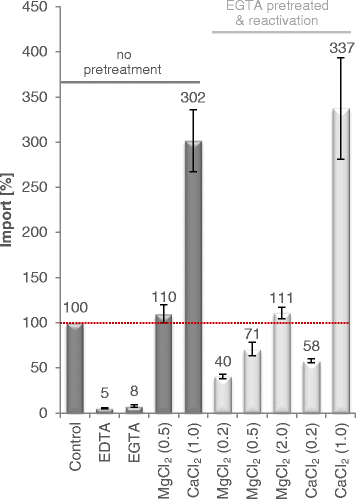
有趣的是,通过gydF4y2Ba在gydF4y2BaAPC2不仅被EGTA阻断,还被二价阳离子螯合剂EDTA阻断。此外,Ca和Ca均可完全恢复egta抑制载体的活性gydF4y2Ba2 +gydF4y2Ba或毫克gydF4y2Ba2 +gydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Ba).然而,当与CagydF4y2Ba2 +gydF4y2Ba高浓度MggydF4y2Ba2 +gydF4y2Ba是转运再活化/刺激所必需的。gydF4y2Ba
egta抑制ATP运输通过gydF4y2Ba在gydF4y2BaAPC2和MgCl的再活化gydF4y2Ba2gydF4y2Ba和CaClgydF4y2Ba2gydF4y2Ba.50 μM [αgydF4y2Ba32gydF4y2Ba-ATP变成PgydF4y2Ba我gydF4y2Ba不含EGTA、MgCl的负载囊泡gydF4y2Ba2gydF4y2Ba和CaClgydF4y2Ba2gydF4y2Ba设置为100%(对照组;红色的线)。在200 μM EGTA、200 μM EDTA和给定浓度(单位:mM)的MgCl存在下的输运gydF4y2Ba2gydF4y2Ba或CaClgydF4y2Ba2gydF4y2Ba据此计算。一般允许转运10分钟。然而,在摄取10分钟后,通过随后添加MgCl, egta抑制的转运被重新激活gydF4y2Ba2gydF4y2Ba或CaClgydF4y2Ba2gydF4y2Ba再次静置10 min (EGTA预处理和再活化;浅灰色条)。数据表示净值(ATP输入与PgydF4y2Ba我gydF4y2Ba减去无负载蛋白质脂质体的背景值),是三个独立实验的平均值。说明了标准误差gydF4y2Ba
到目前为止,我们还不能明确地解释为什么只有ATP的转运,而不是一般的载流子活性被EGTA抑制。可以想象全长gydF4y2Ba在gydF4y2BaAPC2蛋白主要或仅以内向外的方向插入,将n端结构域暴露在脂质体内部。这种定位显然会阻碍EGTA进入监管位点(EF-Hands)。然而,gydF4y2Ba在gydF4y2Baapc2 -蛋白脂质体装载PgydF4y2Ba我gydF4y2Ba和200 μM的EGTA仍然能够导入ATP(78%对应的EGTA未受影响的传输)(附加文件gydF4y2Ba5gydF4y2Ba:图S5)。此外,体外EGTA抑制ATP进入这些负载EGTA的脂质体以及500 μM体外Ca(再)激活ATPgydF4y2Ba2 +gydF4y2Ba与标准相比几乎完全相同gydF4y2Ba在gydF4y2Ba缺乏内部EGTA的apc2 -蛋白脂质体(附加文件gydF4y2Ba5gydF4y2Ba:图S5)。gydF4y2Ba
综上所述,得到的结果表明ATP转运,而不是ADP或PgydF4y2Ba我gydF4y2Ba运输gydF4y2Ba在gydF4y2BaAPC2本质上需要二价阳离子的存在,这一要求与n端结构域无关,因此与载体激活无关。gydF4y2Ba
植物APC2可介导CagydF4y2Ba2 +gydF4y2Ba可以把gydF4y2Ba在体外gydF4y2Ba
观察到的CagydF4y2Ba2 +gydF4y2Ba和EGTA效应gydF4y2Ba在gydF4y2BaAPC2活性使我们得出结论,CagydF4y2Ba2 +gydF4y2Ba可能在ATP转运中起重要的共底物作用。验证所建议的能力gydF4y2Ba在gydF4y2BaAPC2对脂质体系统中ATP-Ca转运的影响gydF4y2Ba45gydF4y2BaCa]和100 μM非标记ATP。初步分析显示,由于高度非特异性,进口汇率的读出受到阻碍[gydF4y2Ba45gydF4y2BaCa]-与脂质体表面磷脂的相互作用(导致高放射性背景值)。然而,减少这些非特定背景计数通过删除绝大多数[gydF4y2Ba45gydF4y2Ba在摄取测量之后(在真空过滤和洗涤之前),通过对囊泡进行额外的EGTA处理,从脂质体表面获得Ca]。相应修改的传输试验允许测定少量但显著的时间依赖性钙gydF4y2Ba2 +gydF4y2Ba全长度和截短的摄取gydF4y2Ba在gydF4y2BaAPC2。gydF4y2Ba
CagydF4y2Ba2 +gydF4y2BaP吸收gydF4y2Ba我gydF4y2Ba载囊泡(图;gydF4y2Ba6gydF4y2Ba而且gydF4y2BabgydF4y2Ba,黑色菱形)总是超过无负载蛋白质脂质体获得的相应速率(图。gydF4y2Ba6gydF4y2Ba而且gydF4y2BabgydF4y2Ba,灰色方框),表明CagydF4y2Ba2 +gydF4y2Ba积累与载体的反端口活性直接相关。全长蛋白钙含量较高gydF4y2Ba2 +gydF4y2Ba与截断后的版本相比,未加载囊泡的传输速率和背景值都有所增强。gydF4y2Ba6gydF4y2Ba而且gydF4y2BabgydF4y2Ba).到目前为止,即使EGTA处理也不能辨别一定量的CagydF4y2Ba2 +gydF4y2Ba仍然与重组蛋白的n端结构域结合gydF4y2Ba在gydF4y2BaAPC2或/和截断蛋白的功能通常会轻微受损。gydF4y2Ba
钙的测定gydF4y2Ba2 +gydF4y2Ba运输通过gydF4y2Ba在gydF4y2BaAPC2。时间依赖性摄取[gydF4y2Ba45gydF4y2BaCa] via full-lengthgydF4y2Ba在gydF4y2BaAPC2 (gydF4y2Ba一个gydF4y2Ba),并通过n端截断gydF4y2Ba在gydF4y2BaAPC2 (gydF4y2BabgydF4y2Ba)重组成PgydF4y2Ba我gydF4y2Ba(黑色菱形)和非负载脂质体(灰色方块)。(gydF4y2BacgydF4y2Ba) MgCl上升的影响gydF4y2Ba2gydF4y2Ba浓度在[gydF4y2Ba45gydF4y2Baa .运输成gydF4y2Ba我gydF4y2Ba已装载(深灰色条)和未装载(浅灰色条)gydF4y2Ba在gydF4y2BaAPC2 proteoliposomes。传输介质为20 μM [gydF4y2Ba45gydF4y2BaCa],并添加100 μM无标记ATP和指定浓度的MgClgydF4y2Ba2gydF4y2Ba.用于Mg的测定gydF4y2Ba2 +gydF4y2BaCa的-效应gydF4y2Ba2 +gydF4y2Ba运输通过gydF4y2Ba在gydF4y2Ba允许APC2摄取10分钟(以nmol mg蛋白给予)gydF4y2Ba−1gydF4y2BahgydF4y2Ba−1gydF4y2Ba).数据表示三个独立重复的平均值。说明了标准误差gydF4y2Ba
最后,我们分析了Mg的影响gydF4y2Ba2 +gydF4y2Ba在CagydF4y2Ba2 +gydF4y2Ba重组进口gydF4y2Ba在gydF4y2BaAPC2。对于这个PgydF4y2Ba我gydF4y2Ba装载和非装载gydF4y2Ba在gydF4y2BaAPC2蛋白脂质体在含20 μM的转运介质中孵育[gydF4y2Ba45gydF4y2BaCa], 100 μM非标记ATP和Mg浓度增加gydF4y2Ba2 +gydF4y2Ba.[gydF4y2Ba45gydF4y2Ba钙离子在镁的作用下显著减少了钙离子在载磷酸盐囊泡中的输入gydF4y2Ba2 +gydF4y2Ba而未负载囊泡的相应速率或多或少不受Mg的影响gydF4y2Ba2 +gydF4y2Ba(图。gydF4y2Ba6摄氏度gydF4y2Ba).镁含量相当高gydF4y2Ba2 +gydF4y2Ba(200 μM)可引起大约一半的最大运输抑制,而过量Mg则达到25倍gydF4y2Ba2 +gydF4y2Ba完全阻滞CagydF4y2Ba2 +gydF4y2Ba吸收。因为普遍的低[gydF4y2Ba45gydF4y2BaCa]截断后的输运速率gydF4y2Ba在gydF4y2BaAPC2对该蛋白得到的相应结果的可靠解释是复杂的。然而,MggydF4y2Ba2 +gydF4y2Ba对钙的影响gydF4y2Ba2 +gydF4y2Ba摄取通常类似于全长蛋白质(附加文件gydF4y2Ba6gydF4y2Ba:图S6)。所得数据表明MggydF4y2Ba2 +gydF4y2Ba与Ca竞争gydF4y2Ba2 +gydF4y2Ba从而降低ATP-Ca的有效性,从而降低CagydF4y2Ba2 +gydF4y2Ba-通过重组载体进口。gydF4y2Ba
讨论gydF4y2Ba
植物apc的运输能力允许能量交换以及净腺嘌呤核苷酸供应gydF4y2Ba
不同的生物条件,如线粒体生物发生期间的atp负载或生理和环境变化,都需要调节线粒体腺嘌呤核苷酸库的大小[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].在过去的几十年里,人们对哺乳动物和酵母中腺嘌呤核苷酸进出细胞器以及相关载体的净流入或流出进行了深入研究[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba,gydF4y2Ba14gydF4y2Ba- - - - - -gydF4y2Ba18gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].然而,我们对植物中的这些过程所知甚少。gydF4y2Ba
很明显,植物线粒体也必须根据各自的代谢需求调整线粒体基质中的腺嘌呤核苷酸浓度。早在20世纪70年代,分离的玉米和花椰菜线粒体就被证明对腺嘌呤核苷酸(羧基)苍术苷不敏感(不依赖AAC)摄取[gydF4y2Ba26gydF4y2Ba- - - - - -gydF4y2Ba28gydF4y2Ba].起初,ADP进入植物线粒体的净输入被确定为通过与P的交换发生gydF4y2Ba我gydF4y2Ba[gydF4y2Ba31gydF4y2Ba].随后研究表明,Mg对ADP输运有影响gydF4y2Ba2 +gydF4y2Ba和CagydF4y2Ba2 +gydF4y2Ba表明磷是外生的,而不是内源性的gydF4y2Ba我gydF4y2Ba驱动净ADP摄取[gydF4y2Ba29gydF4y2Ba].这些不一致可能是由于线粒体中含有各种直接或间接参与腺嘌呤核苷酸转运和代谢的载体和酶,这些蛋白质受到各自的测试条件和细胞器代谢状态的不同影响。gydF4y2Ba
拟南芥gydF4y2Ba编码三个MCF蛋白(gydF4y2Ba在gydF4y2BaAPC1-3)代表有希望的腺嘌呤核苷酸净转运候选者。首先,gydF4y2Ba在gydF4y2BaAPC1-3与来自动物或酵母的apc具有显著的氨基酸相似性,并包含具有EF-hand基序的特征n端结构域(附加文件)gydF4y2Ba7gydF4y2Ba:图S7和附加文件gydF4y2Ba8gydF4y2Ba:图S8)。其次,这些蛋白可以补偿酵母的生长缺陷∆gydF4y2Basal1pgydF4y2Ba突变体在AAC介导的转运中受到抑制[gydF4y2Ba32gydF4y2Ba].第三,在本工作中对重组载体进行的运输试验表明gydF4y2Ba在gydF4y2BaAPC1-3在严格反口模式下起作用。gydF4y2Ba1gydF4y2Ba,附加文件gydF4y2Ba2gydF4y2Ba:图S2);它们可以催化ATP和ADP的同位交换以及ATP/ADP的异位交换,最重要的是ATP和ADP与P的异位交换gydF4y2Ba我gydF4y2Ba在体外gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Ba,附加文件gydF4y2Ba2gydF4y2Ba:图S2,表格gydF4y2Ba1gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba).后一种能力也在Palmieri及其同事最近发表的一项研究中得到了证明,该研究是在本手稿正在修订时发表的[gydF4y2Ba47gydF4y2Ba].基于gydF4y2Ba在体外gydF4y2Ba三种酵母互补试验的生长恢复特点gydF4y2Ba在gydF4y2BaAPC亚型[gydF4y2Ba32gydF4y2Ba]可以归因于它们的净腺嘌呤核苷酸供应能力(Sal1p活性的补充)和/或能量供应能力(AAC活性的补充)。gydF4y2Ba
植物线粒体具有对AAC特异性抑制剂敏感的高亲和ADP吸收系统和显然不涉及AAC活性的低亲和ADP吸收系统[gydF4y2Ba30.gydF4y2Ba].单亚型的生化特征表明AAC蛋白介导高亲和力ADP转运[gydF4y2Ba48gydF4y2Ba而APCs催化或促进低亲和性ADP转运(表gydF4y2Ba3.gydF4y2Ba) [gydF4y2Ba47gydF4y2Ba].gydF4y2Ba
有趣的是,APC基因在增强线粒体传播的生长组织中或多或少普遍表达,且表达率最高(Aramemnon, BAR eFP browser;[gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba])。Palmieri和同事最近的研究表明gydF4y2BaAtapc1gydF4y2Ba与其余两种APC亚型相比,具有更强的活性[gydF4y2Ba47gydF4y2Ba].此外,特异性异构体的表达(Aramemnon, genevestikator [gydF4y2Ba49gydF4y2Ba,gydF4y2Ba51gydF4y2Ba])是由促进生长的植物类固醇(油菜素类固醇)或对非生物应激源(如缺氧或磷酸盐限制)的反应诱导的;假定与线粒体代谢/呼吸改变有关的情况[gydF4y2Ba45gydF4y2Ba,gydF4y2Ba47gydF4y2Ba,gydF4y2Ba52gydF4y2Ba- - - - - -gydF4y2Ba54gydF4y2Ba].在未来的研究中,确定以APC表达增强或减少为特征的特定发育阶段或应激情况是否与线粒体腺嘌呤核苷酸库的建立或改变相关将是有趣的。gydF4y2Ba
基板偏好及二价阳离子对输运的影响gydF4y2Ba
事实上,重组gydF4y2Ba在gydF4y2BaAPC3和gydF4y2Ba在gydF4y2BaAPC1明显倾向于ATP和ADP的同质交换,而不是与P的异质交换gydF4y2Ba我gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Ba,附加文件gydF4y2Ba2gydF4y2Ba:图S2)可能表明由于电致异质交换在脂质体中产生了不利的电荷不平衡而导致运输减少。类似于酵母和哺乳动物线粒体对ATP的净吸收[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba18gydF4y2BaATP转运gydF4y2Ba在gydF4y2BaAPC1和gydF4y2Ba在gydF4y2BaMg显著刺激APC3gydF4y2Ba2 +gydF4y2Ba(无花果。gydF4y2Ba1gydF4y2Ba、表gydF4y2Ba1gydF4y2Ba).这种刺激发生在同性和异性交换的过程中,这表明gydF4y2Ba在gydF4y2BaAPC1和gydF4y2Ba在gydF4y2BaAPC3一般偏好ATP-MggydF4y2Ba2−gydF4y2Ba在ATPgydF4y2Ba4−gydF4y2Ba由于导入衬底独立产生电荷不平衡。gydF4y2Ba
相比之下gydF4y2Ba在gydF4y2BaAPC1和gydF4y2Ba在gydF4y2BaAPC3,重组蛋白的异质交换率gydF4y2Ba在gydF4y2BaAPC2非常相似(图。gydF4y2Ba1gydF4y2Ba,附加文件gydF4y2Ba2gydF4y2Ba:图S2)和ATP摄取仅轻微增强MggydF4y2Ba2 +gydF4y2Ba(图。gydF4y2Ba1 cgydF4y2Ba而且gydF4y2BadgydF4y2Ba).这些观察表明,要么强烈的偏好gydF4y2Ba在gydF4y2BaAPC2 for PgydF4y2Ba我gydF4y2Ba作为交换底物补偿ATP/P电荷不平衡可能带来的负面影响gydF4y2Ba我gydF4y2Ba(ADP / PgydF4y2Ba我gydF4y2Ba)异交换或PgydF4y2Ba我gydF4y2Ba一点都不产电。有趣的是,ATP转运gydF4y2Ba在gydF4y2BaEGTA和EDTA完全抑制APC2, Mg可恢复APC2gydF4y2Ba2 +gydF4y2Ba或CagydF4y2Ba2 +gydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Ba).这一结果有力地证明了ATP易位需要二价阳离子。这是否由于它们作为共底物和/或作为载体蛋白的效应器的功能还不能明确地说明。gydF4y2Ba
与我们的研究相反,Palmieri和同事研究了ATP- mg作为输出底物而不是输入底物的能力,在这些条件下,与ATP相比,ATP- mg的转运相当不利[gydF4y2Ba47gydF4y2Ba].总之,目前的数据表明,植物apc在其外部和内部具有不同的基质偏好(图2)。gydF4y2Ba1gydF4y2Ba、表gydF4y2Ba1gydF4y2Ba) [gydF4y2Ba47gydF4y2Ba].gydF4y2Ba
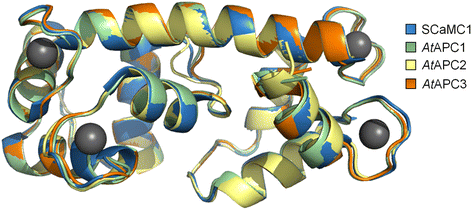
尽管CagydF4y2Ba2 +gydF4y2Ba人类和酵母APCs的依赖活性调控早已为人所知,对其机制的初步认识是最近才开始的。与人类SCaMC1的复杂相互作用研究表明,在缺乏CagydF4y2Ba2 +gydF4y2Ba相当灵活的n端结构域覆盖了跨膜部分,而CagydF4y2Ba2 +gydF4y2Ba-结合使n端结构域变成更刚性的状态,从而导致其解离和易位孔的打开[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba22gydF4y2Ba].在结构排列中叠加相应区域,可见植物APCs和人类SCaMC1的n端结构域之间高度保守(图1)。gydF4y2Ba7gydF4y2Ba).这些结构的相似性以及基于计算机的对接分析(附加文件)gydF4y2Ba8gydF4y2Ba:图S8)表明植物apc的n端结构域也与4个Ca相互作用gydF4y2Ba2 +gydF4y2Ba离子。此外,与Sal1p和人类SCaMC亚型氨基酸序列的相似性表明,植物的apc同样受到Ca的调控gydF4y2Ba2 +gydF4y2Ba(附加文件gydF4y2Ba7gydF4y2Ba:图S7,gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
的n端结构域的结构对齐gydF4y2Ba在gydF4y2BaAPC1-3和人类SCaMC1。的三维同调模型gydF4y2Ba在gydF4y2BaAPC1(残基34-189,绿色)gydF4y2Ba在gydF4y2BaAPC2(残基38-194,黄色)和gydF4y2Ba在gydF4y2BaAPC3(残基35-189,橙色)。基于Ca的晶体结构,利用HHPred服务器和modeler构建了n端结构域gydF4y2Ba2 +gydF4y2Ba-binding人SCaMC1 n端结构域(蓝色;PDB ID: 4N5X)与四个钙离子(灰色球体)配合物。使用PyMOL (version 1.3)进行序列比对,然后对模型进行结构叠加。gydF4y2Ba
事实上,重组的APC亚型来自人类[gydF4y2Ba12gydF4y2Ba),gydF4y2Ba答:芥gydF4y2Ba不需要额外的CagydF4y2Ba2 +gydF4y2Ba-加法导致了CagydF4y2Ba2 +gydF4y2Ba缓冲介质中的污染物足以使载体活化。因为Ca的增加gydF4y2Ba2 +gydF4y2Ba-浓度导致所有重组蛋白的转运刺激gydF4y2Ba在gydF4y2BaAPC异构体可以推断,在重组条件下,活性和非活性载体混合发生,并添加CagydF4y2Ba2 +gydF4y2Ba从而激活额外的载体(图;gydF4y2Ba2gydF4y2Ba).然而,CagydF4y2Ba2 +gydF4y2Ba-刺激是不相同的,不同的取决于运输的底物的种类(表gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
假设CagydF4y2Ba2 +gydF4y2Ba仅通过易位途径中n端结构域的位移在载体激活中起作用,我们将期望相同程度的(i) CagydF4y2Ba2 +gydF4y2Ba-依赖输运刺激,(iigydF4y2Ba马克斯gydF4y2Ba增加(与功能载流子数量成正比),(iii) Ca的输运减少gydF4y2Ba2 +gydF4y2Ba-消耗(与EGTA)独立于交换的底物。此外,n端结构域的截断将导致不受Ca影响的持续活性载流子gydF4y2Ba2 +gydF4y2Ba.然而,这项工作中获得的数据表明情况并非如此。因此我们假设gydF4y2Ba在体外gydF4y2Ba系统ATP- ca作为植物APCs的底物,甚至优于ATP- mg或游离ATP。相比之下,与免费ADP相比,ADP- ca似乎受到了很大的歧视。CagydF4y2Ba2 +gydF4y2Ba-诱导的表观转运亲和性改变很可能反映了各自APC亚型的这些特定底物偏好,例如,较高的ATP- ca偏好(与mg复合物或游离ATP相比),而较低的ADP- ca偏好(与游离ADP相比)(表2)gydF4y2Ba3.gydF4y2Ba).因此,CagydF4y2Ba2 +gydF4y2BaATP的络合增强了有利底物的数量,而ADP的络合减少了相应的重组蛋白的转运能力。也可以想象,在脂质体系统中,CagydF4y2Ba2 +gydF4y2Ba与ATP的共输运阻止了ATP/P的电荷积累gydF4y2Ba我gydF4y2Ba异交换和与ADPgydF4y2Ba3−gydF4y2Ba(ADP-CagydF4y2Ba1−gydF4y2Ba)增强了ADP/ATP异交换引起的不平衡。此外,EGTA、EDTA、MggydF4y2Ba2 +gydF4y2Ba和CagydF4y2Ba2 +gydF4y2Ba对ATP运输的抑制、刺激或再激活表明这些阳离子在复合物形成过程中存在竞争,并为ATP- ca作为电位提供了进一步的证据gydF4y2Ba在体外gydF4y2Ba重组植物apc底物(表gydF4y2Ba2gydF4y2Ba和无花果。gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba).我们认为,CagydF4y2Ba2 +gydF4y2Ba对重组apc传输的影响是多种因素的结果,如衬底偏好,电荷积累/补偿和与Mg的竞争gydF4y2Ba2 +gydF4y2Ba在复杂的形成过程中。gydF4y2Ba
输运特征gydF4y2Ba在gydF4y2BaAPC2和n端截断版本支持了Ca刺激atp转运的假设gydF4y2Ba2 +gydF4y2Ba不是(或不完全是)由激活以前不活跃的(CagydF4y2Ba2 +gydF4y2Ba无)的运营商。Ca可促进全长载体和截短载体的ATP转运gydF4y2Ba2 +gydF4y2Ba并被EGTA抑制,而ADP的转运没有受到显著影响(图。gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba).这些结果证实了只有ATP而不是ADP的转运活性高度依赖于Ca的存在gydF4y2Ba2 +gydF4y2Ba除去阳离子一般不会导致载流子失活。EGTA在抑制总转运活性方面的无效是令人惊讶的。植物apc一般不受Ca调控的可能性gydF4y2Ba2 +gydF4y2Ba依赖性的方式显然不适用。植物、酵母和哺乳动物异构体的重要结构相似性提示了类似的调控原则,但最重要的是,Palmieri和同事最近的研究可能证明了相应的调控。gydF4y2Ba47gydF4y2Ba].目前尚不清楚我们是否gydF4y2Ba在体外gydF4y2Ba研究了重组蛋白n端结构域的功能gydF4y2Ba在gydF4y2BaAPC2以某种方式受损或其与Ca的亲和力受损gydF4y2Ba2 +gydF4y2Ba高于EGTA。然而,这种由内而外的取向重构了可能性gydF4y2Ba在gydF4y2Ba可以排除APC2和n端结构域的不可达性导致EGTA在转运抑制中的无效,因为内部装载EGTA的蛋白脂质体仍然能够输入ATP与P交换gydF4y2Ba我gydF4y2Ba(附加文件gydF4y2Ba5gydF4y2Ba:图S5)。gydF4y2Ba
EGTA的抑制作用是外源性而非内源性gydF4y2Ba在gydF4y2BaAPC2介导ATP导入与P交换gydF4y2Ba我gydF4y2Ba表明ATP而不是PgydF4y2Ba我gydF4y2Ba运输需要Ca的存在gydF4y2Ba2 +gydF4y2Ba(或二价阳离子)。此外,这一观察还表明,脂质体内部的螯合剂与Ca明显物理分离gydF4y2Ba2 +gydF4y2Ba在外部(至少在分析的时间跨度内),这表明,EGTA和CagydF4y2Ba2 +gydF4y2Ba,不能轻易通过脂质屏障。gydF4y2Ba
尽管或甚至因为缺少CagydF4y2Ba2 +gydF4y2Ba依赖性调节,我们能够识别gydF4y2Ba在体外gydF4y2Ba钙函数gydF4y2Ba2 +gydF4y2Ba与应用体系作为共衬底。gydF4y2Ba
尽管α[gydF4y2Ba32gydF4y2BaP]-ATP为可能的ATP-Ca转运提供了证据gydF4y2Ba2 +gydF4y2Ba刺激非螯合ATP的运输,并以不同的方式阻碍ATP- mg的运输。然而,使用[gydF4y2Ba45gydF4y2BaCa]提供了ATP-Ca存在的直接证据gydF4y2Ba事实上的gydF4y2Ba经重组转运(图;gydF4y2Ba6gydF4y2Ba).时间依赖性摄取[gydF4y2Ba45gydF4y2BaCa)通过gydF4y2Ba在gydF4y2BaAPC2与它的反端口活性紧密相连,因为PgydF4y2Ba我gydF4y2Ba负载的蛋白质脂质体积累了大量的[gydF4y2Ba45gydF4y2BaCa]比未装载的囊泡。竞争实验进一步验证了ATP-Ca转运优于ATP-Mg转运gydF4y2Ba在体外gydF4y2Ba因为镁的浓度很高gydF4y2Ba2 +gydF4y2Ba来减少与atp传输相关的CagydF4y2Ba2 +gydF4y2Ba吸收(无花果。gydF4y2Ba6摄氏度gydF4y2Ba,附加文件gydF4y2Ba6gydF4y2Ba:图S6)。与全长相比gydF4y2Ba在gydF4y2BaAPC2 n端截断的载流子Ca减少gydF4y2Ba2 +gydF4y2Ba进口能力(图;gydF4y2Ba6 bgydF4y2Ba).n端结构域的缺失是否直接或间接地(通过重折叠和膜插入受损)影响转运活性,还不能从这些实验中推断出来。gydF4y2Ba
需要对重组蛋白以及转基因APC植物和分离的线粒体进行进一步的研究,以完全破译、评估和比较gydF4y2Ba在体外gydF4y2Ba而且gydF4y2Ba在活的有机体内gydF4y2BaAPC蛋白的特征。此外,测定ATP和Ca的化学计量将是有趣的gydF4y2Ba2 +gydF4y2Baco-transport。初步估计表明,这些底物并不是按照1:1的化学计量量运输的。然而,在这种情况下,重要的是要提到摄取测定必须适应钙gydF4y2Ba2 +gydF4y2Ba输运判断是可行的,进一步证明CagydF4y2Ba2 +gydF4y2Ba和毫克gydF4y2Ba2 +gydF4y2Ba必须考虑介质的污染。因此,在未来的研究中,我们希望进一步优化CagydF4y2Ba2 +gydF4y2Ba脂质体中的-输运测量和意图破译二价阳离子对gydF4y2Ba在gydF4y2BaAPC1-3函数gydF4y2Ba在活的有机体内gydF4y2Ba.gydF4y2Ba
ATP-Ca能通过植物APCs运输吗gydF4y2Ba在活的有机体内gydF4y2Ba?gydF4y2Ba
SCaMCs和酵母Sal1p似乎更喜欢ATP-Mg,而我们最初的研究表明,至少一种gydF4y2Ba在gydF4y2BaAPC亚型明显倾向于ATP- ca,而不是ATP- mg和ATP,作为脂质体系统中的导入底物。由于与ATP-Mg在结构上高度相似,从生物化学的角度来看,至少某些apc原则上可以接受ATP-Ca作为底物也就不足为奇了gydF4y2Ba在体外gydF4y2Ba.然而,有趣的问题是,ATP-Ca的形成和相应的APC是否介导CagydF4y2Ba2 +gydF4y2Ba运输可以而且将会在生理条件下发生。一般来说,ATP-Ca的形成在植物细胞中是一个相当不可能的现象。游离钙的浓度gydF4y2Ba2 +gydF4y2Ba与MggydF4y2Ba2 +gydF4y2Ba,它代表一个主要的二价阳离子,也是MggydF4y2Ba2 +gydF4y2Ba优于CagydF4y2Ba2 +gydF4y2Ba形成atp复合物。然而,人们可以设想在接近载体的地方可能形成ATP-Ca的具体情况。gydF4y2Ba
虽然植物线粒体有助于CagydF4y2Ba2 +gydF4y2Ba储存时,内部Ca居多gydF4y2Ba2 +gydF4y2Ba可能以非晶态磷酸盐沉淀的形式瞬时固定,因此游离CagydF4y2Ba2 +gydF4y2Ba仅略高于细胞质(200 nM vs. 100 nM) [gydF4y2Ba55gydF4y2Ba- - - - - -gydF4y2Ba57gydF4y2Ba].此外,由于镁含量高gydF4y2Ba2 +gydF4y2Ba植物线粒体内ATP几乎完全与Mg络合gydF4y2Ba2 +gydF4y2Ba,这就反对在基质中形成ATP-Ca [gydF4y2Ba45gydF4y2Ba].虽然镁含量较低gydF4y2Ba2 +gydF4y2Ba细胞质中的水平增加了游离ATP的可及性,尚不清楚是条件还是高钙微畴gydF4y2Ba2 +gydF4y2Ba线粒体表面的存在可能允许ATP-Ca的形成[gydF4y2Ba55gydF4y2Ba,gydF4y2Ba58gydF4y2Ba- - - - - -gydF4y2Ba63gydF4y2Ba].在脂质体系统中CagydF4y2Ba2 +gydF4y2Ba通过吸收gydF4y2Ba在gydF4y2BaAPC2低,25倍Mg过量完全阻断gydF4y2Ba2 +gydF4y2Ba.如果这些特性(生化特性与高镁结合gydF4y2Ba2 +gydF4y2Ba对CagydF4y2Ba2 +gydF4y2Ba比旁边的载体)也表示gydF4y2Ba在活的有机体内gydF4y2Ba在这种情况下,ATP-Ca通过植物apc运输是不太可能发生的。gydF4y2Ba
尽管植物apc在ATP-Ca运输中的直接作用因此是有争议的,但最近的数据表明哺乳动物的一种亚型在Ca中有间接作用gydF4y2Ba2 +gydF4y2Ba易位。结果表明,SCaMC3与(低亲和力)线粒体钙单转运体(MCU)发生物理相互作用,缺乏SCaMC3明显降低ATP和CagydF4y2Ba2 +gydF4y2Ba导入线粒体[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba64gydF4y2Ba].因此,SCaMC3被认为是线粒体Ca的重要组成部分gydF4y2Ba2 +gydF4y2Ba摄取系统是钙离子增强的微畴通道和载流子形成的超复合物gydF4y2Ba2 +gydF4y2Ba灵敏(gydF4y2Ba64gydF4y2Ba].是否某些植物APC异构体实现了与SCaMC3描述的功能相关的功能尚不清楚,然而,物理上接近于CagydF4y2Ba2 +gydF4y2Ba释放有利于保证快速CagydF4y2Ba2 +gydF4y2Ba植物apc依赖的激活和反应。gydF4y2Ba
结论gydF4y2Ba
三种推定APC亚型的生化特征测定gydF4y2Ba答:芥gydF4y2Ba结果表明,重组载体介导ATP、ADP和磷酸盐的交换。因此,植物线粒体拥有一个能够进行净腺嘌呤核苷酸易位的载体子集,但与酵母和哺乳动物同源物相比,它们对ATP-Mg作为输入底物没有高度偏好。令人惊讶的是,我们反而获得了在脂质体环境下重组植物APCs可能转运ATP-Ca的证据,但这是有争议的生理MggydF4y2Ba2 +gydF4y2Ba和CagydF4y2Ba2 +gydF4y2Ba浓度最有可能阻止ATP-Ca的形成及其随后的运输gydF4y2Ba在活的有机体内gydF4y2Ba.虽然我们不能检测到基于EF-hand的CagydF4y2Ba2 +gydF4y2Ba依赖于载体调控,这最近被证明存在于植物apc中[gydF4y2Ba47gydF4y2Ba].综上所述,目前的数据表明低CagydF4y2Ba2 +gydF4y2Ba浓度通过n端结构域ef -手调控植物APCs活性gydF4y2Ba2 +gydF4y2Ba浓度可以诱导其自身作为ATP的共底物的运输gydF4y2Ba在体外gydF4y2Ba.虽然这项研究加深了我们对植物线粒体净核苷酸运输的认识,但也提出了新的有趣的问题。在未来,重要的是研究gydF4y2Ba在活的有机体内gydF4y2Ba植物APCs的功能以及二价阳离子对相应运输的影响。gydF4y2Ba
参考文献gydF4y2Ba
Nelson DR, Felix CM, Swanson JM。线粒体载体家族中高度保守的电荷对网络。分子生物学杂志,1998;gydF4y2Ba
Palmieri L, Runswick MJ, Fiermonte G, Walker JE, Palmieri F.酵母线粒体载体:细菌表达、生化鉴定和代谢意义。中国生物医学工程学报。2000;32:67-77。gydF4y2Ba
线粒体转运蛋白家族(SLC25):生理和病理意义。Pflugers Arch. 2004; 447:689-709。gydF4y2Ba
王晓明,王晓明,王晓明,等。拟南芥线粒体载体家族的研究进展。植物科学进展2004;9:138-46。gydF4y2Ba
人类线粒体转运/载体蛋白家族:非同义单核苷酸多态性(nsSNPs)和导致人类疾病的突变。生物化学学报。2006;1757:1263-70。gydF4y2Ba
彭丽丽,李志刚,李志刚,李志刚。线粒体载体的进化、结构与功能研究进展。植物J. 2011; 66:161-81。gydF4y2Ba
ADP和ATP在线粒体及其载体中的转运。生物化学学报,2008;1778:1978-2021。gydF4y2Ba
陈XJ。Sal1p,一种钙依赖的载体蛋白,抑制与ADP/ATP转位酶Aac2亚型相关的基本细胞功能gydF4y2Ba酿酒酵母gydF4y2Ba.遗传学。2004;167:607-17。gydF4y2Ba
肝脏中线粒体腺嘌呤核苷酸池大小的调节:机制和代谢作用。Faseb j . 1988; 2:2547-56。gydF4y2Ba
线粒体ATP-Mg/P(i)载体的机制和调控。中国生物医学工程学报,2001;gydF4y2Ba
王志强,王志强,王志强。大鼠肾线粒体腺嘌呤核苷酸转运的研究。生物化学学报,1993;gydF4y2Ba
ferermonte G, De Leonardis F, Todisco S, Palmieri L, Lasorsa FM, Palmieri F.线粒体ATP-Mg/Pi转运体的鉴定。细菌表达、重建、功能表征和组织分布。中国生物医学工程学报。2004;39:30722 - 30。gydF4y2Ba
Laco J, Zeman I, Pevala V, Polcic P, Kolarov J.通过Sal1载体的腺嘌呤核苷酸转运补偿线粒体ADP/ATP载体的基本功能。FEMS酵母Res. 2010; 10:290-6。gydF4y2Ba
崔巴J,萨特斯特吉J,德尔阿科AA。腺嘌呤核苷酸在线粒体中的转运gydF4y2Ba酿酒酵母gydF4y2Ba: ADP/ATP载体与ATP- mg /Pi载体之间的相互作用。线粒体。2009;9:79 - 85。gydF4y2Ba
jayal JL, Aprille JR.大鼠肝线粒体ATP-Mg/Pi载体催化二价电中性交换。中国生物化学杂志。1992;26(2):388 - 388。gydF4y2Ba
王晓明,王晓明,王晓明,等。钙依赖性ATP-Mg/Pi线粒体载体在糖诱导钙信号通路中的作用gydF4y2Ba酿酒酵母gydF4y2Ba.生物化学学报,2005;gydF4y2Ba
Dransfield DT, Aprille JR.分离肝细胞中线粒体ATP-Mg/Pi载体的调控。中华医学杂志。1993;264:C663-70。gydF4y2Ba
Traba J, Froschauer EM, Wiesenberger G, Satrustegui J, del Arco AA。酵母线粒体通过钙依赖的ATP- mg /Pi载体Sal1p输入ATP,并在葡萄糖有氧生长过程中消耗ATP。Mol Microbiol, 2008; 69:570-85。gydF4y2Ba
Satrustegui J, Pardo B, del Arco AA。线粒体转运蛋白作为细胞内钙信号的新靶点。物理学Rev. 2007; 87:29-67。gydF4y2Ba
王晓明,王晓明,王晓明,等。一种具有钙结合结构域的线粒体载体亚家族的鉴定。中国生物化学杂志,2004;gydF4y2Ba
杨Q, Bruschweiler S,周俊杰。人线粒体ATP-Mg/Pi载体SCaMC1 n端钙调素样结构域的纯化、结晶和初步x射线衍射中国生物工程学报,2014;30(4):344 - 344。gydF4y2Ba
杨Q, Bruschweiler S,周俊杰。线粒体SCaMC载体的Ca(2)(+)自隔离传感器及其对Ca(2)(+)依赖的ATP-Mg/P(i)转运的意义结构。2014;22:209-17。gydF4y2Ba
Traba J, del Arco AA, Duchen MR, Szabadkai G, Satrustegui J. SCaMC-1通过ATP/ adp介导的基质Ca(2+)缓冲脱敏线粒体通透性转变促进癌细胞存活。细胞死亡差异。2012;19:650-60。gydF4y2Ba
Amigo I, Traba J, Gonzalez-Barroso MM, Rueda CB, Fernandez M, Rial E,等。胰高血糖素对氧化磷酸化的调节需要通过Ca2+激活线粒体ATP-Mg/Pi载体SCaMC-3来增加基质腺嘌呤核苷酸含量。中国生物医学工程学报,2013;gydF4y2Ba
Rueda CB, Traba J, Amigo I, Llorente-Folch I, Gonzalez-Sanchez P, Pardo B,等。线粒体ATP- mg /Pi载体SCaMC-3/Slc25a23抵消了神经元兴奋毒性损伤引起的parp -1依赖性线粒体ATP下降。中华神经科学杂志,2015;35:3566-81。gydF4y2Ba
线粒体中的代谢物运输:细胞膜内功能的一个例子。生物化学。1970;6:19 19 - 59。gydF4y2Ba
贾诺维兹A,查维兹E,克拉普M.腺嘌呤核苷酸易位在花椰菜线粒体。生物化学,1976;173:264-8。gydF4y2Ba
荣格DW,汉森JB。花椰菜和玉米线粒体中2,4-二硝基酚刺激atp酶活性的激活。生物化学,1975;168:358-68。gydF4y2Ba
布-哈利勒S,汉森JB。玉米线粒体能量链接腺苷二磷酸的积累:2。磷酸盐和二价阳离子需求。植物物理学报。1979;64:281-4。gydF4y2Ba
布-哈利勒S,汉森JB。玉米线粒体积累能量链接二磷酸腺苷:I.抑制剂的一般特征和作用。植物物理学报。1979;64:276-80。gydF4y2Ba
布-哈利勒S,汉森JB。净二磷酸腺苷在线粒体中的积累。生物化学。1977;183:581-7。gydF4y2Ba
Stael S, Rocha AG, Robinson AJ, Kmiecik P, Vothknecht UC, Teige M.拟南芥钙结合线粒体载体蛋白作为线粒体atp导入和质体sam导入的潜在促进因子。FEBS Lett. 2011; 585:3935-40。gydF4y2Ba
Laemmli英国。在T4噬菌体头部组装过程中结构蛋白的切割。大自然。1970;227:680-5。gydF4y2Ba
Heimpel S, Basset G, Odoy S, Klingenberg M.小鼠线粒体ADP/ATP载体的表达gydF4y2Ba大肠杆菌gydF4y2Ba.10个阳性残基的复性、重组和突变的影响。中国生物化学杂志,2001;gydF4y2Ba
Haferkamp I, Penz T, Geier M, Ast M, Mushak T, Horn M,等。的内共生体gydF4y2BaAmoebophilus asiaticusgydF4y2Ba编码s -腺苷甲硫氨酸载体,弥补其缺失的甲基化循环。中华微生物学杂志,2013;gydF4y2Ba
Gigolashvili T, Geier M, Ashykhmina N, Frerigmann H, Wulfert S, Krueger S,等。拟南芥类囊体ADP/ATP载体TAAC在向细胞质提供可塑性磷酸腺苷5 ' -磷酸硫酸盐方面具有额外的作用。《植物科学》2012;24:4187-204。gydF4y2Ba
Palmieri L, Picault N, Arrigoni R, Besin E, Palmieri F, Hodges M.分子鉴定gydF4y2Ba拟南芥gydF4y2Ba线粒体二羧酸载体异构体:器官分布,细菌表达,脂质体重构和功能表征。生物化学学报,2008;gydF4y2Ba
王晓明,王晓明,王晓明,王晓明,等。线粒体氨基酸转运蛋白的研究进展gydF4y2Ba拟南芥gydF4y2Ba通过功能重组成脂质体并在酵母中互补。植物学报2003;33:1027-35。gydF4y2Ba
Nosek MT, Aprille JR.大鼠肝线粒体ATP-Mg/Pi载体活性的研究。生物化学学报。1992;29(6):691 - 7。gydF4y2Ba
Schoenmakers TJ, Visser GJ, Flik G, Theuvenet AP.螯合剂:一种改进的计算生理溶液中金属离子浓度的方法。生物学技术。1992;12:870-9。gydF4y2Ba
Nosek MT, Dransfield DT, Aprille JR.钙刺激大鼠肝线粒体ATP-Mg/Pi载体活性。《生物化学杂志》1990;gydF4y2Ba
Igamberdiev AU, Kleczkowski LA。膜电位,腺苷酸水平和MggydF4y2Ba2 +gydF4y2Ba在植物细胞中通过腺苷酸激酶平衡相互连接。生物化学学报(英文版),2003;gydF4y2Ba
Igamberdiev AU, Kleczkowski LA。腺苷酸在线粒体膜间隙的平衡维持呼吸和调节细胞质代谢。中国机械工程学报,2006;26(3):344 - 344。gydF4y2Ba
Igamberdiev AU, Kleczkowski LA。缺氧条件下植物镁与细胞能量学。生物化学学报。2011;437:373-9。gydF4y2Ba
Gout E, rebel F, Douce R, Bligny RgydF4y2Ba2 +gydF4y2Ba, ADP和ATP在细胞质和线粒体中的作用:揭示Mg的作用gydF4y2Ba2 +gydF4y2Ba在细胞呼吸中。中国科学院学报(自然科学版),2014;gydF4y2Ba
Aprille JR, Nosek MT, Brennan WA。胰高血糖素处理大鼠或离体肝细胞后,肝线粒体腺嘌呤核苷酸含量升高。生物化学生物物理研究,1982;108:834-9。gydF4y2Ba
Monné M, Miniero DV, Obata T, Daddabbo L, Palmieri L, Vozza A,等。三种线粒体ATP-Mg/Pi载体的功能特征及器官分布gydF4y2Ba拟南芥gydF4y2Ba.生物化学学报1847;2015:1220-30。gydF4y2Ba
王晓燕,王晓燕,王晓燕,等。ADP/ATP载体与ADP/ATP载体功能整合的研究进展gydF4y2Ba大肠杆菌gydF4y2Ba膜揭示了植物、哺乳动物和厌氧壶的不同生化特性。《生物化学学报》,2002;29(2):3172 - 81。gydF4y2Ba
施耐德,范·德·格拉夫,费希尔,卡托尼,德·西蒙,等。拟南芥整体膜蛋白数据库ARAMEMNON。植物物理学报,2003;gydF4y2Ba
温特D,醋B,纳哈尔H,阿玛尔R,威尔逊GV,普罗瓦特NJ。一个“电子荧光象形文字”浏览器,用于探索和分析大规模生物数据集。PLoS ONE。2007; 2: e718。gydF4y2Ba
齐默曼P,赫施-霍夫曼M,亨尼格L, Gruissem W. genresearcher。拟南芥微阵列数据库和分析工具箱。植物物理学报。2004;136:2621-32。gydF4y2Ba
Bekh-Ochir D, Shimada S, Yamagami A, Kanda S, Ogawa K,中泽M,等。一种新的线粒体DnaJ/Hsp40家族蛋白BIL2在油菜素内酯信号通路中促进植物生长和抵抗环境胁迫。足底。2013;237:1509-25。gydF4y2Ba
李志强,李志强,李志强,等。缺氧对水稻线粒体生物发生的影响。植物科学进展。1992;39:411 - 21。gydF4y2Ba
杨晓明,李志强,李志强,等。土壤水淹与膜转运蛋白对根系信号通路的影响。植物细胞环境学报。2014;37:2216-33。gydF4y2Ba
植物线粒体和细胞质钙动态受到不同程度的调控。植物物理学报。2003;133:21-4。gydF4y2Ba
Chalmers S, Nicholls DG。肝和脑线粒体基质中游离钙和总钙浓度的关系。中国生物化学杂志,2003;gydF4y2Ba
Starkov AA。线粒体CagydF4y2Ba2 +gydF4y2Ba隔离系统。Febs j . 2010; 277:3652-63。gydF4y2Ba
史丹,吴青格,李文杰,李文杰,李文杰。植物细胞器钙信号的研究进展。中国科学(d辑),2012;gydF4y2Ba
在玉米悬浮培养细胞中,胞质钙的升高先于缺氧基因的表达。植物细胞。1994;6:1747-62。gydF4y2Ba
Subbaiah CC, Bush DS, Sachs MM.线粒体对缺氧Ca的贡献gydF4y2Ba2 +gydF4y2Ba玉米悬浮培养细胞的信号。植物科学,1998;18:759 - 71。gydF4y2Ba
Giacomello M, Drago I, Bortolozzi M, Scorzeto M, Gianelle A, Pizzo P,等。CagydF4y2Ba2 +gydF4y2Ba线粒体表面的热点是由钙产生的gydF4y2Ba2 +gydF4y2Ba从商店动员,但不是通过激活商店经营的CagydF4y2Ba2 +gydF4y2Ba频道。生物化学学报,2010;gydF4y2Ba
张志刚,张志刚,张志刚,张志刚,等。er -线粒体界面的细胞器间接触和局部钙动力学成像。生物化学学报。2010;39:121-32。gydF4y2Ba
李志刚,李志刚,李志刚。高钙微畴的研究进展gydF4y2Ba2 +gydF4y2Ba靠近相邻线粒体感知的ip3敏感通道。科学。1993;262:744-7。gydF4y2Ba
霍夫曼NE, Chandramoorthy HC, Shanmughapriya S,张晓青,Vallem S, Doonan PJ,等。SLC25A23增强线粒体CagydF4y2Ba2 +gydF4y2Ba摄取,与MCU相互作用,并诱导氧化应激介导的细胞死亡。Mol Biol Cell, 2014; 25:936-47。gydF4y2Ba
资金gydF4y2Ba
该项目由Deutsche Forschungsgemeinschaft (Reinhard Koselleck-Grant)提供资金支持。UCV实验室的工作得到了Deutsche Forschungsgemeinschaft(慕尼黑综合蛋白质科学中心,CIPSM和VO656/5-1)的支持。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
作者的贡献gydF4y2Ba
IH, HEN和UCV有助于研究的概念。AL, ML和IH设计了实验。AL和ML在异体系统中克隆和表达载体。AL进行和ML监督传输测量和载体的功能表征。SNW进行氨基酸序列分析并生成三维模型。AL、ML、SNW和IH收集数据,AL、HEN、UCV和IH进行数据解释。IH撰写稿件,UCV和HEN支持。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
作者的信息gydF4y2Ba
不适用gydF4y2Ba
数据和材料的可用性gydF4y2Ba
不适用gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
不同的表达gydF4y2Ba在gydF4y2BaAPC1-3蛋白积累在包涵体部分gydF4y2Ba大肠杆菌gydF4y2Ba表达的细胞。(gydF4y2Ba一个gydF4y2Ba) 5 μg的SDS- PAGE和(gydF4y2BaBgydF4y2Ba) Western-blot和免疫检测0.5 μg表达细胞的包涵体片段gydF4y2Ba在gydF4y2BaAPC1(1车道)gydF4y2Ba在gydF4y2BaAPC2(2号车道)和gydF4y2Ba在gydF4y2Ba用单克隆多聚His IgG (Sigma, Taufkirchen, Germany)免疫修饰Western-blot。M,预染色分子质量标记(赛默飞世尔科学公司,Schwerte,德国),用于估计重组蛋白的分子质量(以kDa为单位)。(PDF 66kb)gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
时间依赖的ADP传输通道gydF4y2Ba在gydF4y2BaAPC1-3。50 μM [αgydF4y2Ba32gydF4y2Ba-ADP变成PgydF4y2Ba我gydF4y2Ba(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaCgydF4y2Ba,gydF4y2BaEgydF4y2Ba)和ADP (gydF4y2BaBgydF4y2Ba,gydF4y2BaDgydF4y2Ba,gydF4y2BaFgydF4y2Ba)负载重组蛋白脂质体gydF4y2Ba在gydF4y2BaAPC1 (gydF4y2Ba一个gydF4y2Ba,gydF4y2BaBgydF4y2Ba),gydF4y2Ba在gydF4y2BaAPC2 (gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba),gydF4y2Ba在gydF4y2BaAPC3 (gydF4y2BaEgydF4y2Ba,gydF4y2BaFgydF4y2Ba).无负载脂质体(无填充菱形;阴性对照)与含有磷的蛋白质脂质体相比,仅显示出少量的放射性积累gydF4y2Ba我gydF4y2Ba或ADP(黑菱形)。数据表示三个独立重复的平均值,给出了标准误差。(PDF 82kb)gydF4y2Ba
附加文件3:图S3。gydF4y2Ba
一个gydF4y2Ba.ATP输入P的生化参数测定gydF4y2Ba我gydF4y2BaAPC-proteoliposomes加载。运输gydF4y2Ba在gydF4y2BaAPC1 (gydF4y2Ba一个gydF4y2Ba,gydF4y2BaBgydF4y2Ba),gydF4y2Ba在gydF4y2BaAPC2 (gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba),gydF4y2Ba在gydF4y2BaAPC3 (gydF4y2BaEgydF4y2Ba,gydF4y2BaFgydF4y2Ba)在ATP浓度升高的情况下进行(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaCgydF4y2Ba,gydF4y2BaEgydF4y2Ba)或存在(gydF4y2BaBgydF4y2Ba,gydF4y2BaDgydF4y2Ba,gydF4y2BaFgydF4y2Ba)gydF4y2Ba2gydF4y2Ba静置2.5 min。Michaelis-Menten动力学为至少3次重复的平均值,给出了SE。gydF4y2BabgydF4y2Ba.ADP导入ATP负载apc蛋白脂质体的生化参数测定。运输gydF4y2Ba在gydF4y2BaAPC1 (gydF4y2Ba一个gydF4y2Ba,gydF4y2BaBgydF4y2Ba),gydF4y2Ba在gydF4y2BaAPC2 (gydF4y2BaCgydF4y2Ba,gydF4y2BaDgydF4y2Ba),gydF4y2Ba在gydF4y2BaAPC3 (gydF4y2BaEgydF4y2Ba,gydF4y2BaFgydF4y2Ba),在无ADP的情况下,ADP浓度上升(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaCgydF4y2Ba,gydF4y2BaEgydF4y2Ba)或存在(gydF4y2BaBgydF4y2Ba,gydF4y2BaDgydF4y2Ba,gydF4y2BaFgydF4y2Ba)gydF4y2Ba2gydF4y2Ba静置2.5 min。Michaelis-Menten动力学为至少3次重复的平均值,给出了SE。(PDF 126kb)gydF4y2Ba
附加文件4:图S4。gydF4y2Ba
N-末端截断的异源表达及ATP转运分析gydF4y2Ba在gydF4y2BaAPC2。(gydF4y2Ba一个gydF4y2Ba) 5μg SDS-PAGE和(gydF4y2BaBgydF4y2Ba) Western-blot和免疫检测0.5 μg包涵体部分gydF4y2Ba大肠杆菌gydF4y2Ba表达n端截断的细胞(通道1)。为了检测n端延伸缺失导致的分子质量减少,将全长蛋白纳入分析(通道2)。Western-blot用单克隆抗多聚His IgG免疫修饰(Sigma, Taufkirchen,德国)。M,预染色分子量标记(赛默飞世尔科学公司)。(gydF4y2BaCgydF4y2Ba) 50 μM [αgydF4y2Ba32gydF4y2BaP]- atp经N-末端截断gydF4y2Ba在gydF4y2BaAPC2装入ATP(黑色菱形),PgydF4y2Ba我gydF4y2Ba负载(灰色圆圈)和非负载(非填充菱形)脂质体。(PDF 156kb)gydF4y2Ba
附加文件5:图S5。gydF4y2Ba
内部EGTA对ATP转运通路的影响gydF4y2Ba在gydF4y2BaAPC2。50 μM [αgydF4y2Ba32gydF4y2BaP]-ATP转化为蛋白质脂质体gydF4y2Ba我gydF4y2Ba(黑条)或PgydF4y2Ba我gydF4y2Ba加200 μM EGTA(浅灰色条)设置为100%(对照)。外源EGTA (50 μM)和CaCl的抑制和刺激作用gydF4y2Ba2gydF4y2Ba(500 μM)对相应输运速率进行了计算。添加500 μM的氯化钙可使EGTA抑制的转运活性得到恢复gydF4y2Ba2gydF4y2Ba.传输(抑制和激活)允许10分钟。数据表示净值(ATP/P)gydF4y2Ba我gydF4y2Ba交换无负载蛋白质脂质体的负背景值),并且是至少三个重复的平均值。说明了标准误差。(PDF 252kb)gydF4y2Ba
附加文件6:图S6。gydF4y2Ba
上升MgCl的影响gydF4y2Ba2gydF4y2Ba浓度在[gydF4y2Ba45gydF4y2BaCa通过N-末端截断传输gydF4y2Ba在gydF4y2BaAPC2。20 μM [gydF4y2Ba45gydF4y2BaCa]变成PgydF4y2Ba我gydF4y2Ba负载(深灰色条)和不负载(浅灰色条)蛋白质脂质体允许10分钟(以nmol mg蛋白质给予)gydF4y2Ba-1gydF4y2BahgydF4y2Ba-gydF4y2Ba1gydF4y2Ba).在输运介质中加入100 μM的未标记ATP和指定的MgClgydF4y2Ba2gydF4y2Ba浓度。数据表示三个独立重复的平均值。说明了标准误差。(PDF 102kb)gydF4y2Ba
附加文件7:图S7。gydF4y2Ba
来自不同生物的APC蛋白的排列。apc的氨基酸序列比对gydF4y2Ba答:芥gydF4y2Ba(gydF4y2Ba在gydF4y2BaAPC1-3[基因库:At5g61810;At5g51050;At5g07320]),gydF4y2Ba酿酒酵母gydF4y2Ba(Sal1p [GenBank: YNL083w])和human (gydF4y2Ba海关gydF4y2BaSCaMC1-3[基因库:SLC25A24;SLC25A25;SLC25A23]使用ClustalW2 (gydF4y2Bahttp://www.ebi.ac.ukgydF4y2Ba).便于检测n端延伸线粒体AAC2的来源gydF4y2Ba酿酒酵母gydF4y2Ba(gydF4y2BaScgydF4y2BaPET9 [GenBank:YBL030C])被认为是MCF的代表性蛋白。在瑞士EMBnet服务器上使用Boxshade对保守氨基酸残基进行着色(gydF4y2Bahttp://www.ch.embnet.org/index.htmlgydF4y2Ba).的n端结构域的残基gydF4y2Ba在gydF4y2BaAPC1-3拟参与CagydF4y2Ba2gydF4y2Ba+gydF4y2Ba-interaction用不同的颜色突出显示。Scanprosite预测残基(gydF4y2Bahttp://prosite.expasy.org/scanprositegydF4y2Ba)用绿色和分子Ca标记gydF4y2Ba2 +gydF4y2Ba对接分析与AutoDock vina(另见附加文件gydF4y2Ba8gydF4y2Ba:图S8)以橙色标示。CagydF4y2Ba2gydF4y2Ba+gydF4y2Ba通过Scanprosite和分子对接研究预测的-相互作用残基以黄色标记。ef -手I和III(橙色方框)对Ca的支持度较低gydF4y2Ba2gydF4y2Ba+gydF4y2Ba-交互(Scanprosite)比EF-hands II和IV(绿色方框)。(PDF 476 kb)gydF4y2Ba
附加文件8:图S8。gydF4y2Ba
Ca停靠姿势gydF4y2Ba2 +gydF4y2Ba的n端畴内的离子gydF4y2Ba在gydF4y2BaAPC1-3与人SCaMC1相互作用残基和结构叠加(SLC25A24)。的n端结构域的三维同源模型gydF4y2Ba在gydF4y2BaAPC1(残基34-189,绿色)gydF4y2Ba在gydF4y2BaAPC2(残基38-194,黄色)和gydF4y2Ba在gydF4y2BaAPC3(残基35-189,橙色)使用HHPred服务器和modeler构建,利用Ca的晶体结构gydF4y2Ba2gydF4y2Ba+gydF4y2Ba人类SCaMC1 n端域(蓝色)的-bound状态作为模板(PDB ID: 4N5X)。四个EF-hand母题假定涉及CagydF4y2Ba2gydF4y2Ba+gydF4y2Ba装订用深蓝色标示(gydF4y2Ba一个gydF4y2Ba,gydF4y2BaCgydF4y2Ba,gydF4y2BaEgydF4y2Ba).Ca停靠姿势gydF4y2Ba2 +gydF4y2Ba离子显示为gydF4y2Ba在gydF4y2BaAPC1 n项(gydF4y2Ba一个gydF4y2Ba),gydF4y2Ba在gydF4y2BaAPC2 n项(gydF4y2BaCgydF4y2Ba),gydF4y2Ba在gydF4y2BaAPC3 n项(gydF4y2BaEgydF4y2Ba),残基与Ca相互作用gydF4y2Ba2 +gydF4y2Ba用红色标记。这些残基是根据对接或Scanprosite结果选择的(gydF4y2Bahttp://prosite.expasy.org/scanprositegydF4y2Ba).对于分子对接分析,CagydF4y2Ba2 +gydF4y2Ba离子和n端结构域gydF4y2Ba在gydF4y2BaAPC1-3使用Autodock Tools 1.5.6编写。在确定搜索空间后,使用Autodock vina将离子对接到结构中。最适合Ca的装订姿势gydF4y2Ba2 +gydF4y2Ba根据总能量和EF-hand位置进行选择。构造叠加gydF4y2Ba在gydF4y2BaAPC1 (gydF4y2BaBgydF4y2Ba),gydF4y2Ba在gydF4y2BaAPC2 (gydF4y2BaDgydF4y2Ba),gydF4y2Ba在gydF4y2BaAPC3 (gydF4y2BaFgydF4y2Ba)与SCaMC1(蓝色)和CagydF4y2Ba2 +gydF4y2Ba使用PyMOL (version 1.3)对该蛋白内的离子(蓝色球体)进行检测。(PDF 298kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
洛伦兹,A,洛伦兹,M,沃特克内西,加州大学gydF4y2Baet al。gydF4y2Ba在体外gydF4y2Ba线粒体ATP/磷酸盐载体的分析gydF4y2Ba拟南芥gydF4y2Ba出乎意料的CagydF4y2Ba2 +gydF4y2Ba影响。gydF4y2BaBMC植物生物学gydF4y2Ba15,gydF4y2Ba238(2015)。https://doi.org/10.1186/s12870-015-0616-0gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-015-0616-0gydF4y2Ba
关键字gydF4y2Ba
- 线粒体gydF4y2Ba
- 钙gydF4y2Ba
- CagydF4y2Ba2 +gydF4y2Ba
- 信号gydF4y2Ba
- 能源gydF4y2Ba
- 腺嘌呤核苷酸转运gydF4y2Ba
- 植物gydF4y2Ba
- 三磷酸腺苷gydF4y2Ba
- ADPgydF4y2Ba
- 磷酸gydF4y2Ba