抽象的
背景
亚洲稻静脉(Orseolia oryzae)是一种破坏性的昆虫害虫。水稻中的胆中间侵染触发兼容性或不相容的相互作用,分别导致饲养蛆的存活或死亡率。在不相容的相互作用中,植物等化学术/防御分子的产生和/或蛆的不能继续饲喂麦哥内的宿主凋亡。解开这些分子事件,蛆触发为对抗性主体的饲喂的反应,使我们能够更好地理解宿主阻力。目前的研究表明,防御者对凋亡细胞死亡基因的可能参与(爸..)来回应寄主的防御。
结果
cDNA编码爸..在米兰中间的正轨静物(OODAD1.)由339个核苷酸组成,其中一个内含子85bp和208和131个核苷酸的两个外显子。推导的氨基酸序列OODAD1.与黑森蝇(Hessian fly)的DAD1同源基因(Mayetiola析构函数麦片的主要Dipteran害虫。Southern杂交分析表明OODAD1.作为亚洲稻静脉中间生物型(Gmb)1,4和4米的基因组中的单一副本存在于涉及Jaya(易感水稻宿主)的与Jaya(易感水稻宿主)相互作用中的相互作用OODAD1.幼虫取食量在96海时逐渐增加到3倍,在96海时达到最高值,为24海时的3.5倍。在24海时,以抗性寄主RP2068为寄主的蝇蛆的表达量比以Jaya为寄主的蝇蛆的表达量增加了8倍以上,并维持在48、72和96hai水平。重组OoDAD1,表达于大肠杆菌当细胞注入水稻幼苗时,在抗性水稻宿主RP2068中诱导了超敏反应(HR),而在敏感水稻品种Jaya中则没有。
结论
结果表明OODAD1.在饲养蛆织机可能由于宿主阻力响应而被触发,因此,可能是中间日与其水稻之间相互作用的初始阶段的重要分子。
背景
细胞凋亡或编程的细胞死亡具有陈规定型的形态学变化,例如细胞收缩,细胞变形,染色质缩合,最终细胞破碎物中凋亡体。这些变化是细胞内发生的几种生物化学和分子事件的后果[1].这些活动是由动物细胞内的各种分子执行和调节的[2].其中一个调控因子,DAD1(抗凋亡细胞死亡的防御者)被发现并被证明与MCL1 (BCL2蛋白家族成员)相互作用,这为其在凋亡中的假定作用提供了新的视角。的爸..在非允许温度孵育时,最初在突变仓鼠细胞系的互补性研究期间被隔离。此外,在用DAD1野生型基因转染时,可以在非允许温度下抵抗这些TSBN7细胞[3.].
参与爸..调控凋亡或凋亡相关通路的研究至今已被广泛报道。爸..据报道参与了C. Elegans.胚胎[4),Bombyx Mori.[5].据报道,DAD1参与了温度诱导的凋亡细胞死亡十字ventricosus和Argopecten irradians[6,7].在植物王国中,据报道了DAD1同源物的作用拟南芥[8],豌豆[9[米[10].差分调节爸..在花瓣衰老阶段观察到基因[9].这些调查的结果表明,在这一过程中爸..在动物和植物系统中的细胞凋亡和发育。上调的爸..类抗凋亡基因被推测存在于因植物防御分子而遭遇胁迫的害虫中[11].有趣的是,爸..在一种害虫Hessian fly (Mayetiola析构函数),取食抗性小麦(小麦宿主在黑森蝇侵害时启动超敏感介导的防御反应),表明其在抑制宿主防御反应引发的不希望发生的凋亡中发挥作用[11].如在黑森州蝇小麦相互作用中所观察到的,亚洲稻静血(Orseolia oryzae),已知会引起类似类型的防御反应。然而,目前还没有关于抗凋亡基因在稻瘿蚊相互作用中的作用的报道。
亚洲稻瘿蚊是水稻的第三大害虫。据估计,单在印度,瘿蚊袭击造成的经济损失就达8,000万元[12].最近,由于对了解陷入困境的广泛研究[13- - - - - -16]并且随着大量序列数据的可用性[16,稻瘿蚊正逐渐成为一个有用的模型系统,用于理解使昆虫克服宿主防御机制的分子和生理事件。瘿蚊和水稻的相互作用要么是相容的,要么是不相容的[17].在兼容相互作用期间,胆体中的静脉操纵宿主存活并诱导胆形成;然而,在不相容的互动期间,主管防御克服了昆虫采用的策略,导致胆米格的死亡率。不兼容的相互作用可以分为两种类型:HR +和HR-。HR +型相互作用在植物进入地区的植物中,在植物中的过敏反应和细胞死亡,而HR型相互作用是非过敏介导的防御反应。由于生产植物的生产而无法饲料的昆虫蛆导致蛆虫的死亡中不相容的相互作用,并且蛆通常在96小时内孵化后死亡[18].
多种研究已经描述了寄主植物的超敏机制[19].然而,对昆虫在超敏不亲和互作中的反应进行调查和比较的研究却很少。这项工作始于这样一个假设,即以抗性水稻为食的蛆比以敏感水稻为食的蛆遇到更大的胁迫诱导的挑战。昆虫在具有抗性的寄主中遇到的这种压力,是由植物防御分子产生的[20.[此后是否可以喂食,导致昆虫内的细胞凋亡。为了生存,昆虫的可能存活机制将是抗凋亡基因的上调[11].爸..是一个重要的凋亡抑制基因,直到迄今为止没有报告爸..来自亚洲稻湿的基因。此外,如果从胆中饲喂水稻裤触发宿主植物中的细胞凋亡,则尚不清楚。因此,我们认为它与克隆有关,表征和表现爸..并评估其在昆虫中的作用和相应的宿主反应(如果有的话)。
目前的研究描述了表征爸..亚洲稻瘿蚊及其与寄主亲和和不亲和互作过程中的转录表达模式。Orseolia Oryzae Dad1.(OODAD1.)从从敏感和抗性主体品种的蛆虫产生的cDNA文库中分离出[21.].转录过度表达OODAD1.在相容和不相容的相互作用中观察到的蝇蛆表明它在调节不希望的凋亡中发挥作用。此外,本研究首次证明了寄主植物从昆虫中识别出DAD1,从而诱导了一个超敏感介导的反应。研究结果表明,DAD1在植物-虫相互作用中发挥着重要作用。
结果
表征OoDAD1
全长cDNAOODAD1.由339个碱基组成[GenBank:KP890835],编码113个氨基酸,预测分子量为12.7 kDa。确定cDNA克隆OODAD1.并指定了基因组序列gOoDAD1[基因库:KP890834]。后者由一个85 bp的内含子和两个208和131个核苷酸的外显子组成。
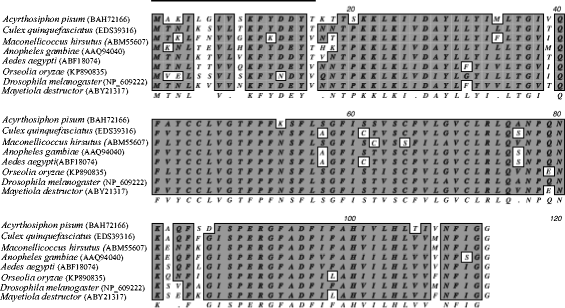
预测蛋白OoDAD1的pI值为9.18。有8个非极性氨基酸残基和7个极性氨基酸残基。通过ExPASy-ProtParam工具计算的不稳定性指数为36.33,为稳定蛋白。TOPCONS预测OoDAD1具有三个跨膜螺旋(附加文件1:图S1)。利用SMART生物信息学分析预测了预测蛋白中分泌信号序列的缺失,而TOPCONS证实该蛋白可能定位于膜。推测的氨基酸序列与来自Mayetiola析构函数(MdesDAD1;89%, 3 e-52;Acc。不。(ABY21317) DAD1后跟DAD1 fromanopheles gambiae.(78%, 2 e-47;Acc。不。AAQ94040)。二级结构预测工具ROBETTA预测了OoDAD1的5个可能的结构(附加文件2:图S2)。在所有预测模型中,发现第五模型具有最低分数(最低能量)和最大稳定性。预计OODAD1具有四个大型α-螺旋,如MDesdad1所报告,在整个推导的蛋白质序列中没有β链。
对预测的DAD1氨基酸序列进行多序列比对(图1)。1),在OoDAD1中发现了多个同源区域和保守区域。结果表明,与n端相比,该蛋白在c端高度保守。同源度(相似度评分)最高为94.6%Mayetiola析构函数(ACC。否。ABY21317)。
系统发育分析
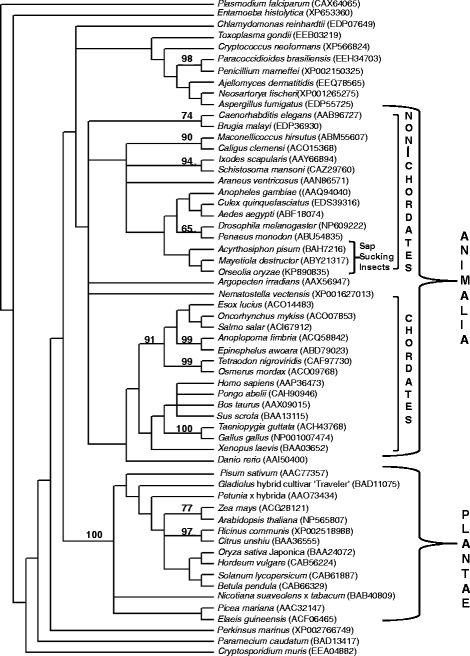
OoDAD1的系统发育分析揭示了OoDAD1与其他生物的亲缘关系(图。2).然而,本研究将植物和动物类群的DAD1明确划分为两个大分支。含DAD1的动物分支又进一步细分为脊椎动物和无脊椎动物。双翅目聚集在无脊椎动物组的一个亚分支中。OoDAD1被归入双翅目昆虫的分支中。这棵树还揭示了OoDAD1与黑森蝇(Hessian fly)同源物的密切关系(Mayetiola析构函数)及蚜虫(Acrythosiphon pisum),它们也是植物的食物。
南方分析
Southern杂交,使用339 bpOODAD1.碎片作为探针,揭示了OODAD1.作为分析所有三种生物型(Gmb1,Gmb4和Gmb4m)的单个副本存在(图。3.).在用限制酶消化的所有三种生物型中观察到单一杂交信号生态ri,生态房车,半径标注I.此外,在这些生物型之间没有检测到限制片段长度多态性(RFLP)。
易受耐水稻品种肉豆胶滴的OODAD1差异表达分析
转录水平OODAD1.在一组兼容(Jaya-Gmb4)和不相容的相互作用中评估(RP2068-GMB4)(图。4).表达水平OODAD1.在易受敏感(Jaya)宿主的蛆虫中24小时的转录物用作基线,并且相对于该基线,所有其他时间点的表达得到得分。在与Jaya(易感宿主)和RP2068(耐宿主)的相互作用中,涉及Gmb4(耐宿主),过度表达OODAD1.在两种情况下都被观察到。然而,表达水平在蛆喂养Jaya逐渐增加了超过三倍72海和3.5倍,96年达到顶峰海[0.35 (log10)褶皱](感染后几小时)相比,蛆虫吃Jaya 24海。而在虫食RP2068的情况下,其表达水平突然从24hai [0.8 (log10)倍]增加到8倍,并维持在48hai [0.65 (log10)倍]、72hai [0.70 (log10)倍]和96hai [0.85 (log10)倍]。
重组OoDAD1的生成
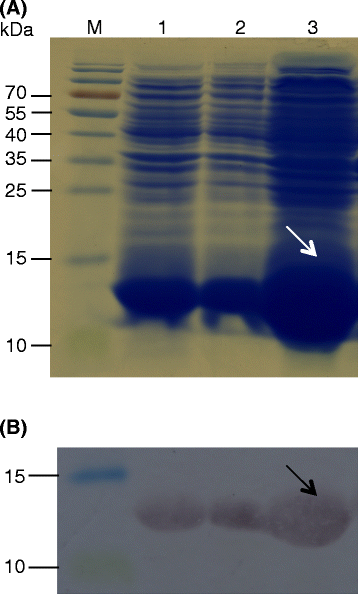
使用PET 28a载体的蛋白质表达导致其标记的OODAD1蛋白的分子量为13.2kDa(包括N-末端区域中的七个他的残基)。抗他的抗体用于确认蛋白质的表达和尺寸(图。5).
OODAD1和西方分析的异源表达。一个Coomassie蓝色染色的十二烷基硫酸钠聚丙烯酰胺凝胶显示在BL21(DE3)的重组OODAD1的过度表达大肠杆菌基于使用PET 28A表达载体的表达系统。车道:1,诱导裂解物,转化细胞OODAD1.;2、诱导转化细胞上清液OODAD1.;3、微丸诱导、转化细胞用OODAD1..m,蛋白梯。b西丙烯酰胺凝胶中显示的西方分析(一个),然后电转移到硝酸纤维素膜上,用抗his标签抗体进行检测(见实验步骤).车道指定与(一个).箭头表示his标记的OoDAD1的位置。左边的数字表示分子量,单位为千道尔顿(kDa)。
植物实验和DAB(3,3’-二氨基联苯胺)染色
经纯化的OoDAD1蛋白(Ni-NTA柱纯化)、蛋白洗脱缓冲液和水注射到宿主品种RP2068中,启动HR。然而,在RP2068中观察到的HR扩散(图。6)在注射了OoDAD1的植物中比注射了缓冲液和牛血清白蛋白的植物中更明显。然而,在注射后Jaya植物中未观察到HR(附加文件)3.:图S3)。经DAB染色,Suraksha注射后48 h和RP2068注射后72 h的注射区域均为棕色(图2)。7).DAB染色在具有增加的过氧化物酶活性的组织中产生棕色着色(增加反应性氧物质的产生),并用作植物中超敏反应的标志物。
讨论
为了更好地理解昆虫植物相互作用的分子基础,研究无毒蛆引发的防御反应,饲喂对抗性宿主的饲喂,同样重要的是,因为获得毒性蛆虫的机制的洞察力。在植物微生物相互作用的情况下,由于植物细胞凋亡的结果,在植物凋亡的结果中引发了过敏反应的启动[22.].然而,除了对Hessian蝇小麦相互作用的研究之外,没有其他报道,其中在与宿主植物的相互作用期间涉及与昆虫中凋亡相关的基因的调节[11].
目前的研究表明OODAD1.在害虫中是转录调节的,这取决于它是否以易感或耐药宿主为食。此外,这是第一次报道a爸..从昆虫注入耐药时,诱导过敏反应。
爆炸和系统发育分析不仅显示出高同源性爸..昆虫和OODAD1.同时,OoDAD1的预测氨基酸残基与包括植物和脊椎动物在内的其他物种的DAD1的预测氨基酸残基高度保守。如此高的保护程度可能表明DAD1在脊椎动物、无脊椎动物和植物中发挥着重要的功能作用。早期的报道证实DAD1是低聚糖转移酶复合物的成员,负责n -连接糖基化[23.].还观察到c端氨基酸残基对n端糖基化功能至关重要[24.],在爸爸中,来自各种各样的生物。
然而,尽管来自不同生物的DAD1之间具有高度的同源性,但蛋白质中的一些不同的氨基酸残基提供了各自具有可用于对与其进化关系相对应的不同生物的DAD1的特定签名。此外,这些特定签名能够将植物的DAD1与动物王国中的那些区分开来。此外,这些签名还将DAD1与无脊椎动物和脊椎动物分化,以及来自植物和血红蛋作的DIPERAN的那些。
在许多生物体中,DAD1已被证明作为凋亡途径的抑制因子发挥重要作用[4].因此,差异表达模式OODAD1.在以易感和耐药宿主为食的蛆中,可能表明它在水稻瘿蚊的凋亡通路中也发挥了重要作用。细胞在发育阶段可诱导受控凋亡,细胞在应激状态下也可发生凋亡[2].在胆中米兼容相互作用的情况下,Midge经历了正常的生命周期。在易感植物上,蛆建立了12至24个HAI和参与生长和发展的基因之间的饲养场,也在Hessian Fly-小麦互动中观察到[25.- - - - - -27.].因此,小幅增加了OODAD1.与24hia相比,在48至96Hai的蛆虫中观察到的蛆虫在敏感宿主上饲养的蛆可能是正常稳态和发展的一部分[28.的蛆虫。
然而,在抗性植株上,转录水平OODAD1.注册瞬间增加,这些水平持续到96段。在以前的研究中涉及Hessian Fly-小麦相互作用的研究,观察到Hessian飞行蛆未能在抗性小麦品种上建立饲养部位,因此结果应激响应基因和参与稳态破坏的人是上调的[20.,29.].此外,可能由于有毒植物化合物和/或摄食威慑物的作用,蛆在具有抵抗力的寄主上无法维持摄食,因此可能面临营养压力,并因此面临饥饿和最终死亡。这可能会导致一系列与防御途径相关的事件,其中一个可能是DAD1的过度表达,以防止它屈服于应激诱导的细胞凋亡。
有趣的是,利用重组OoDAD1进行植物注射试验的结果显示,抗瘿蚊水稻宿主的HR增加,这与报道的DAD1的作用相矛盾。对观察到的结果的一个合理解释可能是,在昆虫衍生的DAD1中存在某些基序,瘿蚊抗性宿主识别这些基序,并因此启动对外源蛋白的超敏反应。这也得到了系统发育分析数据的支持,该数据清楚地区分了植物和动物起源的DAD1。此外,也有研究表明,一种生物的DAD1 (Ost2的同源物)在另一种生物中可能不会继续PCD信号通路的保守机制[30.].此外,在注射重组OoDAD1后,用DAB对水稻组织进行染色,结果显示Suraksha在48hai处HR增加,而RP2068在72hai处HR增加。这可能是由于两个抗性水稻品种内在的基因型差异造成的。我们早期的研究也表明,这两个抗性水稻品种携带抗瘿蚊基因Gm11和gm3, 分别。虽然米饭品种在胆中攻击时表现不同,但两种情况下的最终结果是蛆的死亡率[18,21.].
结论
总之,这里描述的实验表明了OODAD1.在瘿蚊-水稻相互作用中。OODAD1.是在蛆虫中转录上调,以抗性宿主为食,试图克服蛆虫在抗性宿主中面临的挑战。此外,重组OoDAD1的植物分析表明,昆虫蛋白被抗性宿主检测到,导致HR。然而,要进一步阐明OoDAD1在瘿蚊-水稻相互作用中的作用,还需要进行更详细的研究。此外,基于rnai的研究与OoDAD1突变体的研究将有助于理解DAD1在昆虫-植物相互作用,特别是瘿蚊-水稻相互作用中的作用。此外,利用OoDAD1进行免疫定位研究有助于进一步了解昆虫-植物相互作用过程中的分子事件。
方法
昆虫材料和DNA提取
实验材料由温室内饲养的亚洲稻瘿蚊生物型4 (GMB4)昆虫组成[31.]在印度海德拉巴海德拉巴的水稻研究局。最初从印度的不同湿地侵染区域收集成人胆中间。这些昆虫在Jaya上饲养,并在标准条件下检查RP2068各种水稻[31.].GMB4对Jaya(缺乏瘿蚊抗性基因)有毒性(在宿主植物上形成瘿蚊),对RP2068(具有瘿蚊抗性基因)水稻品种无毒性(不能在宿主植物上形成瘿蚊导致蛆虫随后死亡)。用液氮冷冻的微杵从瘿蚊成虫体内提取DNA。基质悬浮在提取缓冲液中(1% SDS, 0.05 M NaCl;0.05 M Tris-HCl, pH 8.0;0.025 M EDTA),然后用蛋白酶K和RNase处理,用苯酚:氯仿:异戊醇(25:24:1)纯化,再用氯仿:异戊醇(24:1)纯化[32.].将纯化的基因组DNA用乙醇沉淀,重新悬浮在蒸馏水中。
昆虫阶段,解剖和收集蛆
分别在24、48、72和96hai的不同时间间隔中分离出蝇蛆,以鉴定差异表达基因。为确定时间间隔,对Jaya和RP2068品种15日龄的水稻幼苗进行GMB4侵染并定期监测。眼斑形成后,蛆需4-6小时到达顶端分生组织。在显微镜下解剖水稻幼苗个体,并在RNAlater (Ambion, Austin, TX, USA)中收集蛆,在80℃下保存至进一步使用。每个水稻品种约有600只蛆被解剖。
RNA分离和基因组克隆恢复
使用RNeasy Plus Micro Kit (Qiagen, GmbH, Hilden, Germany)按照制造商的方案分离RNA。本研究包括两个暂时分离的生物重复。第一链cDNA的合成使用Superscript III RT酶(Invitrogen公司,Carlsbad, CA, USA)根据制造商的协议。cDNA文库的制备如Sinha et al., 2011 [21.].基因组行走和RACE是使用已公布的协议进行的[33.].本研究中使用的引物的细节提供在表中1.PCR产物克隆在Topo Ta克隆载体(Invitrogen,Carlsbad,Ca,USA)中,由M / S Macrogen Inc.,韩国首尔M / S Macrogen Inc.测序。
序列和系统发育分析
使用PHRED和PHRAP中包含的PHRED和PHRAP进行序列组件(MacVector Inc.,Cary NC,USA; V:12.0.5)。序列相似性和注释是在国家生物技术信息中心(NCBI;http://www.ncbi.nlm.nih.gov/)服务器。利用SMART软件对预测的氨基酸序列进行分泌信号肽分析(http://smart.embl-heidelberg.de).使用Expasy-Protparam工具计算分子量和PI(http://web.expasy.org/protparam/).PSORT II分析(蛋白质分类信号和氨基酸序列定位位点的预测,http://psort.hgc.jp/form2.html)用于识别本地化站点。在没有任何匹配模型的情况下,使用Rosetta片段插入方法预测结构。新蛋白线程程序ROBETTA (http://robetta.bakerlab.org)用于预测OoDAD1的二级结构。
使用OODAD1的预测氨基酸序列构建系统发育树和其他生物中的同源物。从脊椎动物,无脊椎动物和植物的DAD1的同源物用于该分析。使用在MacHector套件中提供的内置距离/邻接方法构建树。使用1000份复制来获取分支的引导值。使用泊松校正的距离计算进化距离,间隙按比例分布。
印迹分析
使用基因组DNA(3μg)使用从三种生物型分离的基因组DNA(3μg)进行限制消化生态R1,生态房车,半径标注1限制性内切酶(New England Biolabs, Beverly, MA, USA)。酶切的DNA片段在0.8%琼脂糖凝胶上电泳(30 V, 12 h),并在尼龙膜上印迹(GeneScreen Plus, Perkin Elmer, Boston, MA, USA)。用碱转移法进行DNA转移,用339 bp进行印迹检测OODAD1.片段克隆自GMB4。该片段用α -标记32.使用Nick翻译试剂盒(Invitrogen公司,Carlsbad, CA, USA)。随后进行探针杂交和印迹清洗,如Mohan等人,1994 [34.].
实时荧光定量PCR及统计学分析
执行实时表达配置文件OODAD1.昆虫对感病(Jaya)和抗性(RP2068)寄主的不同取食阶段的基因变化。Primer Express(3.0版;应用生物系统公司,Foster City, CA, USA)设计Real-Time PCR引物OODAD1.和控制基因1).总RNA的相同数量(20 ng;如纳米尺分光光度计估计[GE Healthcare,Little Chalfont,UK]),来自不同阶段使用上标III RT酶(Invitrogen,Carlsbad,Ca,USA)和寡核苷酸(DT)逆转录primers according to the manufacturer’s protocol. Amplification efficiency of the designed primers was checked using serially diluted cDNA samples. Actin gene was selected as the internal control after evaluating several candidates using GENORM [35.].
Real-Time PCR的循环条件为95°C for 10 min,然后是95°C for 15 s和60°C for 1 min的40个循环。Real-Time PCR使用SYBR green chemistry和Applied Biosystems StepOne Real-Time PCR系统进行。Real-Time PCR mix (20 μl)包含1XPower SYBR Green PCR mix (Applied Biosystems)和0.5 mM的引物。Real-Time PCR之后进行熔体曲线分析,以确定引物二聚体和污染。将扩增片段克隆到pCR4-TOPO-TA载体(Invitrogen, Carlsbad, CA, USA)中,并进行测序确认。采用相对标准曲线法测定蝇蛆中OoDAD1 mRNA的含量。输出数据使用2——ΔΔCt结果显示为相对表达值(REVs)。不同样本间OoDAD1表达差异的统计学意义使用Student’s进行测定t以及分析(36.].
OoDAD1蛋白的异体表达及Western blot分析
细菌表达载体pET 28a (Novagen, Darmstadt, Germany)和BL21 (DE3) pLysEE.coli.感受态细胞用于重组OoDAD1的生产。利用正向引物和反向引物,对编码OoDAD1的全长cDNA进行PCR扩增1).引物设计了Bamh.1,XHO.将PCR片段克隆到pET 28a载体中相应的位点。化学活性BL21 (DE3) pLysE大肠杆菌用设计的表达质粒转化。将含有50μg/ ml卡那霉素的LB培养基(10mL)接种过夜培养(1%)转化细胞。将LB培养基在37℃下孵育,直到达到0.6的培养基的光密度(OD)(OD600).0.5毫米异丙基-B-D-硫代菌(IPTG; Merck,Darmstadt,德国)用于诱导他标记的OODAD1蛋白的表达。在诱导4小时后将细胞以10,000g离心10分钟沉淀10分钟。将所得颗粒重新悬浮在裂解缓冲液中[25mM Tris,10mM NaCl,10mM苯胺,15%甘油,1mM苯基甲基磺酰氟(PMSF),2mg / mL溶菌酶]并以13 000g离心15分钟.将沉淀重新悬浮在1x SDS页面染料中(50mM Tris-Cl pH6.8; 10%甘油; 2%SDS; 12.5mM乙二胺四乙酸; 1%B-巯基乙醇; 0.02%溴苯酚蓝)并煮沸5分钟。将样品在15%SDS聚丙烯酰胺凝胶中电泳,用Coomassie Blue Dye染色凝胶以使蛋白质带可视化。
电泳后,将凝胶上的蛋白质电转移到Amersham Hybond-ECL硝酸纤维素膜上(0.45μm; GE Healthcare)(100 V 1小时;使用Mini Trans-Blot Cell [Bio-rad Laboratories,Hercules,CA,USA,USA,CA])。用溶解在磷酸盐缓冲的盐水(PBS)中的3%牛血清白蛋白(BSA)封闭膜。将其进一步温育1小时,1:3000稀释6倍他的抗体与碱性磷酸酶(目录No.A7058-1VL; Sigma Aldrich GmbH,德国)。在含有0.05%吐温-20的PBS重复洗涤(3次)后,使用5-溴-4-氯-3'-吲哚磷酸/硝基 - 蓝四唑(Sigma Aldrich,ST路易斯)检测他的标记-OODAD1。莫,美国)作为基质。发达带的大小估计是使用预染色的蛋白梯(Fermentas,Hanover,MD,USA;目录#SM0671)进行的。
植物注射化验及染色
将15日龄的Jaya、Suraksha和RP2068注入纯化的重组OoDAD1蛋白、洗脱缓冲液或热变性OoDAD1 10 μl (700 ng/μl)。用极细针(26G;0.45 × 13 mm)。为了定位注射区域,在注射蛋白之前就标记了注射区域。每个水稻品种每时间点(24、48、72和96 h) 10株,设3个生物重复。注射后24、48、72和96 h,切除注射部分,用DAB(3,3’-二氨基联苯胺)染色液染色,如前所述[37.]微小修改。
提供支持数据的可用性
全长核苷酸序列OODAD1.已提交至GenBank,登录号为KP890835 (cDNA克隆)和KP890834(基因组克隆)。与本文相关的其他数据包括在本文及其附加文件中。
缩写
- 海:
-
侵犯后的小时数
- 轻拍:
-
3'3'二氨基苯胺
参考文献
- 1.
sasaste a,pulkki K.细胞凋亡的形态学和生化标志。Cardiovasc Res。2000; 45:528-37。
- 2。
Elmore S.细胞凋亡:对编程细胞死亡的综述。毒素别墅。2007; 35:495-516。
- 3。
中岛,Sekiguchi T, Kuraoka A, Shibata S, Komiyama S, et al.。人编码新蛋白DAD1的cDNA的分子克隆,该蛋白的缺陷导致仓鼠BHK21细胞凋亡死亡。《细胞生物学》1993;13:6367-74。
- 4.
杉本A, Hozak RR, Nakashima T, Nishimoto T, Rothman JH。Dad-1,一种内源性程序性细胞死亡抑制因子Caenorhabditis elegans.和脊椎动物。EMBO j . 1995; 14:4434-41。
- 5。
在昆虫变态过程中细胞程序性死亡的ecdy甾体诱导基因。生物化学学报2001;31:321-31。
- 6.
Lee Ks,Chung Eh,Han JH,Sohn HD,Jin Br。CDNA克隆对凋亡细胞死亡1(DAD1)同源物的后卫,响应于蜘蛛的外部温度刺激十字ventricosus.生物化学学报2003;135:117-23。
- 7.
朱丽,宋丽,张华,赵军,李超,徐伟。扇贝抗细胞死亡1 (DAD1)基因的克隆及对损伤刺激的响应表达参数opecten artadians..mol biol rep。2007. DOI:10.1007 / s11033-007-9061-4.
- 8.
作者简介:马志岛(1981 -),男,河北人,博士,主要从事生物医学工程研究。一个拟南芥补充仓鼠凋亡抑制突变体的cDNA。植物j . 1997; 11:1325-31。
- 9。
抗凋亡死亡基因的植物同源基因在花瓣衰老过程中下调。2月。1997;404:275-8。
- 10。
田中勇,马志岛,田中勇,等。Dad-1:水稻中假定的程序性细胞死亡抑制基因。植物生理学杂志。1997;38:379-83。
- 11.
Mittapalli O, Shukle RH。黑森蝇抗凋亡细胞死亡同系物的分子特征和响应性表达,Mayetiola析构函数.Comp Biochem Physiol B. 2008; 149:517-23。
- 12.
王志强,王志强,王志强,等。稻瘿蚊与寄主植物相互作用的研究进展。DRR研究论文系列01/2003。印度海得拉巴:水稻研究理事会;2003.23-9页。
- 13。
Rawat N,Chiruvuri Naga N,Raman Meenakshi S,Nair S,Bentur JS。微阵列分析揭示了水稻品种Kavya的胆体抗性的新机制。Funct综合基因组学。2012; 12:249-64。
- 14。
Rawat N,Himabindu K,Neeraja CN,Nair S,Bentur JS。抑制减法杂交揭示了水稻胆中间攻击引发了水稻中的植物病原体的反应。植物理性生物化学。2013; 63:122-30。
- 15.
Sinha DK,Nagaraju J,Tomar A,Bentur JS,Nair S.基于乳化物的转录组分析亚洲湿MIDGE在兼容和不相容的相互作用期间揭示了差异反应。int j mol sci。2012; 13:13079-103。
- 16。
Sinha DK,Atray I,Bentur Js,Nair S.表达Orseolia oryzae核苷二磷酸激酶(oondpk)在稻瘿蚊取食敏感水稻寄主时增强,其过度表达导致耐盐性大肠杆菌.昆虫学报。2012;21:593-603。
- 17.
与其水稻宿主的兼容相互作用导致寡糖转移酶γ亚基的表达增强(OoOST)在亚洲米胆的中间(Orseolia oryzae).昆虫学报2011;20:567-75。
- 18.
Rawat N, Sinha DK, Rajendrakumar P, Shrivastava P, Neeraja CN, Sundaram RM,等。致病相关基因在稻瘿蚊相互作用中的作用。咕咕叫科学。2010;99:1361-8。
- 19.
摩擦laj。植物中的过敏反应。els。2007. DOI:10.1002/9780470015902. a0020103.
- 20.
Mittapalli O, Neal JJ, Shukle RH。一种恼人昆虫的抗氧化防御反应。美国国家科学研究院2007;104:1889-94。
- 21。
Sinha DK, Lakshmi M, Anuradha G, Rahman SJ, Siddiq EA, Bentur JS,等。稻瘿蚊丝氨酸蛋白酶样基因在与水稻亲和和不亲和互作中表现出差异表达。中华医学杂志。2011;12:2842-52。
- 22。
腾格拉JL。植物的超敏反应和细胞死亡的诱导。细胞死亡不同1997;4:671-83。
- 23.
Kelleher DJ,Gilmore R.真核寡核酸胰岛素的演变视图。糖生物学。2006; 16:47R-62。
- 24.
哺乳动物低聚糖转移酶(DAD1)的一个亚基与bcl-2蛋白家族之一的Mcl-1相互作用。。2000;128:399 - 405。
- 25。
Mittapalli O, Neal JJ, Shukle RH。来自Hessian飞行的两种消化丝氨酸蛋白酶的分子克隆与表征Mayetiola析构函数.昆虫学报2005;14:309-18。
- 26。
Mittapalli O, Neal JJ, Shukle RH。两个细胞色素P450基因在黑森蝇/小麦亲和和不亲和互作中的差异表达。昆虫生物化学学报2005;35:981-9。
- 27。
Mittapalli O, Sardesai N, Shukle RH。黑森蝇围磷蛋白样基因的cDNA克隆及转录表达Mayetiola析构函数[说]。拱形昆虫生物学理发学。2007; 64:19-29。
- 28。
Ameisen JC。关于编程细胞死亡的起源,演化和性质:四亿年的时间表。细胞死亡有所不同。2002; 9:367-93。
- 29.
Mittapalli O, Sardesai N, Giovanini MP, Williams CE, Shukle RH。抗菌基因在黑森蝇中的表达模式。昆虫学报2006;52:1143-52。
- 30.
Pennell Ri,Lamb C.在植物中编程细胞死亡。植物细胞。1997年; 9:1157-68。
- 31.
Vijaya Lakshmi P,Amudhan S,Bindu Kh,Cheralu C,Bentur JS。亚洲稻湿米德的新生物型Orseolia oryzae(Diptera:Cecidomyiidae)以Andhra Pradesh中的Warangal人群为特征。印度int j trop昆虫sci。2006; 26:207-11。
- 32.
Behura Sk,Nair S,Sahu Sc,Mohan M.一个偶然亚洲湿地中间的生物型的AFLP标记(Orseolia oryzae,木制梅森)是性关系,也与airulence有关。Mol Gen Genet。2000; 263:328-34。
- 33。
Reddy PS, Mahanty S, Kaul T, Nair S, Sopory SK, Reddy MK.一种高通量基因组行走法及其在克隆未知侧翼序列中的应用。学生物化学肛门。2008;381:248-53。
- 34。
Mohan M,Nair S,Bentur Js,prasada ru,Bennett J. RFLP和RAPD米饭Gm2抗1型瘿蚊的基因(Orseolia oryzae).Theor Appl Genet. 1994; 87:782-8。
- 35。
VandeSompele J,De Preter K,Pattyn F,Poppe B,Van Roy N,De Paepe A等。通过多个内部对照基因的几何平均来精确正常化实时定量RT-PCR数据。基因组Biol。2002; 3:Research0034.1-Research0034.11。
- 36.
索卡尔RR, Rohlf FJ。生物计量学:生物学研究中的统计学原理与实践。第3版。纽约:W. H. Freeman and Co.;1995.
- 37。
张志强,魏勇,张志强。H2O2在植物。H2O2大麦粉末霉菌相互作用期间乳头基和过敏反应的积累。工厂J. 1997; 11:1187-94。
致谢
这项研究工作部分由印度政府生物技术部门(DBT)拨款(编号BT/PR8629/PBD/16/ 373 /2007)资助,感谢印度政府大学资助委员会(UGC)提供的高级研究奖学金。
作者信息
隶属关系
通讯作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
SN和JSB设计了这项研究。DKS和IA进行了实验。DKS、IA和SN对数据进行了分析。论文由DKS, IA, JSB和SN撰写。所有作者都已阅读并批准了最终稿。
附加文件
附加文件1:图S1。
使用Topcons服务器的膜蛋白拓扑的共识预测表明在OODAD1的预测氨基酸序列中存在三个跨膜螺旋(图中的灰色和白色盒子)。Topcons预测了来自五种不同拓扑预测算法的OODAD1的拓扑:Scampi(单序列模式),Scampi(多序列模式),Prodiv-TMHMM,Pro-Tmhmm和章鱼。这五种算法的输出被用作顶部隐藏马尔可夫模型(HMM)的输入(以栗色示出),这为蛋白质的共识预测提供了基于序列中包括的方法的协议的可靠性评分。此外,Zpred用于预测Z坐标(也就是说,并利用g尺度预测以序列中每个位置为中心的21个氨基酸窗口的膜插入自由能。(PDF 81 kb)
附加文件2:图S2。
由ROBETTA, a .等预测的OoDAD1蛋白结构新创蛋白质穿线程序(http://robetta.bakerlab.org).A,B,C,D和E是五个预测模型,预测第五模型具有最低分(最低能量),因此被认为是最稳定的。(PDF 166 KB)
附加文件3:图S3。
重组OoDAD1抗瘿蚊水稻的HR反应。植物注射试验表明,在抗瘿蚊水稻品种Jaya中,注射重组OoDAD1诱导了HR反应。Jaya注射(a)纯化蛋白;(b)蛋白洗脱缓冲液;(c)蛋白洗脱缓冲液溶解的牛血清白蛋白。黑点表示注射前的标记,便于定位注射区域。(PDF 199 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Sinha,D.K.,Atray,I.,Bentur,J.等等。在抗性水稻上喂养导致对凋亡细胞死亡的后卫表达增强(OODAD1.)在亚洲稻瘿蚊中。BMC植物BIOL.15,235(2015)。https://doi.org/10.1186/s12870-015-061870-015-061870-015-0618.
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-015-061870-015-061870-015-0618.
关键词
- 植物 - 昆虫互动
- 不兼容的交互
- 过敏反应
- 细胞凋亡
- Orseolia oryzae
- 栽培稻
- 胆形成