摘要
背景
越来越多的人认识到,作用于细胞和超细胞水平的电控制影响发育,并启动对环境线索的快速反应。一种用于细胞膜电活动的非侵入性光学成像的新兴方法使用遗传编码电压指示器(GEVIs)。GEVIs由神经科学家开发,用于绘制动物的神经元回路,它包含一种荧光蛋白,融合到电压传感区域。一个著名的GEVI, ArcLight,在哺乳动物细胞中,随着电压的变化,荧光强度发生了强烈的变化。ArcLight由超黄道(SE)磷(pH值敏感的fluorescent prote来在)与A227D取代体(赋予神经元电压敏感性)融合到v电压-年代实体d的电压敏感磷酸酶的主要成分C爱奥那岛我ntestinalis(Ci-VSD)。在一项为植物适应光学电生理学工具的持续努力中,我们在这里描述了ArcLight和各种衍生物在根细胞的不同膜中的表达和测试拟南芥.
结果
设计了转基因结构来表达ArcLight和各种衍生物靶向的质膜和核膜拟南芥根细胞。在转基因幼苗中,使用配备高速摄像机的荧光显微镜监测细胞外ATP (eATP)应用后这些报告蛋白荧光强度的变化。在eATP处理后,在质膜和核膜上观察到ArcLight和含ci - vsd衍生物的荧光强度的协调降低。然而,对于缺乏Ci-VSD的衍生物,也观察到类似的反应。Ci-VSD的可有可无性表明,在植物中,H+离子对电活动的贡献很大,ArcLight的电压感应能力服从于其SEpHluorin碱的pH敏感性。由eATP触发的ArcLight荧光的短暂降低很可能反映了pH值的变化,而不是膜电压的变化。
结论
ArcLight的pH敏感性妨碍了它在植物中用作膜电压的直接传感器。然而,ArcLight及其位于质膜和核膜中的衍生物可以提供可靠的、基于荧光强度的pH指标,用于监测这些离散膜系统中pH值的同时变化。这样的工具将有助于分析pH值作为信号和/或信使在细胞表面和核周围的活植物。
背景
生长、发育和对环境的适当反应需要在细胞、组织和整个生物的多个组织层次上起作用的电子控制和网络[1克ydF4y2Ba- - - - - -3.].在细胞水平上,跨膜电位(电压梯度)和离子通量的变化构成了一个广泛的生物电通信系统,该系统与分子、化学和机械信号通路结合在一起[2 gydF4y2Ba,4].与监测膜电位的经典方法(如微电极和膜片钳)一起,基于光或光电生理学概念的新一代电生理工具正在开发中[4,5].其中一组重要的新工具由基因编码、基于蛋白质的电压指示器组成[6- - - - - -8].
基因编码电压指示器(GEVIs)由荧光蛋白(报告蛋白)和电压传感域(检测器)之间的融合组成[8].在过去20年里,神经生物学家开发了GEVIs,作为一种非侵入性方法,用于光学监测单个和多个神经元及其他细胞类型中跨膜电位的变化[6- - - - - -9].一种类型的GEVI是基于Förster共振能量转移(FRET)之间的一对荧光蛋白连接到跨膜电压传感域。膜电位的变化被认为是通过电压感应域来诱导两种荧光蛋白更有利的排列,从而提高FRET效率[8- - - - - -10].相比之下,在单色GEVIs中,跨膜电压传感域融合到单个荧光蛋白上,该荧光蛋白通过显示荧光强度的变化对电压变化作出反应。有人提出,当膜去极化触发电压传感域的运动,导致连接的荧光蛋白变形,从而降低荧光强度时,就会产生这种结果[8].
其中一个基于强度的GEVI是ArcLight [11,12],由超黄道(SE)的氟(pH值敏感的fluorescent prote来在) [13,14]含有A227D替代,赋予神经元电压敏感性[11的电压敏感磷酸酶的电压敏感域Ciona intestinalis(Ci-VSD) [15].据报道,在哺乳动物细胞的质膜上,ArcLight的荧光强度随着电压的变化而发生显著变化[12].在一项使用人胚胎肾(HEK293)细胞的研究中,ArcLight的荧光强度在膜去极化为100 mV [11].
GEVIs作为电压指示器的一个优势是,它们可以融合到定义的膜靶向基元上,从而允许对内部细胞膜进行电生理分析,这在很大程度上是经典工具测量膜电位所无法达到的。虽然原则上可以使用微电极阵列测量多个细胞的膜电位[16,17], GEVIs还允许无创检测完整组织和器官中细胞群中膜电位的同时变化[6].
我们感兴趣的是使用GEVIs来研究植物细胞的质膜和核膜的电位在环境和发育刺激下的协调变化。由于其低背景荧光和有趣的发育特征,根细胞为评估GEVIs研究活植物中不同膜系统电学行为的可行性提供了一个很好的实验系统[18].我们前面介绍了转基因的产生拟南芥(拟南芥)在根细胞中表达基于fret的GEVIs的植物[19].基于fret的GEVIs稳定表达和良好的耐受性拟南芥最近的一项研究记录了成功使用Mermaid FRET传感器来监测植物系统中外源施用钾对膜电压的响应[20.].鉴于先前ArcLight在哺乳动物细胞中的研究结果显示,荧光强度随电压变化而发生巨大变化[11,12,我们已经组装并引入拟南芥构建了编码ArcLight和几种靶向根细胞质膜和核膜的衍生物。在这里,我们描述了旨在评估ArcLight和位于这两个膜系统中的衍生物的荧光强度变化的实验结果,以响应外部ATP (eATP)和其他预计会触发跨膜电位变化的刺激[21].
结果
在根细胞中表达GEVIs及其衍生物的转基因拟南芥
ArcLight图表[11,12]和本研究中使用的各种衍生物如图所示。1-f.将相应的转基因结构引入拟南芥如图所示。2-f.相对于特定的膜靶向序列,荧光蛋白报告基因的预测细胞位置如图所示。1克.
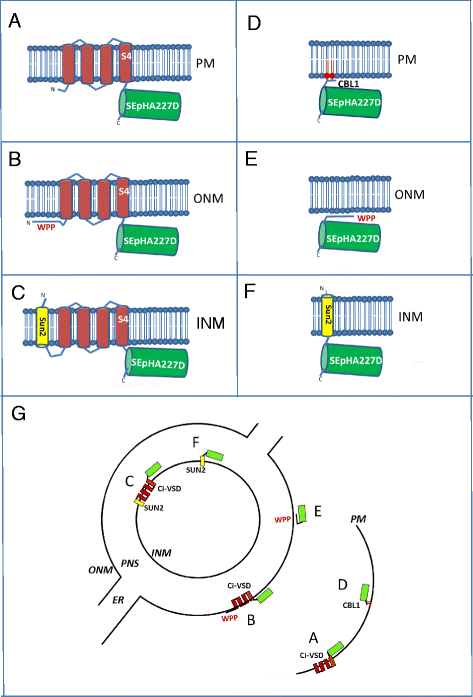
本研究中使用的GEVIs和衍生物的图表以及预测的膜定位。GEVIs包括:一个ArcLight,由融合到Ci-VSD的SEpHluorinA227D组成(跨膜域为红色条,电压传感域在S4);BArcLight n端融合外核膜(ONM)系带序列WPP;CArcLight在n端与内核膜(INM)跨膜蛋白SUN2融合。不含Ci-VSD的衍生品包括:Dsefluororina227d融合到质膜(PM)-tethering sequence CBL1;ESEpHluorinA227D在n端与WPP融合;FSEpHluorinA227D在n端与SUN2融合。部分G显示了这些蛋白质的预测膜定位。扇形字母A-F对应图中的字母。内质网(ER)与核周间隙(PNS)连续。为简单起见,没有显示核孔。制图不按比例
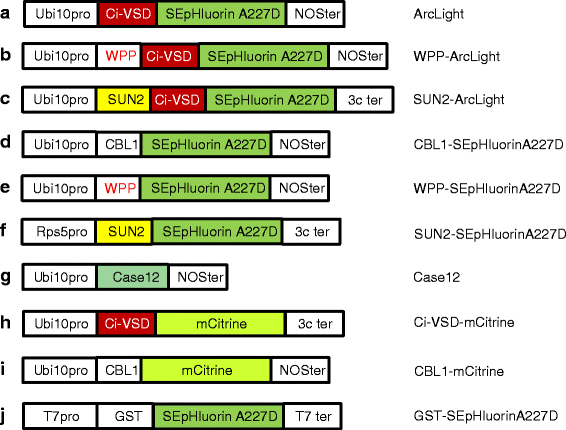
本研究中使用的结构。结构字母(f)对应图中的图字母。1克ydF4y2Ba.文中定义了SEpHluorinA227D, Ci-VSD和Case12。CBL1基序是来自CBL1蛋白的12个氨基酸序列,其中包含一个豆蔻酰甘氨酸和一个棕榈酰半胱氨酸,它们将荧光融合蛋白拴在质膜的细胞质表面[25].WPP序列包含一个在所有陆生植物中高度保守的Trp(W)-Pro(P)-Pro基序[22],由氨基酸28-131组成拟南芥RANGAP1,足以将融合蛋白靶向到外核膜[23].长度为455个氨基酸的SUN2蛋白具有一个跨膜结构域,可在核膜内表面定位SUN2融合蛋白[44,45]。在构念中(f)及(胃肠道),编码荧光报告基因受普遍表达的Ubi10植物启动子控制[39].结构体F包含根特异性Rps5启动子[40].Ci-VSD-mCitrine对应于vsfp3.1 . 1_1 mcitrine [28].构造(-ⅰ)含有诺帕林合成酶(NOS)或3C转录终止子。构造(j)设计用于gst标记的SEpHluorinA227D的表达大肠杆菌包含噬菌体T7启动子和终止子。与野生型GFP和SEpHluorin相比,SEpHluorinA227D和环境不敏感单体(m)Citrine的氨基酸序列显示在附加文件中1克ydF4y2Ba:图S1。构造没有按比例绘制
测试的荧光蛋白包括:经典ArcLight(图。1),在没有任何其他膜靶向序列的情况下,由Ci-VSD定向到质膜(图。1克, A扇区);ArcLight在n端加入WPP域拟南芥RAN GTPASE激活蛋白1 (RANGAP1)1 b) [22,23],促进靶向外核膜(图;1克, B扇区);和ArcLight在n端和拟南芥SAD1/UNC-84结构域蛋白2 (SUN2),包含一个跨膜结构域(图2)。1 c),并能将蛋白质定向到内核膜[24(图。1克C)。
在其他结构中,我们测试了跨膜Ci-VSD在电压传感中的重要性拟南芥钙调神经磷酸酶b样蛋白1 (CBL1)质膜靶向肽[25]在n端(图;1 d),其定位荧光报告在质膜的细胞质表面(图。1克D扇区);n端WPP域(图;1 e),将荧光报告细胞置于外核膜的细胞质表面(图。1克, E扇区);或n端与内核膜蛋白SUN2融合(图。1 f),将荧光报告细胞定位于核周空间(图。1克F扇区)。
为了进行比较,我们使用了表达基于强度的游离钙浓度传感器Case12(钙传感器12)的转基因植物[26(图。2 g)及经改良以减低对环境敏感度的mCitrine [27],连接至Ci-VSD [28(图。2 h)或CBL1(图;2我).gst标记的sefluororina227d(图;2 j)以大肠杆菌并被分离出来作为ArcLight的可溶性变体进行测试。野生型GPF、mCitrine、SEpHluorin和SEpHluorinA227D的氨基酸序列见附加文件1克ydF4y2Ba:图S1。
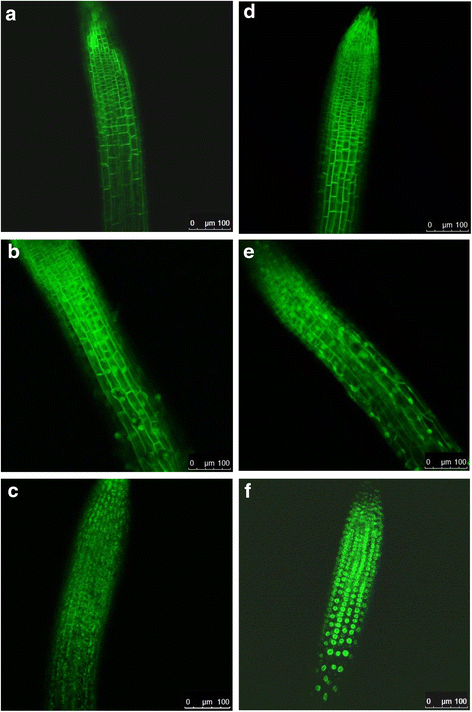
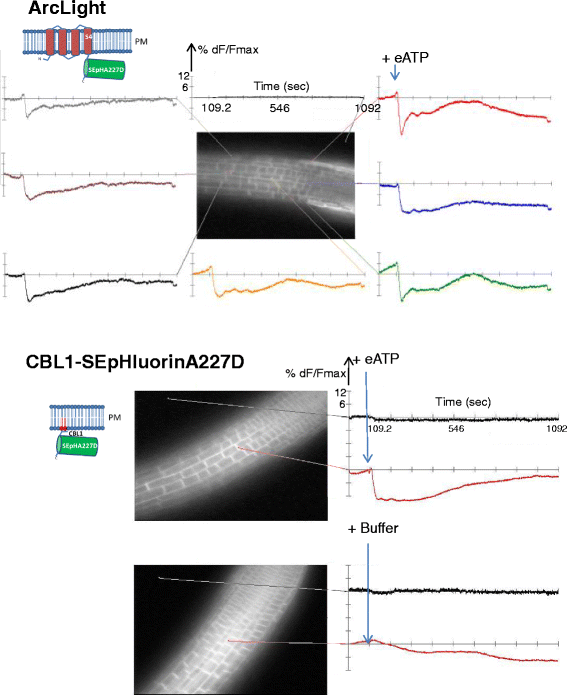
转基因拟南芥在根细胞中表达ArcLight和各种衍生物的细胞系被生产出来,并筛选了转基因在整个研究区域(通常是延伸到根尖分生组织的过渡区)的强而均匀的表达水平,以及膜靶向的特异性和缺乏可见的聚集形成。正如预期的,ArcLight(图。1)和CBL1-SEpHluorinA227D(图;1 d)主要局限于质膜(图;3而且d)对于缺乏Ci-VSD的CBL1-SEpHluorin,质膜荧光特别明显和明亮。WPP融合蛋白(WPP- arclight和WPP- sephluorina227d;无花果。1 b而且e,分别可见于核外周,但质膜定位也被观察到(图。3 b而且e,分别),特别是WPP-ArcLight,其中包含Ci-VSD。SUN2-SEpHluorinA227D,缺乏Ci-VSD(图;1 f),几乎只局限于核边缘(图。3 f),而包含Ci-VSD的SUN2-ArcLight(图。1 c),在质膜和核膜均有聚集的趋势(图。3 c).因此,Ci-VSD作为质膜靶向基序的优势降低了含有额外核膜靶向信号的荧光报告蛋白的优先核沉积,增加了荧光蛋白聚集的可能性。与WPP相比,SUN2对核膜的靶向性可能更强,因为前者涉及跨膜结构域,而后者可能通过静电相互作用与膜的结合更松散。
表达质膜和核膜定位的转基因植物根的荧光共聚焦图像。图像显示根尖(分生组织)和相邻的过渡区。右下白色条表示100 μm。一个电弧光;bWPP-ArcLight;cSUN2-ArcLight;dCBL1-SEpHluorinA227D;eWPP-SEpHluorinA277D;fSUN2-SEpHluorinA277D。这些字母与图中图表和结构中的字母相对应。1克ydF4y2Ba而且2 gydF4y2Ba分别
表达Case12的转基因植物在根尖表现出特别强的弥漫性荧光,而在表达Ci-VSD-mCitrine和CBL1-mCitrine的转基因植物的根细胞中,荧光定位在质膜上2 gydF4y2Ba:图S2)。ArcLight及其衍生物的表达对转基因植物的表型没有明显影响,转基因植物正常生长和繁殖(数据未显示)。
体外ATP (eATP)
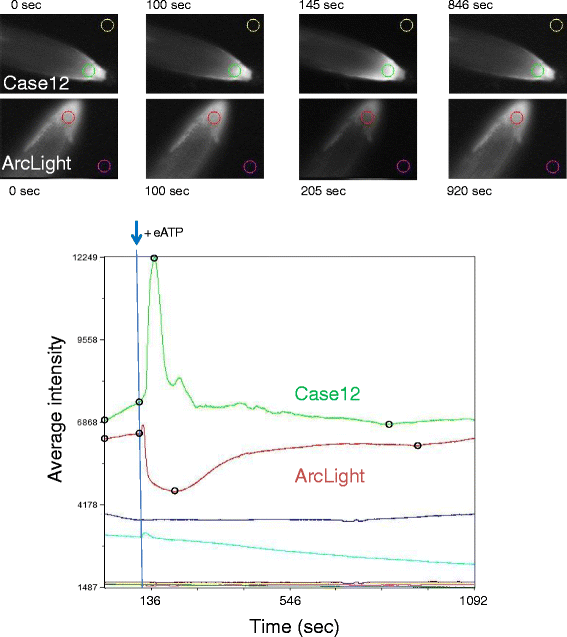
先前的一项研究表明,向表达基于fret的钙传感器的植物根中添加2 mM的细胞外ATP (eATP)会引发一个大的荧光峰值,表明细胞内游离钙增加,随后是振荡,并在大约10分钟的时间内逐渐恢复到接近基线[29].我们观察到,在添加2 mM eATP后,表达荧光强度为基础的游离钙传感器Case12的转基因幼苗的根细胞中也有类似的反应。4Case12)。Case12对eATP应用的预期响应验证了我们的实验系统,并提供了一个已知信号,可以与ArcLight及其衍生物对eATP处理的响应进行比较。
Case12和ArcLight对eATP反应的比较。上图:植物根尖的MiCAM图像表达ArcLight和Case12,用彩色圆圈表示用于图形的根和背景区域。图像对应实验开始(0 s),加入ATP (100 s),反应最高(145 s, Case12,荧光增强;205 s ArcLight,荧光降低)和恢复(846 s Case12;920 s ArcLight),也可以在痕迹上的开放黑色圆圈中看到。底:将MiCAM原始数据文件导入Metamorph,并合并为一个堆栈,用于比较荧光强度的变化。从顶部的彩色圆圈区域得出的轨迹显示了1092秒的时间周期。如蓝色箭头所示,在大约100秒内加入2mm ATP或缓冲液。红色和绿色迹线分别代表ArcLight和Case12对eATP加入的响应。粉色和金色痕迹分别显示ArcLight和Case12的对应背景。绿松石色和蓝色痕迹分别显示ArcLight和Case12的缓冲控件。暗红色和深绿色痕迹分别表示ArcLight和Case12缓冲控件的背景(MiCAM图像未显示)
ArcLight显示出与Case12不同的反应,在加入eATP后直接出现一个初始的小荧光峰,随后荧光迅速下降,并逐渐增加至接近基线(图12)。4、电弧光)。实验设置允许在根内的多个细胞中同时观察ArcLight荧光强度的变化(图。5,最高)。虽然ArcLight荧光强度的降低与质膜去极化是一致的[11,12],用CBL1膜栓基序取代跨膜段Ci-VSD并没有改变暴露于eATP后的反应(图3)。5,底部)。这说明电压敏感域Ci-VSD对植物ArcLight的荧光响应没有影响。电压传感器的可有可无性表明,在应用eATP后,ArcLight不响应电压,而是通过其SEpHluorin碱基响应pH。
ArcLight和cbl1 - sefluororina227d对eATP的类似反应。从连接线所指示的根区域(0秒处的MiCAM图像,20倍物镜)派生的痕迹在1092秒的时间段内显示出来。如蓝色箭头所示,在大约100秒内加入2mm ATP或缓冲液。分数荧光变化(%dF/F马克斯)采用MiCAM相机自带的BV-Analyzer软件进行计算。y轴的分划设为6%。x轴以秒为单位表示时间。上图:ArcLight对添加eATP的反应显示在根内的多个细胞中。所有细胞都有相似的反应。背景痕迹,在添加eATP后保持不变,显示在MiCAM图像上方。底:cbl1 - sefluorina227d对添加eATP或缓冲液的响应。观察到的痕迹与ArcLight看到的相似。背景痕迹显示为黑色
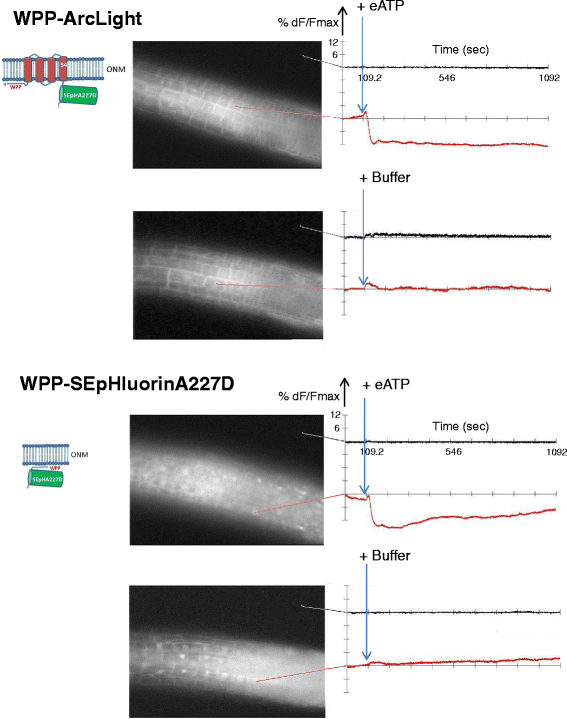
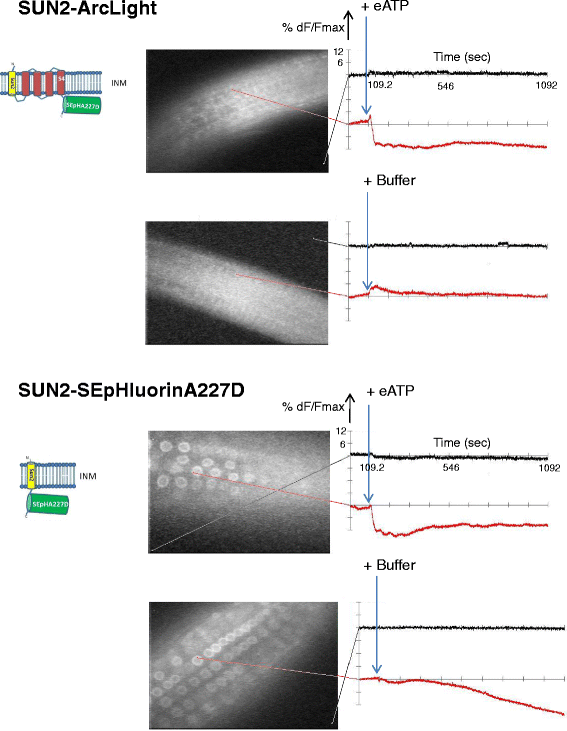
无论Ci-VSD是否存在,2 mM eATP处理引起了类似的核靶蛋白WPP-ArcLight和WPP-SEpHluorinA227D的荧光降低(图2)。6分别为顶部和底部)和SUN2-ArcLight和SUN2-SEpHluorinA277D(图。7分别是顶部和底部)。后一个结果是值得注意的监测变化,特别是在核膜上,给予SUN2-SEpHluorinA227D在核边缘的几乎独家定位。3 f和无花果。7,底部)。在所有转基因株系中添加eATP后,根内的多个细胞或细胞核显示出类似的信号3.:图S3),表明质膜和核膜对eATP处理的反应是协调的。
WPP-ArcLight和WPP-SEpHluorinA227D对eATP的反应。时间段、显示设置、采样时间与图中相同。5
SUN2-ArcLight和SUN2-SEpHluorinA227D对eATP的响应。时间段、显示设置、采样时间与图中相同。5.唯一的区别是,对于SUN2-SEpHluorinA277D(下),MiCAM图像是使用40倍物镜拍摄的
所有观察到的对eATP的反应都依赖于细胞环境中的荧光蛋白,因为可溶性GST-SEpHluorinA227D蛋白在ATP添加到溶液中时没有显示出任何荧光强度的变化(附加文件)4:图S4,上)。此外,在表达与Ci-VSD或CBL1融合的环境不敏感mCitrine的植物中,观察到对eATP应用的反应可以忽略不计(附加文件)5:图S5)。
ITMV与光
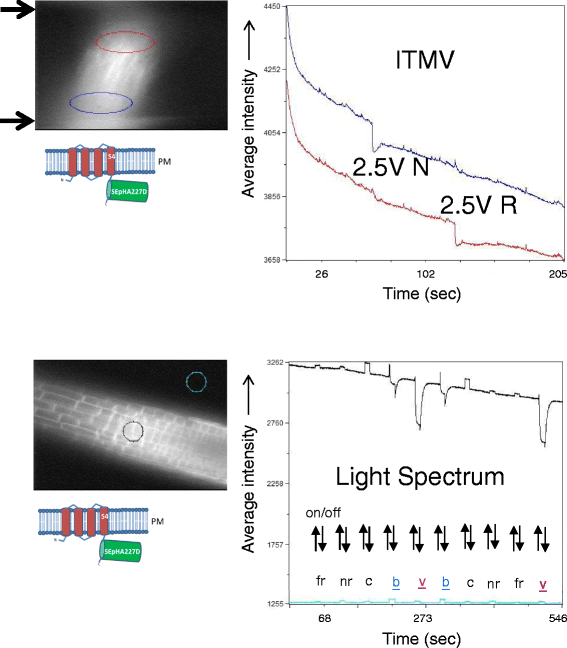
为了确定对ArcLight荧光的进一步影响,我们测试了两个可能引起膜电位变化的额外刺激:诱导跨膜电压(ITMV) [30.,31]和light [32,33].在ITMV实验中,幼苗被放置在两侧有两个电极的室中,并受到2.5 V的电脉冲。在使用额外光的实验中,将幼苗放置在琼脂糖垫室中,并在500/20 nm(即ArcLight的激发波长)的连续照明下,用不同波长的光照射。
ITMV和蓝色、紫色波长的光均引起根细胞ArcLight荧光强度的变化(图。8).然而,可溶性gst - fluororina227d也观察到了类似的荧光变化(附加文件4:图S4,中间和底部),表明与eATP处理观察到的反应不同,这种反应不需要荧光报告蛋白在细胞环境中被膜定位。等离子膜锚定的CBL1-SEpHluorinA227D对蓝色和紫色光的反应与ArcLight观察到的类似(附加文件)6:图S6,上)。然而,在所有波长的额外光照下,与根细胞中的Ci-VSD或CBL1融合的环境不敏感mCitrine的荧光基本保持不变(附加文件)6:图S6,中间和底部),表明并非所有gfp相关荧光蛋白都以类似的方式响应额外的光。
ArcLight对ITMV的响应和不同波长光的附加照明。前诱导跨膜电压(ITMV):电极位于MiCAM图像左侧的黑色箭头处。靠近用于绘制图形的电极的根区域用红色和蓝色圈起来,以对应于图形中的同源迹线。在205秒的时间内以200毫秒的间隔获取图像。电压脉冲(2.5 V,持续时间为200 ms)分别在大约60秒和120秒的正极(N)和反极(R)下施加。根据脉冲的极性,这两个区域的ArcLight会以相反的方式做出反应。这两个区域的不同效应可以解释为响应电池靠近去极化电极(即阴极)。在“正常极性”(t = 60秒时刺激)下,底部电极是阴极,蓝色圈内的细胞对细胞质ph值下降有反应,而在“反极性”(t = 120秒时刺激)下,顶部电极是阴极,红色圈内的细胞有反应。底-额外照明:光谱细节在方法部分提供。采样区域在MiCAM图像中圈出来。在546秒的时间内以100毫秒的间隔获取图像。光脉冲(开/关)持续时间为10秒。缩写:fr,远红;Nr,近红色;c,青色;b,蓝色;v,紫色。在蓝色和紫色照明下,由于光漂白,ArcLight的荧光强度降低,与低能量(蓝色= 438 nm)相比,使用高能量(紫色= 390 nm)的光时荧光强度更明显。 The recovery of fluorescence after the bleaching light has been switched off is due to diffusion of unbleached fluorescent proteins into the focal plane of the imaging objective, an effect known as FRAP (Fluorescence recovery after photo bleaching). The small increases in the signal during illumination with far red, near red and cyan result from insufficient spectral separation of the illuminating light from the optical emission path of the microscope
讨论
我们的研究旨在测试使用基于荧光强度的GEVI ArcLight(已被用作神经元电压指示器)监测根细胞质膜和核膜电压变化的可行性。膜相关荧光报告基因在拟南芥根细胞。电压传感Ci-VSD在没有额外的靶向基序的情况下赋予质膜良好的靶向性。由于尚不完全清楚的原因,当核膜靶向序列也存在时,Ci-VSD倾向于促进蛋白质聚集和/或干扰核膜靶向的特异性。
正如先前在神经细胞中的工作所预期的那样,位于这些膜系统中的ArcLight和含有ci - vsd的衍生物通过显示荧光强度的短暂降低对eATP处理做出了强有力的反应。然而,在缺少电压传感器Ci-VSD的ArcLight衍生物中观察到类似的荧光强度降低,这表明所观察到的响应不依赖于荧光蛋白的电压传感能力。因此,在根细胞中应用eATP后,ArcLight的荧光强度下降,最好的解释是反映了其SEpHluorin碱基的pH敏感性。在神经元中,ArcLight的pH敏感性不太受关注,因为H+-通量和pH值在神经元活动期间的变化是次要的。相比之下,H+-离子对植物的去极化和电活动有重要作用[34].
eATP处理后ArcLight荧光响应pH变化的降低可以理解为:eATP诱导的瞬时去极化伴随着游离细胞质钙离子浓度([Ca2+]cyt)的大量增加,如Case12的瞬时荧光增加所示。去极化和[Ca2+]cyt瞬态都是阳离子通道活动的结果,主要是K+-通道,但这些是非特异性的,也可以传导H+离子。由于存在膜电位(细胞内相对于细胞外为负)和外介质与细胞质之间的pH值梯度(外质体的pH值通常在4.5至6.5之间[35],而细胞质pH值通常在7.3左右[36]),质子沿着电化学梯度在阳离子通道打开后进入细胞,酸化其内部内容物。ArcLight的SEpHluorin成分对H+离子羽状物靠近膜和细胞质酸化,导致荧光减少。在这种情况下,ArcLight主要对膜电压变化(pH值降低)的下游后果做出反应,而不是直接对电压变化本身做出反应。
结论
总之,尽管ArcLight和这里测试的衍生物没有提供植物电压变化的直接传感器,但它们可以潜在地用作基于荧光强度的、膜定位的细胞表面和核外围pH值变化的指示器。这些基于荧光强度的pH指标显示出稳健的响应,在进一步验证和校准后,可能为基于GFP的比值pH指标提供简便的替代方案[37].开发用于植物系统的单色GEVIs需要识别对pH值变化不像ArcLight那么敏感的荧光报告蛋白。
方法
表达荧光蛋白的转基因植物
ArcLight的核苷酸序列,密码子优化表达黑腹果蝇[38],由Michael Nitabach博士(耶鲁大学)获得,然后由我们的实验室对密码子进行优化拟南芥并由GeneScript合成。转基因结构(图;2 gydF4y2Ba)是用标准的分子生物学技术生产的。转基因加上启动子(Ubi10 [39]或Rps5 [40])被组装在修饰的pBC质粒上(Stratagene, Cat。编号212215)萨尔1,XhoI位点,并将整个转基因插入萨尔1位二进制矢量pZP221 [41].各自的二进制载体包含每个转基因结构是通过介绍农杆菌属-介导转化拟南芥生态型哥伦比亚-0采用花浸法[42].本研究中使用的所有转基因系都是在我们实验室生成的。Ubi10启动子驱动整个根的表达,包括根毛。RPS5启动子主要在分裂区-过渡区表达。所显示的数据来自显示最佳表达式的行。
将转基因植物种子置于1.5 ml Eppendorf试管中,在含Triton X-100 (50 μl / 100 ml 70%乙醇)的1ml 70%乙醇溶液中摇摇20 min。种子在Eppendorf离心机中离心1分钟,去除上清液,种子在1ml 100%乙醇中重悬,并立即移液管移到无菌罩中的滤纸盘上。风干1 h后,将种子撒在培养皿中的无菌固体Murashige和Skoog (MS)培养基上,4℃保存3天分层,然后转移到光照培养箱(23℃,光照16 h,暗8 h)中生长约一周,然后按上述方法进行实验。
sefluororina277d在大肠杆菌中的表达
将gst标记的SEpHluorinA277D表达于大肠杆菌利用表达载体pET-42a(+)(包含一个gst标记和多个克隆位点(Novagen, USA)克隆BL21 (NEB, USA)。采用PCR法扩增sefluororina227d序列Bam你好/欣将dIII片段克隆到pET-42a(+)中,导入BL21细胞。用异丙基β- d -1-硫半乳糖yranoside (IPTG)在琼脂平板上诱导gst标记SEpHluorinA227D蛋白的生成。使用BugBuster GST-Bind纯化试剂盒(Novagen 79794-3 REF)分离gst标记的SEpHluorinA277D,并根据制造商的说明使用小批量方法进行纯化。
共焦显微镜
在培养皿中无菌固体MS培养基上生长的幼苗的共聚焦图像,使用配备5倍Z16 APO a变焦系统的徕卡TCS LSI显微镜(德国徕卡Microsystems CMS GmbH,购买自台湾Major Instruments)获得。
荧光成像和数据处理
荧光变化由快速CCD成像系统MiCAM02-HR记录,MiCAM02-HR专门用于钙离子和膜电压成像应用(日本Brainvision公司,采购自台湾Major Instruments公司),安装在Axiovert25倒置荧光显微镜(德国Carl Zeiss GmbH)上,配备5倍/0.12 (CP-Acromat), 20倍/0.8 (Plan-Apochromat)和40倍/0.9 Pol (EC Plan-Neofluar)物镜和一个ET YFP过滤器立方(Ex ET 500/20,分束器T515p,Em ET 535/30)或FITC滤光器立方体(Ex HQ 480/40x,分束器Q 505 LPe, Em HQ 535/50 m)。显微镜的光源是没有反射器的氙短弧灯,型号XBO 150 W/CR OFR(德国欧斯朗公司),安装在OptoSource照明器(英国Cairn研究有限公司,台湾Major Instruments购买)中。使用Metamorph (Meta Imaging Series Software, Molecular Devices, USA)获得结果显示(图2)。4,8;额外的文件6:图S6)或数据分析软件BV_Analyzer (ver1312) (Brainvision Inc., Japan)5,6,7;额外的文件3.:图S3;额外的文件4:图S4;额外的文件5:图S5)。在后者的情况下,分数荧光变化(dF/F马克斯)是使用BV_Analyzer的处理函数计算出来的。所有实验都进行了多次,并给出了具有代表性的结果。幼苗从实验中恢复后,可以转移到土壤中,在那里它们正常生长和繁殖。
体外ATP (eATP)
为了将eATP添加到幼苗中,我们使用了一个显微镜载玻片大小的开放式浴室(来自德国Würzburg大学Kai Konrad博士的礼物),由3毫米厚的有机玻璃(7.6 × 2.5 cm)制成,带有椭圆形斜角凹口(4.5 × 1.8 cm)和一个大盖片(6 × 2.5 cm)粘在底部。在1倍成像溶液中填充1%琼脂糖[5 mM氯化钾,10 mM MES水合物,10 mM氯化钙,用三(羟甲基)氨基甲烷调节到pH5.8] [29,43]来制作紧密的琼脂块。室温凝固后,取出琼脂块,转移到圆形培养皿中,在1x成像液中保存直到使用,将其切成约1cm宽的薄片。
安装拟南芥将400 μl 1x成像液移入开顶室,从MS培养基中取出一株完整的幼苗纵向放置于成像液中。然后将1厘米的琼脂切片(如上所准备的)放在要成像的延伸根区域的顶部,让根尖在一侧突出,而叶子在另一侧。用细镊子小心地把幼苗拉到根尖正好在琼脂块下面。去除琼脂块周围多余的溶液。然后将腔室安装在倒置显微镜上。将硅管一端连接到吉尔森移液器上,如图所示,在硅管中填充50 μl 2 mM ATP在1倍成像溶液或缓冲液中进行缓冲控制实验后,另一端连接到一个支架上,支架位于根所在琼脂块边缘上方(附加文件)7:图S7A)。然后开始荧光记录,并在指定时间将eATP溶液移液到浴室。
为了测试可溶性GST-SEpHluorinA227D,将200 μl分离的蛋白在洗脱缓冲液EB (BugBuster GST-Bind Purification Kit, Novagen)中(蛋白浓度约为30 μg/ml)置于Bügelkammer(见ITMV章节)中,从盖片边缘上方的硅管中加入50 μl eATP溶液,其中也含有30 μg/ml GST-tagged SEpHluorin以保持蛋白浓度。
感应跨膜电压
对于电压脉冲的应用,我们使用Grass SD刺激器(Grass, USA)连接到安装在载玻片支架上的两个电极(Bügelkammer, Krüss GmbH, Germany)。Bügelkammer的两个电极分别安装在不同的塑料箍上,可以分别夹在样品上,这样电极的定位距离为200 μm。将24 × 40 mm盖片置于开放的Bügelkammer, 200 μl 1x成像液[29,43]置于所述盖卡瓦上,所述第一电极夹紧在所述盖卡瓦上。将幼苗水平放置在第一电极上方的成像溶液中,并将第二电极夹紧到盖卡瓦上,使根位于第二电极之下。然后将一个18x18毫米的封面卡放在根的顶部以稳定(附加文件7:图S7B)。两个电极之间的根区成像(例如,见图。8).为了测试可溶性GST-SEpHluorinA227D,将洗脱缓冲液EB (BugBuster GST-Bind Purification Kit, Novagen)中分离的蛋白(蛋白浓度约为30 μg/ml)置于Bügelkammer中,用18x18 mm的盖片覆盖。
光治疗
为了测试额外的光脉冲对ArcLight及其衍生物荧光强度的影响(在500/20 nm的连续照明下,ArcLight的激发波长),使用SPECTRA X光引擎(Lumencor,美国,从台湾的Major Instruments购买)照明在390/18 nm(紫色),438/24 nm(蓝色),475/28 nm(青色),589/15 nm(近红色)和632/22 nm(远红色)。这些波长的额外光以30°角和10厘米的距离照射在顶部开孔室中安装在琼脂块下的幼苗上,如eATP实验所述。在SPECTRA X光引擎上,光强度设置为10%,聚焦在成像平面上。使用GhostMouse软件在特定时间点自动开启和关闭光谱X光引擎的特定波长(http://tw.vrbrothers.com)或手工进行。为了测试可溶性GST-SEpHluorinA227D,在洗脱缓冲液EB (BugBuster GST-Bind Purification Kit, Novagen)中分离的蛋白(蛋白浓度约为30 μg/ml)被放置在Bügelkammer中,用18x18 mm的盖片覆盖,并如上所述用SPECTRA X Light Engine光照。
缩写
- 电弧光:
-
sefluororina227d熔合到Ci-VSD
- Case12:
-
钙传感器12
- CBL1:
-
钙调神经磷酸酶b样蛋白1。的拟南芥CBL1蛋白(At4g17615)含有一个肉豆丝化甘氨酸和一个棕榈醇化半胱氨酸,它们将荧光融合蛋白拴在质膜的细胞质表面
- Ci-VSD:
-
电压敏感域Ciona intestinalisvoltage-sensing磷酸酶
- eATP:
-
细胞外ATP
- 烦恼:
-
Förster共振能量传递
- GEVI:
-
基因编码电压指示器
- 销售税:
-
谷胱甘肽S-transferase
- ITMV:
-
感应跨膜电压
- mCitrine:
-
单体的水晶
- RANGAP1:
-
gtpase激活蛋白1
- SEpHluorin:
-
超黄道(SE)氟(pH值敏感的fluorescent prote来在)
- SEpHluorinA227D:
-
超黄道(SE)氟(pH值敏感的fluorescent prote来在)中含有一种A227D取代,使神经元具有电压敏感性
- SUN2:
-
Sad1 / unc-84结构域蛋白2。的拟南芥SUN2蛋白(At3g10730)有一个跨膜结构域,可以在核膜内表面定位SUN2融合蛋白
- WPP:
-
WPP序列包含一个Trp(W)-Pro(P)-Pro基序,由28-131的氨基酸组成拟南芥RANGAP1 (At3g63130),足以将融合蛋白靶向到外核膜
参考文献
Jaffe LF, Nuccitelli R.电气控制开发。生物物理学报。1977;6:445-76。
莱文M,史蒂文森CG。生物电信号调节细胞行为和组织模式:生物医学工程的挑战和机遇。中国生物医学工程学报,2012;
张峰,张敏。细胞和组织极性的电化学控制。中国生物医学工程学报。2014;30:317-36。
科恩AE, Venkatachalam V.将生物电引入光明。生物物理学报。2014;43:211-32。
基于光的电生理学。Nat Methods. 2012;9:38。
Knöpfel T.用于分析神经元电路的遗传编码光学指示器。神经科学,2012;13:687-700。
Miyawaki A, Niino Y.生物成像的分子间谍-荧光蛋白探针。中国生物医学工程学报,2015;
张志刚,张志刚。用荧光蛋白测量膜电压。《寒泉哈布议定书》2013;7:606-13。
阿尔弗德SC,吴J,赵Y,坎贝尔再保险,Knopfel t Optogenetic记者。《生物细胞》2013;
Tsutsui H, Karasawa S, Okamura Y, Miyawaki A.利用新型荧光蛋白改进膜电压测量。Nat Methods. 2008; 5:683-5。
金玲,韩忠,李志强,李志强,陈志强,等。基于荧光蛋白电压探针的单动作电位和阈下电事件成像。神经元。2012;75:779 - 85。
韩震,金亮,陈峰,李志强,李志强,等。基因编码荧光蛋白电压探针ArcLight的机理研究。科学通报。2014;9:e113873。
Miesenböck G, De Angelis DA, Rothman JE。用ph敏感的绿色荧光蛋白观察分泌和突触传递。大自然。1998;394:192-5。
Miesenböck G. Synapto-pHluorins:基因编码的突触传递报告。《寒泉哈布议定书》2012;2012:213 - 7。
村田Y,岩崎H,佐佐木M,稻叶K,冈村Y.与本征电压传感器耦合的磷酸肌醇磷酸酶活性。大自然。2005;435:1239-43。
马茜,M西斯扎克,Stefano G, Renna L, Azzarello E, Pandolfi C,等。根尖电网络活动的时空动态。中国科学院学报(自然科学版)2009;
赵德杰,王志智,黄玲,贾亚平,冷建强。利用多电极阵列原位绘制向日葵幼苗叶片变异电位的时空图谱。科学通报2014;4:5435。
Matzke AJM, Weiger TM, Matzke M.核离子通道:电生理学满足基因组。植物学报。2010;3:642-52。
Matzke AJM, Matzke M.膜“电位组学”:朝着电压成像在细胞群水平在活植物的根。植物科学进展(英文版);
葛芬C, Karnik R, Larson E, Lefoulon C,王勇,Waghmare S,等。囊泡运输蛋白征用Kv通道电压传感器电压依赖的分泌。Nat Plants, 2015, DOI:10.1038 / NPLANTS.2015.108
杨晓燕,王晓燕,王晓燕,王晓燕。植物细胞外ATP信号通路的研究进展。细胞生物学杂志,2010;20:601-8。
罗丝A,迈耶i。一个工厂特有的区域,RanGAP负责它的目标到工厂的核边缘。中国科学院学报(自然科学版)2001;
Deal RB, Henikoff S.组织中单个细胞类型的基因表达和染色质分析的简单方法。Dev Cell. 2010; 18:1030-40。
田田,福田拟南芥有丝分裂期间的SUN蛋白及其参与核形成。植物J. 2011; 66:629-41。
Batistic O, Sorek N, Schültke S, Yalovsky S, Kudla J.双脂酰修饰决定CBL/CIPK Ca2+信号复合物的定位和质膜靶向拟南芥.植物学报。2008;20:1346-62。
Souslova EA, Belousov VV, Lock JG, Strömblad S, Kasparov S, Bolshakov AP,等。增加动态范围的单荧光蛋白Ca2+传感器。BMC生物技术,2007;7:37。
王志强,王志强,王志强。荧光蛋白对环境敏感性的研究。原理与应用。中国生物化学杂志,2001;
Perron A, Mutoh H, Launey T, Knöpfel T.红移电压敏感荧光蛋白。化学与生物学报。2009;16:1268-77。
Loro G, Drago I, Pozzan T, Schiavo FL, Zottini M, Costa a .针对不同亚细胞区室的cameleon揭示了严格的细胞质/线粒体Ca2 +植物细胞的处理关系。植物J. 2012; 71:1-13。
Kralj JM, Hochbaum DR, Douglass AD, Cohen AE。电刺入大肠杆菌用荧光电压指示蛋白探测科学。2011;333:345-8。
邹鹏,赵颖,douglas AD, Hochbaum DR, Brinks D, Werley CA,等。明亮和快速多色电压报告通过电致变色FRET。Nat Commun. 2014;5:4625。
李志强,李志强,李志强,等。植物细胞质膜光诱导超极化的研究进展。植物学报2001;26:1-13。
王晓明,王晓明,王晓明,等。植物根系的光感应特性研究。植物学报。2007;2:106-8。
植物质膜质子泵atp酶:一种具有多重生理作用的高度调控的p型atp酶。中国生物医学工程学报。2009;47:645 - 55。
Felle HH。pH值:植物细胞中的信号和信使。植物学报2001;3:577-91。
沈娟,曾勇,庄霞,孙玲,姚霞,Pimpl P,等。细胞器pH值拟南芥endomembrane系统。植物学报。2013;6:1419-37。
Martinière A, Desbrosses G, senenac H, Paris N.植物pH基因编码传感器的开发与特性。植物科学进展(英文版);doi:10.3389 / fpls.2013.00523.
曹g, Platisa J, Pieribone VA, Raccuglia D, Kunst M, Nitabach MN。完整神经回路中的基因靶向光电生理学。细胞。2013;154:904-13。
Grefen C, Donald N, Hashimoto K, Kudla J, Schumacher K, Blatt MR.一种基于泛素-10启动子的荧光蛋白标记载体,在瞬时和稳定表达研究中促进了时间稳定性和天然蛋白分布。植物J. 2010; 64:355-65。
韦杰斯D,弗兰克-范戴克M,文肯RJ,昆特A,胡伊卡斯P,奥弗林加R.安拟南芥由核糖体蛋白S5基因半显性突变引起的分钟样表型。发展。2001;128:4289 - 99。
Hajdukiewicz P, Svab Z, Maliga P.小型,多功能pPZP家族农杆菌属植物变换的二元向量。植物分子生物学,1994;25:989-94。
Clough SJ, Bent AF.花浸渍:一种简化的方法农杆菌属-介导转化拟南芥.植物学报(英文版);1998;
罗罗G,科斯塔A.线粒体和核Ca2+动力学成像拟南芥的根源。《寒泉哈布议定书》2013;8:785 - 5。
Graumann K, Vanrobays E, Tutois S, Probst AV, Evans DE, Tatout c拟南芥以及它们与新型kash结构域蛋白AtTIK的相互作用。中国科学(d辑),2014;
杨晓明,李文杰,王晓明,等。植物核膜中太阳结构域蛋白的研究进展。植物学报,2010;
致谢
我们感谢陈地图的有益建议和讨论;Jason Fu负责显微镜管理;Hiroo Fukuda博士,东京大学SUN2;Roger Deal博士,埃默里大学,WPP;Thomas博士Knöpfel,伦敦帝国理工学院,V3.1-mCitrine;以及耶鲁大学的Michael Nitabach博士,为ArcLight的序列。我们非常感谢本文第一个版本的匿名审稿人提供的许多有用的评论。
资金
中央研究院(AS)和植物与微生物生物学研究所(AS)为这项工作提供了慷慨的财政支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明没有利益竞争。
作者的贡献
AJMM和MM设计了这项研究。AJM进行了实验工作。AJMM和MM对结果进行解读,撰写论文并批准最终稿。两位作者都阅读并批准了最终的手稿。
作者的信息
不适用。
数据和材料的可用性
不适用。
附加文件
附加文件1:图S1。
mCitrine、野生型GFP、SEpHlourinA227和SEpHluorin A227D氨基酸序列的比较。(PDF 62kb)
附加文件2:图S2。
表达可溶性Case12和质膜定位Ci-VSD-mCitrine和CBL1-mCitrine的转基因植物根系荧光共聚焦图像(PDF 610kb)
附加文件3:图S3。
加入eATP后多个根细胞中报告蛋白荧光强度的同时变化(PDF 371 kb)
附加文件4:图S4。
可溶性GST-SEpHlorinA227D对eATP、光和ITMV的响应。(PDF 193kb)
附加文件5:图S5。
Ci-VSD-Citrine和CBL1-Citrine对eATP的反应。(PDF 225kb)
附加文件6:图S6。
CBL1-SEpHluorinA227D但对环境不敏感mCitrine对不同波长的光的额外照明有反应。(PDF 627kb)
附加文件7:图S7。
用eATP、light和ITMV处理的装裱幼苗的照片。(PDF 196kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
Matzke, a.j., Matzke, M. ArcLight在植物中的表达和测试,一种用于神经科学研究的遗传编码电压指示器。BMC植物生物学15日,245(2015)。https://doi.org/10.1186/s12870-015-0633-z
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-015-0633-z
关键字
- 电弧光
- 电气信号
- 基因编码电压指示器
- pH-sensitive指示器
- 超级黄道的氟