抽象的
背景
粉状霉菌(PM)是黄瓜的重要疾病(Cucumis巨大成功L.)。CsaMLO8公司以前被鉴定为黄瓜PM的候选易感基因,原因有两个:1)该基因在进化上聚集在cladev中,先前已被证明含有所有已知的PMMLO公司-在双子叶植物中发现的PM类易感基因;2) 该基因与5号染色体上的一个QTL共定位,以检测下胚轴对PM的特异抗性。
方法
CsaMLO8公司对感病和抗性黄瓜的等位基因进行了克隆和转化mlo.-变异番茄。黄瓜幼苗接种Podosphaera xanthii用qRT-PCR方法检测接种后不同时间点组织中CsaMLO8的表达。观察到的功能丧失等位基因的出现CsaMLO8公司对黄瓜重测序材料进行了研究生物信息学.
结果
我们克隆了CsaMLO8公司来自感病和抗性黄瓜基因型的等位基因,后者携带下胚轴抗性的QTL。我们发现在抗性基因型中插入一个非自治类LTR逆转录转座因子会导致基因的异常剪接CsaMLO8公司mRNA。大肠杆菌野生型等位基因的异源表达CsaMLO8公司在一个番茄mlo公司-突变体恢复了PM敏感性。然而,异源表达的CsaMLO8公司从抗性黄瓜基因型中克隆的等位基因未能恢复PM敏感性。此外,我们还证明了接种敏感黄瓜的PM病原体Podosphaera xanthii诱导转录上调的CsaMLO8公司在下胚轴组织中,但不在子叶或叶组织中。这与观察到的QTL在CsaMLO8公司-基因座引起下胚轴组织的完全抗性,但只有子叶和真叶的部分抗性。我们研究了函数丧失等位基因的发生CsaMLO8公司对黄瓜种质进行了初步研究生物信息学方法利用115份黄瓜种质的重测序数据,发现115份黄瓜种质中有31份存在该等位基因。
结论
CsaMLO8公司是一个功能性的PM易感基因,特别是在下胚轴中,在接种PM病原菌后,其转录上调P苍耳子。基因突变导致功能丧失CsaMLO8公司由于转座子的插入被发现是下胚轴对PM抗性的原因。这个特殊的等位基因CsaMLO8公司被发现发生在27%的ReseChenced Cucumber access中。
背景
黄瓜(Cucumis巨大成功是一种重要的经济作物,全球年产量超过65兆吨[1].白粉病(PM)是瓜类最常见的病害之一,是制约黄瓜生产的重要因素。据报道有两种真菌引起黄瓜中PM,即Podosphaera xanthii(同义词P. Fusca.,以前的名称Sphaerotheca Fuliginea)以及Golovinomyces cichoracearum(以前的名字)菊科白粉菌).其中,P苍耳被认为是造成葫芦中PM的主要原因[2,3.].
几只二数(例如,[)已经开展了抗性黄瓜品种的育种(例如,[4- - - - - -6])但迄今为止,潜在的抗性基因还没有功能上的特征。随着2009年黄瓜基因组(中国长型自交系9930)的发表[7],和其他几个黄瓜种质已被重新测序[8,9]目前,鉴定黄瓜抗霉病致病基因的时机已经成熟。
传统上,抗性作物的繁殖是通过抵抗抵抗(R)基因,通常来自作物的野生亲属。r蛋白,最常见的核苷酸结合,富含亮氨酸富含重复(Nb-LRR)类型,能够识别相应的aairulence(Avr公司)病原体的基因产物,或与病原体攻击相关的宿主因子的降解产物[10].这触发了宿主细胞中的防御响应,通常与过敏反应(HR)相关,导致细胞死亡[10].作为R基因认识到非常特异性的产品,迟滞和随后的就业R基因对病原菌施加选择性压力,使其进化到不再被寄主植物识别。因此,R- 基于乙烯的抗性通常是突破的,病原体的竞争很快,特别是对于多功能病原体,如粉状霉菌真菌[10].
另一种为R-基因介导的耐药性是易感性受损的鉴定(年代)基因11].大多数病原体需要他们的主机合作能够成功建立兼容的互动[12].对于生物养殖病原体如霉菌种类,尤其如此,因为它们大大依赖于与(生活)宿主细胞的长期相互作用,以促进其传播[12]. 因此,多种寄主基因的表达对病原菌至关重要。这样的基因可以看作年代基因,并且可以起作用例如促进宿主识别和渗透,宿主防御的负调节或满足病原体的代谢和结构需要[12]. 功能丧失突变年代基因被认为是导致持久的,广谱的,隐性遗传抗性[13,14].
大麦mlo.基因是最著名的受损基因的例子之一年代基因。之后首先在20世纪40年代发现了一个诱变的大麦人群[15],功能丧失mlo.大麦中的等位基因产生了抗PM大麦品种。这些植物在田间已经生长了几十年,迄今为止还没有破坏新的致病性霉菌品种的抗性,这为其耐用性提供了证据年代-基因抗性[16].后的大麦MLO公司基因被克隆[17,人们发现MLO公司基因在整个植物界都是保守的,在高等植物中作为一个多拷贝基因家族存在[18,19]. 在几种植物中,MLO公司-类似基因已经被发现与PM易感性有关,例如拟南芥,番茄,豌豆,胡椒,烟草,面包小麦和潜在的葡萄和桃子[20.- - - - - -27.]. 研究发现,在植物的系统发育树中MLO公司基因家族所有MLO-如在单子叶植物中检测到的PM s基因聚类在枝支IV,而所有MLO-喜欢年代在CLADE V.中鉴定在CLADE V.另一片(I,II,III和VI)港口中鉴定在分枝叶植物簇中MLO-就像那些尚未被证实年代基因(19].
黄瓜港的基因组13推定MLO-像基因一样[28.].其中,三(即,CsaMLO1公司,CsaMLO8公司和CsaMLO11,分别具有瓜类基因组数据库ID[Csa1M085890.1]、[Csa5M623470.1]和[Csa6M292430.1])在MLO公司基因家族,因此可以被视为候选人年代-抗白粉病基因[28.].CsaMLO8公司特别令人兴趣,因为它在基因组上的位置(CHR5:24,827,408..24,831,456)与之共定PM5.2,一个最近鉴定的主要QTL解释了来自抗性黄瓜自交系WI 2757的F3家系抗下胚轴表型变异的74.5% [29.].先前,黄瓜对PM的“kychotyl”或中间抗性在几根黄瓜线之间的交叉中是一种可隐性的继承的单一形式性状,并且通过完全抗性的幼杆,茎和叶柄组织和部分抗叶片和子叶。建议在黄瓜的总PM电阻中发挥重要作用,因为它看起来不可能在没有隐性缺核性抗性基因的情况下造成完全抗性的抗性[5]. 在育种实践中,下胚轴抗性等位基因的缺失导致幼苗对PM敏感。该等位基因几乎存在于所有的现代腌制黄瓜品种中,大部分抗性长黄瓜品种(Freddy-Hermans,personal communications)中,显示了黄瓜下胚轴抗性的农业意义。
在这里,我们报道克隆CsaMLO8公司从敏感和(下胚轴)抗性黄瓜基因型。我们发现,在转录水平上,从抗性基因型获得的等位基因有72或174 bp的缺失,这是由于在基因组水平上插入LTR逆转录转座因子导致的选择性剪接。番茄的互补mlo.- 用野生型和δ174等位基因进行CsaMLO8公司显示出野生型CsaMLO8公司是一个功能性易感基因(年代- 那烯),而Δ174等位基因已经失去了其功能年代- 导致PM电阻。此外,QRT-PCR显示CsaMLO8公司接种后转录上调P苍耳在下胚轴组织中,而不是在叶或子叶中,这解释了为什么细胞功能丧失CsaMLO8公司在下胚轴中提供特别的抗性。
结果
克隆和测序CsaMLO8公司来自易感和抗性基因型的编码序列
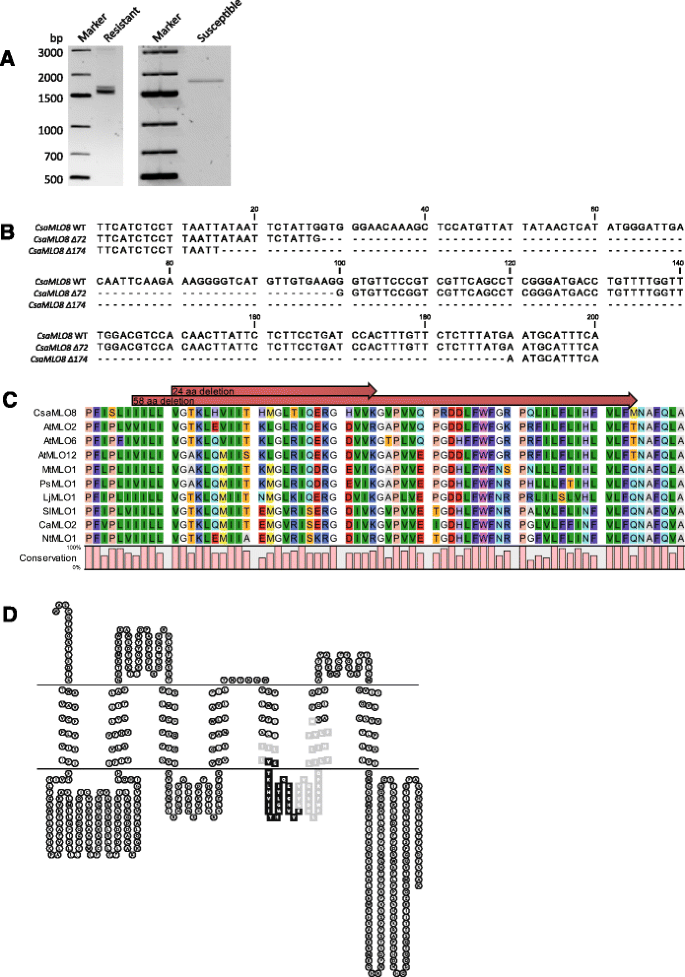
我们使用来自敏感的野生型黄瓜品种或已知为该病纯合子的抗性育种系的RNA进行RT-PCR下胚轴抗性以QTL为模板。然而,我们从易感基因型获得的产物具有预期的大小(即1726 bp),我们从抗性基因型获得了两种不同的产物,均小于预期(图。1A).序列分析表明CsaMLO8公司从易感基因型获得的mRNA变体与预测的编码序列相同。然而,从抗性基因型获得的两个mRNA产物分别具有72和174bp的(非框架)缺失。174bp删除变体对应于完整的第11个外显子的损失CsaMLO8公司基因,而72bp缺失变体对应于具有规范接头位点(5'-GT和Ag-3')的第11个外显子片段的损失(图。1B.). 此外,与参考基因组(附加文件)相比,抗性基因型的编码序列有5个(同义)SNP1).
特征化CsaMLO8公司来自抗性和易感性黄瓜基因型的等位基因。A.以黄瓜抗感基因型cDNA为模板进行PCR扩增CsaMLO8公司特定的引物。扩增产物用1.25%琼脂糖凝胶分析。然而从易感基因型的cDNA扩增出的产物给出了一个预期大小的单条带,而抗性基因型的cDNA产生了两个单独的条带,都比预期的小。B全长CsaMLO8公司对黄瓜感病基因型和抗病基因型的cDNA进行了序列测定。从易感基因型获得的(野生型)序列和从两个缺失变体获得的序列之间显示出部分比对(∆72和∆174)从抗性基因型获得。数字是相对于路线起点的。CCsaMLO8蛋白与进化枝V编码的其他蛋白的部分比对MLO S公司-几个物种的基因。氨基酸残基根据RasMol颜色方案着色。缺失的24和58个氨基酸残基∆72和∆174种CsaMLO8公司用红色箭头表示。排列下方的条形图表示每个氨基酸位置的保守性。D用HMMTOP 2.1测定预测的CsaMLO8蛋白的跨膜结构的图示[30.].等离子体膜由两条水平线表示。预计在黑色中突出的氨基酸残基被删除在由Δ72变体编码的蛋白质中删除CsaMLO8公司以黑色和灰色突出显示的基因残基预计将在该基因编码的蛋白质中被删除∆174型CsaMLO8公司基因
为了确定在mRNA中发现的72和174 bp缺失对预测的CsaMLO8蛋白质序列的影响,将预测的CsaMLO8蛋白质与来自其他几种物种的clade V S-基因编码的MLO蛋白质数据集对齐,即。,拟南芥,桶三叶草,豌豆,莲花,西红柿,胡椒和烟草(附加文件2). 在72和174bp缺失变体中,由缺失区域编码的区域在不同的MLO蛋白中高度保守(图。1C).利用HMMTOP 2.1软件对野生型等位基因CsaMLO8蛋白的跨膜结构进行预测[30.]. 所预测的野生型蛋白的跨膜结构与Devoto等人确定的大麦MLO结构基本一致[18,19]. 72和174bp的缺失分别对应于CsaMLO8(预测的)第三个细胞质环中24个和58个氨基酸残基的区域的去除(图。1D).
两者的相对转录丰度CsaMLO8公司通过使用PM抗性黄瓜的不同组织(即次琥珀酰基,子叶和真叶)的QRT-PCR来确定特征在于72和174bp缺失的剪接变体缺失,所述PM抗性黄瓜的不同组织(中丘酰,子叶和真叶),或者接种PM或非接种。它似乎174bp缺失剪接变体是最丰富的同种型,而72bp缺失剪接变体在每种组织中较少,无论组织是否被接种(附加文件)3.).
互补SlMLO1型番茄功能丧失突变体CsaMLO8公司重量和CSAMLO8Δ174
转录本的序列分析CsaMLO8公司由易感基因型和抗性基因型导致的假设是CsaMLO8公司是一个功能S -而174bp缺失等位基因(CSAMLO8Δ174)的功能已经丧失S -基因。为了测试这些假设,这两个等位基因在先前描述的番茄中过表达mlo.-突变,在番茄中携带突变SlMLO1型基因和抗番茄白粉病,新叶甲虫[21.].
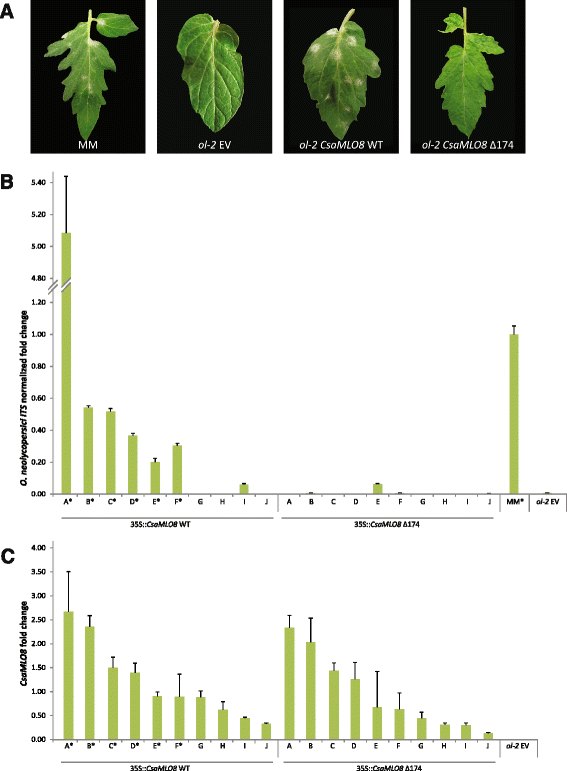
每个构建体的十个独立转基因个体的切割(35S::CsaMLO8公司重量和35 s: CsaMLO8∆174)被番茄PM病原体侵袭O。新菌.通过在叶片上寻找PM症状,定性评价白粉病的敏感性(图。2A,附加文件4).十分之六的个体转化者表达CsaMLO8公司WT被评分为易受PM的影响,而无表达的转化体CSAMLO8Δ174得分为易受PM影响。通过对从接种叶片中分离的DNA进行qPCR,利用pcr技术对PM的敏感性进行了定量分析O。新菌特定的引物。这表明O。新菌对PM敏感的植株的生物量至少为0.20,而对PM敏感的植株的生物量低于0.20(图。2B.).此外,通过使用QRT-PCR测定每种转基因个体中的转基因的转录物丰度CsaMLO8公司特异性引物(图。2C).这证实了转录水平CsaMLO8公司重量和CSAMLO8Δ174是可比的。6CsaMLO8公司重量转化体易于PM的敏感性CsaMLO8公司表达比四CsaMLO8公司WT转化体对PM有抵抗力。
互补醇-2番茄CsaMLO8公司WT恢复PM敏感性,而与CSAMLO8Δ174没有。抗PM醇-2番茄突变体SlMLO1型[21.]是用35秒转换的:CsaMLO8公司WT构造,a 35S::CSAMLO8Δ174构造,或一个空向量(EV)控制。从这些转化子的插枝上接种一种新叶甲虫孢子悬浮液。作为附加控制,我们使用了野生型,易感品种。赚钱的人(MM)。A.易感控制的表型mm,耐力转化ol-2,和转基因个体过度表达CsaMLO8公司WT或CSAMLO8Δ174在里面醇-2背景。接种后16天服用照片。B通过qpcr之间的相对量化新叶甲虫在感病的MM中种植gDNA,抗性的EV转化ol-2,和转基因个体过度表达CsaMLO8公司WT或CSAMLO8Δ174在里面醇-2背景。折射率变化相对于敏感对照MM进行了归一化处理。条形图表示3次技术重复的平均折射率变化。误差条表示标准偏差。星号表示宏观评价为白粉病易感植物。CqRT-PCR相对定量分析CsaMLO8公司番茄管家基因的表达与表达SlEF-α在电动汽车改变了醇-2和转基因个体过度表达CsaMLO8公司WT或CSAMLO8Δ174在里面醇-2背景。酒吧表示平均折叠变化超过3个技术复制。误差条表示标准偏差。星号表示基于宏观评估的植物易受粉状霉菌的影响
可转换元件的测序和表征CsaMLO8公司
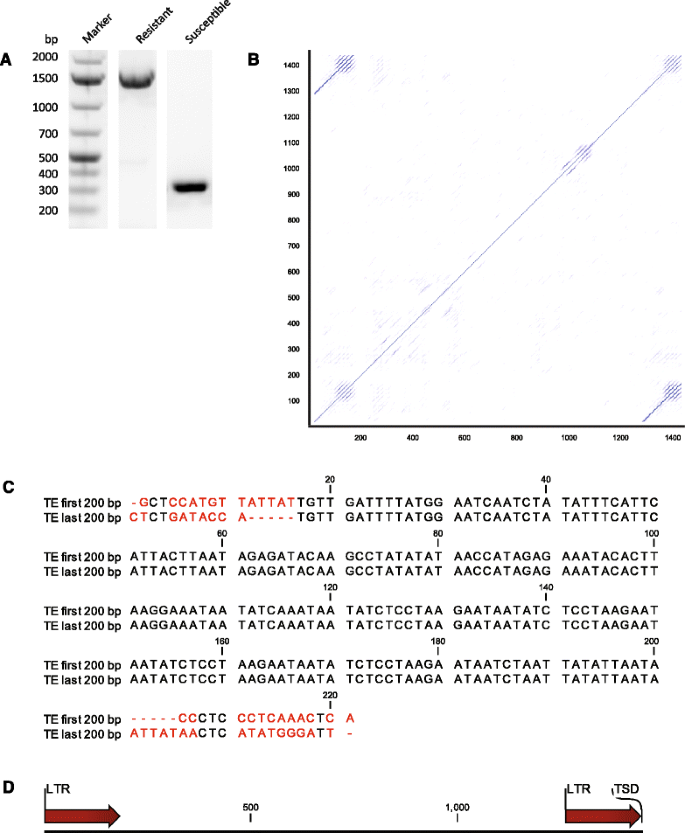
中删除的原因CsaMLO8公司编码序列,我们使用来自敏感和抗性黄瓜基因型的DNA作为模板进行PCR,引物旨在扩增包含缺失的区域CsaMLO8公司.从敏感基因型扩增的产物达到预期大小(即346 bp),而从抗性基因型扩增的产物更大(约1500 bp,图。3A).对扩增产物进行序列分析,发现抗性基因型与易感基因型在基因组DNA序列中有1449 bp的插入。在抗性基因型DNA中的插入与基因缺失的区域相吻合CsaMLO8公司这种基因型的信使rna。用点图描述这个基因组插入(图。3B.)揭示了长期重复(LTRS)的长度的存在。200 BP。插入的第一和最后200bp之间的对准确认了以5'-tg-3'开始的184bp长LTR,并以5'-ta-3'结束(图。3C).LTRS彼此共享100%的序列标识。在3'LTR之后,有5个BP的重复CsaMLO8公司在插入之前(目标站点复制,TSD,5'-Attat-3')。无法在插入中检测到开放阅读框架(ORF)。这些发现导致我们的结论是,根据柳条子等人提出的转换元素分类方案,插入件最有可能是I级的非自动转换元素(TE),订单LTR。[31.].
基因的扩增和测序CsaMLO8公司从抗性基因型的基因组DNA中发现插入了一个1449 bp长的转座因子(Transposable Element, TE)。A.的基因组区域CsaMLO8公司其中抗性基因型的编码序列缺失是从敏感基因型和抗性基因型分离的DNA中扩增出来的。扩增产物在1.25%琼脂糖凝胶上分析。而从易感基因型扩增的产物达到预期的大小,而从抗性基因型扩增的产物大于预期。B按照(a)中所述的耐药基因型扩增的产物测序,揭示了长度为1449bp的插入。DOT图是插入,看看序列是否包含重复元素。C插入的第一个和最后200bp,加15bpCsaMLO8公司在插入之前和之后彼此对齐,以验证是否存在长末端重复(ltr)。序列中未对齐的部分以红色突出显示。可以看出,插入的第一个184 bp与插入的最后一个184 bp完全相同。有一个重复的5个bp从CsaMLO8公司插入前后(靶位点重复,5′-ATTAT-3′)。D插入的示意图。显示了ltr和3′TSD的位置
黄瓜基因组中的类似突变
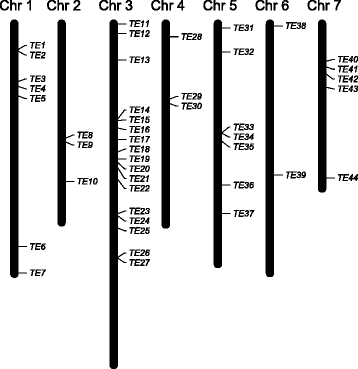
为了在黄瓜基因组中鉴定同源的、可能是自主的转座因子,我们在黄瓜参考基因组(中国长自交系9930,v2)上进行了BLASTn搜索,其中在CsaMLO8公司作为查询。我们鉴定了169个同源LTRs。先前设计的工具[32.用于筛选由两个推定的同源LTR序列界定的区域的基因组。在20kb的窗口内的两个推定的同源LTR序列被认为是推定的同源te的边界。根据观察到LTR回收转换在尺寸的3至15kb之间的观察中,确定20kb窗口[33.],我们知识的唯一例外是非常大的食人魔豆类中发现的反转录转座子[34.,它有大约5 kb的LTRs,因此大小约为22 kb。共鉴定出44个推测的TEs,随机分布在黄瓜参考基因组的所有7条染色体上(图1)。4,附加文件5). 对于20个假定的TE,从基因组中提取LTR之间的完整序列,并与在中发现的TE序列进行比较CsaMLO8公司(附加文件6).发现大多数推定的TES的长度与CsaMLO8公司-TE,介于1到2kb之间。一个假定的TE比平均值大得多,为7142bp,而一个假定的TE比平均值小得多,即367bp。在20个假定的TE37中,只有一个能检测到开放阅读框(ORF)。根据对所有非冗余蛋白质数据库的BLASTp搜索,这个长度为411bp的ORF不能得到与已知蛋白质有任何相似性的预测蛋白质,因此被认为是假阳性ORF。我们的结论是,我们无法检测到一个含有可能导致非自主TE插入的基因的自主TECsaMLO8公司。
TE等位基因的出现CsaMLO8公司在黄瓜种质中
我们有兴趣了解Te-Allele的频率CsaMLO8公司我们已经在我们的黄瓜种质中鉴定了抗病基因型。正如Qi等人(2013)重新测序了115份非常不同的黄瓜材料的核心集合[8],我们决定执行生物信息学寻找突变体的存在CsaMLO8公司等位基因含有可转座元素TE)和/或这些基因型中的野生型(WT)等位基因。对于21个重新开始的换乘(18%)我们只能检测到表明存在Te-等位基因的读数。对于82次重新调整(71%),我们只能找到表明存在WT-等位基因的读数。对于10种附加(9%),我们发现读取指示存在两位等位基因。对于剩下的两种进入(2%),可以识别出不均匀的存在(表1,附加文件7). 等位基因CsaMLO8公司由QI等人定义的四个地理群(即东亚,欧亚和印度人而不是西双版纳)中有三名。[8]. 在31份材料中,TE等位基因CsaMLO8公司被检测出(即Pi215589)属于野生黄瓜,Cucumis巨大成功变量。hardwickii,而其他30份材料属于黄瓜栽培品种,c .巨大成功变量。萨提夫.
接种P苍耳诱导的转录CsaMLO8公司在缺苗组织中,但不含易感黄瓜的叶组织
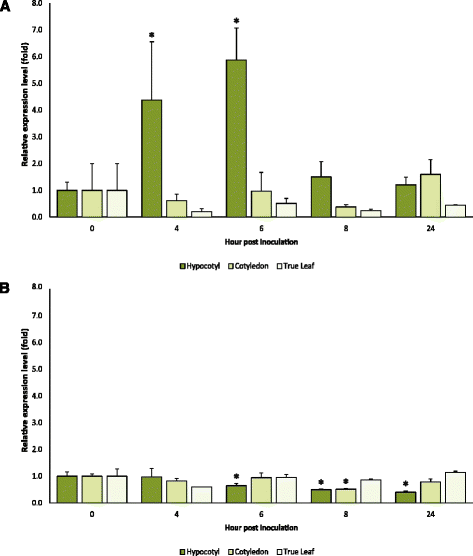
MLO公司与PM敏感性有关的基因在接种数小时后在几种植物中上调(例如[26.,35.,36.])。看看是否相同CsaMLO8公司,我们进行了qRT-PCR实验来定量CsaMLO8公司在PM接种之后在4,6,8和24h之前和在4,6,8和24h之前和在4,6,8和24h之前和在4,6,8和24小时的缺苗基,子叶和叶组织中的转录物丰度(图。5).对于PM敏感植物,我们发现在胚轴组织中CsaMLO8公司转录本丰度在4 hpi时显著升高(P= 0.037)和6 hpi (P = 0.004)与接种前的转录物丰度(0 hpi)相比。显著性差异在8hpi后消失(P= 0.212)和24 hpi (P = 0.281). 相比之下,CsaMLO8公司接种PM后,子叶和真叶的转录物丰度在任何时间点都没有显著变化(P > 0.05)(图。5A). 对于PM抗性植物,我们发现CsaMLO8公司与接种前的转录物丰富相比,在接种后,在接种后的任何时间点的转录物丰度没有显着较高(P> 0.05)。在下胚轴组织中,6 hpi时转录本丰度显著降低(P = 0.046),8马力(P = 0.006) and 24 hpi (P = 0.009)与接种前的转录物丰度(0 hpi)相比。在子叶组织中,转录物丰度在8hpi时显著降低(P = 0.002) compared to the transcript abundance prior to inoculation (Fig.5B.).
讨论
CsaMLO8公司是黄瓜PM的功能性易感性基因
有几项研究描述了一些(但不是全部)分支V的特征MLO公司不同双子叶植物PM敏感性所需的基因[20.- - - - - -23.,25.- - - - - -27.]. 在这里我们已经证明了黄瓜基因的异源表达CsaMLO8公司在里面slmlo1.突变番茄背景恢复PM易感性,为PM的作用提供证据CsaMLO8公司作为黄瓜中PM的易感基因(图。2).作为Clade V的作用MLO公司在不同的双子叶植物科(如芸薹科)中,PM易感性基因似乎是进化上保守的[20.),茄科(21.,23.,25.],fabaceae [22.]维他科[26.]蔷薇科[27.,36.]现在还有葫芦科,可能在其他经济上重要的物种属于家庭葫芦科(如甜瓜)(甜瓜)还有南瓜(西葫芦V)进化枝MLO公司基因也将在PM易感性中发挥作用。实际上,在专利申请中的功能互补拟南芥Atmlo2,Atmlo2 6和Atmlo2、6、12级甜瓜的突变体MLO公司-根据4-9个初级转化体的病叶面积百分比,like基因可以部分恢复PM的易感性[37.]. 这个瓜的排列MLO公司与黄瓜的三个思想V基因的基因显示,来自甜瓜的基因最相似CsaMLO8公司,与其他两个分支V基因不太相似(即。,CsaMLO1公司和CsaMLO11) [28.]. 这与我们的发现一致CsaMLO8公司是一个S -点的基因。在番茄中观察到互补SlMLO1型丧失突变体与CsaMLO8公司将PM易感性恢复,具有更高的个体转化体CsaMLO8公司表达通常比表达量低的转化子更易受PM的影响CsaMLO8公司表达式(图。2). 似乎有可能,在互补的情况下拟南芥变种人MLO公司由于不同的甜瓜,基因也存在定量效果MLO公司在单个转化子中表达,得出甜瓜MLO公司基因仅部分恢复了易感性,而这可能是由于转基因表达量不够高,不能完全弥补易感性缺失Atmlo函数。
转座子插入CsaMLO8公司导致异常剪接,从而导致基因缺失年代-基因功能
通过克隆CsaMLO8公司从PM抗性黄瓜基因型的cDNA,纯合下胚轴抗性QTL,我们发现了CsaMLO8公司在该基因型中,与WT基因相比,第11外显子的缺失分别为72和174bp。我们发现,这些缺失预计将导致CsaMLO8蛋白第三个细胞质环中24个和58个氨基酸残基的丢失,位于不同物种的分支V MLO蛋白之间的高度保守区域(图。1). 如前所述,MLO功能需要细胞质环路的相互作用[38.[我们预计如果蛋白质应妥善折叠,则在其中一种细胞质环中缺失,这将导致蛋白质的功能丧失。实际上,我们在此表明了Δ174变体的表达CsaMLO8公司在里面Slmlo突变番茄背景未能恢复PM敏感性(图。2).这是黄瓜,大麦之后[17],番茄[21.和豌豆[22.],第四种植物物种,其中MLO公司已经发现这种基因会导致抗药性。虽然我们没有试图补充Slmlo突变番茄与72bp删除变体CsaMLO8公司,因此不能排除其作为S基因(部分)发挥功能的可能性,鉴于缺失区域的保守性,我们预计其结果将与174bp缺失变体相似。
确定异常剪接的原因CsaMLO8公司在耐药黄瓜基因型中,我们开始扩增和序列基因组区域CsaMLO8公司其中检测到缺失。通过这种方式,我们发现与参考基因组相比,该基因第11外显子插入了1449bp。插入序列分析显示存在100%相同的LTR和TSD,但没有开放阅读框或与已知蛋白质或基因的任何相似性(图。3.),导致插入可能是I类,按照柳条等人提出的TE分类方案之后,插入可能是I类I,订单LTR(Retro)转换元件(TE)。[31.].LTRS完全相同的事实彼此完全相同,这表明TE相对最近插入。在a中的转换元素的集成MLO公司基因导致转录物的异常剪接,以这种方式丧失基因功能,请让豌豆中的结果激起psmlo1.基因,其中一个等位基因(在PM耐药豌豆品种Ji 2302中发现)的一体化食人魔LTR逆转录转座子导致异常剪接[22.].
我们分析了具有类似LTR的假定TE(图。4),发现这些TES中没有功能性ORF,确认我们正在处理一系列非自治TES。另外,检测到大量的LTR单体(即,没有伴侣的LTR序列),只能将169个检测到的LTR中的88分为推定的TE(附加文件5). LTR单峰可能起源于单个元素的两个LTR之间的不等重组[39.]或从参考基因组的组装误差。众所周知,植物基因组在很大程度上通过整合大量的转换元件而形成,LTR回收器在其中最丰富(例如,[40,41.])。显示黄瓜基因组对此没有例外,其中24%的基因组由可转换元素和包含10.4%的基因组组成的基因组[7]. 据我们所知,我们发现插入的TECsaMLO8公司是第一个对黄瓜基因有影响的TE。今后可能还会发现更多对黄瓜基因有影响的TEs。
CsaMLO8公司调节在P苍耳只在下胚轴组织中接种
黄瓜对PM的抗性以前有报道是组织特异性的,有一个重要的隐性遗传基因在下胚轴组织中提供了充分的抗性,在叶片中提供了部分抗性[5].近年来,黄瓜的PM抗性已分别在多个组织中进行了定位。下胚轴抗性最强QTL,PM5.2在5号染色体上的一个区域CsaMLO8公司[29.].在这项研究中,我们证明了CsaMLO8公司在感病黄瓜中,在接种后4和6小时,在下胚轴组织中转录上调,但在子叶或叶样品中不上调(图。5A). 显然,病原体上调CsaMLO8公司表达是小孤子组织的特异性。因此,我们假设它很可能是由于损失功能等位基因引起的PM抗性CsaMLO8公司还对幼杆组织也是特异性的。
有趣的是,CsaMLO8公司在抗性黄瓜系的下胚轴组织(或任何其他组织)中未发现转录上调(图。5B.).这与大麦中的发现形成了鲜明的对比[35.]其中的转录MLO公司接种PM后,该基因的诱导作用更强mlo.与野生型植物相比功能缺失突变体。在番茄中发现SlMLO1型基因在接种PM后略有上调slmlo1型功能突变体的丧失,但程度远低于野生型植物[21.]. 尽管这仍然是一个问题,为什么病原体不能上调CsaMLO8公司在我们的抗性黄瓜线中的表达可以提供几种解释,例如,突变体的较小的转录稳定性CsaMLO8公司转录物,突变等位基因的促进区的差异CsaMLO8公司或其他基因所需的差异CsaMLO8公司表达与易感品种相比。
以前,RNA-SEQ在黄瓜叶片组织上的实验显示十三个csamlo.仅基因CsaMLO1公司,另一个分支VMLO公司基因接种后,在接种后转录上调P苍耳[28.]. 这与我们的发现一致CsaMLO8公司在接种PM后的叶片样品中没有上调(图。5). 有可能CsaMLO1公司和CsaMLO8公司在功能上是多余的,但在不同的组织中特异表达(即。,CsaMLO1公司特异性叶组织和CsaMLO8公司下胚轴组织)。据我们所知,目前还没有其他的组织特化的例子MLO-喜欢年代其他物种的基因。在拟南芥也有三个分支VMLO公司基因,ATMLO2突变体被发现部分抗性,双突变体ATMLO2/ATMLO6.或ATMLO2/ATMLO12.比ATMLO2单个突变体和三重突变体ATMLO2/ATMLO6./ATMLO12.完全抵抗[20.]. 目前还不知道是什么机制造成的MLO公司基因在PM感染后转录上调,尽管假设这是由真菌效应物引起的一个活跃过程似乎很直观。鉴于MLO公司在黄瓜中上调,这可能是调查机制的有趣模型MLO公司PM真菌上调。
的转座子插入等位基因CsaMLO8公司在黄瓜种质中经常发生
有趣的是,在编写这篇手稿期间,另一个小组报告了在5号染色体长臂上的一个PM抗性QTL的精细定位,他们称之为QTLPM5.1.,含有25个预测基因的170kb的区域。发现该地区的主要候选基因是一个MLO公司像基因一样,似乎与之相同CsaMLO8公司在我们的研究中。通过从他们的抗性亲本S1003以及另外两个不相关的抗性品系S02和S06的基因组DNA中克隆和测序,他们发现在基因的第11外显子中含有一个1449bp的插入片段[42.].序列分析表明,在其研究中发现的插入的位置和序列与本研究中描述的LTR回析扫描器完全相同。这些研究人员没有报告克隆编码序列CsaMLO8公司在他们的材料中,也没有互补实验。
此外,还申请了一项专利,描述了CSKIP2.,一个声称能提供PM抗性的基因,显示在编码序列中有72 bp的缺失[43.]. 尽管该等位基因未在专利中显示,但据称该等位基因的出现是由该基因第11外显子中的转座子样元件整合引起的。序列分析显示CSKIP2.实际上是和CsaMLO8公司,他们描述的72 bp缺失等位基因与我们在材料中发现的72 bp缺失等位基因相同。有趣的是,专利并没有描述我们发现的174 bp缺失,而是生物信息学预测表明,通过它们选择放大部分的引物不会扩增174bp删除变体CsaMLO8公司顺序。在专利中没有功能性证据证明CsaMLO8公司确实会导致抵抗。
因为几个小组独立地发现了相同的等位基因CsaMLO8公司在不同的,据我们所知不相关的,抗性黄瓜基因型中,我们有兴趣知道这个等位基因在全球黄瓜种质中出现的频率。因此,我们进行了生物信息学115份最近重测序黄瓜种质的筛选[8]用于存在和/或不存在转移元素(TE)等位基因CsaMLO8公司.我们发现了在115种附加的至少31个中均匀或杂织地存在TE-等位基因的证据(表1),表明CsaMLO8公司经常发生。对于某些过程,仅发现指示泰基尔的存在/不存在的少量读取,可能是由于该基因座的读取覆盖率低。因此,在某些过程中,现在可以鉴定为TE-等位基因或WT等位基因的纯合CsaMLO8公司,由于读取覆盖率较低,丢失了其他等位基因的读取量,因此可能有一些杂合子材料被误认为是其中一个等位基因的纯合子。
我们发现TE等位基因CsaMLO8公司导致PM抗性,可能是黄瓜育种家通过选择最具抗性的植物来选择的。有趣的是,其中一份材料被发现具有CsaMLO8公司是Pi215589,一个C哈德威奇变种1954年在印度采集的。这表明CsaMLO8公司确实存在于野生环境中,并且可能已经从Pi215589或相关基因导入栽培黄瓜中哈德维克加入。
结论
在这项研究中,我们提供了一个作用的证据CsaMLO8公司作为一个年代白粉病易感性基因。我们通过CsaMLO8公司过度表达slmlo1.突变番茄背景恢复PM易感性。我们还发现了一个突变的等位基因CsaMLO8公司从抗性黄瓜克隆未能恢复PM易感性。作为CsaMLO8公司我们确定了在检测到QTL特异性电阻的区域中CsaMLO8公司在接种PM的植物不同组织中的表达,发现CsaMLO8公司只在下胚轴组织中转录上调。在此基础上,我们认为CsaMLO8公司这与黄瓜下胚轴对PM的抗性有关。
方法
植物材料和真菌菌株
本研究采用2个黄瓜基因型:PM敏感cv。希拉和一个高级育种系,有关的抗性cv。Anaxo,5号染色体上一个隐性遗传的QTL具有下胚轴抗性(pm-h公司).
选用两个番茄基因型:PM敏感型cv。Moneymaker(MM)和抗PM育种系醇-2,编码序列中一个19bp缺失突变的纯合子SlMLO1型[21.].
除非另有说明,植物是在标准条件下在封闭的温室中生长的。
一个孤立的P苍耳(引起黄瓜中的PM)是从荷兰一家种子公司温室中受感染的黄瓜植株中获得的,并保存在cv上。希拉在荷兰瓦格宁根大学的温室里。用5′-cgtcagagaagccacctc-3′引物对真菌DNA进行ITS序列测定,证实了分离物的种属P苍耳向前)和5′-AGCCAGAGATCCGTTTG-3′(ITSP苍耳(数据未显示)。
瓦赫宁根分离物新叶甲虫(番茄PM)保持在cv上。毫米,如上所述[44.].
克隆和排序CsaMLO8公司CDS
黄瓜幼叶。希拉和抗病育种系被收获并立即在液氮中冷冻。使用RNeasy试剂盒(德国Qiagen)分离总RNA。通过DNA酶I,Amp级(美国Invitrogen life technologies)处理去除RNA样品中可能存在的DNA污染。使用2μg RNA样品和iScript cDNA合成试剂盒(美国Bio-Rad实验室)合成cDNA。
扩大CsaMLO8公司用引物5′-caccctgcctccacatga-3′(全长)扩增cDNACsaMLO8公司向前)和5 ' -GCGCCCTGTACATGAAGAAC-3 '(全长CsaMLO8公司反向)。以50 ng cDNA为模板,50 μl反应,1upfuultra.II融合HS DNA聚合酶(安捷伦科技公司,美国),1x反应缓冲液,1mM dNTP和每个引物200nm。循环条件为:1分钟。在95℃下进行初始变性,然后进行40个循环20秒。在95°C下变性,20 s。60℃退火,72℃延伸2分钟。反应在72℃孵育3分钟后完成。用溴化乙锭染色琼脂糖凝胶电泳分离PCR产物。使用QIAquick Gel Extraction Kit(德国Qiagen)切割并纯化条带。纯化产物被克隆到网关兼容载体pENTR D-TOPO(Invitrogen-life technologies,U.S.A.)中并转化为化学活性载体大肠杆菌紧张一杆TOP10。使用上述引物和条件,通过菌落PCR评估正确片段的存在。使用Qiaprep spin miniprep试剂盒(德国Qiagen)回收质粒。使用pUC/M13正向和反向测序引物(GATC Biotech,德国)进行三次测序反应。
番茄的互补性醇-2突变体与CsaMLO8公司重量和CSAMLO8Δ174
输入质粒pENTR:CsaMLO8公司重量和重量:CSAMLO8Δ174通过Gateway-LR克隆将获得的35S花椰菜花叶病毒启动子转入含有组成性活性35S花叶病毒启动子的二元载体pK7WG2nptII卡那霉素抗性标记基因[45.].将重组质粒转化为化学竞争力大肠杆菌菌株dh5α。用菌落PCR法筛选阳性重组菌落CsaMLO8公司如上所述的特异性引物,并测序。使用QIAprep Spin Miniprep套件(Qiagen,德国)回收重组质粒。PK7WG2:CsaMLO8公司WT pK7WG2:CSAMLO8Δ174将二元载体转化为电容细胞根癌农杆菌电穿孔法分离AGL1-virG菌株[46.].
子叶外植体的醇-2如前所述转化突变番茄幼苗[25.]. 对获得的番茄转化子进行了细菌鉴定CsaMLO8公司,这个nptII用5′-caccctgcctccacatga-3′(全长)引物PCR检测标记基因和35S-CaMV启动子序列CsaMLO8公司正向)和5′-GCCCTGTACATGAAC-3′(全长CsaMLO8公司反向),5′-gaagggctggctgctattg-3′(NPTII F.Orward)和5'-aatatcacggggtagcaacg-3'(NPTII R.evers)和5'-tacaaaggcgcgcaacaaacg-3'(35s前进)和5'-agcaagccttgaatcgtcca-3'(35s反向),条件如上所述。
对于具有不同构建体的两个转化中的每一个,选择了十种独立的转基因植物,并评估了CsaMLO8公司采用qRT-PCR技术对特异性引物序列进行表达CsaMLO8公司5 ' -GCGACGGCATTGAAGAACTG-3 '(正向)和5 ' -AGGAGACATGCCGTGAGTTG-3 '(反向)。作为管家基因的规范化CsaMLO8公司在番茄中的表达,SlEF-α与引物对5′-ATTGGAAACGGATATGCCCCT-3′一起使用(SlEF-α向前)和5′-TCCTTACCTGAACCGCCTGTCA-3′(SlEF-α反转)。使用CFX96实时PCR机(美国Bio-Rad实验室)进行qRT PCR。每10μl反应包含300 nM的每个引物、1μl(50 ng)cDNA模板和1 x iQ SYBR Green Supermix(Bio-Rad Laboratories,U.S.A.)。循环条件是95℃的初始变性步骤3分钟,然后40次循环10秒。在95℃和30 s下变性。在60°C下退火和延伸,通过每10 s增加0.5°C的熔融循环完成。从65℃到95℃。
PM电阻的评价醇-2番茄,过度表达CsaMLO8公司WT或CSAMLO8Δ174
每个植株上接种10个转基因植株(每株2个)的插枝O。新菌属。空传染媒介(EV)的切割转变醇-2以感病品种Moneymaker(MM)为对照。通过洗涤重病叶片制备孢子悬浮液。MM,并将孢子浓度调整为8 x 104Conidiospores / ml。孢子悬浮液在切割上均匀喷涂。接种疾病严重程度的十六天被眼睛评估,并被敏感(孢子花纹粉状菌落在叶子上可见)或抗性(根本没有粉末状霉菌症状)。另外,叶样品用于定量O。新菌生物质。每次切取感染叶(第2或第3叶)。用DNeasy植物试剂盒(Qiagen, Germany)提取植物和真菌总DNA。用引物对5 ' -CGCCAAAGACCTAACCAAAA-3 ' (小孢子它向前)和5'-AGCCAAGAGATCCGTTGTTG-3'(小孢子它的反面),特定于O。新菌核糖体DNA,来量化O。新菌生物量,与SlEF-α引物如上所述,用于标准化。qPCR采用CFX96 Real-Time PCR仪(Bio-Rad Laboratories, U.S.A.)进行。每10 μl反应包含每个引物300 nM, 2 μl (20 ng) cDNA模板和1 x iQ SYBR Green Supermix (Bio-Rad Laboratories, U.S.A.)。定量的循环条件与上述相同CsaMLO8公司转化番茄中的表达。
扩增,测序和表征CsaMLO8公司-插入
从黄瓜幼苗叶片中提取DNA。Sheila和抗性育种系,收获后立即用液氮冷冻,使用DNeasy植物试剂盒(德国Qiagen)。用引物5′-agcatttgccatccatactca-3′扩增DNA(CsaMLO8公司插入区域正向)和5 ' -CTGCAAGCACAGGATGAATGTC-3 ' (CsaMLO8公司插入区域反向)。以30 ng DNA为模板,用1.25 u DreamTaq DNA聚合酶(Thermo Scientific,美国)、1倍DreamTaq缓冲液、0.8 mM dNTP和200 nM每个引物进行25 μl反应。循环条件为:95°C初始变性3分钟,95°C变性30秒,57°C退火30秒,72°C延长2分钟,共35次循环。72°C孵育5分钟后反应结束。PCR产物经GelRed染色和琼脂糖凝胶电泳观察。PCR产物使用Qiaquick PCR纯化试剂盒(Qiagen,德国)进行纯化。采用引物5 ' -AGCATTTTGCCATCCATACTTCA-3 ' (CsaMLO8公司插入区域向前),5'-acgaagagcgaaacgaagaa-3'(CsaMLO8公司插入测序Forward), 5 ' - GCTCCTGCCCAATTCAGACC-3 ' (CsaMLO8公司插入测序(反向)和5′-CTGCAAGCACAGATGAATGTTC-3′(CsaMLO8公司插入区反转(GATC Biotech,德国)。使用CLC Genomics Workbench 7.5软件对获得的序列进行比对。从比对中提取扩增区域的一致序列。该一致序列与CsaMLO8公司确定插入的确切位置和顺序。
使用CLC Genomics Workbench 7.5标准设置构建插入序列的点图。提取插入序列的第一个和最后一个200bp,并相互对齐,以确定LTRs的长度和序列。使用CLC Genomics Workbench 7.5标准设置扫描插入序列以获得开放阅读框,但没有给出结果。
生物信息学用于同源TES的黄瓜参考基因组
以前确定的LTR序列CsaMLO8公司-以中国黄瓜自交系9930,v2[7])确定推测的同源LTR。结果输出存储为表格文件。Wolters等人描述的python脚本[32.]用于搜索彼此相距20 kb内的LTR匹配项。长度小于20kb且两侧有两个ltr的序列被认为是假定的同源序列,并使用BEDtools套件从基因组中提取[47.]. 人工整理假定的TE列表,以去除两个方向相反的LTR序列(两个实例)和具有大(>100bp)间隙的序列(25个实例)。在三种情况下,假定的TE被发现是嵌套的(即,发现三个LTR彼此之间的距离在20KB以内),在这种情况下,较小的假定TE被丢弃,取而代之的是较大的嵌套模型。假定的TE彼此对齐并与CsaMLO8公司-TE采用CLC-Genomics-Workbench 7.5软件,测定序列同一性比较CsaMLO8公司-特。使用CLC Genomics Workbench 7.5标准设置对假定的TE进行开放阅读框筛选。假定的TE被用作对REPbase数据库执行tBLASTx搜索的查询[48.].
生物信息学筛选重新开始的线路存在CsaMLO8公司te等位基因
Qi等人对115份黄瓜材料的重测序项目[8]下载自NCBI短读档案,注册号SRA056480。通过一个简单的Bash脚本,对总读取数进行筛选,以确定是否存在30 bp序列,包括:
- 1)
过去15磅CsaMLO8公司在TE插入前和TE插入前15 bp,正向(5 ' - GCTCCATGTTATTATTGTTGATTTTATGGA-3 ')或反向(5 ' - tccataaaatcaacaataataataacatggagc -3 ');
- 2)
TE插入的最后15bp和前15bpCsaMLO8公司TE插入后,正向(5′-tatattataattataactcatatggatt-3′)或反向(5′-aatccatatgagtataattata-3′)定向;
- 3)
30 bp的CsaMLO8公司围绕TE插入位点,无TE序列,正向(5 ' - GCTCCATGTTATTATAACTCATATGGGATT-3 ')或反向(5 ' - aatcccatatgagttataataacatggagc -3 ')取向。
六个诱饵序列中每一个的每次加入检测到的读取次数存储为一个表格文件。将表明存在TE等位基因的总读取次数和表明存在WT等位基因的总读取次数相加,确定材料的基因型为纯合TE等位基因、纯合WT等位基因或杂合。
CsaMLO8公司PM接种黄瓜的表达分析
PM易感和耐药在20℃(日)和16℃(夜晚)的气候室中生长在气候室中,具有16 H / 8 H日/夜循环,相对湿度为90%。播种后18天,植物接种了一个P苍耳孢子悬浮液采用喷雾法,接种物是通过用水冲洗严重感染的黄瓜叶片获得的。将接种物调整至1.0 x 10的最终浓度4孢子悬浮液均匀地喷洒在幼苗的叶片、子叶和下胚轴上。在接种前和接种后4、6、8和24小时,分别从每个时间点的三株植物的下胚轴、子叶和(第一)真叶中采集样品,并立即在液氮中冷冻。
使用MagMAX-96总RNA分离试剂盒(Ambion,美国)分离总RNA。使用1μg RNA样品和iScript cDNA合成试剂盒(美国Bio-Rad实验室)合成cDNA。qRT-PCR前,cDNA样品稀释10倍。
使用CFX96实时PCR机(美国Bio-Rad实验室)进行定量实时PCR。特异性引物对序列CsaMLO8公司5'-gcgacggcattgaagaactg-3'(前进)和5'-aggagacatgccgtgagttg-3'(反向)用于量化CsaMLO8公司表达式。黄瓜家政基因特异性引物对提示41,机电和EF-α,如Warzybok等人所述[49.],用于标准化CsaMLO8公司表情。每10μl反应包含300 nM的每个引物、1μl(50 ng)cDNA模板和1 x iQ SYBR Green Supermix(Bio-Rad Laboratories,U.S.A.)。循环条件是95℃的初始变性步骤3分钟,然后进行40次10秒的循环。在95℃和30 s下变性。在60°C下退火和延伸,以每10 s 0.5°C增量的熔融循环完成。从65℃到95℃。
对每个样品进行两次技术复制试验。CsaMLO8公司每一个样本的表达量由∆∆CT方法[50.],通过三个管家基因的几何平均值进行归一化。的平均和标准误差CsaMLO8公司在每个组织/时间点组合的三个生物复制中计算转录物丰度,并统计差异的显著性∆∆CT使用学生的T检验确定时间点4,6,8和24 HPI和0HPI之间的值。
相对量化CsaMLO8公司抗性黄瓜的转录亚型
使用如上所述获得的未接种和接种(6hpi)抗性黄瓜组织的cDNA样本来量化该基因的相对转录物丰度∆174和∆72剪接异构体。使用CFX96实时PCR机(美国Bio-Rad实验室)进行定量实时PCR。设计了四对引物对其中一对进行特异性扩增CsaMLO8公司剪接异构体:5′-CTCCTATATATGCATTCAGC-3′(正向)与5′-CTTGATATATAACCCCATTGAG-3′(反向)或5′-TTCATTGATGCATCTTGC-3′(正向)与5′-AAGCTGATATTAAGG-3′(反向)用于特异性定量CsaMLO8公司∆174和5′-ATTCTATTGGGTGTTCCCGTC-3′(正向)与5′-CTTGATATATAACCCCATGAG-3′(反向)或5′-TTCATGTGCACATCTTGC-3′(正向)与5′-GAACGGGAACACAAT-3′(反向)用于特定定量CsaMLO8公司Δ72。黄瓜家政基因特异性引物对提示41,机电和EF-α,如Warzybok等人所述[49.],用于标准化CsaMLO8公司表情。每10μl反应包含300 nM的每个引物、1μl(50 ng)cDNA模板和1 x iQ SYBR Green Supermix(Bio-Rad Laboratories,U.S.A.)。循环条件是95℃的初始变性步骤3分钟,然后进行40次10秒的循环。在95℃和30 s下变性。在60°C下退火和延伸,以每10 s 0.5°C增量的熔融循环完成。从65℃到95℃。
对每个样品进行两次技术复制试验。CsaMLO8公司每一个样本的表达量由∆∆CT方法[50.],通过三个管家基因的几何平均值进行归一化。的平均和标准误差CsaMLO8公司剪接异构体丰度是通过每个组织的三个生物复制来计算的,每个组织用两个不同的引物对计算的相对丰度的平均值是每个剪接异构体。
缩写
- 下午:
-
白粉病
- MLO公司:
-
Mildew Locus O.
- QTL:
-
定量特质基因座
- LTR:
-
长末端重复
- NB-LRR:
-
核苷酸结合-富亮氨酸重复
- R基因:
-
抗性基因
- S基因:
-
易感基因
- SNP:
-
单核苷酸多态性
- 重量:
-
野生型
- TSD公司:
-
目标站点重复
- 开放阅读框:
-
打开阅读框
- te:
-
转座因子
- 企业价值:
-
空向量
参考
- 1.
联合国粮食及农业组织统计司[http://faostat3.fao.org/2015年5月通过。
- 2。
佩雷斯·加西亚a、罗梅罗D、费尔南德斯·奥尔图尼奥D、洛佩斯·鲁伊斯F、德维森特a、托雷斯·贾。白粉菌山萝花单囊壳(同义词Podosphaera xanthii),对葫芦的持续威胁。植物病理学。2009;10:153–60.
- 3.
块CC,Reitsma Kr。粉状霉菌抗性在美国国家植物种质系统黄瓜收集。Hortic SCI。2005; 40:416-20。
- 4.
Jahn M,Munger HM,McCreight JD。用于粉末状霉菌抗性的繁殖葫芦作物。在:粉末状霉菌:全面的论文。2002. p。239-48。
- 5。
Shanmugasundaram S, Williams PH, Peterson CE。黄瓜对白粉病抗性的遗传。植物病理学。1971;61:1218-21。
- 6。
保姆的车手。瓜类抗病育种。植物病理学年鉴1972;10:471-90。
- 7.
黄S,李R,张Z,李L,顾X,范W,等。黄瓜的基因组,Cucumis巨大成功L. Nat Genet。2009; 41:1275-81。
- 8.
齐杰,刘×,沈德,苗H,谢B,李×等。基因组变异图谱为黄瓜的驯化和多样性提供了遗传基础。纳特·吉内特。2013;45:1510–5.
- 9
Wóycicki R,Witkowicz J,Gawroèski P,Dąbrowska J,Lomsadze A,Pawełkowicz M等。北欧黄瓜(Cucumis sativus L.)的基因组序列揭示了植物的进化适应机制。公共科学图书馆一号。2011;第6章:e22728。
- 10
Jones jtg, Dangl JL。植物的免疫系统。大自然。2006;444:323-9。
- 11
关键词:线虫,敏感性损失,耐虫性生物技术。2005;16:12 - 7。
- 12
van Schie Ccn,Takken Flw。易感性基因101:如何成为一个好主持人。Annu Rev phytopathol。2014; 52:551-81。
- 13。
Pavan S、Jacobsen E、Visser RGF、Bai Y。敏感性丧失是一种持久和广谱抗性育种的新策略。摩尔品种。2010;25:1–12.
- 14。
Eckardt na。植物疾病易感基因?植物细胞。2002; 14:1983-6。
- 15.
Freisleben R,梅茨格一世。这是一种变异的牛磺酸,它是一种新型的抗肿瘤药物。自然感觉。1942;24:608.
- 16。
乔根森JH。大麦Mlo抗白粉病性的发现、鉴定及开发利用。大提琴。1992;63(表1):141–52。
- 17。
Büschges R、Hollk、Panstruga R、Simons G、Wolter M、Frijters A等。大麦mlo.基因:植物抗病的新控制元件。细胞。1997;88:695 - 705。
- 18
Devoto A, Piffanelli P, Nilsson M, Wallin E, Panstruga R, von Heijne G,等。植物Mlo家族的拓扑结构、亚细胞定位和序列多样性。生物化学杂志。1999;274:34993-5004。
- 19
Devoto A,Hartmann HA,Piffanelli P,Elliott C,Simmons C,Taramino G等。植物特异性七跨膜MLO家族的分子系统发育和进化。摩尔进化杂志。2003;56:77–88.
- 20.
Consonni C,Humphry ME,Hartmann HA,Livaja M,Durner J,Westphal L等.白粉病发病机制中对植物宿主细胞蛋白的保守要求。纳特·吉内特。2006;38:716–20.
- 21.
白毅,郑智,张志平,Reinstädler A, Lotti C,等。在自然发生的广谱白粉病抗性中,中美洲番茄的入库损失是造成的mlo.函数。植物与微生物的相互作用。2008;21:30-9。
- 22.
Humphry M,ReinstädlerA,Ivanov S,Bisseling T,Panstruga R.耐用的广谱粉状抗性在豌豆ER1植物中的抗性由自然的功能丧失突变赋予psmlo1..莫尔植物途径。2011; 12:866-78。
- 23.
Zheng Z,Nonomura T,Appiano M,Pavan S,Matsuda Y,Toyoda H等。脑功能丧失mlo.直系同源基因降低辣椒和番茄对白粉病的易感性白粉病. 公共科学图书馆一号。2013;8:e70723。
- 24.
王Y,Cheng X,Shan Q,Zhang Y,Liu J,Gao C等人。同时编辑六倍倍醇面包小麦中的三个同种型伴侣赋予含有含粉状霉菌的萎缩性。NAT BIOTECHNOL。2014年;(7月)前进:1-6。
- 25.
Appiano M,Pavan S,Catalano D,Zheng Z,Bracuto V,Lotti C,等。候选人的鉴定MLO公司栽培茄科植物白粉病易感基因及烟草功能特性研究NtMLO1公司.转基因Res。2015; 24:847。
- 26
Feechan A,Jermakow AM,Torregrosa L,Panstruga R,Dry IB.葡萄藤的鉴定MLO公司参与粉末状霉菌易感性的基因候选。Funct植物Biol。2008; 35:1255-66。
- 27
Jiwan D、Roalson EH、Main D、Dhingra A。桃抗霉基因座O的反义表达(PpMlo1公司)基因赋予粉末状霉菌的交叉物种抗性Fragaria x ananassa. 转基因研究,2013年;22:1119–31.
- 28
Schouten HJ、Krauskopf J、Visser RGF、Bai Y。黄瓜白粉病和霜霉病感病候选基因的鉴定。大提琴。2014;200:475–486.
- 29
他X,Li Y,Pandey S,Yandell BS,Pathak M,Weng Y.Wi 2757黄瓜(Cucumis Sativus L.)的粉末状霉菌抗性的QTL映射。Al Appl Genet。2013; 126:2149-61。
- 30
HMMTOP跨膜拓扑预测服务器。生物信息学。2001;17:849-50。
- 31
Wicker T, Sabot F, Hua-Van A, Bennetzen JL, Capy P, Chalhoub B等。真核生物转座因子的统一分类系统。Nat Rev Genet, 2007; 8:973-82。
- 32
Wolters PJ、Schouten HJ、Si Ammour A、Baldi P。“Wijcik”突变的基因组特征。瓦赫宁根,荷兰:瓦格宁根大学;2014
- 33
Kumar A, Bennetzen JL。植物反转位子活动。《Annu Rev Genet》1999;33:479-532。
- 34
Neumann P,PožárkováD,Macas J。高丰度豌豆LTR反转录转座子食人魔组成性转录和部分剪接。植物分子生物学。2003;53:399–410.
- 35
pffanelli P, Zhou F, Casais C, Orme J, Jarosch B, Schaffrath U,等。大麦MLO调节防御和细胞死亡是响应生物和非生物胁迫刺激。植物杂志。2002;129:1076 - 85。
- 36
Pessina S,Pavan S,Catalano D,Gallotta A,Visser RGF,Bai Y等。表征MLO公司在蔷薇科和基因表达分析中的基因家族海棠. BMC基因组学。2014;15:1–12.
- 37。
Diergaarde PJ,Van Enckevort LJG,Posthuma Ki,Prins MW。粉状霉菌抗性提供基因甜瓜.2012. p。1-50。
- 38。
Elliott C、Uller JM、Miklis M、Bhat RA、Schulze lefert P、Panstruga R。保守的细胞外半胱氨酸残基和细胞质环-环相互作用是七肽MLO蛋白功能所必需的。生物化学杂志。2005;385:243–54.
- 39。
Bennetzen杰。转座因子对植物基因和基因组进化的贡献。植物学报,2000;42:251-69。
- 40.
Tenailon MI、Hollister JD、Gaut BS。植物转座因子进化的三联图。植物科学趋势。2010;15:471–8.
- 41.
Oliver KR, McComb JA, Greene WK。转座因子:被子植物进化和多样性的有力贡献者。基因组生物学进化。2013;5:19 86 - 901。
- 42.
Nie J,He H,Peng J,Yang X,Bie B,Zhao J等人。识别和精细映射PM5.1.:黄瓜抗白粉病隐性基因(Cucumis巨大成功L.)。摩尔品种。2015;35:7.
- 43.
Diergaarde PJ,van Enckevort LJG,Posthuma KI,普林斯MW。黄瓜抗白粉病基因的研究。2013年。1–50.
- 44.
Bai Y,Van der Hulst R,Bonnema G,Marcel Tc,Meijer -Dekens F,Niks Re,等。番茄防守新叶甲虫:主导Ol基因通过不同的机制赋予隔离依赖性电阻而不是隐性醇-2.Mol植物微生物相互作用。2005; 18:354-62。
- 45.
Karimi M, Inzé D, Depicker A.网关向量农杆菌介导植物转换。植物科学学报,2002;
- 46.
拉佐·格,斯坦·帕,路德维希·拉。DNA转化能力拟南芥中国基因组文库农杆菌. 纳特生物技术公司。1991;9:963–5.
- 47.
昆兰AR,大厅IM。BEDTools:一套灵活的实用工具,用于比较基因组特征。生物信息学。2010;26:841–2.
- 48.
jurka j,Kapitonov vv,Pavlicek A,Klonowski P,Kohany O,WalichiewiCz J. Repbase更新,一种真核性重复元素的数据库。CytoOgenet基因组Res。2005; 110:462-7。
- 49.
不同氮营养条件下黄瓜基因表达标准化的可靠内参基因。《公共科学图书馆•综合》。2013;8:e72887。
- 50
Pfaffl兆瓦。实时荧光定量pcr中相对定量的新数学模型。核酸杂志2001;29:2002-7。
致谢
这项工作得到了TKI起始材料基金会的资助。
作者信息
从属关系
通讯作者
额外的信息
利益争夺
作者声明他们没有相互竞争的利益。
作者的贡献
JAB、MA、YB和HJS设计了实验。JAB、MA和MSM进行了实验。FWKH和WHV提供了资源。贾布起草了手稿。MA,WHV,RGFV,YB和HJS批判性地修改了手稿。所有作者都阅读并批准了手稿。
杰罗恩A。贝格和米歇拉阿皮亚诺对这项工作的贡献不相上下。
其他文件
附加文件1:
全长对准CsaMLO8公司重量,72年CsaMLO8∆和CSAMLO8Δ174编码序列。(PDF 162 KB)
附加文件2:
cladev编码MLO蛋白的多重序列比对MLO S.-不同物种的基因。(PDF 287 KB)
附加文件3:
相对量化CSAMLO8Δ174和72年CsaMLO8∆转录物丰度中存在在从中获得的cDNA样品不接种的(A) 或接种(B)黄瓜组织样品。与对照组相比,折叠变化正常化CSAMLO8Δ174表情。条形图表示三个独立的生物复制的平均折叠变化。误差线表示平均值的标准误差(PDF(386 kb)
附加文件4:
20位独立摄影醇-2番茄植物也转化CsaMLO8公司WT或CsaMLO8公司∆174(PDF 343 kb)
附加文件5:
完整概述假定的LTR和假定的TE与中确定的TE同源CsaMLO8公司。(XLSX 27 kb)
附加文件6:
所识别的TE的多个序列对准CsaMLO8公司和推定的同源TEs。(PDF 917 kb)
附加文件7:
完整表115重组的换乘。所识别的读数据量在两者的重叠处给出CsaMLO8公司以及插入的开始在正向(TE start-F)和反向(TE start-R)方向,在插入的结束和结束之间的重叠处CsaMLO8公司在前向(TE端F)和反向(TE端-R)方向上,仅在插入部位CsaMLO8公司正向(WT-F)和反向(WT-R)顺序(XLSX(22 kb)
权利和权限
开放访问本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Berg,J.A.,Appiano,M.,Santillán Martínez,M。等。易感性基因中的转座因子插入CsaMLO8公司结果黄瓜下胚轴对白粉病的抗性。BMC植物BIOL.15,243 (2015). https://doi.org/10.1186/s12870-015-0635-x
收到:
接受:
发表:
关键词
- 白粉病
- MLO公司
- 易感基因
- 黄瓜(Cucumis巨大成功(法律)
- 下胚轴抗性
- 非自动转换元素