抽象的
背景
种子使用温度等环境提示来协调其萌发的时间,使植物与季节同步他们的生命历史。冬季寒冷是为了减轻种子休眠的核心重要性,但众所周知的是在针叶树种子中如何调节冷冻反应。白色云杉(Picea glauca.)是北美针叶林中一种重要的针叶树。最近对白云杉基因组的测序和组装使得比较基因表达研究能够阐明通过潮湿冷却缓解休眠的分子机制。在这里,我们聚焦于激素代谢谱和激素信号转导途径的基因编码成分分析,以阐明休眠缓解期间的变化,并帮助解决萌发信号(如温度和光线)如何触发胚根的出现。
结果
ABA,GA和养羊酸接受了相当大的变化,随后在随后的萌发过程中的种子;同样地,在这些关键阶段期间,编码激素信号传导组分(例如ABI3,ARF4和Aux / IAA)的转录物。在潮湿的冷却过程中,活性IAA保持在恒定水平,但基本上积累IAA缀合物(IAA-ASP和IAA-GLU)。在先前潮湿的种子的发芽期间ABA浓度降低,而生物活性Ga1(Ga53)的前体累积。我们认为种子休眠和发芽可以部分地通过变化的激素浓度和中枢性蟾蜍素 - 信号通路组分(TiR1 / AFB,AUX / IAA和ARF4)之间的相互作用的调节。响应于发芽线索,即暴露于光线并增加温度:将种子从湿润降至30℃的转移,在前六个小时内发生基因转录物和蛋白质表达的显着变化,使得对发芽非常迅速- 种子后的条件均接受充分暴露于冷却刺激。
结论
白云杉种子从休眠到萌发的转变与生长素偶联、生长素信号成分的变化以及生长素- aba信号级联(转录因子ARF4和ABI3)之间潜在的相互作用有关。生长素通量为ABA:GA平衡机制增加了一个新的维度,即通过冷却来缓解休眠,然后通过温暖和光照刺激胚根萌发。
背景
针叶树在生态和经济上都是重要的植物,针叶林在北半球覆盖了大片土地。白色云杉(Picea glauca.)是北美针叶林中一种重要的北方森林物种。在加拿大,每年有超过1亿棵白杉幼苗被外植以再生[1].然而,我们对白云杉种子和针叶树种子休眠和萌发的分子机制仍然知之甚少。随着白云杉基因组在2013年首次在针叶树物种中测序和组装,人们对研究关键发育和生理过程的分子机制方面的兴趣正在增加[2-4.].
在自然林分和实验室条件下,湿冷是一种常见的打破针叶树种子休眠的刺激措施。不同针叶树物种之间的具体要求可能有很大的差异,以及特定物种的不同克隆和种子之间的差异[5.那6.];对于白云杉来说,在实验室条件下典型的湿冷要求大约是21天。
在种子成熟过程中,亲本植物上的种子暴露于低温会影响成熟种子初级休眠的深度。在吸收的成熟休眠种子中,暴露于低温通常会促进休眠的缓解。因此,假设低温在调节休眠中起双重作用[7.].此外,在某些条件下,延长低温会导致次生休眠[8.那9.].利益湿气对休眠缓解的有益效果的机制无疑涉及植物激素 - 用脱落酸(ABA)和嗜酸盐(天然气)接受最多的关注,仅在其相互作用或串扰的背景下与其他激素等植物中的其他激素,细胞蛋白和乙烯[10-14].
尽管从2.6亿年前开始,它就在进化上独立于其他种子植物[15],针叶树种子表现出与被子植物种子共同调节休眠和萌发的保守机制,包括由ABA介导的机制[16-18].一些研究表明,湿冷会引起针叶树种子中ABA和GAs含量的变化及其敏感性的变化[19-21].黄柏(Callitropsis nootkatensis)及道格拉斯冷杉(Pseudotsuga menziesii)种子22那23].西部白松(Pinus Monticola.)种子在湿冷期间也显著下降,这种下降与萌发能力的增加有关[24].值得注意的是,如果不符合休眠状态,种子保持高ABA水平;和休眠拼版和维护需要aba生物合成[25].对于西部白松种子来说,ABA生物合成与分解代谢的比值似乎是决定休眠维持与萌发能力的关键因素。气体对缓解针叶树种子休眠和萌发有积极作用[25];同样,湿冷拟南芥种子的休眠缓解也依赖于GA的表达3.赤霉素生物合成途径的氧化酶1 [19那21].在黑兹尔(Corylus avellana),湿冷对种子生物合成赤霉素的能力有明显的影响,尽管在种子处于萌发条件下才会产生活跃的赤霉素[26].
在拟南芥的ABA信号级联,四个转录因子协同行动,即3 (ABI3)脱落酸不敏感,FUSCA 3 (FUS3),绿叶子叶1 (LEC1)和绿叶子叶2 (LEC2),协调各种种子成熟过程和其中的一些因素也参与过渡从休眠与萌发27那28].orthologsABI3,编码结构保守的转录因子已从Agiosperm和裸子植物(针叶树)物种中分离,它们充当种子发展和休眠的中央调节因子[10那29].委员会成员ABI3/VP1从黄柏中克隆的家系与休眠维持呈正相关[30.].通过酵母双杂交分析,一种黄柏树ABI3相互作用蛋白(CnAIP2)最近被鉴定为ABI3的负调控因子[31];注意到该蛋白不同于拟南芥E3泛素连接酶AIP2 [32].cnaip2,如CNABI3,起到重要的植物生命周期过渡的中央门守,包括种子休眠到萌发转变[31].
天然气还调节植物生长和发育,并可在控制种子休眠和发芽中对抗ABA [11那33].值得注意的是,在许多物种中,光和温度对种子萌发的调控与GA代谢和信号转导相关[10那19那27那34].外源对西白松种子施用GAs通过改变ABA稳态,即促进ABA分解代谢或通过ABA生物合成运输,从而导致休眠种子ABA水平下降[25].
生长素(主要是吲哚-3-乙酸[IAA])调节植物生长发育的许多方面[35那36]可作为种子萌发时游离IAA的来源[37那38].一些证据表明生长素在拟南芥种子休眠维持中的作用[39-41]生长素介导的种子休眠维持依赖于ABI3,这种抑制作用可通过湿冷消除[42].生长素信号通路的枢纽是运输抑制剂应答1(TIR1)/生长素信号F盒(AFB)蛋白信号系统[43-45].
在这项研究中,我们研究了一种白云杉(Picea glauca.,以阐明以激素为基础的机制,在响应温度信号(即潮湿冷却和转移到萌发条件)的休眠缓解和发芽。这项研究将有助于深入了解冬季寒冷如何影响物候时间,以及在新的气候情景下针叶树的生活史可能如何发展。
方法
种子材料,发芽试验和种子采样
选取来自加拿大不列颠哥伦比亚省(位于54°26′n, 121°44′w,海拔850 m)的一个白云杉种群,根据其标准21天湿冷处理后的累积萌发性能进行研究[46].为了确定种子的萌发特性,首先将种子置于透明塑料萌发箱(Hoffman)中,箱内内衬有湿润的纤维素絮和滤纸,并在3°C的黑暗环境中用50 mL无菌水湿润21天。然后将装有种子的盒子转移到萌发条件(30/20°C, 8-h的光周期和70%的相对湿度)。荧光强度为13.5 μmol·m-2s-1.按照国际种子检测协会的标准进行21天的标准发芽[47].作为转入促发芽条件(30/20°C和光照)的对照,种子在30/20°C转入持续黑暗,或保存在湿冷条件(3°C恒定),光周期8小时。发芽测定、评分和定量按前面所述进行[46].
对3个生物复制品进行分子和生化分析的种子取样,包括湿冷期间(0、10和21天)和转移至萌发或对照条件后(6、24、80小时和9天)的时间(图。1).对于保持在黑暗中的种子,在黑暗中也进行了采样。收集包含3重复的样品并立即冷冻液体n2储存于−80摄氏度。
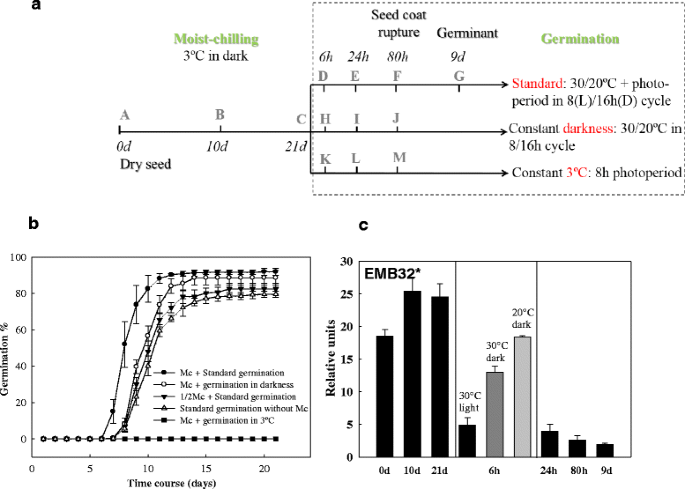
湿冷对云杉种子萌发性能的影响。一种对白云杉种子在湿冷期(Mc或1/2Mc)为21天或10天或不湿冷的不同萌发条件下的发芽情况进行取样示意图。在标准萌发条件(30/20℃,光周期8 h)下,80 h时,大多数种群的种皮破裂,胚根突出。在第9天达到胚根长至种子长度4倍的阶段。B.白云杉种子在(一种),没有潮湿的冷却。数据点是四盘100粒种子的平均值±SE。虽然生物学家将萌发完成定义为胚根的萌发,但森林行业的“萌发”百分比是基于当胚根萌发到种子长度的4倍时(白云杉约为4毫米)达到萌发阶段的种子数量。在B.,我们使用后一种定义。C休眠标记物的转录动态,EMB32在湿冷期(0、10、21 d)、萌发期(6、24、80 h)和幼苗生长期(9 d)(黑色条)。6小时时间点,记录水平在三个条件下测定:在转移后种子标准发芽条件(30/20°C和8小时光周期)(黑条),种子在黑暗中保持在30°C(深灰色酒吧),和种子在黑暗中保持在20°C(浅灰色酒吧)。RT-qPCR检测的相对表达量如图所示。每个数据点是三个生物重复的平均值。条形图表示扫描电镜。注:一个星号(*)表示该基因在裸子植物中已被注释,而在白云杉中未被注释
使用BLASTN参考基因选择和基因查询
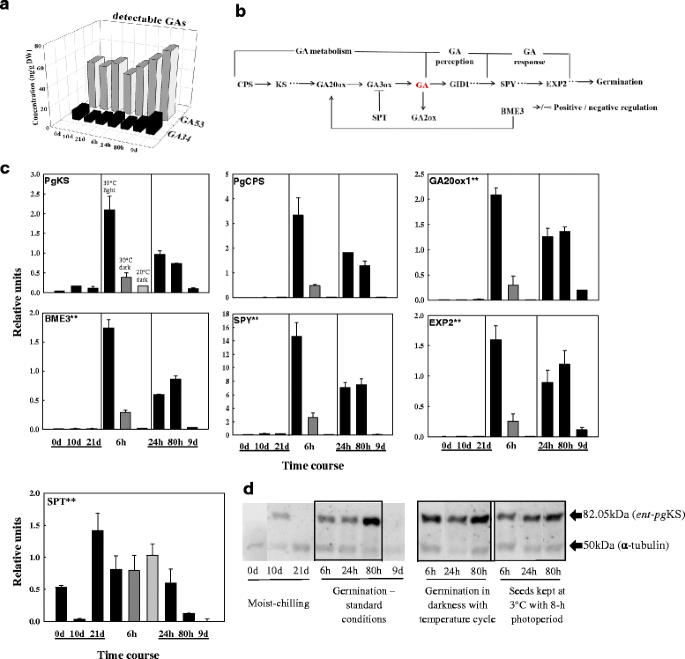
选择3个基因作为内控基因:CO220221(过氧化物酶体靶向信号受体)、CO206996(假想蛋白)和AY639585(泛素结合酶1,UBC1);根据已发表的微阵列分析确定的发育转变过程中它们的组成性表达而选择[48那49].一个特定蛋白的基因子集,介导ABA、GA和生长素生物合成/分解代谢或信号通路(图)。2),利用BLASTN对云杉EST数据库(PlantGDB)和白杉全基因组数据(NCBI)进行查询。引物(附加文件1表S1)采用在线引物3工具设计[50].
白云杉种子从休眠到萌发过程中ABA、ABA代谢物和ABA信号转导成分的变化一种通过UPLC/ESI-MS/MS测定ABA及其代谢物在3°C(0、10和21天)、萌发(6、24和80 h)和幼苗生长(9 d)期间的分布。每个数据点是两个生物学重复的平均值。B.ABA生物合成、信号转导和分解代谢的原理图。C在湿冷(0、10、21 d)、萌发(6、24、80 h)和幼苗生长(9 d)(黑色条)过程中,ABA代谢和信号转导基因的转录水平和选定的下游靶点。还显示了先前冷冻的种子放置在两个对照处理-在30°C(深灰色条)或20°C(浅灰色条)黑暗下萌发6小时的条件。每个数据点是三个生物重复的平均值。条形图表示扫描电镜。注:两个上标星号(**)表示该基因仅在被子植物中被注释;一个星号(*)表示该基因在裸子植物中已被注释,而在白云杉中未被注释;没有星号表明该基因已被白云杉注释
RNA分离、定量RT-PCR和主成分分析
如前所述,RNA从种子中分离出来[51].使用EasyScript Plus™试剂盒(abmGood)用oligo-dT引物将2 μg RNA逆转录为cDNA。将第一链cDNA合成产物稀释5倍,用1 μl的cDNA进行半定量RT-PCR,进行引物特异性检测。使用PerfeCTa®SYBR®Green SuperMix with ROX (Quanta Biosciences)在ABI7900HT机器(Applied Biosystems)上进行定量RT-PCR (qRT-PCR)分析,每个样品在15 μl反应体积中进行3个生物重复。反应混合物由稀释5倍的cDNA 1.0 μl、超混合7.5 μl和每条引物(10 μmol·L) 1.0 μl组成-1).95℃反应5 min, 95℃反应15 s, 59℃反应60 s,循环45次。每个qRT-PCR末端生成解离曲线,仅验证一个产物的扩增。采用real-time PCR Miner (www.miner.ewindup.info) [52],通过内部控制和非模板控制,并通过比较重复的重复性来确认数据质量。由归一化数据生成每个基因在每个时间点的平均表达值。
主要使用SAS®(Vers.9.3; SAS Institute Inc.,Cary,NC)进行原理成分分析(PCA),基于在文本中描述的不同萌发条件下的所有基因的表达模式,如图6,24和80 H中所述.
免疫印迹分析
将种子材料在蛋白提取缓冲液(50 mM Tris pH 8.0, 150 mM NaCl, 1% Triton X-100, 100 μg·ml)中研磨得到蛋白质提取物-1通过测量OD测定苯甲磺酰氟)和蛋白质浓度750借助光度计。蛋白提取液(30 μg总可溶性蛋白)用10% SDS-PAGE分离,用湿电印迹法转移到Amersham hy邦- p (PVDF)膜上。用5% (w/v)脱脂奶粉和0.1% (v/v) Tween-20 (PBST)在3°C条件下阻断印迹过夜,然后用PBST洗3次(每次15分钟)。免疫印迹与抗细胞孵育pgKS (耳鼻喉科-kaurene合成酶)抗体(1:500稀释度)在室温下放置1小时(由T-P.Sun实验室提供)。用PBST冲洗三次(每次15分钟)后,将膜与抗鼠HRP(辣根过氧化物酶)抗体(1:40000稀释度)在室温下孵育1小时。用PBST冲洗三次(每次15分钟)后,将膜排空并放置在含有2 ml超信号West Pico溶液的包装膜内,膜暴露于光下。化学发光图像由CCD摄像系统(Fujifilm LAS 4000)拍摄。
HPLC-ESI-MS / MS的植物激素量化
定量多重激素和代谢物的方法,包括ABA及其代谢物(顺式-Aba,反式-ABA, ABA-GE, PA, DPA, 7'OH-ABA, neoPA)53和ga34),生长素/生长素结合物(IAA, IAA- asp, IAA- glu),细胞分裂素(iPR,顺式zr,顺式-ZOG)遵循之前描述的[53那54].
简单地说,将冻干的种子样品磨碎,并将所有内标的混合物添加到重复的均质种子样品中(每个样品约50 mg),然后使用酸性异丙醇进行提取。样品用Sep-Pac C18墨盒(Waters, Mississauga, ON, Canada)进行固相萃取(SPE)重建和纯化。随后,用在线过滤器将样品注入ACQUITY UPLC®HSS C18 SB色谱柱(2.1 × 100 mm, 1.8 μl),用含0.02 %甲酸的水对乙腈和甲醇混合物(50:50,v/v)进行梯度洗脱。分析使用了MassLynx v4.1 (Waters Inc)控制软件的多反应监测功能。与样品一起进行质量控制样品、内标和溶剂阴性对照样品的制备和分析。
结果
不同萌发条件下云杉种子的萌发曲线
白云杉成熟的种子休眠程度较浅,即使没有湿冷也能发芽。然而,种子在湿冷条件下萌发更快、更均匀。1 b).
为了研究光照对云杉种子休眠缓解和萌发的影响,将云杉种子置于不同条件下,湿冷处理21 d。种子在光照(8小时光周期)和30/20°C温度(标准萌发条件)条件下萌发速度最快,且最均匀。1 b).经过21天的湿冷处理后,在30/20°C和8小时光周期的组合条件下,随后的种子萌发比在恒定黑暗条件下但在相同的30/20°C温度周期下更为成功。根据大多数萌发参数,这种情况是:休眠指数(即,未处理和任何处理的发芽曲线之间的面积;15.54 ± 2.12 vs.7.56±0.97)、发芽速度(即50%发芽所需的时间,8d vs.10d)和发芽滞后时间(6d vs.7d)(图。1 b).在21天研究期结束时,两种处理的萌发率相似(96% vs. 94%)(图。1 b).对照处理(保持3°C,但8小时的光周期)的种子无法发芽(图2)。1 b).无论在转移到发芽温度(8小时光周期或恒定的黑暗)后,经过湿润冷却的种子培养的萌芽比没有接受湿润的种子的种子更快,更同步寒冷;21天的冷却比10天冷冻处理更有益(图。1 b).这表明湿润冷却对休眠缓解具有显着影响,并且在种子暴露于萌发温度之后的光线提示促进了萌发。
基因的表达EMB32它编码一个晚期胚胎发生丰富蛋白(LEA)
通过监测aba调控基因的表达,研究其休眠状态EMB32LEA (Late Embryogenesis Abundant)组的成员之一。休眠维持与晚期成熟程序有一些相似之处[55]、EMB32和其他LEAs在确保种子在干燥/休眠状态下存活方面发挥作用。因此,EMB32可用作休眠标记[56].的确,在白云杉种子潮湿冷却期间,表达了这一点LEA基因保持在高水平,但当种子被转移到发芽条件下,即使在标准发芽条件下6小时,这种表达也会迅速下降(图。1 c, 30°C)。因此,当种子被暴露在光照下并转移到萌发温度时,休眠向萌发过渡就立即开始了。
植物激素途径的动态变化响应于温度升温和种子萌发期间的温度提示
为了研究休眠缓解和萌发期间的激素代谢和信号转导,我们在不同的采样阶段测定了激素水平和指定激素代谢和信号转导蛋白介质的基因转录(图2)。1).
ABA代谢与信号转导
生物活性顺式-S.(+)-ABA的丰度在湿冷过程中没有显著变化,但在冷冻过的白云杉种子随后的萌发过程中有所下降。2).所谓的“trans-ABA”实际上是天然ABA在紫外光下异构化的产物,在向萌发过渡的过程中并没有改变。总的来说,生物活性ABA水平远高于ABA分解代谢产物的水平。从ABA代谢物的变化可以看出,白杉种子中ABA的主要代谢途径是通过8′-羟基化(产生相酸(PA),再还原为二氢相酸(DPA))。然而,次级分解代谢途径如7 '和9 '羟基化(导致7 '羟基ABA和neo-Pa)以及缀合(导致ABA-GE)也被代表。在潮湿的冷却过程中,各种分子,尤其是Pa和7'oh-ABA增加,以及在湿冷的种子的发芽期间(图。2).
大量的记录ABI3在湿冷处理的前10 d,叶绿素含量显著升高,但在21 d时下降到几乎检测不到的水平(图2)。2摄氏度).SnRK2.2转录本在湿冷阶段表现出类似的表达模式(图。2摄氏度).因此,虽然绝对ABA水平仍然是恒定的,但是对于ABA信号传导组分的基因转录,从而对ABA的敏感性开始在潮湿的冷却相的后部开始下降(图。2 b那C).此外,ABI3的负调节器的推定正轨的转录物,CnAIP2[31],在湿冷期逐渐积累,在萌发早期(6 h)保持较高浓度。ABI3而在萌发后期(24和80 h),转录本的含量有所增加(图2)。2摄氏度).
记录的编码AAO3(ABA生物合成酶)在湿冷期变化不大,但在标准条件下萌发早期显著增加,随后下降;那些CYP707A4(编码ABA 8’羟化酶)未检测到。2摄氏度).类似于AAO3,转录本编码CYP707A4和SnRK2.2在早期阶段在6小时将种子转移到标准萌发条件时显示出显着的上调调节,在后期的阶段下降转录物(图。2摄氏度).在萌发24小时前,生物活性ABA的实际下降并不明显。2).在幼苗阶段(9d)中,用于参与ABA代谢和信号传导的所有受监测基因的转录物降低至非常低水平(图。2摄氏度).
GA代谢和信号传导
在白云杉种子(即GA)中定量的14种气体中1那3.那4.那7.那8.那9.那19那20.那24那29那34那44那51,53),只有GA53和ga34都达到了可检测的水平GA53是13-羟基化途径(GA53 → GA44 → GA19 → GA20.(→GA29GA)→1 → GA8.),从而形成具有生物活性的GA1及其无效的退化产品GA8.;GA34是生物活性GA的不活跃的抗牛磺糕4.在非羟基化生物合成途径(GA12 → GA15 → GA24 → GA9.(→GA51GA)→4. → GA34).这两种合成途径的中间产物的存在表明,在白云杉种子休眠缓解和萌发过程中,GA的这两种代谢途径都是活跃的。此外,GA的存在34表明,遗传算法4.肯定是在早期生产的。GA53早期13-羟基化途径有助于生物活性GA的形成1种子经过湿冷处理后,在标准条件下萌发时逐渐增加。期间湿冷本身,GA53和ga34保持在稳定水平,GA53比GA高约5倍34(无花果。3).GA34在第9 d时(即幼苗生长时期)增幅最大(图2)。3).
云杉种子从休眠到萌发过程中GAs和GA信号成分的变化一种遗传前体遗传图谱53和代谢物ga34通过UPLC/ESI-MS/MS在3℃湿冷(0、10和21天)、萌发(6、24和80 h)和幼苗生长(9 d)时测定。每个数据点为两个生物重复的平均值。在我们的分析中没有检测到活性气体。B.GA信号级联中关键基因及其相互作用的示意图特征。连接表示正(箭头)和负(阻塞)调节。C在湿冷(0、10、21 d)、萌发(6、24、80 h)和幼苗生长(9 d)(黑色条)过程中赤霉素代谢基因的转录水平和选定的下游靶标。还显示了先前冷冻的种子放置在两个对照处理- 6小时的萌发条件下,在黑暗的30°C(深灰色条)或20°C(浅灰色条)。每个数据点是三个生物重复的平均值。条形图表示扫描电镜。注:见图。2注意星号。D.云杉种子湿冷、萌发和生长过程中的Ent-pgKS蛋白水平。免疫印迹法显示每lane总蛋白提取物30 μg。以抗ks抗体和抗微管蛋白作为负载对照进行印迹检测
我们监测的大多数GA相关基因(那些编码GA-生物合成、信号传递或作用的介质;无花果。3 b)在湿冷期间低水平表达(图。3 c).(注意,所有内参基因都在这段时间表达;额外的文件1:图S3)。的表达标准贯入试验(抹刀),编码ABA-和GA-信号相互作用的中介,在湿冷10 d时降低到低水平,但在21 d时增加了14倍(图2)。3 c).
我们还研究了已知由GA正调控的基因的转录本丰度,作为存在活性GA的间接指标。GA调控的细胞壁修饰基因expansin 2(EXP2)在将潮湿冷冻种子转移至标准萌发条件后6小时内表现出15倍的上调调节(图。3 c).其他ga相关基因在胚根萌发前的表达量也显著增加;在24-80 h之间有中度表达,而在苗期,所有监测基因的表达都很低或几乎检测不到(图2)。3 c).这表明在种子萌发完成和幼苗早期生长(幼苗出苗)中存在活跃的GA。
耳鼻喉科-pgKS蛋白水平在湿冷的前10天增加,在湿冷的后期下降(图。3 d).将湿冷的种子转移到萌发条件下,这一水平增加了6 h(与增加的转录水平一致;无花果。3 c).最明显的ent-pg在标准萌发条件下,在80小时的种子中ks蛋白水平明显;然而,对照处理表明,改变光条件或暴露于萌发温度的种子足以引发该蛋白质的增加的水平(图。3 d).
生长素代谢和信号转导
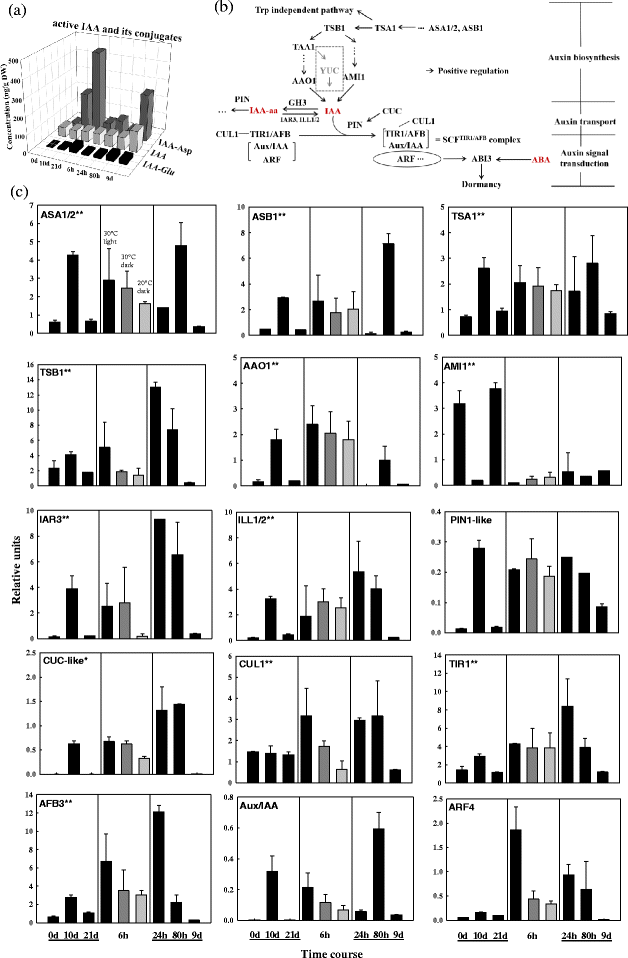
在整个湿冷期和萌发期,活性IAA几乎处于恒定水平。4).IAA偶联物(IAA- asp和IAA- glu)在湿冷处理21 d时显著增加了20倍以上(图2)。4).在标准萌发条件下的前6 h,这些共轭IAAs显著下降;幼苗生长后期,活性IAA和偶联IAA均增加(图。4).
白云杉种子从休眠到萌发过程中IAA、IAA偶联物及生长素相关基因表达的变化一种通过UPLC/ESI-MS/MS检测,IAA和IAA在3°C湿冷(0,10,和21 d)、萌发(6,24,和80 h)和幼苗生长(9 d)期间结合在种子中。每个数据点是两个生物学重复的平均值。B.生长素信号级联中关键基因及其相互作用的示意图特征。连接代表正(箭头)调节。C在湿冷(0、10、21 d)、萌发(6、24、80 h)和幼苗生长(9 d)(黑色条)期间,生长素代谢基因、生长素信号转导基因和选定的下游靶基因的转录水平。还显示了先前冷冻的种子放置在两个对照处理- 6小时的萌发条件下,在黑暗的30°C(深灰色条)或20°C(浅灰色条)。每个数据点是三个生物重复的平均值。条形图表示扫描电镜。注:1)见图。2c中星号的注释;2) BLASTN在白杉中未发现其他ARF同源物(如ARF16)和GH3(将活性IAA转化为IAA-aa)同源物
在制冷途径中(图。4 b那C),生长素生物合成基因的表达(ASA1/2那ASB1那TSA1那TSB1,AAO1)在湿冷处理10 d时最高,在湿冷处理后期(21 d)下降。AMI1,另一个生长素生物合成基因与AAO1,在湿冷处理10 d时表达量最低(图。4摄氏度).这说明生长素在湿冷过程中是活跃合成的,在湿冷的早期和晚期分别激活了两条生长素合成途径的介质。同样的,ASA1/2那ASB1那TSA1那TSB1,AAO1在第6和80 h表现出高表达AMI1发芽期间具有恒定的低表达水平。在拟南芥中,存在第三个助长生物合成途径尤克[57];与拟南芥没有同源物尤克通过大量的数据库搜索,在白云杉中发现了这种生长素生物合成途径,这种针叶树可能不存在这种生长素生物合成途径。的表达IAR3和第1/2页同时,生长素转运体PIN1-like和cuclike的基因表达也随着生物合成基因的转录调节而显著上调和下调AAO1(图2)4摄氏度).在标准发芽条件下放置的种子中,生长素转运蛋白的基因在发芽期间表现出转录物丰度增加的模式,在幼苗生长期间表达降低(图。4摄氏度).
生长素信号主要依赖于TIR1/AFB生长素受体(TAAR)、Aux/IAA和ARF4。的表达TIR1那AFB3和辅助/国际宇航科学院在湿冷过程中有明显的先升后降的调节,而ARF4似乎遵循相同的模式,但处于较低的绝对水平(图。4摄氏度).在萌发6h时,TIR1那AFB3那辅助/ IAA,ARF4显着增加但只有TIR1和AFB3在苗期,ARF4随着TIR1那AFB3,辅助/国际宇航科学院在相当低的水平表达(图。4摄氏度).同样,SCF泛素连接酶复合物的组成部分CUL1的转录本在萌发80小时内大量产生,但在幼苗生长期间没有产生(图1)。4摄氏度).
萌发和胚根突出过程中终止休眠后激素信号通路的动态变化
为了区分最佳发芽温度和光信号对发芽完成的贡献(即胚根突出),在种子接受21天的湿冷处理后,使用两种额外的发芽条件代替标准条件。作为对照,种子不暴露于光(即保持在黑暗中)但暴露于最佳发芽温度(30/20°C)(图。1)或非最佳发芽温度(恒定20°C)(图中未示。1)。将种子转移到标准(即最佳)萌发条件下比将种子转移到相同温度条件下但保持黑暗会导致更大的折叠转录物变化。在黑暗中将种子转移到20°C进一步减少转录诱导(图。2摄氏度那3 c,4摄氏度).这种效应在GA通路的研究基因中表现得尤为明显。
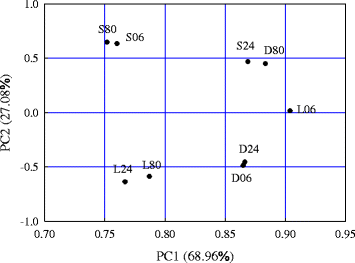
对所有研究基因在不同萌发条件下进行PCA分析(图2)。5.和额外的文件1:图S4)。PC1和PC2解释基因表达变化(68.96和27.08%),PCA和PCA将样品分组为五簇(图。5.).通过PCA分析,我们发现:1)标准萌发条件(30/20°C和8 h光周期)下的萌发起始(6 h)和胚根突出(80 h)与相似的基因表达模式相关。在30/20°C温度循环的黑暗环境中6 h和24 h,在3°C恒定温度(8 h光周期)下24 h和80 h也是如此;2)持续黑暗条件下80 h基因表达模式与8 h光周期条件下24 h基因表达模式相似;3)低温6 h与独特的基因表达模式有关。因此,与最佳萌发温度和光周期条件下的种子相比,持续黑暗光照条件下的种子在6 h的表达模式不同,但在时间上有所延迟。在24和80 h,尽管没有完全发芽(可见胚根突出)(图。5.).温度和光照共同促进了ABA、GA和生长素途径介导的萌发。
主成分分析的结果适用于三种不同萌发条件下ABA和GA途径中先前qPCR分析中使用的所有基因的表达。S06/S24/S80、D06/D24/D80和L06/L24/L80代表与图中D/E/F、H/I/J和K/L/M相对应的标准、黑暗和低温(3°C)发芽条件。1分别
讨论
植物激素协调地对温度信号作出反应
湿冷与激素流量的变化有关
IAA生物合成在湿冷过程中有活性(图。4摄氏度),但活性IAA水平维持在恒定水平,而共轭IAA- asp和IAA- glu稳定且显著升高(图2)。4).偶联IAAs被认为是一种贮藏化合物,在种子中,它要么被储存起来通过脱偶激活并在幼苗早期生长,要么被用作进入随后分解代谢的途径[58].与诸如天门冬氨酸和谷氨酸等氨基酸结合的IAA可能大部分被降解[59].虽然IAA缀合物的功能和调节其形成的基因几乎已经研究,但在湿润冷却过程中积累的大量IAA缀合物可能具有生物学意义。需要更多信息,关于不同的制造形式的蜂窝分布以及对特定传输机制的相对依赖性的蜂窝分布[60].
PIN家族蛋白和最近发现的PIN- like蛋白在IAA胞质和内质网之间运输中作为IAA外排载体非常重要[60那61].我们观察到,在湿冷处理10 d和随后的萌发过程中,转录本PIN1样和类铜显著上调(图。4摄氏度),而活性IAA保持相对恒定(图。4).生长素诱导的细胞扩张与细胞壁的酸化有关,被认为是引起细胞壁松弛蛋白(expansins)活动的增加[62],可以破坏细胞壁中纤维素和半纤维素之间形成的非共价键,从而促进细胞扩张[63].尽管在种子萌发过程中IAA的总量没有显著增加,但由于各种转运体的作用,IAA可能会在种子组织内重新分配到细胞扩张的活跃区域(图。4摄氏度).极性运输在特定的细胞类型中建立了生长素梯度,这种梯度可以在胚胎发生和根系发育等关键过程中提供发育线索[64那65].
助枝素的反应不仅取决于助枝素水平和位置,还取决于TIR1-AUX / IAA和AUX / IAA-ARF互动的特异性和强度[45]。TIR1的可用性降低可能导致游离Aux/IAA水平升高,其将与ARF4结合,从而最终降低游离ARF4水平。因此,在湿冷10 d之前,Aux/IAA可能主要与TIR1/AFB3结合,而不是与ARF4结合,并且游离ARF4有助于增加FABI310 d时的转录本(图。4摄氏度和2摄氏度),因为arf可能结合假定的生长素响应元件(AuxREs)ABI3基因启动子[42].相反,在10d后,ARF4可能更有可能与Aux/IAA相互作用[45],从而降低游离ARF4,导致表达减少ABI321 d时(图;4摄氏度和2摄氏度).这些ABA和生长素信号通路组分之间的相互作用变化可能促进休眠缓解[42].我们的分析仅限于监测转录水平,因此我们只能推测介导生长素和ABA作用的蛋白质水平的变化。ABI3拮抗剂CnAIP2的转录水平的变化也可能与此相关CnAIP2启动子由生长素精确调控。
活性ABA在湿冷过程中没有减少,但在随后的萌发过程中显著减少(图。2),在GA的时候53早期13-羟基化途径有助于生物活性GA的形成1,稳步增长(图。3和C)因此,GA/ABA比率的增加显然与白云杉种子的萌发有关[66].我们的样本中没有检测到任何生物活性细胞分裂素(补充文件)1:图S1)。细胞分裂素和生长素长期以来一直被认为是相互拮抗的,在过去的五年里,我们对细胞分裂素和其他各种激素,特别是生长素之间广泛的相互干扰的理解取得了重大进展。67])。在我们的研究中,在潮湿冷冻期间没有检测到生物活性的游离基细胞分裂素(玉米素,二氢玉米素和异戊二烯腺嘌呤)。然而,生物合成前体顺式玉米素roboside (顺式-ZR)和异戊烯腺嘌呤核苷(iPR)明显增加,而分解代谢产物明显增加顺式-玉米素-O-葡萄糖苷(顺式-ZOG)仅在湿冷却过程中检测到非常低的级别(附加文件1:图S1)。这可能表明顺式-玉米素是湿冷却的结果。
SPT (SPATULA)被认为参与了ABA和GA信号的交叉传递,并可能在拟南芥成熟种子中驱动两种拮抗作用——“促进休眠”和“抑制休眠”——这取决于生态类型背景[68那69].在白色云杉种子,标准贯入试验表达在湿冷10天时下降到低水平,但在21天时表现出14倍的增加(图。3 c).其在白云杉休眠缓解和萌发中的作用尚不明确。
萌发条件
当种子转入萌发状态时,我们观察到我们所监测的基因表达的显著变化,通常仅在6小时内。编码GA调控的细胞壁修饰蛋白expansin 2 (EXP2)的转录本上调了15倍,表明GA信号通路的强烈上调(图)。3 c).ABA在24 h后下降尤其明显(图2)。2).ABI3在第6小时低水平表达,但在第24小时上调,可能与这个关键阶段的“应激感知”功能有关(图)。2摄氏度).在胚根突出时间点(80 h),指定生长素生物合成酶(ASA1/2那ASB1那TSA1,AAO1),或介导转化为活性IAA的蛋白质(IAR3和第1/2页)及发信号(辅助/ IAA,这些信号通路可能与GA和ABA信号通路共同作用(图1)。4摄氏度).因此生长素在白云杉种子萌发过程中可能也起着关键作用。
植物已经进化出一系列光感受器来感知周围的光和光信号的转导[70].在控制种子休眠和萌发方面,光敏色素是研究最多的光感受器。光敏色素是通过SPT与GA途径相关的温度和光依赖[71].的表达标准贯入试验6 h时转录水平显著降低,与光照和黑暗处理的转录水平基本一致。然而,在30°C的种子有较低的水平标准贯入试验在20°C下放置比种子更多的转录物(图。3 c).在白云杉和拟南芥中,SPT可能是一种光稳定的种子萌发抑制因子,并可能通过其转录的温度敏感变化在萌发对温度的响应中发挥作用[68].
新气候情景下的冬季低温及其对针叶树生活史的影响
冬季寒冷是调节植物寿命历史的重要信号;冷却导致通过在冬季年度春节化的春化,并减轻芽和种子休眠,允许春季的生长发作[9.那72].值得注意的是,气候变化可能最终导致冬季缩短和生长期延长[73那74.].在北美,由于气候变化,从南向40°N的冬季寒冷天数已经不足以打破芽休眠,导致植被延迟绿植,但从北向40°N的冬季寒冷天数仍然足够,因为早春导致绿植提前开始[75.].在温带地区,发芽过程中观察到的类似地理格局也可能发生,根据是否最低限度地满足湿冷要求,存在两种可能的情况;即,快速和迅速的萌发导致更大的补充(充分的冷却)或延长的萌发时间导致干旱夏季的不利条件(不充分的冷却)(见图)。1 b).因此,较短的冬季可能会推迟或提前发芽[76.].
另一方面,云杉和其他针叶树的分布范围覆盖了很大的气候梯度,而它们的亚种群可以适应当地的环境[77.那78.].这些种群可能会利用其他分子解决方案来应对当地的环境条件[79.那80].据推测,基因表达的变化有助于表型多样性,包括休眠变异,从而维持针叶树种群的适应性[81.].因此,我们在湿冷过程中基因表达的结果可能有助于预测未来应对气候变化的种子招募。最后,值得注意的是,某些其他针叶树物种(黄柏、西部白松和白皮松)的种子在成熟时比白云杉的种子表现出更深的休眠。这些种子需要几个月的潮湿低温来缓解它们的休眠状态,而且很可能会受到气候变化更大程度的影响,因为延长的低温期对它们的发芽能力至关重要。
结论
除了经典的ABA和GA机制之外,植物蛋白似乎积极参与休眠终止和白云种子的萌发。我们假设通过与ABA信令相互作用,助长信号传导部分在这些过程中起作用。这符合最近关于蟾蜍串和ABA的调查结果在服从中的种子休眠中的肿瘤和ABA [42].生长素在植物形态发生中起着主导作用,在许多发育过程中是不可避免的参与者,也是串扰网络的核心组成部分。我们的研究结果表明,生长素是一个关键的参与者,可能与ABA和GA信号通路一起工作,而此前在植物休眠缓解机制中研究过生长素针叶树种子的低温。我们的研究还深入了解了吸水种子调节其转录以适应环境条件的速度,正如种子从潮湿的低温转移到萌发条件时所证明的那样。在较高温度下光照仅6小时后,转录物丰度的显著变化有人观察到。
缩写
- 阿坝:
-
脱落酸
- ABA-GE:
-
脱落酸葡萄糖酯
- PA:
-
Phaseic酸
- 分区:
-
二氢六烯酸
- neo-爸爸:
-
neo-phaseic酸
- 7 'oh-aba:
-
7'-羟基脱落酸
- 遗传算法:
-
赤霉素
- GA53/34:
-
赤霉素53和34
- 国际宇航科学院:
-
Indole-3-acetic酸
- IAA-Asp:
-
(N) - Indole-3-yl-acetyl天冬胺酸
- IAA-Glu:
-
N - (Indole-3-yl-acetyl)氨基戊二酸
- AAO3:
-
脱落酸醛氧化酶3
- CYP707As:
-
Aba 8'-羟化酶
- PYR / RCAR:
-
Pyrbactin抗性1-like/ aba受体的调控成分
- PP2C:
-
蛋白磷酸酶2C
- SnRK2:
-
蔗糖非发酵1相关蛋白激酶2
- ABI3/5:
-
Aba的3/5
- AIP2:
-
ABI3相互作用蛋白2
- LEC1:
-
叶状鹅卵石1
- 沛富/ AREB:
-
脱落酸响应元素结合因子
- CPS:
-
戊二醛基二磷酸合酶
- KS:
-
Ent——kaurene合酶
- GA20ox:
-
赤霉素20氧化酶
- Ga3ox:
-
赤霉素3氧化酶
- GA2ox:
-
赤霉素2氧化酶
- GID1:
-
赤霉素钝感矮生1
- BME3:
-
蓝色珠孔端3
- 间谍:
-
smindly
- EXP2:
-
棒曲霉素A2
- SPT:
-
铲
- ASA1/2:
-
邻氨基苯甲酸合酶I-1/2组分
- ASB1:
-
邻氨基苯甲酸合成酶1亚基
- TSA1:
-
色氨酸合成酶链1
- TSB1:
-
色氨酸合酶亚基1
- AAO1:
-
醛氧化酶1
- AMI1:
-
酰胺酶1
- IAR3:
-
iaa -丙氨酸抗性3 (iaa -氨基酸水解酶)
- 第1/2条:
-
iaa -亮氨酸抗性(ILR)样1/2 (iaa -氨基酸水解酶)
- PIN1-like:
-
销形成1
- CUC-like:
-
的杯状容器cotyledon-like
- CUL1:
-
Cullin1
- TIR1:
-
运输抑制剂反应1
- AFB3:
-
生长素信号F-box 3
- AUXIN / IAA:
-
生长素诱导蛋白2(生长素/IAA)
- ARF4:
-
生长素反应因子4
参考文献
- 1.
布斯凯J,伊莎贝尔N,佩尔加斯B,科特雷尔J,伦吉斯D,丽特兰K.云杉.森林树木.2007;7:93-114。
- 2.
Nystedt B,Street NR,Wetterbom A,Zuccolo A,Lin YC,Scofield DG等。挪威云杉基因组序列和针叶树基因组进化。自然。2013;497(7451):579-84。
- 3.
杨志强,杨志强,杨志强,等。组装20 Gb白云杉(Picea glauca.)来自全基因组鸟枪测序数据的基因组。生物信息学。2013;29(12):1492-7。
- 4.
Rigault P, Boyle B, Lepage P, Cooke JEK, Bousquet J, MacKay JJ。针叶树基因组分析的白云杉基因目录。植物杂志。2011;157(1):14-28。
- 5.
Baskin CC, Baskin MJ。种子:生态学、生物地理学、休眠和萌发的进化。圣地亚哥:学术;1998.
- 6.
种子:发育、萌发和休眠的生理机制。第三版。.电子书:施普林格;2012
- 7.
巴特拉·D, Benech-Arnold RL。自然种子土壤库休眠水平的预测。acta botanica sinica(云南植物学报),2010;47(1):1 - 4。
- 8。
Finch-Savage WE, Cadman CSC, Toorop PE, Lynn JR, Hilhorst HWM。干旱后熟、低温、硝酸盐和光照对拟南芥(Cvi)种子休眠的释放具有普遍的定量表达模式。51植物j . 2007;(4): 738 - 8。
- 9。
李志刚,李志刚。拟南芥种子对低温胁迫的响应及其对生活史的贡献。中国生物科学(英文版);2012;367(1586):291-7。
- 10.
Graeber K, Nakabayashi K, Miatton E, Leubner-Metzger G, Soppe WJ。种子休眠的分子机制。植物学报。2012;35(10):1769-86。
- 11.
王志强,王志强,王志强,等。水稻种子休眠的分子机制研究。植物生物学学报2008;59:387-415。
- 12.
王志强,王志强,王志强,等。植物种子萌发和休眠过程中激素的相互作用。种子科学与资源学报2005;15(4):281-307。
- 13.
安德森·吉夫,Dogramaci M,Horvath DP,Foley Me,Chao Ws,Suttle JC等。助产工具和ABA充当加拿大蓟(Canade)与Paradormance相关的发展网络中央监管Cirsium arvense).功能整合基因组学。2012;12(3):515-31。
- 14.
林奇斯A,莱布纳·梅茨格G.《超越赤霉素和脱落酸:乙烯和茉莉酸盐如何控制种子萌发》。植物细胞代表2012;31(2):253-70。
- 15.
蕨类植物在被子植物阴影下的多样性。大自然。2004;428(6982):553 - 7。
- 16.
acta botanica sinica(云南植物研究中心),2017,34(4):553 - 558。56进化。2002;(11):2112 - 25。
- 17.
C .种子的进化。新植醇。2010;186(4):817 - 31所示。
- 18。
Hauser F, Waadt R, Schroeder JI。脱落酸合成及信号转导机制的进化。咕咕叫医学杂志。2011;21 (9):R346-55。
- 19。
关键词:赤霉素,低温,生物合成,响应途径拟南芥种子。植物细胞。2004;16(2):367 - 78。
- 20.
acta optica sinica, 2010, 31 (4): 594 - 598 . acta optica sinica, 2010, 31(4): 594 - 598。成熟种子休眠释放和维持过程中内源脱落酸水平的变化:以佛得角群岛生态型、休眠模式为研究对象拟南芥.足底。2004;219(3):479 - 88。
- 21.
张志强,王志强,王志强,等。拟南芥种子萌发过程中赤霉素的合成与调控。植物细胞。2003;15(7):1591 - 604。
- 22.
黄香柏休眠终止后ABA周转及敏感性的变化黄扁柏)种子。中国农业科学(英文版)2002;53(366):89-101。
- 23.
Corbineau F, Bianco J, Garello G, Come dPseudotsuga menziesii与种子ABA敏感性和ABA水平变化相关的冷处理种子休眠。生理植物。2002;114(2):313-9。
- 24.
Feurtado JA, Ambrose SJ, Cutler AJ, Ross ARS, Abrams SR, Kermode AR. western white pine (Pinus Monticola.Dougl。种子与脱落酸代谢的变化有关。足底。2004;218(4):630 - 9。
- 25.
4 .杨杰,安brose SJ, Cutler J, Abrams SR, Kermode AR. western white pine (western white pine, western white pine, western white pine, western white pine, western white pine)Pinus Monticola.Dougl。种子诱导休眠终止和脱落酸分解产物的变化。植物生长规律。2007;26(1):46-54。
- 26.
王志强,王志强,王志强,等。水稻种子休眠的研究进展。赤霉素A的鉴定与测定1和一个9.在的种子Corylus avellanal .足底。1974;117(2):101 - 8。
- 27.
Holdsworth MJ, Bentsink L, Soppe WJJ。调控拟南芥种子成熟、后熟、休眠和萌发的分子网络。新植醇。2008;179(1):33-54。
- 28.
Nambara E,Okamoto M,Tatematsu K,Yano R,Seo M,Kamiya Y.脱离酸和种子休眠和萌发的控制。种子sci res。2010; 20(2):55-67。
- 29.
Romanel EAC,Schrago CG,CuaraGo RM,Russo Cam,Alves-Ferreira M. B3 DNA的演变超级家谱:REM家族基因多样化的新见解。Plos一个。2009; 4(6):E5791。
- 30.
曾玉华,王丽娟,王丽娟,等。一种ab3同源基因在黄杉种子休眠维持和贮藏蛋白激活中的作用相对长度单位基因启动子。植物学报。2003;51(1):39-49。
- 31.
Zeng Y Y, Zhao T ., Kermode AR. ab3互作蛋白在针叶树生命周期的关键转变中起重要作用。植物杂志。2013;161(1):179 - 95。
- 32.
张晓荣,蔡宁华。AIP2 E3连接酶通过促进ABI3降解,作为ABA信号转导的新型负调控因子。基因Dev。2005;19(13):1532 - 43。
- 33.
太阳tp。拟南芥的嗜酸性胃泌素新陈代谢,感知和信号通路。拟南芥书。2008; 6:E0103。
- 34.
徐敏,南原E,崔G,山口S.种子萌发过程中光和激素信号的相互作用。acta botanica sinica(云南植物学报),2009;
- 35.
Bialek K, Cohen JD。大豆种子发育中的游离和共轭吲哚-3-乙酸。植物杂志。1989;91(2):775 - 9。
- 36.
李志强,李志强,李志强,等。吲哚-3-乙酸的生物合成、偶联、分解代谢和稳态拟南芥.植物学报。2002;49(3-4):249-72。
- 37.
Bialek K,Michalczuk L,Cohen JD。种子萌发过程中的生长生物合成菜豆.植物杂志。1992;100(1):509 - 17所示。
- 38.
植物生长素结合水解酶家族在拟南芥萌发过程中促进吲哚-3-乙酸水平的研究。植物杂志。2004;135(2):978 - 88。
- 39.
Brady Sm,Sarkar SF,Bonetta D,McCourt P.该脱落酸不敏感(ABI3)基因受farnesylation调控,参与生长素信号转导和侧根发育拟南芥《植物杂志》2003;34(1):67-75。
- 40
Liu PP, Montgomery TA, Fahlgren N, Kasschau KD, Nonogaki H, Carrington JC。镇压生长素响应FACTOR10MicroRNA160对于种子萌发和发芽后阶段至关重要。工厂J. 2007; 52(1):133-46。
- 41
陈志强,陈志强,陈志强,等。吲哚乙酸和色氨酸对小麦休眠和采前发芽的影响。植物生态学报。2003;30(9):939-45。
- 42
刘XD,张H,赵Y,冯ZY,李问杨总部,等。生长素通过诱导arf介导的ABI3活化,通过刺激脱落酸信号来调控种子休眠拟南芥.美国国立科学院。2013; 110(38): 15485 - 90。
- 43
王志强,王志强。植物生长素对植物生长发育的影响。细胞。2009;136(6):1005 - 16。
- 44.
王志强,王志强,王志强,等。植物生长素调控基因表达的机制。Annu Rev Genet, 2009; 43:265-85。
- 45.
CalderónVillalobosLi,Lee S,De Oliveira C,Ivetac A,Brandt W,Armitage L等。一种用于助长感测的组合TiR1 / AFB-AUX / IAA共同受体系统。NAT CHEM BIOL。2012; 8(5):477-85。
- 46.
刘毅,Kermar,El Kassaby YA。湿冷和热引发对白云杉萌发特性的作用(Picea glauca.)种子。种子SCI技术。2013; 41:321-35。
- 47.
ISTA。种子试验国际规则。种子科技。1999;27:50-2。
- 48.
李志强,李志强,李志强,等。锡特卡云杉发育转变的基因表达谱研究(云杉sitchensis)顶端芽。中国生物医学工程学报。2007;58(3):593-614。
- 49.
Palovaara J,Hakman I.针叶树与相关的同性恋转录因子,WOX2期间的发育考虑和表达动态挪威云杉体细胞胚胎发生。植物mol biol。2008; 66(5):533-49。
- 50.
Rozen S, Skaletsky H. Primer3在万维网上为一般用户和生物学程序员。方法2000;132:365-86。
- 51.
Müller K,Bouyer D,Schnittger A,Kermode R.种子生命周期转变过程中进化上保守的组蛋白甲基化动力学。PLoS ONE.2012;7(12):e51532。
- 52.
赵胜,王志强。实时定量聚合酶链反应的综合算法。计算机生物学杂志。2005;12(8):1047-64。
- 53.
Chiwocha SDS, Abrams SR, Ambrose SJ, Cutler AJ, Loewen M, Ross ARS,等。一种利用液相色谱-电喷雾电离串联质谱分析植物激素及其代谢物的分类方法:生菜热稳定性的激素调节分析(摘要以L.)种子。工厂J. 2003; 35(3):405-17。
- 54.
Chiwocha SDS, Cutler AJ, Abrams SR, Ambrose SJ, Yang J, Ross ARS,等。的etr1-2突变拟南芥影响种子休眠、冷湿和萌发过程中脱落酸、生长素、细胞分裂素和赤霉素的代谢途径。植物j . 2005; 42(1): 35-48。
- 55.
等。冷分层和外源硝酸盐导致拟南芥种子休眠释放过程中类似的蛋白质组功能调整。中国蛋白质组学杂志2012;11(11):5418-32。
- 56.
威廉姆森jd,quatrano rs,cuming ac。EM多肽及其信使RNA水平在小麦的胚胎发生期间通过脱盐酸调节。EUR J Biochem。1985; 152(2):501-7。
- 57.
袁超,沈小龙,马山口,郑志勇,戴晓华,程玉峰,等。色氨酸转氨酶转化为吲哚-3-乙酸的研究拟南芥和丝兰拟南芥.美国国立科学院。2011; 108(45): 18518 - 23所示。
- 58.
植物生长素转运与信号转导的动态整合。咕咕叫医学杂志。2006;16 (11):R424-33。
- 59.
植物生长素结合物:它们在植物发育和陆生植物进化中的作用。中国生物医学工程学报。2011;62(6):1757-73。
- 60
ZažímalováE,Murphy AS,Yang H,HoyerováK,Hošek P.生长素转运蛋白——为什么这么多?冷泉透视生物学。2010;2(3):a001552。
- 61
王宝强,王宝强,王宝强,等。一个新的假定的生长素载体家族调节植物细胞内生长素稳态。大自然。2012;485(7396):119 - 22所示。
- 62
质膜H +−atp酶在生长素诱导的伸长生长中的作用:历史和新方面。植物学报2003;116(6):483-505。
- 63
《膨胀素的生长世界》,植物细胞生理学,2002;43(12):1436-44。
- 64
李志强,李志强,李志强,等。依赖外排的生长素梯度建立拟南芥的顶-基轴。大自然。2003;426(6963):147 - 53年。
- 65
徐建军,王志强,王志强,等。PIN生长素流出促进网络控制拟南芥根的生长和模式。大自然。2005;433(7021):39-44。
- 66
种子休眠对种子萌发的影响。新植醇。2006;171(3):501 - 23所示。
- 67
交叉途径:细胞分裂素信号转导与串扰。发展。2013;140(7):1373 - 83。
- 68.
Penfield S, Josse EM, Kannangara R, Gilday AD, Halliday KJ, Graham IA。冷光通过bHLH转录因子SPATULA调控种子萌发。咕咕叫医学杂志2005;15(22):1998 - 2006。
- 69.
何志强,王志强,王志强,等。转录因子SPATULA对拟南芥生态型种子初级休眠的调控差异。美国国立科学院。2013; 110(26): 10866 - 71。
- 70.
Moglich A,Yang X,Ayers RA,Moffat K.植物光感受器的结构和功能.植物生物学年鉴,2010;61:21–47。
- 71.
黄志强,王志强,王志强,等。光敏色素在温度依赖性萌发中的作用。新植醇。2007;174(4):735 - 41。
- 72.
王志强。植物对温度的感知和信号转导。新植醇。2008;179(3):615 - 28。
- 73.
罗伯逊SM。北美日最低和最高温度的时变百分比趋势。地球物理学报。2004;31(4):1-4。
- 74.
Schwartz MD,AASA R,AASA A.春天开始前一半开始的春天开始。全球变化BIOL。2006; 12(2):343-51。
- 75.
张XY,Tarpley D,Sullivan JT.植被物候对气候变暖的不同响应。地球物理研究。2007;34:L19405。
- 76.
一枝黄花(菊科)一种狭义特有种与两种地理分布广泛的种种子萌发生物学的比较研究1。萌发物候及冷分层对萌发的影响。种子科学与资源学报1997;7(1):47-58。
- 77.
Aitken SN,Yeaman S,Holliday JA,Wang TL,Curtis McLane S.适应、迁移或灭绝:树木种群的气候变化结果.进化应用.2008;1(1):95-111。
- 78.
Mimura M, Aitken SN。锡特卡云杉周边地区的局部适应。生物多样性。2010;23(2):249-58。
- 79.
Prunier J,Laroche J,Beaulieu J,Bousquet J.扫描基因组的基因SNP与气候适应和估算在北方黑云杉中分子水平的估算选择。Mol Ecol。2011; 20(8):1702-16。
- 80。
Prunier J,Gérardi S,Laroche J,Beaulieu J,Bousquet J.北方黑云杉对气候的平行和谱系特异性分子适应.分子生态学.2012;21(17):4270-86。
- 81。
Verta JP, Landry CR, MacKay JJ。长寿的树木能适应进化变化吗?云杉基因表达网络进化中的单位点效应。摩尔生态。2013;22(9):2369 - 79。
确认
我们要感谢T-P博士。Sun(杜克大学)获得KS抗体,L. Irina Zaharia博士(植物生物技术研究所)获得激素量化数据,D. Kolotelo先生(不列颠哥伦比亚省森林、土地和自然资源经营部)获得种子供应。我们非常感谢欧洲委员会通过玛丽·居里IOF奖学金资助KM,以及NSERC发现基金资助ARK和YEK。
作者信息
从属关系
相应的作者
补充资料
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
构思设计实验:YL ARK KM YAK。进行实验:YL.分析数据:YL.撰写论文:YL ARK KM YAK。所有作者都已阅读并批准了手稿的最终版本。
额外的文件
附加文件1:表S1。
用于qPCR的基因和引物对的描述。图S1。概要文件的种子细胞分裂素及其代谢产物的白云杉电喷雾质谱(由UPLC / / MS)在moist-chilling 3°C(0、10和21 d),在萌发(6、24和80 h)和幼苗生长(9 d)。每个数据点是两个生物复制的平均值。顺式-ZR,顺式玉米素核苷;知识产权,Isopentenyladenine roboside;顺式佐格,顺式-Zeatin-O-glucoside。图S2。将种子转移到标准萌发条件(即8小时光周期和30/20°C)(黑色条)、持续黑暗和30/20°C周期(浅灰色条)或恒定3°C和8小时光周期(深灰色条)后6、24和80 h,各种标记基因的转录水平。每个数据点是三个生物重复的平均值。条形图表示扫描电镜。图S3。研究时间点所有三个参考基因的C(t)值。图S4。激素定量分析的重复性。注:4种代谢物(IAA- asp, IAA, PA和ABA)的两个实验重复之间的差异通过面板上的颜色来区分。多克斯(475 kb)
权利和权限
开放获取本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
刘,Y.,Müller,K.,El Kassaby,Y.A。等白云杉激素通量和信号转导的变化(Picea glauca.种子从休眠到萌发过程中对温度信号的响应。BMC植物杂志15,292(2015)。https://doi.org/10.1186/s12870-015-0638-7
收到了:
公认:
发表:
关键词
- 种子休眠
- 生长素
- 阿坝
- 气体
- Moist-chilling
- 种子发芽
- 白云杉