摘要
背景
NAC转录因子是一个大型的植物特异性基因家族,参与多种生物过程的调控。尽管对不同物种NAC转录因子的研究越来越多,但关于针叶树中NAC转录因子的信息却很少。本研究的目的是鉴定海松的NAC转录家族(松果体松树),研究ataf样基因在不同胁迫下的分子调控特性。
方法
我们隔离了两棵海松南汽基因和使用瞬时表达分析n benthamiana叶研究启动子茉莉酸反应。
结果
在这项研究中,我们确定了37个南汽并将其分为6个亚科。最大的一组包括12个与压力相关基因对应的序列。其中两个南汽的基因,PpNAC2而且PpNAC3,分离并检测了它们在不同发育阶段和对不同类型胁迫的反应中的表达谱。茉莉酸甲酯(MeJA)、机械伤害和高盐度均能强烈诱导这两个基因的表达。这些基因的启动子区域显示包含独联体-参与应激反应和植物激素调节的元素,包括e -box,通常在茉莉酸反应基因的启动子中发现,以及bHLH蛋白的结合位点。使用瞬时表达分析法n benthamiana我们发现叶子的启动子PpNAC3而在转录因子NbbHLH2沉默的植物中,这种反应消失了。
结论
我们的研究结果表明PpNAC2而且PpNAC3编码与松树茉莉酸反应有关的胁迫应答NAC转录因子。此外,这些数据还表明茉莉酸信号通路在被子植物和裸子植物之间是保守的。这些发现可能有助于通过生物技术手段对松木的工程抗逆性进行研究。
背景
针叶树是裸子植物中最重要的一组,统治着北半球的大型生态系统,它们也具有重要的经济意义,因为它们被密集地用于木材、燃料、树脂和造纸[1].在数百万年与不断变化的环境条件、相互竞争的植物、潜在的害虫和觅食的动物共存的过程中,针叶树进化出了强大而有效的防御机制。这些机制包括结构、形态或物理障碍,如树脂管、草酸钙结构、巩膜细胞和木质素,以及/或化学防御,包括酚类或挥发性和非挥发性萜类化合物的产生[2].在过去的几十年里,人们发现茉莉酸(JA)、乙烯(ET)和水杨酸(SA)等几种植物激素参与复杂的信号级联反应和化学防御的合成[3.].特别是,研究发现Me-JA通路与对落叶毛虫、budworms和树皮甲虫的伤害反应密切相关[4- - - - - -6].与我们对与胁迫相关的结构和化学反应的详细知识相比,关于植物应对环境变化的分子机制的信息很少。
海事松(松果体松树爱)对非生物胁迫特别耐受,表现出相对较高的种内变异性[7].在欧洲,海松也被用作针叶树基因组研究的模型树[8,9而新一代测序技术(NGS)的出现促进了新创转录组组装[10].测序数据可在SustainpineDB (http://www.scbi.uma.es/sustainpinedb/sessions/new).
海洋松转录组中共有877个转录因子(transcription factor, TF),根据与DNA结合相关的保守结构域分布在30个家族中[10].海松中TF的数量与先前报道的白杉中TF的数量相似[11但比报道的被子植物物种要小[10].
基因表达调控在植物响应环境刺激过程中起着至关重要的作用。最近积累的证据表明,许多TF家族,包括DREB、bZIP、MYB、zinc-finger、WRKY和NAC家族,直接或间接调控植物的防御和胁迫反应[12- - - - - -18].
NAC家族是最大的植物特异性转录因子家族之一,由105个基因组成拟南芥水稻140、马铃薯110、杨树163、白云杉32。NAC蛋白具有高度保守的n端dna结合结构域,由近160个氨基酸残基组成,分为5个子结构域(a - e)。NAC结构域的功能与细胞核定位、DNA结合以及与其他含NAC结构域的蛋白质形成homo或异二聚体有关[19].相比之下,c端区域是高度分化的,包含一个转录调控域[20.].NAC因子调控茎尖分生组织发育等过程中相关基因的表达[21- - - - - -23],花的形态建成[22,24],侧根发育[25],叶片衰老[26,27,细胞周期的调节[28,29],激素信号传导[25,28,30.,31],谷物养分再调动[32],木质素发生、纤维发育及木材形成[33- - - - - -35].NAC蛋白也参与植物对非生物和生物胁迫的反应[36,37].
几种NAC蛋白已经在拟南芥在水稻、大豆和棉花等植物中具有提高生物和非生物抗逆性的潜力。ANAC019、ANAC055和RD26 (ANAC072)在拟南芥上调胁迫诱导基因的表达,提高植物的抗旱性和耐盐性[38].ATAF1和ATAF2拟南芥HvNAC6在大麦中对干旱和病原菌胁迫的响应中发挥重要作用[31,39- - - - - -41].ATAF1作为ABA信号的负调控因子,但诱导MeJA/ et相关的防御信号标记基因[31].相反,ATAF2的表达是由脱水、MeJA和SA诱导的,而不受ABA的影响[40].在水稻中,OsNAC1和OsNAC5的过表达提高了田间条件下的耐旱性和耐盐性,提高了产量[42,43].
在过去的几年里,被子植物NAC转录因子家族成员的结构特征有了很大的提高;然而,这些TF的大部分函数仍然是未知的。关于裸子植物中NAC蛋白的资料有限[23,44].在本研究中,我们共鉴定了37个含NAC结构域的TFp .松树.进行了详细的序列分析,包括系统发育、保守基序和启动子分析。此外,我们还分析了两种表达模式p .松树NAC基因,PpNAC2而且PpNAC3,与拟南芥ATAF1而且ATAF2基因。我们已经确定了它对高盐度、低温、伤害、MeJA和ABA处理的响应。这两个基因在MeJA处理和/或损伤时都能迅速和强烈地诱导。
此外,我们执行在网上而且在活的有机体内PpNAC3调控区分析。在瞬态表达式的方法中使用烟草benthamiana叶子,的表达PpNAC3被bHLH MYC茉莉酸应答转录因子调控。这表明在两个系统发育距离较远的物种中存在一种保守机制。
结果
NAC家族成员的鉴定与系统发育分析
以已知NAC蛋白保守的dna结合结构域作为查询,鉴定NAC蛋白南汽海洋松木数据库(SustainpineDB)中的基因。共有37个推定南汽基因被确定。我们将所有NAC结构域编码基因标注为PpNACxx,其中Pp为物种首字母(松果体松树)和xx是在SustainpineDB中的有序标识中给出的数字。
鉴定出的NAC基因p .松树编码平均409个氨基酸的蛋白质。本研究确定了松木NAC基因的详细信息,包括入库编号、与NAC基因的相似性拟南芥假定的同源物和蛋白质序列,在附加文件中提供1.
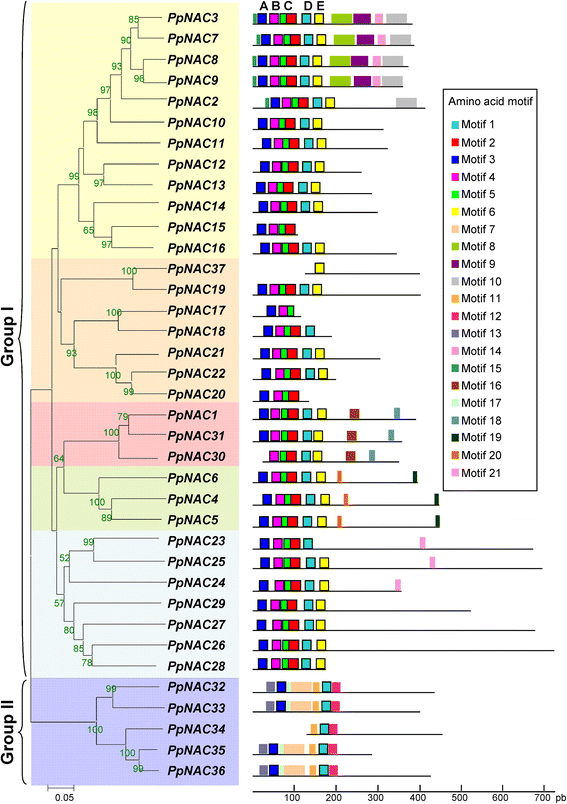
利用Clustal X version 1.83程序对其蛋白序列进行多序列比对松树。结果表明p .松树根据dna结合域结构的相似性,NAC家族可以分为两类:一类是可以细分为5个簇的NAC家族,另一类是由5个NAC蛋白组成的单一簇组成的NAC家族(图2)。1).
NAC蛋白家族在松树。编码的37个蛋白质的多重比对南汽基因p .松树使用MEGA 4.0软件,通过Neighbor-Joining (NJ)方法构建系统发育树,自举重复1000次。bootstrap评分高于50%的百分比和亚科分类。NAC蛋白(1 - 21)中的氨基酸基序用彩色框表示(附加文件2).黑线表示相对蛋白质长度
为了进一步研究松树NAC家族的多样性,我们利用MEME程序预测了保守性母题[45].共鉴定出21个蛋白质基序,残基长度为6 ~ 50个。为了简化,我们只考虑那些在一个集群中超过一半的成员中存在的母题。在系统发育树中,大多数关系密切的成员具有共同的motif组成(图。1).NAC蛋白n端有5个子结构域A-E [20.,46].我们将Motif 3分配给子域A, Motif 4分配给子域B, Motif 5和Motif 2分配给子域C, Motif 1分配给子域D, Motif 6分配给子域E(图。1和额外的文件2).在附加文件中显示了不同NAC蛋白n端区域的子结构域分布3..大多数海洋松NAC蛋白的dna结合域包含A- E子域;然而,II组的成员只包含子域A和D,缺乏子域B, C和e。这些蛋白包含n端区域的Motif 7,似乎已经取代了大多数的Motifs 2,4和5PpNAC序列。II组蛋白也含有NAC结构域的Motifs 11、12和13。尽管我们能够从I组的特定簇中识别出NAC蛋白中的某些特定基序,但c端区域是高度不同的2).motif 8、9、10和14存在于最大的NAC蛋白簇中。大多数假定的母题的生物学意义是未知的,需要进一步的研究,但它是诱人的推测,结构同源性可能与功能有关。
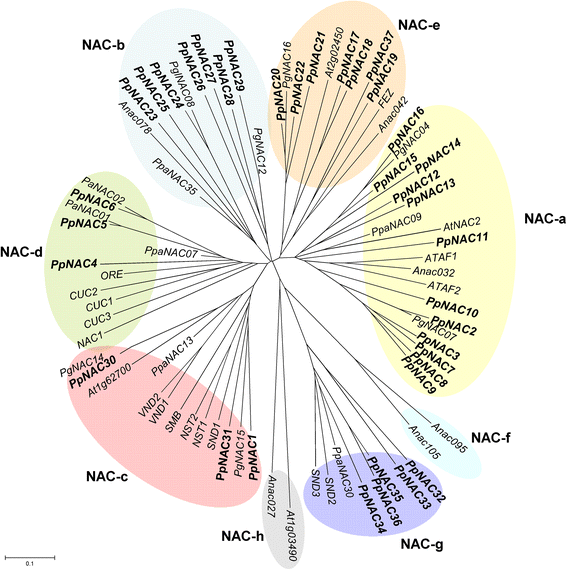
为了探讨海松NAC因子与该家族其他成员在植物中的系统发育关系,本研究获得的序列和海松NAC蛋白全长序列P. glauca, P. abies, A. thaliana而且Physcomitrella金属盘比较。数字2表明松木NAC科可根据[46].第一组包括naa、NAC-b、NAC-d和NAC-e亚家族,第二组包括NAC-g亚家族。naa支是中最大的一支p .松树其中包括12序列。该进化支包括系统发育接近于胁迫相关基因的基因,如ATAF1和ATAF2 [41和PpaNAC09, PgNAC04和PgNAC07(附加文件4) [23,46].
NAC-b支包括7个p .松树与c末端具有跨膜基序的蛋白质相似的序列,在细胞分裂或内质网应激反应期间介导细胞分裂素信号传导[28,47].NAC-e支包括7个p .松树序列和费斯基因,已被证明与根干细胞的细胞分裂方向有关[29].三个p .松树NAC与血管发育有关,如VND1/2、NST1/2、SND1和SMB [48- - - - - -50].三个p .松树序列与来自的CUC1/2/3和ORE基因聚在NAC-d枝上拟南芥[51- - - - - -54],以及PaNAC1和PaNAC2基因p .冷杉属[23];该分支的基因可能参与器官的起始和分化。5个序列与NAC-g聚在一起拟南芥;这些基因参与了次级细胞壁的转录网络[55].枝NAC-f和NAC-h不含任何细菌p .松树南汽基因。与这两个亚科聚集在一起的大部分NAC基因的功能尚不清楚,但这两个亚科在海洋松中没有代表性。
两种NAC基因的克隆及分子特性分析p .松树
根据我们实验室之前获得的微阵列数据,两棵海松南汽naa亚家族的基因PpNAC2而且PpNAC3(无花果。2),进行功能表征。PpNAC2而且PpNAC3利用PCR技术克隆cDNA并进行全序列测定。这些基因的序列同源性达到75%拟南芥ATAF1和ATAF2是NAC转录因子,在生物和非生物胁迫响应中具有生物学功能[40,41].的互补PpNAC2长度为1170 bp,包含一个编码387个氨基酸的ORF,而PpNAC3cDNA全长1152 bp,氨基酸序列为383个氨基酸。起始密码子上游的调控序列PpNAC2(661 bp)和PpNAC3(1115 bp)采用基因组行走法分离。
PpNAC2而且PpNAC3空间和时间器官特异性表达
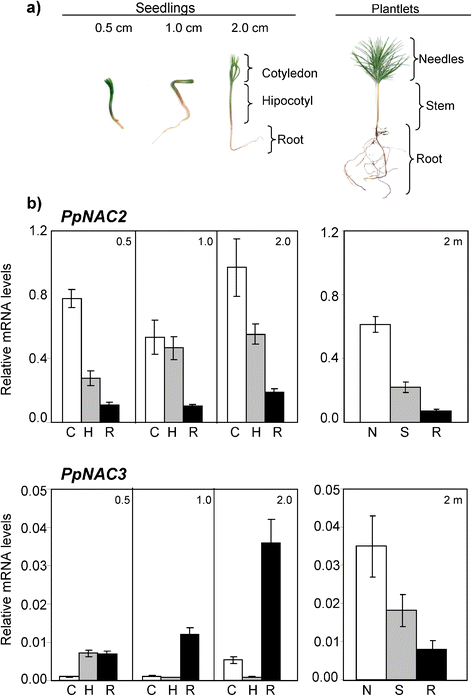
确定这些基因的空间表达模式和发育模式p .松树提取各植物器官的总RNA,采用定量PCR (qPCR)技术对其相对丰度进行分析。基因表达的PpNAC2而且PpNAC3在子叶长度为0.5、1.0和2.0 cm的幼苗和2个月大的幼苗中进行分析。3).苗,PpNAC2在子叶和下胚轴中转录本含量特别高,而在根中转录本含量低得多。相比之下,PpNAC3在发育过程中主要在幼苗的根部表达。有趣的是,PpNAC2而且PpNAC3在2个月大的幼苗中表现出类似的组织特异性表达模式,在针中检测到最高水平的转录本(图。3 b).值得注意的是,表达水平PpNAC2比of高一个数量级PpNAC3.将转录水平归一化为内参基因的表达水平,如方法部分。
的表达模式PpNAC2而且PpNAC3。一个本研究采用子叶长0.5、1.0、2.0 cm的松树幼苗和2个月龄的幼苗的代表性图片。bqPCR分析PpNAC2而且PpNAC3不同器官的转录本p .松树种子和植株。从不同样品中提取总RNA并进行逆转录。使用每个基因的特定引物扩增cDNA,如附加文件中所述4S1:表。表达数据用内参基因的几何平均值(行为,40年代而且EF1α).对3个独立的生物标本进行3次分析,并显示平均值±SE。(C)子叶,(N)针,(H)下胚轴,(S)茎,(R)根
PpNAC2而且PpNAC3响应非生物胁迫和激素处理的表达
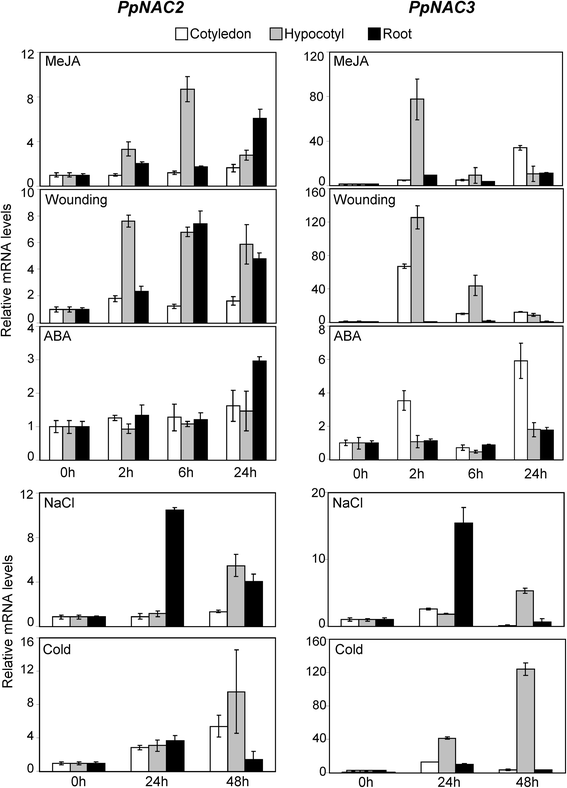
测试是否PpNAC2而且PpNAC3作为胁迫响应基因,我们对不同胁迫条件下幼苗子叶、下胚轴和根系的总RNA进行了qPCR分析。表达式PpNAC2而且PpNAC3在MeJA和受伤反应中上调(图1)。4法案,受伤)。然而,PpNAC2下胚轴和根在24小时内表现出持续的反应,而观察到的短期反应为PpNAC32小时时,下胚轴优先。对ABA的响应仅在处理24 h后才能检测到,且仅在根中观察到PpNAC2并在子叶为PpNAC3(无花果。4ABA)。相比之下,PpNAC2而且PpNAC3NaCl处理和冷处理的反应相似(图1)。4、氯化钠、冷)。值得一提的是,对不同治疗的反应幅度总是较高的PpNAC3比PpNAC2。具体来说,观察到的诱导PpNAC3大约是?的10倍PpNAC2对MeJA的反应,伤人又冷漠。
PpNAC2而且PpNAC3启动子控制独联体-参与生物和非生物胁迫的元素
进一步探讨对这些产品的监管南汽海松基因的5′-上游序列PpNAC2而且PpNAC3在PLACE数据库(https://sogo.dna.affrc.go.jp/cgi-bin/sogo.cgi) [56识别假定的独联体监管元素。分析表明,两种启动子具有相似的应激反应独联体-元件如DPBF1 (aba响应元件)、w -box、gcc -box、MYB结合位点和w -box(图;5).这一分析也显示3个电子盒(CANNTG)位于661台币PpNAC2启动子序列,6个e -box位于1115 ntPpNAC3启动子序列。在植物防御基因的启动子中发现了e -box [57].此外,e- box是植物中bHLH转录因子的结合位点,被认为是AtMYC2结合的同源元件,在植物中早期茉莉酸反应基因的激活中起重要作用拟南芥[58,59].这些元素通常存在于对MeJA反应的基因启动子中[59,60].
假定的分布方案独联体的-作用元素PpNAC2而且PpNAC3基因启动子。分析了这些基因的5 '调控区,以确定其是否存在独联体-利用植物的作用调节元件独联体-acting regulatory DNA elements (PLACE)数据库(http://www.dna.affrc.go.jp/PLACE/),以及一些应激反应和激素调节独联体映射PLACE数据库中列出的元素。相对位置是相对于翻译起始点(ATG)的第一个基的。
的功能分析PpNAC3启动子的n benthamiana
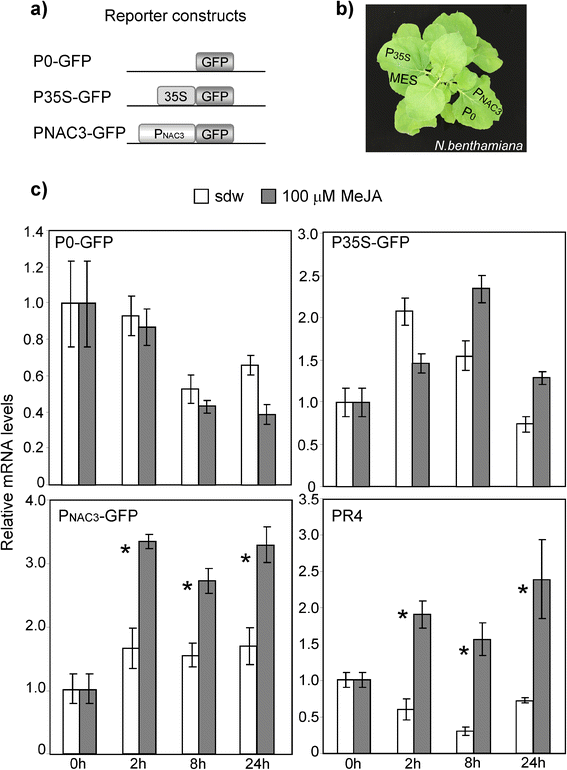
由于稳定表达的针叶树株系的产生需要一年左右的时间,而转基因株系的选择是一个费力的过程,我们在烟草作为一种简便、高效的植物启动子定量分析方法在活的有机体内[61,62].启动子的PpNAC3,根据观察到的应力响应,选择其进行功能分析(图。4).
的启动子区域的结构PpNAC3(1115 bp)与二元载体p35S-GFP中GFP报告基因融合,取代35S启动子,生成PNAC3gfp。阳性对照为p35S-GFP,阴性对照为MES缓冲液和不含35S启动子的p35S-GFP (p0-GFP)(图3)。6).n benthamiana树叶被农业浸透农杆菌属包含各种构造(图。6 b).MeJA激活了被报道的基因的转录PpNAC3启动子(无花果。6摄氏度PNAC3gfp)。与水处理的叶片相比,MeJA处理2、8和24小时后,GFP表达量大约增加了3倍。相反,阴性对照和MES缓冲液浸润的叶片GFP表达没有增加(图3)。6摄氏度P0-GFP)。无论用MeJA处理还是水处理,浸润阳性对照的叶片均表现出GFP表达的瞬时增加(图1)。6摄氏度P35S-GFP)。作为附加对照,内源性的表达水平PR4分析该基因作为茉莉酸依赖信号通路的标记。如图所示。6摄氏度(PR4), PR4的表达是通过MeJA快速诱导的,观察到的谱图与MeJA介导的PR4非常相似PpNAC3启动子。
表达调控由PpNAC3启动子的NbbHLH2沉默的植物
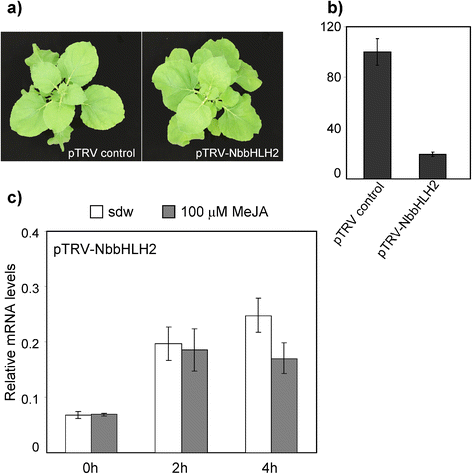
为进一步研究茉莉酸酯介导的对黄芪多糖的调控作用PpNAC3启动子的n benthamiana我们使用VIGS方法沉默bHLH MYC蛋白。以往的报道显示,MYC2蛋白识别并结合的启动子序列在不同植物类群之间具有高度的保守性[58,63].在n benthamiana,蛋白质NbbHLH1而且NbbHLH2可以绑定一个E-box元素在PMT启动子(64并激活它[65].
利用RT-PCR和特异性引物,我们得到了一个400 bp的片段,对应于该基因开放阅读框的5 '区域NbbHLH2基因。将该片段插入gateway兼容的烟草rattle病毒载体pTRVGW (pTRV-NbbHLH2) [66].4周后,与pTRV对照植株相比,nbbhlh2沉默植株的形态没有变化(图1)。7一个).内源性植物烯去饱和酶基因的沉默,NbPDS,作为对照,以检测VIGS的有效性。通过qPCR评估沉默程度,结果表明NbbHLH2与pTRV对照植株相比,转录本丰度降低了约85%。7 b).
MeJA条例PpNAC3启动子在n benthamiana叶子沉默之后NbbHLH2。经土壤浸渍48 h后,PNAC3-GFP构建后,用MeJA处理叶片,分别在0、2、4 h测定GFP表达。如图所示。7 c,在n benthamiana叶片具有内源性沉默NbbHLH2基因,GFP转录水平在MeJA处理后没有改变。
讨论
森林树木经常受到环境压力的影响。当前和预测的气候条件,如长期干旱、土壤和水的盐碱化加剧以及高温事件,对世界范围内的森林生产力构成严重威胁,影响树木的生长和生存。了解森林树木如何适应恶劣的环境条件对维持生产力和满足未来对森林衍生产品的需求是必要的。目前,利用分子分析和基因工程来提高非生物胁迫耐受性的努力取决于对植物响应胁迫的信号通路的深入了解,以及对关键调控蛋白的识别[67].
在这项工作中,我们已经鉴定了37个非冗余的NAC结构域蛋白p .松树基因组。这一数字接近于先前报告的数字云杉glauca(36)11,44),Physcomitrella金属盘ssp。金属盘(35)68],但大大少于被子植物中报道的数量:117 in拟南芥,水稻151,杨树163,桉树189,大豆和烟草各152 [69- - - - - -74].在针叶树的其他TF基因家族成员中也有类似的发现,例如海洋松和火炬松的Dof基因家族,共有10个成员[75],明显少于被子植物中Dof基因的数量[76,77].这些数据表明,NAC基因家族和其他TF家族一样,通过基因复制在被子植物中扩大和多样化,产生了序列高度相似和功能冗余的近缘基因。
的p .松树NAC蛋白可以根据其dna结合域的相似性在系统发育上聚集成两个亚组。第I组有31个成员,可以进一步分为5个亚组,第II组由6个NAC蛋白组成(图。1).使用MEME程序识别的保守母题定义了六个亚族p .松树NAC蛋白,这与我们的系统发育分析一致。此外,在I类所有蛋白n端区域鉴定出的5个亚结构域(A-E)中,我们鉴定出了4个保守结构域(motifs 7、11、12和13),它们也位于II类NAC蛋白的n端区域。具体来说,Motif 7与Motif 9相似,在各种植物的少数NAC蛋白中都发现了Motif 9 [74].该motif与NAM结构域(PF02365)同源,似乎取代了motif 2、4和5。1b).大部分位于c端区域的保守母题都是新的,但也有一些被发现是相关的,尽管它们的功能不同。例如,Motif 10先前被描述为一个转录激活Motif [20.,78],它存在于与压力相关的基因中。Motifs 19和Motifs 20在一个亚家族成员中保守,分别对应于W-motif和L-motif,正如前面所描述的CUC亚家族的c端结构域[23,52,79].然而,大多数蛋白质基序的生物学意义目前尚不清楚,因此仍有待进一步研究。
Shen et al.(2009)对来自不同植物物种的植物NAC域TFs进行了全基因组生物信息学调查,分析中不包括裸子植物。系统发育分析p .松树NAC蛋白和其他植物的NAC蛋白特征表明,所有的NAC序列来自于p .松树可以包括在不同的进化支中(图。2一个),如前所述[46].然而,演化支f和演化支h却不存在p .松树南汽的蛋白质。有趣的是,在苔藓中也没有NAC-f亚家族(p .金属盘,苔藓类),穗状苔藓(美国moellendorffii、石松)及白云杉(p . glauca),这表明这个进化支出现的时间比其他六个进化支晚,可能具有独特的、可能更具体的和专门的功能[23,46].
NAC家族的高序列多样性,尤其是c端结构域,提示该家族的功能也已多样化。这一结论得到了NAC蛋白参与植物生长发育和胁迫响应的研究的支持。
进化上密切相关的nac编码基因通常发挥相似的功能[46,80].在海松的系统发育分析中,PpNAC2和PpNAC3聚在naa支中,表明这些转录因子可能扮演着类似的角色拟南芥干旱诱导ATAF1和ATAF2 [40,41].
的表达PpNAC2而且PpNAC3qPCR检测的所有组织中均检测到PpNAC2在幼苗的子叶和下胚轴中,而基因表达水平PpNAC3在幼苗根系中含量尤其丰富。3 b).这种表达模式表明,这两个基因可能在松树幼苗中发挥非冗余功能。最接近的同系物拟南芥,ATAF1而且ATAF2,也在所有组织中表达;然而,根据genev调查者的数据,ATAF1在根中表达量较高ATAF2在子叶和叶片中含量较高。这个转录分布模式拟南芥与观察到的PpNAC3而且PpNAC2在松树。文献的不同报道表明,NAC转录因子在植物的生长发育、激素信号转导以及植物的胁迫响应中发挥着重要作用。ATAF1作为ABA信号的负调控因子,但诱导JA/ et相关的防御信号标记基因[31].然而,ATAF2是由脱水以及JA和SA诱导的[40].ANAC19、ANAC055和RD26 (ANAC072)是干旱、高盐和/或脱落酸诱导的基因,这些基因的过表达上调了多个胁迫相关基因的表达,从而增强了植物对干旱胁迫的耐受性[38].同样,我们的研究表明PpNAC2而且PpNAC3盐、冷、机械伤等多种应力处理(图1)4).这些结果表明PpNAC2而且PpNAC3可能涉及到一般的反应p .松树非生物压力。有趣的是,损伤和MeJA处理对这两个基因都有强烈的诱导作用。MeJA作为一种可运输的细胞间分子,可以从叶片移动到根部或其他组织,这一作用已在研究中确立拟南芥在植物中茄科家庭(81,82].这也许可以解释为什么PpNAC2而且PpNAC3在子叶上施用MeJA后,下胚轴的基因发生了变化。非常迅速的积累PpNAC3治疗两小时后的转录结果也表明PpNAC3对压力的短期反应特别敏感吗.的基因StNAC在土豆,OsNAC6大米,ATAF1而且ATAF2在拟南芥,都具有高度的同源性PpNAC2而且PpNAC3,被致伤/致病相关的植物激素MeJA上调[40,83,84].许多NAC转录因子对多种应激信号作出反应,它们的蛋白产物可能以负调控或正调控的方式参与几个显然不相关的过程的调控[85].
基因启动子区分析PpNAC2而且PpNAC3是进一步了解这两个基因在胁迫诱导下表达调控的前提。5).两个启动子都有几个先前的应激反应特征独联体-元素,包括DPBF1 (aba响应元素)和MYB结合位点[86- - - - - -88].其他已知对环境刺激有反应的元素,如光、病原体、脱水和低温(具体来说,w -box [89]及通讯盒[90)也在场。w -box和gcc -box分别被称为WRKY和ERF转录因子的识别位点。快速而短暂的积累PpNAC2而且PpNAC3表明它们可能是创伤/MeJA反应的早期调控因子。的在网上对假定的分析独联体有效的PpNAC2而且PpNAC3促销者还展示了三款电子信箱PpNAC2还有六个电子信箱PpNAC3(无花果。5).E-box元件普遍存在于MeJA应答基因的启动子上,是植物中bHLH转录因子的典型结合位点。一般来说,含有应激反应的基因独联体-元素实际上是由相应的胁迫诱导的,我们特别感兴趣的是转录反应的功能分析PpNAC3的法案。由于转基因树的再生时间长、技术复杂,针叶树基因的功能分析在其他模式植物中也有研究[91,92].在这项工作中,我们研究了转录调控PpNAC3推广使用农杆菌属-介导的瞬时表达n benthamiana叶子。这是一种简单有效的植物启动子定量分析方法在活的有机体内[61,62].我们的结果表明,电子盒包含在PpNAC3近端启动子区经MeJA处理后被反转录激活n benthamiana叶子(图。6摄氏度).这个响应消失时n benthamiana植物内源性沉默NbbHLH2基因(图。7 c).这些结果表明,茉莉酸诱导的PpNAC3启动子由NbbHLH2蛋白介导。的PpNAC3本研究中使用的启动子片段似乎包含了大多数合适的元素PpNAC3表达式,此外,这些元素也在n benthamiana尽管这些物种在系统发育和进化上存在差异。
值得注意的是,虽然PpNAC3是一个在松树幼苗中低表达的基因,它的表达在响应MeJA和多种胁迫时迅速而强烈地增加。这就增加了使用PpNAC3作为一种潜在的meja诱导的异源启动子,可作为生物技术工具来驱动针叶树和其他植物物种的基因表达。
方法
植物材料和生长条件
松果体松树河中的小岛。种子由Centro de Recursos Genéticos Forestales“El Serranillo”(西班牙马里诺中部农村环境省)提供。种子在蒸馏水中浸泡24 h,持续通气,以蛭石为基质,在23±1℃光照16 h /黑暗8 h的生长条件下发芽生长。将松树幼苗的子叶、下胚轴和根系样本分别采集,放入液氮冷冻,−80°C保存直至使用。
烟草benthamiana L。种子播种后在花盆中生长,在24°C光照16小时/暗光8小时的环境下保存6周。
强调治疗
用4周龄的幼苗进行胁迫处理。机械损伤是用镊子刺穿下胚轴,切掉三分之一的子叶。在地上部分喷洒ABA (50 μM)和MeJA (100 μM)溶液;对照组只用水喷洒[93,94].处理0 h、2 h、8 h和24 h后采集子叶、下胚轴和根进行分析。在NaCl胁迫下,幼苗在蛭石中生长,用含250 mM NaCl的水溶液灌溉;对照组用水灌溉。低温(8°C)处理是在24°C的室内生长的幼苗在8°C转移48 h,而对照植株在24°C保存。nacl处理和冷处理的植株分别在处理后0 h、24 h和48 h收集分析。每个处理收集3个生物重复。从生物重复中单独收集组织样本,冷冻在液氮中,并保存在- 80°C,直到分析。
PpNAC2和PpNAC3的克隆
全身的PpNAC2而且PpNAC3采用逆转录- pcr (RT-PCR)技术从松树幼苗下胚轴rna中克隆出cdnap .松树序列(SustainpineDB)。用CTAB法分离松木基因组DNA [95],并使用GenomeWalker™通用试剂盒(Clontech Laboratories, Mountain View, CA, USA)扩增两个基因的启动子序列。利用优势基因组聚合酶(Advantage Genomic Polymerase mix, Clontech Laboratories, Mountain View, CA, USA)从PpNAC2启动子中分离出661 bp和1115 bp的PpNAC3启动子区域。所有引物都列在附加文件中5S1:表。将cDNA和基因组序列插入pGEM-3Zf(+)克隆载体,利用CEQ 8000遗传分析系统(Beckman Coulter, Madrid, Spain)对两条链进行测序。
PpNAC3启动子分析质粒的构建
对pBI121载体进行修饰,将GUS报告基因替换为具有功能的GFP基因,使GFP基因置于CaMV 35S启动子(p35S-GFP)控制下。将PpNAC3基因ATG(+1)上游1165 bp的基因组片段克隆到pGEM-3Zf(+)中。利用特异的侧翼引物进行PCR扩增4:表S1)。经消化后,将产物插入二元载体p35S-GFP中GFP基因上游,取代35S启动子(PNAC3gfp)。将重组质粒导入根癌土壤杆菌将C58C1和隔夜细胞培养物离心,在含10 mM MES-KOH (pH5.6)和0.15 mM乙酰丁香酮的浸润介质中重悬。在浸润4-5周龄叶片前,将600 nm处的光密度调至0.5n benthamiana植物。以p35S-GPF质粒为阳性对照,以不含35S启动子的质粒(P0-GFP)或MES为阴性对照。浸渗后48 h,n benthamiana叶片分别用100 μM MeJA溶液处理和水作为对照。每个时间点用3株独立植株的3个叶盘(10 mm)。实验至少重复三次。
病毒诱导基因沉默(VIGS)实验
利用病毒诱导基因沉默(VIGS)系统瞬时沉默转录因子MYC2。我们扩增了一个400 bp的片段n benthamianabHLH2 (ADH04263.1)基因使用特定网关适配器引物(附加文件4:表S1)重组到pDONR207 (Invitrogen)中,并克隆到VIGS网关适应目标载体pTRVGW。使用CEQ 8000 (Beckman Coulter,西班牙)进行测序验证构建。随后,我们改造了农分别用空质粒(ptrv -对照)和带插入物的质粒(pTRV-NbbHLH2)分离菌株C58C1, 28°C孵育2天。沉默的n benthamiana叶子的表现被描述为[66].用含pTRV对照或pTRV-的培养物浸润15日龄幼苗NbbHLH2与辅助质粒pTRV-1 1:1混合制备,两者的光密度均为600 nm为0.1。在24°C的生长室中,光照16小时,黑暗8小时。我们利用渗透pTRV-的对照植物监测沉默的传播PDS构建诱导叶片漂白的基因,而相应基因的沉默效率通过使用特异引物的qPCR测量转录丰度来确定(附加文件4:表S1)。沉默四周后,n benthamiana植物叶片浸磷肥NAC3-GFP、P35S-GFP和P0-GFP结构;48 h后,分别用100 μM MeJA溶液处理和水作为对照。每个时间点采用3株独立植株的3个叶盘(10 mm)。实验重复了三次,给出了一个有代表性的实验结果。
RNA分离和qPCR
按照前面描述的方法提取总RNA [96].用RQ1 RNase-Free DNase (Promega)处理RNA样本,用iScript逆转录Supermix (Bio-Rad)在寡聚物(dT)或随机引物的存在下进行cDNA合成。采用CFX384 Real- Time System C1000 Thermal cycle (Bio-Rad),反应体积为10 μl,含cDNA (10 ng)和5 μl SsoFast EvaGreen Supermix (Bio-Rad), 60°C退火10 s, 72°C延伸15 s。反应进行40个循环,最后一个循环结束后,绘制熔化曲线以验证反应的特异性。松木中以肌动蛋白(Actin)、延伸因子-1 -α (EF1-α)和40S核糖体蛋白为内参基因,松木中以肌动蛋白(Actin)为内参基因n benthamiana样本。使用iQ5循环器(Bio-Rad)连续监测PCR产物的荧光,并按前所述估算相对基因表达[94].使用的基因特异性引物在附加文件中描述4S1:表。
生物信息学
数据库检索和系统发育分析
利用Clustal X 1.83版本程序对该蛋白全长序列进行了多序列比对,包括高度保守的n端NAC结构域和较发散的c端结构域。利用MEGA 4.0软件,采用Neighbor-Joining (NJ)方法构建无根系统发育树,并进行1000次迭代的bootstrap检验。采用两两间隙删除模式,以确保更发散的c端结构域有助于NJ树的拓扑结构。
主题识别
利用MEME (Multiple Expectation Maximization for Motif Elicitation) 4.9.1版程序(http://meme.nbcr.net/meme/cgi-bin/meme.cgi, [45]),具有以下参数:重复次数,any;最多50个图案;和最佳宽度的motif之间的6和50残基。每个蛋白质的motif profile示意性地提出。
的识别独联体监管元素
为在网上PpNAC2和PpNAC3启动子序列的研究,并确定独联体利用植物数据库PlantCARE (http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)及地方(http://www.dna.affrc.go.jp/PLACE/)进行。
结论
综上所述,我们对海松NAC转录因子家族的组成进行了研究,并将37个NAC基因分为6个亚家族。最大的一组包括12个与压力相关的基因。我们对这一群体的两个基因的表达谱进行了表征:PpNAC2而且PpNAC3,以应对各种类型的压力。茉莉酸甲酯、机械损伤和高盐度均能强烈诱导这两种基因的表达。此外,这项研究在网上这两种启动子都发现了顺式元件如e -box的存在,它们通常存在于对茉莉酸反应的启动子中,是bHLH蛋白的结合位点。使用瞬时表达分析法n benthamiana我们发现叶子的启动子PpNAC3但在NbbHLH2被沉默的植物中,这种反应消失了。我们的研究结果表明PpNAC2而且PpNAC3编码胁迫应答的NAC转录因子,参与海松的茉莉酸反应。此外,我们的结果支持了NbbHLH2蛋白可以介导茉莉酸诱导PpNAC3启动子提示茉莉酸信号通路在被子植物和裸子植物之间可能是保守的。这些发现增加了使用的可能性PpNAC3作为生物技术工具驱动meja诱导表达在针叶树和其他植物。
参考文献
法戎A.世界针叶树的手册。莱顿:布里尔学术出版社;2010.
李志强,李志强。针叶树对昆虫和病原体的防御机制中萜类化合物多样性的基因、酶和化学成分。新植醇。2006;170:657 - 75。
刘志强,刘志强,刘志强,等。通过肌醇磷酸增强COI1-JAZ共受体感知茉莉酸。大自然。2010;468:400-5。
张志强,张志强,张志强,张志强,等。针叶树防御昆虫:锡特卡云杉的微阵列基因表达谱(云杉sitchensis)由机械损伤或云杉budworms取食(Choristoneura occidentalis)或白松象鼻虫(Pissodes strobi)揭示了宿主转录组的大规模变化。植物细胞环境。2006;29:1545-70。
Heidel AJ, Baldwin IT。烟草对多种食性昆虫攻击反应中水杨酸和茉莉酸信号的微阵列分析。植物细胞环境。2004;27:1362-73。
Koo AJK, Gao X, Jones AD, Howe GA。一个快速的伤口信号激活了体内生物活性茉莉酸盐的系统合成拟南芥.植物j . 2009; 59:974 - 86。
张志强,张志强,张志强,等。干旱胁迫对水稻幼苗生物量分配和碳同位素特征的影响松果体松树人群。植物基因组学。2010;6:169-78。
J, Dean J, Plomion C, Peterson DG, Cánovas FM, Pavy N,等。对针叶树巨型基因组进行解码。植物学报,2012;20(3):393 - 393。
林树基因组学:生长资源与应用。Nat Rev Genet. 2011; 12:111-22。
张志强,张志强,张志强,等。海洋松木转录组从头组装:森林育种和生物技术的意义。生物技术学报;2014;12:286-99。
李志强,李志强,李志强,等。一种用于针叶树基因组分析的白云杉目录。植物杂志。2011;157:14-28。
张志刚,张志勇,张志勇,等。利用全长cDNA芯片监测干旱、寒冷和高盐度胁迫下7000个拟南芥基因的表达谱。植物j . 2002; 31:279 - 92。
毛旭,贾丹,李安,张浩,田松,张旭,等。TaMYB2A的转基因表达增强了水稻对多种非生物胁迫的耐受性拟南芥.funt integra Genomics. 2011; 11:445-65。
毛欣,张慧,钱欣,李安,赵刚,景荣。小麦naci型转录因子TaNAC2增强多重非生物胁迫抗性拟南芥.中国生物医学工程学报。2012;63:2933-46。
Mukhopadhyay A, Vij S, Tyagi AK。水稻锌指蛋白基因的过表达使转基因烟草对低温、脱水和盐胁迫具有耐受性。中国科学(d辑)2004;
沈浩,刘超,张勇,孟X,周欣,褚超,等。OsWRKY30被MAP激酶激活,赋予水稻抗旱性。植物化学。2012;80:241 - 241。
杨晓燕,杨晓燕,王晓燕,等。干旱和低温胁迫下基因表达调控网络的研究进展。植物学报。2003;6:410-7。
植物盐和干旱胁迫信号转导。《植物学报》2002;33(3):357 - 363。
Olsen AN, Ernst HA, Leggio LL, Skriver K. NAC转录因子:结构不同,功能多样。植物学报。2005;21(3):393 - 393。
王志强,徐志刚,陈志勇,陈志勇,陈志勇,等。水稻和拟南芥NAC家族基因的综合分析。DNA研究》2003;10:239-47。
Souer E, van Houwelingen A, Kloos D, Mol J, Koes R.矮Petunia无顶端分生组织基因在胚胎和花的模式形成中是必需的,并在分生组织和原始边界表达。细胞。1996;85:159 - 70。
李志强,李志强,李志强,等。拟南芥胚发生过程中茎尖分生组织与子叶形成的相互作用:杯状子叶与Shoot分生组织less基因的相互作用。发展。1999;126:1563 - 70。
云杉杯形子叶同源体PaNAC01的表达受生长素极性运输的调控,与茎尖分生组织的分化和分离子叶的形成有关。记录机器人。2012;110:923-34。
无顶端分生组织(NO APICAL MERISTEM)的同源性是雌蕊同源异型基因APETALA3的直接靶点。细胞。1998;92:93 - 103。
谢倩,郭海华,郭海峰,郭海峰,方松,魏士曼,蔡乃辉。SINAT5促进泛素相关的NAC1降解,从而减弱生长素信号。大自然。2002;419:167 - 70。
李森,徐培杰,李慧杰,朴景明。NAC转录因子NTL4在干旱诱导叶片衰老过程中促进活性氧的产生拟南芥.植物j . 2012; 70:831-44。
大麦NAC转录因子基因家族成员在旗叶衰老过程中与衰老相关基因表现出差异共调控。J Exp Bot. 2014; 65:4009-22。
金妍儿,金SG, Park JE, Park HY, Lim MH,蔡NH,等。拟南芥细胞膜结合的NAC转录因子调节细胞分裂。植物细胞。2006;18:3132-44。
徐军,徐志刚,徐志刚,等。拟南芥根干细胞中NAC结构域转录因子FEZ和SOMBRERO控制着细胞分裂平面的方向。Dev细胞。2008;15:913-22。
张志强,张志强,张志强,张志强,等。脱水诱导的NAC蛋白RD26参与了一种新型aba依赖的应激信号通路。植物j . 2004; 39:863 - 76。
王志强,王志强,王志强,等。NAC (nam - ataf1,2 - cuc2)转录调控减弱ABA信号通路,从而有效地进行基础防御Blumeria茎f . sp。hordei在拟南芥.植物j . 2008; 56:867 - 80。
黄晓燕,刘志强,张志强,等。小麦衰老调控基因NAC对小麦籽粒蛋白质、锌和铁含量的影响。科学。2006;314:1298 - 301。
高志辉,杨胜,朴阿,欧勒鲁塞,韩克华。ANAC012是植物特异性NAC转录因子家族的成员之一,负向调控木质素纤维的发育拟南芥.植物j . 2007; 50:1035-48。
钟锐,叶志。木质素生物合成的转录调控。植物信号行为。2009;4:1028 - 1034。
钟荣,李昌,叶志华。调控次生细胞壁生物合成的转录网络的进化保守性。植物学报。2010;24(3):329 - 331。
张志强,张志勇,张志勇,等。NAC转录因子在植物非生物胁迫应答中的作用。中国生物物理学报,2000,20(3):393 - 397。
黄晓明,李志强,李志强,等。NAC蛋白在植物抗逆性中的调控作用。植物学报(自然科学版),2012;
陈立峰,李志强,陈立峰,陈立峰,等。拟南芥干旱胁迫诱导NAC转录因子的分离及功能分析独联体-元素在脱水应激早期反应1启动子。植物细胞。2004;16:2481 - 98。
林德姆斯,林德姆斯,德马西,雷默。ATAF1转录因子直接调控脱落酸生物合成基因NCED3拟南芥.FEBS Open Bio. 2013; 3:321-7。
Delessert C, Kazan K, Wilson IW, Van Der Straeten D, Manners J, Dennis ES,等。转录因子ATAF2可抑制细胞中致病相关基因的表达拟南芥.植物j . 2005; 43:745-57。
卢佩麟,陈新洲,安荣,苏智,齐伯森,任芳,等。一个新的干旱诱导基因ATAF1编码了一个NAC家族蛋白,该蛋白负向调控干旱胁迫应答基因的表达拟南芥.植物化学学报。2007;33(3):349 - 356。
胡洪,邓明秋,姚杰,肖波,李旭,张强,等。过表达一个NAM、ATAF和CUC (NAC)转录因子可以增强水稻的抗旱性和耐盐性。美国国家科学院。2006; 103:12987 - 92。
郑js, Kim YS, Redillas MC, Jang G, Jung H, Bang SW,等。OsNAC5过表达使水稻植株的根径增大,增强了水稻的耐旱性,提高了田间产量。植物学报2013;11:101-14。
李志强,李志强,李志强,等,Giguère I, Morency M-J,等。大规模筛选转录因子-启动子相互作用在云杉揭示了一个转录网络参与血管发育。中国地质大学学报(自然科学版)2014;
Bailey TL, Williams N, Misleh C, Li WW。MEME:发现和分析DNA和蛋白质的序列基序。中国生物医学工程学报。2006;34(4):349 - 356。
沈浩,尹勇,陈芳,徐勇,Dixon RA。植物细胞壁发育与木质纤维素生物能量生产相关的NAC基因的生物信息学分析。Bioenerg杂志2009;2:217-32。
金SG,金SY,朴CM。一个膜相关的NAC转录因子通过开花位点T调控盐敏感的开花拟南芥.足底。2007;226:647-54。
久保M,田川M,西久保N,堀口G,山口M,伊藤J,等。原生木质部和心木质部导管形成的转录开关。基因Dev。2005;19:1855-60。
M. Shinozaki K . ohme -高木M.拟南芥调节次生壁增厚,为花药开裂所必需。植物细胞。2005;17:2993 - 3006。
钟锐,德村泰,叶智。SND1是NAC结构域转录因子,是纤维二次壁合成的关键调控因子拟南芥.植物细胞。2006;18:3158 - 70。
李志强,李志强,李志强,等。拟南芥杯状子叶突变体基因的克隆与分析。植物细胞。1997;9:841-57。
杨志强,李志强,李志强,等。拟南芥cucytyledon1基因调控茎尖分生组织的形成。发展。2001;128:1127-35。
Vroemen CW、Mordhorst AP、Albrecht C、Kwaaitaal MA、de Vries SC. CUP-SHAPED COTYLEDON3基因在植物边界分生组织和茎分生组织的形成中是必需的拟南芥.植物细胞。2003;15:1563 - 77。
金志辉,禹仁,金杰,林宝,李ic,崔善,等。miR164参与年龄依赖性细胞死亡的三叉前馈调控拟南芥.科学。2009;323:1053-7。
Hussey SG, Mizrachi E, Spokevicius AV, Bossinger G, Berger DK, Myburg AA。SND2是一个NAC转录因子基因,调节拟南芥纤维次生细胞壁发育的相关基因,增加纤维细胞面积桉树.植物学报。2011;11:393。
K Higo K, Ugawa Y, Iwamoto M, Korenaga T. Plant独联体-acting regulatory DNA elements (PLACE)数据库。中国生物医学工程学报1999;27:297-300。
金金荣,崔金龙,李志强,刘志强,等。G-box序列对马铃薯蛋白酶抑制剂II启动子茉莉酸甲酯反应的影响。植物杂志。1992;99:627-31。
Boter M, ruizi - rivero O, Abdeen A, Prat S.保守的MYC转录因子在茉莉酸信号转导中起着关键作用拟南芥.基因Dev。2004;18:1577 - 91。
张志强,薛光平,张志强,张志强,等。MYC2差异调节不同的茉莉酸依赖功能拟南芥.植物细胞。2007;19:2225-45。
张志强,张志强,张志强,等。基因ORCA3启动子中茉莉酸盐响应元件的研究Catharanthus roseus也叫在拟南芥中活跃,受转录因子AtMYC2控制。植物生理学报。2011;52:578 - 579。
王睿,关萍,陈梅,邢鑫,张勇,郭德华。拟南芥NIA 1启动子中的多个调控元件协同作用形成硝酸盐增强子。植物杂志。2010;154:423-32。
刘伟,马扎雷M,鲁迪斯MR,费特MH,小斯图尔特CN。植物病原植物感应合成启动子的体内快速分析。BMC生物技术。2011;11:108。
卡雷特罗-保莱特L,加尔斯蒂安A,罗伊-维拉诺瓦I,马丁内斯-加西亚JF,毕尔巴鄂-卡斯特罗JR,罗伯逊DL。bHLH家族转录因子的全基因组分类和进化分析拟南芥,杨树,水稻,苔藓和藻类。植物杂志。2010;153:1398 - 412。
Todd AT, Liu E, Polvi SL, Pammett RT, Page JE。功能基因组学筛选确定多种转录因子,调节生物碱生物合成烟草benthamiana.植物j . 2010; 62:589 - 600。
K, Tilleman S, paulwels L, Bossche RV, De Sutter V, Vanderhaeghen R,等。APETALA2/乙烯响应因子与碱性螺旋-环-螺旋烟草转录因子协同介导茉莉酸酯诱导的烟碱合成。植物j . 2011; 66:1053 - 65。
刘志强,刘志强,刘志强,等。病毒诱导的番茄基因沉默研究。植物j . 2002; 31:777 - 86。
张志强,张志强,张志强,等。森林树木对非生物胁迫的分子和生理响应及其与树木改良的关系。树杂志。2014;34:1181 - 98。
张志强,张志强,张志强等。小立碗藓基因组揭示了植物征服土地的进化洞见。科学。2008;319:64-9。
张浩,陈晓东,陈晓东,韩松,等。烟草转录因子:茄科转录调控的新发现。植物杂志。2008;147:280 - 95。
胡锐,齐刚,孔勇,孔丹,高强,周刚。毛杨NAC结构域转录因子基因家族的综合分析。植物医学杂志。2010;10:145。
刘志强,刘志强,刘志强,刘志强,等。水稻NAC转录因子家族全基因组分析。基因。2010;465:30-44。
张志刚,张志刚,张志刚,张志刚。单子叶和多子叶植物NAC转录因子家族的全基因组研究,《遗传学导论- DNA甲基化、组蛋白修饰与基因调控》(香港:中国生物医学工程出版社),2012a;ISBN 978-14775549-4-4。
Le DT, Nishiyama R, Watanabe Y, Mochida K, Yamaguchi-Shinozaki K, Shinozaki K,等。大豆植物特异NAC转录因子家族在发育和脱水胁迫中的全基因组调查与表达分析。DNA研究》2011;18:263 - 76。
胡西SG, Saïdi MN, Hefer CA, Myburg AA, Grima-Pettenati J.水稻NAC结构域蛋白家族的结构、进化和功能分析桉树.新植醇。2014;206:1337-50。
Rueda-López M, García-Gutiérrez A, Cánovas FM, Ávila C.松木Dof转录因子家族。树木。2013;27:1547-57。
李志强,李志强,李志强,等。水稻全基因组比较系统发育分析拟南芥景深基因家族。BMC Evol bioon 2003;3:17。
Pérez-Rodríguez P, Riaño-Pachón DM, Guedes Corrêa LG, Rensing SA, Kersten B, Mueller-Roeber B. PlnTFDB:植物转录因子数据库的更新内容和新功能。核酸研究。2010;38:D822-7。
Oliveira TM, Cidade LC, Gesteira AS, Coelho Filho MA, Soares Filho WS, Costa MGC。对柑橘NAC转录因子基因家族的分析揭示了一个参与多种非生物胁迫响应的新成员。Tree Genetics Genom. 2011; 7:1123-34。
Taoka K, Yanagimoto Y, Daimon Y, Hibara K, Aida M, Tasaka M. NAC结构域介导CUP-SHAPED子叶蛋白功能特异性。植物j . 2004; 40:462 - 73。
张志强,张志强,张志强,张志强,等。的拟南芥NAC转录因子家族:ANAC019应激信号转导的结构-功能关系及决定因素j . 2010; 426:183 - 96。
张志平,Baldwin IT。[2-14C]茉莉酸从叶片到根的运输模拟了创伤诱导的内源性茉莉酸池的变化烟草的抗旱性.足底。1997;203:436-41。
索普先生,Ferrieri AP, Herth MM, Ferrieri RA。11c成像:茉莉酸甲酯在韧皮部和木质部移动,促进茉莉酸的运输,即使质子运输解耦合后也能促进光同化。足底。2007;226:541-51。
Stprx2和StNAC基因的差异诱导对马铃薯感染的反应5种和伤害。植物化学。2001;46:521 - 529。
张志强,张志勇,张志勇,等。OsNAC6是NAC基因家族的一个成员,在水稻中受各种胁迫诱导。中国生物医学杂志2005;80:135-9。
王晓燕,王晓燕,王晓燕,等。NAC转录因子在植物生物和非生物胁迫中的调控作用。Microbiol前面。2013;4:248。
Kim SY, Chung HJ, Thomas TL.利用改良的酵母单杂交系统分离一类与Dc3启动子aba响应和胚胎规范元件相互作用的新型bZIP转录因子。植物j . 1997; 11:1237-51。
一个新的基本亮氨酸拉链蛋白家族结合到胡萝卜的种子规格元素Dc3基因启动子。植物生理学报1998;32(3):329 - 331。
安倍H,浦老T,伊藤T,关木M,筱崎K,山口-筱崎K。拟南芥AtMYC2(bHLH)和AtMYB2MYB在脱落酸信号转导中发挥转录激活因子的作用。植物细胞。2003;15:63 - 78。
欧阳琴,鲁什顿,罗巴泽克,索姆西奇。植物转录因子WRKY超家族。植物科学进展。2000;
Brown RL, Kazan K, McGrath KC, Maclean DJ, Manners JM。GCC-box在茉莉酸酯介导的大豆PDF1.2基因激活中的作用拟南芥.植物杂志。2003;132:1020-32。
刘志强,刘志强,刘志强,刘志强,等。松木质部R2R3-MYB基因PtMYB1的特征分析。植物化学。2003;53:597-608。
Newman LJ, Perazza DE, Juda L, Campbell MM. R2R3-MYB, AtMYB61参与det3突变表型的异位木质化和暗光形态形成组分。植物j . 2004; 37:239-50。
Levée V, Major I, Levasseur C, Tremblay L, MacKay J, Seguin a .杨树WRKY23的表达分析和功能分析揭示了其在防御中的调节作用。新植醇。2009;184:48 - 70。
李志强,李志强,李志强,李志强,等。针叶树第4亚组r2r3 - myb:基因家族扩展和对类异戊二烯和类黄酮定向反应的贡献J Exp Bot. 2010; 14:3847-64。
多伊尔·JJ,多伊尔·jr。一种用于少量新鲜叶片组织的快速DNA分离方法。Phytochem公牛。1987;19:11 - 1596。
Canales J, Rueda-López M, Craven-Bartle B, Avila C, Cánovas FM。针叶树天冬酰胺合成酶调控的新见解。植物学报,2012;3:100。
致谢
我们感谢Fernando de la Torre博士(university versidad de Málaga)提供的TRVGW沉默载体,以及关于瞬时表达分析的技术建议n benthamiana叶子。这项工作由西班牙竞争部Economía y Competitividad (BIO2012-33797)、军政府德Andalucía (BIO2012-0474)和欧盟委员会第七次框架赠款PROCOGEN (FP7-KBBE 2011-5)资助。MBP由Juan de la Cierva博士后合同(Ministerio de Ciencia e Innovación, Spain)支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
我们确认,没有任何作者有任何竞争利益。
作者的贡献
MBP和CA设计实验。MBP做了实验工作。MBP, CA, FMC分析数据,撰写稿件。所有作者阅读并批准最终稿。
附加文件
额外的文件1:
基因的名称,基因加入号和序列p .松树南汽的蛋白质。(XLS 37 kb)
额外的文件2:
利用模因技术鉴定出PpNAC蛋白中21个氨基酸序列标志。显示的数据是包含每个motif的蛋白数量、宽度、e值、它所在的区域以及每个motif的注释。(XLS 379 kb)
附加文件3:图S1。
PpNAC蛋白序列比对p .松树.NAC蛋白中的氨基酸基序(A-E)用彩色方框表示。排列上方显示了NAC结构域的二级结构元素(β、α、螺旋)。(TIFF 544 kb)
附加文件4:表S2。
用于系统发育分析的基因登录号、名称和参考文献。根据Shen et al. (2009) [46]以及本研究中产生的群体。(医生95 kb)
附加文件5:表S1。
本工作中使用的寡核苷酸。(医生50 kb)
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许不受限制地在任何媒体上使用、分发和复制,前提是您要适当地注明原作者和来源,提供创作共用许可的链接,并说明是否进行了更改。知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Pascual, m.b., Cánovas, F.M. & Ávila, C.海松NAC转录因子家族(松果体松树):参与应激反应的两个基因的分子调控。BMC植物杂志15日,254(2015)。https://doi.org/10.1186/s12870-015-0640-0
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-015-0640-0
关键字
- 松果体松树
- 南汽基因家族
- 压力
- 甲基jasmonate
- 启动子