- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
有一种氨基酸起了作用:氨基酸的形成gydF4y2BaentgydF4y2Ba-kaurene和16α-羟基-gydF4y2Baent -gydF4y2Ba杨树中二萜合酶对贝壳烷的研究gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba15gydF4y2Ba,文章号:gydF4y2Ba262gydF4y2Ba(gydF4y2Ba2015gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
与拉丹相关的二萜是二萜中最大的一类。它们作为必需的植物生长激素在初级代谢中发挥重要作用,并在次级代谢中发挥作用,例如植物抗毒素。lab丹相关二萜的生物合成是由II类和I类二萜合酶的作用介导的。尽管杨树中萜烯合成酶的研究已经很深入,但对这种多年生木本植物中二萜的形成还知之甚少。gydF4y2Ba
结果gydF4y2Ba
最近测序的基因组gydF4y2Ba杨树trichocarpagydF4y2Ba拥有两个推测的copalydiphosphate合成酶基因(gydF4y2BaCPSgydF4y2Ba(II类)和两个推测的kaurene合成酶基因(gydF4y2BaKSgydF4y2Ba, I类),最有可能分别通过基因组复制和最近的串联基因复制产生。我们展示了gydF4y2BaCPSgydF4y2Ba例如基因gydF4y2BaPtTPS17gydF4y2Ba编码一个gydF4y2BaentgydF4y2Ba-钴二磷酸合成酶(gydF4y2BaentgydF4y2Ba-CPS),而蛋白质编码的假定gydF4y2BaCPSgydF4y2Ba基因gydF4y2BaPtTPS18gydF4y2Ba没有酶活性。假定的kaurene合成酶PtTPS19和PtTPS20均被认可gydF4y2BaentgydF4y2Ba-二磷酸钴酯(gydF4y2BaentgydF4y2Ba-CPP)作为基板。然而,尽管它们的序列相似性很高,但它们产生的二萜产物却不同。而PtTPS19只形成gydF4y2BaentgydF4y2Ba-kaurene, PtTPS20主要生成二萜醇,16α-羟基-gydF4y2Baent -gydF4y2Bakaurane。通过基于同源性的结构建模和位点定向突变,我们证明了一个氨基酸残基决定了PtTPS19和PtTPS20不同的产物特异性。PtTPS19和PtTPS20活性位点上的蛋氨酸607和苏氨酸607的相互交换导致酶产物谱的完全相互转换。基因表达分析显示,二萜合酶基因表现为器官特异性表达,丰度最高gydF4y2BaPtTPS17gydF4y2Ba而且gydF4y2BaPtTPS20gydF4y2Ba杨树根部的转录本。gydF4y2Ba
结论gydF4y2Ba
杨树二萜合酶PtTPS17、PtTPS19和PtTPS20有助于产生gydF4y2BaentgydF4y2Ba-kaurene和16α-羟基-gydF4y2Baent -gydF4y2BaKaurane在杨树。而gydF4y2BaentgydF4y2Ba-kaurene很可能是赤霉素的通用前体,其功能为16α-羟基-gydF4y2Baent -gydF4y2Ba白杨树的考拉内还不知道。然而,高表达水平gydF4y2BaPtTPS20gydF4y2Ba而且gydF4y2BaPtTPS17gydF4y2Ba16α-羟基-在杨树根系中可能具有重要的功能gydF4y2Baent -gydF4y2Ba这种植物器官的次生代谢中的贝壳烷。gydF4y2Ba
背景gydF4y2Ba
萜类化合物存在于几乎所有的生命形式中,发挥着广泛的重要功能。目前已描述的萜类化合物有6万多种不同的结构,是天然产物中规模最大、结构最多样化的一类[gydF4y2Ba1gydF4y2Ba].这种生物多样性仅来自少数二磷酸戊烯基前体。萜类合成酶(Terpene synthases, TPSs)作为萜类代谢的关键酶,接受这些前体作为底物,并将其转化为单萜(CgydF4y2Ba10gydF4y2Ba),倍半萜烯(CgydF4y2Ba15gydF4y2Ba),或二萜(CgydF4y2Ba20.gydF4y2Ba)产品,通常是烯烃和醇。由于其高挥发性,许多单萜和倍半萜是营养或花香的主要成分,因此在植物与昆虫的相互作用或植物内部和植物间的交流中发挥重要作用[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba].二萜类化合物通常挥发性较低,但也经常在植物与其他生物的相互作用中发挥作用。例如,它们是不同针叶树种类的树脂中的主要成分,可以抵御射虫[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba].大米(gydF4y2Ba栽培稻gydF4y2Ba)含有大量具有抗真菌活性的二萜类植物抗菌素[gydF4y2Ba6gydF4y2Ba]在玉米中,二萜类油菜素被证明参与抗食草动物和抗真菌防御[gydF4y2Ba7gydF4y2Ba].除了在植物防御中的重要功能外,一些二萜类化合物对植物也是必不可少的。gydF4y2BaEntgydF4y2Ba例如,-kaurene是赤霉素的前体,赤霉素代表了参与各种生理过程的一组重要的植物激素(最近在[gydF4y2Ba8gydF4y2Ba])。gydF4y2Ba
香叶酰二磷酸(GGPP)是所有植物二萜的通用前体。二萜合酶和P450酶的不同组合可产生迄今为止已知的约12,000种多样性的二萜化合物,其中最大的一组是与lab丹相关的化合物[gydF4y2Ba9gydF4y2Ba].lab丹相关二萜的形成是由II类和I类二萜合酶的作用介导的[gydF4y2Ba10gydF4y2Ba].II类二萜合成酶以GGPP为底物,催化形成双环二磷酸戊烯酯。它们的特征是高度保守的DxDD基序,该基序介导底物的初始质子化[gydF4y2Ba11gydF4y2Ba].双环二磷酸戊烯酯可被I类二萜合酶进一步转化,这些合酶具有DDxxD特征和NSE/DTE基序。一类酶催化底物的金属离子依赖性电离,形成碳正离子,碳正离子可进一步进行环化和重排反应[gydF4y2Ba12gydF4y2Ba].一类酶的碳正离子反应机制导致二萜结构变化较大[gydF4y2Ba13gydF4y2Ba].gydF4y2Ba
赤霉素的生物合成已经得到了很好的研究。它们的形成始于GGPP转化为gydF4y2BaentgydF4y2Ba-二磷酸copalyl (CPP)由II类酶催化,gydF4y2BaentgydF4y2Ba-CPP合成酶(CPS)。随后,一类酶,丁香烯合酶(KS),转化gydF4y2BaentgydF4y2Bacpp来gydF4y2BaentgydF4y2Ba通过复环化和环重排反应合成-kaurene(最近在[gydF4y2Ba8gydF4y2Ba,gydF4y2Ba9gydF4y2Ba])。而高等植物通常具有单一功能的CPS和KS酶[gydF4y2Ba13gydF4y2Ba],苔藓gydF4y2BaPhyscomitrella金属盘gydF4y2Ba具有双功能CPS/KS,包含两个活性位点,将GGPP直接转化为gydF4y2BaentgydF4y2Ba-kaurene [gydF4y2Ba14gydF4y2Ba].而拟南芥只有个体gydF4y2BaCPSgydF4y2Ba而且gydF4y2BaKSgydF4y2Ba与赤霉素生物合成有关的基因[gydF4y2Ba15gydF4y2Ba- - - - - -gydF4y2Ba17gydF4y2Ba),gydF4y2BaCPSgydF4y2Ba而且gydF4y2BaKSgydF4y2Ba基因家族在其他植物物种中也得到了扩展。以大米为例,含有4个gydF4y2BaCPSgydF4y2Ba/gydF4y2BaCPSgydF4y2Ba像基因和十一个gydF4y2BaKSgydF4y2Ba/gydF4y2BaKSgydF4y2Ba类基因参与了大量不同的lab丹型二萜的产生[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba19gydF4y2Ba].这里,I类萜烯合酶没有介导作用gydF4y2BaentgydF4y2Ba-kaurene生成,但生成其他与lab丹相关的二萜,称为kaurene合成酶样酶(KSL) [gydF4y2Ba19gydF4y2Ba].gydF4y2Ba
的gydF4y2BaTPSgydF4y2Ba基因家族gydF4y2Ba杨树trichocarpagydF4y2Ba最近被描述为[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba21gydF4y2Ba].然而,本研究的重点是单半萜合酶和倍半萜合酶,只描述了一种二萜合酶,香叶基芳樟醇合酶PtTPS10。除了gydF4y2BaPtTPS10gydF4y2Ba,gydF4y2Bap . trichocarpagydF4y2Ba还包含两个假定gydF4y2BaCPSgydF4y2Ba还有两个假设gydF4y2BaKSgydF4y2Ba基因(gydF4y2Ba21gydF4y2Ba]被指定为gydF4y2BaPtTPS17gydF4y2Ba,gydF4y2BaPtTPS18gydF4y2Ba而且gydF4y2BaPtTPS19gydF4y2Ba,gydF4y2BaPtTPS20gydF4y2Ba,分别。在本研究中,我们研究了这些基因及其编码的CPS和KS酶。gydF4y2Ba
结果gydF4y2Ba
杨树具有两个推测的共聚物二萜合酶基因(gydF4y2BaCPSgydF4y2Ba)和两种假定的丁香烯合酶(如)- (gydF4y2BaKS(左)gydF4y2Ba)基因gydF4y2Ba
除了最近发现的香叶基香叶醇合成酶基因gydF4y2BaPtTPS10gydF4y2Ba,杨树基因组中含有4个额外的基因(Potri.002G05210、Potri.005G210300、Potri.008G082400和Potri.008G082700)编码推测的二萜合成酶[gydF4y2Ba21gydF4y2Ba].爆炸分析表明,Potri.002G052100与Potri.005G210300具有很高的相似性gydF4y2BaCPSgydF4y2BaPotri.008G082400和Potri.008G082700最相似gydF4y2BaKSgydF4y2Ba基因。从叶芽、叶、茎和根的cDNA池中扩增出Potri.002G05210、Potri.005G210300、Potri.008G082400和Potri.008G082700gydF4y2Ba杨树trichocarpagydF4y2Ba并对得到的开放阅读框进行了指定gydF4y2BaPtTPS17gydF4y2Ba,gydF4y2BaPtTPS18gydF4y2Ba,gydF4y2BaPtTPS19,gydF4y2Ba而且gydF4y2BaPtTPS20gydF4y2Ba,分别。gydF4y2Ba
PtTPS17gydF4y2Ba而且gydF4y2BaPtTPS18gydF4y2Ba根据现有的数据库(gydF4y2Bawww.phytozome.orggydF4y2Ba).具有较高的序列相似性和染色体位置gydF4y2BaPtTPS17gydF4y2Ba而且gydF4y2BaPtTPS18gydF4y2Ba通过杨树最近描述的基因组复制事件表明它们的起源[gydF4y2Ba22gydF4y2Ba].在系统进化树中,编码蛋白与来自其他植物的特征CPS蛋白聚集在一起,是TPS-的成员gydF4y2BacgydF4y2Ba家庭(图。gydF4y2Ba1gydF4y2Ba).II类TPS酶的特征序列基序和CPS活性的重要序列基序,如负责双键初始质子化的DxDD基序和协调Mg的edxxd样基序gydF4y2Ba2 +gydF4y2Ba/二磷酸[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba23gydF4y2Ba],可以在两种酶中识别(图;gydF4y2Ba2gydF4y2Ba).此外,两种蛋白质都含有保守的组氨酸残基,已被描述为介导对Mg的敏感性gydF4y2Ba2 +gydF4y2Ba[gydF4y2Ba24gydF4y2Ba].gydF4y2Ba
推测的kaurene合成酶-(类)酶(KS(L))和copalyl二磷酸合成酶(CPS)的系统发育树。推测KS(L)和CPS合成酶的系统发育关系gydF4y2Bap . trichocarpagydF4y2Ba到KS(L)和CPS从其他植物物种。用近邻连接法推导出树gydF4y2BangydF4y2Ba= 1000个重复用于引导。引导值显示在每个节点旁边。TPS -gydF4y2BacgydF4y2Ba和TPS -gydF4y2Bae,gydF4y2Ba代表已建立的租置计划亚族[gydF4y2Ba13gydF4y2Ba].PtTPS1用作外组。KS:gydF4y2BaentgydF4y2Ba-kaur-16-ene synthase, SMS: stemar-13-ene synthase, LPPS: 8-羟基copalyl diphosphate synthase, CPS: copalyl diphosphate synthase, Nt:gydF4y2Ba烟草,gydF4y2BaCm:gydF4y2BaCucurbita最大值,gydF4y2Ba:gydF4y2BaArabidosis芥,gydF4y2Ba操作系统:gydF4y2Ba栽培稻gydF4y2BaPg:gydF4y2Ba云杉glaucagydF4y2Ba,gydF4y2Ba产地:白杨,Sm:丹参,Pp:小立碗gydF4y2Ba
推测CPS和KS(L)的氨基酸序列比较gydF4y2Bap . trichocarpagydF4y2Ba与特征gydF4y2BaentgydF4y2BaCPS和KS来自gydF4y2Ba答:芥gydF4y2Ba。相同的氨基酸用黑色方框标记,具有相似侧链的氨基酸用灰色方框标记。保守的图案被标记,高度保守的DxDD和DxxDD图案被框成红色。星号表示对调节和产品特异性重要的氨基酸。预测的n端信号肽以粗体显示,箭头表示异源表达的截断位点。AtCPS (Q38802),gydF4y2BaentgydF4y2Ba-copalyl二磷酸合成酶;AtKS (Q9SAK2), kaurene合成酶gydF4y2Ba拟南芥gydF4y2Ba
的密切联系gydF4y2BaPtTPS19gydF4y2Ba而且gydF4y2BaPtTPS20gydF4y2Ba在8号染色体上,它们的高序列相似性为99.3%,表明这些基因是通过最近的串联基因复制事件进化而来的(附加文件gydF4y2Ba1gydF4y2Ba:图S1)。编码的蛋白质属于TPS-e家族(图。gydF4y2Ba1gydF4y2Ba),并包含对I类TPS酶活性重要的序列基序,如DDxxD基序和NSE/DTE基序,用于二磷酸丙烯基物的金属离子依赖性电离(图2)。gydF4y2Ba2gydF4y2Ba) [gydF4y2Ba13gydF4y2Ba].这些蛋白质很可能是单功能酶,因为它们中没有一个同时包含I类和II类TPS特征(图2)。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
使用不同的预测程序对信号肽进行预测,结果显示PtTPS17、PtTPS18、PtTPS19和PtTPS20含有n端转运肽(图2)。gydF4y2Ba2gydF4y2Ba,附加文件gydF4y2Ba1gydF4y2Ba:表S3)。尽管,关于酶的亚细胞靶向,不同的预测算法给出了不同的结果(附加文件gydF4y2Ba1gydF4y2Ba:表S3)。然而,酶的目标质体是最有可能的,因为二萜生物合成已知是在叶绿体。gydF4y2Ba
PtTPS17产生gydF4y2BaentgydF4y2Ba-CPP、PtTPS19和PtTPS20分别具有KS和KSL酶活性gydF4y2Ba
为了确定假定的杨树CPS和KS(L)蛋白的酶功能,据报道,缺少预测信号肽但仍含有n端SxYDTxW motif的截断版本在KS和CPS酶中是保守的[gydF4y2Ba25gydF4y2Ba在…中异质地表达gydF4y2Ba大肠杆菌gydF4y2Ba。此外,gydF4y2Baent-CPSgydF4y2Ba(AtCPSgydF4y2Ba,拟南芥)gydF4y2Ba,一个gydF4y2Basyn-CPSgydF4y2Ba(OsCPS4gydF4y2Ba栽培稻gydF4y2Ba,使gydF4y2BasyngydF4y2Ba-copalyl二磷酸gydF4y2Ba)gydF4y2Ba和一个gydF4y2Ban-CPSgydF4y2Ba(aga: D621A,gydF4y2Ba冷杉属茅,gydF4y2Ba为KS(L)酶提供潜在的底物。使用粗酶提取物或纯化蛋白进行分析,并含有单独的杨树蛋白PtTPS17-20或这些酶与上述不同CPS的组合。gydF4y2Ba
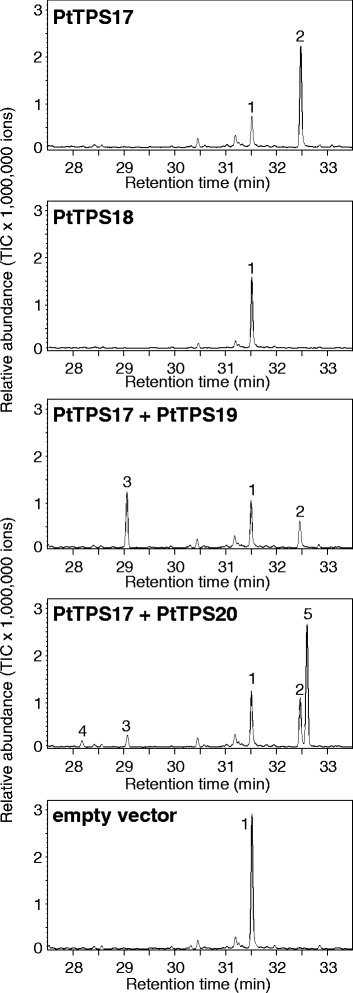
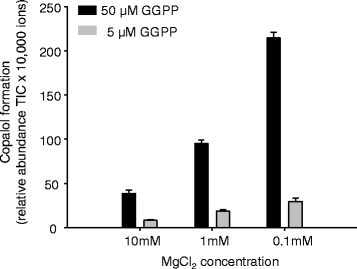
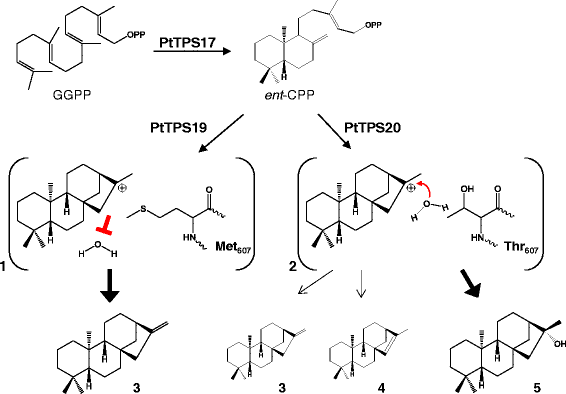
而假定的KS(L)酶PtTPS19和PtTPS20单独或与GGPP联合均未观察到活性gydF4y2BasyngydF4y2Bacps或gydF4y2BangydF4y2Ba-CPS,当这些酶被喂食GGPP时,二萜产物形成gydF4y2BaentgydF4y2Bacps。PtTPS19转换gydF4y2BaentgydF4y2Bacpp进gydF4y2Baent -gydF4y2Bakaurene和PtTPS20将该中间体转化为16α-羟基-gydF4y2BaentgydF4y2Ba-贝壳烷(86%)和少量的gydF4y2BaentgydF4y2Ba-kaurene(8%)和gydF4y2Baent -gydF4y2Ba异紫红烯(6%)gydF4y2Ba3.gydF4y2Ba、表gydF4y2Ba1gydF4y2Ba).当PtTPS17与GGPP孵育时,检测到copalol,这是CPP去磷酸化的结果。将形成的copalol的保留时间与真实标准的copalol的保留时间进行比较,发现PtTPS17可以产生任何一种gydF4y2BaentgydF4y2Bacpp或gydF4y2BangydF4y2Banormal - cpp(附加文件gydF4y2Ba1gydF4y2Ba:图S2)。然而,当PtTPS17与PtTPS19或PtTPS20偶联时,PtTPS17能够支持二萜产物的形成,这一事实证实了酶介导的二萜产物的形成gydF4y2BaentgydF4y2Bacpp。为PtTPS17提供不同浓度的MggydF4y2Ba2 +gydF4y2Ba影响酶活性,用gydF4y2BaentgydF4y2Ba-辅助因子浓度较低时,cpp形成率较高(图。gydF4y2Ba4gydF4y2Ba).尽管与PtTPS17的序列高度相似,但无论是单独使用GGPP还是与其他CPS或KS联合使用,都没有观察到PtTPS18的酶活性(图2)。gydF4y2Ba3.gydF4y2Ba).一些氨基酸突变可影响各种萜合酶的酶活性(例如:[gydF4y2Ba26gydF4y2Ba])。在所有实验中都能检测到香叶基芳樟醇的形成,反映了GGPP底物的非特异性去磷酸化。试图通过从杨树根和叶中提取粗蛋白来验证酶在体内的活性是不成功的。gydF4y2Ba
一个氨基酸决定了PtTPS19和PtTPS20的产物特异性gydF4y2Ba
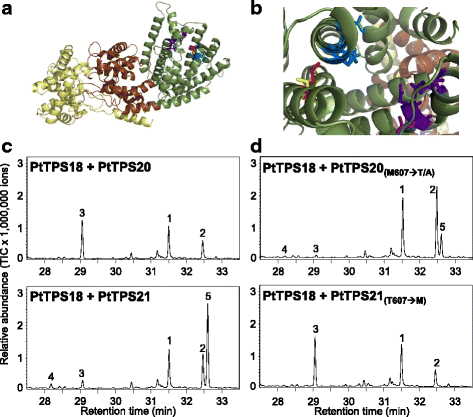
虽然PtTPS19和PtTPS20氨基酸序列高度相似(99.1%),但它们的酶产物谱差异显著。而PtTPS19只产生二萜烃gydF4y2Baent -gydF4y2Ba蒎烯、PtTPS20主要形成二萜醇16α-羟基-gydF4y2Baent -gydF4y2Bakaurane(无花果。gydF4y2Ba3.gydF4y2Ba).为了鉴定负责产物特异性的氨基酸,构建了基于同源性的PtTPS19和PtTPS20结构模型。这两个模型都显示了大多数植物DiTPS的三畴结构(β、γ和α畴)特征,催化位点在α畴中形成了一个深口袋(图2)。gydF4y2Ba5 a、bgydF4y2Ba;[gydF4y2Ba23gydF4y2Ba])。与PtTPS20相比,PtTPS19的活性位点只有一个氨基酸不同。gydF4y2Ba2gydF4y2Ba).在PtTPS19中,蛋氨酸残基位于607号位置,而在PtTPS20中,更小、极性更强的苏氨酸位于这个位置(图2)。gydF4y2Ba5 bgydF4y2Ba).将PtTPS20的苏氨酸607替换为蛋氨酸完全改变了PtTPS20的产品产量。而不是通过加入水分子来猝灭beyeran-16-基阳离子,从而产生16α-羟基-gydF4y2BaentgydF4y2Ba-kaurane,正如野生型PtTPS20所观察到的那样,突变酶催化了PtTPS20的去质子化gydF4y2BaentgydF4y2Ba-考拉尼阳离子导致gydF4y2Baent -gydF4y2Ba与PtTPS19形成相似的氧化石墨烯(图2)。gydF4y2Ba5 dgydF4y2Ba).反之亦然gydF4y2Ba,gydF4y2BaPtTPS19中蛋氨酸607与苏氨酸的交换导致突变体主要产生16α-羟基-gydF4y2Baent -gydF4y2BaKaurane和少量的gydF4y2BaentgydF4y2Ba-kaurene和gydF4y2BaentgydF4y2Ba与PtTPS20相似比例的-异紫铜烯(图2)。gydF4y2Ba5度gydF4y2Ba、表gydF4y2Ba1gydF4y2Ba).突变体PtTPS19 MgydF4y2Ba607gydF4y2BaA也主要生成16α-羟基-gydF4y2Baent -gydF4y2Bakaurane。然而,与野生型酶相比,将PtTPS20中各自的苏氨酸607交换为丙氨酸并没有改变产物特异性(表2)gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
PtTPS19和PtTPS20的底物特异性。gydF4y2Ba一个gydF4y2BaPtTPS19的三个结构域(黄色:γ结构域,棕色:β结构域,绿色:α结构域)模型。gydF4y2BabgydF4y2BaPtTPS19和PtTPS20排列活性位点的模型。保守的DDxxD基序以蓝色棒表示,而NDxxTxxxE/DDxxSxxxE基序以紫色棒表示。见过gydF4y2Ba607gydF4y2BaPtTPS19和ThrgydF4y2Ba607gydF4y2BaPtTPS20的表达,分别用红色棒和黄色棒表示。野生型酶的产物形成(gydF4y2BacgydF4y2Ba)和具有一种氨基酸交换的酶(gydF4y2BadgydF4y2Ba).酶在gydF4y2Ba大肠杆菌gydF4y2Ba提取,部分纯化,与PtTPS17和底物GGPP孵育。产物用己烷萃取,用GC-MS分析。1、geranyllinalool;2、copalol;3.gydF4y2Baent -gydF4y2Bakaurene;4,gydF4y2BaentgydF4y2Ba-isokaurene;5、16α羟基-gydF4y2Baent -gydF4y2BakauranegydF4y2Ba
PtTPS17gydF4y2Ba-gydF4y2Ba20.gydF4y2Ba在杨树中是否有差异表达gydF4y2Ba
为了进一步描述gydF4y2BaCPSgydF4y2Ba而且gydF4y2BaKS(左)gydF4y2Ba我们测定了合成酶基因在叶芽、叶、茎和根中的转录丰度gydF4y2Bap . trichocarpagydF4y2Ba使用定量RT-PCR。对比四种不同的杨树器官,所分析基因的转录水平有显著差异(图2)。gydF4y2Ba6gydF4y2Ba).的最高基因表达gydF4y2BaPtTPS17gydF4y2Ba而且gydF4y2BaPtTPS19/20gydF4y2Ba在根中发现,表达量分别比叶片高约3500倍和20倍。也发现了相当强的转录本积累gydF4y2BaPtTPS17gydF4y2Ba在茎(大约比叶高50倍)和用于gydF4y2BaPtTPS19/20gydF4y2Ba在叶芽和茎中(分别比叶片高8倍和5倍)。所有分析基因在叶片中的转录丰度均最低。而gydF4y2BaPtTPS17gydF4y2Ba而且gydF4y2BaPtTPS19/20gydF4y2Ba不同杨树器官的表达水平不同,gydF4y2BaPtTPS18gydF4y2Ba在叶芽、茎和根中表现出相似的表达,与叶片相比,转录物丰度高约10倍(图2)。gydF4y2Ba6gydF4y2Ba).较小的cgydF4y2Ba问gydF4y2Ba值为gydF4y2BaPtTPS19/20gydF4y2Ba相比之下gydF4y2BaPtTPS17/18gydF4y2Ba表明,gydF4y2BaPtTPS19/20gydF4y2Ba总体上比gydF4y2BaPtTPS17gydF4y2Ba而且gydF4y2BaPtTPS18gydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba:表S1)。由于它们的核苷酸序列高度相似,约为99.4%,无法区分gydF4y2BaPtTPS19gydF4y2Ba而且gydF4y2BaPtTPS20gydF4y2Ba在qRT-PCR中。然而,克隆的qRT-PCR产物的重复测序显示gydF4y2BaPtTPS20gydF4y2Ba在叶芽中不存在,仅在叶片中少量表达(占总扩增量的15.0±6.2%),在茎和根中表达较强(分别占总扩增量的44.4±9.6和63.2±13.9%)。gydF4y2Ba6gydF4y2Ba).gydF4y2Ba
转录丰度gydF4y2BaPtTPS19/20, PtTPS17gydF4y2Ba而且gydF4y2BaPtTPS18gydF4y2Ba不同器官的基因gydF4y2Bap . trichocarpagydF4y2Ba。采用qRT-PCR方法检测叶芽(Bd)、叶(Lf)、茎(St)和根(Rt)的基因表达。gydF4y2BaPtTPS19gydF4y2Ba来gydF4y2BaPtTPS20gydF4y2Ba通过扩增子重复测序确定比例。平均值和标准误差显示在(gydF4y2BangydF4y2Ba= 6)。采用单因素方差分析,然后采用Holm-Sidak检验来检验统计学显著性。不同字母表示植物器官间的显著差异。gydF4y2BaPtTPS19/20gydF4y2Ba:gydF4y2BaFgydF4y2Ba= 140.549,gydF4y2BapgydF4y2Ba= < 0.001;gydF4y2BaPtTPS17gydF4y2Ba:gydF4y2BaFgydF4y2Ba= 271.955,gydF4y2BapgydF4y2Ba= < 0001;gydF4y2BaPtTPS18gydF4y2Ba:gydF4y2BaFgydF4y2Ba= 31.952,gydF4y2BapgydF4y2Ba= < 0.001gydF4y2Ba
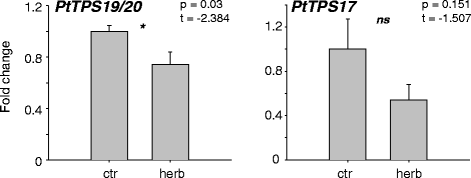
由于已知食草性常诱导参与植物防御的萜烯合酶基因的表达[gydF4y2Ba21gydF4y2Ba,gydF4y2Ba27gydF4y2Ba],我们测量的转录本积累gydF4y2BaPtTPS17/19/20gydF4y2Ba在未受损和草食受损的杨树叶片中,研究这些基因在防御毛虫方面的假定作用。然而,qRT-PCR结果显示基因表达gydF4y2BaPtTPS17/19/20gydF4y2Ba食草后是不是上调了由gydF4y2BaLymantria dispargydF4y2Ba这是一种以杨树为食的多面手毛虫。相比之下,gydF4y2BaPtTPS19/20gydF4y2Ba草食动物损伤后,转录本积累略有下调(图2)。gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
的假定反应机理gydF4y2BaentgydF4y2Ba-kaurene和16α-羟基-gydF4y2BaentgydF4y2Ba白杨树-kaurane的形成。II类萜烯合酶PtTPS17催化GGPP转化为gydF4y2BaentgydF4y2Bacpp。两种高度相似的I类酶PtTPS19和PtTPS20可以接受gydF4y2BaentgydF4y2Ba-CPP作为底物,并将其转换成gydF4y2BaentgydF4y2Ba-kaur-16-ene,赤霉素生物合成前体或16α-羟基-gydF4y2BaentgydF4y2Ba分别-kaurane。产物特异性似乎由蛋白活性中心的一个氨基酸控制,排除(1)或允许(2)水分子对beyeran-16-基阳离子的猝灭(由[gydF4y2Ba33gydF4y2Ba])。3.gydF4y2BaentgydF4y2Ba-kaurene;4,gydF4y2BaentgydF4y2Ba-isokaurene;5、16α羟基-gydF4y2BaentgydF4y2Ba-kauranegydF4y2Ba
讨论gydF4y2Ba
labdane相关的二萜是重要的植物代谢产物,已知在植物的初级和次生代谢中起作用。它们的形成始于II类二萜合酶催化GGPP的环化。由此产生的环二磷酸戊烯酰是I类二萜合酶的底物,形成最终的二萜碳氢化合物和醇。我们已经证明过了gydF4y2Bap . trichocarpagydF4y2Ba含有两个推定的II类二萜合酶(PtTPS17/18)以及两个与I类酶同源的二萜合酶(PtTPS19/20)。异种表达gydF4y2Ba大肠杆菌gydF4y2Ba揭示了PtTPS17催化GGPP转化为gydF4y2BaentgydF4y2Ba-CPP,而第二种假定的II类酶PtTPS18无活性。PtTPS19和PtTPS20表现为I类酶活性转换gydF4y2BaentgydF4y2Bacpp进gydF4y2BaentgydF4y2Ba-kaurene和16α-羟基-gydF4y2BaentgydF4y2Ba-kaurane(图;gydF4y2Ba3.gydF4y2Ba,附加文件gydF4y2Ba1gydF4y2Ba:图S2)。gydF4y2Ba
在四环的gydF4y2BaentgydF4y2Ba-kaurene是赤霉素生物合成的通用中间体,赤霉素是控制发芽、细胞伸长和开花等多种生长过程的重要植物激素[gydF4y2Ba8gydF4y2Ba].拟南芥gydF4y2Baga1gydF4y2Ba(gydF4y2Baent-CPSgydF4y2Ba)突变体,例如,在gydF4y2BaentgydF4y2Ba-kaurene生物合成,显示雄性不育矮化表型[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba28gydF4y2Ba],表明gydF4y2BaentgydF4y2Ba- kaurenee衍生的赤霉素是植物发育和繁殖所必需的。gydF4y2BaentgydF4y2Ba-CPS和KS酶存在于所有高等植物中[gydF4y2Ba29gydF4y2Ba]并且已经从一些主要的草本物种如水稻和拟南芥中鉴定和鉴定[gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba25gydF4y2Ba].酶PtTPS17和PtTPS19在本工作中被表征gydF4y2BaentgydF4y2Bacpp和gydF4y2BaentgydF4y2Ba-kaurene,很可能是杨树赤霉素生物合成的关键酶。因此,它们的鉴定和鉴定为进一步研究赤霉素在这种快速生长的多年生木本植物中的形成、调控和功能提供了基础。gydF4y2Ba
参与初级代谢的基因的复制和随后产生的副本的亚功能或新功能被认为是驱动植物次级代谢的进化[gydF4y2Ba30.gydF4y2Ba].一般情况下,植物CPS和KS由单拷贝基因编码[gydF4y2Ba13gydF4y2Ba].然而,在少数植物物种中,基因复制导致了基因的扩张gydF4y2BaCPSgydF4y2Ba而且gydF4y2BaKSgydF4y2Ba基因家族。在这些植物中,有一个gydF4y2BaCPSgydF4y2Ba基因和一个gydF4y2BaKSgydF4y2Ba基因保留了赤霉素生物合成的功能[gydF4y2Ba25gydF4y2Ba].以大米为例,含有三种gydF4y2BaCPSgydF4y2Ba比如基因和十个gydF4y2BaKSgydF4y2Ba类基因除了单一gydF4y2BaCPSgydF4y2Ba/gydF4y2BaKSgydF4y2Ba基因对[gydF4y2Ba31gydF4y2Ba],并且已经表明,这些中的大多数gydF4y2BaCPS / KSgydF4y2Ba类基因被招募来形成二级化合物,如二萜植物抗毒素。在杨树中,最近的基因组重复事件和最近的串联基因重复产生了两个拷贝gydF4y2BaCPSgydF4y2Ba而且gydF4y2BaKSgydF4y2Ba基因,分别([gydF4y2Ba22gydF4y2Ba],附加文件gydF4y2Ba1gydF4y2Ba:图S1)。据推测,随后的突变导致了其中一个的失活gydF4y2BaCPSgydF4y2Ba基因复制gydF4y2BaKSgydF4y2Ba基因gydF4y2BaPtTPS20gydF4y2Ba进化出新的产品特异性。因此,gydF4y2BaPtTPS19gydF4y2Ba而且gydF4y2BaPtTPS20gydF4y2Ba很可能代表了一个参与二级代谢的基因从一个在初级代谢中起作用的祖先进化而来的例子。gydF4y2Ba
PtTPS19和PtTPS20在氨基酸水平上高度相似,但并不只产生氨基酸gydF4y2BaentgydF4y2Ba-kaurene, PtTPS20主要生成16α-羟基-gydF4y2BaentgydF4y2Ba-贝壳烷和少量的gydF4y2BaentgydF4y2Ba-kaurene和gydF4y2BaentgydF4y2Ba-isokaurene(无花果。gydF4y2Ba3.gydF4y2Ba).虽然单半萜合酶和倍半萜合酶生成醇是很常见的,但绝大多数二萜合酶生成碳氢化合物,而关于二萜合酶生成醇的报道很少。一个例子是双功能二萜合酶gydF4y2Ba挪威云杉gydF4y2Ba生产热不稳定的羟基枞烯作为主要产品[gydF4y2Ba32gydF4y2Ba].据我们所知,唯一一种二萜合酶能产生16α-羟基-gydF4y2BaentgydF4y2Ba-kaurane是来自苔藓植物的双功能PpCPS/KSgydF4y2BaPhyscomitrella金属盘gydF4y2Ba[gydF4y2Ba14gydF4y2Ba].gydF4y2Ba
假设16α-羟基-的生成gydF4y2BaentgydF4y2Ba-kaurane是由beyeran-16-yl阳离子通过加入水分子而淬灭,而不是通过简单的去质子化形成双键[gydF4y2Ba14gydF4y2Ba].对PtTPS19和PtTPS20的三维结构进行建模,使我们能够识别活性位点上的一个氨基酸,该氨基酸决定了酶的产物特异性(图2)。gydF4y2Ba5gydF4y2Ba).PtTPS19中的蛋氨酸607转化为苏氨酸导致了与PtTPS20几乎相同的产物结构,而PtTPS20中苏氨酸607互补交换为蛋氨酸完全将酶转化为类似PtTPS19的KS(图2)。gydF4y2Ba5gydF4y2Ba).PtTPS19较大的蛋氨酸侧链可能屏蔽了beyeran-16-yl中间体的碳正离子,从而阻止了水分子的加入(图。gydF4y2Ba8gydF4y2Ba).相反,更小、极性更强的苏氨酸残基可能形成水结合袋和/或改变底物构象,从而允许水分子的加入(生成16α-羟基-)gydF4y2BaentgydF4y2Ba-kaurane)以及质子在两个不同位置的抽象(给gydF4y2BaentgydF4y2Ba-kaurene和gydF4y2BaentgydF4y2Ba-isokaurene)。而苏氨酸侧链上的羟基似乎不参与水分子的配位,因为丙氨酸取代苏氨酸并没有改变产物的特异性。在产生16α-羟基-的PpCPS/KS中也观察到类似的效应gydF4y2BaentgydF4y2Ba-贝壳烷和少量的gydF4y2BaentgydF4y2Ba-kaurene [gydF4y2Ba14gydF4y2Ba,gydF4y2Ba33gydF4y2Ba].Kawaide和同事(2011)可以识别出决定酶产物特异性的丙氨酸残基。在PtTPS19/20中,与苏氨酸/蛋氨酸607位于相应位置的丙氨酸710交换为蛋氨酸或具有较大疏水侧链的氨基酸残基,导致酶只能产生gydF4y2BaentgydF4y2Ba-kaurene,而其他较小的亲水侧链在这个位置仍然允许产生醇。这些发现表明,该氨基酸位置在形成活性位点空腔中发挥作用,而不是像所描述的那样参与水结合,例如,在1,8-桉树脑合酶的活性位点上的天冬酰胺gydF4y2Ba鼠尾草后gydF4y2Ba[gydF4y2Ba34gydF4y2Ba].有趣的是,在高等植物的KS中,PtTPS20中苏氨酸607对应的氨基酸被强烈保守为蛋氨酸[gydF4y2Ba33gydF4y2Ba].就像PtTPS19一样,在白云杉的双功能KS中,这种保守的蛋氨酸转化为更小的丙氨酸(gydF4y2Ba云杉glaucagydF4y2Ba)导致醇16α-羟基-的生成gydF4y2BaentgydF4y2Ba-贝壳烷和少量的gydF4y2BaentgydF4y2Ba-isokaurene [gydF4y2Ba35gydF4y2Ba].然而,突变云杉酶仅产生40%的16α-羟基-gydF4y2BaentgydF4y2Ba-贝壳烷,在生产过程中保留了大部分原始活性gydF4y2BaentgydF4y2Ba而在杨树中,单氨基酸开关对KS活性的影响更强。少数氨基酸的交换可以特异性地改变二萜合酶产物的结果,这一事实是众所周知的[gydF4y2Ba30.gydF4y2Ba,gydF4y2Ba33gydF4y2Ba,gydF4y2Ba35gydF4y2Ba,gydF4y2Ba36gydF4y2Ba].例如,在水稻中,单个氨基酸的改变足以将异油菜烯合酶转化为吡马拉烯合酶[gydF4y2Ba30.gydF4y2Ba].gydF4y2Ba
参与赤霉素生物合成的CPS酶通常具有高度保守的组氨酸残基,这导致在较高Mg时酶活性受到抑制gydF4y2Ba2 +gydF4y2Ba浓度(gydF4y2Ba24gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].这种效应已被假设为一种控制通量的机制gydF4y2BaentgydF4y2Ba-CPP转化为赤霉素生物合成[gydF4y2Ba24gydF4y2Ba,gydF4y2Ba37gydF4y2Ba].虽然gydF4y2BaentgydF4y2Ba-CPP合成酶PtTPS17具有这种保守的组氨酸和gydF4y2BaentgydF4y2Ba-CPP的形成在Mg含量较高时受到抑制gydF4y2Ba2 +gydF4y2Ba浓度(无花果。gydF4y2Ba4gydF4y2Ba)的相似表达模式gydF4y2BaPtTPS17gydF4y2Ba而且gydF4y2BaPtTPS19/20gydF4y2Ba表明PtTPS17为两者提供了底物gydF4y2BaentgydF4y2Ba-kaurene和16α-羟基-gydF4y2BaentgydF4y2Ba-kaurane形成(图。gydF4y2Ba2gydF4y2Ba,gydF4y2Ba4gydF4y2Ba,gydF4y2Ba6gydF4y2Ba).由于它们具有促进生长的功能,gydF4y2BaCPSgydF4y2Ba而且gydF4y2BaKSgydF4y2Ba据报道,基因在不同的植物器官中具有组成性表达,快速生长的组织中表达量最高,充分扩张的叶和根中表达量较低,而用于二次代谢的二萜基因的丰度则较为有限[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba38gydF4y2Ba- - - - - -gydF4y2Ba41gydF4y2Ba].虽然gydF4y2BaPtTPS17gydF4y2Ba而且gydF4y2BaPtTPS19/20gydF4y2Ba在所有杨树组织中均有表达,根系中转录物积累量最高。然而,测序gydF4y2BaPtTPS19/20gydF4y2Ba成绩单显示gydF4y2BaKSLgydF4y2Ba基因gydF4y2BaPtTPS20gydF4y2Ba占根系转录本的60%以上(图2)。gydF4y2Ba6gydF4y2Ba),表明有16α-羟基-的特异性生成gydF4y2BaentgydF4y2Ba-kaurane在这个器官中,可能由高丰度的PtTPS17支持以产生前体gydF4y2BaentgydF4y2Bacpp。在gydF4y2Ba甜叶菊rebaudiana。gydF4y2Ba在这种植物中的表达gydF4y2BaentgydF4y2Ba-gydF4y2BaCPSgydF4y2Ba一个重复的gydF4y2BaKSgydF4y2Ba基因在成熟叶中含量最高,与赤霉素的生物合成相反,这两个基因都参与甜菊糖苷的生物合成[gydF4y2Ba39gydF4y2Ba].gydF4y2Ba
不幸的是,我们测量粗杨树蛋白提取物中TPS酶活性的尝试失败了。因此,我们无法将体内酶活性与基因表达数据进行比较。然而,大量研究表明,萜烯合酶的体外产物谱以及表达模式通常与各自植物产生的萜烯具有良好的相关性[gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba42gydF4y2Ba],很可能杨树二萜合酶活性也反映在gydF4y2BaTPSgydF4y2Ba记录积累。gydF4y2Ba
16α-羟基-的作用gydF4y2BaentgydF4y2Ba白杨树中的-kaurane尚不清楚。苔藓gydF4y2Bap .金属盘gydF4y2Ba以高速率释放这种二萜醇作为挥发剂,但对其功能一无所知[gydF4y2Ba43gydF4y2Ba].作为萜烯合成酶基因gydF4y2BaPtTPS20gydF4y2Ba在杨树中,16α-羟基-似乎是组成型表达gydF4y2BaentgydF4y2Ba-kaurane可以作为一种化感化学物质或植物预期素。然而,由于我们无法在植物材料的己烷提取物中检测到该化合物,该醇也可能是杨树中其他尚未鉴定的化合物的前体。gydF4y2BaEntgydF4y2Ba例如,同样由PtTPS20产生的-异油菜烯是水稻叶片中发现的一种抗菌化合物oryzalide a生物合成的假定中间体[gydF4y2Ba31gydF4y2Ba].然而,二萜醇16α-羟基-gydF4y2BaentgydF4y2Ba-kaurane也可能作为信号分子,正如已经证明的烟草中的双环二萜醇介导烟草中的防御反应的激活(Seo, 2003)。gydF4y2Ba
结论gydF4y2Ba
我们发现了gydF4y2BaentgydF4y2Ba-CPS和KS在杨树中似乎参与了赤霉素的生物合成。的gydF4y2BaKSgydF4y2Ba该基因似乎最近经历了串联基因复制和亚/新功能化,并伴随着一个氨基酸变化,足以将KS转变为KSL。通过加入水分子,使beyeran-16-yl阳离子淬灭,主要产物由gydF4y2BaentgydF4y2Ba-丁香烯到16α-羟基-gydF4y2BaentgydF4y2Ba-kaurane。虽然赤霉素生物合成的基因似乎在所有器官中都是组成性表达的,但是赤霉素的基因似乎在所有器官中都是组成性表达的gydF4y2BaKSLgydF4y2Ba该基因在根中含量较高,可能在特化代谢中起作用。gydF4y2Ba
方法gydF4y2Ba
植物及昆虫材料gydF4y2Ba
西洋苦瓜杨(gydF4y2Ba杨树trichocarpagydF4y2Ba)用单克隆茎扦插(克隆625,NW-FVA, Hann。Münden,德国),在温室夏季条件下(24°C, 60%相对湿度,16小时/8小时光/暗循环),以1:1的沙土混合(Klasmann盆栽基质,Klasmann- deilmann, Geeste, Germany)种植,直到达到约1米高。根据叶片增殖期指数(LPI)对叶片进行编号[gydF4y2Ba44gydF4y2Ba].采集lpi2 ~ lpi7叶、叶间茎以及杨树根部。此外,种植茎插枝,13天后收获刚开放的叶芽。经食草动物处理的植物材料如[gydF4y2Ba45gydF4y2Ba].简单地说,树木被感染了gydF4y2Bal . dispargydF4y2Ba幼虫在一个叶子上,用PET袋(“Bratschlauch”,Toppits, Minden, Germany)包裹,用电缆粘合剂固定袋的两端。五个gydF4y2Bal . dispargydF4y2Ba饥饿12 h的3 ~ 4龄幼虫在叶片上释放。毛毛虫被喂食gydF4y2Bap . trichocarpagydF4y2Ba在实验开始前离开一周。让毛毛虫进食24小时(16.00 - 16.00 h)。收获后,植物材料立即用液氮速冻,并在−80°C保存,直到进一步加工。gydF4y2Ba
舞毒蛾(gydF4y2BaLymantria dispargydF4y2Ba)鸡蛋批次由美国APHIS的Hannah Nadel提供。幼虫孵化后,用人工饲料(舞毒蛾饲料,MP Biomedicals LLC, Illkirch, France)饲养。gydF4y2Ba
植物组织取样,RNA提取和逆转录gydF4y2Ba
植物材料在液氮中研磨。根据制造商的说明,使用Invisorb Spin Plant RNA Mini Kit (Invitek GmbH, Berlin, Germany)分离总RNA。RNA浓度、纯度和质量使用分光光度计(NanoDrop 2000c, Thermo Scientific, Wilmington, USA)和Agilent 2100生物分析仪(Agilent Technologies GmbH, Waldbronn, Germany)进行评估。在合成cDNA之前,用1 μL DNase对0.75 μg RNA进行DNase处理(Fermentas GmbH, St. Leon Roth, Germany)。利用SuperScript从dna处理的RNA中制备单链cDNAgydF4y2Ba™gydF4y2BaIII逆转录酶和寡核苷酸(dTgydF4y2Ba12 - 18gydF4y2Ba底漆(Invitrogen, Carlsbad, CA, USA)。gydF4y2Ba
识别和隔离gydF4y2BaKS(左)gydF4y2Ba而且gydF4y2BaCPSgydF4y2Ba基因gydF4y2Ba
识别假定的gydF4y2BaKS(左)gydF4y2Ba而且gydF4y2BaCPSgydF4y2Ba基因,TBLASTN搜索与gydF4y2Bap . trichocarpagydF4y2Ba基因组数据库(gydF4y2Bahttp://www.phytozome.net/poplargydF4y2Ba)使用AtCPS (Q38802)和AtKS (AAC39443)作为查询序列。两个公认的gydF4y2BaKS(左)gydF4y2Ba还有两个假设gydF4y2BaCPSgydF4y2Ba基因被确定在基因组中,并可以从cDNA池中扩增gydF4y2Bap . trichocarpagydF4y2Ba叶,茎,芽和根gydF4y2Ba。gydF4y2Ba引物序列信息可在附加文件gydF4y2Ba1gydF4y2Ba:表S2。PCR产物克隆到测序载体PCR®中gydF4y2Ba-gydF4y2BaBlunt II-TOPO®(Invitrogen)和两条链都进行了完全测序。信号肽预测使用TargetP 1.1服务器(gydF4y2Bahttp://www.cbs.dtu.dk/services/TargetP/gydF4y2Ba), TargetLoc (gydF4y2Bahttps://abi.inf.uni-tuebingen.de/Services/MultiLocgydF4y2Ba),以及PSORT (gydF4y2Bahttp://psort.hgc.jp/form.htmlgydF4y2Ba)(见附加文件gydF4y2Ba1gydF4y2Ba:表S3)。序列存入GenBank,登录号KT877421 (gydF4y2BaPtTPS17gydF4y2Ba), kt877422 (gydF4y2BaPtTPS18gydF4y2Ba), kt877423 (gydF4y2BaPtTPS19gydF4y2Ba)、KT877424 (gydF4y2BaPtTPS20gydF4y2Ba).gydF4y2Ba
CPS和KS(L)的异源表达gydF4y2Ba大肠杆菌gydF4y2Ba
对于异源表达,基因n端截断(PtTPS19/20: Δ42 aa;PtTPS17: Δ65 aa;PtTPS18:全长,Δ92 aa),克隆到细菌表达载体pET200 (Invitrogen)。文化的gydF4y2Ba大肠杆菌gydF4y2Ba菌株BL21(DE3)在37℃、220 rpm条件下生长,达到OD后置于18℃、180 rpm条件下gydF4y2Ba600gydF4y2Ba= 0.5, 60分钟后用1 mM IPTG诱导,再培养18 hgydF4y2BaggydF4y2Ba),置于冷却萃取缓冲液(50 mM Tris HCl, pH = 7.5, 10%甘油(v/v), 10 mM MgClgydF4y2Ba2gydF4y2Ba, 5 mM二硫苏糖醇,5 mM抗坏血酸钠,1×蛋白酶抑制剂Mix HP (SERVA,德国),25U苯并酶核酸酶(默克,德国),0.2 mg/mL溶菌酶),并用超声波仪进行3 × 30 s处理(Bandelin UW2070,柏林,德国;50%)。细胞片段通过14,000 g(10分钟,4°C)离心分离,上清液直接通过Econopac 10DG色谱柱(BioRad, Hercules, CA, USA)脱盐到测定缓冲液(10%甘油(v/v), 10 mM TrisHCl pH = 7.5, 1 mM二硫苏糖醇),或使用Ni-NTA旋转色谱柱(Qiagen, Hilden,德国)从上清液中纯化蛋白质,随后通过Illustra nap5色谱柱脱盐(GE Healthcare)。gydF4y2Ba
重组KS(L)和CPS的分析gydF4y2Ba
为测定CPS的催化活性,采用含80 μL细菌提取物或纯化蛋白的酶测定法和含50 μM (gydF4y2BaE, E, EgydF4y2Ba)-GGPP (Sigma,德国)和5mm MgClgydF4y2Ba2gydF4y2Ba,在特氟龙密封,螺旋盖的1ml GC玻璃瓶中进行,并覆盖100 μl己烷。将40 μL CPS提取物或纯化蛋白与40 μL KS/KSL提取物或纯化蛋白混合,测定KS和KSL活性。在25°C孵育2 h后,收集己烷相并用GC-MS分析。用于分析不同镁元素的依赖性gydF4y2Ba2 +gydF4y2Ba浓度对PtTPS17/18活性的影响,用0.1、1或10 mM MgCl进行三次重复试验gydF4y2Ba2gydF4y2Ba5 μl或50 μM GGPP孵育30 min (PtTPS18孵育4 h),加入20 μl 5 N HCl停止孵育15 min后提取。gydF4y2Ba
作为阴性对照,我们将CPS或KS(L)提取物替换为生蛋白提取物gydF4y2Ba大肠杆菌gydF4y2Ba表示一个空矢量控件。这些实验证明了这一点gydF4y2Ba大肠杆菌gydF4y2Ba提取物将GGPP非特异性地转化为香叶基芳醇,但不支持产生额外的二萜(图。gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
KS(L)/CPS酶产物使用Agilent 6890系列气相色谱仪耦合Agilent 5973四极质量选择检测器(界面温度,250℃;四极温度,150℃;源温度,230°C;电子能,70 eV)。GC采用DB-5MS色谱柱(Agilent, Santa Clara, USA, 30 m × 0.25 mm × 0.25 μm)。在80°C的初始温度下注入1 μl的己烷样品,不发生裂解。温度保持2分钟,然后以5°C min的梯度增加到280°CgydF4y2Ba−1gydF4y2Ba,并进一步增加到320°C,梯度为100°C mingydF4y2Ba−1gydF4y2Ba将化合物的保留时间和质谱与Wiley和国家标准与技术研究所图书馆和文献中的参考光谱(Joulain, 1998)以及真实标准的参考光谱(gydF4y2BaentgydF4y2Ba-kaurene, 16α-羟基- t-kaurane)由Reuben Peters教授(爱荷华州立大学,美国)提供。gydF4y2Ba
建模和定点诱变gydF4y2Ba
为了鉴定控制PtTPS19和PtTPS20产物特异性的氨基酸,使用SwissModel web服务(swissmodel.expasy.org)创建了基于同源性的PtTPS19和PtTPS20的结构模型gydF4y2Ba冷杉属茅gydF4y2Ba(PDB 3S9V)为模板。模型的可视化使用Pymol (gydF4y2Bahttp://www.pymol.org/gydF4y2Ba).gydF4y2Ba
对于位点定向突变,30 ng pET200/D-TOPO®载体含有任一n端截断版本gydF4y2BaPtTPS19gydF4y2Ba或gydF4y2BaPtTPS20gydF4y2Ba根据制造商的说明(引物信息见附加文件?),在诱变PCR(18个循环,Phusion®高保真DNA聚合酶,新英格兰Biolabs GmbH,法兰克福,德国)中用作模板gydF4y2Ba1gydF4y2Ba:表S2)。模板DNA被消化gydF4y2BaDpngydF4y2BaI和PCR产物被插入并扩增gydF4y2Ba大肠杆菌gydF4y2Ba全球(表达载体)。gydF4y2Ba
qRT-PCR分析gydF4y2BaCPS及KS(L)gydF4y2Ba表达式gydF4y2Ba
cDNA的制备方法如上所述。用于放大gydF4y2BaPtTPS17, PtTPS18和PtTPS19/20gydF4y2Ba长度在100 ~ 170 bp之间的基因片段,设计具有TgydF4y2Ba米gydF4y2BaGC含量在39 - 45%之间,引物长度在20 - 25nt之间(附加文件)gydF4y2Ba1gydF4y2Ba:表S2)。由于序列相似性的高gydF4y2BaPtTPS19gydF4y2Ba而且gydF4y2BaPtTPS20gydF4y2Ba,使用两个序列特异性的引物对进行扩增。从每个杨树器官的三个生物重复中获得PCR产物测序,用于确定转录本的平均百分比gydF4y2BaPtTPS19gydF4y2Ba而且gydF4y2BaPtTPS20gydF4y2Ba。gydF4y2Ba
通过琼脂糖凝胶电泳、熔融曲线分析和标准曲线分析,以及克隆PCR扩增子的序列验证,证实引物特异性。gydF4y2Ba泛素gydF4y2Ba作为内参基因[gydF4y2Ba46gydF4y2Ba].使用Brilliant®III SYBR®Green QPCR Master Mix (Stratagene, CA, USA),以ROX作为参比染料,进行三次重复试验。所有反应均采用以下PCR条件:95°C初始孵育3 min,随后扩增40次(95°C 20 s, 60°C 20 s)。在每个周期的退火和延伸步骤中进行板读。在55 - 95°C循环结束时记录熔化曲线的数据。gydF4y2Ba
所有样品在同一台PCR机(MxPro - Mx3000P, Stratagene, Agilent Technologies, USA)上的96孔光学板上运行。在qRT-PCR中,对三个处理中的每一个进行5个生物重复分析,作为3个重复。从MxPro软件中导出校准平均相对量(dRn)的数据。gydF4y2Ba
植物萜烯及蛋白提取gydF4y2Ba
萜烯提取以500 μl己烷含20 ng/μl壬基乙酸酯为内标提取100 mg组织粉(叶芽、叶、茎或根)。在室温下进行剧烈的涡流萃取4小时。然后去除正己烷相,注入2 μl正己烷样品,除使用不同的温度程序外,未在上述GC-MS上裂解。在初始烤箱温度为45°C后,温度保持2分钟,然后以6°C min的梯度增加到270°CgydF4y2Ba−1gydF4y2Ba,并进一步增加到340°C,梯度为60°C mingydF4y2Ba−1gydF4y2Ba我们可以在这些提取物中鉴定出几种单萜和倍半萜,但没有检测到二萜化合物。gydF4y2Ba
对于粗植物蛋白提取物,在100mg冷冻新鲜研磨的杨树组织中加入1ml冷冻蛋白提取缓冲液(100mm磷酸钾,pH 8.0, 5mm二硫苏糖醇,2mm乙二胺四乙酸,1% (w/v)聚乙烯醇吡啶烷酮(Mr = 10,000), 4% (w/v)聚乙烯醇吡啶烷酮,1mm苯甲基磺酰氟),样品孵育1 h(4℃,150转/分),离心(4℃,12.000 × 30min)gydF4y2BaggydF4y2Ba)并脱盐到检测缓冲液中(通过Zeba™旋转脱盐柱,7 K MWCO, Thermo Scientific)。采用45 μl脱盐粗蛋白提取物进行上述蛋白质分析,采用GC-MS进行上述分析。未检测到二萜的形成。gydF4y2Ba
系统发生树重建gydF4y2Ba
为了构建具有特征的PtCPS和PtKS(L)酶以及其他具有代表性的CPS和KS酶的系统发育树,我们使用了MUSCLE算法(gap open, - 2.9;间隙延伸,0;疏水性倍率,1.5;聚类方法,upgmb)在MEGA5中实现[gydF4y2Ba47gydF4y2Ba]来计算CPS和KS(L)酶的氨基酸排列。基于MUSCLE对齐,使用MEGA5使用邻居连接算法(泊松模型)重建树。进行了1000次重复的自举重采样分析,以评估树的拓扑结构。gydF4y2Ba
PtCPS和PtKS(L)酶与来自gydF4y2Ba答:芥gydF4y2Ba使用BioEdit (gydF4y2Bahttp://www.mbio.ncsu.edu/bioedit/bioedit.htmlgydF4y2Ba)和ClustalW算法。gydF4y2Ba
统计分析gydF4y2Ba
为了检验不同杨树器官之间基因表达的显著差异,使用SigmaPlot 11.0 for Windows (Systat Software Inc. 2008),使用单向方差分析(ANOVA)和成对多重比较(Holm-Sidak方法)对对数转换数据进行分析。gydF4y2Ba
缩写gydF4y2Ba
- CPS:gydF4y2Ba
-
Copalyl二磷酸合成酶gydF4y2Ba
- CPP:gydF4y2Ba
-
Copalyl二磷酸gydF4y2Ba
- GGPP:gydF4y2Ba
-
Geranylgeranyl二磷酸gydF4y2Ba
- KS (L):gydF4y2Ba
-
Kaurene合成酶(类)酶gydF4y2Ba
- LPI:gydF4y2Ba
-
叶质体指数gydF4y2Ba
- 存在:gydF4y2Ba
-
实时定量PCRgydF4y2Ba
- TPS:gydF4y2Ba
-
萜烯合酶gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
欧菲德,林飞。萜烯生物合成:模块化规则。化学工程学报。2012;51(5):1124-37。gydF4y2Ba
- 2.gydF4y2Ba
林志强,李志强,李志强。植物挥发物在植物防御食草动物中的作用。植物学报。2009;12(4):479-85。gydF4y2Ba
- 3.gydF4y2Ba
李文杰,李志强,李志强。植物挥发物对植物与取花昆虫相互作用的影响。植物化学。2011;72(13):1647 - 54。gydF4y2Ba
- 4.gydF4y2Ba
李志强,李志强,李志强,李志强。针叶树对害虫抗性的研究进展。见:树木对昆虫抗性的机制和部署。编辑瓦格纳M,克兰西K,中尉F,潘恩T:荷兰:施普林格;2002.105 -130年。gydF4y2Ba
- 5.gydF4y2Ba
Martin D, Tholl D, Gershenzon J, Bohlmann J.茉莉酸甲酯诱导挪威云杉木质部发育过程中创伤性树脂导管、萜类树脂生物合成和萜类积累。植物科学进展。2002;29(3):344 - 344。gydF4y2Ba
- 6.gydF4y2Ba
彼得斯RJ。揭示水稻和其他谷类作物植物中二萜类植物抗毒素生物合成的复杂代谢网络。植物化学。2006;67(21):2307 - 17所示。gydF4y2Ba
- 7.gydF4y2Ba
Schmelz EA, Kaplan F, Huffaker A, Dafoe NJ, Vaughan MM, Ni XZ,等。玉米诱导型二萜类植物抗毒素的鉴定、调控及活性。中国科学:自然科学(英文版),2011;29(3):344 - 344。gydF4y2Ba
- 8.gydF4y2Ba
赤霉素植物激素代谢。入:巴赫TJ,侯麦M,编辑。植物和微生物中的类异戊二烯合成。纽约:施普林格;2013.233 - 49页。gydF4y2Ba
- 9.gydF4y2Ba
蔡子杰,马夫,彼得斯。到赤霉素和其他地方去!研究(二)萜类化合物代谢的演化。植物科学进展。2014;gydF4y2Ba
- 10.gydF4y2Ba
王志强,王志强,王志强,等。植物萜类合成酶的分子生物学和系统发育分析。中国科学(d辑:自然科学),1998;26(3):366 - 366。gydF4y2Ba
- 11.gydF4y2Ba
徐俊杰,徐俊杰,李志强,李志强。探讨DXDD基序在II类二萜环化酶中的作用。ChemBioChem。2007; 8(8): 869 - 74。gydF4y2Ba
- 12.gydF4y2Ba
周凯,彼得斯。研究植物中第二萜烯合酶二价金属结合基序的保存模式。植物化学。2009;70(3):366 - 9。gydF4y2Ba
- 13.gydF4y2Ba
陈峰,Tholl D, Bohlmann J, Pichersky E.植物萜烯合酶家族:一个中等规模的特化代谢基因家族,在整个世界中高度多样化。植物学报,2011;26(1):344 - 344。gydF4y2Ba
- 14.gydF4y2Ba
林林K,川德H, Notomi M, Sakigi Y, Matsuo A, Nozaki H.双功能的识别和功能分析gydF4y2BaentgydF4y2Ba-丁香烯合酶gydF4y2BaPhyscomitrella金属盘gydF4y2Ba。中国科学(d辑),2005;gydF4y2Ba
- 15.gydF4y2Ba
孙春平,谷谷勇。拟南芥Ga1基因座对环化酶的编码gydF4y2BaEntgydF4y2Ba-赤霉素生物合成的kaurene合成酶a。《植物科学》1994;6(10):1509-18。gydF4y2Ba
- 16.gydF4y2Ba
山口S,孙TP, Kawaide H, Kamiya Y.gydF4y2Ba拟南芥gydF4y2Ba编码gydF4y2BaentgydF4y2Ba赤霉素生物合成-蒽合酶。植物科学进展。1998;36(4):344 - 344。gydF4y2Ba
- 17.gydF4y2Ba
张丽娟,李志强,张志强,等。植物萜类合成酶基因家族的基因组分析gydF4y2Ba拟南芥gydF4y2Ba。中国生物医学工程学报,2002;26(6):344 - 344。gydF4y2Ba
- 18.gydF4y2Ba
徐mm, Hillwig ML, Prisic S, Coates RM, Peters RJ。水稻功能鉴定gydF4y2BasyngydF4y2Ba-copalyl二磷酸合成酶及其在二萜类植物抗毒素/化感作用天然产物生物合成中的作用。植物学报,2004;39(3):309-18。gydF4y2Ba
- 19.gydF4y2Ba
徐MM, Wilderman PR, Morrone D,徐俊杰,Roy A, Margis-Pinheiro M,等。水稻丁香烯合酶样基因家族的功能研究。植物化学。2007;68(3):312 - 26所示。gydF4y2Ba
- 20.gydF4y2Ba
陈峰,陈峰,陈振宗,等。四种萜合酶产生舞毒蛾喂食诱导的挥发性混合物的主要化合物gydF4y2Ba杨树trichocarpagydF4y2Ba。植物化学。2011;72:897。gydF4y2Ba
- 21.gydF4y2Ba
陈峰,蒋勇,陈峰,郭申宗,郭志刚。西部苦瓜杨树萜类合成酶及其在食草动物诱导挥发性排放中的作用(gydF4y2Ba杨树trichocarpagydF4y2Ba).中国生物医学工程学报。2014;14(1):270。gydF4y2Ba
- 22.gydF4y2Ba
图斯坎,杜菲西奥,杨松,鲍尔曼,格里戈里耶夫,赫尔斯滕,等。黑棉白杨的基因组gydF4y2Ba杨树trichocarpagydF4y2Ba(托。&灰色)。科学。2006;313(5793):1596 - 604。gydF4y2Ba
- 23.gydF4y2Ba
曹锐,张永华,Mann FM,黄昌昌,Mukkamala D, Hudock MP,等。二萜环化酶和异戊二烯折叠的性质。蛋白质结构功能生物信息学。2010;78(11):2417-32。gydF4y2Ba
- 24.gydF4y2Ba
Mann FM, Prisic S, Davenport EK, Determan MK, Coates RM, Peters RJ。Mg的单残留开关gydF4y2Ba2 +gydF4y2Ba植物II类二萜环化酶在初级和次级代谢中具有依赖性抑制作用。中国生物医学工程学报,2010;29(3):344 - 344。gydF4y2Ba
- 25.gydF4y2Ba
坂本T,三浦K,伊藤H,达隅T,上口-田中M,石山K,等。水稻赤霉素代谢酶基因及其相关突变体的研究进展。植物科学进展。2004;34(4):344 - 344。gydF4y2Ba
- 26.gydF4y2Ba
Köllner TG, Schnee C, Gershenzon J, Degenhardt JgydF4y2Ba玉米gydF4y2Ba栽培品种由编码立体选择性多产物酶的两个萜烯合酶基因的等位变异控制。植物细胞。2004; 16(5): 1115 - 31所示。gydF4y2Ba
- 27.gydF4y2Ba
Kollner TG, Held M, Lenk C, hiltold I, Turlings TCJ, Gershenzon J,等。一种玉米(gydF4y2BaEgydF4y2Ba)- -石竹烯合酶涉及对食草动物的间接防御反应,在大多数美国玉米品种中不表达。植物学报。2008;20(2):482-94。gydF4y2Ba
- 28.gydF4y2Ba
李文杰,李志刚。赤霉素敏感突变体的诱导与分析gydF4y2Ba拟南芥gydF4y2BaHeynh (L)。应用理论。1980;58(6):257-63。gydF4y2Ba
- 29.gydF4y2Ba
彼得斯RJ。其中有两个环:与labdan相关的二萜。中国科学,2010;27(11):1521-30。gydF4y2Ba
- 30.gydF4y2Ba
徐mm, Wilderman PR, Peters RJ。接下来的进化导致了二萜合酶产物结果的单一残基开关。中国科学院学报(自然科学版),2007;26(3):366 - 366。gydF4y2Ba
- 31.gydF4y2Ba
高等植物和真菌中二萜环化酶基因的研究进展。生物工程学报,2008;32(5):1168-75。gydF4y2Ba
- 32.gydF4y2Ba
Keeling CI, Madilao LL, Zerbe P, Dullat HK, Bohlmann J.gydF4y2Ba挪威云杉gydF4y2Ba左旋松二烯/枞二烯合酶(PaLAS)是一种热不稳定二萜的外聚物。中国生物医学工程学报,2011;29(3):344 - 344。gydF4y2Ba
- 33.gydF4y2Ba
江华德,K隼,川边R, Sakigi Y,松尾A,夏目石M,等。鉴定参与猝灭的单一氨基酸gydF4y2BaentgydF4y2Ba-考拉尼在ent-kaurene合成酶的水分子阳离子gydF4y2BaPhyscomitrella金属盘gydF4y2Ba。中国生物医学工程学报,2011;29(1):344 - 344。gydF4y2Ba
- 34.gydF4y2Ba
Kampranis SC, Ioannidis D, Purvis A, Mahrez W, Ninga E, Katerelos NA,等。鼠尾草单萜合酶底物和产物特异性的合理转换:萜类合酶功能演化的结构洞见。植物细胞,2007;19(6):1994-2005。gydF4y2Ba
- 35.gydF4y2Ba
张志刚,张志刚,张志刚。白云杉的遗传变异分析(gydF4y2Ba云杉glaucagydF4y2Ba)gydF4y2BaentgydF4y2Ba-kaurene合成酶(PgKS)揭示了针叶树二萜合成酶一般代谢和特化代谢的共同和独特的机制。植物化学。2012;74:30-9。gydF4y2Ba
- 36.gydF4y2Ba
莫龙D,徐MM,富尔顿DB,德特曼MK,彼得斯RJ。增加二萜合酶反应的复杂性与一个单一的残基开关。中国化学学报,2008;29(6):344 - 344。gydF4y2Ba
- 37.gydF4y2Ba
Prisic S, Peters RJ。协同底物抑制gydF4y2BaentgydF4y2Ba-二磷酸copalyl合成酶:一种潜在的前馈抑制机制,限制赤霉素代谢。植物科学进展。2007;44(1):445-54。gydF4y2Ba
- 38.gydF4y2Ba
银石艾尔,张长武,孙春平。赤霉素生物合成基因GA1的发育调控gydF4y2Ba拟南芥gydF4y2Ba。植物学报,1997;12(1):9-19。gydF4y2Ba
- 39.gydF4y2Ba
李志刚,李志刚,杨志刚,李志刚。二萜合成中的gydF4y2Ba甜菊糖甙rebaudianagydF4y2Ba:赤霉素生物合成途径关键酶的募集和上调。植物学报,1999;19(4):411-21。gydF4y2Ba
- 40.gydF4y2Ba
基林CI, Bohlmann J.二萜树脂酸在针叶。植物化学。2006;67(22):2415 - 23所示。gydF4y2Ba
- 41.gydF4y2Ba
Vaughan MM, Wang Q, Webster FX, Kiemle D, Hong YJ, Tantillo DJ,等。拟南芥I类萜烯合成酶TPS08在根中柱中形成不寻常的半挥发性二萜根athalene,参与防御地下食草。植物学报。2013;25(3):1108-25。gydF4y2Ba
- 42.gydF4y2Ba
Irmisch S, Krause ST, Kunert G, Gershenzon J, Degenhardt J, Kollner TG。萜烯合酶基因的器官特异性表达有助于洋甘菊精油的萜烃组成。BMC植物生物学。2012;12:84。gydF4y2Ba
- 43.gydF4y2Ba
冯·施瓦茨伯格K,舒尔茨W,卡斯纳hgydF4y2BaPhyscomitrella金属盘gydF4y2Ba释放一种四环二萜。植物细胞学报2004;22(10):780-6。gydF4y2Ba
- 44.gydF4y2Ba
Frost CJ, Appel HM, Carlson JE, De Moraes CM, Mescher MC, Schultz JC。通过挥发物传递的植物内信号克服了血管对系统信号的限制,并启动了对食草动物的反应。生态学报,2007;10(6):490-8。gydF4y2Ba
- 45.gydF4y2Ba
艾密施S,麦考密克AC, Boeckler GA,施密特A, Reichelt M,施耐德B,等。两种草食动物诱导的细胞色素P450酶CYP79D6和CYP79D7催化挥发性醛氧肟的形成,参与杨树的防御。植物科学进展。2013;25(11):4737-54。gydF4y2Ba
- 46.gydF4y2Ba
拉米雷斯-卡瓦哈尔GA,莫尔斯AM,戴维斯JM。杨树细胞分裂素反应调节基因家族的转录谱显示了其在植物发育中的不同作用。环境科学学报,2008;29(1):379 - 379。gydF4y2Ba
- 47.gydF4y2Ba
Tamura K, Peterson D, Peterson N, Stecher G, Nei M, Kumar S. MEGA5:利用最大似然,进化距离和最大简约方法进行分子进化遗传学分析。分子生物学杂志,2011;28(10):2731-9。gydF4y2Ba
致谢gydF4y2Ba
我们感谢鲁本·彼得斯对二萜合酶表达和发送标准的建议gydF4y2BaentgydF4y2Ba-kaurene和16α-羟基-gydF4y2Baent -gydF4y2Bakaurane和Tamara Krügel以及所有MPI-CE园丁,感谢他们帮助培育杨树。这项研究由马克斯·普朗克学会资助。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
作者的贡献gydF4y2Ba
SI, TGK和JG设计了研究。SI、ATM、LS和JaG进行了实验工作。SI分析了数据。SI和TGK撰写了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
额外的文件gydF4y2Ba
附加文件1:gydF4y2Ba
图S1。gydF4y2BaKS(左)gydF4y2Ba位于8号染色体上的基因。gydF4y2Ba图S2gydF4y2Ba。的GC-MS分析gydF4y2BaentgydF4y2Bacps,gydF4y2BasyngydF4y2Bacps,gydF4y2BangydF4y2Ba-CPS和PtTPS17产品。gydF4y2Ba表S1。gydF4y2BaCgydF4y2Ba问gydF4y2Ba杨树的价值gydF4y2BaCPSgydF4y2Ba而且gydF4y2BaKS(左)gydF4y2Ba。gydF4y2Ba表S2。gydF4y2Ba本研究中使用的寡核苷酸。gydF4y2Ba表S3。gydF4y2Ba信号肽预测使用不同的预测算法。(pptx147 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
厄米施,S, Müller, a.t.,施密特,L。gydF4y2Baet al。gydF4y2Ba有一种氨基酸起了作用:氨基酸的形成gydF4y2BaentgydF4y2Ba-kaurene和16α-羟基-gydF4y2Baent -gydF4y2Ba杨树中二萜合酶对贝壳烷的研究。gydF4y2BaBMC植物生物学gydF4y2Ba15日,gydF4y2Ba262(2015)。https://doi.org/10.1186/s12870-015-0647-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-015-0647-6gydF4y2Ba
关键字gydF4y2Ba
- 杨树trichocarpagydF4y2Ba
- 二萜合成酶gydF4y2Ba
- EntgydF4y2Ba-kaurenegydF4y2Ba
- 16α羟基-gydF4y2Baent -gydF4y2BakauranegydF4y2Ba
- 基因复制gydF4y2Ba
- 赤霉素生物合成gydF4y2Ba