- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
苜蓿蔗糖合成酶的转基因沉默(gydF4y2Ba紫花苜蓿gydF4y2BaL.)茎维管组织表明转化酶在细胞壁纤维素合成中的作用gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba15gydF4y2Ba、物品编号:gydF4y2Ba283gydF4y2Ba(gydF4y2Ba2015gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
紫花苜蓿(gydF4y2Ba紫花苜蓿gydF4y2Ba(L.)是一种广泛适应的多年生饲料作物,具有很高的生物质生产潜力。苜蓿茎中纤维素含量的提高将增加作物作为生物能源原料的价值。我们检测了蔗糖合酶(SUS;EC 2.4.1.13)会增加干细胞壁上的纤维素。gydF4y2Ba
结果gydF4y2Ba
将截断的紫花苜蓿磷酸烯醇丙酮酸羧化酶基因启动子(PEPC7-P4)与紫花苜蓿结节增强的SUS cDNA (gydF4y2BaMsSUS1gydF4y2Ba)或β-葡萄糖醛酸酶(gydF4y2Ba格斯gydF4y2Ba)基因。在木质部和韧皮部检测到强烈的GUS表达,表明PEPC7-P4启动子在茎维管组织中有活性。与预期相反,gydF4y2BaMsSUS1gydF4y2Ba在含有该基因的苜蓿植株中,转录物积累减少了75 - 90%gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba转基因与对照组相比。酶分析表明,与对照相比,选定的下调转化子茎中的SUS活性降低了95%以上。在对照植物木质部和韧皮部检测到SUS活性gydF4y2Ba原位gydF4y2Ba酶分析,植物用gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba转基因在伸长茎(PES)节间缺乏可检测到的SUS活性,而在伸长茎(ES)节间具有极低的SUS活性。免疫印迹证实了下调系PES节间SUS蛋白的缺失。在茎组织中下调SUS的表达和活性,没有导致明显的表型或细胞壁糖组成的显著变化。然而,在SUS下调的品系中,碱性/中性(A/N)转化酶活性增加,酸性转化酶活性较高。gydF4y2Ba原位gydF4y2Ba茎组织酶分析显示,中性转化酶定位于ES和PES节间的维管组织。gydF4y2Ba
结论gydF4y2Ba
这些结果表明,转化酶在为纤维素生物合成提供葡萄糖或补偿茎维管组织中SUS1活性的丧失方面起主要作用。gydF4y2Ba
背景gydF4y2Ba
紫花苜蓿(gydF4y2Ba紫花苜蓿gydF4y2Ba(L.)是全球种植最广泛的饲用豆科植物,在家畜营养、保护水土资源、提高土壤肥力和固碳等方面具有重要作用。此外,苜蓿具有许多特性,使其作为生物燃料原料具有吸引力,包括高生物质产量潜力。由于苜蓿具有生物固氮作用,通常不需要氮肥,可以提供后续粮食作物所需的全部氮。苜蓿饲料可以分成富含蛋白质的叶片和富含纤维素的茎,形成两种产品流。茎可用于通过发酵生产乙醇或气化生产电力的能源。开发含有更多纤维素的品种将提高苜蓿作为纤维素生物质原料的价值[gydF4y2Ba1gydF4y2Ba]。在伸长茎节间的所有组织(除了原木质部导管细胞)沉积薄的,纤维素贫乏的初代细胞壁[gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba]。相反,茎伸长后节间的韧皮部和木质部纤维细胞中沉积了厚的、富含纤维素的次生壁。增加纤维素的一个策略是增加苜蓿茎维管细胞中参与纤维素合成的酶的表达。gydF4y2Ba
蔗糖合成酶;EC 2.4.1.13)是一种糖基转移酶,催化蔗糖可逆转化为果糖和udp -葡萄糖,被认为在为纤维素合成提供udp -葡萄糖方面起主要作用[gydF4y2Ba4 gydF4y2Ba- - - - - -gydF4y2Ba6gydF4y2Ba]。在大多数植物物种中,SUS是由一个小基因家族编码的[gydF4y2Ba7gydF4y2Ba- - - - - -gydF4y2Ba11gydF4y2Ba]。在gydF4y2Bam . truncatulagydF4y2Ba紫花苜蓿的近亲,5岁gydF4y2BaSUSgydF4y2Ba基因鉴定[gydF4y2Ba11gydF4y2Ba],在模式豆科植物中鉴定出6种同种异构体gydF4y2BaLotus对虾gydF4y2Ba(gydF4y2Ba12gydF4y2Ba]。在紫花苜蓿中,鲜为人知的是gydF4y2BaSUSgydF4y2Ba基因家族。目前只有一家gydF4y2BaSUSgydF4y2Ba基因序列gydF4y2BaMsSUS1gydF4y2Ba同种异构体,存在于GenBank (AF049487)。在一些植物中,SUS表达的增加与纤维素的增加相关[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba]。an的过度表达gydF4y2BaSUSgydF4y2Ba棉花基因(gydF4y2Ba陆地棉gydF4y2BaL.)在两种防治方法下的杂交杨树gydF4y2Ba花椰菜花叶病毒gydF4y2Ba35S启动子或木质部特异性启动子增加了次生木质部SUS酶活性和纤维素[gydF4y2Ba15gydF4y2Ba]。gydF4y2Ba
蔗糖也被转化酶水解成葡萄糖和果糖。转化酶主要分为两大类,酸性转化酶主要位于细胞壁和液泡中,碱性/中性(A/N)转化酶位于细胞质、线粒体和质体中[gydF4y2Ba16gydF4y2Ba]。转化酶被认为在蔗糖代谢中起次要作用,但最近的研究表明,它们在蔗糖分解代谢中可能起着更广泛的作用。突变gydF4y2Ba拟南芥gydF4y2Ba的六种同工异构体中缺少四种的植物gydF4y2BaSUSgydF4y2Ba(gydF4y2Basus1 / sus2 / sus3 / sus4gydF4y2Ba),据报道缺乏可溶性和膜结合SUS活性,但其生长和纤维素含量正常。然而,两种中性细胞质转化酶亚型的突变(gydF4y2Bacinv1 / cinv2gydF4y2Ba)导致生长受到严重抑制[gydF4y2Ba17gydF4y2Ba]。同样,细胞质转化酶的主要亚型突变gydF4y2BaL. japonicus, LjINV1gydF4y2Ba,导致根和芽的生长严重减少,细胞发育发生变化,开花受损[18]。然而,主要SUS亚型的突变,gydF4y2BaLjSUS1gydF4y2Ba和gydF4y2BaLjSUS3gydF4y2Ba对植物生长、繁殖和固氮作用不大。只有当gydF4y2Basus1-1 / sus3-1gydF4y2Ba在无氮条件下生长的双突变体叶片数和茎重较野生型减少[gydF4y2Ba12gydF4y2Ba]。gydF4y2Ba
先前的研究表明,苜蓿磷酸烯醇丙酮酸羧化酶基因(gydF4y2BaPEPC-7gydF4y2Ba)在苜蓿根瘤中高水平表达[gydF4y2Ba19gydF4y2Ba]。全长启动子(相对于转录起始位点- 1299到+86)融合到β-葡萄糖醛酸酶(gydF4y2Ba格斯gydF4y2Ba)基因在根瘤、根尖和根茎中表达GUS。一个较短的启动子片段P4(−536至+86)在整个植物的维管组织中具有很强的GUS活性。在茎中,GUS活性主要局限于木质部细胞[gydF4y2Ba20.gydF4y2Ba]。gydF4y2Ba
我们利用的P4启动子gydF4y2BaPEPC-7gydF4y2Ba(PEPC7-P4)表达gydF4y2BaMsSUS1gydF4y2BacDNA在转基因苜蓿中的表达,以验证血管增强表达会增加干细胞壁纤维素的假设。结果表明,与预期相反,表达gydF4y2BaMsSUS1gydF4y2Ba使用PEPC7-P4启动子导致gydF4y2BaMsSUS1gydF4y2Ba并消除了苜蓿茎维管组织中大部分SUS酶的活性。下调SUS对植物生长和茎细胞壁糖组成的影响较小。虽然SUS活性非常低的转化与gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba构建后,酸性转化酶活性维持,A/N转化酶活性升高。我们讨论SUS和转化酶之间关系的含义gydF4y2BaSUSgydF4y2Ba异构体及其在细胞壁生物合成中的潜在作用。gydF4y2Ba
结果gydF4y2Ba
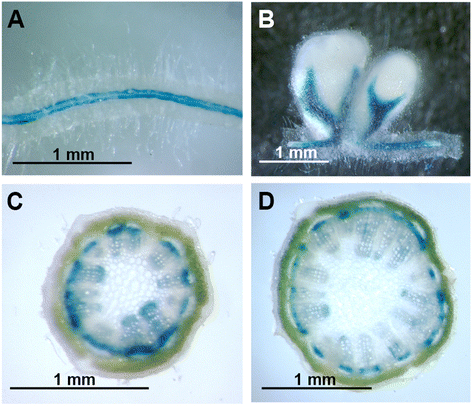
组织化学分析gydF4y2BaPEPC7-P4:格斯gydF4y2Ba记者gydF4y2Ba
先前的研究表明,PEPC7-P4启动子在苜蓿根瘤、根和茎的维管组织中具有活性[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba]。我们检测了植物根瘤、根和茎的GUS染色模式gydF4y2BaPEPC7-P4:格斯gydF4y2Ba对茎组织进行更详细的分析。我们的研究结果证实了GUS在根和根瘤维管组织中的表达gydF4y2BaPEPC7-P4:格斯gydF4y2Ba构造(图。gydF4y2Ba1 a, bgydF4y2Ba).在茎中,我们发现PEPC7-P4启动子在木质部和韧皮部组织中都有活性。韧皮部GUS染色在伸长茎(ES)和后伸长茎(PES)节间都很明显(图2)。gydF4y2Ba1 c, dgydF4y2Ba).相对于PES节间,ES的木质部GUS染色更为明显,且主要定位于原木质部和木质部薄壁组织。在ES节间(第一节间和第二节间)的顶端区域,GUS染色仅发生在木质部,表明PEPC7-P4启动子在原始韧皮部不活跃。选择作为转基因控制系的转化子(M22、M35)含有gydF4y2BaPEPC7-P4:格斯gydF4y2Ba构建,但组织化学染色检测缺乏GUS表达。gydF4y2Ba
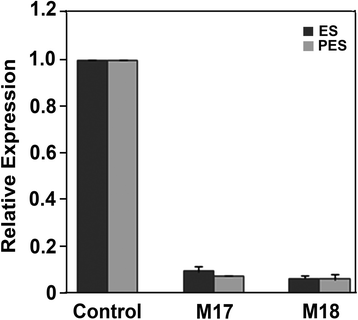
的相对表达gydF4y2BaMsSUS1gydF4y2Ba在转基因植物中gydF4y2Ba
特定的引物gydF4y2BaMsSUS1gydF4y2Ba转录本采用定量逆转录酶PCR (qRT-PCR)检测gydF4y2BaMsSUS1gydF4y2Ba茎中的转录物积累。来自20个独立的ES节点间的调查gydF4y2BaPEPC7-P4: SUS1gydF4y2Ba变换后的直线表明gydF4y2BaMsSUS1gydF4y2Ba与对照株系(M22、M35)的ES节间转录水平相比,转录水平降低了75% ~ 90%。两个转化系(M17, M18)显示了大约90%的表达下调gydF4y2BaMsSUS1gydF4y2Ba与对照组相比,ES和PES节间的转录本(图2)均有所减少。gydF4y2Ba2gydF4y2Ba)作为进一步研究的对象。gydF4y2Ba
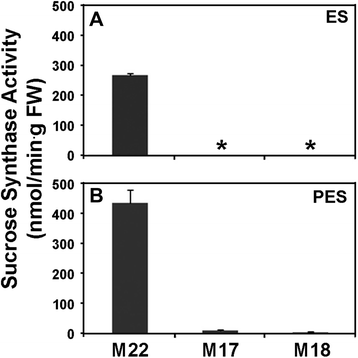
SUS酶和gydF4y2Ba原位gydF4y2Ba酶活性gydF4y2Ba
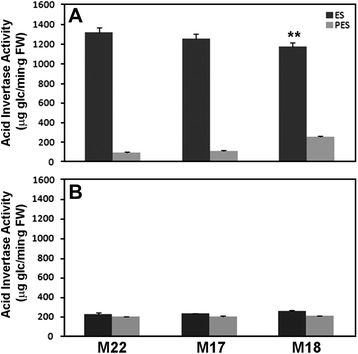
在对照(M22)苜蓿品系的茎中,发现PES的SUS酶活性比ES节间高1.6倍(图2)。gydF4y2Ba3.gydF4y2Ba).在gydF4y2BaPEPC7-P4: SUS1gydF4y2Ba转化系(M17、M18) ES节间的SUS活性低于检测水平(图2)。gydF4y2Ba3gydF4y2Ba),与对照系M22相比,PES节间的SUS活性降低了95%以上(图22)。gydF4y2Ba3 bgydF4y2Ba).SUS活性由gydF4y2Ba原位gydF4y2Ba对照系韧皮部和木质部组织的酶分析表明,PES节间的酶活性高于ES节间(图2)。gydF4y2Ba4 a, egydF4y2Ba).的gydF4y2Ba原位gydF4y2Ba酶学分析表明,大豆ES节间的SUS活性明显降低gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba转化株(无花果。gydF4y2Ba4摄氏度gydF4y2Ba),低于PES节间的检测水平(图2)。gydF4y2Ba4 ggydF4y2Ba).gydF4y2Ba
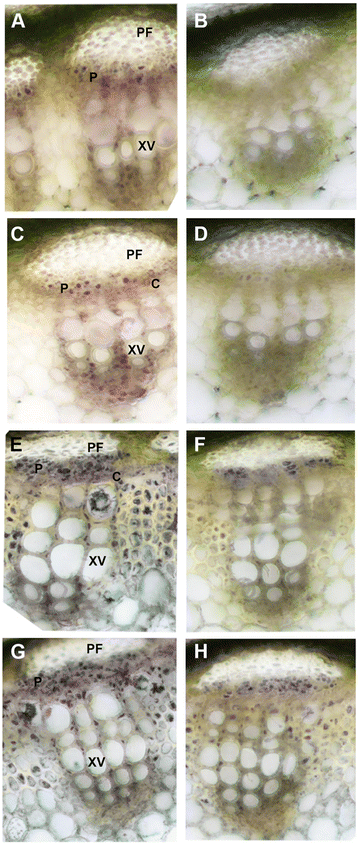
的比较gydF4y2Ba原位gydF4y2Ba对照(M22)伸长茎(ES)和后伸长茎(PES)节间茎秆横截面和SUS下调(M18)转化中蔗糖合酶活性的变化。细胞呈紫色表示酶活性。gydF4y2Ba一个gydF4y2BaM22的ES节间;(gydF4y2BacgydF4y2Ba), M18节点间ES;(gydF4y2BaegydF4y2Ba), M22的PES节点间;(gydF4y2BaggydF4y2Ba), M18的PES节间。gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba阴性对照(检测培养基中无蔗糖)gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba,分别。缩写:PF,韧皮部纤维;P,韧皮部;C,形成层;木质部导管gydF4y2Ba
单肽免疫印迹和质谱分析gydF4y2Ba
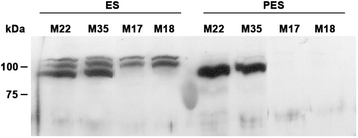
采用免疫印迹法检测对照组(M22、M35)和对照组(M22、M35)茎提取物的可溶性部分(16000 × g上清部分)中的SUS蛋白gydF4y2BaMsSUS1gydF4y2Ba下调的变压器(M17, M18)。玉米蔗糖合酶2的SUS抗血清[gydF4y2Ba21gydF4y2Ba用]进行免疫印迹检测。结果显示,在对照组ES节间检测到3种免疫反应性多肽,1种主要多肽约90 kDa, 2种次要多肽分子量略高(图2)。gydF4y2Ba5gydF4y2Ba).在SUS下调转化系的ES节间,主要的90 kDa的SUS多肽带缺失,但两个较小的分子量较高的带仍然存在。相比之下,对照系的PES节间仅存在一条约90 kDa的主要SUS多肽带。SUS下调系的PES节间未显示免疫反应性多肽。gydF4y2Ba
SUS蛋白可以作为细胞质或膜相关的[gydF4y2Ba22gydF4y2Ba- - - - - -gydF4y2Ba24gydF4y2Ba]。可溶部分(16000 × g上清)用于PES淋巴结间的免疫印迹(图2)。gydF4y2Ba5gydF4y2Ba)含有细胞质和微粒体膜组分。为了确定PES淋巴结间的SUS蛋白是细胞质性的还是与膜相关的,我们将可溶性部分以100,000 x g离心去除微粒体膜并重复免疫印迹。结果表明,PES节间的SUS亚型是可溶性细胞质蛋白,而不是膜相关蛋白(图2)。gydF4y2Ba6gydF4y2Ba).凝胶中的免疫反应带被洗脱,胰蛋白酶消化,并通过质谱分析。总共分析了44个独特的肽,对应于SUS1中805个氨基酸中的426个(覆盖率为53%)。基于GenBank中可用序列和RNA-seq数据(gydF4y2Bahttp://plantgrn.noble.org/AGED/gydF4y2Ba), 90 kDa波段的蛋白鉴定为MsSUS1。gydF4y2Ba
从对照植物的苜蓿根瘤提取物中鉴定出一个主要和一个次要的免疫反应性SUS多肽(图2)。gydF4y2Ba6gydF4y2Ba).结节中的两种SUS多肽均位于细胞质部分,而在膜相关部分中未检测到SUS蛋白。免疫印迹显示,结节内主要的SUS多肽与来自茎的细胞质MsSUS1共同迁移。质谱分析也确定结节中主要的SUS多肽为MsSUS1。这些结果与该报告一致gydF4y2BaSUS1gydF4y2Ba直接同源的gydF4y2Bam . truncatulagydF4y2Ba(gydF4y2Ba11gydF4y2Ba),gydF4y2Bal .对虾gydF4y2Ba(gydF4y2Ba12gydF4y2Ba]在根瘤和茎中均表达。gydF4y2Ba
的影响gydF4y2BaMsSUS1gydF4y2Ba对其他的下调gydF4y2BaSUSgydF4y2Ba成绩单gydF4y2Ba
我们确定了四个gydF4y2BaSUSgydF4y2Ba苜蓿的异构体,gydF4y2BaMsSUS1, MsSUS2, MsSUS3gydF4y2Ba,gydF4y2BaMsSUS5gydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba),使用苜蓿RNA-seq数据(gydF4y2Bahttp://plantgrn.noble.org/AGED/gydF4y2Ba).所鉴定的紫花苜蓿基因是紫花苜蓿的同源基因gydF4y2BaMtSUS1gydF4y2Ba,gydF4y2BaMtSUS2, MtSUS3gydF4y2Ba,gydF4y2BaMtSUS5gydF4y2Ba基因(gydF4y2Ba25gydF4y2Ba]先前在gydF4y2Bam . truncatulagydF4y2Ba(附加文件gydF4y2Ba2gydF4y2Ba)gydF4y2Ba.gydF4y2Ba利用四种紫花苜蓿的序列数据gydF4y2BaSUSgydF4y2Ba我们为同种异构体设计了引物gydF4y2BaMsSUS1, MsSUS2, MsSUS3gydF4y2Ba,gydF4y2BaMsSUS5gydF4y2Ba(附加文件gydF4y2Ba3.gydF4y2Ba),并测量了这四种转录物的丰度gydF4y2BaSUSgydF4y2Ba植物中的同种异构体含有gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba构建(M17, M18)相对于转基因控制系M22。在ES和PES节点间,gydF4y2BaMsSUS3gydF4y2Ba转录本的相对表达量很低gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba变换后的线(图1)gydF4y2Ba7gydF4y2Ba),表明转基因也引起了gydF4y2BaMsSUS3。gydF4y2Ba然而,没有观察到下调gydF4y2BaMsSUS2gydF4y2Ba和gydF4y2BaMsSUS5gydF4y2Ba成绩单gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba变换后的线(图1)gydF4y2Ba7gydF4y2Ba).的表达gydF4y2BaMsSUS2gydF4y2Ba和gydF4y2BaMsSUS5gydF4y2Ba与ES提取物免疫印迹中出现的小条带一致(图2)。gydF4y2Ba5gydF4y2Ba)和低水平的gydF4y2Ba原位gydF4y2Ba在ES末端的SUS活性gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba变换后的线(图1)gydF4y2Ba4 gydF4y2Ba).gydF4y2Ba
SUS下调不会产生突变表型gydF4y2Ba
尽管在M18和M17的茎节间大部分不存在SUS酶活性(图2)。gydF4y2Ba3.gydF4y2Ba),与对照(M22)相比,这些植株没有表现出明显的茎型。我们比较了对照(M22)和对照(M22)的地上部和根系生物量积累gydF4y2BaMsSUS1gydF4y2Ba下调线(表1gydF4y2Ba1gydF4y2Ba).结果显示,有少量(11%)显著的(gydF4y2BaPgydF4y2Ba< 0.05),与对照(M22)相比,M17的地上部生物量和总生物量减少。然而,M18和M22之间没有显著差异。我们还研究了gydF4y2BaMsSUS1gydF4y2Ba下调干细胞壁糖成分(附加文件)gydF4y2Ba4 gydF4y2Ba).结果表明,纤维素(葡萄糖)的量在两种玉米中没有差异gydF4y2BaMsSUS1gydF4y2Ba下调系(M17、M18)和对照系(M22)。小的统计显著性(gydF4y2BaPgydF4y2Ba< 0.05)总细胞壁和半乳糖含量在M18中发生变化,而在M17中没有(附加文件)gydF4y2Ba4 gydF4y2Ba).细胞壁含量的变化可能局限于维管组织,因此在整个茎分析中无法检测到显著差异。gydF4y2Ba
的影响gydF4y2BaMsSUS1gydF4y2Ba下调转化酶和gydF4y2Ba原位gydF4y2Ba中性转化酶的酶分析gydF4y2Ba
我们研究了在植物中缺乏显着突变表型的可能性gydF4y2BaMsSUS1gydF4y2Ba茎中的下调是转化酶活性的结果。因此,我们测量了对照系和下调系ES和PES节间的酸性、碱性和中性转化酶活性。对于酸性转化酶,我们评估了ES和PES节间液泡(可溶性)和细胞壁(不可溶性)形式的活性。结果表明,相对于PES节间,ES的液泡酸转化酶活性非常高(图2)。gydF4y2Ba8gydF4y2Ba)在对照组(M22)和gydF4y2BaMsSUS1gydF4y2Ba下调系(M17、M18)。这一结果是意料之中的,因为液泡酸转化酶在渗透调节中起作用,并且在细胞分裂和伸长区域高度表达[gydF4y2Ba26gydF4y2Ba],发生在ES节间。与对照M22相比,M18的ES节间液泡酸转化酶略有降低,而M17的ES节间液泡酸转化酶与对照相比差异不显著(图2)。gydF4y2Ba8gydF4y2Ba).稻瘟病菌节间空泡酸转化酶活性在对照系和下调系之间无显著差异。不溶性酸转化酶活性在ES和PES样品之间没有显着差异,与液泡酸转化酶相比,表达水平相对较低(图2)。gydF4y2Ba8 bgydF4y2Ba).gydF4y2BaMsSUS1gydF4y2Ba与对照相比,下调系的不溶性酸转化酶活性无显著差异。总的来说,结果表明gydF4y2BaSUS1gydF4y2Ba下调对ES或PES节间酸转化酶活性的影响很小或没有影响。gydF4y2Ba
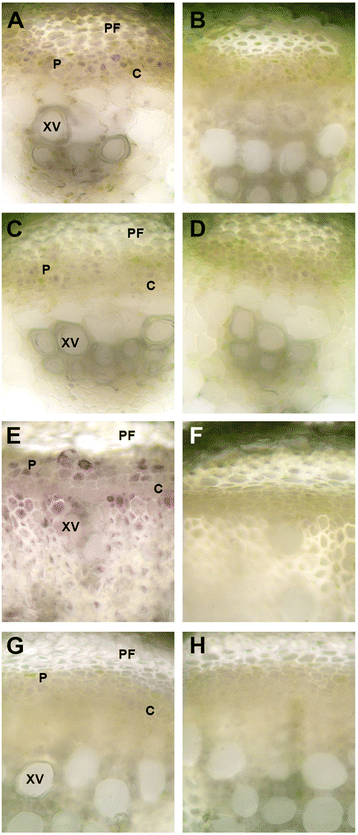
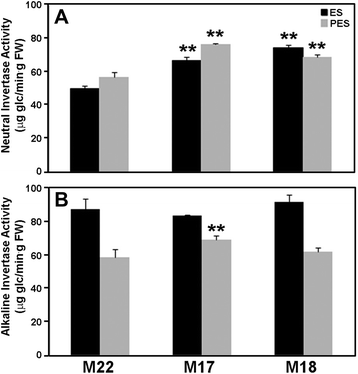
与酸性转化酶活性相反,gydF4y2BaMsSUS1gydF4y2Ba下调导致显著的(gydF4y2BaPgydF4y2Ba< 0.01),中性转化酶活性升高。与M22相比,M17和M18 ES节间的中性转化酶活性分别增加了1.3- 1.5倍。gydF4y2Ba9gydF4y2Ba).同样,在PES中,M17和M18的节间中性转化酶分别比M22增加了1.4倍和1.2倍。相比之下,对照和对照间ES节间碱性转化酶活性无显著差异gydF4y2BaMsSUS1gydF4y2Ba下调谱线(图2)gydF4y2Ba9 bgydF4y2Ba).M17的PES节间碱性转化酶活性比对照M22高1.2倍,而M18的活性与对照相似。一个gydF4y2Ba原位gydF4y2Ba采用ES和PES茎横切面酶测定法对对照和对照植株的中性转化酶活性进行定位gydF4y2BaMsSUS1gydF4y2Ba理气行。结果表明,中性转化酶活性定位于与SUS相同的维管组织(木质部、韧皮部)。gydF4y2Ba10 a, egydF4y2Ba).此外,在M18下调转化的维管组织中,中性转化酶活性得以维持,而SUS活性则大大降低(图2)。gydF4y2Ba10 c、ggydF4y2Ba).gydF4y2Ba
的比较gydF4y2Ba原位gydF4y2Ba在对照(M22)的伸长茎(ES)和后伸长茎(PES)的茎横截面和节间中测定了中性转化酶活性gydF4y2BaMsSUS1gydF4y2Ba下调线(M18)。gydF4y2Ba一个gydF4y2BaM22的ES节间;(gydF4y2BacgydF4y2Ba), M18的ES节间;(gydF4y2BaegydF4y2Ba), M22的PES节点间;(gydF4y2BaggydF4y2Ba), M18的PES节间。gydF4y2BabgydF4y2Ba,gydF4y2BadgydF4y2Ba,gydF4y2BafgydF4y2Ba,gydF4y2BahgydF4y2Ba阴性对照(检测培养基中不含蔗糖)gydF4y2Ba一个gydF4y2Ba,gydF4y2BacgydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BaggydF4y2Ba,分别。缩写:PF,韧皮部纤维;P,韧皮部;C,形成层;木质部导管gydF4y2Ba
讨论gydF4y2Ba
本研究探讨了下调的作用gydF4y2BaMsSUS1gydF4y2Ba在紫花苜蓿的ES和PES节间。我们最初的目的,是要过度表达gydF4y2BaMsSUS1gydF4y2Ba在苜蓿茎维管组织中,纤维素的增加反而导致茎维管组织中纤维素的下调gydF4y2BaMsSUS1gydF4y2Ba成绩单(无花果。gydF4y2Ba2gydF4y2Ba)和SUS酶活性(图2)。gydF4y2Ba3.gydF4y2Ba).在苜蓿茎组织中,SUS的下调没有导致明显的表型变化,细胞壁糖组成也没有显著变化。然而,在SUS下调系的茎中发现A/N转化酶活性增加,酸转化酶水平仍然很高。以前的研究gydF4y2Ba答:芥gydF4y2Ba和gydF4y2Bal .对虾gydF4y2Ba发现SUS活性的丧失对植物表型几乎没有影响,而转化酶活性的丧失会导致严重的生长迟缓[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba]。我们的研究结果表明,MsSUS1和MsSUS3不是苜蓿正常营养生长所必需的,并支持转化酶在蔗糖分解代谢中的主要作用。然而,我们不能排除血管组织中的A/N转化酶和可能的酸转化酶可以补偿SUS活性的降低。gydF4y2Ba
下调的gydF4y2BaSUS1gydF4y2Ba植物茎中含有的转录本gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba构建可能是由于转基因沉默(共抑制)。当转基因的过表达导致转基因和内源同源基因的下调时,就会发生转基因沉默[gydF4y2Ba27gydF4y2Ba- - - - - -gydF4y2Ba29gydF4y2Ba]。我们的结果表明gydF4y2BaMsSUS1gydF4y2Ba在苜蓿茎维管组织中高度表达。用于编码序列表达的PEPC7-P4启动子可导致GUS在维管组织中的高水平表达(图2)。gydF4y2Ba1gydF4y2Ba).在本研究生成的转化苜蓿植株中,gydF4y2BaMsSUS1gydF4y2Ba在茎维管组织中,它已经高度表达,可能导致沉默。qRT-PCR检测结果显示gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba可能还会沉默吗gydF4y2BaMsSUS3gydF4y2Ba(无花果。gydF4y2Ba7gydF4y2Ba).在以往的研究中,SUS的过表达增加了杂交杨树的纤维素gydF4y2BaSUSgydF4y2Ba棉花基因与异源启动子[j]gydF4y2Ba15gydF4y2Ba]。共抑制的机制尚不完全清楚,但认为当转录物超过特定阈值时发生[gydF4y2Ba30.gydF4y2Ba]。显然,转基因表达gydF4y2BaMsSUS1gydF4y2Ba在血管组织中超过触发共抑制所需的阈值。我们还发现gydF4y2BaMsSUS1gydF4y2Ba在根和根瘤中表达下调gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba构建(未发表的结果)表明共抑制发生在整个植物中。gydF4y2Ba
以前的研究gydF4y2Ba答:芥gydF4y2Ba,gydF4y2Bam . truncatulagydF4y2Ba,gydF4y2Bal .对虾gydF4y2Ba鉴定出多种同种异构体gydF4y2BaSUSgydF4y2Ba它们以某种器官特异性表达gydF4y2Ba8gydF4y2Ba,gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba]。在gydF4y2Bam . truncatulagydF4y2Ba,gydF4y2BaMtSUS1gydF4y2Ba是在所有器官中主要表达的异构体,并且在茎、根和结节的血管细胞中表达增强[gydF4y2Ba25gydF4y2Ba]。的同种型gydF4y2BaMtSUS3gydF4y2Ba的茎中也高度表达gydF4y2Bam . truncatulagydF4y2Ba.厘清这六个角色gydF4y2BaSUSgydF4y2Ba亚型在gydF4y2Ba答:芥gydF4y2Ba构建了单敲除突变体和双敲除突变体。特异性同种异构体的消除不会导致明显的表型。然而,一个gydF4y2Basus1 / sus4gydF4y2Ba突变体在低氧土壤条件下体重增加减少[gydF4y2Ba8gydF4y2Ba]。对四重突变体(gydF4y2Basus1 / sus2 / sus3 / sus4gydF4y2Ba)发现与野生型相比,叶片或根的淀粉和糖含量、种子重量或脂质含量、纤维素含量或细胞壁结构没有变化[gydF4y2Ba17gydF4y2Ba]。相比之下,gydF4y2Ba答:芥gydF4y2Ba细胞质中性转化酶双突变体(gydF4y2Bacinv1 / cinv2gydF4y2Ba)减少了根和茎的生长,根膨大区细胞异常大,柱、内胚层和皮层细胞分裂异常,表明转化酶在正常生长中起着关键作用[gydF4y2Ba17gydF4y2Ba]。研究gydF4y2Bal .对虾gydF4y2Ba发现主要的转化酶异构体LjINV1对整个植物的发育至关重要,但对根瘤的形成或功能不是必需的[gydF4y2Ba18gydF4y2Ba]。维管组织的能量代谢、胼胝质和细胞壁纤维素合成所需的结构碳的合成,以及维持韧皮部运输流正常运作所需的膨润,都需要糖解活性[gydF4y2Ba16gydF4y2Ba,gydF4y2Ba26gydF4y2Ba,gydF4y2Ba31gydF4y2Ba]。我们的研究结果表明,转化酶可以提供维管组织所需的蔗糖分解活性。然而,我们不能排除额外的SUS异构体对糖解活性的补偿。四朵苜蓿gydF4y2BaSUSgydF4y2Ba我们确定的同种异构体可以根据其相对于对照的表达模式分为两组(图2)。gydF4y2Ba7gydF4y2Ba).gydF4y2BaMsSUS1gydF4y2Ba和gydF4y2BaMsSUS3gydF4y2Ba与对照相比,下调株系的转录物积累极低。相比之下,gydF4y2BaMsSUS2gydF4y2Ba和gydF4y2BaMsSUS5gydF4y2Ba转录水平类似或略高gydF4y2BaMsSUS1gydF4y2Ba相对于控制线的下调线。茎节间提取物免疫印迹中发现的小条带(图2)。gydF4y2Ba5gydF4y2Ba)可能对应于这些同工异构体。较小的条带可能不是MsSUS1,因为这些条带在下调的植物中缺乏。我们从同一转基因系的根中提取的分离蛋白的凝胶中对相似的小条带进行了测序,鉴定出了MsSUS2和MsSUS3(未发表的结果)。gydF4y2Ba
以前关于转化酶在非光合器官中的基本功能的报道[gydF4y2Ba17gydF4y2Ba,gydF4y2Ba18gydF4y2Ba,gydF4y2Ba32gydF4y2Ba,gydF4y2Ba33gydF4y2Ba]强调需要进一步研究转化酶在高等植物中的调节和功能,包括它们在调节碳交换和淀粉积累的信号通路中的作用。A/N转化酶存在于多个细胞位置(细胞质、叶绿体、线粒体、细胞核),表明其在细胞器内部和细胞器之间的代谢过程中起协调作用。据推测,细胞质转化酶通过控制蔗糖、葡萄糖和果糖的胞质浓度,在维持SUS活性较低的细胞中的糖稳态中发挥关键作用[gydF4y2Ba34gydF4y2Ba]。我们的研究表明,酸转化酶活性高,A/N转化酶在ES和PES节间均升高gydF4y2BaMsSUS1gydF4y2Ba相对于对照,下调的植物品系(图2)。gydF4y2Ba9gydF4y2Ba).在继发细胞壁合成发生的PES节间,A/N转化酶活性比对照组高1.2- 1.4倍gydF4y2BaMsSUS1gydF4y2Ba与PES节间对照相比,下调的细胞系较多。这表明转化酶提供了纤维素合成所需的葡萄糖。转化酶也可能提供维持韧皮部蔗糖转运所需的蔗糖分解活性。在茎中,由于韧皮部和外质体之间的浓度梯度很大,因此从运输韧皮部不断地泄漏蔗糖[gydF4y2Ba35gydF4y2Ba]。至关重要的是,泄漏的蔗糖被回收,以保持膨胀压力,驱动蔗糖从源到汇的流动。蔗糖的回收机制包括通过利用质膜H产生的质子动力的蔗糖/质子同调体进行摄取gydF4y2Ba+gydF4y2Baatp酶(gydF4y2Ba36gydF4y2Ba]。蔗糖裂解提供了生成ATP所需的碳,从而为质膜H提供燃料gydF4y2Ba+gydF4y2Ba腺苷三磷酸酶。如果韧皮部中的蔗糖恢复功能依赖于SUS对蔗糖的切割,那么蔗糖转运将显著减少gydF4y2BaMsSUS1gydF4y2Ba下调的细胞系导致生长抑制。由于维管组织中SUS的下调只导致植物生物量积累的少量减少,因此韧皮部中的转化酶活性似乎能够提供蔗糖回收所需的能量,但可能存在能量惩罚。转化酶裂解蔗糖的能量效率低于SUS裂解。也有可能是由于氧气扩散有限和代谢率高,苜蓿茎经历缺氧(缺氧)。缺氧导致从有氧呼吸到无氧呼吸的转换,这对ATP的产生效率较低。在缺氧条件下,SUS对蔗糖的裂解在能量上比转化酶的水解更有利。在gydF4y2BaMsSUS1gydF4y2Ba蔗糖被转化酶切割所带来的能量损失可能导致植物生长速度减慢和/或生物量积累减少。与对照相比,调控下调植株的茎部生物量积累显著减少,这表明苜蓿茎部可能经历了缺氧,并降低了转化酶活性gydF4y2BaMsSUS1gydF4y2Ba下调调控的植物会受到能量损失。gydF4y2Ba
据报道,SUS在植物生长发育中具有其他重要作用。豆科植物的根瘤含有高浓度的SUS [gydF4y2Ba12gydF4y2Ba,gydF4y2Ba25gydF4y2Ba]有研究表明,根瘤维管系统中的中柱鞘细胞在蔗糖转运到固氮区以及固氮过程中产生的氮化合物进入木质部的过程中起着关键作用[gydF4y2Ba37gydF4y2Ba]。此外,大多数研究表明,在缺氧或低氧条件下,根的SUS活性增强,而A/N转化酶活性降低[gydF4y2Ba14gydF4y2Ba,gydF4y2Ba38gydF4y2Ba,gydF4y2Ba39gydF4y2Ba]。SUS下调的苜蓿品系可以为进一步研究SUS和转化酶在蔗糖转运和渗透胁迫耐受中的相对作用提供有用的工具。gydF4y2Ba
结论gydF4y2Ba
我们检查了它的表达gydF4y2BaMsSUS1gydF4y2Ba在维管组织中会增加苜蓿细胞壁的纤维素含量。与预期相反,紫花苜蓿植物变成了紫花苜蓿gydF4y2BaMsSUS1gydF4y2Ba利用苜蓿启动子进行血管特异性表达导致茎节间转录本、蛋白和SUS酶活性下调。下调最有可能是由于转基因沉默(共抑制)。而下调SUS活性对植株干重和茎部细胞壁含量的影响较小。血管细胞A/N转化酶活性升高gydF4y2BaMsSUS1gydF4y2Ba下调的植物和转化酶似乎提供了细胞壁合成和维持韧皮部蔗糖转运所需的蔗糖水解活性。gydF4y2Ba
方法gydF4y2Ba
植物转化载体的构建gydF4y2Ba
此前,苜蓿结节增强磷酸烯醇丙酮酸羧化酶基因的启动子片段PEPC7-P4gydF4y2BaPEPC-7gydF4y2Ba(L39371)由相对于转录起始位点的- 592 ~ 86个核苷酸组成,克隆并插入gydF4y2BaXbagydF4y2Ba我和gydF4y2BaSmagydF4y2Ba1植物表达载体pBI101.1中的限制性位点[gydF4y2Ba40gydF4y2Ba产生…gydF4y2BaPEPC7-P4:格斯gydF4y2Ba嵌合报告基因[gydF4y2Ba19gydF4y2Ba]。本研究对PEPC7-P4启动子进行了测序,发现了一个56 bp的直接重复序列,这在原始基因序列提交中没有报道。序列校正已提交给GenBankgydF4y2BaPEPC-7gydF4y2Ba基因。在早期的一项研究中,从一个结节增强的蔗糖合酶基因(gydF4y2BaMsSUS1gydF4y2Ba;AF049487)被分离并克隆到pBluescript [gydF4y2Ba41gydF4y2Ba]。在这项研究中gydF4y2BagusAgydF4y2Ba序列中gydF4y2BaPEPC7-P4:格斯gydF4y2BaConstruct被an取代gydF4y2BaXmagydF4y2Ba我- - - - - -gydF4y2Ba囊gydF4y2BaI片段包含gydF4y2BaMsSUS1gydF4y2BacDNA来产生gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba表达载体。克隆DNA片段的核苷酸序列在明尼苏达大学生物医学基因组学中心进行了测序验证。gydF4y2Ba
植物转化及转化品系的选择gydF4y2Ba
以紫花苜蓿(品种Regen SY)为研究对象gydF4y2BaPEPC7-P4:格斯gydF4y2Ba或者是gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba构造的gydF4y2Ba根癌土壤杆菌gydF4y2Ba如前所述[gydF4y2Ba42gydF4y2Ba]。通过卡那霉素抗性筛选转化植株,并通过存在gydF4y2BanptIIgydF4y2Ba如前所述[gydF4y2Ba43gydF4y2Ba]。选择作为转基因对照植株的转化子(M22、M35)含有gydF4y2BaPEPC7-P4:格斯gydF4y2Ba构建,但组织化学染色检测缺乏GUS表达。包含gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba选择进一步评价的结构(M17, M18)的评分最低gydF4y2BaMsSUS1gydF4y2BaqRT-PCR检测表达量。的存在gydF4y2BaPEPC7-P4: MsSUS1gydF4y2Ba构建在gydF4y2BaMsSUS1gydF4y2Ba利用启动子和启动子上的引物进行PCR鉴定gydF4y2BaMsSUS1gydF4y2Ba编码序列。gydF4y2Ba
植物材料和培养条件gydF4y2Ba
选择的初级转化体通过茎扦插无性系繁殖,在温室中生长。由于紫花苜蓿近交系严重衰退,采用了初级转化子。在大多数实验中,植物生长在沙子:土壤混合物(2:1,v/v)中,每个容器一株植物(Stuewe & Sons, Tangent, OR;7厘米宽,35厘米深)。植物在一个随机的完整块中生长,有3或4个重复。每周用含25ppm N的四分之一浓度的霍格兰营养液浇灌植株。gydF4y2Ba44gydF4y2Ba]。在qRT-PCR、免疫印迹和酶分析实验中,每个重复收获10根茎。ES节间(顶端4 - 5节间)和PES节间(茎尖7 - 8节间)采自开花植物[gydF4y2Ba45gydF4y2Ba]。将每个重复的茎材料(约1g新鲜重量)合并,冷冻在液氮中,保存在- 80°C直到检测。在比较转化植株生长情况的实验中,将植株种植在石灰改性的沙子中,并用含有100 ppm n的半强度Hoagland营养液浇灌。每隔四天,植株只接受水。植物在开花的时候收割。在60℃干燥后测定根和芽的干重。的表达gydF4y2BaPEPC7-P4:格斯gydF4y2Ba在根和根瘤中,植物生长在石英砂中。植物接种了gydF4y2BaSinorhizobium melilotigydF4y2Ba(Nitragin®,Novozymes, Davis, CA),每天用不含氮的半强度Hoagland营养液浇灌。gydF4y2Ba
定量逆转录酶PCR (qRT-PCR)gydF4y2Ba
使用RNeasy Plant Mini试剂盒(Qiagen, Valencia, CA)从ES和PES样品中分离RNA。用无dna试剂盒(Ambion Inc., Austin, TX)处理DNase I后,按照制造商的建议,使用Superscript II RT (Invitrogen, Carlsbad, CA)从2 μg总RNA中提取每个样品的第一链cDNA,并在用于PCR之前稀释10倍。基因特异性引物(附加文件gydF4y2Ba3.gydF4y2Ba)的设计基础gydF4y2BaMsSUSgydF4y2Ba从GenBank和苜蓿RNA-seq数据中检索到的异构体序列(附加文件)gydF4y2Ba1gydF4y2Ba;gydF4y2Bahttp://plantgrn.noble.org/AGED/gydF4y2Ba).采用iTaq Universal SYBR Green Supermix (BioRad, Hercules, CA)进行qRT-PCR,反应浓度为12.5 μL,正反引物各4 pmol,模板cDNA各2.5或3.0 μL。三个生物重复的样本在StepOnePlus上一式三份运行gydF4y2BaTMgydF4y2BaReal-Time PCR系统(应用生物系统公司,Grand Island, NY)遵循制造商的建议。PCR条件为:95°C预变性30s, 95°C预变性30s, 95°C预变性30s, 60°C预变性30s, 40个循环,然后依次生成熔化曲线(95°C, 60°C, 95°C预变性15s)。StepOne软件(Applied Biosystems)用于数据收集。检查每个扩增子的解离曲线以确认单个扩增子的存在。熔化曲线显示只有一个gydF4y2BaSUSgydF4y2Ba对转录物进行了测量,证明引物对每个亚型的转录物都是特异性的。每个样本的相对转录本积累量使用比较CgydF4y2BatgydF4y2Ba方法(gydF4y2Ba46gydF4y2Ba使用CgydF4y2BatgydF4y2Ba取苜蓿肌动蛋白基因(JQ028730.1)的值进行归一化。gydF4y2Ba
SUS酶测定gydF4y2Ba
ES和PES节间样品(0.3 g)用臼杵在3.0 mL萃取缓冲液中研磨[100 mM MES, pH 6.8, 15% (v/v)乙二醇,2% (v/v) β-巯基乙醇,60 mg聚乙烯聚吡罗烷酮(PVPP), 30 μL 0.1 M苯甲磺酰氟(PMSF), 30 μL蛋白酶抑制剂混合物(Sigma-Aldrich, St. Louis, MO)]。匀浆在4℃离心(16800 x g, 25 min)。将上清液应用于在萃取缓冲液中平衡的脱盐柱(PD minitrap G-25, GE Healthcare, Buckinghamshire, UK)。该洗脱液用于测定。酶活性测定于1 mL反应混合物中,该反应混合物含有50 mM HEPES, pH 7.4, 2 mM醋酸镁,5 mM二硫苏糖醇(DTT), 2 mM EGTA, 50 mM蔗糖,1 mM焦磷酸钾,1 mM UDP, 1 mM NAD, 0.02 mM d -葡萄糖-1,6-二磷酸,磷酸葡萄糖糖化酶,尿苷-5 ' -二磷酸葡萄糖焦磷酸酶和葡萄糖6-磷酸脱氢酶各1单位gydF4y2Ba明串珠菌属mesenteroidesgydF4y2Ba;Sigma-Aldrich)。使用Thermo Scientific Genesys 6分光光度计(Thermo Electron Corp., Madison, WI - fi)在340 nm(24°C)处测量吸光度来监测酶活性。gydF4y2Ba
转化酶测定gydF4y2Ba
酸转化酶测定方法改编自Sergeeva等人。[gydF4y2Ba47gydF4y2Ba]。将ES和PES节间的冷冻组织(0.4 g)用液氮在研钵和杵中研磨,然后在2 mL萃取缓冲液(50 mM HEPES·KOH, pH 7.4, 5 mM MgCl)中均质gydF4y2Ba2gydF4y2Ba, 1 mM EGTA, 1 mM EDTA, 5 mM DTT, 10%甘油,40 mg PVPP, 20 μL 0.1 M PMSF, 20 μL蛋白酶抑制剂鸡尾酒用于植物细胞和组织提取物[Sigma-Aldrich]。将匀浆离心(16,800 x g, 1分钟,4°C),将上清转移到冰上的新鲜试管中,用于测定可溶性(液泡)酸转化酶。用1 mL萃取缓冲液减去PVPP和DTT洗涤三次。洗涤包括均质球,然后离心(16,800 x g, 4°C)。前两次洗涤离心1分钟,最后一次洗涤离心5分钟。洗涤后的颗粒重悬于提取缓冲液中,萃取缓冲液由20 mM MES·KOH, pH 6.0, 1 M NaCl组成,在4°C下孵育过夜。第二天,将悬浮液离心(16,800 x g, 20分钟,4°C),将上清转移到冰上的新鲜管中,用于细胞壁结合酸转化酶的测定。细胞壁和可溶性酸性转化酶的测定采用两步法,包括葡萄糖生成(反应a)和随后的葡萄糖分光光度法(反应B),包括NAD还原(反应B)。可溶性酸性转化酶的测定,反应a培养基中含有150 μL植物提取物,200 μL 150 mM柠檬酸-磷酸盐缓冲液,pH为4.5,50 μL 400 mM蔗糖。实验在30℃下进行,10 min后停止,将试管置于沸水浴中4 min。试管在室温下离心,使沉淀的蛋白质成球。对照在没有添加蔗糖的情况下运行,并在最终计算中用于背景减法。 The reaction B assay cuvette contained 450 μl of 2X HEPES assay buffer (100 mM HEPES, pH 7.4, 4 mM Mg acetate, 10 mM DTT, 4 mM EGTA), 100 μL substrate mix (10 mM NAD and 5 mM ATP in sterile water) and boiled reaction A (25 μL and 100 μL for ES and PES extracts, respectively) and water (375 μL and 300 μL for ES or PES tissue extracts, respectively). The reaction was run to completion (3 min) and background absorbance was measured at 340 nm using a Thermo Scientific Genesys 6 spectrophotometer. Next, 50 μL of an enzyme mix [1 unit each of hexokinase and glucose 6-phosphate dehydrogenase (froml . mesenteroidesgydF4y2Ba;将Sigma-Aldrich(2倍HEPES实验缓冲液)混合到每个实验皿中,室温孵育15分钟。对每个反应进行吸光度读数,并使用吸光度的变化来计算葡萄糖含量。细胞壁酸性转化酶测定方法与可溶性酸性转化酶测定方法相同,只是在pH为4.8的条件下,用50 μL细胞壁提取物进行反应A,用200 μL反应A进行NAD还原试验(反应B)。gydF4y2Ba
对于碱性和中性转化酶检测,除PVPP不包括在内,组织在用于提取酸性转化酶的缓冲液中提取。提取液离心(16800 x g, 25 min, 4°C)。除了反应a的缓冲液分别由100 mM HEPES-NaOH (pH 7.5)或100 mM硼酸钠(pH 9.4)组成,用于测量中性和碱性转化酶的活性外,这两种酶的活性都是用上述两步法测定酸性转化酶的活性。反应A中含有100 μL ES或50 μL PES提取物用于测定中性转化酶,100 μL ES或PES提取物用于测定碱性转化酶。对于ES和PES提取物的中性转化酶检测,反应B中分别加入200 μL的煮沸反应A。对于碱性转化酶检测,反应B中分别加入200 μL和100 μL的煮沸反应A。在Tris存在的情况下也进行碱性和中性转化酶试验,以检查已知的Tris抑制作用。gydF4y2Ba
试验在三个生物重复中进行了三次。采用InStat (GraphPad, San Diego, CA)方差函数分析和Dunnett多重比较事后检验进行统计分析,将下调系与对照组进行比较。gydF4y2Ba
蛋白提取和免疫印迹gydF4y2Ba
用研臼和杵在液氮中研磨0.4 g茎组织,加入2 mL提取缓冲液(100 mM MES, pH 6.8, 15%乙二醇,2% β-巯基乙醇,100 mM蔗糖,20 μL 0.1 M PMSF)提取蛋白质。离心后(16000 × ggydF4y2Ba,gydF4y2Ba20分钟,4°C)将上清转移到新鲜试管中,使用Bio-Rad蛋白测定试剂(Bio-Rad, Hercules, CA)对蛋白质进行定量。在10% SDS-PAGE凝胶上分离蛋白质[gydF4y2Ba48gydF4y2Ba并转移到硝化纤维上。用玉米蔗糖合酶2 (SS2)抗血清检测SUS;(gydF4y2Ba21gydF4y2Ba])。使用Precision Plus双蛋白标准(Bio-Rad)来估计分子量。结合抗体用SuperSignal West Pico Chemiluminescent Substrate kit (Thermo Scientific, Rockford, IL)可视化。gydF4y2Ba
SUS蛋白的质谱分析gydF4y2Ba
按照上述方法提取M22(对照)的PES节间总可溶性蛋白,并用10% SDS-PAGE凝胶分离。与MsSUS1抗体反应带相对应的蛋白带,通过免疫印迹分析确定在凝胶上运行的相同车道,被切除并进行凝胶内胰蛋白酶消化。来自M22 PES组织的MsSUS1基因由明尼苏达大学质谱和蛋白质组学中心进行MS/MS鉴定。LC/MS样品使用Sequest (Thermo Fisher Scientific, San Jose, CA, version 27)进行分析。Sequest被设置为搜索非冗余的gydF4y2Bam . truncatulagydF4y2Ba数据库修改为包含GenBank条目AF049487gydF4y2BaMsSUS1gydF4y2Ba成绩单。Scaffold(版本3.6.0,Proteome Software Inc., Portland, OR)用于验证基于LC/MS的肽和蛋白质鉴定。如果Peptide Prophet算法规定的多肽鉴定的建立概率大于95%,则接受其鉴定[gydF4y2Ba49gydF4y2Ba]。如果蛋白质鉴定的建立概率大于99%,并且含有至少两个已鉴定的肽,则接受蛋白质鉴定。蛋白质概率由Peptide Prophet算法分配[gydF4y2Ba50gydF4y2Ba]。gydF4y2Ba
蔗糖合酶和中性转化酶gydF4y2Ba原位gydF4y2Ba酶化验gydF4y2Ba
SUS和中性转化酶gydF4y2Ba原位gydF4y2Ba通过酶活性与硝基蓝四氮唑(NBT)的还原和沉淀进行酶学分析。ES和PES样品的横切面(100-150 μm)用雪橇切片机切割。切片立即通过将固定介质应用于刀和每个新制备的茎切片进行固定。固定介质为1%多聚甲醛,2% (w/v)聚乙烯吡咯烷酮40,5 mM DTT, pH 7.0。组织在室温下固定30分钟至1.5小时。固定后,切片在水中冲洗三次,然后在4°C下水洗3小时。冷水在3小时内刷新一次。蔗糖合酶测定按wititch和Vreugdenhil [gydF4y2Ba51gydF4y2Ba]除蔗糖浓度为100 mM,室温孵育时间为1 h外。检测培养基中含有:100 mM蔗糖,15 mM UDP, 15 mM PPi, 150 mM NAD, 3 mM葡萄糖-1,6-二磷酸,1单位磷酸葡萄糖糖化酶,1单位葡萄糖-6-磷酸脱氢酶,1单位UDPG焦磷酸化酶,50 mM HEPES-KOH, pH 7.5, 1 mM EDTA, 1 mM EGTA, 0.1%牛血清白蛋白(BSA), 5 mM MgClgydF4y2Ba2gydF4y2Ba0.07% NBT。中性转化酶gydF4y2Ba原位gydF4y2Ba检测培养基含有:50 mM HEPES-KOH, pH 7.5, 1 mM EDTA, 1 mM EGTA, 1 mM NAD, 5 mM ATP, 100 mM蔗糖,0.1% BSA, 0.03% NBT,葡萄糖-6-磷酸脱氢酶,己糖激酶和磷酸糖异构酶各1单位,100 mM蔗糖,1 mM NAD, 5 mM ATP, 0.03% NBT。ES节间在室温下检测1小时,PES节间在室温下检测过夜。阴性对照在试验培养基中不加蔗糖。gydF4y2Ba
组织化学GUS分析gydF4y2Ba
GUS活性检测方法如Udhe-Stone等人所述。[gydF4y2Ba52gydF4y2Ba]。使用尼康DXM1200数码相机连接的尼康SMZ800立体镜拍摄染色茎切片的显微照片。gydF4y2Ba
细胞壁分析gydF4y2Ba
10茎(从顶端测量45厘米)在开花时收获,并为每个重复组合。采用Uppsala膳食纤维法测定干细胞壁糖组成[gydF4y2Ba53gydF4y2Ba]如前所述[gydF4y2Ba54gydF4y2Ba]。采用R的方差函数分析进行统计分析[gydF4y2Ba55gydF4y2Ba]。gydF4y2Ba
支持数据的可用性gydF4y2Ba
支持本文结果的数据集包含在本文及其附加文件中。gydF4y2Ba
参考文献gydF4y2Ba
Samac DA, Jung H-JG, Lamb JFS。紫花苜蓿的发展(gydF4y2Ba紫花苜蓿gydF4y2Bal)作为生产乙醇和其他生物产品的原料。编辑:Minteer SD,编辑酒精燃料。博卡拉顿:CRC出版社;2006.p . 79 - 98。gydF4y2Ba
恩格斯FM, Jung HG.苜蓿茎组织:细胞壁发育和木质化。安博。1998;82:561-8。gydF4y2Ba
荣格HG,恩格斯FM。苜蓿茎组织:细胞壁沉积、组成和可降解性。作物科学。2002;42:524-34。gydF4y2Ba
李建军,李建军,李建军,等。在棉纤维次生细胞壁合成过程中,发现了一种新的蔗糖合酶异构体。植物生理学报。2011;37(4):444 - 444。gydF4y2Ba
藤井S, Hatyashi T, Mizuno K.蔗糖合酶是纤维素合成机器的一个组成部分。植物生理学报,2010;51(1):391 - 391。gydF4y2Ba
popersia D, Cai G, Del Casino C, Faleri C, Willemse MTM, Cresti M.蔗糖合酶与烟草花粉管细胞壁相关。植物生理学报。2008;47(2):1603 - 1608。gydF4y2Ba
Barratt DHP, Barber L, Kruger NJ, Smith AM, Wang TL, Martin C.豌豆蔗糖合酶的多种不同同工型。植物生理学报。2001;27(2):655 - 664。gydF4y2Ba
Bieniawska Z, Barratt DHP, Garlick AP, Thorle V, Kruger NJ, Martin C,等。蔗糖合酶基因家族分析gydF4y2Ba拟南芥gydF4y2Ba.植物学报,2007;49(1):81 - 81。gydF4y2Ba
傅海,金世义,朴卫东。马铃薯Sus4蔗糖合成酶基因的高水平块茎表达和蔗糖诱导需要5 '和3 '侧链序列和先导内含子。植物学报。1995;7:1387-94。gydF4y2Ba
Goren S, Huber S, Granot D.一种新的番茄蔗糖合成酶SISUS4与先前描述的SISUS亚型的比较揭示了与茎成熟相关的不同序列特征和差异表达模式。足底。2011;233:1011-23。gydF4y2Ba
Hohnjec N, Becker JD, Puhler A, Perlick AM, Kuster H.模型豆科植物MtSucS1基因的基因组组织和表达特性gydF4y2BaMedicago truncatulagydF4y2Ba.生物医学进展。1999;26:514 - 522。gydF4y2Ba
Horst I, Welham T, Kelly S, Kaneko T, Sato S, Tabata S,等。的突变体gydF4y2BaLotus对虾gydF4y2Ba揭示氮的同化和固定可以在没有结节增强蔗糖合酶的情况下发生。植物生理学报。2007;44(4):564 - 564。gydF4y2Ba
黄海涛,李建平,李建平,等。甜菜干组织中蔗糖-磷酸合酶、蔗糖合酶和中性转化酶的提取活性和蛋白质含量gydF4y2Ba洋槐pseudoacaciagydF4y2BaL与形成层木材的形成有关。足底。1998;207:266 - 74。gydF4y2Ba
黄春华,李春华。小麦根系蔗糖合酶定位研究进展gydF4y2Ba原位gydF4y2Ba蔗糖合酶的活性与缺氧条件下纤维素沉积使细胞壁增厚有关。足底。2003;217:252-60。gydF4y2Ba
Coleman HD, Yan J, Mansfield SD。蔗糖合酶影响碳分配,增加纤维素产量,改变细胞壁超微结构。科学通报,2009;26(6):888 - 888。gydF4y2Ba
《蔗糖水解的灰姑娘故事:从蓝藻到植物细胞器和细胞器中不可预见的作用的碱性/中性转化酶》。植物科学,2010;18(1):1 - 8。gydF4y2Ba
Barratt DHP, Derbyshire P, Findlay K, Pike M, Wellner N, Lunn J,等。正常生长gydF4y2Ba拟南芥gydF4y2Ba需要胞质转化酶而不是蔗糖合酶。科学通报,2009;26(6):391 - 391。gydF4y2Ba
Welham T, Pike J, Horst I, Flemetakis E, Katinkakis P, Kaneko T,等。18需要细胞质转化酶。模式豆科植物荷花的正常生长和细胞发育。[J] .中国生物医学工程学报,2009;30(2):357 - 357。gydF4y2Ba
Pathirana MS, Samac DA, Roeven R, Yoshioka H, Vance CP, Gantt JS。苜蓿根瘤中磷酸烯醇丙酮酸羧化酶基因结构及表达分析。植物学报。1997;12(3):391 - 391。gydF4y2Ba
Samac DA, Temple SJ。转型的开发利用gydF4y2BaMedicagogydF4y2Ba物种。编辑:Skinner DZ, Liang G。作物的遗传转化。宾汉姆顿:霍沃斯出版社;2004.p . 165 - 202。gydF4y2Ba
引用本文:李春华,李春华,等。正常玉米和萎缩1号玉米蔗糖合酶同工酶的比较。植物生理学。1985;79:530-6。gydF4y2Ba
刘建军,刘建军,刘建军。蔗糖合酶的一种膜相关形式及其在植物纤维素和胼胝质的合成中的潜在作用。科学通报,1995;22(2):357 - 357。gydF4y2Ba
张建军,张建军,张建军,等。玉米蔗糖合成酶基因的克隆、定位和磷酸化特征。植物生理学报。2006;47(1):959 - 971。gydF4y2Ba
王晓华,王晓华。植物糖代谢的调控:关键酶的定位和活性调控。中国生物医学工程学报,2009;35(5):591 - 591。gydF4y2Ba
霍恩杰克N, Perlick AM, Puhler A, Kuster H.gydF4y2BaMedicago truncatulagydF4y2Ba蔗糖合成酶基因MtSucS1在根瘤感染区和被丛枝菌根真菌定殖的根皮质中都被激活。植物与微生物学报。2003;16(3):903 - 15。gydF4y2Ba
唐国强。蔗糖切割酶对植物的发育、生长和碳分配起着至关重要的作用。植物学报,1999;4:1360-85。gydF4y2Ba
李建军,李建军,李建军,李建军,等。拟南芥T-DNA突变体基因的克隆与表达分析。植物细胞。2004;16:2561-72。gydF4y2Ba
王晓明,王晓明,王晓明,等。植物转录后基因沉默的研究进展。中国生物医学工程学报(英文版);2001;22(3):391 - 391。gydF4y2Ba
赵荣华,李建军,李建军,等。H +−atp酶同工异构体的共抑制对植物生长和雄性生殖的影响。植物细胞。2000;12:53 - 46。gydF4y2Ba
Lechtenberg B, Schubert D, Forsbach A, Gils M, Schmidt R.倒序重复T-DNA结构和串联重复转基因的排列都不足以触发转基因沉默。植物科学学报,2003;34(4):591 - 591。gydF4y2Ba
蔗糖合酶在马铃薯块茎和其他植物组织发育中催化一个容易可逆的体内反应。足底。1993;189:329-39。gydF4y2Ba
贾磊,张斌,毛超,李军,吴勇,吴鹏,等。碱性/中性转化酶OxCYT-INV1参与水稻根细胞发育和繁殖(gydF4y2Ba栽培稻gydF4y2Bal .)。足底。2008;228:51-9。gydF4y2Ba
Welham T, Pike J, Horst I, Flemetakis E, Katinakis P, Kanedo T,等。在模型豆科植物中,细胞质转化酶是正常生长和细胞发育所必需的。gydF4y2BaLotus对虾gydF4y2Ba.[J] .中国生物医学工程学报,2009;33(1):444 - 444。gydF4y2Ba
阮Y-L。蔗糖代谢:多种碳利用和糖信号的门户。植物学报,2014;35(5):693 - 693。gydF4y2Ba
帕特里克JW。韧皮部运输生理学基础。见:thompson GA, van Bel AJE,编辑。韧皮部:分子细胞生物学,系统通讯,生物相互作用。牛津:John Wiley & Sons;2013.30-59页。gydF4y2Ba
宋嘉德,舒尔兹A,帕姆格伦MG。植物运输过程的能量化。质膜的作用gydF4y2Ba+gydF4y2Ba腺苷三磷酸酶。植物生理学报。2004;36(6):544 - 544。gydF4y2Ba
刘建军,李建军,李建军,等。大豆根瘤的共塑运输。土壤学报。1995;27(2):387 - 398。gydF4y2Ba
李建军,李建军,李建军,等。糖、己糖激酶和蔗糖合酶对番茄根系缺氧耐受性的影响。植物生理学报。1997;14(4):357 - 357。gydF4y2Ba
曾艳,吴艳,王文伟,柯科赫。低氧对玉米转化酶的快速抑制。转化酶/蔗糖合成酶平衡、糖信号潜能和幼苗存活。植物生理学报。1999;21:599 - 608。gydF4y2Ba
杰斐逊RA。植物嵌合基因的分析:GUS基因融合系统。植物化学学报,1987;5:387-405。gydF4y2Ba
Robinson DL, Trepp G, Gregerson RG, Twary SN, Roeven R, Gantt JS等。苜蓿结节型蔗糖合酶cDNA的克隆及发育表达。编辑:Martinez E, Hernandez G。固氮的亮点。纽约:Kluwer;1999.23-31页。gydF4y2Ba
Samac DA, Austin-Phillips S. Alfalfa (gydF4y2Ba紫花苜蓿gydF4y2Bal .)。In:王凯,编辑。农杆菌属协议。第2版。Totowa: Humana出版社;2006.301 - 12页。gydF4y2Ba
萨鲁尔·P,斯里恩·F,萨默斯,萨马克·d。在转基因苜蓿中生产可生物降解的塑料聚合物聚β-羟基丁酸酯。作物科学。2002;42:19 19 - 92。gydF4y2Ba
霍格兰博士,阿农博士。无土栽培植物的水培方法。加州农业出口协会,1950;347:1-32。gydF4y2Ba
Tesfaye M, Yang SS, Lamb JFS, Jung H-JG, Samac DA, Vance CP,等。gydF4y2BaMedicago truncatulagydF4y2Ba作为双子叶细胞壁发育的模型。生物能源学报,2009;2:59-76。gydF4y2Ba
Schmittgen TD, Livak KJ。采用对比CT法分析实时PCR数据。自然科学进展。2008;3:1101-8。gydF4y2Ba
Sergeeva LI, Keurentjes JJB, Bentsink L, Vonk J, van der Plas LHW, Koornneef M,等。液泡转化酶调节伸长gydF4y2Ba拟南芥gydF4y2Ba通过QTL和突变体分析发现。科学通报,2006;30(3):391 - 391。gydF4y2Ba
Laemmli英国。T4噬菌体头部组装过程中结构蛋白的切割。大自然。1970;227:680-5。gydF4y2Ba
Keller A, Nesvizhskii AI, Kolker E, Aebersold R.基于MS/MS和数据库检索的肽鉴定准确性的实证统计模型。化学学报。2002;44(4):583 - 592。gydF4y2Ba
张建军,张建军,张建军,等。蛋白质的串联质谱分析。化学学报。2003;45(5):446 - 458。gydF4y2Ba
Wittich PE, vreugdenhill D.蔗糖合酶活性在发育玉米籽粒中的定位gydF4y2Ba原位gydF4y2Ba酶组织化学。[J] .中华医学杂志。1998;49(1):1 - 3。gydF4y2Ba
李建军,李建军,李建军,李建军,张建军,张建军,等。植物抗性基因的克隆及其在植物根系中的应用。植物科学学报,2005;44(4):564 - 564。gydF4y2Ba
Theander O, Aman P, Westerlund E, Anderson R, Petersson D.以中性糖残基、醛酸残基和Klason木质素测定总膳食纤维(Uppsala法):合作研究。[J]中国生物医学工程学报,1995;28(3):344 - 344。gydF4y2Ba
Lamb JFS, Jung H-JG, Sheaffer CC, Samac DA。干草和生物量管理制度下苜蓿叶蛋白和干细胞壁多糖产量作物科学。2007;47:1407-15。gydF4y2Ba
团队RDC。R:用于统计计算的语言和环境。奥地利:维也纳统计计算基金会;2010.gydF4y2Bahttps://www.r-project.orggydF4y2Ba.gydF4y2Ba
致谢gydF4y2Ba
我们感谢佛罗里达大学USDA-ARS的Prem Chourey提供的玉米蔗糖合酶(SS2)抗体。作者还要感谢明尼苏达州圣保罗美国农业部农业部植物科学研究部门的Ted Jeo进行细胞壁分析,Melinda Dornbusch进行转基因植物的生产,以及Jon Mack进行植物维护。本出版物中提及的商品名称或商业产品仅用于提供特定信息,并不意味着美国农业部的推荐或认可。这项研究的资金由USDA-ARS CRIS项目2640-12210-002-00D提供。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有竞争利益。gydF4y2Ba
作者的贡献gydF4y2Ba
DAS参与了研究的设计和协调,并起草了稿件。执行BBgydF4y2Ba原位gydF4y2Ba酶分析并修改原稿。SSM进行酶分析、免疫印迹和qPCR分析,并协助修改稿件。SSY评估了转基因植物中的基因表达。JAO分析转录序列并进行统计分析。SS构建植物转化载体。CPV参与了实验设计和协调。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:gydF4y2Ba
用于qRT-PCR引物设计的DNA序列。gydF4y2Ba(docx166kb)gydF4y2Ba
附加文件2:gydF4y2Ba
的系统发育分析gydF4y2Ba紫花苜蓿SUS基因(Ms)gydF4y2Ba,gydF4y2Ba凤仙花(Mt)gydF4y2Ba,gydF4y2Ba拟南芥(At)gydF4y2Ba和gydF4y2Ba,gydF4y2BaPisum sativum (Ps)。gydF4y2Ba(DOCX 188kb)gydF4y2Ba
附加文件3:gydF4y2Ba
qPCR引物序列。gydF4y2Ba(docx62kb)gydF4y2Ba
附加文件4:gydF4y2Ba
对照(M22)细胞壁含量gydF4y2BaPEPC7-P4: MsSUSgydF4y2Ba变压器(M17, M18)。gydF4y2Ba(DOCX 64kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
萨马克,d.a.,布恰雷利,B.,米勒,S.S.gydF4y2Baet al。gydF4y2Ba苜蓿蔗糖合成酶的转基因沉默(gydF4y2Ba紫花苜蓿gydF4y2BaL.)茎维管组织表明转化酶在细胞壁纤维素合成中的作用。gydF4y2BaBMC Plant BiolgydF4y2Ba15,gydF4y2Ba283(2015)。https://doi.org/10.1186/s12870-015-0649-4gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-015-0649-4gydF4y2Ba
关键字gydF4y2Ba
- 生物燃料gydF4y2Ba
- 细胞壁生物合成gydF4y2Ba
- 纤维素gydF4y2Ba
- 基因沉默gydF4y2Ba
- 韧皮部gydF4y2Ba
- 木质部gydF4y2Ba