摘要
背景
Biochar是生物质热解的固体副产物,已经显示了用生物炭修正的土壤来增强各种作物的生产率,并诱导全身植物抗真菌病原体的抗性。本研究的目的是探讨木材生物炭诱导对根结线虫(RKN)的抗性的能力有graminicola在米饭中(栽培稻简历。并探讨其对植物防御机制的组织化学和分子影响。
结果
结果表明,在水稻盆栽培养基中添加1.2%浓度的生物炭对抑制线虫生长最有效,而生物炭渗出液对线虫的生存力、侵染力和生长发育没有直接毒性作用。植物抗性增强与生物炭诱导的H2O2积累以及参与乙烯(ET)信号通路所涉及的基因的转录增强。增加的易感性Ein2b-RNAI线路缺乏ET信令,进一步证实了生物炭诱导的引发至少部分通过ET信号传导。
结论
这些结果表明,生物炭改良剂可以保护受线虫攻击的水稻植株。这种启动效应部分依赖于ET信号通路和H增强2O2积累。
背景
大米是世界上最常见的谷物食品之一。根据联合国粮食及农业组织(粮农组织)的当前预测,2015年世界大米产量将达到CA。500万吨[1].然而,由于培养实践被改变以使用较少的水,因此培养实践已经增加了全世界的土壤丧产(包括线虫)的数量,并且这些病原体对水稻生产产生了潜在的威胁[2].据估计,全世界因植物寄生线虫造成的水稻年产量损失在10%至25%之间[3.].对水稻危害最大的线虫之一是根结线虫(RKN)。有graminicola(mg),导致鸡汤中的胆汁形成。在渗透根伸长区并朝向根尖端迁移到根尖之后,RKN进入血管缸,其中它们用其探测器刺穿细胞壁并从其咽腺注入分泌物进入植物细胞,诱导称为巨细胞的永久喂养位点。[4,5].在集约化种植系统中,rknn几十年来一直使用化学杀线虫剂(如temic、furadan和fenamiphos)进行管理。然而,这些化学品对环境和人类的潜在负面影响已导致禁止或限制使用大多数化学杀线虫剂。随着种植者减少杀线虫剂使用的压力越来越大,而且没有有效的替代品,诱导抗性(IR)或引物作为这种破坏性病原体的新管理工具的兴趣越来越大。
灌注是由特殊刺激引发的增强防御能力的生理状态,其中植物的先天防御在真菌,细菌,病毒或线虫的随后攻击时具有快速活化的增强[6].总的来说,已经描述了两种导致植物防御增强的主要途径,它们是由诱导子和调节途径的性质区分的[7].全身获得性抗性(SAR)与致病相关(PR)蛋白的产生相关,并由水杨酸(SA)依赖过程介导,通常以超敏反应开始,导致局部坏死。诱导系统抗性(Induced systemic resistance, ISR)由多种机制触发,如植物根际促生菌(plant growth-promoting rhizobacteria, PGPR)和真菌(plant growth-promoting rhizobacteria, PGPF),并由植物激素ET和茉莉酸(jasmonic acid, JA)在其中起关键作用的信号通路介导[6,8].Nahar等人。[9]研究了JA / ET途径,发现提供Ethephon(ET的源泉)或茉莉酸甲酯到米芽诱导根系中的强大的全身防御反应m . graminicola.确认JA在植物防御对线虫的重要性,JA的叶面申请也被发现在西红柿中对RKN引起全身防御[10].然而,Bhattarai等人[11发现番茄对rkn的敏感性需要通过冠状核不敏感1 (coronatine-insensitive 1, COI1)的JA信号。
ET在root防御对线虫的作用也是有争议的。Nahar等人。[9报道ET激活水稻根系对rkn的防御是基于完整的JA生物合成。Fudali等证实ET在根防御中的作用[12表明et过量产生的拟南芥对rkn的吸引力较小。然而,ET可能对根瘿发育有积极的影响,Glazer等人观察到[13在西红柿。总的来说,植物激素途径在植物防御线虫中的作用可能取决于宿主物种,并可能在感染过程中发生变化。这些激素途径也不是诱导对线虫的防御的先决条件,这是Ji等人提出的[14他发现,非蛋白氨基酸β -氨基丁酸(BABA)可以诱导水稻对RKNs的防御,而不依赖于JA和ET途径,而是通过激活木质素和胼钙的产生来起作用。
目前受到严重关注的诱导植物防御的潜在启动剂之一是生物炭,这是一种高碳材料,其从空气中没有生物量的缓慢解析,因此是生物燃料工业的副产品[15].某些添加到土壤中的生物炭已被证明可以显著改善土壤的耕作、养分的保持和植物的有效性,以及作物的生产力[7,16,17].所观察到的生物炭土壤改良剂对作物的影响主要是通过改善养分保留来解释的[18]、pH值增加和土壤物理性质改变[19]改善菌根真菌殖民化[20.]改变土壤生物群落组成和丰富[18,21].一些研究表明,土壤施用生物炭可以诱导许多植物对不同叶面真菌病原体的系统防御。真菌叶面疾病Botrytis cinerea和Oidiopsis胎管在生物炭改性的盆栽培养基中,番茄和辣椒的产量显著降低[7].研究发现,两种不同的生物炭可诱导草莓植株对三种叶面真菌病原菌产生系统抗性。b .灰质),Hemi-Biotrophic(Collettrichum acutatum)和生物营养(Podospharea Aphanis.) [22].graber等。[23],假设这种抗性可能是由于生物炭中含有的植物毒性化合物(如ET和丙二醇)施加的低强度胁迫,或者是由于从生物炭处理过的土壤中分离出的大量有益微生物,如众所周知的isr诱导微生物trichoderma.SPP。[24].最近,Mehari等人[25研究发现,生物炭改良剂可减少约50%的b .灰质大多数测试基因型中的疾病严重程度Solanum lycopersicum.系统性的阻力S. lycopersicum.结果表明,与较强且较早的过氧化氢(H2O2)积累,涉及JA信号。
目前,数据受到线虫植物寄生作用的限制。对土壤的禽凋落物生物炭的修正通常降低了植物 - 寄生线虫的数量,同时增加了土壤中的自由生物线虫量[26].Matlack [27]在景观量表进行了一个观察研究,无法检测到线虫人群与土壤中的烧焦材料之间的显着关系。此外,当在麦田中实行短期生物炭加入时,没有观察到显着的效果[28].然而,生物炭对二氯丙烯有较高的吸附能力,二氯丙烯是一种强抗线虫熏蒸剂。因此,在土壤中添加生物炭可以增加所需的二氯丙烯剂量,从而有效地控制线虫[29].这些报告研究了生物炭对线虫种群的土壤和化学线虫控制措施的影响,而通过对寄生线虫感染激活植物防御的间接影响尚未研究。
本研究旨在测试生物炭改性土壤是否能够诱导水稻植株对RKN的抗性m . graminicola.在建立了有益效果后,防御相关通路的作用,产生了H2O2,研究了染病水稻植株中胼胝质和木质素的沉积。利用ET不敏感线进一步研究ET通路的作用。我们发现生物炭诱导的水稻防御m . graminicola涉及H.2O2积聚在稻根中,部分取决于ET信号。
结果
生物炭渗出物对线虫的存活率和感染性没有负面影响
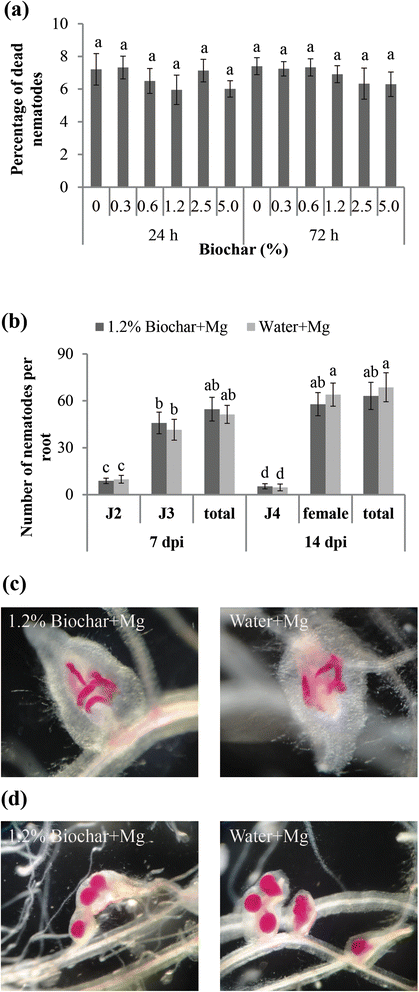
评价生物炭对线虫的杀灭效果m . graminicola,将线虫置于不同浓度的生物炭分泌物中培养。在生物测定开始24小时后,0.3 ~ 5%生物炭剂量下,生物炭渗出物(6.6±0.7%)和水(7.2±0.6%)的线虫死亡率没有显著差异(图)。1).当在BioChar孵育72小时的生物炭渗出物中,还观察到类似的结果(图。1).这些数据表明Biochar渗出物没有直接的旨在的效果m . graminicola在测试的剂量上。
为了验证Biochar是否会阻碍RKN的感染性,用生物炭渗出物或水(作为对照)处理的线虫接种在水稻根中。在7和14 dpi记录线虫渗透和发育(图。1 b).在7 dpi,大多数线虫发达于第三阶段少年(J3)。根系内的线虫的平均数量及其显影在生物炭渗透处理和控制线虫之间没有差异(图。1 b和C.).在14 dpi,大多数线虫已经发展成为成年女性。同样,在成年女性的数量或生物炭渗出物处理和水处理的线虫中未观察到显着差异,或者在生物炭渗出物处理和水处理的线虫中的总数(图。1 b和D.).生物炭分泌物处理的线虫成虫比例(91.6±7.4%)与水处理的线虫成虫比例(93.2±7.1%)相似。总的来说,我们的数据显示孵化m . graminicola在生物炭中,渗出物不抑制其渗透或延缓其在水稻根内的发育。
用生物炭修复的土壤可减少细菌的侵染m . graminicola在没有抑制植物生长的情况下
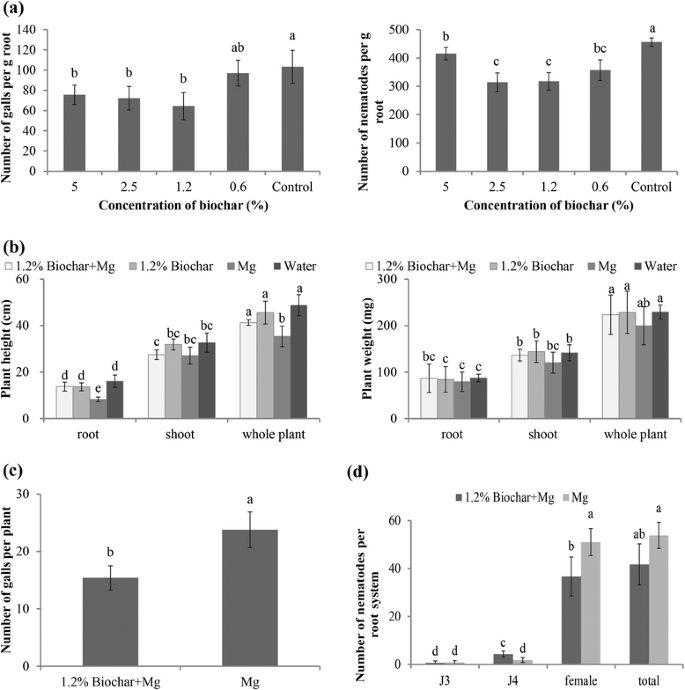
最近,研究发现,在不同热解温度下,由两种原料制备的四种生物炭在相对较低浓度(1%)的条件下,均能抑制生物炭的衰减辣椒而浓度较高(3%)则不能有效预防疾病[30.].因此,不同生物炭剂量的效果应该更加关注。为了评估生物炭作为引发剂的潜力,将不同浓度的生物炭加入到SAP底物中,并在14dPi下评估植物敏感性。结果表明,生物炭修正案在所有测试浓度下减少了每G根的胃数和每G根的线虫数量(图。2).然而,当SAP中生物炭浓度为1.2%时,效果最好。因此,所有后续实验均以该最佳生物炭浓度为1.2%进行。
在随后的实验中,通过分析4周龄植物的根部和芽的长度和新鲜重量来评估生长参数(图。2 b).rkn侵染植株与未侵染植株比较,侵染植株的根长和株高有轻微但显著的降低。虽然1.2%生物炭对分析的生长参数没有显著影响,但生物炭改性部分缓解了rkn感染带来的负面影响。
在最佳浓度1.2%时,添加生物炭可显著降低14 dpi时的根瘿总数(图2)。2摄氏度).此外,添加生物炭后的根中线虫的发育也略有延迟。添加生物炭的植物根中雌成虫的数量略低于未添加生物炭的植物根,而添加生物炭的植物根中第四阶段幼虫(J4s)的数量高于未添加生物炭的植物根(J4s)。二维).
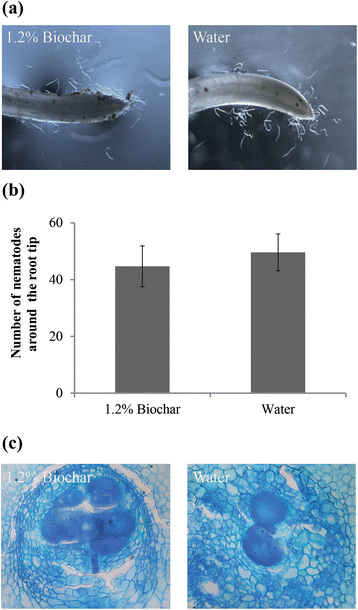
在某些植物寄生线虫种类中,根系分泌物常吸引线虫并触发卵孵化[31].验证Biochar是否阻碍了植物吸引的能力m . graminicola,在接种之前,用生物炭渗透或水1d浸没米根。在9 HPI时,大约20.2±3.1%的线虫被吸引到生物炭处理的根尖,这与吸引到未修正的根尖的那些没有显着差异(23.3±3.2%)(P.>(图0.05)。3,B.).这一结果表明,被测生物炭渗出物并不能阻止生物炭的吸引力m . graminicola大米。
对胆管内的线虫喂养部位的显微镜分析表明,在生物炭修正的根部形成的巨细胞上没有发生显着的形态差异,而非修正的根。大多数巨细胞仍然具有多种核,致密细胞质和增稠的细胞壁的细胞增大(图。3 c).
这些数据表明,生物炭修正案的浓度为1.2%延迟RKN的发展,但不会改变根本吸引力或巨型细胞形态。然而,在这种浓度下,土壤的生物炭修正可以减少RKN对植物生长的负面影响。
生物炭改良剂不诱导根瘿中胼胝质沉积
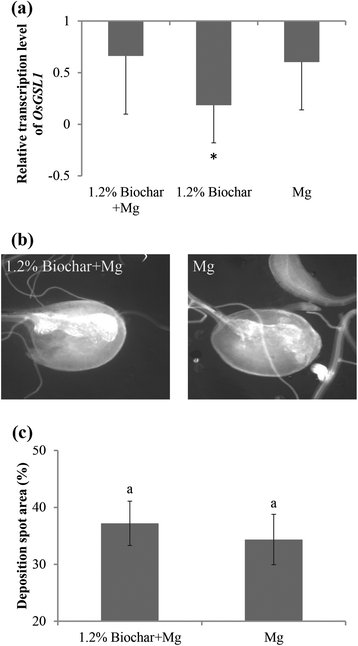
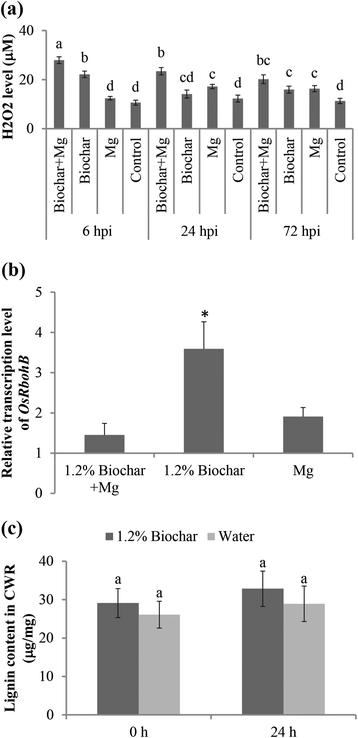
添加BABA来保护水稻免受rkn的侵袭,此前已证明与增强的葡聚糖合成酶样基因相关(OsGSL1) mRNA水平和胆组织中胼胝质沉积[14].为了研究Biochar是否具有类似的作用模式,这种胼conse合成酶编码基因的表达,OsGSL1采用定量逆转录酶PCR (qRT-PCR)对生物炭修饰和未修饰的植物进行了研究。在24 hpi时,的转录水平OsGSL1与对照植物相比,生物炭修正的植物中的显着下调(图。4).尽管在两种情况下,该基因的表达都有降低的趋势,但在接种植物中,无论是生物炭修饰的还是未修饰的,均未观察到显著差异。证实了这些结果,在7 dpi时,添加生物炭的瘿与未添加生物炭的瘿相似。4 b和C.).这些数据表明,生物炭修正案在线虫侵袭后不会诱导胼舌沉积。
添加生物炭对水稻根系胼胝质生物合成的影响。A.胼胝质生物合成基因(葡聚糖合成酶样基因,OsGSL1),采用qRT-PCR分析。用3个内参基因对基因表达水平进行归一化,Osexp.,OsEif5C和OsEXPnarsai.数据显示为归一化到对照根的相对转录水平(对照组的表达水平为1)。条形图代表两个独立生物复制的平均表达水平±SE,每个复制包含6株植物。星号表示与对照根相比,表达水平有显著差异。B.使用尼康Eclipse Ti-E对荧光显微镜(激发390nm),在UV光下检查在7dPI的根胆管中沉积沉积(激发390nm;发射460nm)。C.使用imagej软件进行胼shiposition的量化。所呈现的数据是两个独立实验的平均值±SE,每个实验都使用10 gall进行。不同的字母表示显着差异(Duncan的多个范围测试P.≤0.05)
生物炭修正案诱导H2O2累积但不是根组织中的瘫痪
H2O2是一种重要的活性氧物质(ROS),对植物中的防御反应诱导至关重要。进行了该实验,调查生物炭是否能够为禁止防御戒断ROSm . graminicola.首先,H2O2在3个不同时间点测定了植物根中H的含量,结果表明,单独添加生物炭会导致较高的H2O2水平的水稻根系(图。5).在米-Inculation(在非修订的SAP),H增加2O2还观察到水平。然而,在生物炭修正的接种植物中,H2O2在所有被调查的时间点,水平都显著增加到更高的水平,表明启动效应。定量分析OsRbohB,参与植物免疫反应的NADPH氧化酶基因[32的转录水平OsRbohB在与24hPi的非修正的非接种对照植物相比,在接受生物炭修正的植物中显着上调(图。5 b).生物炭改性接种植株与未改性接种植株无显著差异。最有可能的是,根结线虫干扰了这个基因的诱导,或者它的诱导发生在其他时间点,而不是这里研究的时间点。
生物炭对生长培养基的影响202水稻根系中木质素的积累和水平。A.H2O2在与Ki反应时测量每克根部的含量,并在390nm下使用克拉氏甾型微孔板读数检测。条形为四个重复的平均值,每个都包含六个根池。不同的字母表示显着差异(Duncan的多个范围测试P.≤0.05)。B.H2O2合成基因(OsRbohB),采用qRT-PCR分析。用3个内参基因对基因表达水平进行归一化,Osexp.,OsEif5C和OsEXPnarsai.与控制根部相比,所示的数据是相对转录水平(表达水平设置为1)。条形标准代表来自两个独立的生物重复的平均表达水平±SE,每个复制含量含有6个植物的池。与水处理对照根的比较,星号表示显着不同的表达水平。(P.≤0.05)。C.采用乙酰溴法测定了1.2%生物炭或水对水稻根中木质素含量的影响。接种前(0 h)和接种后24 hpi采样。条形代表6种植物木质素含量的平均值±SE。不同的字母表示显着差异(Duncan的多个范围测试P.≤0.05)
H2O2已知通过过氧化物酶和随后的木质素形成单烯酮的聚合[33].木质素赋予植物次生细胞壁机械强度,有助于抵抗植物寄生线虫的基础防御[34].在线虫接种前(0 h),单独施用生物炭的根中木质素水平与未施用生物炭的根中木质素水平相似(图2)。5度).在24 HPI,在生物炭修正的接种根中观察到稍微强烈的瘫痪,尽管差异没有统计学意义。这些数据表明生物炭修正案不会强烈促进木质素综合。
水稻生物炭诱导的防御m . graminicola部分由ET信号的激活介导
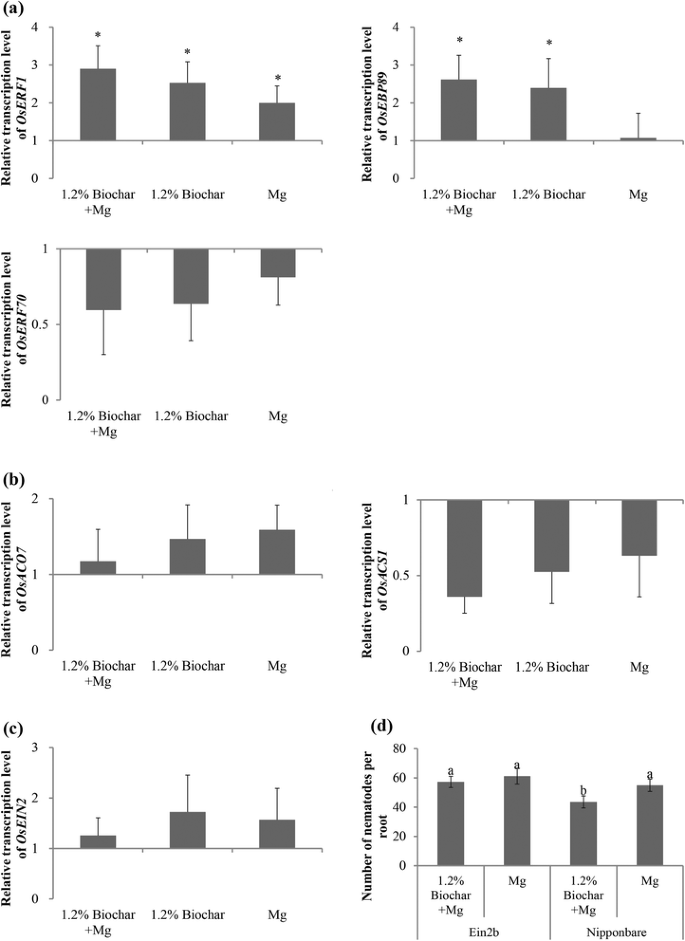
ET可以由生物质热解产生,尽管不同评价的生物炭产生的ET差异很大[35].为了探讨ET途径在生物炭诱导的抗rkns抗性的重要性,ET反应所涉及的基因的表达水平(OsERF70,OsERF1, OsEBP89),et生物合成(OSACS1.,OsACO7)及ET信号(OsEIN2)分析了。
ET反应基因的转录oserf1.和Osebp89.在生物炭修饰的植物中显著上调(图。6),而且OsERF70没有受到这些治疗的显着影响。两个et-Biosynthesis基因显示出不一致的结果,与OsACO7所有治疗和略微诱导OSACS1.虽然这些数值与对照植株无显著差异(图2)。6 b).ET信号基因的转录OsEIN2在所有治疗中显示出次要但非显着的诱导(图。6摄氏度).
生物炭修正在水稻生长培养基对水稻根系稻核的影响。A.相对表达水平oserf1.,Osebp89.,OsERF70,在24 hpi下采用qRT-PCR进行分析。B.相对表达水平OsACO7和OSACS1.,参与乙烯生物合成途径,采用24 hpi qRT-PCR分析。C.相对表达水平OsEIN2,参与乙烯信号通路,采用24 hpi qRT-PCR分析。用3个内参基因对基因表达水平进行归一化,Osexp.,OsEif5C和OsEXPnarsai.这些数据是与对照根(表达水平设置为1)相比的相对转录水平。条形图代表两个独立的生物学重复和三个技术重复的平均表达水平±SE,每个重复包含6株植物。星号表示表达水平有显著差异(P.≤0.05)。1.2%Biochar + Mg,1.2%Biochar修改加m . graminicola接种;1.2%生物炭,1.2%生物炭改进剂;毫克,m . graminicola单独接种;控制,不修改和非接种。D.AN.的效果Ein2b-RNAI突变体,其缺乏乙烯信号传导,野生型Nipponbare在14dpi下线虫感染。条形是从三种独立的生物重复的数据的平均值,每个都包含6个植物。不同的字母表示显着差异(Duncan的多个范围测试P.≤0.05)
为了获得更详细的了解ET反应在生物炭诱导的rkn防御中的作用Ein2b研究ET信号通路缺失的-RNAi细胞系(图。6 d).确认我们之前的观察结果(图。2), 14dpi的线虫数量减少。结果表明,生物炭修饰的植物与未修饰的植物间无显著差异Ein2brnai线。这些结果表明,ET信号通路在生物炭诱导的防御中是必需的m . graminicola在大米。
讨论
在本研究中,我们研究了生物炭对RKN感染过程不同阶段的影响m . graminicola在大米。所有的实验都是用holm橡木热解的生物炭进行的。的执行体外生物测定表明,生物炭渗出物对rkn的存活或感染没有直接的负面影响。
在优化浓度后,我们的数据显示,在1.2 %浓度的生物炭修饰sapi -培养基,不仅减少了水稻根上形成的虫瘿数量,而且延缓了根内线虫的发育。生物炭诱导的抗性以前曾在其他植物中针对不同的病原体进行过报道。用柑桔木热解生物炭处理番茄植株,抑制了番茄灰霉病和白粉病的发生Botrytis cinerea和Leveillula Taurica[7].从胡椒植物废物中制备的生物炭抑制了三种叶面疾病(b .灰质,C. Acutatum.,P. Aphanis.)草莓植物中的不同感染策略[22].最近,发现从桉树木屑和胡椒植物废物中热解的生物脉,在降低严重程度时有效R. Solani.豆类感染[30.].生物炭的推荐用量没有标准;然而,本研究中使用的水平与文献中普遍报道的水平相似[7,22].
生物炭不包含可增强疾病抑制的本土微生物联合体,Lehmann等人在一篇综述中记录了生物炭诱导植物对微生物系统防御的潜在方法[21].生物炭对土壤致病菌的抑制可能源于多种机制,包括改善养分的溶解和吸收,有助于提高植物的生长和对致病菌胁迫的抵抗力;微生物刺激,促进对病原体的直接竞争或寄生;或诱导植物防御机制[36].这里提出的研究专注于后一种选择,并据我们所知,这是第一份描述生物化学和分子引发机制的第一个报告,响应于植物对RKN感染的生物炭修正案。
在植物防御的生化反应中,细胞内的胼胝质沉积与植物-病原互作中的抗性有关[37].在感染上沉积的胼胝质(以乳头状的形式)可以帮助加强细胞壁,并作为延缓病原体入侵的物理屏障[38].在拟南芥中,过度表达RAP2.6增强了合胞体中胼胝质沉积,增强了拟南芥的抗性异皮线虫属schachtii[37].此外,BABA在水稻上的应用显示了一种强烈的防御反应,这与受感染组织中胼胝质沉积的增加相关[14].然而,我们的结果表明,生物炭添加物在接种线虫后不会诱导根瘿中胼胝质沉积。也没有显著增加OsGSL1生物炭修饰的接种植物的mRNA。
以前的研究表明,生物炭修正后的ET产量对一系列土壤和植物代谢活动产生了重大影响[21,36].斯波卡斯等人[35]评价了12种不同来源生物炭的ET生产潜力,发现非无菌土壤的ET产量比无菌土壤提高了21.5%。这种由生物炭修饰的土壤产生的外源ET可能会诱导植物对病原体的抗性[21,35].此外,已显示生物炭修正案在植物中激活SAR或ISR途径。例如,在草莓的灌封介质中施用1-3%的生物炭后,五种无国防相关基因的相对表达(FaPR1,FAOLP2,Fraa3,阿诺伊,FaWRKY1)显著增加。FaPR1和Fraa3是SAR途径的指标,而阿诺伊与诱导抗性的ISR途径相关,表明生物炭修正案触发叶子中的SA和JA / ET相关的基因表达[22].最近,Mehari等人[25]发现生物炭介导的番茄IR不需要高ET敏感性和SA积累。然而,JA的缺失阻止了生物炭诱导的IR,并阻止了H的激发2O2番茄侵染后的合成。本研究的qRT-PCR分析表明,外源生物炭的应用增强了ET响应基因的表达oserf1.和Osebp89.在米饭中,表明生物炭对水稻植物的影响取决于ET信号OsEin2B.
我们小组之前的研究表明,ET在激活ja依赖的rkn防御中发挥了重要作用[9].Fudali等证实ET在防御rkn中的作用[12表明et过量产生的拟南芥对rkn的吸引力较小。然而,由于ET被众所周知,诱导细胞膨胀和抑制瘫痪,建议该植物生长调节剂在感染过程的稍后时间点在线虫饲养部位的发展中起主要作用。正如Kyndt等人的审查所说。[39] ET很可能在线虫感染过程的不同阶段起不同阶段发挥不同的作用,包括(1)抑制作用,其通过激活线虫驱虫剂和JA生物合成,以及(2)激活作用,可能通过其积极作用在生长素生物合成中,从而促进巨细胞的径向膨胀。本研究提供的数据表明,生物炭诱导的稻米对RKN的防御m . graminicola至少部分是通过ET信号作用的。然而,由于我们没有在生物炭处理的植物中观察到吸引力或巨细胞发育的差异,需要进一步的研究来调查在处理的植物中特别激活的基因和途径。
我们的数据为生物炭改性剂对抗线虫感染引起的水稻生长抑制提供了证据。然而,生物炭处理的拟南芥和莴苣的微阵列显示,生物炭诱导的正生长效应伴随着大量植物防御基因的下调,包括JA生物合成途径、防御素和大多数类别的次级代谢物[40].相反,我们的结果表明,生物炭在1.2%浓度时对植物防御有积极的作用。重要的是,Viger等人的实验[40]的浓度较高(5%),而且众所周知,由于资源有限的权衡效应,过度激活植物生长会对植物防御产生负面影响。
H2O2是诱导植物防御过程中的一个重要因素[41].基于以往的研究,H2O2可被生物炭有效活化,产生羟基自由基(OH)降解2-氯联苯[42].H2O2在植物中可以通过过氧化物酶引起单酚的聚合和木质素的形成[33].目前的研究结果表明,生物炭添加物诱导H2O2而后续接种线虫结合生物炭处理则导致H2O2在根中,表明生物炭修饰对氧化爆发有启动作用。Taheri和Tarighi也报告了类似的结果[43[核黄素诱导米耐药抗性R. Solani.,增强H2O2在核黄素处理的接种植株中,木质素的积累与较高水平的木质素化有关。然而,本文的研究结果表明,生物炭改性剂在线虫入侵后并没有诱导木质素形成的增强。这些矛盾的结果可能是由于在本研究中使用的观察时间可能还为时过早,无法检测木质素的积累。
结论
这里提出的结果导致我们得出结论,水稻灌浆介质中的生物炭修正促进了对RKN的灌注防御反应m . graminicola并保护植物免受线虫感染对植物生长的负面影响。观察到的ET响应激活和H.2O2积累可能有助于生物炭抑制根内线虫感染的能力。显然,必须进行更多的研究,以量化生物炭触发植物防御的程度,并确定抑制线虫感染的最有效条件,因为生物炭在其物理和化学性质上表现出很大的可变性[21].未来的研究还需要确定生物炭中的有效化合物,并进一步确定生物炭-植物-线虫相互作用系统中发生的代谢变化。
方法
生物炭和植物材料
由霍尔木木材在650°C下热解12 - 18 h制备的生物炭由PROININSO S.A.(马拉加,西班牙)提供。这种生物炭由72.4%的干物质(DM)(%/新鲜)、77.8%的有机物(%/DM)和74.2%的C (%/DM)组成,Vandecasteele等人最近对其进行了表征和使用。[44,45].将生物炭研磨成1mM颗粒的粉末,并储存在密封容器中直至使用。将生物炭以不同浓度(0.6,1.2,2.5和5.0%)加入合成吸收性聚合物(SAP) - 溶液,其为砂和合成吸收聚合物的1:400(w:V)混合物[46].
水稻种子(栽培稻简历。日本晴)从美国农业部(GSOR-100)获得。转基因OsEin2bRNAi Line是由银阳(宾州州立大学,州立大学,美国州立大学)提供的。在30℃的萌发后4天,在含有或没有生物炭的含有SAP的聚氯乙烯(PVC)管中播种种子,并在26℃下保持温室,具有16 H / 8 H光/暗状态和70-75%相对湿度。每种植物每周施肥两次,含有20毫升的Hoagland溶液。两周的植物用于线虫接种。
线虫培养和提取
m . graminicola保持在o .漂白亚麻纤维卷简历。Nipponbare在温室下在与上述相同的条件下。将被切割的根和根胆汁切成碎片,使用改性浮选筛分方法提取线虫[47].用25 μm筛分法收集第二期幼虫(jps)。
Biochar的直接影响对线虫行为的渗出物
将生物炭浸入蒸馏水中,以0.3,0.6,1.2,2.5和5%(V:V)的浓度为1周。将悬浮液以12,000g离心5分钟,使用上清液来测试Biochar渗出物对RKN的直接毒性作用。在含有1ml Biochar的6孔培养板上将大约200J℃的直径阱置于3.5厘米的直径孔中,渗出物或用于模拟处理的1ml蒸馏水。在孵育24小时和72小时后,将1n NaOH滴入溶液中,并且通过在3分钟内改变它们的体形来响应NaOH的线虫被认为是活着的,而直线线虫未能应对NaOH被认为死了[48].在立体显微镜(Leica S8,Leica Microsystems,Deegem,Belgium)下计数生活和死线虫。实验进行三次,每次进行6次。
为了确定生物炭对线虫感染性的直接效果,在接种之前,将线虫在BioCher渗出液中孵育72小时。作为对照处理,在接种之前将线虫在水中温育72小时。每两周大米根部接种两百j2。在7和14dPI下,收集根样品并用酸紫红色染色,如Nahar等人所述。[9].利用立体显微镜对根内线虫进行计数,统计根内线虫总数和不同发育阶段的线虫数量。
吸引力生物测定
按照Wang等人的描述进行了线虫吸引试验[49].首先,将23g Pluronic F-127粉末(Sigma Aldrich,Brussels,比利时)加入到100ml无菌水中,并在4℃下搅拌溶解24小时。从2周龄植物的稻米浸透了20毫升1.2%的Biochar渗出物或水。一天之后,将1cm长的根尖切割成,并将其置于含有1ml Pluronic凝胶的6孔培养板中的3.5cm孔中,约200 J2s。根伸长区附近的线虫在接种后(HPI)的9小时内计数,并用DFC400相机在Leica立体显微镜下拍摄照片。实验进行三次,每次进行6次。
生物炭改良剂诱导抗性
这些试验旨在确定生物炭修正案是否能有效诱导水稻对rkn的防御。每个2周龄水稻植株在含有适当浓度生物炭的SAP培养基中或对照(仅SAP)接种约200 jps。在14 dpi时,测量水稻植株的根长、茎长和鲜重,并用酸性品红染色法对根系样品进行染色[9].在显微镜下对不同发育阶段的线虫进行计数。实验进行三次,每次进行6次。
巨型细胞的显微镜检查
如JI等人所述进行巨细胞的显微检查。[50].根瘿以7 dpi的浓度收集,固定在含2%戊二醛的1x PIPES缓冲液中过夜,然后用一系列乙醇稀释剂脱水,并在Technovit 7100中渗透。按照制造商的描述,将渗入的根嵌入到填充Technovit 7100加硬化剂II的塑料立方体中。用Leica RM2265电动旋转切片机(Leica Microsystems, Nussloch, Germany)将包埋的胆汁组织切片成10 μm的薄片。胆汁切片保存在盖玻片上,用0.05%甲苯胺蓝染色5分钟。显微镜观察使用bx51系统显微镜(Olympus光学公司,东京,日本),放大40倍,图像由Olympus ColorView III相机获得。试验重复2次,每次处理10个虫瘿。
胼舌的显微镜观察
根据Millet等人的研究,检测胼胝质沉积[51稍作修改。简单地说,用1.2%生物炭修饰的水稻根或未经处理的对照植株以7 dpi采集。收集10个处理的根瘿,在3:1乙醇:醋酸溶液中固定过夜,然后在70、50、30%乙醇稀释溶液中依次脱水。最后用0.01%苯胺蓝溶液真空浸润对根瘤进行染色。利用尼康Eclipse Ti-E表面荧光显微镜(激发波长为390nm;排放460海里)。使用ImageJ软件对胼胝质沉积进行定量分析。
H2O2和木质素量化
的在足底H的积累2O2使用三氯乙酸(TCA)法测定稻根[52].在6,24和72 HPI的中,在6,24和72 HPI中收集在SAP的水稻植物中生长的水稻植物的根源。在液氮中研磨一百毫克的新鲜根组织,并用0.8mL 0.1%TCA均化。离心匀浆,加入相同的10mM磷酸钾缓冲液(PPB,pH7.0)和1M ki作为上清液。使用Clariostar Microplate Reader(BMG Labtech,Temse,Belgium),在390nm读取上清液的吸光度。H的浓度2O2用标准曲线估算,其中0.1 μm到1 mM H2O2以相同比例的TCA、PPB和KI稀释。每个试验进行2次,每个重复4个样品,每个重复6株单株。
根据Vanholme等人所描述的乙酰溴(AcBr)方法定量测定木质素的积累[53].在接种rkn前(0 h)和接种rkn后24 h,分别采集在添加1.2%生物炭的SAP中生长的水稻植株和对照植株的根系。新鲜的根在快速真空(−20°C, 3天)中干燥,并在液氮研钵中研磨。地面亚样品(至少5mg)在2ml塑料管中连续提取30分钟(每个),使用水(98℃)、乙醇(76℃)、氯仿(59℃)和丙酮(54℃)。将剩余的细胞壁残渣干燥并再次称重。用Nano-Drop®ND-1000分光光度计(NanoDrop Technologies, Wilmington, DE, USA)在280 nm处测量木质素的吸光度。采用布格-兰伯特-比尔定律计算木质素浓度,其中A = є × l × c, є = 17.75 l g-1厘米-1且l = 0.1 cm [54].每个实验进行2次,每个重复4个样本。每个重复从6株单株中收集。
RNA提取,逆转录和QRT-PCR
为了检测不同植物防御相关基因的表达水平,我们以24 hpi的浓度采集了生长在含1.2%生物炭的SAP中的水稻植株和未处理的对照植株的根系。在每个处理中,6种植物的根被汇集在液氮中并粉碎。RNA提取使用NucleoSpin试剂盒(machery - nagel, Düren,德国),其中包括DNase处理。用SuperScript®II逆转录酶试剂盒(Invitrogen, Karlsrube, Germany)合成2 μg RNA。防御相关基因和内参基因引物序列见表1.所有QRT-PCR反应都以三份进行三份,具有两个独立的生物重复。在下列条件下,在转子-CENRG-3000机器(Corbett Life Science,Belgium)上运行QRT-PCR反应:在1个循环中为95℃。和95℃,58℃的95℃,40℃,25℃,40次循环。使用来自3个内部参考基因的数据标准化相对转录水平,并且使用2009年的软件进行统计分析[55].每个基因的相对表达量为未修饰和未接种对照植株(设表达量为1)中转录本水平的fold change。
统计分析
除了如上所述分析的QRT-PCR数据外,使用SAS软件8.0版(SAS Institute,Cary,NC)进行所有其他统计分析。在检查正常性和同性恋后,根据Duncan的多个范围测试确定治疗之间的显着差异。
缩写
- RKN:
-
综合国内线虫
- 红外光谱:
-
诱导抗性
- SAR:
-
系统获得性耐药
- 公关:
-
Pathogenesis-related
- 山:
-
水杨酸
- ISR:
-
诱导全身性抵抗
- PGPR:
-
植物生长促进relizobacteria
- PGPF:
-
促进植物生长的真菌
- 等:
-
乙烯
- JA:
-
茉莉酸
- H2O2:
-
过氧化氢
- SAP:
-
合成吸收性聚合物
- PVC:
-
聚氯乙烯
- DPI:
-
接种后的天数
- 柠檬酸:
-
三氯乙酸
- 磅:
-
磷酸钾缓冲液
参考文献
- 1.
粮农组织。谷物供求简况。2015年,王志刚,王志刚。水稻植物线虫病的分子生物学研究进展。植物病理学杂志。2014;52:135-53。doi:10.1146 / annurev -发朵- 102313 - 050111.
- 2.
陈志强,王志强,王志强,等。水稻植物线虫病的分子生物学研究进展。植物病理学杂志。2014;52:135-53。doi:10.1146 / annurev -发朵- 102313 - 050111.
- 3.
王志强,彭东生,王志强,等。水稻线虫的研究进展。在:MLuc RAS, Bridge J,编辑。亚热带和热带农业中的植物寄生线虫。瓦林福德:出租车国际;2005.p . 87 - 130。
- 4.
等。线虫寄生的基因。植物病理学杂志。2000;38:365-96。doi:10.1146 / annurev.phyto.38.1.365.
- 5.
geysen G, Mitchum MG。敏感植物对线虫感染反应的分子观察。植物学报。2009;15:45-81。
- 6.
Vallad Ge,Goodman Rm。常规农业中的全身获得性能和诱导全身性抗性。农作物科学。2004; 44:1920-34。doi:10.2135 / cropsci2004.1920.
- 7.
Elad Y, David DR, Harel YM, Borenshtein M, Kalifa HB, Silber A, et al.;土壤固碳剂生物炭诱导植物系统抗性的研究。Phytopathol。2010;100:913-21。doi:10.1094 /发朵- 100 - 9 - 0913.
- 8.
Van威斯SC, Pieterse CM, Trijssenaar A, Van 't Westende YA, Hartog F, Van Loon LC。生防菌诱导拟南芥系统抗性的差异研究。植物微生物相互作用学报1997;10:716-24。doi:10.1094 / MPMI.1997.10.6.716.
- 9.
黄志刚,王志刚,王志刚,等。水稻根结线虫的系统防御机制研究进展[j]。植物杂志。2011;157:305-16。doi:10.1104 /页。111.177576.
- 10。
李志强,李志强,李志强,等。茉莉酸对番茄根结线虫侵染的影响。J Chem Ecol. 2005; 31:53 - 67。doi:10.1007 / s10886 - 005 - 6070 - y.
- 11.
谢庆国,王志强,王志强,等。番茄对根结线虫的敏感性需要一个完整的茉莉酸信号通路。acta botanica botanica(云南植物研究). 2008;doi:10.1094 / mpmi-21-9-1205.
- 12.
王灿,王福达,威廉姆森VM。乙烯信号通路调节寄主根对根结线虫的吸引力有差异.植物微生物学报2013;26:75-86。doi:10.1094 / mpmi - 05 - 12 - 0107 - r.
- 13.
Glazer I,Orion D,Apelbaum A.乙烯生产meloidogyne.spp.-Infected植物。J Nematol。1985;17:61-3。
- 14.
关键词:根结线虫,β-氨基丁酸,抗性,基础防御植物微生物学报。2015;28:519-33。doi:10.1094 / mpmi - 09 - 14 - 0260 r.
- 15.
Chan Ky,Van Zwieten L,Meszaros I,Downie A,Joseph S. Greenwast BioChar的农艺价值作为土壤修正案。AUST J土壤。2007; 45:629-34。doi:10.1071 / SR07109.
- 16.
Lehmann J,Pereira Da Silva J,Steiner JR C,Nehls T,Zec W,Glaser B.考古蒽醇的营养可用性和浸出和亚马逊中央盆地的铁兰醇:肥料,粪肥和木炭修正案。植物土壤。2003; 249:343-57。
- 17.
陈志强,陈志强,陈志强,等。肥料、木炭和矿物肥料对作物生产和高度风化的亚马逊中部高地土壤肥力的长期影响。土壤植物。2007;291:275 - 90。doi:10.1007 / s11104-007-9193-9..
- 18.
梁志强,李志强,李志强,等。黑碳增加了土壤中的阳离子交换能力。土壤学报2006;70:1719-30。doi:10.2136 / sssaj2005.0383.
- 19.
诺瓦克JM, Busscher WJ, Laird DL, Ahmedna M, Watts DW, Niandou MAS。生物炭改良对东南沿海平原土壤肥力的影响土壤科学。2009;174:105-12。doi:10.1097 / SS.0b013e3181981d9a.
- 20。
王志强,王志强,王志强,等。微生物菌根对生物炭的响应及其机制研究进展。土壤植物。2007;300:9-20。doi:10.1007 / s11104-007-9391-5.
- 21。
Lehmann J,Rillig MC,Thies J,Masiello Ca,Hockaday Wc,Crowley D. Biochar对土壤Biota的影响:综述。土壤Biol Biochem。2011; 43:1812-36。doi:10.1016 / j.soilbio.2011.04.022.
- 22。
Harel Y, Elad Y, Rav-David D, Borenstein M, Shulchani R, Lew B,等。生物炭介导草莓对叶面真菌病原体的系统反应。土壤植物。2012;357:245-57。doi:10.1007 / s11104 - 012 - 1129 - 3.
- 23.
Graber ER, Meller Harel Y, Kolton M, Cytryn E, Silber A, Rav David D,等。生物炭对在施肥无土介质中生长的辣椒和番茄的发展和生产力的影响。土壤植物。2010;337:481 - 96。doi:10.1007 / s11104-010-0544-6.
- 24.
Hermosa R, Viterbo A, Chet I, Monte E.植物有益作用trichoderma.其基因。微生物学。2012; 158:17-25。doi:10.1099 / MIC.052274-0.
- 25.
(1)诱导番茄系统抗性的研究进展Solanum lycopersicum)反对Botrytis cinerea生物炭修饰涉及茉莉酸信号转导。土壤植物。2015;1 - 14。doi:10.1007 / s1114 - 015 - 2445 - 1.
- 26.
李志刚,李志刚,李志刚。有机土壤改良剂(包括家禽垃圾生物炭)对土壤线虫的影响。土壤> 2014;52:604-19。doi:10.1071 / SR14041.
- 27.
决定商业森林景观土壤线虫分布的因素。森林生态学报。2001;146:129-43。doi:10.1016 / s0378 - 1127 (00) 00454 - 0.
- 28.
张晓霞,李强,梁伟,张敏,鲍旭,谢志忠。生物炭添加对土壤线虫生长的影响。土壤圈。2013;23:98 - 103。doi:10.1016 / s1002-0160(12)60084-8.
- 29.
Graber ER,Tsechansky L,Khanukov J.吸附,挥发和熏蒸剂1,3-二氯丙烯在生物炭修正的土壤中的疗效。土壤化学。2011; 75:1365-73。
- 30.
Jaiswal AK, Frenkel O, Elad Y, Lew B, Graber ER。生物炭剂量对大豆幼苗生长和对茄丝核菌敏感性的非单调影响:“转移的rmax效应”。土壤植物。2014;1 - 16。doi:10.1007 / s11104-014-2331.2..
- 31.
hiltold I, Jaffuel G, Turlings TC。根冠分泌物对线虫的双重作用:从植物寄生线虫的沉默到昆虫病原线虫的疯狂。J Exp Bot. 2015; 66:603-11。doi:10.1093 / jxb / eru345.
- 32。
Wong HL,Pinontoan R,Hayashi K,Tabata R,Yaeno T,Haegawa K,等。RAC GTP酶结合到N末端延伸的水稻NADPH氧化酶调节。植物细胞。2007; 19:4022-34。doi:10.1105 / tpc.107.055624.
- 33。
王志强,王志强,王志强。木质素的生物合成。植物学报2003;54:519-46。doi:10.1146 / annurev.arplant.54.031902.134938.
- 34。
陈志强,陈志强,陈志强,等。穴居线虫感染的物理和化学屏障研究进展radopholus similis.在敏感和抗病香蕉的根中(穆萨SPP。)。植物别墅。2007; 56:878-90。doi:10.1111 / j.1365-3059.2007.01607.x.
- 35.
Spokas Ka,Baker JM,Reicosky DC。乙烯:生物炭修正案的潜在关键。植物土壤。2010; 333:443-52。doi:10.1007 / s11104-010-0359-5.
- 36.
Elad Y, Cytryn E, eller Harel Y, LEW B, Graber ER。生物炭效应:植物对生物胁迫的抗性。Phytopathol Mediterr。2011;50:335-49。
- 37.
转录因子RAP26的过表达导致合胞体胼胝质沉积增强,增强了对甜菜包囊线虫的抗性异皮线虫属schachtii在拟南芥根。BMC Plant Biol. 2013;13:47。doi:10.1186 / 1471-2229-13-47.
- 38.
植物防御相关乳突中胼胝质介导的对致病入侵者的抗性。植物科学学报。2014;5:168。doi:10.3389 / FPLS.2014.00168.
- 39.
Kyndt T, Vieira P, Gheysen G, Almeida - Engler J.线虫取食地点:植物根的独特器官。足底。2013;238(5)。doi:10.1007 / s00425-013-1923-z
- 40。
Pimer M,Hancock Rd,Miglietta F,Taylor G.更多植物生长但植物防御较少?在用生物炭修正的土壤中生长的植物的第一个全球基因表达数据。GCB生物学。2015; 7:658-72。doi:10.1111 / gcbb.12182.
- 41.
范得那比勒,范德克伦K,达J,加吉夫I, Boonefaes T, Morsa S,等。过氧化氢诱导烟草基因表达的综合分析。中国科学院院刊2003;100(26):16113-8。
- 42.
方刚,高建军,刘超,王亚东,周丹丹。生物炭对过氧化氢的活化作用及其对有机污染物降解的影响。环境科学与技术。2014;48:1902-10。doi:10.1021 / ES4048126.
- 43.
核黄素诱导水稻抗核黄素辣椒通过Jasonate介导的苯丙烷丙醇途径的初探。J植物理性。2010; 167:201-8。doi:10.1016 / j.jplph.2009.08.003.
- 44。
Vandecasteele B,Reubens B,Willekens K,De Neve S.堆肥增加鸡肉粪便的肥料价值:原料对P获取的影响。废物生物量valor。2014; 5:491-503。doi:10.1007 / s12649 - 013 - 9264 - 5.
- 45。
生物炭在堆肥或储存过程中会影响堆肥质量和氮损失,但不会影响磷植物的吸收。提交。
- 46。
利用沙子和吸水合成聚合物的混合物作为基质在实验室植物寄生线虫的xenic培养。线虫学。1999;1:209-12。doi:10.1163 / 156854199508027.
- 47.
Byrd DWJR,Nusbaum CJ,Barker Kr。一种用于从土壤中提取线虫的快速浮选技术。植物DIS批准。1966; 50:954-57。
- 48.
陈思义,迪克森DW。一种测定甘氨酸异虫第二阶段活幼体的技术。J Nematol。2000;32:117-21。
- 49.
王超,王志强,王志强,王志强。用pluronic f -127凝胶测定根结线虫聚集的首选pH值。J Chem Ecol. 2009; 35:1242-51。
- 50。
季海,盖森G,丹尼尔S,林塞K,托平JF,纳哈尔K,等。通过RNA测序对巨细胞诱导的转录分析有graminicola在稻根。J Exp Bot。2013; 64:3885-98。doi:10.1093 / JXB / ERT219.
- 51。
陈志强,陈志强,陈志强,等。通过微生物相关分子模式激活拟南芥根的先天免疫应答。植物细胞。2010;22:973 - 90。doi:10.1105 / tpc.109.069658.
- 52。
陈志强,陈志强,陈志强,等。外源多胺对酸雨胁迫下大豆抗氧化能力的影响。植物科学。2000;151:59 - 66。doi:10.1016 / s0168-9452(99)00197-1.
- 53.
Vanholme B,Cesarino I,Goeminne G,Kim H,Marroni F,Van Acker R等。含有罕见缺陷等位基因(BRDA)的繁殖:自然Populus nigra.以改性木质素的HCT突变体为例。新植醇。2013;198:765 - 76。doi:10.1111 / nph.12179.
- 54.
Vega-Sánchez ME, Verhertbruggen Y, Chen X, Sharma V, Varanasi P, et al.。纤维素合成酶样F6功能的丧失影响了混合连接葡聚糖沉积、细胞壁力学特性和水稻营养组织的防御反应。植物杂志。2012;159:56 - 69。
- 55.
Pfaffl MW, Horgan GW, Dempfle L. real-time PCR的相对表达软件工具(Relative expression software tool, REST)进行分组比较和统计分析。核酸学报2002;30:e36。
致谢
我们承认中国国家基础研究计划(2013CB127502)和国家科学基金会项目(31272022)的财务支持。TK由FWO博士后奖学金支持。WKH由中国奖学金委员会资助。我们感谢Kristof de Schutter博士在微观观测和H中的帮助下2O2测量。
BioChar是在佛罗里坡项目(Grant协议N°289853)内制作的,该项目由欧洲委员会的研究和创新董事会共同资助,在第七个RTD,主题2-生物技术,农业和食品方案中。本文表达的观点和意见纯粹是作家的观点,可能不会被视为陈述欧盟委员会的官方立场。我们感谢Proininso S.A.提供生物炭。
作者信息
隶属关系
通讯作者
附加信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
TK和GG构思了该研究并监督所有实验。WKH表演了大部分实验。HLJ参与了Nematode接种实验和QRT-PCR分析。JD提供了BioChar并帮助起草了手稿。WKH,TK和HLJ讨论了结果并写了稿件。所有作者均阅读并批准最终手稿。
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
黄,工作。霁,霍奇金淋巴瘤。,Gheysen, G.等等。生物炭修饰的盆栽培养基降低了水稻对根结线虫感染的敏感性。BMC植物杂志15,267(2015)。https://doi.org/10.1186/s12870-015-0654-7
收到:
接受:
发表:
关键词
- 生物炭
- 有graminicola
- 过氧化氢
- 木质素
- 有硬块的