- 研究文章GydF4y2Ba
- 开放访问GydF4y2Ba
- 发表:GydF4y2Ba
鉴定与黑暗引起的衰老相关的miRNAGydF4y2Ba拟南芥GydF4y2Ba
BMC植物生物学GydF4y2Ba体积GydF4y2Ba15.GydF4y2Ba, 文章编号:GydF4y2Ba266GydF4y2Ba(GydF4y2Ba2015年GydF4y2Ba)GydF4y2Ba
摘要GydF4y2Ba
背景GydF4y2Ba
MicroRNA(miRNA)是内源性的小(〜21个核苷酸)单链非编码RNA,其通常通过引导靶基因的切割而起作用。为了找到可能参与深色诱导的叶片衰老的miRNA,我们通过微阵列平台识别MIRNAGydF4y2Ba拟南芥GydF4y2Ba叶子从整个变暗的植物(DPS)和单独变暗的叶子(IDL)。GydF4y2Ba
结果GydF4y2Ba
我们发现137 MiRNA的表达式(GydF4y2BaP.GydF4y2Ba < 0.01, signal intensity >0) were significantly changed both in DP and IDL leaves. Among them, the expression levels of 44 miRNAs were relative higher than others (P.GydF4y2Ba< 0.01,信号强度>500)。在这些差异表达的miRNAs中,有6个miRNAs (miR319a, 319c, miR159, miR164a, miR164c和miR390a)之前被报道参与了黑暗诱导的叶片衰老,其余38个miRNAs之前没有参与过叶片衰老。对44个mirna的靶基因进行了预测,其中一些靶基因如GydF4y2Ba母GydF4y2Ba那GydF4y2BaAT3G28690GydF4y2Ba那GydF4y2BaAT2G17640GydF4y2Ba和GydF4y2BaAT2G45160GydF4y2Ba,均在叶片衰老数据库(LSD)中找到。137个mirna的GO和KEGG分析显示,预测的靶基因在转录调控、发育相关的生物学过程和代谢途径中显著富集。部分相应miRNA靶点的表达水平(GydF4y2BaAt1g73440GydF4y2Ba那GydF4y2BaAT2G03220和AT5G54810GydF4y2Ba分析并发现在DP / IDL中显着不同,而不是wt。GydF4y2Ba
结论GydF4y2Ba
这里存在关于涉及叶片衰老的黑暗诱导的miRNA的微阵列分析。进一步的表达分析表明,一些新的创始miRNA可能会调节叶片衰老GydF4y2Ba拟南芥GydF4y2Ba并且,研究结果突出了miRNA在黑暗诱导的叶片衰老中的重要作用。GydF4y2Ba
背景GydF4y2Ba
植物中的衰老是一种内在,遗传确定的自然发育方案,在叶子,水果或花开发结束时运行[GydF4y2Ba1GydF4y2Ba]。它的特征在于叶片的可见变黄(叶绿素降解),伴随着叶养营养物的携带叶营养成繁殖结构,并且是一种复杂的过程,涉及通过内源性和外源性因子调节的生理,生化和基因表达的变化[GydF4y2Ba2GydF4y2Ba]。由于衰老发生在叶片发育的最终阶段,并且在细胞死亡之前[GydF4y2Ba2GydF4y2Ba]但它对农业产生了至关重要的影响,特别是在较长的生长期间增加作物产量的作物。虽然叶片衰老主要由发育年龄控制,但它可以通过温度,高盐度,干旱,淹没,臭氧,恒定的黑暗,营养缺乏,光和病原体感染等不利的环境因素来调节或引发。GydF4y2Ba2GydF4y2Ba-GydF4y2Ba8.GydF4y2Ba]。因此,了解叶片衰老机制不仅对回答基础科学问题很重要,而且对通过延长蔬菜光合活性和减少收获后品质损失来增加作物产量也很重要[GydF4y2Ba9.GydF4y2Ba]。GydF4y2Ba
在黑暗中孵育也能诱发类似衰老的现象[GydF4y2Ba5.GydF4y2Ba]。在某些方面,黑暗诱导的衰老方案与自然时代依赖性衰老共享许多常见途径[GydF4y2Ba10.GydF4y2Ba]。在两个条件下存在一些类似的症状和分子组分,除了线粒体中的ROS生产外,在黑暗诱导的衰老豌豆叶中显着增加了显着增加[GydF4y2Ba11.GydF4y2Ba]和老薯(GydF4y2BaSolanum Tuberosum.GydF4y2Ba)块茎[GydF4y2Ba12.GydF4y2Ba]。GydF4y2Ba
比较转录组分析显示,自然年龄依赖性和暗诱导衰老调节重叠但不同的基因集GydF4y2Ba拟南芥GydF4y2Ba莲座丛叶(GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba13.GydF4y2Ba]。自然年龄依赖性诱导的特定基因的数量远高于黑暗诱导的特定基因的数量[GydF4y2Ba10.GydF4y2Ba]。然而,经历不同类型衰老的植物叶片转录组数据显示,在两种条件(自然或黑暗)下,基因表达谱和信号通路存在显著差异[GydF4y2Ba13.GydF4y2Ba]。此外,Keech.GydF4y2Ba等等。GydF4y2Ba发现代谢调节在整个植物上附着的单独变暗的叶片(IDL)和完全变暗的植物(DP)中的等效叶子之间的调节差异,尽管两种情况下都是叶片衰老诱导的叶片[GydF4y2Ba14.GydF4y2Ba]。GydF4y2Ba
miRNA是内源性的小(〜21核途径)单链非编码RNA,其能够通过在几乎所有真核生物中存在的转录或翻译机制后调节基因表达[GydF4y2Ba15.GydF4y2Ba-GydF4y2Ba17.GydF4y2Ba]。大量研究表明,mirna参与了植物大多数重要的生物学过程,包括发育调控、细胞增殖、凋亡、信号转导、激素和应激反应[GydF4y2Ba18.GydF4y2Ba-GydF4y2Ba22GydF4y2Ba]。最近,一些证据表明,MiRNA有效地调节植物衰老的不同机制[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba23GydF4y2Ba-GydF4y2Ba25GydF4y2Ba]。GydF4y2Ba
近年来,在了解植物中的衰老功能是如何实现巨大的进步。植物衰老是一种令人兴趣和挑战性的研究,吸引科学家探讨来自不同角度的多方面现象[GydF4y2Ba1GydF4y2Ba]。结合遗传学方法,对模式植物叶片衰老进行了研究GydF4y2Ba拟南芥GydF4y2Ba,研究主要关注衰老相关基因(SAG)表达和功能[GydF4y2Ba13.GydF4y2Ba那GydF4y2Ba26GydF4y2Ba]。迄今为止,若干研究探讨了miRNA在植物衰老中的潜在参与。例如,MiR319通过调节TCP转录因子的活性来呈现叶片衰老[GydF4y2Ba24GydF4y2Ba]。miR164过表达抑制ein3诱导的早期衰老表型GydF4y2Ba拟南芥GydF4y2Ba树叶 [GydF4y2Ba23GydF4y2Ba那GydF4y2Ba25GydF4y2Ba]。然而,对梅尔诺斯响应叶片衰老的作用的了解仍然有限,只有几个miRNA的特征GydF4y2Ba体内GydF4y2Ba在此过程中的功能[GydF4y2Ba6.GydF4y2Ba那GydF4y2Ba23GydF4y2Ba-GydF4y2Ba25GydF4y2Ba]。GydF4y2Ba
本研究旨在通过DPs和IDLs上的mirna芯片平台鉴定在暗诱导的拟南芥叶片衰老过程中发挥作用的mirna。其中8个通过实时定量PCR (qPCR)进行了进一步的实验验证,结果发现与微阵列近似一致。对暗诱导衰老应答miRNA靶点的精细表达分析为某些miRNA参与暗诱导衰老提供了分子证据。因此,对暗诱导衰老相关mirna及其靶点的鉴定有助于揭示暗诱导叶片衰老的分子机制。GydF4y2Ba
方法GydF4y2Ba
植物材料及生长条件GydF4y2Ba
拟南芥GydF4y2Ba(Heyn。)生态型哥伦比亚(COL-0)种子在4℃下表面灭菌和冷处理3d。然后将它们种植在土壤中并在受控环境生长室中种植〜4周,具有漫长的光周期(16小时光/ 8小时暗),250 mmol的辐照度GydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba,相对湿度为55%,每天/夜温度为22°C。GydF4y2Ba
衰老的黑暗诱导(IDL和DPS处理)GydF4y2Ba
诱发叶片衰老GydF4y2Ba拟南芥GydF4y2Ba根据Keech等人的实验设计。[GydF4y2Ba14.GydF4y2Ba] (图。GydF4y2Ba1GydF4y2Ba).从第6到第10件玫瑰花的28株植物中被黑色塑料袋和铝箔覆盖,以减少热量,而植物的其余部分仍然是光线,即,IDLS附着在整个植物上GydF4y2Ba.GydF4y2Ba叶片在2、4或6 d后变暗。GydF4y2Ba
在每个生物重复中,盆中的28个植物被从下方通风的黑色塑料盒覆盖,以允许气体交换,但仍然保持植物充分变暗,即DPS。植物在与IDLS处理相同的气候室中为2,4或6天变暗。从第6到第10朵玫瑰花,没有任何暗治疗(16小时光/ 8小时黑暗,250 mmol mGydF4y2Ba-2GydF4y2BaS.GydF4y2Ba-1GydF4y2Ba)作为对照(图1中的WT,即DP / IDL-0d)收集。GydF4y2Ba1GydF4y2Ba).GydF4y2Ba
叶绿素(CHL)含量测定GydF4y2Ba
该程序在4°C和黑暗中进行。将叶片样品(0.25g)用5ml 80%丙酮(v / v)用5ml 80%丙酮(v / v)捣碎,通过两层尼龙过滤萃取物,并加入25ml,丙酮80%。然后将其以15,000×g在密封管中离心5分钟。收集上清液并分别在663和645nm处读取CHL A和CHL B.根据Arnon的等式计算CHL的浓度[GydF4y2Ba27GydF4y2Ba]。GydF4y2Ba
总RNA和小RNA分离GydF4y2Ba
根据制造商的方案,使用Trizol试剂(Invitrogen公司,美国)提取总RNA。用NanoDrop ND-1000分光光度计(NanoDrop,美国)在260/280 nm(> 2.0)检测总RNA的数量和纯度。用Novex 15% tbe -尿素凝胶(Invitrogen,美国)从总RNA库中分离10-40个核苷酸的小RNA片段。GydF4y2Ba
μParaflo™MiRNA微阵列检测试剂盒GydF4y2Ba
使用服务提供商(LC SCIENCE)进行微阵列测定。首先,使用聚(a)聚合酶,4-8μg总RNA样品用聚(a)尾部延伸3'延伸。然后将寡核苷酸标签连接到聚(a)尾部以供以后的荧光染料染色。使用微循环泵(策略技术)在μParaflo微流体芯片上进行杂交过夜进行过夜[GydF4y2Ba28GydF4y2Ba那GydF4y2Ba29GydF4y2Ba]。在微流体芯片上,每个检测探针由化学修饰的核苷酸编码段与靶miRNA互补(来自miRBase,GydF4y2Bahttp://www.mirbase.org/GydF4y2Ba)或其他RNA(对照或顾客定义的序列)和聚乙二醇的间隔区段,以将编码段延伸远离基板。检测探针是通过的GydF4y2Ba原位GydF4y2Ba使用照片生成的试剂(PGR)化学合成。通过检测探针的化学修饰平衡杂交熔化温度。在RNA杂交之后,通过用于染料染色的微流体芯片循环标签缀合Cy3染料。使用Genepix 4000B激光扫描仪(Molecular Device,USA)收集荧光图像,并使用Array-Pro图像分析软件(媒体网络网络)数字化。通过在减去背景(本地加权回归)之后使用杠杆滤波器归一化信号来分析数据[GydF4y2Ba30.GydF4y2Ba]。GydF4y2Ba
实时定量PCRGydF4y2Ba
在DP、IDL和野生型中检测8种mirna的表达GydF4y2Ba拟南芥GydF4y2Ba(COL-0)通过铂SYBR绿基QPCR(Invitrogen,11733-038),具有高特异性miRNA量子磁体RT试剂盒(RA610A-1,系统生物学)在ABI 7900上。八个选定的miRNA和内部对照基因的引物(UBQ6-1)在附加文件中可用GydF4y2Ba2GydF4y2Ba:表S1。GydF4y2Ba
采用SYBR®Green Realtime PCR (TOYOBO,日本)和SYBR®Green Realtime PCR MasterMix试剂盒(TOYOBO,日本)在Eppendorf realplex上检测7个样本中12个选定基因(如WRKY22, WRKY53, SAG12, SAG20)的表达GydF4y2Ba4.GydF4y2Ba.10个基因和1个内控基因(ACT2, AT3G18780)的引物可在附加文件中找到GydF4y2Ba2GydF4y2Ba:表S1。GydF4y2Ba
基因本体(GO)和途径分析GydF4y2Ba
我们对miRNA的靶基因进行了分析(GydF4y2BaP.GydF4y2Ba < 0.01) with differential expression based on the GO database (http://www.geneontology.org/GydF4y2Ba).途径分析还对基于KEGG数据库的差异表达的miRNA的靶基因进行(GydF4y2Bahttp://www.genome.jp/kegg/GydF4y2Ba).使用一个GydF4y2BaP.GydF4y2Ba-值<0.5,则确定富集途径。GydF4y2Ba
结果GydF4y2Ba
DPS和IDL中的表型和CHL含量分析GydF4y2Ba拟南芥GydF4y2Ba
在2D的黑暗处理后,在DPS或IDL中未观察到较大的增加,尽管叶子开始丢失颜料。在4 d暗处后,DPS的一些较旧的叶子显示出较大,而IDL仍然浅绿色,没有明显的泛黄。在第6天,几乎所有的叶子都在变黄,长而薄的DPS,而只有一些经过处理的IDL显示黄变(图。GydF4y2Ba1GydF4y2Ba).GydF4y2Ba
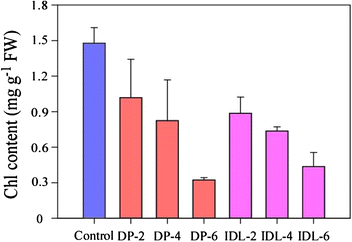
数字GydF4y2Ba2GydF4y2Ba结果表明,DP/IDL叶片中Chl含量与对照不同。GydF4y2Ba2GydF4y2Ba).它是1.48 mg gGydF4y2Ba-1GydF4y2Ba治疗前对照的CHL FW。在暗处理后2天,DP和IDL叶的CHL含量为1.02和0.89 mg gGydF4y2Ba-1GydF4y2BaFW分别。在4天,DP和IDL叶片降至0.82和0.74 mg gGydF4y2Ba-1GydF4y2BaFW。此外,DP和IDL叶片包含约0.32和0.44 mg gGydF4y2Ba-1GydF4y2BaFW,分别经过6 d的相应处理。GydF4y2Ba
微阵列分析在DPs和IDLs中的miRNAs表达GydF4y2Ba拟南芥GydF4y2Ba
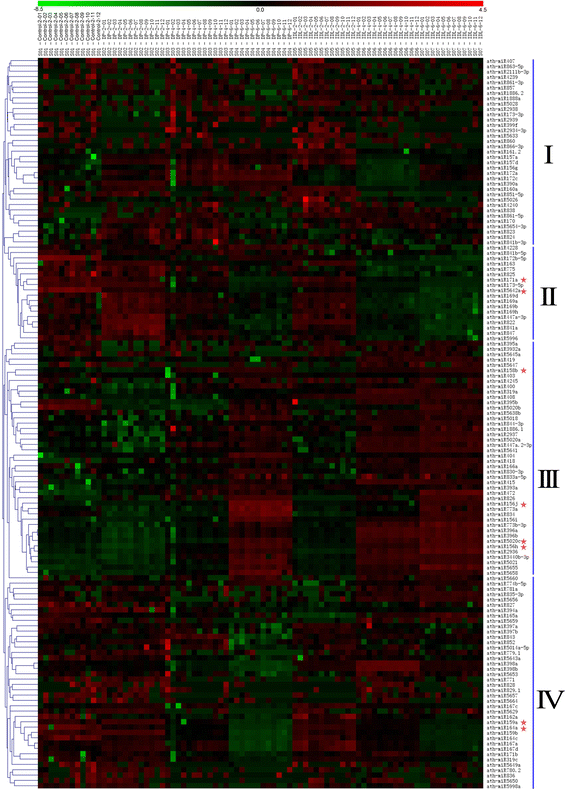
检查miRNA的差异表达GydF4y2Ba拟南芥GydF4y2Ba在预处理和处理的叶片(DPS和IDL)之间,进行miRNA微阵列分析以检测DPS和IDL中miRNA的全局表达。转录数据具有统计学意义但具有低信号(GydF4y2BaP.GydF4y2Ba < 0.01, signal intensity > 0), based on theZ.GydF4y2Ba- 从两种颜色反转杂交实验的平均值(图)平均值的LOG2数据(图。GydF4y2Ba3.GydF4y2Ba).我们发现,在DPs和IDLs中,44个mirna的表达水平发生了显著变化(GydF4y2BaP.GydF4y2Ba < 0.01, signal intensity >500, Additional file2GydF4y2Ba:表S2)。miRNA表达分析显示DP和IDL叶中的类似混沌表达模式,其标记为I和II。GydF4y2Ba3.GydF4y2Ba.与预处理相比,我在DPS和IDL中表现出不同的上/下调。与预处理相比,第II组在DP和IDL叶中的下调显着降低。与预处理相比,III组在DPS和IDL中表现出显着增加。此外,与预处理相比,IV组在DP和IDL叶之间表现出类似的表达模式(图。GydF4y2Ba3.GydF4y2Ba).GydF4y2Ba
基于微阵列的miRNA的验证GydF4y2Ba
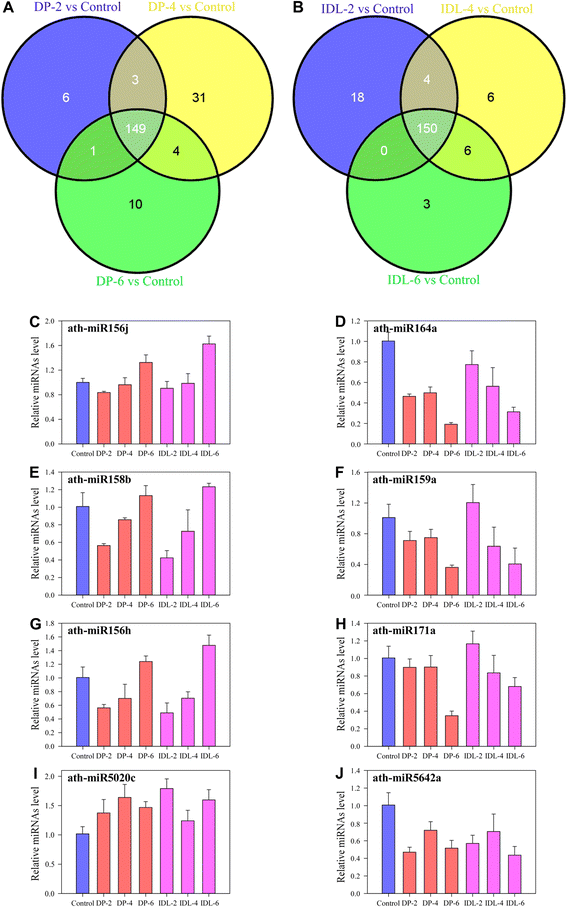
分析了对照,DPS中检测到的所有miRNA响应MIRNA响应暗处理的差异表达(图。GydF4y2Ba4AGydF4y2Ba)和IDL(图。GydF4y2Ba4B.GydF4y2Ba).在深色诱导的处理下,在2,4和6d下,分别检测到159,187和164 miRNA(信号强度> 0)。其中,在DP下表达149个miRNA,而6,31和10分别在2,4和6d中特别地表达(图。GydF4y2Ba4AGydF4y2Ba).但是,这在IDL中不同(图。GydF4y2Ba4B.GydF4y2Ba).在2,4和6d下,分别检测到IDL,172,166和159 miRNA下。其中,在所有三个样品中表达了150个miRNA,而分别在2,4和6d中特别地表达18,6和3(图。GydF4y2Ba4B.GydF4y2Ba,附加文件GydF4y2Ba2GydF4y2Ba:表S3)。有趣的是,图中三个样本中有149个mirna表达。GydF4y2Ba4AGydF4y2Ba与图4相同。GydF4y2Ba4B.GydF4y2Ba137 mirnas有GydF4y2BaP.GydF4y2Ba < 0.01 (data not shown). Only ath-miR1886.1 is specifically expressed in 2, 4 and 6 d IDL (Additional file2GydF4y2Ba:表S3)。但是,ATH-MIR1886.1的表达非常低,其信号强度在IDL中的50岁以下(数据未显示)。GydF4y2Ba
Venn图和差异表达miRNA的实时PCR分析。GydF4y2Ba一种GydF4y2Ba维恩图显示,DP和对照叶片在暗诱导2、4和6d后的mirna表达差异。GydF4y2BaB.GydF4y2Ba通过维恩图,可以看出IDL和对照叶片在单独暗诱导后2、4和6d的mirna表达差异。微阵列和高通量测序圈中间的数字代表DP第2、4和6d中具有相同表达模式的mirna (GydF4y2Ba一种GydF4y2Ba)和IDL(GydF4y2BaB.GydF4y2Ba).Venn图是结果GydF4y2BaP.GydF4y2Ba < 0.01 in both experiments.CGydF4y2Ba-GydF4y2BajGydF4y2Ba通过茎环实时RT-PCR定量分析IDL和dp诱导的叶片中8个mirna水平GydF4y2BaCGydF4y2Bamir156j,GydF4y2BaD.GydF4y2BamiR164a,GydF4y2BaE.GydF4y2Bamir158b,GydF4y2BaFGydF4y2Bamir159a,GydF4y2BaGGydF4y2BamiR156h,GydF4y2BaHGydF4y2Bamir171a,GydF4y2Ba一世GydF4y2Bamir5020c.GydF4y2BajGydF4y2Bamir5642a。UBQ6-1用作内部控制。误差条表示从三个生物重复中获得的SDGydF4y2Ba
我们选择了八个miRNA,在控制,DP和IDL样本中具有相似的表达模式(如图所示为红星。GydF4y2Ba3.GydF4y2Ba).8个mirna对暗处理反应的微阵列分析显示在附加文件中GydF4y2Ba1GydF4y2Ba:图S1。使用定量实时PCR(QRT-PCR)测试八种所选miRNA的表达水平,并确认了整体上从微阵列分析获得的差异表达数据(图。GydF4y2Ba4.GydF4y2Ba).我们发现8个mirna的表达模式与微阵列数据大致一致(图。GydF4y2Ba4.GydF4y2Ba,附加文件GydF4y2Ba1GydF4y2Ba:图S3)。与对照相比,Ath-MiR164a,Ath-miR159a,Ath-miR159a,Ath-miR171a和Ath-mir5642a的表达在DP和IDL样品中下调(图。GydF4y2Ba4.GydF4y2Ba).此外,与对照组相比,athi - mir5020c在DPs和IDLs中的表达均上调。然而,与对照组相比,在DP-6和IDL-6d样本中,athi - mir156j、athi - mir158b、athi - mir156h和athi - mir5020c的表达在4 d前降低,然后升高(图2)。GydF4y2Ba4.GydF4y2Ba).其中,ath-miR164a过表达曾被报道抑制ein3诱导的早期衰老表型[GydF4y2Ba23GydF4y2Ba]。ORE1/NAC2基因被鉴定为叶片衰老的正调控因子,因为敲除ORE1/NAC2可以延长植物的寿命GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba25GydF4y2Ba[MiR164介导一组NAC家族基因的切割,其中ORE1 / NAC2是衰老诱导的细胞死亡和叶片衰老的阳性调节剂[GydF4y2Ba25GydF4y2Ba那GydF4y2Ba31GydF4y2Ba]。GydF4y2Ba
暗诱导衰老过程中miRNA靶基因的分析GydF4y2Ba
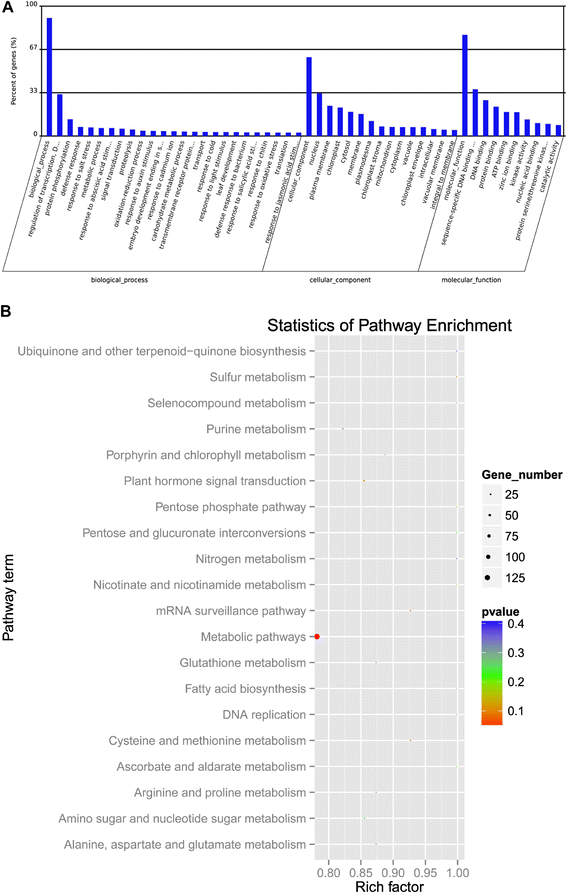
在靶基因预测之后,我们对137个差分miRNA的预测靶基因进行了分析(GydF4y2BaP.GydF4y2Ba < 0.01) that changed in DP and IDL samples. We found the molecular functions of 1827 identified target genes to be involved in functions such as leaf development, gene silencing by miRNAs, response to auxin stimulus, response to salicylic acid stimulus, response to abscisic acid stimulus, 等等GydF4y2Ba(附加文件GydF4y2Ba2GydF4y2Ba:表S4,数据未示出)。去分析结果表明,所识别的miRNA及其靶标被分类为1584个GO术语,包括867个生物过程,174个细胞成分和543个分子函数(附加文件GydF4y2Ba2GydF4y2Ba:表S4),靶基因的分子功能主要集中在序列特异性DNA结合,蛋白质结合(图。GydF4y2Ba5AGydF4y2Ba).GydF4y2Ba
基于KEGG途径数据库的途径分析也应用于差异表达的miRNA的预测靶基因。删除冗余术语后,我们的研究结果会定位98个注释的Kegg路径(附加文件GydF4y2Ba2GydF4y2Ba:用于miRNA的表S4),富含20 kegg途径(图。GydF4y2Ba5B.GydF4y2Ba).miRNA的靶基因的Kegg浓缩分析表明,这些基因受调节的方法,例如代谢途径,植物激素信号转导,氮代谢和一些生物合成途径(图。GydF4y2Ba5B.GydF4y2Ba).GydF4y2Ba
暗诱导衰老过程中靶点的差异表达分析GydF4y2Ba
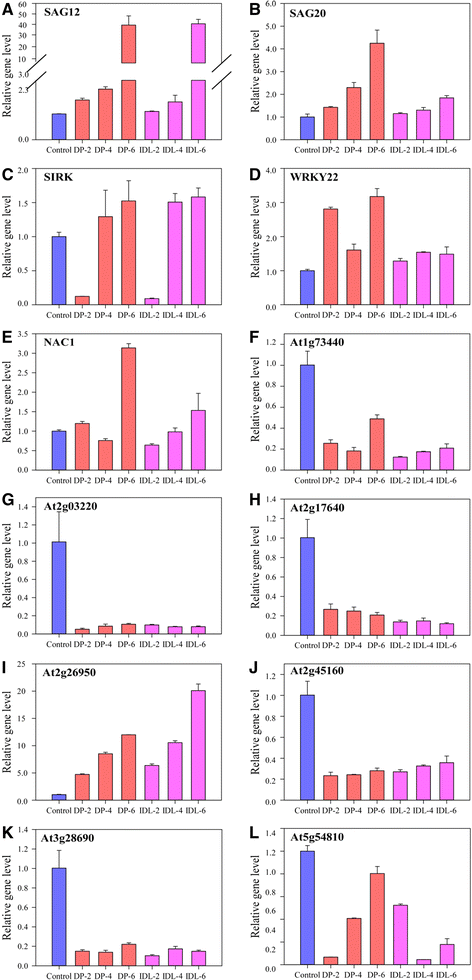
在GydF4y2Ba拟南芥GydF4y2Ba, SAG12的表达与年龄调节的衰老高度相关,而不是由多种应激条件诱导的[GydF4y2Ba8.GydF4y2Ba]。它被认为是天然叶衰老的可靠标记[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba32GydF4y2Ba]。此外,据报道,SAG20、SIRK和WRKY22也参与了叶片衰老[GydF4y2Ba33GydF4y2Ba那GydF4y2Ba34GydF4y2Ba]。我们发现这些基因的表达在所有暗诱导的样品中增加了(图。GydF4y2Ba6.GydF4y2Ba).鉴定生物信息学预测分析GydF4y2Ba母GydF4y2Ba那GydF4y2BaAt1g73440GydF4y2Ba(钙调蛋白相关蛋白质),GydF4y2BaAT2G03220GydF4y2Ba(半乳糖酰胺2-α-L-岩氧基转移酶),GydF4y2BaAT2G17640GydF4y2Ba(丝氨酸乙酰转移酶),GydF4y2BaAT2G26950GydF4y2Ba(域MYB蛋白),GydF4y2BaAT2G45160GydF4y2Ba(蛋白质丢失的商品1),GydF4y2BaAT28690.GydF4y2Ba(假定的蛋白激酶)GydF4y2BaAT5G54810GydF4y2Ba(色氨酸合成酶β链)作为MiR164a,mir5020c,miR158b,miR156j,miR159a,miR171a,mir156h和mir5642a的靶基因。GydF4y2Ba
DP和IDL中差异表达靶基因的实时PCR分析GydF4y2Ba拟南芥GydF4y2Ba叶子。GydF4y2Ba一种GydF4y2BaSAG12,GydF4y2BaB.GydF4y2BaSAG20,GydF4y2BaCGydF4y2BaSIRK,GydF4y2BaD.GydF4y2BaWRKY22,GydF4y2BaE.GydF4y2Ba母,GydF4y2BaFGydF4y2BaAt1g73440,GydF4y2BaGGydF4y2BaAT2G03220,GydF4y2BaHGydF4y2BaAt2g17640,GydF4y2Ba一世GydF4y2BaAT2G26950,GydF4y2BajGydF4y2BaAT2G45160;GydF4y2BaK.GydF4y2BaAT3G28690,GydF4y2BaL.GydF4y2BaAT5G54810。ACT2基因用作内部对照。误差条表示从三个生物重复中获得的SDGydF4y2Ba
为了确认miRNA表达模式及其靶基因的因果关系,我们研究了对照,DP和IDL样品中这些基因的表达。GydF4y2Ba母GydF4y2Ba和GydF4y2BaAT2G26950GydF4y2BaDP / IDL的表达水平比在与miRNA164a和mir159a的下表达相关的对照中较高。MiRNA164A表达水平比6-IDL中的6-DP更高。同时,在DP / IDL中,其他基因表达水平比在对照中较低,与相应的miRNA的更高表达相关(图。GydF4y2Ba6.GydF4y2Ba).GydF4y2Ba
讨论GydF4y2Ba
叶片衰老是一种自然的年龄依赖性过程。它可以通过内部和外部信号,如黑暗,极端温度,干旱和营养缺陷暴露的影响,通过复杂的监管网络来影响[GydF4y2Ba7.GydF4y2Ba那GydF4y2Ba33GydF4y2Ba]。最近,通过比较已知促进衰老的27种不同治疗的转录组变化,据报道,衰老诱导的早期途径不同,但后来会融合成共同的衰老计划[GydF4y2Ba35GydF4y2Ba]。多年来,人们已经知道持续的黑暗会导致叶子衰老,许多关于这一现象的研究已经发表[GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba13.GydF4y2Ba那GydF4y2Ba36GydF4y2Ba那GydF4y2Ba37GydF4y2Ba]。然而,在几乎所有情况下,研究都集中在任何脱离的叶子上[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba31GydF4y2Ba那GydF4y2Ba34GydF4y2Ba那GydF4y2Ba38GydF4y2Ba]或完整的幼苗[GydF4y2Ba13.GydF4y2Ba那GydF4y2Ba37GydF4y2Ba那GydF4y2Ba39GydF4y2Ba]。在IDL中已经完成了一点工作GydF4y2Ba拟南芥。GydF4y2Ba此外,一些报告已经有所矛盾的结论,特别是DP治疗是否可以诱导叶片衰老[GydF4y2Ba13.GydF4y2Ba那GydF4y2Ba39GydF4y2Ba那GydF4y2Ba40GydF4y2Ba]。织布工和氨基氨基的结论是,黑暗是导致个体叶片衰老的主要因素[GydF4y2Ba40GydF4y2Ba]。最近的研究发现,在idl中显著上调或下调的基因中,超过75%的基因在自然衰老和年龄依赖性衰老中表现出相同的反应GydF4y2Ba拟南芥。GydF4y2Ba这意味着具有IDL治疗的发育衰老和黑暗诱导的衰老计划在于许多常见的途径GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba10.GydF4y2Ba]。基于这些结果,我们使用了叶片衰老的快速,受控和更同步的诱导,以模仿DPS或IDLS处理的发育衰老。GydF4y2Ba
CHL降解是叶片衰老的可见症状,并且通常通过叶绿素的量来检测进展。大多数报告都认为,全植物转移到黑暗中诱导真实叶片的叶绿素损失[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba31GydF4y2Ba那GydF4y2Ba41GydF4y2Ba]。我们发现黑暗诱导的叶片衰老GydF4y2Ba拟南芥GydF4y2Ba在DPS相对于IDLS中更慢地发生(图。GydF4y2Ba1GydF4y2Ba和GydF4y2Ba2GydF4y2Ba).在暗处理6D后,DP和IDL的CHL含量均在处理前仅降低〜25%(图。GydF4y2Ba2GydF4y2Ba).但是,与治疗前的对照相比,在正常情况下,在6 d生长后,WT减少〜10%(附加文件GydF4y2Ba1GydF4y2Ba:图S2)。衰老表型和CHL含量不同于其他人描述的[GydF4y2Ba14.GydF4y2Ba那GydF4y2Ba26GydF4y2Ba那GydF4y2Ba37GydF4y2Ba那GydF4y2Ba40GydF4y2Ba],这可能是因为在我们的实验中幼苗是在长日光周期(16 h光照/8 h黑暗)下生长的,而在其他实验中幼苗是在短日光周期(8 h光照/16 h黑暗)下生长的[GydF4y2Ba14.GydF4y2Ba那GydF4y2Ba26GydF4y2Ba]。此外,可能不同的生态型会导致不同的表现型[GydF4y2Ba40GydF4y2Ba]。GydF4y2Ba
在完整的植物中,暗诱导的衰老表型比分子反应发生得慢。随着基因组测序的完成和多种研究工具的可用性,黑暗诱导衰老的分子角度在GydF4y2Ba拟南芥GydF4y2Ba已经彻底研究了[GydF4y2Ba26GydF4y2Ba那GydF4y2Ba42GydF4y2Ba那GydF4y2Ba43GydF4y2Ba]。以前的研究表明,表演过程中,其在叶片衰老的发育和应力相关诱导中起到高阶调节器,在叶片衰老中发挥着重要作用[GydF4y2Ba44GydF4y2Ba那GydF4y2Ba45GydF4y2Ba]。表观遗传调节叶片衰老主要通过染色质结构,差异组蛋白修饰,DNA甲基化和小RNA结合/相互作用的变化发生[GydF4y2Ba44GydF4y2Ba-GydF4y2Ba48GydF4y2Ba]。然而,很少有mirna控制衰老的报道[GydF4y2Ba24GydF4y2Ba-GydF4y2Ba26GydF4y2Ba那GydF4y2Ba49GydF4y2Ba]。MiR319通过控制TCP转录因子来调节叶片衰老。TCP转录因子坐标叶片发育中的两个顺序过程(叶生长)[GydF4y2Ba48GydF4y2Ba]。金GydF4y2Ba等等。GydF4y2Ba(2009)发现在miR164突变体中加速衰老[GydF4y2Ba25GydF4y2Ba]。他们证明MiR164通过肉瘤裂解的MiR164压抑Ore1。EIN3和ORE1可以直接促进CHL降解[GydF4y2Ba50.GydF4y2Ba]。这与我们的数据是一致的。GydF4y2Ba3.GydF4y2Ba和GydF4y2Ba4.GydF4y2Ba).此外,ORE1是调节下游凹凸的NAC转录因子,例如SAG12 [GydF4y2Ba35GydF4y2Ba]。MiR390触发了转发siRNA TAS3的产生。TAS3导致ARF2的mRNA劣化[GydF4y2Ba49GydF4y2Ba那GydF4y2Ba51.GydF4y2Ba]。ARF2是生长素应答的负调节剂,疾病反应涉及衰老的时序[GydF4y2Ba46GydF4y2Ba那GydF4y2Ba52.GydF4y2Ba]。此外,通过mirna全基因组分析发现miR-159a存在于水稻叶片衰老过程中[GydF4y2Ba53.GydF4y2Ba]。GydF4y2Ba
此外,MIRNA在黑暗引起的衰老中的变化GydF4y2Ba拟南芥GydF4y2Ba仍然未知,特别是DP和IDL治疗的实验。韦弗GydF4y2Ba等等。GydF4y2Ba(1998)发现了GydF4y2Ba拟南芥,GydF4y2Ba当整个植物放置在黑暗中时,没有诱导叶片,但实际上是抑制的,而相比之下,当个体叶片变暗时,当植物的其余部分保持在光线中时,它被强烈加速了[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba40GydF4y2Ba]。此发现与我们的结果符合IDL,但部分矛盾的结果是DP的结果(图。GydF4y2Ba1GydF4y2Ba那GydF4y2Ba3.GydF4y2Ba和GydF4y2Ba4.GydF4y2Ba).事实上,在大多数情况下,整株植物被持久的黑暗处理以诱导衰老,并发现了一些与sagar相关的基因[GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba26GydF4y2Ba]。DP治疗是否可以诱导衰老仍然不清楚[GydF4y2Ba10.GydF4y2Ba那GydF4y2Ba31GydF4y2Ba那GydF4y2Ba40GydF4y2Ba]。为了解决这一点,并阐明黑暗诱导的衰老中的分子事件,我们在DP和IDL中使用了微阵列GydF4y2Ba拟南芥GydF4y2Ba研究mirna及相关靶基因。GydF4y2Ba
在本研究中,在所有三个DP样本中诱导了150个mirna,在所有三个IDL样本中表达了149个mirna。有趣的是,DP和IDL样品中有149个mirna是相同的,说明DP和IDL处理对叶片衰老的影响高度相似,全株黑暗处理也能诱导衰老。同时,虽然变化趋势相似,但在DP和IDL处理之间存在一定的差异,如miRNA159在IDLs中的表达高于DP样品等(图2)。GydF4y2Ba6.GydF4y2Ba).在149个与衰老相关的mirna中,有44个mirna在DPs和IDLs中表达水平显著改变(附加文件)GydF4y2Ba2GydF4y2Ba:表S3)。其中,先前已被识别为参与衰老:miR319a,319c,miR-159a,miR164a,mir164c和mir390a [GydF4y2Ba25GydF4y2Ba那GydF4y2Ba35GydF4y2Ba那GydF4y2Ba46GydF4y2Ba那GydF4y2Ba48GydF4y2Ba那GydF4y2Ba49GydF4y2Ba那GydF4y2Ba53.GydF4y2Ba]。此外,我们发现mir408和mir396a参与叶片衰老(附加文件GydF4y2Ba2GydF4y2Ba:表S3),它与撒切尔的深度序列结果一致[GydF4y2Ba54.GydF4y2Ba]。我们选择了来自这些44 miRNA的八个miRNA,以使用QRT-PCR确认微阵列数据(图。GydF4y2Ba4.GydF4y2Ba)(miR164a,mir5020c,mir158b,mir156j,mir159a,miR171a,mir156h和mir5642a)。MiR164a在DP和IDL叶中下调。结果表明,我们的数据与年龄相关的叶片衰老一致GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba25GydF4y2Ba]。另外7个mirna是最新通过qRT-PCR鉴定出来的,它们可能参与了黑暗诱导的衰老(图。GydF4y2Ba4.GydF4y2Ba).GydF4y2Ba
其他研究使用微阵列分析来鉴定一大群基因,其显示对黑暗治疗的反应响应的转录物水平差异GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba13.GydF4y2Ba那GydF4y2Ba26GydF4y2Ba]。许多研究表明,响应于黑暗的诱导诱导相对大量的凹陷的叶片表达,例如SAG12,SAG20,SIRK,WRKY22和NAC [GydF4y2Ba8.GydF4y2Ba那GydF4y2Ba32GydF4y2Ba那GydF4y2Ba33GydF4y2Ba那GydF4y2Ba40GydF4y2Ba那GydF4y2Ba43GydF4y2Ba]。据报道,NAC由MIR164监管[GydF4y2Ba3.GydF4y2Ba]。有报道称miR159通过靶向MYB来确定叶片结构[GydF4y2Ba55.GydF4y2Ba]。我们发现在DPS和IDL中上调的这些基因,除了在DPS和IDL中处理后的2D被测调节的2d(图。GydF4y2Ba6.GydF4y2Ba).这种发现突出显示DP或IDL治疗可以模仿年龄相关的衰老。本研究涵盖的miRNA的靶预测表明,调节衰老过程,包括叶片发育,由miRNA沉默的基因沉默,以及对植物刺激刺激的反应(图。GydF4y2Ba5.GydF4y2Ba).我们预测了Fig中选择的其余7个mirna的靶基因。GydF4y2Ba4.GydF4y2Ba并检测这些基因的表达(图。GydF4y2Ba6.GydF4y2Ba).刘GydF4y2Ba等等。GydF4y2Ba(2011)生成了叶片衰老数据库(LSD,GydF4y2Bahttp://www.eplantsenescence.org/GydF4y2Ba)[GydF4y2Ba56.GydF4y2Ba]。它包含来自21种植物物种的1145个凹凸。李GydF4y2Ba等GydF4y2Ba.(2012)还开发了潜在与叶片衰老相关的基因的准确数据库GydF4y2Ba拟南芥GydF4y2Ba[GydF4y2Ba4.GydF4y2Ba]。在预测的靶基因中,我们发现GydF4y2BaAT3G28690GydF4y2Ba那GydF4y2BaAT2G17640GydF4y2Ba和GydF4y2BaAT2G45160GydF4y2Ba在LSD中发现,分别是miR-156h,miR-156j和miR-171a的目标基因GydF4y2Ba.At1g73440GydF4y2Ba那GydF4y2BaAT2G03220GydF4y2Ba那GydF4y2BaAT5G54810GydF4y2Ba不在LSD中,其分别对应于miR-5020c,miR-158b和miR-5642a的靶基因。其他30 miRNA在附加文件中调节的目标基因GydF4y2Ba2GydF4y2Ba表S3中miR-158a、miR162a、miR166a、miR5021、miR171a参与细胞生长、生长速率、脱落酸信号通路及光收获复合物II的负调控。这些靶基因可能与叶片衰老有关。这些mirna和靶基因以前从未发表过。我们未来的研究方向将集中在这些mirna /target基因与叶片衰老的关系上。GydF4y2Ba
结论GydF4y2Ba
miRNA芯片鉴定了对暗诱导衰老反应的miRNA。此外,利用生物信息学方法预测了额外的miRNA靶点。大量mirna在暗诱导衰老过程中被诱导或抑制,表明mirna在叶片衰老过程中发挥重要作用。在IDL和DP处理下,我们可以排除一些新的调控叶片衰老的mirna。我们还可以确定可能的目标基因,这些基因可能对黑暗诱导的叶子衰老有消极或积极的影响。本研究进一步扩展了现有mirna在暗诱导叶片衰老中的作用,并为未来的研究提供了一些新的mirna。GydF4y2Ba
可获得的支持数据GydF4y2Ba
支持本文结果的数据集可在NCBI Geo(基因表达式Omnibus)中获得GydF4y2Bahttp://www.ncbi.nlm.nih.gov/geo/GydF4y2Ba)存储库的登录号为GSE74376。GydF4y2Ba
参考GydF4y2Ba
- 1。GydF4y2Ba
植物的衰老。植物生长规律。2014;33(33):1-3。GydF4y2Ba
- 2.GydF4y2Ba
林宝,金hj,nam hg。叶衰老。Annu Rev植物Biol。2007; 58:115-36。GydF4y2Ba
- 3.GydF4y2Ba
郭颖,甘树生。叶片衰老的信号、执行和调控。中国科学(d辑:地球科学)2005;GydF4y2Ba
- 4.GydF4y2Ba
李志华,彭建勇,温旭,郭宏伟。衰老相关基因的基因网络分析和功能研究揭示了拟南芥叶片衰老的新调控因子。acta botanica yunnanica(云南植物研究). 2012;54(8):526-39。GydF4y2Ba
- 5。GydF4y2Ba
Seltmann Ma,Hussels W,Berger S. Jasonates在衰老期间:代谢的信号或产品?植物信号表现。2010; 5(11):1493-6。GydF4y2Ba
- 6。GydF4y2Ba
徐X,yin l,ying q,song h,xue d,lai t等。高通量测序和降级分析识别miRNA及其参与果实衰老的果实衰老。Plos一个。2013; 8(8):E70959。GydF4y2Ba
- 7。GydF4y2Ba
Woo HR,Kim JH,Nam Hg,Lim Po。拟南芥,矿石1,矿石3和ORE9的延迟叶片衰老突变体耐受氧化应激。植物细胞生理。2004; 45(7):923-32。GydF4y2Ba
- 8。GydF4y2Ba
Weaver LM, Gan S, Quirino B, Amasino RM。应激和激素处理下几个衰老相关基因表达模式的比较。植物学报。1998;37(3):455-69。GydF4y2Ba
- 9.GydF4y2Ba
甘S,amasino rm。衰老感(叶片衰老的分子遗传调控和操纵)。植物理性。1997; 113(2):313-9。GydF4y2Ba
- 10。GydF4y2Ba
张志强,张志强,张志强,等。拟南芥叶片发育和诱导衰老过程中膜转运体和激素通路的转录分析。植物杂志。2006;141(2):776 - 92。GydF4y2Ba
- 11.GydF4y2Ba
Jimenez A,Hernandez Ja,Pastori G,Del RioLa,塞维利亚F.线粒体抗坏血鬼和过氧化体在豌豆叶衰老中的作用。植物理性。1998年; 118(4):1327-35。GydF4y2Ba
- 12.GydF4y2Ba
Boveris A,Sanchez Ra,Beconi Mt。新鲜和老化马铃薯 - 块茎线粒体中的抗致抗敏感剂和抗性呼吸和超氧化物阴离子产量。费用。1978; 92(92):333-8。GydF4y2Ba
- 13.GydF4y2Ba
Buchanan-Wollaston v,Page T,Harrison E,Breeze E,Lim Po,Nam Hg等。比较转录组分析揭示了在拟南芥中发育和黑暗/饥饿的衰老之间的基因表达和信号传导途径的显着差异。工厂J. 2005; 42(4):567-85。GydF4y2Ba
- 14.GydF4y2Ba
Kech o,pesquet e,a,a,Askne A,Nordvall D,Vodnala Sm,等。拟南芥叶片黑暗衰老期间线粒体和叶绿体的不同序号。植物细胞环境。2007; 30(12):1523-34。GydF4y2Ba
- 15.GydF4y2Ba
Hwang HW,Mendell JT。细胞增殖,细胞死亡和肿瘤术中的MicroRNA。BR J癌症。2006; 94(6):776-80。GydF4y2Ba
- 16。GydF4y2Ba
Brodersen P,Sakvarelidze-Achard L,Bruun-Rasmussen M,Dunoyer P,Yamamoto YY,Sieburth L等人。植物miRNA和siRNA广泛的翻译抑制。科学。2008; 320(5880):1185-90。GydF4y2Ba
- 17。GydF4y2Ba
巴特德DPMicrornas:目标识别和监管功能。细胞。2009; 136(2):215-33。GydF4y2Ba
- 18。GydF4y2Ba
刘PP,蒙哥马利TA,Fahlgren N,Kasschau Kd,Nonogaki H,Carrington JC。MicroRNA160的抑制植金响应因子10对种子萌发和发芽后阶段至关重要。工厂J. 2007; 52(1):133-46。GydF4y2Ba
- 19。GydF4y2Ba
陈旭。发育中的小rna -来自植物的见解。acta optica sinica, 2012;22(4): 361-7。GydF4y2Ba
- 20.GydF4y2Ba
植物microrna的起源、生物起源和活性。细胞。2009;136(4):669 - 87。GydF4y2Ba
- 21。GydF4y2Ba
Mallory AC,VAUCHERET H. MicroRNA的功能和植物中相关的小RNA。NAT Genet。2006; 38(SUP):S31-6。GydF4y2Ba
- 22。GydF4y2Ba
Ruiz-Ferrer V,Voinnet O.植物小RNA在生物应力反应中的角色。Annu Rev植物Biol。2009; 60:485-510。GydF4y2Ba
- 23。GydF4y2Ba
Li Z,Peng J,Wen X,Guo H.乙烯 - 不敏感性3是一种衰老相关基因,通过直接抑制拟南芥MiR164转录来加速年龄依赖性叶片衰老。植物细胞。2013; 25(9):3311-28。GydF4y2Ba
- 24。GydF4y2Ba
Schommer C,Palatnik JF,Aggarwal P,Chetelat A,Cubas P,Farmer EE,等。MiR319靶标控制茉莉酸盐生物合成和衰老。Plos生物学。2008; 6(9):1991-2001。GydF4y2Ba
- 25.GydF4y2Ba
Kim Jh,Woo Hr,Kim J,Lim Po,Lee Ic,Choi Sh等。涉及拟南芥MiR164的年龄依赖性细胞死亡的前鼻前调节。科学。2009; 323(5917):1053-7。GydF4y2Ba
- 26.GydF4y2Ba
林建峰,吴绍华。拟南芥叶片衰老的分子事件。植物j . 2004;(4): 612 - 28。GydF4y2Ba
- 27.GydF4y2Ba
阿诺迪。铜酶在分离的叶绿体中。β寻常的多酚氧化酶。植物理性。1949; 24(1):1-15。GydF4y2Ba
- 28。GydF4y2Ba
朱Q,洪A,Sheng N,Zhang X,Matejko A,Jun Ky等。核酸和蛋白质分析的Microparaflo Biochip。方法Mol Biol。2007; 382:287-312。GydF4y2Ba
- 29。GydF4y2Ba
高旭,周旭东。寡核苷酸微阵列的原位合成。生物聚合物。2004;73(5):579 - 96。GydF4y2Ba
- 30.GydF4y2Ba
Bolstad BM,Irtizarry Ra,Astrand M,Speed TP。基于方差和偏置的高密度寡核苷酸阵列数据的归一化方法比较。生物信息学。2003; 19(2):185-93。GydF4y2Ba
- 31.GydF4y2Ba
俄亥俄州,公园jh,李吉,Paek Kh,Park Sk,Nam Hg。拟南芥鉴定鉴定三种遗传基因座控制叶片衰老。工厂J.997; 12(3):527-35。GydF4y2Ba
- 32.GydF4y2Ba
卢三世,Amasino RM。衰老特异性表达SAG12启动子区域的鉴定。植物学报。1999;41(2):181-94。GydF4y2Ba
- 33。GydF4y2Ba
Azumi Y,Watanabe A.暗度诱导的衰老相关基因的证据。植物理性。1991; 95(2):577-83。GydF4y2Ba
- 34。GydF4y2Ba
周X,江Y,Yu D. Wrky22转录因子在拟南芥中介导黑暗诱导的叶片衰老。mol细胞。2011; 31(4):303-13。GydF4y2Ba
- 35。GydF4y2Ba
27种促衰老激素、病理和环境胁迫处理对叶片衰老诱导基因表达谱的趋同和分化。植物学报。2012;35(3):644-55。GydF4y2Ba
- 36。GydF4y2Ba
Fukao T,Yeung E,Bailey-Serres J.通过水稻激素调节,淹没耐受性基因Sub1a延迟延长黑暗的叶片衰老。植物理性。2012; 160(4):1795-807。GydF4y2Ba
- 37.GydF4y2Ba
Lee Rh,Wang Ch,Huang Lt,Chen SCG。叶片在水稻植物中的叶片:衰老和表征衰老上调基因。J Exp Bot。2001; 52(358):1117-21。GydF4y2Ba
- 38.GydF4y2Ba
Kim ys,sakuraba y,han sh,yoo sc,paek nc。拟南芥NAC016转录因子延迟叶片衰老的突变。植物细胞生理。2013; 54(10):1660-72。GydF4y2Ba
- 39.GydF4y2Ba
陈丽娟,乌日洋汉,张玉强,段克新,陈红伟,李qt,等。OsSIK2是一种s结构域类受体激酶,具有抗非生物胁迫能力,并能延缓暗诱导的水稻叶片衰老。植物杂志。2013;163(4):1752 - 65。GydF4y2Ba
- 40。GydF4y2Ba
韦弗LM,阿马西诺RM。衰老在单个变暗的拟南芥叶片中被诱导,但在整个变暗的植株中被抑制。植物杂志。2001;127(3):876 - 86。GydF4y2Ba
- 41。GydF4y2Ba
关键词:大麦,暗诱导,衰老,基因表达,基因克隆足底。1997;203(3):332 - 40。GydF4y2Ba
- 42.GydF4y2Ba
Guo Y,Cai Z,Gan S.拟南芥叶片的转录组。植物细胞环境。2004; 27:521-49。GydF4y2Ba
- 43.GydF4y2Ba
Gepstein s,sabehi g,鲤鱼mj,hajouj t,nesher mf,Yariv I等。大规模鉴定叶片衰老相关基因。工厂J. 2003; 36(5):629-42。GydF4y2Ba
- 44.GydF4y2Ba
Humbeck K.表观遗传和小RNA调节衰老。植物mol biol。2013; 82(6):529-37。GydF4y2Ba
- 45。GydF4y2Ba
在拟南芥中,通过WRKY53位点组蛋白甲基化的表观遗传编程控制叶片衰老。植物j . 2009; 58(2): 333 - 46。GydF4y2Ba
- 46。GydF4y2Ba
林宝,李IC,金杰,金HJ,Ryu Js,Woo Hr等。助流素响应因子2(ARF2)在调节生长素介导的叶子寿命方面发挥着重要作用。J Exp Bot。2010; 61(5):1419-30。GydF4y2Ba
- 47。GydF4y2Ba
罗明,刘新平,崔玉英,齐默尔利,吴克勤。植物非生物胁迫反应中的染色质修饰和重塑。生物物理学报。2012;1819(2):129-36。GydF4y2Ba
- 48。GydF4y2Ba
Penterman J,Zilberman D,Huh Jh,Ballinger T,Henikoff S,Fischer RL。拟南芥基因组中的DNA去甲基化。Proc Natl Acad Sci U S A. 2007; 104(16):6752-7。GydF4y2Ba
- 49.GydF4y2Ba
adenot x,elmayan t,lauressergue d,boutet s,bouche n,gasciolli v等。DRB4依赖性TAS3反动SIRNAS控制叶片形态通过前7个。Curr Biol。2006; 16(9):927-32。GydF4y2Ba
- 50。GydF4y2Ba
邱克,李泽,杨Z,陈杰,吴Sx,朱XY等。EIN3和ORE1通过直接激活拟南芥中的叶绿素分解代谢基因来加速乙烯介导的叶片衰老。Plos Genet。2015; 11(7):E1005399。DOI:GydF4y2Ba10.1371 / journal.pgen1005399GydF4y2Ba.GydF4y2Ba
- 51。GydF4y2Ba
Fahlgren n,Montgomery Ta,Howell Md,艾伦e,dvorak sk,亚历山大al,等。TAS3 Ta-siRNA对蟾蜍素响应因子3的调节影响拟南芥的发育正时和图案化。Curr Biol。2006; 16(9):939-44。GydF4y2Ba
- 52。GydF4y2Ba
ellis cm,nagpal p,年轻的jc,hagen g,guilfoyle tj,芦苇jw。植物素响应因子1和生长素响应因子2调节拟南芥衰老和花粉器官脱落。发展。2005; 132(20):4563-74。GydF4y2Ba
- 53。GydF4y2Ba
徐XB,白人,刘CP,陈艾,陈QG,庄JY等。微稻草的基因组分析及其叶片衰老相关的靶基因。Plos一个。2014; 9(12):E114313。GydF4y2Ba
- 54.GydF4y2Ba
撒切尔SR,Burd S,Wright C,Lers A,Green PJ。MiRNA和靶基因在Sencing叶片和单片中的差异表达:小RNA的深度测序的见解和切割靶RNA。植物细胞环境。2015; 38(1):188-200。GydF4y2Ba
- 55.GydF4y2Ba
Naqvi AR,Haq QMR,Mukherjee Sk。番茄叶卷曲的MicroRNA分析新德里病毒(Tolcndv)被感染的番茄叶表明MiR159 / 319和MiR172的放松管制可能与叶卷曲疾病联系起来。Virol J.2010; 7:281。GydF4y2Ba
- 56.GydF4y2Ba
刘旭,李志强,姜志强,彭军,金军,等。LSD:叶子衰老数据库。核酸学报2011;39(数据库版):D1103-7。GydF4y2Ba
确认GydF4y2Ba
这项工作得到了中国自然科学基金(31400229,31200190)的支持。我们感谢QL Lang博士和JF Zhu从LC-Bio进行MiRNA的微阵列和数据分析。GydF4y2Ba
作者信息GydF4y2Ba
从属关系GydF4y2Ba
相应的作者GydF4y2Ba
附加信息GydF4y2Ba
利益争夺GydF4y2Ba
提交人声明他们没有竞争利益。GydF4y2Ba
作者的贡献GydF4y2Ba
XL构思并设计了实验。XH进行qRT-PCR实验,检测Chl含量。XH和CW进行标本采集、RNA提取和miRNAs制备。CW和YT对NCBI和LSD数据库中的相关数据进行了搜索和分析。XL写了这篇论文。所有的作者阅读并批准了最终的手稿。GydF4y2Ba
附加文件GydF4y2Ba
附加文件1:图S1。GydF4y2Ba
IDL和DP诱导叶片微阵列平台的差异表达miRNA分析。(a)mir156j;(b)mir164a;(c)MIR158B;(d)mir159a;(e)mir156h;(f)mir171a;(g)mir5020c;(h)mir5642a。误差条表示从三个生物重复获得的SD。 (DOC 224 kb)
附加文件2:GydF4y2Ba
在此附加表中,它包括4个子表。GydF4y2Ba表的所有注释也是如下所示。GydF4y2Ba表S1。GydF4y2BaRT-PCR引物序列。GydF4y2Ba表S2。GydF4y2Ba变暗处理后mirna发生变化(p < 0.01,信号强度> 500)。GydF4y2Ba表S3。GydF4y2Ba常见的miRNA在黑暗处理期间改变(信号深度> 500)。GydF4y2Ba表S4。GydF4y2BaDP / IDL中的黑暗诱导的衰老miRNA,miRNA靶标,GO条款和KEGG途径GydF4y2Ba拟南芥GydF4y2Ba叶子。(Doc 224 KB)GydF4y2Ba
权利和权限GydF4y2Ba
开放访问GydF4y2Ba本文根据创意公约署署署的条款分发了4.0国际许可证(GydF4y2Bahttp://creativecommons.org/licenses/by/4.0/GydF4y2Ba)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(GydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/GydF4y2Ba)适用于本条提供的数据,除非另有说明。GydF4y2Ba
关于这篇文章GydF4y2Ba
引用这篇文章GydF4y2Ba
霍,X.,王,C.,Teng,Y.GydF4y2Ba等等。GydF4y2Ba鉴定与黑暗引起的衰老相关的miRNAGydF4y2Ba拟南芥GydF4y2Ba.GydF4y2BaBMC植物BIOL.GydF4y2Ba15日,GydF4y2Ba266(2015)。https://doi.org/10.1186/s12870-015-0656-5GydF4y2Ba
收到了GydF4y2Ba:GydF4y2Ba
公认GydF4y2Ba:GydF4y2Ba
发表GydF4y2Ba:GydF4y2Ba
迪伊GydF4y2Ba:GydF4y2Bahttps://doi.org/10.1186/s12870-015-0656-5GydF4y2Ba
关键词GydF4y2Ba
- 拟南芥GydF4y2Ba
- Dark-induced衰老GydF4y2Ba
- 微阵列GydF4y2Ba
- miRNA.GydF4y2Ba