摘要
背景
蛋白质泛素化是真核生物中普遍存在的一种机制。拟南芥泛素修饰主要由2种泛素激活酶(E1s)、37种泛素结合酶(e2)和1300多种预测泛素连接酶(e3)介导,其中约470种为环型E3s。RING E3的大部分基因产物还有待鉴定在体外这可能是因为大规模的cDNA克隆、蛋白表达、纯化和鉴定所涉及的繁重工作。此外,一些可能是某些E3连接酶活性所必需的e2不能被表达大肠杆菌或培养的昆虫细胞,因此,保持无特征。
结果
利用RIKEN拟南芥全长cDNA文库(RAFL),采用“分裂引物”PCR法和小麦胚细胞无系统,建立拟南芥E2和RING E3酶的文库。我们表达了35个拟南芥e2,其中包括6个此前未表达的酶,以及204个RING蛋白,其中大部分尚未进行功能鉴定。使用二硫苏糖醇(DTT)进行硫酯分析显示,所有表达的e2都形成了DTT敏感的泛素硫酯。在RING蛋白的表达分析中,有31个蛋白表现出较高的分子印迹,这可能是其功能活性的结果。另外27个RING蛋白的活性通过AtUBC10和/或一组不同的e2进行评估。27个环E3s均显示泛素连接酶活性,其中17个环E3s。他们的活动首次被报道。
结论
本研究采用的小麦胚细胞无表达系统是一种真核表达系统,与植物内源蛋白表达更为接近,非常适合于拟南芥e2和RING e3的功能性表达。此外,本文描述的蛋白文库可用于进一步了解E2-E3特异性,并作为蛋白质-蛋白质相互作用筛选的平台。
背景
蛋白质泛素化是一种翻译后修饰,涉及一种高度保守的76个氨基酸的蛋白质,称为泛素(Ub),在真核生物中调节多种靶点[1- - - - - -3.].在植物中,泛素化参与多种生物过程的调控,包括生长发育、对生物和非生物胁迫信号的响应以及对染色质结构的调控[4- - - - - -7].Ub与多种靶蛋白共价连接需要三种酶催化的级联反应:泛素激活酶(E1)、泛素结合酶(E2)和泛素连接酶(E3)。e3是泛素化级联中最多样化的酶,可能是底物特异性的主要决定因素[2].E3蛋白根据E6-AP c -末端同源性(HECT)、U-box或真正有趣的新基因(RING)被分为三类。这些域主要充当E2对接站点。
在atp依赖的反应中,Ub的E1依赖活化启动泛素化,最终在E1催化Cys残基和Ub的羧基末端Gly之间形成硫酯连接。然后,活化的Ub通过硫酯连接转移到E2的UBC结构域内的催化Cys残基。最后,E3蛋白识别目标蛋白,并介导Ub的c端Gly羧基与目标Lys ε-氨基之间形成异肽键。根据E3的类型,Ub在最后一步直接从E2 (RING-和u -box-型E3)转移到目标蛋白,或在Ub与E3 (hect -型E3)形成硫酯后[6].E1-E2-E3酶促反应的结果差异很大,因为它们可能在不同构型的目标蛋白中添加一个或多个Ub(s)(分别为单泛素化或多泛素化)[8].因此,泛素化可作为蛋白质激活、26S蛋白酶体降解、细胞内定位、囊泡转运或组蛋白修饰和转录调控的信号[9,10].
在拟南芥中,编码介导Ub修饰的酶的基因占了基因组的很大一部分[2].拟南芥基因组中编码E1的两个相关基因:泛素激活1 (AtUBA1)和泛素激活2 (AtUBA2) [11].这些蛋白质彼此之间有大约80%的氨基酸同源性,并且与哺乳动物和酵母酶有保守的氨基酸序列[8].以e2为例,拟南芥基因组编码48个蛋白质,包含大约140-200个氨基酸的保守区域,称为UBC域[12,13].48个含UBC结构域的蛋白中有37个被认为与Ub (e2)结合。另外8种缺乏被称为泛素酶变体(UEVs)的催化Cys,其余3种催化泛素样蛋白(UBLs)的结合。48个基层组别按彼此的身分划分为16个小组别[13].据预测,拟南芥基因组中有1300多个基因编码E3连接酶组分[2].含有HECT和U-box结构域的蛋白分别由7个和64个基因编码[6],而超过470个基因编码含有RING结构域的蛋白质[14].利用RING结构域与E2结合的E3s可分为简单E3s和复杂E3s。在许多情况下,简单的RING e3在一个蛋白质中同时包含E2结合域(RING)和底物结合域,而在其他情况下,它们可能作为两个不同的RING蛋白质的homo或heterodimers [14].另一方面,复杂的RING e3包含多种不同的蛋白质。最具特征的是拟南芥CULLIN1、CUL3a/b或CUL4的cullin-RING ligase (CRL) e3,它是一个平台,将两个密切相关的环型蛋白(RBX1a/b)中的一个连接到超过800个底物识别亚基[15].为了便于在体外在我们的研究中,我们主要关注简单的拟南芥RING E3s。
环型E3连接酶共享一个富含Cys的环结构域,其中包含8个保守的Cys和/或His残基,并结合两个锌(Zn)离子[14,16].其他一些结构域,如Zn手指、LIM和PHD,也显示出与RING结构域相似的Cys和His残基模式,尽管它们的折叠和功能不同[17,18].环域中的8个Zn配位残基与Zn离子形成交叉支撑结构,作为E2相互作用的平台[16].拟南芥的RING蛋白根据锌配位残基类型和氨基酸数量分为3种RING类型(RING- h2、RING- hca和RING- hcb)和5种修饰型(RING-v、RING- c2、RING- d、RING- s /T和RING- g) [14].这些锌配位残基中的一个或多个突变可能会破坏RING结构域,从而介导蛋白质泛素化。
作为RING e3活动的要求在体外被认为和那些是一样的在活的有机体内,即使没有它们的生理基础[13],对RING E3s基因产物进行功能表征是可能的。据我们所知,之前进行的最大规模的分析使用了表达于大肠杆菌细胞。首先测试了~64个RING E3连接酶的泛素化活性在体外与AtUBC8 [14],然后加上不同UBC亚科的代表性成员[13].虽然大多数检测的RING e3显示活性,但19个RING e3对所有检测的e2显示无活性[13,14].表达后7个e2不溶大肠杆菌和/或培养昆虫细胞[13],从而阻止了它们在泛素化分析中的应用。这可能是其中一个e2对这些明显不活跃的E3s的活性所必需的,E3s的表达有错误的折叠或需要额外的蛋白质。因此,在我们的研究中,我们使用了一个真核无细胞系统来表达和分析拟南芥e2和RING e3的活性。使用无细胞蛋白合成系统对基因产物进行生化表征是非常方便的,因为细胞毒性不受关注[19].特别是小麦胚细胞无表达系统,它是一个真核表达系统,更接近于植物蛋白的内源性表达,它成功表达了几种多结构域的功能性真核蛋白[20.].为了对拟南芥e2和RING E3s进行大规模分析,我们采用了RIKEN拟南芥全长(RAFL) cDNA文库作为e2和RING E3s cDNA的主要来源。采用“分离引物”PCR法高通量制备转录模板,构建了35个e2和204个RING e3蛋白文库。最后,我们用小麦胚芽粗提物验证了所有表达的e2和代表性的RING e3的生化活性。
结果
小麦胚细胞无表达系统表达了37个拟南芥中的35个
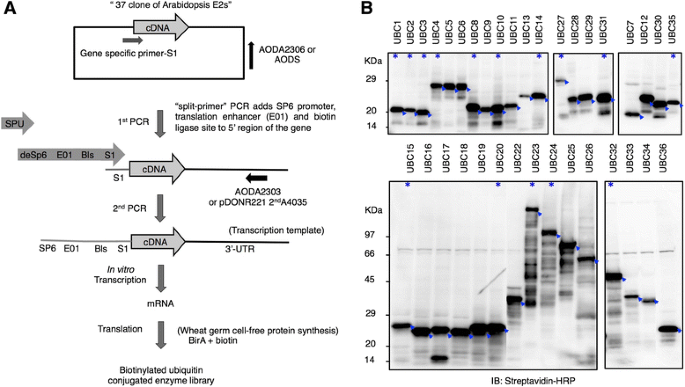
我们的目的是收集尽可能多的目前在拟南芥中注释的e2的cDNA克隆,并利用小麦生殖细胞无系统表达它们,并测试它们的功能活性。据预测,拟南芥基因组编码了37个被认为具有e2功能的基因[13].我们从RAFL cDNA文库中收集了这37个基因的cDNA克隆[21]或从表中列出的其他资源1.我们以' split-primer ' PCR和37个cDNA克隆为模板,将SP6启动子、E01增强子区域和生物素连接酶位点(Biotin ligase site, Bls)的序列添加到5 '端,制备了转录模板(图3)。1).该方法适用于高通量制备转录模板[22].在体外通过小麦胚芽无细胞系统的双层模式转录后,37个基因中有35个n -末端生物素化(N-bio-) e2表达。1 b).与之前的研究相比,这一表达分析代表了拟南芥翻译e2的最大集合。一组e2包括UBC12、UBC23、UBC24、UBC25、UBC31、UBC33,之前未表达过在体外[8,13,23],利用小麦胚芽无细胞系统成功表达。只有UBC21和UBC37蛋白在我们的表达系统中没有表达。他们的mRNA水平与其他人相当,但我们无法通过免疫印迹分析检测到相应的蛋白。据报道,UBC37在细菌中表达时会发生广泛的蛋白质水解[13],而UBC21则不表达大肠杆菌或者使用人工培养的昆虫细胞[13,23].
利用小麦胚细胞无生物素系统构建拟南芥E2蛋白文库一个带n端生物素标签的拟南芥E2文库的小麦胚芽高通量生产流程图第一步是使用2步“分裂引物”PCR高通量制备用于转录的DNA模板,然后在体外利用噬菌体编码的SP6 RNA聚合酶进行转录,最后利用小麦胚芽无细胞系统进行翻译。所有步骤均在96孔微量滴定板中进行。b小麦无胚细胞系统表达n -bio- e2的免疫印迹分析。将2-6 μL粗制的带有n-末端生物素标记的E2蛋白进行SDS-PAGE检测,采用链霉亲和素- hrp抗体进行检测。在37个预测拟南芥中,共检测到35个。图中的箭头显示了每个E2的预期信号,星号表示后面使用的E2在体外泛素化分析(图。4,无花果。5,无花果。6)
所有表达的都是e2催化的dtt敏感Ub偶联在体外
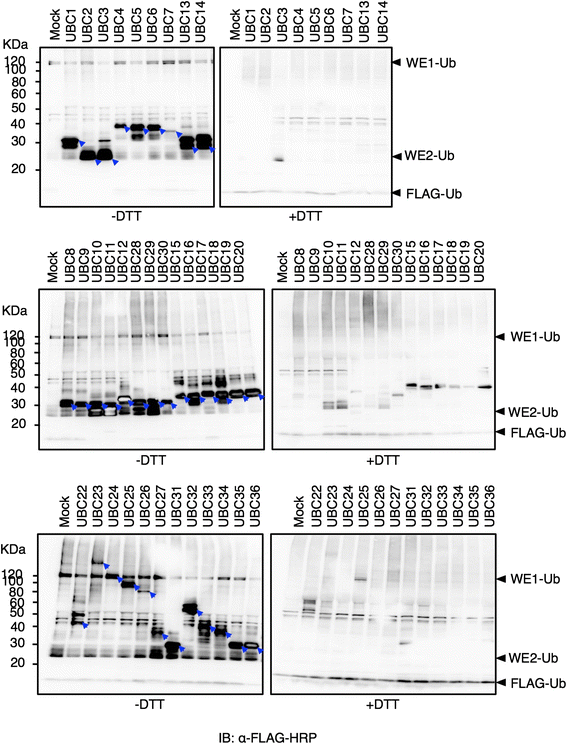
利用小麦胚芽细胞无表达系统表达35个拟南芥e2后,检查这些表达的蛋白是否具有功能活性是很重要的在体外特别是此前未报道过的6个e2表达。e2的活性是通过其在“硫酯试验”中与Ub形成硫酯连接的能力来确定的,这是独立于E3的,或者是通过其对特定环E3泛素化活性的要求来确定的。由于拟南芥E2-E3特异性的不确定性和大量的RING e3在基因组中,我们倾向于对所有表达的e2使用独立于e3的硫酯测定。在这种分析中,反应在还原条件下终止(SDS样品缓冲液与DTT)或在非还原条件下终止(SDS样品缓冲液与8 M尿素)。与8 M尿素处理相比,DTT处理切断了Ub的E2活性位点半胱氨酸和羧基端之间的硫酯连接[24].
为了评估使用含有E2的小麦胚芽提取物进行硫酯测定的可能性,我们测试了N-bio-UBC1作为代表E2,在flag标记的Ub (FLAG-Ub)和/或兔E1存在或不存在时与Ub形成硫酯连接的能力(附加文件)1).使用anti-FLAG-HRP进行免疫印迹分析(附加文件1A),显示dtt敏感的Ub偶联,无论添加E1(如下面两个箭头所示),这表明WE1的活性。该图还显示,在E1缺失的情况下,抗flag抗体检测到另一个与E1- ub等效的dtt敏感信号(如图2上箭头所示)ndlane),也指WE1活动。用链霉亲和素- hrp免疫印迹法检测未修饰的bio-UBC1(附加文件1B,如下箭头所示),并显示了一个额外的dtt敏感带,其大小相当于单个Ub加合物(如上箭头所示)。无论添加FLAG-Ub,都检测到带移,表明存在内源胚芽Ub。综上所述,这些结果证实了小麦胚芽内源E1的活性以及小麦胚芽提取物中Ub的存在,与之前的报道一致[25].
因此,我们利用小麦胚芽基硫酯法检测了35个n -bio- e2的活性,并依赖于内源性E1的活性。值得注意的是,所有35个表达的e2都能够催化dtt敏感的Ub偶联在体外对FLAG-Ub进行印迹后,基于小麦胚芽提取物的测定(图。2,摘要见表1).其中包括6个之前从未表达过的e2 (UBC12、UBC23、UBC24、UBC25、UBC31和UBC33),以及其他在之前研究中表达但没有活性的e2 (UBC16、UBC17、UBC18、UBC20、UBC26),以及激活某些e3但未能成功与Ub形成硫酯连锁的e2 (UBC3、UBC5、UBC6、UBC29、UBC30、UBC22和UBC34)。免疫印迹分析中出现了UBC15、UBC16、UBC17、UBC18、UBC22等部分e2条带。在25-30 KDa左右检测到可能的小麦胚芽内源e2 (WE2s)背景,但幸运的是,这些信号足够弱,可以区分重组e2的活性(图2)。2).因为小麦胚芽提取物可能含有活性E3s [26],我们无法确定这些e2的活性是否取决于特定E3或其他蛋白质(如激活剂)的存在。
利用小麦生殖细胞无细胞表达系统共表达了204个拟南芥RING蛋白
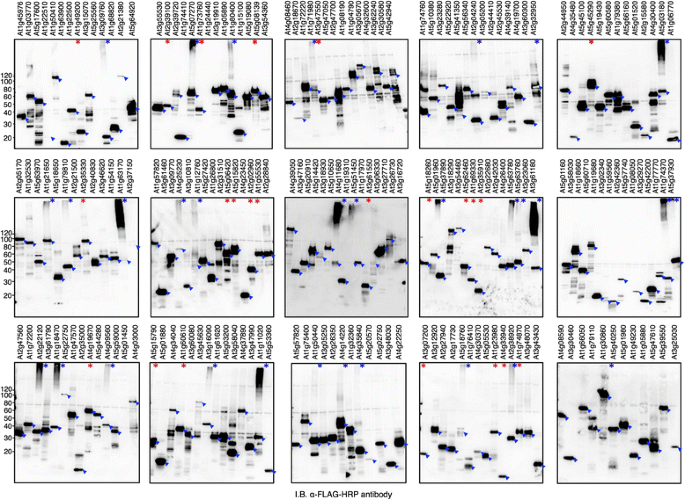
据预测,拟南芥基因组编码超过470种包含环结构域的蛋白质[14].为了构建拟南芥RING蛋白文库,我们从RAFL文库中收集了274个cDNA克隆[21]根据注释的RING蛋白[14]和RAFL数据库中注释的基因[21].我们使用“分裂引物”PCR方法制备了带有n端标记序列的转录模板(附加文件2).我们能够为208个RING克隆构建转录模板(大约占收集克隆的75%)(附加文件3.).在使用小麦胚芽无细胞系统的双层模式表达后,通过免疫印迹分析确认了208个RING蛋白编码mrna中的204个表达(图2)。3.).15种rna以相对较低的水平表达。我们将表达蛋白的大小与RAFL数据库中记录的预期分子量进行了比较。我们注意到,并非所有来自RAFL的cDNA克隆都与TAIR v10的代表性基因模型相匹配。因此,我们主要使用RAFL信息进行比较,因为RAFL信息是我们合成RING蛋白文库所用cdna的来源。因此,204个表达的蛋白中,除了7个,其他所有蛋白的分子量都与预测的相匹配(+/- 20 KDa)。这7个蛋白比预期的RAFL大小小> 20 KDa,被认为是被截断的(附加文件3.).有趣的是,在检测表达的RING蛋白时,我们注意到一组31个具有抗flag高分子涂片的蛋白,或在溶解凝胶顶部附近的非常高的分子块上具有免疫反应性的蛋白(图。3.,用蓝色星号;表格2).由于RING蛋白被预测为Ub E3连接酶,而小麦胚芽提取物含有内源性E1、E2和Ub,我们假设这些涂片和高分子量形式是Ub连接酶活性导致的。
环蛋白通过WE1和WE2催化泛素化活性
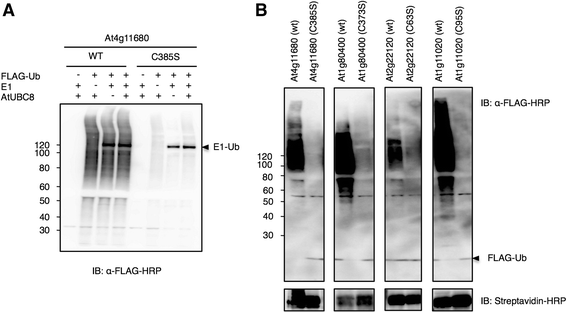
为了验证某些RING蛋白表达后出现的涂片和高分子量形态是否源于提取物中的RING活性,我们在维持RING结构和功能所需的第三个金属配体残基的密码子上引入点突变(用丝氨酸密码子取代半胱氨酸)[14].我们选择At4g11680作为环蛋白的代表,因为它在表达后产生了易于检测的高分子涂片(图4)。3.).一个在体外采用野生型N-bio-At4g11680 (wt)及其对应的RING突变体N-bio-At4g11680 (C385S)进行泛素化分析。如图所示。4, At4g11680 (wt)促进高分子量涂片的产生,无论是否添加E1或E2 (AtUBC8)。相反,At4g11680 (C385S)的RING突变体促进高分子量涂片产生的能力显著降低。这一结果表明,RING蛋白活性对于Ub涂片的生产是必需的,而且这些蛋白独立于拟南芥E1和E2,可能利用了WE1和WE2。为了进一步验证这一假设,我们选择了另外三个在表达时也显示出高分子涂片的RING蛋白。分别是At1g80400、At2g22120和At1g11020。这些蛋白以及At4g11680通过生物素标记表达。同样,在每个蛋白质的第三个金属配体残基的密码子上引入点突变,并使用这两种形式进行测试在体外泛素化分析。与相应的野生型蛋白相比,RING突变体促进泛素化的能力大大降低(图1)。4 b).这些数据表明,表达的RING蛋白通过WE1和WE2具有功能活性。此外,在小麦胚芽无细胞系统中表达的泛素化蛋白积累也提示内源性Ub的存在以及小麦胚芽26S蛋白酶体的减少或不活性,这也与之前的报道一致[25].
小麦germ-based在体外环蛋白泛素化分析显示为高分子涂片。一个在生物素标记下表达At4g11680及其相应的RING突变体,并在FLAG-Ub、E1和/或AtUBC8存在或不存在泛素化活性标记的情况下分析为代表蛋白。将第三个金属配体Cys替换为Ser后,用抗flag - hrp抗体对FLAG-Ub进行blotting,导致涂片减少。反应中E1或AtUBC8的缺失并不能取消高分子涂片。b另外三个RING蛋白At1g80400、At2g22120和At1g11020及其RING突变体和At4g11680在FLAG-Ub存在下进行了分析。经抗flag - hrp抗体印迹,4个具有RING突变体的蛋白活性明显降低,而具有完整RING结构域的蛋白在不添加E1或E2的情况下仍具有活性。侧箭头指游离的FLAG-Ub迁移到凝胶底部
环蛋白与AtUBC10具有泛素化活性
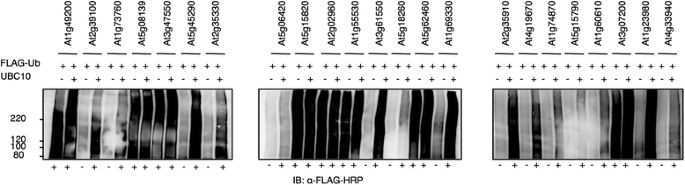
31个RING蛋白在小麦胚芽无细胞系统中表达时具有明显的高分子印迹,表明具有活性,而其他大部分表达的RING蛋白不具有活性。为了测试这些RING蛋白的功能活性,我们进行了研究在体外添加FLAG-Ub和N-bio-UBC10对23个RING蛋白进行泛素化分析,以增加分析的敏感性,并确定拟南芥E2是否是必需的。23种RING蛋白包括各种类型的RING蛋白(Table2额外的文件3.).一些RING蛋白在加入UBC10后才表现出多泛素化活性,这表明这些RING蛋白需要拟南芥E2(图2)。5)或者这种E2型在小麦胚芽中不存在。相比之下,其他的RING蛋白在没有UBC10的情况下表现出多泛素化活性,这表明这些RING蛋白在WE2下表现出弱活性,加入FLAG-Ub后可以明显检测到。
环蛋白具有不同的E2亚家族泛素化活性
为了进一步测试RING蛋白的功能活性,我们选择了三个RING蛋白(ATL2, At3g74410和At3g15580),这些蛋白在不同的拟南芥e2 [13].另一个介导组蛋白H2B单泛素化的RING蛋白名为histone monoubiquitination 1 (HUB1)。有报道称HUB1专门利用UBC1和UBC2进行H2B单泛素化在体外而且在活的有机体内[27];因此,观察其他e2是否能促进HUB1活性是很有意义的。我们利用小麦胚芽对这四种蛋白的活性进行了测试在体外来自不同亚群的e2存在时的泛素化分析。所有检测的RING蛋白均显示两个亚家族VI e2 UBC8和UBC10的相对密集涂片(图2)。6),在某些情况下还伴有XIII E2 UBC31亚科。对于At2g15580, UBC10存在时涂片最明显,而UBC8和UBC31存在时涂片稍低。HUB1显示UBC8和UBC10强涂片,UBC2中涂片。ATL2也显示UBC31、UBC8和UBC10的涂片相对密集。综上所述,这些结果表明一些RING蛋白的活性在之前使用表达时没有表现出活性大肠杆菌表明真核表达系统在拟南芥蛋白功能分析中的重要性。
讨论
通过确定这些基因编码的假定蛋白质中的保守区域,完整的基因组序列使推断基因的功能变得更加容易[28].然而,确定的任务需要实验验证。对于拟南芥中编码泛素化途径酶核的基因,这些基因编码的大部分蛋白质在生物化学上是无特征的。在这项研究中,我们使用小麦生殖细胞无系统表达了拟南芥95%的E2蛋白组(37种酶中的35种)(图3)。1 b).这个蛋白质文库包含了所有之前被描述的e2 [8,13,27,29].亚家族XIV的成员,包含预测跨膜结构域,表达不缺失。ubc 16-18未表达大肠杆菌或培养昆虫细胞[13],但使用小麦无胚细胞系统成功表达。令人惊讶的是,所有35个表达的e2都显示了dtt敏感的Ub偶联活性(图。2),证实了以真核小麦胚芽为基础的蛋白表达系统在研究真核蛋白功能方面的优势。通过这项研究,我们以功能形式提供了泛素化过程中最重要的酶的最大集合。这一优势使得在体外对拟南芥中E2-E3的分析可能有助于我们对其特异性的认识。
利用小麦胚芽无细胞系统,我们还能够合成204个拟南芥RING E3s蛋白文库,占拟南芥RING蛋白组的40%以上(图3)。3.).据我们所知,这也是报道的最大的表达RING蛋白集合。RAFL等全长cDNA文库的可用性,以及“分裂引物”PCR等用于制备线性转录模板的PCR方法,使我们能够探索如此大量基因的产物在体外.与传统的克隆和表达方法相比,我们的方法绕过了耗时的亚克隆步骤,进入表达载体,与小麦胚细胞无系统结合,实现了高通量的蛋白表达[22].我们已经证明了27个RING蛋白作为E3连接酶的活性,其中17个是首次证明的(表2).
值得注意的是,这204个基因在相似的条件下扩增,在相同的条件下转录和翻译,用于高通量合成蛋白文库。未来根据每个模板cDNA的性质对PCR条件进行修改,可能会得到更多的转录模板。此外,在我们的研究中,我们可以从RAFL cDNA文库中收集到约470个注释的RING基因中的274个。加入RAFL cDNA文库以外的其他来源的RING cDNA,可能会提高我们的蛋白文库的覆盖率,并改善未来的分析。
硫代酸酯和在体外泛素化分析通常需要从重组表达或天然来源纯化蛋白质,并添加商业上可用的成分,如Ub和E1。因此,大规模在体外分析工作既费力又昂贵。当使用不含外源E1的小麦胚芽粗提物分析时,据报道,AtUBC22和AtUBC35等e2和CIP8等RING e3可以催化泛素化[25].因此,我们对35个e2和几个e3的活性进行了测试在体外基于其粗提物不纯化和不添加E1的分析。对UBC15、UBC16、UBC17、UBC18和UBC22等e2的硫酯分析中FLAG-Ub进行印迹,显示两条条带(图2)。2).对于UBC22,以前的报道清楚地显示了它独特的与一个或多个Ub分子结合的能力(13,24)。而对于其他的E2,需要进一步的研究来检验它们是否具有类似的能力,或者这个额外的条带是由于E2、其标记或Ub标记上添加了不特定的Ub标记而出现的。
RING蛋白表达后泛素化物种的检测(图。3.,无花果。4)也表明了泛素化蛋白在小麦胚芽提取物中的稳定性。这一发现与之前的一项研究一致[25],这可能表明小麦胚芽提取物中不存在26S蛋白酶体活性。使用荧光报告器验证蛋白酶体活性已成为可能[30.].在我们的研究中检测的所有27个E3s均显示UBC10和/或UBC8活性,这与人类UbcH5家族有关。这些e2在几乎所有植物器官中都大量表达[13]并被认为是淫乱的e2 [8].因此,它们可以与大多数e3一起工作也就不足为奇了。甚至HUB1 E3已经被证明专门使用UBC1和UBC2来进行H2B的单泛素化[27],在我们的研究中对UBC8和UBC10表现出较强的活性。这表明UBC8和UBC10可能具有普遍的泛素化功能在活的有机体内而UBC1和UBC2等其他e2可能参与组蛋白修饰等特定功能。本研究中所进行的E2-E3特异性分析可以提供一个潜在的数据集,对未来有帮助在活的有机体内分析。
本文所述的小麦胚芽蛋白库的使用不仅限于基因产物的分析,而且可以作为若干前瞻性研究的平台。我们的RING蛋白文库可用于筛选蛋白质之间的相互作用,并有助于发现拟南芥植物中新的RING e3 -底物关系。利用AlphaScreen蛋白-蛋白相互作用筛选技术与拟南芥关键调控蛋白筛选时,部分RING e3连接酶显示出显著的相互作用信号(未发表数据)。在未来,通过去除一些内源成分,如WE1(s)和/或WE2(s)来修饰小麦胚芽提取物,并可能分离完整的拟南芥26S蛋白酶体[31],可能会增加我们对拟南芥Ub蛋白酶体系统的认识。小麦胚芽系统容易产生不同n端序列的蛋白质,而且缺乏26S蛋白酶体活性,这使得该系统适合于系统分析n端规则[32].E2和RING e3酶功能性活性蛋白文库的建立是我们进一步了解E2 - e3相互作用和特异性的重要一步。扩展我们的系统来分析底物的泛素化,使用不同的E2-E3组合也可以增加我们对受泛素化调控的各种细胞过程的理解。
结论
在这项研究中,我们证明了使用真核和植物相关蛋白表达系统在执行中的重要性在体外拟南芥e2和RING e3序列分析。利用RAFL cDNA文库、“分裂引物”PCR方法和小麦胚芽无细胞系统,拟南芥E2和ring - E3蛋白组的表达量分别为95%和40%。本研究首次对几种蛋白质的功能活性进行了评估。本文描述的蛋白文库可用于提高对E2-E3特异性的认识,并作为通过蛋白-蛋白相互作用筛选识别新的靶底物的平台。
方法
植物材料
拟南芥col0种子产自理研生物资源中心。用30% (v/v)漂白剂消毒,在1% (w/v)琼脂培养基上用0.5× Murashige和Skoog培养基和3% (w/v) Suc连续光照培养。
转录DNA模板的克隆与构建
我们从拟南芥RIKEN全长(RAFL) cDNA文库中收集了29个UBC克隆和274个RING克隆。另外5个ubc分别为AtUBC7、AtUBC17、AtUBC21、AtUBC23、AtUBC31和AtUBC35,分别克隆到pT7Blue t载体或pDONR221 (TakaraBio、http://www.takara-bio.com/),从商用的拟南芥cDNA文库(Stratagene,http://www.stratagene.com/).采用巢式PCR方法从col0生态型拟南芥2周龄植株中扩增出AtUBC12和AtUBC37,并加入100 μM ABA。利用gateway克隆系统(Invitrogen, Carlsbad, CA)将扩增的插入片段克隆到pDONR221载体中,并对其序列进行确认。将8个克隆的序列与TAIR v10 (http://www.arabidopsis.org).使用Qiagen RNeasy植物RNA提取试剂盒(Qiagen, Valencia, CA)按照说明书提取总RNA。ubc和RING克隆的cDNA来源见表1和额外的文件3.,分别。
采用“分裂引物”PCR法高通量构建转录模板(图;1和额外的文件2),如前所述[22].本研究中使用的引物序列列在附加文件中4.第1轮PCR使用以下引物的100 nM进行:基因特异性引物- s1, 5’- ccacccaccaccaatgnnnnnnnnnnnnnnnnnnnnnnnnnnnnnn (n表示与目的基因编码区前20 bp的序列互补),以及基于插入方向的AODA2306或AODS。然后进行第二轮PCR,将启动子SP6和翻译增强子序列E01以第一个PCR产物为模板,在ORF的5 '端标记序列。PCR反应中使用2个引物,100 nM的SPu引物和1 nM的deSP6E02FLAG-S1或deSP6E02bls-S1分别生成n端flag标记和n端生物素连接位点(bls)融合的转录模板。反义引物为100 nM AODA2303或pDONR221ndA4035。根据RAFL数据库中保存的cDNA序列设计“分裂引物”PCR的基因特异性引物[21]或TAIR v10 (http://www.arabidopsis.org).
诱变
为了进行RING突变分析,我们设计了引物来产生3的点突变理查德·道金斯金属配体残渣(附加文件5),利用PrimeSTAR MAX DNA聚合酶(Takara, Kyoto, Japan)和含有RING cDNA的pDONR221载体作为PCR模板。序列分析证实了核苷酸的变化。
无细胞蛋白质合成
在体外如前所述进行转录和无细胞蛋白合成[33].利用SP6 RNA聚合酶对每个DNA模板进行转录。然后用乙醇沉淀合成的mrna,用日立R10H转子离心收集。每个mRNA被清洗并转移到翻译反应混合物中。翻译反应按照前面的描述在双层模式中进行[22].底层的平移混合物为60 A260小麦胚芽提取物的单位(无细胞科学,http://www.cfsciences.com)和2 μg肌酸激酶(Roche Diagnostics k.k.,http://www.roche-diagnostics.jp) 25 μL SUB-AMIX (cellfree Sciences)。subamix包含(最终浓度)30 mM Hepes/KOH (pH 8.0)、1.2 mM ATP、0.25 mM GTP、16 mM肌酸磷酸、4 mM DTT、0.4 mM亚精胺、0.3 mM每种20种氨基酸、2.7 mM醋酸镁和100 mM醋酸钾。上层放置125 μL SUB-AMIX,下层轻轻移液。为了标记生物素,在底层添加1 μL的由小麦无细胞表达系统产生的粗生物素连接酶(BirA), 0.5 μM(最终浓度)的d -生物素(Nacalai Tesque, Inc.,http://www.nacalai.co.jp)添加到两个层,如前所述[34].每个蛋白在16℃孵育~20 h后,分离成10 μl的等份蛋白,用液氮冷冻,-80℃保存。这些等分被用于表达分析和功能表征。
免疫印迹分析
免疫印迹法检测重组FLAG-tagged RING和生物素化UBC蛋白的表达。取2-6 μL的重组蛋白样品与3× SDS样品缓冲液混合,煮沸5 min。变性蛋白用5 - 20% SDS- page分离,使用Invitrogen, Invitrogen, Invitrogen, Invitrogen, Invitrogen, Invitrogen, Invitrogen, Invitrogen, Invitrogen, Invitrogen, Invitrogen。http://www.lifetechnologies.com)或EzFastBlot (ATTO,http://www.atto.co.jp).使用单克隆抗flag m2 -过氧化物酶(HRP)抗体(Sigma)或结合链霉亲和素HRP (Invitrogen)进行免疫印迹分析,使用Immobilon Western Chemiluminescent HRP底物(Millipore,http://www.millipore.com),根据制造商的程序。最后,使用ImageQuant LAS 4000 mini (GE医疗、http://www.gelifesciences.com).
硫代酸酯测定
硫酯测定如前所述[13],由于本研究的检测方法是基于小麦胚芽提取物,且为E1 (WE1),因此有轻微的修改。在总反应体积为25 μL的条件下,混合20 mM Tris-HCl, pH 7.4, 5 mM MgCl2, 3 mM ATP, 1 mg/ml BSA, 400 nM人重组FLAG-Ub(波士顿生物化学公司,http://www.bostonbiochem.com), 3 μL重组e2。反应混合物在37℃孵育5分钟,以DTT加2× SDS样品缓冲液或8 M尿素样品缓冲液不煮沸结束反应。4°C进行SDS-PAGE,然后使用anti-FLAG-HRP进行免疫印迹。除UBC22、UBC23、UBC24、UBC25、UBC26样品15 μL外,其余样品均采用10 μL的样品进行SDS-PAGE加载。
在体外泛素化分析
基于小麦胚芽的RING蛋白泛素化分析如前所述进行[25].测定在10 μL反应液中进行,反应液中含有20 mM Tris-HCl pH 7.5, 0.2 mM DTT, 5 mM MgCl2, 10 μM醋酸锌,3 mM ATP, 1 mg/mL BSA, 400 nM人重组FLAG-Ub或HA-Ub (Boston Biochem,http://www.bostonbiochem.com)、1 μL重组E2和1 μL重组RING蛋白在37℃下反应3 h,加入5 μL 3× SDS样品缓冲液,煮5 min,然后在5 - 20% SDS- page上进行分析,然后使用抗flag - hrp (Sigma)或抗ha - hrp(克隆3 F10)抗体(罗氏生命科学)进行免疫印迹(免疫印迹)。
支持数据的可用性
所有支持数据都包含在附加文件中。
缩写
- RAFL:
-
拟南芥RIKEN全长cDNA文库
- 乌兰巴托:
-
泛素
- E1:
-
Ubiquitin-activating酶
- E2:
-
Ubiquitin-conjugating酶
- E3:
-
Ubiquitin-ligase酶
- 德勤:
-
二硫苏糖醇
- HECT:
-
E6-AP c端同源性
- 环:
-
非常有趣的新基因
- UEV:
-
泛素酶变异
- UBL:
-
Ubiquitin-like蛋白质
- CRL:
-
Cullin-RING连接酶
- N-bio -:
-
n端生物素化的
- WE1:
-
小麦胚芽E1
- WE2:
-
小麦胚芽E2
- 美国劳工统计局:
-
生物素连接酶的网站
参考文献
Hershko A, Ciechanover A.泛素系统。《生物化学》1998;67:610-21。
泛素26S蛋白酶体蛋白水解途径。植物生理与生理化学。2004;5:535 - 538。
扩展的泛素和泛素样修饰剂的宇宙。植物杂志。2012;160:2-14。
刘文华,李文华,李文华。泛素-蛋白酶体途径与植物发育的关系。植物细胞。2004;16:3181 - 95。
黄晓明,李志强。植物泛素、激素与生物胁迫的关系。为机器人。2007;99:787 - 822。
与植物生物学关系密切的泛素/26S蛋白酶体系统。中国生物医学杂志。2009;10:385 - 397。
泛素和26S蛋白酶体在植物非生物胁迫信号传导中的作用。前面。植物科学》2014。doi:10.3389 / fpls_2014_00135.
泛素系统的泛素化机制。拟南芥图书。2014;12:e0174。
泛素依赖性蛋白降解。1996; 30:405-39。
泛素在细胞内吞和信号转导中的蛋白酶体独立功能。科学。2007;315:201-5。
Hatfield PM, Gosink MM, Carpenter TB, Vierstra RD.泛素激活酶(E1)基因家族在拟南芥.植物j . 1997; 11:213-26。
黄晓明,李志强,李志强,等。泛素化修饰在植物中的应用。植物学报,2001;6:463 - 463。
牛玉华,石磊,马璐,苏宁,高宇,刘os,等。E2和环E3连接酶泛素化酶的基因组分析和功能鉴定拟南芥.植物杂志。2005;139:1597 - 611。
王志强,张志强,张志强,张志强,等。拟南芥环型泛素连接酶家族的功能分析。植物杂志。2005;137:13-30。
张华华,张志华。cullin-RING泛素-蛋白连接酶。植物学报。2011;29(3):393 - 393。
dehaies RJ, Joazeiro CAP. RING Domain E3泛素连接酶。中国生物化学杂志。2009;39(3):349 - 356。
Lovering R, Hanson IM, Borden KL, Martin S, O 'Reilly NJ, Evan GI,等。锌指相关蛋白基序的鉴定与初步鉴定。中国科学(d辑)1993;90:2112-6。
Capili AD, Schlutz DC, Rausher IF, Borden KL.来自KAP-1辅抑制因子的PHD域溶液结构:PHD, RING和LIM锌结合域的结构决定因素。EMBO j . 2001; 20:165 - 77。
卡尔森ED,甘R,霍奇曼E,朱厄特MC.无细胞合成:应用成熟。生物技术放置2012;30:1185 - 94。
真核蛋白生产的无细胞表达系统。生物科技。2006;17:373-80。
张志勇,张志勇,张志勇,等。拟南芥全长cDNA收集的功能注释。科学。2002;296:141-5。
张志刚,张志刚,张志刚。高通量蛋白质组学的无细胞蛋白质合成系统。美国国家科学院。2002; 99:14652-7。
赵强,田明,李强,崔峰,刘玲,尹波,等。一个植物在体外泛素化分析系统。植物j . 2013; 74:524-33。
高通量分析监测e2 -泛素硫酯中间体的形成。酶学方法。2005。doi:10.1016 / s0076 - 6879 (05) 98009 - 9
Takahashi H, Nozawa A, Seki M, Shinozaki K, Endo Y, Sawasaki T.一种基于小麦细胞无蛋白合成的泛素化和多泛素化分析方法。植物学报。2009;9:39。
Girod PA, Vierstra RD.小麦胚芽提取物中一个主要的泛素偶联系统涉及到一个15 kda的泛素偶联酶(E2),该酶与酵母UBC4/UBC5基因产物同源。生物化学。1993;268:955 - 958。
曹燕,戴燕,崔松,马玲。拟南芥开花位点C染色质组蛋白H2B单泛素化调控开花时间。植物细胞。2008;20:2586 - 602。
Eric SL, Lauren ML, Bruce B, Chad N, Michael CZ, Jennifer B,等。人类基因组的初步测序和分析。大自然。2001;409:860 - 921。
Van Nocker S, Walker JM, Vierstra RD.拟南芥UBC7/13/14基因编码一个多泛素链形成的E2酶家族。生物化学。1996;271:12150-8。
Dantuma NP, Lindsten K, Glas R, Jellne M, Masucci MG。用于定量活细胞中泛素/蛋白酶体依赖的蛋白质水解的短寿命绿色荧光蛋白。Nat。Biotechnol。2000;18:538-43。
Book AJ, Gladman NP, Lee SS, Scalf M, Smith LM, Vierstra RD.拟南芥26S蛋白酶体的亲和纯化揭示了多种植物蛋白水解复合物。生物化学学报,2010;285:25554-69。
张志强,张志强,张志强,等。利用纯化小麦胚合成无细胞蛋白的实用系统。Nat Protoc。2010;5:227-38。
陈志明,陈志明,陈志明,陈志明,陈志明,等。小麦胚细胞无表达系统:遗传信息高通量物化的方法。方法中国生物医学杂志2005;310:131-44。
张志勇,张志勇,张志勇,等。拟南芥HY5蛋白作为DNA结合标签,用于琼脂糖/DNA微板上蛋白质的纯化和功能固定化。2月。2008;582:221-8。
确认
我们感谢Richard Vierstra (UW-Madison)对研究的有益建议和Judy Callis (UC-Davis)对研究的有益建议,编辑和评论手稿。这项工作得到了来自日本文部科学省的科学研究资助(B) (T.S.)、创新领域科学研究资助(T.S.)和药物发现、信息学和结构生命科学平台(T.S.)的资金支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们之间没有利益冲突。
作者的贡献
AR构思研究,参与研究设计,进行实验,撰写论文。MS和KS对实验设计进行了讨论,并提供了RAFL cDNA克隆。H Takahashi构思了这项研究,制作了大部分E2转录模板,并参与了数据解释。KN和H Takeda构思了这项研究,并参与了数据解释。TS构思并设计了这项研究,监督工作并修改了手稿。所有作者阅读并批准最终稿。
附加文件
额外的文件1:
小麦胚芽法测定UBC1的硫酯含量。小麦胚芽法测定UBC1的硫酯含量。Bio-UBC1粗蛋白在FLAG-Ub和/或E1存在或不存在时作为代表E2进行分析。37°C孵育2小时,然后用DTT或8 M尿素(-DTT)处理(a)抗标记- hrp抗体的免疫印迹分析显示UBC1具有DTT敏感的Ub偶联活性,无论添加了E1(参见下面两个箭头)。(b) streptavidin-HRP免疫印迹分析检测出bio-UBC1(见下箭头),显示dtt敏感的带移相当于单一Ub加合物(见上箭头)。(PPTX 198 kb)
额外的文件2:
拟南芥RING蛋白库的小麦胚芽生产流程流程图。第一步是使用2步“拆分引物”PCR高通量制备用于转录的DNA模板,然后在体外利用噬菌体编码的SP6 RNA聚合酶进行转录,最后利用小麦胚芽无细胞系统进行翻译。所有步骤均在96孔微量滴定板中进行。(55 PPTX kb)
额外的文件3:
拟南芥RING克隆的研究概况。我们展示了它们的表达和泛素化活性。本研究中使用的拟南芥RING蛋白及其在小麦生殖细胞无细胞系统中的表达及其泛素化活性综述。“M。wt. (Da)’表示根据RAFL数据库,表达蛋白的期望分子量。“高分子涂片”表示检测到涂片:一个采用免疫印迹法检测RING蛋白表达b在不添加E1或E2的情况下进行泛素化分析。' Activity with UBC8/10 '表示所测试的选定RING蛋白的E3连接酶活性cAtUBC8 [14]或d本研究中的AtUBC10。“与其他e2的活性”表示所测试的选定RING蛋白的E3连接酶活性e各种e2 (13]或f在这项研究中。“截断”指的是比预期大小少迁移超过20kda的蛋白质。“低表达”指的是在相对较低水平表达的蛋白质。缩写:是的,检测;不,不是检测;和,而不是测试。(XLSX 69 kb)
额外的文件4:
拟南芥e2和RING蛋白转录模板构建使用的引物列表。(XLSX 42 kb)
额外的文件5:
用于RING结构域诱变的引物列表。(XLSX 34 kb)
权利和权限
开放获取本文根据知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许不受限制地在任何媒体上使用、分发和复制,前提是您要适当地注明原作者和来源,提供创作共用许可的链接,并说明是否进行了更改。知识共享公共领域转让豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本文提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
拉马丹,A., Nemoto, K., Seki, M.。et al。拟南芥E2泛素结合酶和RING-type E3泛素连接酶的功能鉴定小麦胚芽蛋白库。BMC植物杂志15,275(2015)。https://doi.org/10.1186/s12870-015-0660-9
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-015-0660-9
关键字
- 拟南芥
- 泛素化
- Ubiquitin-conjugating酶
- 环型泛素连接酶
- 小麦胚芽蛋白库
- E2和E3筛选