- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
FtsZ蛋白在氯蜘蛛藻次级质体中的前瞻性功能gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba15gydF4y2Ba,文章号:gydF4y2Ba276gydF4y2Ba(gydF4y2Ba2015gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
双膜质体(初级质体)的分裂是通过收缩由多个质体分裂蛋白组成的环状分裂复合体来完成的。与原生质体的内共生起源一致,一些质体分裂蛋白来自蓝藻细胞分裂机制,另一些则来自宿主。在一些藻类谱系中,复杂质体,即“次级质体”,是由含原生质体的藻类的内共生吸收获得的,并被三到四层膜包围。虽然在携带二级质体的生物基因组序列中发现了一级质体分裂蛋白的同源基因,但这些蛋白的功能和二级质体分裂机制尚不清楚。gydF4y2Ba
结果gydF4y2Ba
为了深入了解叶绿体二级分裂的机制,我们对叶绿体二级分裂蛋白FtsZD-1和FtsZD-2进行了鉴定。FtsZ同源体由核基因组编码,携带n端质体靶向信号。免疫电镜观察显示,FtsZD-1和FtsZD-2在双酸酯质体中点均形成环状结构,其中有一个突出的类芘体gydF4y2BaBigelowiella•gydF4y2Ba.环总是与两个最内层质体膜的浅板状内陷有关。此外,基因表达分析证实gydF4y2BaftsZDgydF4y2Ba细胞分裂后不久,基因呈周期性增加gydF4y2Bab•gydF4y2Ba细胞周期,与质体分裂的时间不一致。gydF4y2Ba
结论gydF4y2Ba
我们的研究结果表明,氯蜘蛛植物FtsZD蛋白参与了质体内膜对的部分收缩,但不参与质体分裂的整个过程。目前尚不清楚外层质体膜是如何收缩的,也不清楚氯蜘蛛植物二级质体分裂的机制。gydF4y2Ba
背景gydF4y2Ba
质体是内共生衍生的细胞器,由于多次内共生事件,它们的进化历史是复杂的。植物和三个藻类类群(绿藻、红藻和蓝藻)通过异养原生生物和光合蓝藻之间的单一初级内共生获得了质体,我们将这一过程中产生的质体称为初级质体[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba].相比之下,许多其他藻类(如鞭毛藻、异孔藻、裸植藻、隐植藻、裸植藻和氯蛛丝植物)和尖复杂寄生虫具有复杂的质体。这些被称为次级质体,是由不同的原生生物通过内共生吸收红藻和绿藻而进化而来的[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba4gydF4y2Ba].多种次生内共生导致了当前质体生物的系统发育多样性[gydF4y2Ba5gydF4y2Ba].在结构上,原生质体和次生质体的包膜数量不同。初级质体被两层膜包围,而次级质体有一到两层额外的膜;裸裸藻和鞭毛藻的质体由三层膜包裹,其他的有四层膜[gydF4y2Ba6gydF4y2Ba].在四个膜结合的次生质体中,最里面的两个膜被认为是被吞噬藻类的初级质体膜的后代,最外面的两个膜分别被认为是宿主的前吞噬体膜和内共生的残余质膜,[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba].在红藻起源的一些次生质体中,最外层的膜与内质网(ER)相连,最近的ER-enclosure模型提出,最外层的一对膜来自宿主ER [gydF4y2Ba8gydF4y2Ba].这些额外的膜应该是核编码质体蛋白运输以及代谢物交换的障碍。因此,次生质体承载生物必须进化出突破膜的运输机制[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba].此外,在质体分裂方面,需要新的机制来收缩次生质体中附加的膜。gydF4y2Ba
初生质体的分裂是由两个包膜在分裂部位同时收缩来进行的,收缩是由一个环形分裂复合体介导的,该环状分裂复合体同时包围了两个膜的内外[gydF4y2Ba11gydF4y2Ba,gydF4y2Ba12gydF4y2Ba].与初生质体的起源一致,间质侧分裂复合体的蛋白质成分通常来自蓝藻细胞分裂蛋白,一些宿主来源的蛋白质组成了细胞质部分[gydF4y2Ba13gydF4y2Ba].在植物和藻类中,在质体分裂开始之前,小管状GTPase FtsZ在分裂位点内质体膜的基质表面组装成环状结构[gydF4y2Ba14gydF4y2Ba- - - - - -gydF4y2Ba18gydF4y2Ba].在模型植物中gydF4y2Ba拟南芥gydF4y2Ba时,FtsZ环(Z环)通过与整合膜蛋白ARC6相互作用被拴在内质体膜上[gydF4y2Ba19gydF4y2Ba], Z环的定位受几种基质蛋白的调节,MinD [gydF4y2Ba20.gydF4y2Ba],我的[gydF4y2Ba21gydF4y2Ba], arc3 [gydF4y2Ba22gydF4y2Ba],以及MCD1 [gydF4y2Ba23gydF4y2Ba].随后,基质质体分裂蛋白直接或间接吸收分裂复合物的细胞质组分,包括外膜蛋白PDV1和PDV2 [gydF4y2Ba24gydF4y2Ba],以及在细胞质部分组装成环状结构的与动力相关的GTPase DRP5B(也称为ARC5) [gydF4y2Ba25gydF4y2Ba].两种自组装的gtpase, FtsZ和DRP5B,被认为可以产生膜收缩的收缩力[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].在早期的电子显微镜研究中,在植物和藻类质体膜的基质和细胞质表面的质体分裂位点观察到电子密集的环结构,称为质体分裂环[gydF4y2Ba28gydF4y2Ba].最近的一项研究表明,原始红藻的外PD环gydF4y2BaCyanidioschyzon merolaegydF4y2Ba由聚葡聚糖丝组成[gydF4y2Ba29gydF4y2Ba], DRP5B (CmDnm2)介导的纤维滑动可产生收缩力使膜收缩[gydF4y2Ba30.gydF4y2Ba].类植物质体分裂机制的主要特征似乎广泛保守于具有质体分裂蛋白同源性的原生质体承载藻类[gydF4y2Ba31gydF4y2Ba].然而,在某些藻类谱系中,一些质体分裂蛋白是缺失的[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba32gydF4y2Ba].例如,蓝叶植物gydF4y2BaCyanophora paradoxagydF4y2Ba基因组不编码任何已知的宿主来源的质体分裂蛋白,外膜的收缩似乎依赖于DipM的肽聚糖水解活性,就像在蓝藻细胞分裂中一样[gydF4y2Ba33gydF4y2Ba].红藻的基因组gydF4y2Bac . merolaegydF4y2Ba该蛋白仅编码两种植物样质体分裂蛋白FtsZ和DRP5B,目前尚不清楚质体分裂复合体在分裂位点的定位是如何调控的。gydF4y2Ba
在次生质体生物的全基因组中,也发现了若干原生质体分裂蛋白的同源基因[gydF4y2Ba13gydF4y2Ba].如表所示gydF4y2Ba1gydF4y2Ba(更新自[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba18gydF4y2Ba]),异位子中存在FtsZ、MinD、MinE和/或DRP5B的同源基因gydF4y2Ba这种pseudonanagydF4y2Ba,gydF4y2BaPhaeodactylum tricornutumgydF4y2Ba,gydF4y2BaAureococcus anophagefferensgydF4y2Ba即触生植物gydF4y2BaEmiliania huxleyigydF4y2Ba,以及隐生植物gydF4y2BaGuillardiaθgydF4y2Ba基于BLAST调查。这些同源基因被认为是通过二次内共生从被吞噬的红藻中获得的。质体分裂蛋白大多由核基因组编码,是内共生基因转移的结果gydF4y2Bag .θgydF4y2Ba和心灵gydF4y2Ba大肠huxleyigydF4y2Ba由质体基因组编码[gydF4y2Ba34gydF4y2Ba,gydF4y2Ba35gydF4y2Ba),而gydF4y2Bag (ftsZgydF4y2Ba该基因在红藻内共生体的核形态基因组中被发现,核形态基因组是红藻内共生体的残余核基因组[gydF4y2Ba36gydF4y2Ba].二级质体分裂蛋白的定位研究仅限于少数几种生物。绿色荧光蛋白(GFP)标记实验证实了硅藻中的FtsZ蛋白gydF4y2BaChaetoceros negogracilegydF4y2Ba携带n端质体靶向信号[gydF4y2Ba37gydF4y2Ba],免疫荧光定位显示gydF4y2Bat . pseudonanagydF4y2BaDRP5B在质体分裂位点形成环状结构[gydF4y2Ba11gydF4y2Ba].因此,二级质体膜内对的收缩似乎是由来自被吞噬的内共生体的部分初级质体分裂复合体实现的。虽然目前还不确定外对次级质体膜是如何分裂的,但一项对尖复体寄生虫的研究揭示了这个问题。尖复体具有非光合作用的次生质体(称为尖质体),被四层膜包围。van Dooren et al.(2009)报道了一种与动力相关的蛋白质gydF4y2Ba刚地弓形虫gydF4y2Ba(TgDrpA)定位于根尖质体表面的点状区域,是根尖质体分裂所必需的[gydF4y2Ba38gydF4y2Ba].的gydF4y2BadrpAgydF4y2Ba是一种尖端复合物特异性基因,在系统发育上不同于gydF4y2Badrp5BgydF4y2Ba原生质体生物的基因。有趣的是,尖复合体缺乏包括FtsZ和DRP5B在内的初级质体分裂蛋白的同源基因,这表明尖复合体已经失去了初级质体分裂机制,发展出了一种由DrpA介导的新机制[gydF4y2Ba38gydF4y2Ba].迄今为止,很少有蛋白质被定性为二级质体分裂机制的一部分,而且,二级质体分裂的全貌仍未被揭示。gydF4y2Ba
为了深入了解二级质体分裂机制,我们研究了通过摄取一种绿藻而获得二级质体的氯蜘蛛藻中初级质体分裂蛋白的同源性。叶绿体被四层膜包裹。每个质体在内外膜对之间的质周隔室中都有一个内共生体的残余核(称为核形体),核形体的存在将使质体的分裂更加复杂[gydF4y2Ba39gydF4y2Ba].已经完成了氯蜘蛛植物的基因组测序gydF4y2BaBigelowiella•gydF4y2Ba,包括核基因组[gydF4y2Ba40gydF4y2Ba], nucleomorph [gydF4y2Ba41gydF4y2Ba]和plastid [gydF4y2Ba42gydF4y2Ba].先前的蛋白质组学研究在分离的细胞中鉴定出两个核编码的FtsZ同源物gydF4y2Bab•gydF4y2Ba叶绿体(gydF4y2Ba43gydF4y2Ba].在本研究中,我们报道了两个FtsZ蛋白FtsZD-1和FtsZD-2在氯蜘蛛植物中的详细亚细胞定位和周期性基因表达模式gydF4y2Bab•gydF4y2Ba.我们的研究结果表明,FtsZD蛋白参与了最内层两层质体膜的部分收缩,但不参与质体分裂的整个过程。目前尚不清楚外层质体膜是如何收缩的,并且尚不清楚在氯蛛形植物中二级质体分裂所需要的成分。gydF4y2Ba
结果gydF4y2Ba
叶绿体分裂蛋白FtsZD的序列分析gydF4y2Ba
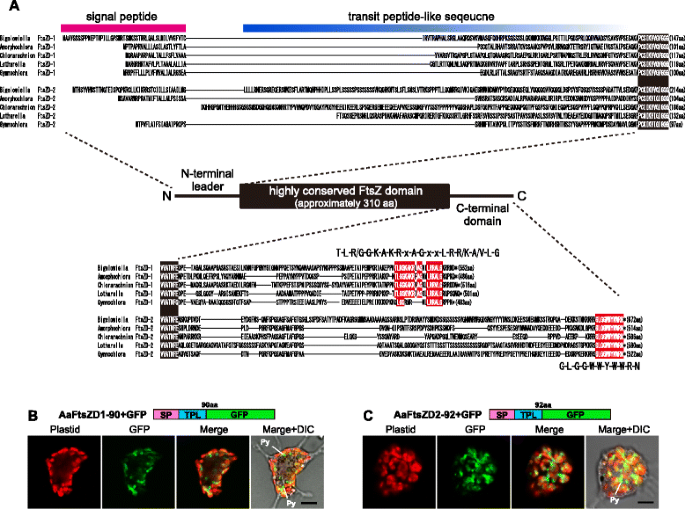
为了鉴定叶绿体分裂蛋白的同源基因,我们对叶绿体分裂蛋白进行了研究gydF4y2Bab•gydF4y2Ba基因组的相互BLAST与相应的已知序列gydF4y2Ba拟南芥gydF4y2Ba,gydF4y2Ba衣藻reinhardtiigydF4y2Ba,gydF4y2BaCyanidioschyzon merolaegydF4y2Ba[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].FtsZ蛋白有两个同源基因gydF4y2Bab•gydF4y2Ba先前报道的核基因组[gydF4y2Ba43gydF4y2Ba],其余ARC6、MinC、MinD、MinE、DRP5B、PDV、ARC3、MCD1和PDR1未检测到(表2 - 4)gydF4y2Ba1gydF4y2Ba).两种类型gydF4y2BaftsZgydF4y2Ba基因,名叫gydF4y2BaftsZD-1gydF4y2Ba而且gydF4y2BaftsZD-2gydF4y2Ba的RNAseq转录组数据中也发现了四种氯蜘蛛植物,gydF4y2BaAmorphochlora amoebiformisgydF4y2Ba,gydF4y2BaChlorarachnion reptansgydF4y2Ba,gydF4y2BaGymnochloragydF4y2Basp. (CCMP2014),和gydF4y2BaLotharella globosagydF4y2Ba.所有这些FtsZD蛋白都由一个n端前导蛋白、一个高度保守的FtsZ结构域和一个可变的c端区域组成(图2)。gydF4y2Ba1gydF4y2Ba).n端先导被预测为一个典型的质体靶向信号,由一个ER靶向信号肽和一个转运肽样序列组成(图2)。gydF4y2Ba1gydF4y2Ba)使用signalp3.0 [gydF4y2Ba44gydF4y2Ba]和ChloroP 1.1 [gydF4y2Ba45gydF4y2Ba)项目。为了证实n端前导蛋白的质体靶向能力,我们使用的瞬态变换系统进行了基于gfp的实验gydF4y2Ba答:amoebiformisgydF4y2Ba.的n端前导的GFP融合蛋白gydF4y2Ba答:amoebiformisgydF4y2BaFtsZD蛋白(AaFtsZD1-N90 + GFP和AaFtsZD2-N92 + GFP)被导入质体间质(图。gydF4y2Ba1 b, cgydF4y2Ba).FtsZD蛋白的c端区域在序列和长度上呈发散性,而FtsZD-1和FtsZD-2蛋白的c端末端大多保守;FtsZD-1的c端保守基序为' T-L-R/ g - g -K-A- k - r -x- a - g -x- l - r - r /K-A/V-L-G ', FtsZD-2的c端保守基序为' g - l - g - g - g - w - w - y - w - w - r - n '。gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
chlorarachniophyte FtsZD蛋白N端和c端序列的比对。gydF4y2Ba一个gydF4y2Ban端前导蛋白被预测由一个信号肽和一个转运肽样序列组成。高度保守的FtsZ结构域内的相同氨基酸用黑色框起,c端保守基序用红色框突出显示。的FtsZD-2序列gydF4y2BaChlorarachniongydF4y2Ba而且gydF4y2BaLotharellagydF4y2Ba缺少n端。(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba)的共焦图像gydF4y2BaAmorphochlora amoebiformisgydF4y2Ba表达GFP的细胞与AaFtsZD-1和AaFtsZD-2的n端前导蛋白融合。图像显示质体的叶绿素自发荧光为红色,而绿色荧光为GFP。类pyrenoid (Py)是质体间质中没有叶绿素自发荧光的一部分。比例尺为5 μmgydF4y2Ba
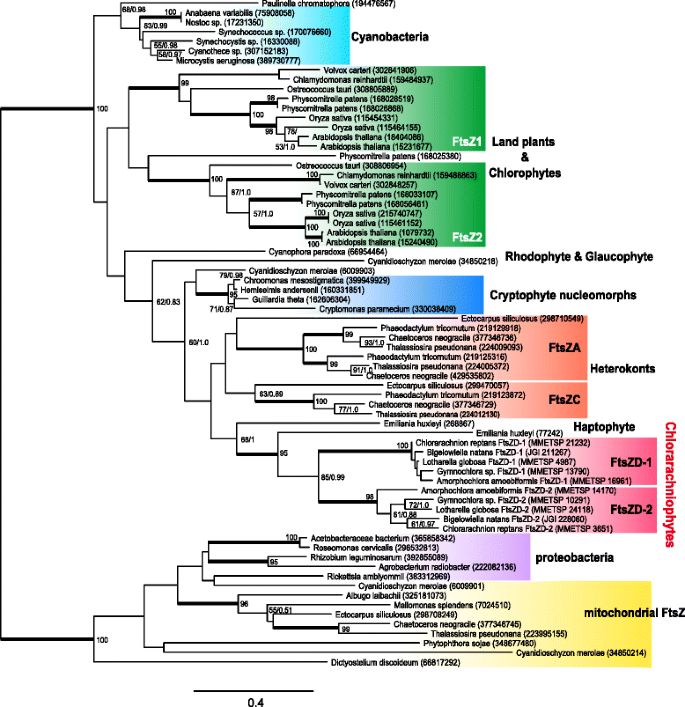
以前的两项系统发育研究报告了氯蜘蛛植物gydF4y2BaftsZgydF4y2Ba基因似乎源自红藻谱系,尽管绿藻起源于绿蛛藻质体[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba46gydF4y2Ba].来考察这两种类型的进化过程gydF4y2BaftsZgydF4y2Ba利用原核和真核FtsZ序列,以8个氯蛛丝植物FtsZ序列重建了系统发育树。该树表明氯蛛丝植物为单系gydF4y2BaftsZgydF4y2Ba基因,这是密切相关的一个序列的happhytegydF4y2BaEmiliania huxleyigydF4y2Ba带有红藻次级质体,和gydF4y2BaftsZD-1gydF4y2Ba而且gydF4y2BaftsZD-2gydF4y2Ba基因被牢固地分离成两个分支(图;gydF4y2Ba2gydF4y2Ba).这一结果有力地表明gydF4y2BaftsZD-1gydF4y2Ba而且gydF4y2BaftsZD-2gydF4y2Ba发生在氯蛛丝植物物种分化之前,而红色起源的氯蛛丝植物gydF4y2BaftsZDgydF4y2Ba我们的分析没有很好地支持基因。gydF4y2Ba
氯蜘蛛植物FtsZD蛋白的亚细胞定位gydF4y2Ba
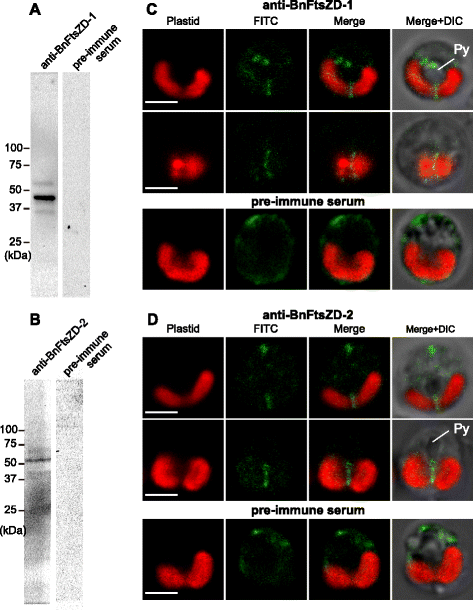
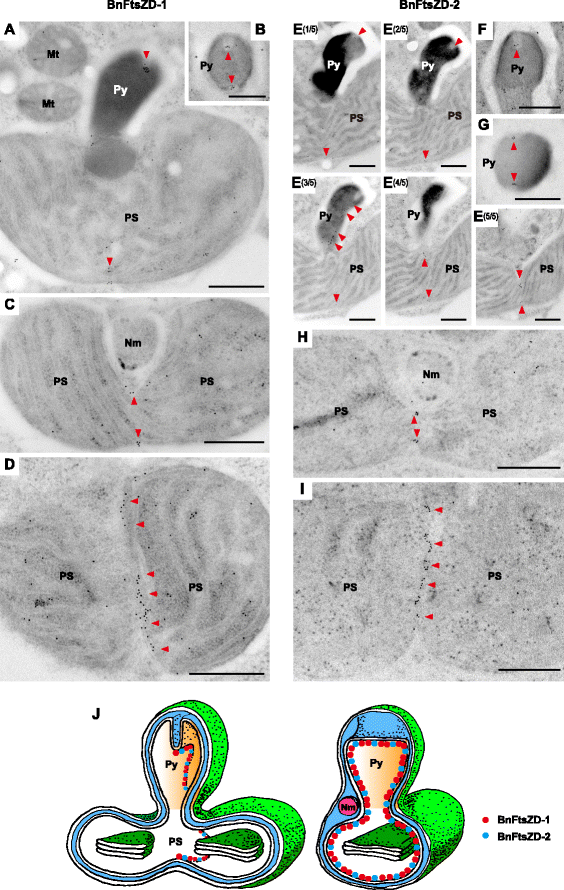
为了确定氯蜘蛛植物FtsZD蛋白的详细亚细胞定位,我们首先检测了与GFP融合的AaFtsZD-1(486个氨基酸)和AaFtsZD-2(514个氨基酸)的全长。不幸的是,它们的定位不明确,我们在质体分裂部位没有观察到明显的GFP积累,这可能是由于GFP标记蛋白的高表达造成的。因此,我们生成了针对gydF4y2Bab•gydF4y2BaFtsZD蛋白(anti-BnFtsZD-1和anti-BnFtsZD-2)进行免疫定位实验。gydF4y2Bab•gydF4y2Ba通常在微小的细胞中有一个质体,这在电子显微镜的超微结构研究中具有优势。的gydF4y2Bab•gydF4y2Ba质体通常具有一个突出的类芘,最内层的两层膜呈板状内陷,核形位于类芘碱基附近[gydF4y2Ba47gydF4y2Ba].用免疫印迹法检测两种抗体的特异性gydF4y2Bab•gydF4y2Ba细胞;检测到的条带与BnFtsZD-1 (44 kDa)和BnFtsZD-2 (50 kDa)成熟蛋白的预测大小一致。gydF4y2Ba3gydF4y2Ba,gydF4y2BabgydF4y2Ba).我们首先进行了免疫荧光显微术。在抗bnftszd -1和抗bnftszd -2的双酸酯质体中点观察到异硫氰酸荧光素(FITC)信号(图2)。gydF4y2Ba3 cgydF4y2Ba,gydF4y2BadgydF4y2Ba),而细胞质信号将是非特异性的背景,因为在免疫前血清处理的阴性对照细胞中也观察到这种信号(图。gydF4y2Ba3 cgydF4y2Ba,gydF4y2BadgydF4y2Ba).此外,我们使用这两种抗体进行了免疫电子显微镜检查。在这两种情况下,在突出的类肾内两个最内层质体膜浅内陷的尖端附近观察到共轭金颗粒。gydF4y2Ba4gydF4y2Ba,gydF4y2BaegydF4y2Ba,gydF4y2BafgydF4y2Ba),在水平切面上的类芘两侧(图。gydF4y2Ba4 bgydF4y2Ba,gydF4y2BaggydF4y2Ba),在靠近核形体的双酸质体中心狭窄部分的最内层膜上(图。gydF4y2Ba4摄氏度gydF4y2Ba,gydF4y2BahgydF4y2Ba),并在双叶酸质体的底部形成一条垂直线(图。gydF4y2Ba4 dgydF4y2Ba,gydF4y2Ba我gydF4y2Ba).BnFtsZD蛋白的免疫金信号几乎总是在观察细胞的质体中点检测到。综上所述,这些发现表明BnFtsZD-1和BnFtsZD-2在双酸质质体中点最内层膜的基质侧组装成一个葫芦状的环状结构,并且该环状结构总是与内对质体膜的浅板状内陷有关(图2)。gydF4y2Ba4 jgydF4y2Ba).在我们的电子显微镜观察中,在免疫金颗粒所在的假定质体分裂位点上没有检测到电子密集的pd环。gydF4y2Ba
BnFtsZD-1和BnFtsZD-2蛋白的免疫印迹分析和免疫荧光显微镜观察。抗bnftszd -1的免疫印迹分析(gydF4y2Ba一个gydF4y2Ba)和anti-BnFtsZD-2 (gydF4y2BabgydF4y2Ba)的抗体,以对抗从蛋白质中提取的全部蛋白质gydF4y2Bab•gydF4y2Ba细胞。(gydF4y2BacgydF4y2Ba,gydF4y2BadgydF4y2Ba免疫荧光标记BnFtsZD-1和BnFtsZD-2的共聚焦图像(绿色)gydF4y2Bab•gydF4y2Ba细胞。免疫前血清作为阴性对照。质体的叶绿素自发荧光用红色表示。Py,蛋白核。比例尺为2 μmgydF4y2Ba
免疫电子显微照片gydF4y2Bab•gydF4y2Ba显示BnFtsZD蛋白定位的质体。图像显示BnFtsZD-1 (a到d)和BnFtsZD-2 (e到i)的免疫金定位。共轭金颗粒(10 nm)用红色箭头突出显示。(gydF4y2Ba一个gydF4y2Ba质体间质纵切面(PS),有突出的类核蛋白(Py)。(gydF4y2BabgydF4y2Ba,gydF4y2BaggydF4y2Ba)肾类横切面。(gydF4y2BacgydF4y2Ba,gydF4y2BahgydF4y2Ba)质体间质中段带核形态(Nm)。(gydF4y2BadgydF4y2Ba,gydF4y2Ba我gydF4y2Ba)质体间质底部横切面。(gydF4y2BaegydF4y2Ba质体的连续纵切面。(gydF4y2BafgydF4y2Ba)类芘的纵切面。标尺为1 μm。(gydF4y2BajgydF4y2Ba) BnFtsZD在质体中的定位示意图;gydF4y2Ba红色的gydF4y2Ba而且gydF4y2Ba蓝色的gydF4y2Ba圆分别对应BnFtsZD-1和BnFtsZD-2gydF4y2Ba
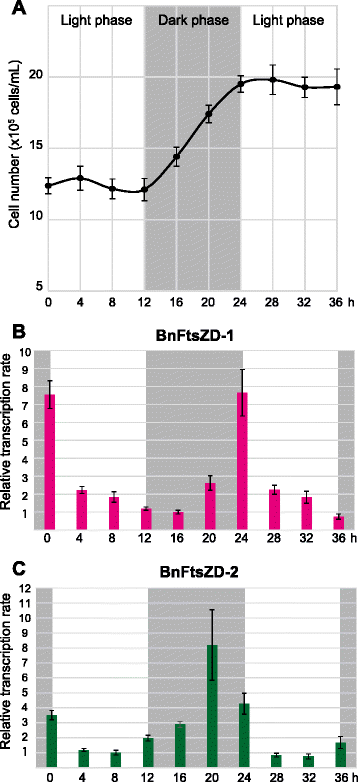
转录模式gydF4y2BaftsZDgydF4y2Ba细胞周期中的基因gydF4y2Ba
在具有单个质体的单细胞藻类中,质体分裂通常受宿主细胞周期的调控,当质体分裂先于细胞质分裂时,核编码的质体分裂蛋白的转录通常局限于S、G2或M期。plastidal的转录本gydF4y2BaftsZgydF4y2Ba已知基因在红藻的S期积累gydF4y2Bac . merolaegydF4y2Ba[gydF4y2Ba48gydF4y2Ba]和一些绿藻[gydF4y2Ba18gydF4y2Ba],在次生含质体硅藻的S/G2期gydF4y2BaSeminavis罗布斯塔gydF4y2Ba[gydF4y2Ba49gydF4y2Ba].明确了时间的关系gydF4y2BaftsZgydF4y2Ba基因表达和宿主细胞分裂,我们检测了转录水平gydF4y2BaBnftsZDgydF4y2Ba基因在细胞周期内使用同步gydF4y2Bab•gydF4y2Ba文化。连续光剥夺预处理36 h, 12:12 h光暗循环同步细胞分裂;细胞分裂发生在第二暗期(图;gydF4y2Ba5gydF4y2Ba).总RNA在第二次光照、黑暗和第三个光照阶段每隔4小时提取一次,我们计算mRNA转录水平gydF4y2BaBnftsZD-1gydF4y2Ba而且gydF4y2BaBnftsZD-2gydF4y2Ba使用实时定量PCR (RT-qPCR)。两种基因的转录水平在细胞分裂后不久的黑暗期(图。gydF4y2Ba5 bgydF4y2Ba,gydF4y2BacgydF4y2Ba).转录水平gydF4y2BaBnftsZD-1gydF4y2Ba在暗期末期达到峰值,对应于宿主M/G1期gydF4y2BaBnftsZD-2gydF4y2Ba4小时前gydF4y2BaBnftsZD-1gydF4y2Ba.这两个gydF4y2BaBnFtsZgydF4y2Ba基因似乎受到宿主细胞周期的调控。然而,与其他单细胞藻类不同的是,氯蜘蛛藻的转录模式gydF4y2BaftsZDgydF4y2Ba基因与质粒分裂发生在细胞质分裂之前的时间不一致。当mRNA的转录比之间gydF4y2BaBnftsZD-1gydF4y2Ba而且gydF4y2BaBnftsZD-2gydF4y2Ba通过RT-qPCR在其峰值(24 h和20 h)时的Ct值简单计算gydF4y2BaBnftsZD-1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba的最大转录水平gydF4y2BaBnftsZD-1gydF4y2Ba是的2.3倍gydF4y2BaBnftsZD-2gydF4y2Ba.这表明在质体中可能存在两个不同分子量的BnFtsZD蛋白。gydF4y2Ba
转录的gydF4y2BaBnftsZDgydF4y2Ba细胞周期中的基因。gydF4y2Ba一个gydF4y2Ba细胞密度(细胞mLgydF4y2Ba−1gydF4y2Ba)同步的gydF4y2Bab•gydF4y2Ba细胞计数培养;误差条表示基于六个独立测量值计算的标准偏差。(gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba)的相对转录水平gydF4y2BaBnftsZD-1gydF4y2Ba而且gydF4y2BaBnftsZD-2gydF4y2Ba在13个时间点(间隔4小时,36小时)使用实时定量PCR检测基因。每个转录水平都参照参照基因18S rRNA的转录水平进行归一化。误差条表示三次重复实验的标准差gydF4y2Ba
讨论gydF4y2Ba
FtsZD蛋白在氯蜘蛛植物中的展望功能gydF4y2Ba
氯蜘蛛植物的超微结构研究gydF4y2Bab•gydF4y2Ba已表明质体和核形的分裂发生在细胞分裂的早期阶段,而类芘的部分等分和两个最内层膜的内陷似乎在细胞分裂后不久就开始了[gydF4y2Ba47gydF4y2Ba].因此,在电子显微镜下,在类芘内几乎总是能观察到浅层膜内陷。这表明,部分膜收缩是由一种独立于质体分裂的机制实现的。我们的免疫定位结果表明两个FtsZD蛋白gydF4y2Bab•gydF4y2Ba堆积形成葫芦状环状结构,与突出的类肾膜内陷有关(图。gydF4y2Ba5 jgydF4y2Ba).这表明FtsZD蛋白参与了内对质体膜的部分收缩,这一发现得到了蛋白表达模式的支持gydF4y2BaBnftsZDgydF4y2Ba基因与膜内陷形成的时间一致。有趣的是,膜的收缩过程以某种方式停止,FtsZD蛋白沿着膜内陷保持在环状结构中。然而,如何控制膜的收缩以及质体间质何时完全分裂仍不清楚。gydF4y2Ba
叶绿体中突起的类前体膜内陷在属间具有显著的形态多样性,这是其分类的依据。的类芘gydF4y2BaBigelowiellagydF4y2Ba而且gydF4y2BaNorrisiellagydF4y2Ba最内层的两层质体膜有浅内陷(深度不足类芘高度的一半)[gydF4y2Ba50gydF4y2Ba),而gydF4y2BaLotharellagydF4y2Ba,gydF4y2BaAmorphochloragydF4y2Ba,gydF4y2BaChlorarachniongydF4y2Ba类芘具有很深的内陷,可到达质体间质[gydF4y2Ba51gydF4y2Ba].不同程度的Z环收缩可能是导致叶绿体形态多样性的原因。与其他氯蜘蛛植物不同,gydF4y2BaGymnochloragydF4y2Ba在类肾腺中有许多单膜管内陷[gydF4y2Ba52gydF4y2Ba],这意味着该属可能表现出FtsZD定位的谱系特异性行为。gydF4y2Ba
两个FtsZ家族的功能分化gydF4y2Ba
虽然蓝藻只有一个FtsZ蛋白的基因,但在植物和藻类中已经报道了多种类型的潮质FtsZ蛋白;绿藻属植物(陆生植物和绿藻)有FtsZ家族的两个系统发育类型FtsZ1和FtsZ2,红藻有FtsZA和FtsZB,次生含质体异孔体有FtsZA和FtsZC [gydF4y2Ba53gydF4y2Ba].两个不同的潮质体FtsZ家族是由一个时期的多次重复事件形成的gydF4y2BaftsZgydF4y2Ba基因最初来源于绿藻、红藻和异孔体的每个共同祖先的蓝藻[gydF4y2Ba53gydF4y2Ba].绿色谱系FtsZ2和红色谱系FtsZA以及蓝藻FtsZ在其c端包含高度保守的序列“D/E-I/V-P-x-F/Y-L”,即“c端核心结构域”,而其他FtsZ1、FtsZB和FtsZC蛋白则缺乏该结构域[gydF4y2Ba53gydF4y2Ba,gydF4y2Ba54gydF4y2Ba].这表明两个FtsZ家族中的一个在复制事件后失去了c端核心结构域。在模型植物中gydF4y2Ba答:芥gydF4y2Ba时,FtsZ2的c端核心结构域与质体分裂位点的跨膜蛋白ARC6发生特异性相互作用,将Z环系在内质体膜上[gydF4y2Ba19gydF4y2Ba].我们揭示了氯蛛丝植物也有两个不同的FtsZ家族,FtsZD-1和FtsZD-2,这是由氯蛛丝植物的共同祖先的基因复制而出现的(图2)。gydF4y2Ba2gydF4y2Ba).FtsZD-1和FtsZD-2都含有氯蛛丝植物特有的c端保守基序,分别为T-L-R/ g - g -K-A- k - r -x- a - g -x- l - r - r /K-A/V-L-G,不同于FtsZ2和FtsZA的c端核心结构域。这表明氯蜘蛛植物FtsZD-1和FtsZD-2在基因复制后独立获得了独特的c端基序。由于在氯蜘蛛植物基因组中缺乏ARC6同源基因,c端保守基序不参与ARC6给药的膜系留,c端保守基序的功能重要性尚不确定。gydF4y2Ba
遗传互补实验证明了这一点gydF4y2Ba拟南芥gydF4y2BaFtsZ1和FtsZ2在质体分裂中无功能冗余[gydF4y2Ba55gydF4y2Ba].只有FtsZ2与跨膜蛋白ARC6有特定的相互作用,这在一定程度上解释了它们的功能差异[gydF4y2Ba19gydF4y2Ba]且FtsZ1纤维的翻转速度快于FtsZ2,说明FtsZ1有利于Z环的重塑[gydF4y2Ba56gydF4y2Ba].此外,据报道gydF4y2Ba拟南芥gydF4y2BaFtsZ1和FtsZ2在整个成熟叶中保持恒定的1:2比例[gydF4y2Ba57gydF4y2Ba],并且它们能够在体外以不同比例形成异聚物[gydF4y2Ba58gydF4y2Ba].在这项研究中,我们发现两种类型的gydF4y2BaB. natans ftsZgydF4y2Ba的基因,gydF4y2BaBnftsZD-1gydF4y2Ba而且gydF4y2BaBnftsZD-2gydF4y2Ba,在细胞周期中表现出略有不同的转录模式,而的最大转录水平gydF4y2BaBnftsZD-1gydF4y2Ba预计是?的2倍gydF4y2BaBnftsZD-2gydF4y2Ba.这些发现使我们推断氯蜘蛛植物的两个FtsZ家族也表现出类似的功能分歧gydF4y2Ba拟南芥gydF4y2BaFtsZ家庭。早期的抄写gydF4y2BaBnftsZD-2gydF4y2Ba比gydF4y2BaBnftsZD-1gydF4y2Ba提出BnFtsZD-2在Z环组装和定位早期发挥作用的可能性。gydF4y2Ba
次生质体中质体分裂机制的演化gydF4y2Ba
在陆生植物中,Z环组装被几个分区现场定位因子ARC3、MCD1、MinD和MinE限制在质体中点[gydF4y2Ba54gydF4y2Ba].蓝藻衍生的Min蛋白的同源基因也在一种蓝藻和绿藻以及次生质体承载藻类中被发现(表2)gydF4y2Ba1gydF4y2Ba).因此,Z环定位机制的一部分似乎在一级和二级质体中都广泛保守。然而,氯蛛丝植物gydF4y2Bab•gydF4y2Ba完全缺乏植物样Z环定位因子的所有基因,类似于红藻gydF4y2Bac . meloraegydF4y2Ba.尽管缺乏典型的定位因子,但FtsZ蛋白能够在两种藻类的质体中点组装,这表明它们已经独立进化出了一种目前未知的Z环定位机制。gydF4y2Ba
原代质体的分裂复合体通常由两种不同的GTPase蛋白FtsZ和DRP5B组成,分别定位于内膜的基质侧和外膜的细胞质侧的环状结构。FtsZ和DRP5B的同源基因已在一些含次生质体的藻类、异孔体和一种裸植体中被发现,这些蛋白被认为在四个质体膜内对的收缩中起作用[gydF4y2Ba11gydF4y2Ba].然而,DRP5B基因尚未在基因组中被发现gydF4y2Bab•gydF4y2Ba还有隐生植物gydF4y2BaGuillardiaθgydF4y2Ba[gydF4y2Ba32gydF4y2Ba].之前的研究已经报道过gydF4y2Badrp5BgydF4y2Ba(gydF4y2Baarc5gydF4y2Ba)突变体gydF4y2Ba答:芥gydF4y2Ba苔藓gydF4y2BaPhyscomitrella金属盘gydF4y2Ba出现完全质体收缩缺陷,导致增大哑铃状质体[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba59gydF4y2Ba,gydF4y2Ba60gydF4y2Ba].然而,每个细胞的gydF4y2Badrp5BgydF4y2Ba突变体中含有少量的质体,说明在没有DRP5B的情况下质体仍然可以分裂成子质体。因此,在氯蜘蛛植物和隐植植物中,次生质体的两个最内层膜可能是由ftsz依赖但drp5b独立的机制所限制的gydF4y2Badrp5BgydF4y2Ba突变体。此外,DRP5B的缺失可能与叶绿体的膜收缩偏好有关。gydF4y2Ba
在一些次生质体中,外对质体膜的收缩发生在内对质体膜的收缩之后[gydF4y2Ba61gydF4y2Ba].虽然不知道外层膜对是如何分裂的,但收缩是由一种不同于内层膜对的机制执行的。在顶复体寄生虫中,顶复体特异性动力学相关蛋白DrpA可能定位于四个膜结合的顶质体表面,是顶质体分裂所必需的[gydF4y2Ba38gydF4y2Ba].可以推断,在其他次生质体承载生物中,有一种谱系特异性的类动力蛋白参与了外层质体膜对的收缩。的gydF4y2Bab•gydF4y2Ba基因组被发现编码两种高度不同的动力学样蛋白[GenBank ID: 113201831和113201829],未来对这些蛋白的研究将为我们的发现提供进一步的见解。gydF4y2Ba
结论gydF4y2Ba
我们在具有次生质体的氯蜘蛛藻中鉴定了两个质体分裂蛋白FtsZD-1和FtsZD-2。这两个不同的FtsZ家族是由氯蜘蛛植物的一个共同祖先的基因复制而产生的。两种FtsZD蛋白在双酸酯质体的中点组装成环状结构,具有突出的类芘。环与内对质体膜的浅板状内陷有关。转录水平gydF4y2BaB. natans ftsZDgydF4y2Ba基因在细胞分裂后不久周期性增加,这与膜内陷形成的时间一致。我们的研究结果表明,氯蜘蛛植物FtsZD蛋白参与了质体内膜对的部分收缩,但不参与质体分裂的整个过程。目前,次生含质体藻类的外质体膜是如何收缩的尚不清楚。我们需要进一步的研究来确定整个二级质体分裂系统。gydF4y2Ba
方法gydF4y2Ba
Chlorarachniophyte文化gydF4y2Ba
b•gydF4y2Ba(CCMP2755)和gydF4y2Ba答:amoebiformisgydF4y2Ba(CCMP2058)细胞在22℃白光(80 ~ 100 μmol光子m)下生长gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)在ESM介质中12:12 h光照:黑暗循环。的同步gydF4y2Bab•gydF4y2Ba细胞分裂如前所述[gydF4y2Ba62gydF4y2Ba].gydF4y2Ba
质体分裂蛋白的同源性研究gydF4y2Ba
质体分裂蛋白基因(FtsZ、ARC6、MinC、MinD、MinE、DRP5B、PDV、ARC3、MCD1和PDR1)在前期研究中利用陆生植物和几种藻类的全基因组数据鉴定[gydF4y2Ba13gydF4y2Ba,gydF4y2Ba18gydF4y2Ba].为了更新信息,我们在含次生质体的藻类全基因组中寻找质体分裂蛋白的同源基因(gydF4y2Ba这种pseudonanagydF4y2Ba,gydF4y2BaPhaeodactylum tricornutumgydF4y2Ba,gydF4y2BaAureococcus anophagefferensgydF4y2Ba,gydF4y2BaEmiliania huxleyigydF4y2Ba,gydF4y2BaGuillardiaθgydF4y2Ba,gydF4y2Ba刚地弓形虫gydF4y2Ba,gydF4y2BaBigelowiella•gydF4y2Ba),基于e值截断值为1e的倒数BLASTpgydF4y2Ba−10gydF4y2Ba使用相应的已知序列gydF4y2Ba拟南芥gydF4y2Ba,gydF4y2Ba衣藻reinhardtiigydF4y2Ba,gydF4y2BaCyanidioschyzon merolaegydF4y2Ba.基因组序列从GenBank和DOE联合基因组研究所(JGI)站点获得。gydF4y2Ba
系统发育分析gydF4y2Ba
ChlorarachniophytegydF4y2BaftsZgydF4y2Ba基因从基因组序列鉴定gydF4y2Bab•gydF4y2Ba[gydF4y2Ba40gydF4y2Ba]和四种氯蜘蛛植物的illumina转录组,gydF4y2Ba答:amoebiformisgydF4y2Ba,gydF4y2Bac . reptansgydF4y2Ba,gydF4y2BaGymnochloragydF4y2Basp。gydF4y2Bal . globosagydF4y2Ba的对应序列进行tBLASTn同源搜索gydF4y2Ba答:芥gydF4y2Ba,gydF4y2Bac . reinhardtiigydF4y2Ba,gydF4y2Bac . merolaegydF4y2Ba.转录组分析由海洋微生物真核生物转录组测序项目进行[gydF4y2Ba63gydF4y2Ba],序列数据可从iMicrobe网站(gydF4y2Bahttp://data.imicrobe.us/project/view/104gydF4y2Ba)的样本编号:MMETSP 0041, 0042, 0109和0110。利用从GenBank提取的60条原核和真核FtsZ蛋白序列和10条氯蛛丝植物序列构建系统发育树。MAFFT包的L-INS-i方法自动对齐的序列[gydF4y2Ba64gydF4y2Ba],使用MEGA6手动检查排列不良的位置[gydF4y2Ba65gydF4y2Ba].使用最大似然(ML)和贝叶斯方法进行系统发育分析,最终数据集包括来自70个分类群的315个明确对齐的氨基酸位置。使用RAxML v8.1.15进行ML分析[gydF4y2Ba66gydF4y2Ba],其中LG + GAMMA模型被Aminosan选为最适合的模型[gydF4y2Ba67gydF4y2Ba].使用10个不同的随机最大简约树在多次搜索中确定得分最高的ML树,并通过1000个自举重复评估统计支持。使用MrBayes v3.1.2在LG + GAMMA模型下进行贝叶斯分析[gydF4y2Ba68gydF4y2Ba].大都会耦合马尔可夫链蒙特卡洛从随机起始树运行1,000,000代,每1000个周期采样一次。三条加热链和一条冷链同时运行,最初的38万次循环被废弃。从剩下的620棵树中计算节点后验概率。gydF4y2Ba
GFP融合蛋白的定位分析gydF4y2Ba
提取总RNAgydF4y2Ba答:amoebiformisgydF4y2Ba使用TRIzol试剂(Invitrogen),用SuperScript II逆转录酶(Invitrogen)和寡核苷酸(dT)引物合成cDNA。为了构建编码GFP融合蛋白的质粒,使用特异性引物PCR扩增编码AaFtsZD-1(90个氨基酸)和AaFtsZD-2(92个氨基酸)n端前导的cDNA片段(见附加文件)gydF4y2Ba1gydF4y2Ba),然后将每个片段插入其中gydF4y2Ba欣gydF4y2BadIII和gydF4y2Ba以区域gydF4y2BapLaRGfp + mc向量的I位gydF4y2Ba69gydF4y2Ba携带rubisco小亚基基因的启动子。为了分析GFP融合蛋白的亚细胞定位,gydF4y2Ba答:amoebiformisgydF4y2Ba如前所述,使用Biolistic PDS-1000/He粒子传递系统(Bio-Rad)将每个质粒转化细胞[gydF4y2Ba70gydF4y2Ba].转化24 ~ 48 h后,在倒置的蔡司LSM 510激光扫描显微镜(Carl Zeiss)单轨模式下观察表达报告基因的瞬时转化细胞。gydF4y2Ba
抗体的制备gydF4y2Ba
抗多克隆抗体gydF4y2Bab•gydF4y2Ba由BioGate Co., Ltd(岐阜,日本)在兔子中使用相应的210个氨基酸的成熟蛋白(BnFtsZD-1的256 - 444个残基或BnFtsZD-2的326 - 514个残基)的重组蛋白来培养FtsZD蛋白。将这些BnFtsZD成熟蛋白扩增cDNA片段克隆到pET28表达载体中,并在Rosetta 2 (DE3)中表达6xHis融合多肽。gydF4y2Ba大肠杆菌gydF4y2Ba细胞(Novagen),根据制造商的说明。重组蛋白用His GraviTrap柱(GE Healthcare)在8 M尿素变性条件下纯化,然后用磷酸盐缓冲盐水(PBS)透析过夜。多克隆兔免疫球蛋白G (IgG)抗体使用HiTrap Protein A HP柱纯化(GE Healthcare)。用提取的总蛋白进行免疫印迹检测抗体的特异性gydF4y2Bab•gydF4y2Ba细胞。这些蛋白质在12% SDS聚丙烯酰胺凝胶上电泳,并使用Trans-Blot Turbo Transfer System (Bio-Rad)将其吸附到PVDF膜上。免疫印迹采用iBind Western系统(Life Technologies)进行,每个抗bnftszd抗体/免疫前血清稀释1:500,然后以1:10 0 000稀释辣根过氧化物酶(HRP)偶联二抗体。使用ECL Prime Western Blotting检测试剂(GE Healthcare)和ChemiDoc MP系统(Bio-Rad)检测信号。gydF4y2Ba
免疫荧光和免疫电子显微镜gydF4y2Ba
对于免疫荧光显微镜,gydF4y2Bab•gydF4y2Ba细胞在室温下在4%多聚甲醛/0.25 M蔗糖中phm缓冲液(60 mM PIPES, 25 mM HEPES, 10 mM EGTA, 2 mM MgCl2;pH值7.4)。固定细胞转移到聚l -赖氨酸涂层的覆盖物上,并用PBS冲洗。用5% tween 20在PBS中透化细胞膜10 min;洗涤剂Triton X-100没有用处,因为即使在0.01%的低浓度下,叶绿素自发荧光也被去除了。用3%脱脂牛奶/ 1%正常山羊血清在PBS中阻断30分钟后,将各自的抗bnftszd抗体/免疫前血清在PBS中稀释至1:50,在室温下处理2小时。PBS洗涤细胞,然后用fitc偶联抗兔IgG抗体(Sigma: F9887)在PBS中稀释至1:100标记一抗1 h。使用SlowFade Diamond抗褪色剂安装细胞,并在倒置的蔡司LSM 510激光扫描显微镜(卡尔蔡司)下观察。gydF4y2Ba
在免疫电子显微镜下,使用之前描述的冷冻固定和冷冻替代的改进方案制备标本[gydF4y2Ba71gydF4y2Ba].CryofixedgydF4y2Bab•gydF4y2Ba细胞在冷却的100%乙醇(- 80°C)中培养2天,最后包埋在LR White树脂中。聚合块的超薄切片由徕卡超微微生物仪EM UC6创建,并收集到formvar涂层铜网格上。分别用PBS稀释1:10的抗bnftszd抗体进行免疫金标记,并将金偶联抗兔IgG二抗(Sigma: G7402)稀释至1:20。超薄切片用醋酸铀染色10min,在日立H7650透射电镜下观察,电压80kv。gydF4y2Ba
实时定量PCRgydF4y2Ba
b•gydF4y2Ba从100 mL同步培养物中每隔4小时收集细胞36小时,用Fuchs-Rosenthal血细胞计监测细胞数量。使用TRIzol试剂(Invitrogen)从13个时间点提取总RNA,并根据制造商的协议使用ReverTra Ace qPCR RT Kit (Toyobo)合成cDNA。定量引物gydF4y2BaBnftsZD-1gydF4y2Ba而且gydF4y2BaBnftsZD-2gydF4y2Ba使用Primer3Plus在线软件设计(引物序列列于附加文件gydF4y2Ba1gydF4y2Ba),以及先前报道的18S rRNA引物[gydF4y2Ba62gydF4y2Ba用于标准化。RT-qPCR采用Thermal Cycler Dice Real Time System II (Takara), cDNA 1 μL,引物0.4 μM, SYBR Premix Ex Taq II (Takara) 12.5 μL,无DNase/RNase-free水25 μL。循环条件包括在95℃下变性3 min,然后在95℃下10 s和60℃下30 s循环40次,并使用熔化曲线程序检测非特异性产物。通过ΔΔCT方法计算基因表达的相对变化[gydF4y2Ba72gydF4y2Ba]在不同时间点。gydF4y2Ba
支持数据的可用性gydF4y2Ba
本研究中使用的核苷酸序列可以从GenBank(国家生物技术信息中心)获得,GenBank是JGI的基因组门户网站gydF4y2BaBigelowiella•gydF4y2Ba(gydF4y2Bahttp://genome.jgi.doe.gov/Bigna1/Bigna1.home.htmlgydF4y2Ba),以及gydF4y2BaCyanophora paradoxagydF4y2Ba基因组计划网站(gydF4y2Bahttp://cyanophora.rutgers.edu/cyanophora/home.phpgydF4y2Ba),以及iMicrobe网站(gydF4y2Bahttp://data.imicrobe.us/project/view/104gydF4y2Ba).gydF4y2Ba
缩写gydF4y2Ba
- 呃:gydF4y2Ba
-
内质网gydF4y2Ba
- 绿色荧光蛋白:gydF4y2Ba
-
绿色荧光蛋白gydF4y2Ba
- FITC:gydF4y2Ba
-
异硫氰酸荧光素gydF4y2Ba
- RT-qPCR:gydF4y2Ba
-
实时定量PCRgydF4y2Ba
- 免疫球蛋白:gydF4y2Ba
-
免疫球蛋白GgydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
Rodríguez-Ezpeleta N, Brinkmann H, Burey SC, Roure B, Burger G, Löffelhardt W,等。原生光合真核生物的单系:绿色植物、红藻类和绿藻。《当代生物学》2005;15:1325-30。gydF4y2Ba
- 2.gydF4y2Ba
Price DC, Chan CX, Yoon HS, Yang EC, Qiu H, Weber APM,等。gydF4y2BaCyanophora paradoxagydF4y2Ba基因组阐明了藻类和植物光合作用的起源。科学。2012;335:843-7。gydF4y2Ba
- 3.gydF4y2Ba
古尔德SB,沃勒RF,麦克法登GI。质体进化。植物学报。2008;39:491 - 517。gydF4y2Ba
- 4.gydF4y2Ba
吉林PJ。质体的内共生起源、多样化和命运。中国生物医学工程学报(英文版);2010;gydF4y2Ba
- 5.gydF4y2Ba
从全球系统基因组学的角度看真核生物生命树。中国生物医学工程学报。2014;6:a016147。gydF4y2Ba
- 6.gydF4y2Ba
膜遗传与早期叶绿体进化。植物科学,2000;5:174-82。gydF4y2Ba
- 7.gydF4y2Ba
麦克费登GI。质体和蛋白质靶向。中国生物工程学报。1999;46:339-46。gydF4y2Ba
- 8.gydF4y2Ba
Gould SB, Maier UG, Martin WF。蛋白质的输入和红色复合质体的起源。中国生物医学杂志。2015;25:R515-21。gydF4y2Ba
- 9.gydF4y2Ba
Bolte K, Bullmann L, Hempel F, Bozarth A, zuner S, Maier UG。蛋白质靶向进入次级质体。中国生物医学工程学报。2009;gydF4y2Ba
- 10.gydF4y2Ba
李志刚,李志刚。复杂质体中蛋白质的分选。生物化学学报(英文版);2013:352-9。gydF4y2Ba
- 11.gydF4y2Ba
质体分裂机制:从细菌到细胞器。植物科学学报。2011;gydF4y2Ba
- 12.gydF4y2Ba
奥斯特扬KW,派克KA。质体的分裂与动态形态。植物学报,2014;gydF4y2Ba
- 13.gydF4y2Ba
宫agishima S, Kabeya Y.叶绿体分裂:挤压光合俘虏。《微生物学杂志》2010;13:738-46。gydF4y2Ba
- 14.gydF4y2Ba
森T,黑岩H,高原M,宫agishima S,黑岩TgydF4y2Ba百合longiflorumgydF4y2Ba叶子。植物物理学报。2001;42:555-9。gydF4y2Ba
- 15.gydF4y2Ba
李志强,李志强,李志强,等。植物叶绿体分裂位点FtsZ环的形成。中国生物医学工程学报,2001;23(3):344 - 344。gydF4y2Ba
- 16.gydF4y2Ba
Miyagishima S, Takahara M, Mori T, Kuroiwa H, Higashiyama T, Kuroiwa T.质体分裂是由一种复杂的机制驱动的,该机制涉及细菌和真核分裂环的差异转变。植物细胞,2001;13:2257-68。gydF4y2Ba
- 17.gydF4y2Ba
Sato M, Nishikawa T, Kajitani H, Kawano S.花青体中FtsZ与肽聚糖的保守关系gydF4y2BaCyanophora paradoxagydF4y2Ba类似于细菌细胞分裂。足底。2007;227:177 - 87。gydF4y2Ba
- 18.gydF4y2Ba
Miyagishima S, Suzuki K, Okazaki K, Kabeya Y.藻类细胞周期调控的核编码叶绿体分裂基因和蛋白的表达。中国生物医学工程学报,2012;29:2957-70。gydF4y2Ba
- 19.gydF4y2Ba
马枫J, Aldridge C, Møller SG。质体分裂是由质体分裂蛋白的组合组装介导的。植物学报,2005;gydF4y2Ba
- 20.gydF4y2Ba
Colletti KS, Tattersall EA, Pyke KA, Froelich JE, Stokes KD, Osteryoung KW.细菌细胞分裂位点决定因子MinD的同源物介导叶绿体分裂装置的放置。《生物学报》2000;10:507-16。gydF4y2Ba
- 21.gydF4y2Ba
Itoh R, Fujiwara M, Nagata N, Yoshida S.一种与真菌拓扑特异性因子minE同源的叶绿体蛋白在叶绿体分裂中起作用。植物物理学报2001;127:1644-55gydF4y2Ba
- 22.gydF4y2Ba
张敏,Schmitz AJ, Kadirjan-Kalbach DK, Terbush AD, Osteryoung KW.拟南芥叶绿体分裂蛋白ARC3通过与FtsZ2相互作用调控叶绿体ftsz环的组装和定位。《植物科学》2013;gydF4y2Ba
- 23.gydF4y2Ba
Nakanishi H, Suzuki K, Kabeya Y, Miyagishima S.植物特异性蛋白MCD1与细菌来源的MinD共同决定叶绿体分裂的位置。生物学报,2009;19:151-6。gydF4y2Ba
- 24.gydF4y2Ba
Miyagishima S, Froehlich JE, Osteryoung KW. PDV1和PDV2介导动态相关蛋白ARC5募集到质体分裂位点。植物细胞。2006;18:2517-30。gydF4y2Ba
- 25.gydF4y2Ba
Gao H, Kadirjan-Kalbach D, Froehlich JE, Osteryoung KW. ARC5是植物细胞质动力学样蛋白,是叶绿体分裂机制的一部分。中国科学院学报,2003;30(2):349 - 349。gydF4y2Ba
- 26.gydF4y2Ba
Sweitzer SM, Hinshaw JE。动力蛋白发生依赖于gtp的构象变化,引起囊化。细胞。1998;93:1021-9。gydF4y2Ba
- 27.gydF4y2Ba
小泽M,安德森DE,埃里克森HP。脂质体中可收缩FtsZ环的重构。科学。2008;320:792-4。gydF4y2Ba
- 28.gydF4y2Ba
黑岩T,黑岩H,酒井A,高桥H,户田K,伊藤R.质体和线粒体的分裂装置。细胞科学,1998;181:1-41。gydF4y2Ba
- 29.gydF4y2Ba
吉田Y,黑岩H,三隅欧,吉田M,大沼M,藤原T,等。叶绿体通过收缩由聚葡聚糖组成的一束纳米丝来分裂。科学。2010;329:949-53。gydF4y2Ba
- 30.gydF4y2Ba
Yoshida Y, Kuroiwa H, Misumi O, Nishida K, Yagisawa F,藤原T,等。孤立的叶绿体分裂机械在拉伸后可以主动收缩。科学。2006;313:1435-8。gydF4y2Ba
- 31.gydF4y2Ba
Miyagishima S.叶绿体分裂机制的起源和进化。植物学报2005;118:295-306。gydF4y2Ba
- 32.gydF4y2Ba
Miyagishima S, Nakamura M, Uzuka A, Era A. FtsZ缺失的原核细胞分裂以及FtsZ缺失和动态缺失的叶绿体和非光合质体分裂。植物科学进展(英文版);gydF4y2Ba
- 33.gydF4y2Ba
Miyagishima S, Kabeya Y, Sugita C, Sugita M, Fujiwara T.叶绿体分裂过程中肽聚糖水解需要DipM。BMC植物生物学。2014;14:57。gydF4y2Ba
- 34.gydF4y2Ba
Douglas SE, Penny SL.隐藻质体基因组,gydF4y2BaGuillardiaθgydF4y2Ba:完整的序列和保守的同步性群证实了其与红藻的共同祖先。中华药理学杂志,1999;26(2):344 - 344。gydF4y2Ba
- 35.gydF4y2Ba
Sánchez Puerta MV, Bachvaroff TR, Delwiche CF. happhyte的完整质体基因组序列gydF4y2BaEmiliania huxleyigydF4y2Ba:与其他质体基因组的比较。DNA决议2005;12:151-6。gydF4y2Ba
- 36.gydF4y2Ba
冯浩泽,王志强,王志强。在隐单胞体中,叶绿体分裂蛋白FtsZ由核形态基因编码。Mol Gen Genet, 1998; 260:207-11。gydF4y2Ba
- 37.gydF4y2Ba
西川T,森山Y,佐藤M,佐野T,长泽S,太田S,等。硅藻线粒体和质体ftsZ基因的分离及细胞器靶向序列分析gydF4y2BaChaetoceros neogracilegydF4y2Ba(硅藻、硅藻纲)。Phycol Res. 2012; 60:123-36。gydF4y2Ba
- 38.gydF4y2Ba
van Dooren GG, Reiff SB, Tomova C, Meissner M, Humbel BM, Striepen bgydF4y2Ba刚地弓形虫gydF4y2Ba.生物学报,2009;19:267-76。gydF4y2Ba
- 39.gydF4y2Ba
氯蜘蛛藻藻类的复杂质体。展望Phycol 2014; 1:87-92。gydF4y2Ba
- 40.gydF4y2Ba
Curtis BA, Tanifuji G, Burki F, Gruber A, Irimia M, Maruyama S,等。藻类基因组揭示了进化的镶嵌性和核胚的命运。大自然。2012;492:59 - 65。gydF4y2Ba
- 41.gydF4y2Ba
Gilson PR, Su V, Slamovits CH, Reith ME, Keeling PJ, McFadden GI。完整的核序列的氯蜘蛛植物的核形态:自然界最小的核。中国科学院学报(自然科学版)2006;103:9566-71。gydF4y2Ba
- 42.gydF4y2Ba
罗杰斯MB,吉尔森PR,苏V,麦克法登GI,基林PJ。叶绿体:叶绿体的完整基因组gydF4y2BaBigelowiella•gydF4y2Ba:氯蛛丝植物和euglenid次生内共生体独立起源的证据。生物化学学报。2007;24:54-62。gydF4y2Ba
- 43.gydF4y2Ba
Hopkins JF, Spencer DF, Laboissiere S, Neilson JA, Eveleigh RJ, Durnford DG,等。蛋白质组学揭示了叶绿体和周围质体靶向蛋白gydF4y2BaBigelowiella•gydF4y2Ba.中国生物工程学报。2012;4:1391-406。gydF4y2Ba
- 44.gydF4y2Ba
Bendtsen JD, Nielsen H, von Heijne G, Brunak S.改进的信号肽预测:SignalP 3.0。中国生物医学杂志,2004;34:783 - 95。gydF4y2Ba
- 45.gydF4y2Ba
Emanuelsson O, Nielsen H, von Heijne G. ChloroP,一种基于神经网络的预测叶绿体转运肽及其切割位点的方法。蛋白质科学,1999;8:978-84。gydF4y2Ba
- 46.gydF4y2Ba
Yang Y, Matsuzaki M, Takahashi F, Qu L, Nozaki H.对两种“绿色”次生光养植物——氯蛛丝植物“红色”基因的系统基因组分析表明,在现有氯蛛丝植物分化之前,红色谱系就发生了多次水平基因转移。PLoS One. 2014;9:e101158。gydF4y2Ba
- 47.gydF4y2Ba
Moestrup Ø, Sengco .超微结构研究gydF4y2BaBigelowiella•gydF4y2Ba, gen. et sp. nov.,一种氯蜘蛛纲鞭毛虫。中华物理学报。2001;37:624-46。gydF4y2Ba
- 48.gydF4y2Ba
藤原T,三隅奥,田代K,吉田Y,西田K,八泽F,等。单细胞红藻在高度同步的细胞核和细胞器分裂周期中的周期性基因表达模式gydF4y2BaCyanidioschyzon merolaegydF4y2Ba.DNA决议2009;16:59-72。gydF4y2Ba
- 49.gydF4y2Ba
Gillard J, Devos V, Huysman MJ, De Veylder L, D 'Hondt S, Martens C,等。在羽状硅藻中叶绿体个体发生和细胞周期进展之间密切耦合的生理和转录组证据gydF4y2BaSeminavis罗布斯塔gydF4y2Ba.植物学报。2008;48:1394 - 411。gydF4y2Ba
- 50.gydF4y2Ba
太田S上田K石田KgydF4y2BaNorrisiella sphaericagydF4y2Bagen. et sp. nov.,墨西哥下加利福尼亚州球虫属一新种。植物学报2007;120:661-70。gydF4y2Ba
- 51.gydF4y2Ba
石田K, Green B, Cavalier-Smith T.嵌合藻类群的多样化:核和核形小亚基rRNA基因的系统发育。中国生物医学杂志1999;16:21 - 31。gydF4y2Ba
- 52.gydF4y2Ba
石田K,中山T,原杨。绿蜘蛛植物的分类学研究。2标题氯蜘蛛植物属的属界和描述gydF4y2BaGymnochlora stellatagydF4y2Ba将军等11月和gydF4y2BaLotharellagydF4y2Bagen. nov. Phycol Res. 1996; 44:37-45。gydF4y2Ba
- 53.gydF4y2Ba
Miyagishima S, Nozaki H, Nishida K, Nishida K, Matsuzaki M, Kuroiwa T.线粒体和红系叶绿体中的两种FtsZ蛋白:FtsZ的复制与内共生有关。中华药理学杂志,2004;gydF4y2Ba
- 54.gydF4y2Ba
李志刚,李志刚。叶绿体的结构、功能与进化。中国生物医学杂志,2013;25:461-70。gydF4y2Ba
- 55.gydF4y2Ba
施密茨AJ,格林JM,奥尔森BJ,斯托克斯KD,奥斯特扬KW。gydF4y2Ba拟南芥gydF4y2BaFtsZ2-1和FtsZ2-2在功能上是冗余的,但基于ftsz的质体分裂对于叶绿体的分配和植物的生长发育都不是必需的。植物学报。2009;2:1211-22。gydF4y2Ba
- 56.gydF4y2Ba
TerBush AD, Osteryoung KW.叶绿体FtsZ1和FtsZ2在z -环结构和重塑中的独特功能。中国生物医学工程学报,2012;gydF4y2Ba
- 57.gydF4y2Ba
McAndrew RS, Olson BJ, Kadirjan-Kalbach DK, Chi-Ham CL, Vitha S, Froehlich JE,等。gydF4y2Ba在活的有机体内gydF4y2Ba质体分裂蛋白FtsZ1和FtsZ2的定量关系以及天然FtsZ复合物中ARC6和ARC3的鉴定。生物化学学报,2008;gydF4y2Ba
- 58.gydF4y2Ba
王倩,王强,王晓明。gtp依赖性异质聚合物FtsZ1和FtsZ2的形成与成束。中国生物化学杂志,2010;gydF4y2Ba
- 59.gydF4y2Ba
Robertson EJ, Rutherford SM, Leech RM。叶绿体分裂的特征gydF4y2Ba拟南芥gydF4y2Ba突变体gydF4y2Ba弧gydF4y2Ba5.植物物理学报。1996;112:149-59。gydF4y2Ba
- 60.gydF4y2Ba
Sakaguchi E, Takechi K, Sato H, Yamada T, Takio S, Takano H.三个与质体分裂有关的动力相关蛋白5B基因gydF4y2BaPhyscomitrella金属盘gydF4y2Ba.植物科学进展(英文版);2011;30(4):349 - 349。gydF4y2Ba
- 61.gydF4y2Ba
次级质体的超微结构特征和分裂。植物学报2005;118:163-72。gydF4y2Ba
- 62.gydF4y2Ba
平川杨,布基F,基林PJ。氯蜘蛛藻中的核和核形靶向组蛋白。微生物学杂志,2011;80:1439-49gydF4y2Ba
- 63.gydF4y2Ba
Keeling PJ, Burki F, Wilcox HM, Allam B, Allen EE, Amaral Zettler LA,等。海洋微生物真核生物转录组测序项目(MMETSP):通过转录组测序揭示海洋真核生物的功能多样性。《公共科学图书馆·生物学》2014;12:e1001889。gydF4y2Ba
- 64.gydF4y2Ba
Katoh K, Standley DM. MAFFT多序列比对软件版本7:性能和可用性的改进。中国生物医学杂志,2013;30:772-80。gydF4y2Ba
- 65.gydF4y2Ba
田村K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析版本6.0。中国生物医学杂志,2013;30:2725-9。gydF4y2Ba
- 66.gydF4y2Ba
Stamatakis A. RAxML版本8:用于系统发育分析和大系统发育后分析的工具。生物信息学。2014;30:1312-3。gydF4y2Ba
- 67.gydF4y2Ba
田边。Kakusan4和Aminosan:两个程序,用于比较非分区、比例和分离模型,用于多位点序列数据的组合分子系统发育分析。生物化学学报。2011;11:914-21。gydF4y2Ba
- 68.gydF4y2Ba
Ronquist F, Huelsenbeck JP。MrBayes 3:混合模型下的贝叶斯系统发育推断。生物信息学。2003;19:1572-4。gydF4y2Ba
- 69.gydF4y2Ba
平川杨,长门K,石田K。氯蛛形植物二级质体蛋白靶向研究。中国科学院学报(自然科学版),2009;gydF4y2Ba
- 70.gydF4y2Ba
王志刚,王志刚,王志刚,王志刚。一种含氯蜘蛛藻的瞬态转化,gydF4y2BaLotharella amoebiformisgydF4y2Ba(chlorarachniophyceae)gydF4y2BauidgydF4y2Ba一个和gydF4y2BaegfpgydF4y2Ba报告基因。中华物理学报。2008;44:814-20。gydF4y2Ba
- 71.gydF4y2Ba
张志刚,张志刚,张志刚。植物有丝分裂和胞质分裂的超微结构研究gydF4y2BaScytosiphon lomentariagydF4y2Ba冷冻替代受精卵(镰藻科,褐藻科)。原生质。2002;219:140-9。gydF4y2Ba
- 72.gydF4y2Ba
Livak KJ, Schmittgen TD。相关基因表达数据的分析采用实时定量PCR和2gydF4y2Ba−ΔΔCTgydF4y2Ba方法。方法。2001;25:402-8。gydF4y2Ba
确认gydF4y2Ba
我们感谢Takashi Shiratori先生(筑波大学)对系统发育分析的帮助,以及Tetsuo Hashimoto教授(筑波大学)对ChemiDoc MP系统的访问权限。这项工作得到了日本科学促进协会(JSPS) KAKENHI资助号:23117004和15K18582。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
作者的贡献gydF4y2Ba
YH设计了这项研究,进行了所有的实验和分析,并撰写了手稿。KI构思了这项研究,并帮助起草和修改了手稿。两位作者都阅读并批准了最终的手稿。gydF4y2Ba
额外的文件gydF4y2Ba
附加文件1:gydF4y2Ba
质粒构建引物序列(表S1)和质粒构建引物序列gydF4y2BaRT-qPCRgydF4y2Ba实验(表S2)。gydF4y2Ba(PDF 120kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
平川,Y.,石田,Ki。FtsZ蛋白在氯蜘蛛藻次级质体中的前瞻性功能。gydF4y2BaBMC植物生物学gydF4y2Ba15日,gydF4y2Ba276(2015)。https://doi.org/10.1186/s12870-015-0662-7gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-015-0662-7gydF4y2Ba
关键字gydF4y2Ba
- ChlorarachniophytesgydF4y2Ba
- 内共生gydF4y2Ba
- FtsZgydF4y2Ba
- NucleomorphgydF4y2Ba
- 质体分裂gydF4y2Ba