摘要
背景
在现代农业中,由于希望减少杀菌剂和农药的使用以及病原体和害虫对农用化学品的抗性不断增强,对替代作物保护战略的呼声越来越高。植物免疫系统的直接激活并不能提供一个有前途的植物保护措施,因为其适应成本很高。然而,经过某些天然或合成化合物的处理后,植物细胞可以促进健康,节省成本,增强防御能力。在启动状态下,植物对生物和非生物胁迫的反应具有更快、更强的防御激活,这通常与免疫和非生物胁迫耐受性有关。到目前为止,对具有启动诱导活性的化合物(即所谓的植物激活剂)的鉴定依赖于繁琐的侵入性方法,或者需要在欧芹细胞培养物中后期检测分泌的呋喃香豆素植物抗毒素。因此,简单、快速、直接和非侵入性的鉴定植物保护引发化合物的技术是非常受欢迎的。
结果
研究表明,呼吸活性监测系统(RAMOS)可以在培养的欧芹细胞悬浮液中识别具有防御启动诱导活性的化合物。RAMOS依靠准连续、无创的在线测定氧转移率(OTR)。用已知的植物激活剂水杨酸(SA)处理欧芹培养细胞,水杨酸是一种天然的植物防御信号,导致OTR增加。添加防御激发子Pep13,一种细胞壁肽诱发突变,诱导了两个独特的OTR峰,在Pep13刺激下,sa启动的细胞比未启动的细胞有更高的OTR峰。SA启动和Pep13刺激后的OTR均呈剂量依赖性。此外,根据荧光光谱分析,化合物增强欧芹细胞耗氧量的活性与其启动pep13诱导的呋喃香豆素分泌的能力密切相关。
结论
RAMOS非侵入性地确定OTR作为植物细胞代谢活性的测量。在欧芹细胞悬浮培养中,水杨酸衍生物对耗氧的化学增强与增强防御的启动状态的诱导相关,增强了pep13诱导的呋喃香豆素植物抗毒素的数量。引燃活性化合物茉莉酸甲酯和吡唑菌酯处理也导致呼吸活性增强。因此,RAMOS是一种用于农业鉴定引物诱导化合物的新技术。
背景
植物比以往任何时候都更需要为不断增长的世界人口提供食物、饲料、纤维和生物能源。需要可持续和有效的植物保护策略,以确保足够的植物产量,减少生物和非生物胁迫造成的产量损失[1]. 传统上,合成杀菌剂、杀虫剂和除草剂被用来保护植物免受生物胁迫。然而,这些化学物质也经常损害非目标生物,通常降解性差,因此在作物、土壤或两者中积累。此外,害虫、病原体和杂草对所用农药的抗性也在不断发展[1].因此,需要一种替代的作物保护战略正变得越来越重要。
另一种可持续的作物保护策略可以增强植物的免疫系统对生物和非生物胁迫的防御能力[2,3.]. 事实上,经过某些天然或合成化合物的处理,植物可以切换到一个警戒状态。在启动状态下,植物对生物或非生物的挑战做出反应,从而更快、更强地激活防御,这通常导致免疫和/或胁迫耐受[3.- - - - - -6].
事实上,某种农用化学品(例如,斯特脱石蛋白杀菌剂,新烟碱类杀虫剂)的商业成功,至少部分地依赖于其对增强防御的灌溉厂的能力。然而,用于鉴定诱导诱导的化学化合物的可靠测试系统是罕见的。最近报告的免疫引发化合物的高通量测定评估了细菌诱导的细胞死亡的增强拟南芥启动剂培养细胞[7]. 除了细菌挑战,测试需要伊文思蓝染色,洗涤,染料提取和消光测量。因此,屏幕相当乏味。
1998年,Siegrist等人。[8]据报道,荧光分析有助于植物免疫启动化合物的鉴定。这项试验依赖于欧芹培养细胞和Pep13,一种13个氨基酸的防御诱导子大豆疫霉[9]. 该试验测量了用启动激活剂预处理后Pep13诱导的呋喃香豆素(植保素)分泌的增强[10].对竞争性测定的测试的优点是Furanocoumarin荧光检测的高灵敏度,并且在最终分析之前仅使用两种后续治疗(引发,Pep13挑战)。例如,欧芹细胞的延长预处理(引发)植物防御信号茉莉酸(Ja),水杨酸(Sa),或合成SA模拟苯并噻唑(Bth;商品名Bion®,Actigard®或Boost®)通过荧光光谱检测到,增强了Pep13激活的抗微生物呋喃古马林植物植物肝素[8,10,11].该试验的一个缺点是它对呋喃香豆素分泌的依赖,而呋喃香豆素分泌通常要在Pep13刺激后24小时才能确定[10].
在本研究中,我们报道了一种呼吸活动监测系统(RAMOS) [12,13]可以鉴定具有植物防御引发活性的化合物。拉莫斯使得在悬浮培养中的欧芹细胞的氧气转移率(OTR)进行非侵入性在线监测。随着氧气溶液的储存能力非常小,可以等于欧芹植物细胞的氧摄取率。研究了SA和PEP13对OTR的影响。此外,测试了已知灌注 - 活性(SA,4-CSA,MEJA,F500)和灌注 - 无活性(3-HBA,4-HBA)化合物的影响。
结果与讨论
欧芹细胞培养转移到RAMOS装置
将欧芹细胞培养转移到RAMOS装置上,建立了一种简单、可靠的筛选植物防御启动化合物的方法。以前的研究[14- - - - - -16]已经表明植物细胞的呼吸活动提供了有关其新陈代谢的重要信息。
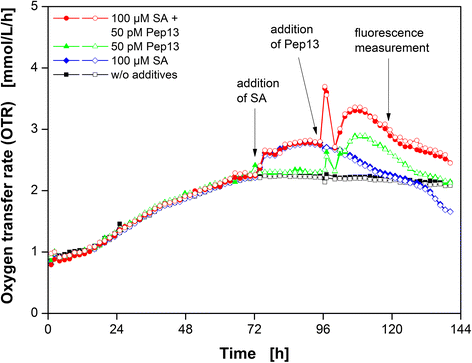
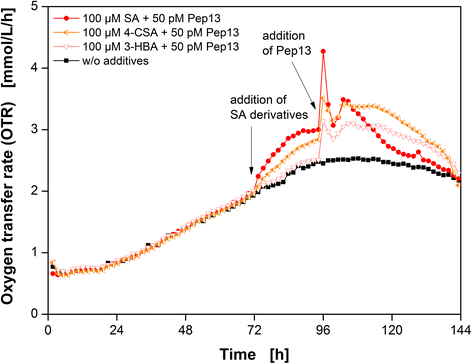
首先,通过SA和随后的Pep13激发进行标准实验[9,17进行了评价每种化合物对悬浮培养物中荷兰芹细胞OTR的影响。没有添加SA或PEP13的未经处理的培养物,仅使用SA处理的培养物以及专门用PEP13处理的培养物作为参考。数字1显示这四个实验中欧芹细胞培养的OTR随时间的变化。
所有重复的OTR曲线都有很好的一致性(图1)。1).OTR曲线的未经处理的欧芹细胞培养显示持续增加直到72 h。100μM的股价造成1.2倍增加OTR比未经处理的文化在12 h SA后除了这个层面上的剩余12 h。只增加50点Pep13 96 h导致第一OTR峰值的1.2倍与未处理细胞的OTR水平相比,OTR水平增加(图。1).100 h后开始出现第二次OTR增加。100 μM SA和50 pM Pep13处理后,细胞的OTR均在加入SA后增加,在加入50 pM Pep13后出现两个OTR最大值。与单独使用50pm的Pep13培养液相比,这两个最大值都更明显。
以往的研究对植物免疫启动过程中耗氧量的增加提供了两种可能的解释:一种解释认为线粒体选择性氧化酶(AOX)的激活可能导致耗氧量的增加[18- - - - - -23],而另一种解释认为,由质膜定位的NADPH氧化酶合成的活性氧物种导致了氧消耗的增强[18,24,25].然而,这两个解释虽然是替代,但不相互排斥。此外,植物防御中的其他氧气消耗机制可能负责观察到的OTR的增加,例如ROS的产生[24,26- - - - - -28]. 可能是O的来源2−受SA影响的是位于线粒体膜内的真正的电子传递链[26,29].Kawano和Muto(1999)表明SA可防止细胞形成高反应性羟基(HO)•). 相反,烟草细胞产生较少的活性氧2−[30.].超氧化物歧化酶(SOD)可能进一步催化O2−至H2O2SA激活烟草中的SOD[31.]. 此外,水杨酸抑制两种酶通常降解H2O2,过氧化氢酶和抗坏血酸过氧化物酶,导致H增加2O2[24,27,28,32.]. 因此,添加SA后OTR的增加可以解释为几种耗氧机制的激活,这些机制反过来可能影响Pep13反应。
Pep13的添加启动了欧芹细胞中明显的氧气消耗增加的第二个阶段,这可能是模仿病原体的存在。Pep13和其他微生物相关分子模式(MAMPs)在植物细胞中激活无数的防御反应[9]. 在以前的出版物中[33.,34.],一小时2O2我们已经描述了由两个阶段组成的ROS爆发:一个快速的,似乎非特异性的生成,接着是一个长期的,明显的病原体特异性的增加。Nürnberger等人[9]说明在欧芹细胞中,Pep13激活质膜结合的NAD(P)H氧化酶,导致O2−形成。随后,O2−可以转换为h2O2作为细胞核内基因表达的激活剂[9].因为氧的形成需要氧2−和H2O2,添加Pep13后欧芹细胞耗氧量的增加(图。1)可能有助于NAD(P)H介导的氧化爆发[33.,34.].
SA预处理增强了Pep13处理诱导的OTR爆发,如图所示。1.无论是第一峰还是第二峰,都比单独用Pep13处理的培养物的峰更明显。如果OTR爆发反映了氧化爆发,那么这种氧消耗的增强可以用H的增强来解释2O2生产[25,35.].
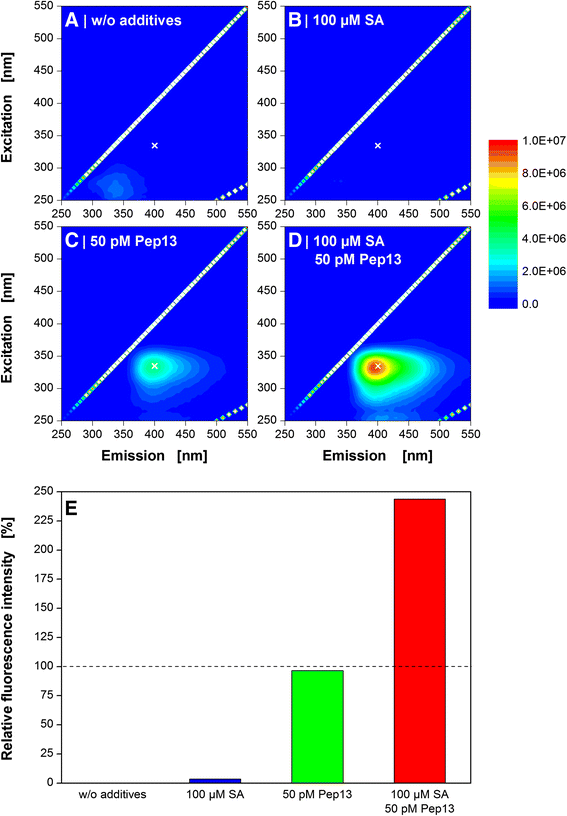
已经建立了用荧光法定性测定分泌呋喃香豆素植物抗毒素用于防御引物检测的方法[8,10,36.].单波长对(λexc= 335 nm and λ新兴市场 = 398 nm) were extended to 2D-fluorescence measurements (Fig.2).呋喃香豆素成分的微小变化可能导致最大强度的变化,可通过2d -光谱检测到。以前的作品显示[37.,38.[MAMP会影响分泌的呋喃库林斯的组成。候选化合物对PeP13时的分泌呋喃香菜组合物的影响也是可能的。
pep13诱导的呋喃香豆素在欧芹细胞悬浮培养中的荧光光谱研究。72 h后用引物水杨酸(SA)处理细胞,96 h后用Pep13处理细胞。加入Pep13 24 h后取细胞培养上清,进行2d荧光光谱分析。实验条件:石英比色皿,填充体积3ml,光谱范围250-550 nm。参考栽培:无添加剂(一个),添加完全100μmsa(b),并专门添加了50pm的Pep13 (c).引物实验包括添加100 μM SA和50 pM Pep13 (d).所有实验均在(e)在335nm的激发波长和400nm的发光波长(用白色交叉标记一个-d). 参考栽培:不含添加剂(黑柱),添加100μM水杨酸(SA)(蓝色列),并专门添加了50pm的Pep13 (红色专栏).将培养物上清液的总荧光信号减去未处理培养物的总荧光信号。因此,“100 μM SA”的校正荧光强度(蓝色列)和“50 pM Pep13”(绿色列)被设定为100%。引发实验含有100μmA和50pp13(红色专栏)
数字2 a - c为3种参考培养物(不添加添加剂,只添加100 μM SA,只添加50 pM Pep13)培养120 h后的培养上清液。此外,无花果。2D描述用SA和Pep13处理的培养上清。
与参考文献相比(图。2 a - c)SA和Pep13处理的细胞上清(图。2D)在约λ处显示出增强的荧光强度exc= 335 nm and λ新兴市场= 400海里。此外,在λ附近观察到一个独特的肩exc= 330 nm和λ新兴市场 = 450 nm表明该信号来自于分泌的呋喃香豆素混合物[39.].无花果。2e说明了波长对λ处的相对荧光exc= 335 nm and λ新兴市场 = 400 nm,以便更好地进行比较。用100μM SA处理并随后添加50 nM Pep13(红色柱)导致荧光强度比参考文献的加性信号增加2.3倍。SA处理对呋喃香豆素分泌和随后添加Pep13的增强作用已在以前的出版物中显示[8,10,36.].
SA和Pep13浓度对OTR的影响
为了更好地理解欧芹细胞培养物在防御启动方面的呼吸反应,我们使用了不同浓度的SA和Pep13。图中显示的两条OTR曲线。1非常匹配。随后,对实验进行了单次测量。为了在整个研究过程中更好地比较实验之间的测量结果,在每个实验中进行了未处理培养物和用100μM SA处理并随后用50μM Pep13激发的培养物作为参考培养物。因此,独立实验考虑了生物变异。然而,由于用于接种的保持培养物的生理状态的变化,不同个体RAMOS实验在相同实验条件下的OTR表现出轻微的差异。
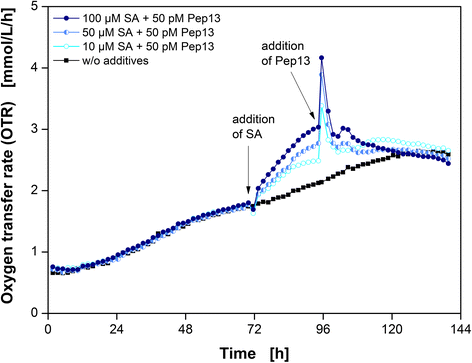
首先,改变SA浓度,并将Pep13浓度保持在50μm不变。除了100μM SA和50μM Pep13的标准实验外,图。3.对10 μM和50 μM SA的其他两个引物实验的OTR进行了分析。一个未经处理的欧芹培养物可以作为参考。
在添加SA后,OTR显著增加,在50pm的Pep13处理后,可以看到两个OTR峰,如图所示。1. SA浓度越低,OTR的增加越小。因此,在低浓度SA预处理后,添加Pep13诱导的OTR爆发也不明显。然而,在所有三个批次中,添加Pep13引起的主峰都超过了单独添加Pep13后出现的主峰(附加文件)1).此观察结果同意Kauss等人的调查结果。[25]他发现细胞外H2O2诱导后的浓度和用于引物的SA浓度。
然而,在不同实验中的SA浓度的更大变化显示了该实验设置的极限。只要1μmSA没有导致OTR和PEP13中的任何可检测变化都没有提升OTR突发(附加文件2一种)。由于荧光测量也没有显示出倾向(附加文件2D) 这一发现表明,在欧芹细胞中激活可检测的启动状态需要最低水平的水杨酸。与添加100μmsa后的OTR相比,200μmsa处理的细胞没有导致OTR进一步增加。与100μmsa处理的欧芹细胞相比,200μmsa处理的欧芹细胞的相对呋喃香豆素荧光增强。这一结果表明,OTR的增加很可能是由于启动,因为在添加更高浓度的SA后,防御反应的直接激活可能会更强,就像其他防御标记物一样[40].当预处理具有100μm和200μmSA的预处理电池时,OTR突发也发生在PEP13上(附加文件)2). 在烟草细胞培养中,SA浓度与过氧化氢酶活性呈sigmoid相关,因此具有抑制作用,表明显著抑制过氧化氢酶活性至少需要200μmsa[27]. 然而,在欧芹细胞培养中,10μM SA增加了OTR并增强了呋喃香豆素的合成(图。2,附加文件1).这可能是由于SA的亚细胞分布和储存,或物种特异性。欧芹细胞呼吸活动的直接SA反应是剂量依赖性的。
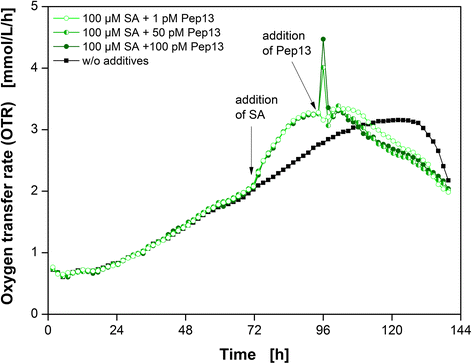
研究了不同浓度的Pep13对sa诱导的欧芹细胞呼吸活动的影响(图。4). 在这些实验中,SA浓度保持在100μM。使用100μM SA和1μM、50μM和100μM Pep13进行启动试验,如图所示。4.未经处理的培养物作为参考培养。同样,SA加导致OTR增加(图。1,3.,4和5).parsley细胞的呼吸反应与Pep13浓度有关。添加100pm的Pep13后,OTR出现明显的OTR爆发和一个小的次级峰。较低浓度的50 pM SA导致OTR爆发不那么明显,但与添加100 pM Pep13后出现的二次峰相比更明显(图)。4).仅添加1pm的Pep13没有引起OTR爆发,但次级峰更为明显。然而,与单独用100 μM SA处理的培养物的OTR相比,这种增加相当微小(附加文件3.).如前所述,Pep13诱导的第一个OTR峰可能代表一种非特异性反应,而第二个OTR峰则代表一种特异性反应[33.,34.]. Pep13浓度越高,细胞的即时反应越大。此外,初级OTR突发越大,次级响应越小。如果OTR爆发与H的增加相关2O2浓度,这种现象可以通过H的影响来解释2O2这可能是细胞毒性的[33.].在明显的OTR突发后的OTR的降低大于OTR时只发生一点突发时的减少(图。4).OTR爆裂对呼吸活动的负面影响支持H的假设2O2累积的。如果H的合成2O2由于OTR爆发,对细胞活力的影响增加,可能是在较高的Pep13浓度下分泌的呋喃香豆素浓度较低的原因(附加文件3.).
总之,SA和PEP13浓度影响呼吸系统和呋喃替马林合成。由于SA加法与Furanocoumarin荧光测量结果相关的OTR增加,因此OTR增加似乎是灌注活性的合适指标。
SA衍生物对OTR的影响
在前面的章节中,SA预处理的欧芹细胞的OTR增加与呋喃香豆素分泌增强之间的相关性得到了证实。如果OTR的增加是启动活性的一个量度,那么预期诱导防御启动的化合物会增加,而启动阴性化合物不会引起耗氧量的增加。因此,被称为引发活性和引发非活性化合物的SA衍生物被测试其增加欧芹细胞耗氧量的潜力。
数字5对引物SA和4-chloroSA (4-CSA)以及引物阴性化合物3-羟基苯甲酸(3-HBA)的OTR表现为时间的函数。所有三种培养物都用50pm的Pep13处理。未处理的培养物作为参考。此外,研究了引物不活跃化合物4-羟基苯甲酸(4-HBA)的影响(附加文件4).
100 μM SA和100 μM 4-CSA的加入均增加了OTR。加入SA后的增幅大于加入4-CSA后的增幅。因此,用SA和4-CSA预处理的欧芹细胞培养物显示了增强的pep13活性氧消耗。用引物无活性化合物3-HBA处理(图。5)或4-HBA(附加文件)4)与未经处理的参考培养物相比,未导致OTR的变化。OTR爆发的强度与仅用Pep13处理的培养物的OTR爆发的强度相同(附加文件)4).
上述结果表明,引物的加入会导致OTR的增加,而引物阴性的化合物则不会。Conrath等人[27]表明,SA或4-CSA处理后的细胞均对过氧化氢酶活性有抑制作用,这可能是导致观察到的ROS积累的原因。相反,引物不活跃的SA衍生物如3-HBA和4-HBA不影响过氧化氢酶活性[24,27].再次测量荧光强度以支持OTR结果。如附加文件所示,用SA或4-CSA预处理增强了荧光强度4.3-HBA或4-HBA处理均未导致电位增强。Thulke等人[40]结果表明,经SA或4-CSA预处理后,香芹细胞中苯丙素途径中的基因激活更强。3-HBA不会引起这种增强[40].添加引发活性的SA衍生物导致OTR的显着增加(图。4);添加引物不活跃的SA衍生物,然而,没有可检测的影响。我们的结果表明,添加一个候选化合物后呼吸活动的增加可以为该化合物在植物中是否具有防御启动诱导活性提供可靠信息。
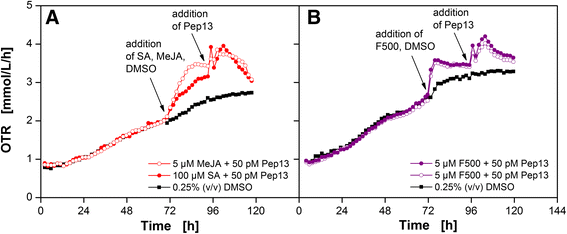
茉莉酸甲酯和吡唑菌酯对微生物活性的影响
基于OTR,成功地对水杨酸及其衍生物进行了引物活性和非引物活性的鉴别。数字6描述了茉莉酸甲酯(MeJA)(a)和strobilurin杀菌剂吡咯烷酮(F500)(B)的OTR随时间的变化。众所周知,这两种化合物都能引起引发反应[41.- - - - - -44.]. 添加MeJA或F500后,OTR增加的幅度大于用DMSO处理的对照培养物。因此,OTR的增加与添加MeJA或F500直接相关。然而,与SA预处理和随后添加Pep13后的OTR爆发相比,添加Pep13后的OTR爆发较小。这一结果表明,化合物的代谢途径不同于SA[41.,45.仍然刺激欧芹细胞的呼吸活性。
结论
在这项研究中,我们介绍了在线测量摇动瓶中的OTR,作为对欧芹细胞培养中常规呋喃香豆素荧光分析的补充技术。用候选化合物治疗后OTR增加与Pep13诱导的呋喃香豆素植物抗毒素分泌增强一致。对于欧芹细胞培养系统,RAMOS装置提供了一种快速、无创和额外的识别启动化合物的信号。细胞培养的指纹是通过在线测量呼吸活动而不是常规的呋喃香豆素终点测定获得的。此外,呼吸活动是一个整体信号,可以转移到其他植物物种。这也将有助于筛选特定作物的引发剂。
方法
欧芹细胞培养
欧芹(脆油)在改良的Gamborg’s B5培养基中,每3-4个月从愈伤组织中培养细胞[46.].培养维护:每7天在500 mL摇瓶中培养30 ~ 40 mL悬液(下外缘一个摇瓶,h≈22 mm)。培养物在25°C、90 rpm、5 cm的震动下进行。实验在250 mL RAMOS摇瓶中进行,填充量为50 mL,包括10 mL欧芹细胞培养和40 mL新鲜的改良Gamborg’s B5培养基。震动直径设置为5 cm,震动频率设置为180 rpm。培养在黑暗的25°C下进行。
媒介和解决方案
西芹细胞悬液在改良的Gamborg’s B5培养基中培养。微量元素和微量元素,包括维生素,均购自荷兰哈勒姆DUCHEFA BIOCHEMIE B.V。培养基中添加蔗糖20 g/L、2,4-二氯苯氧乙酸20 mg/L、七水硫酸镁250 mg/L。1 M氢氧化钾调节pH值至5.5。
将有引物活性和无引物的SA衍生物溶解在蒸馏水中,得到10 mM的储备溶液。用1m氢氧化钾溶液调节pH值至5.5。将MeJA和F500溶解在DMSO中,得到5 mM的储备溶液。化合物在−20℃下被异构化保存。将所有复合原液分别用蒸馏水或DMSO稀释,得到所需浓度。化合物在Sigma-Aldrich有限责任公司购买。Pep13被溶解在水中,获得一个5 nM的原液,该原液被放入1.5 mL的微管中,并在-20°C保存。
标准实验程序
该过程包括两个后续步骤。首先,在72小时的培养时间后,补充欧芹细胞培养物在72小时后补充1ml灌注 - 活性或灌注无活性的SA衍生物。加入125μLMEJA或F500溶液,其中875μL蒸馏水加入1mL至欧芹细胞培养物。然后,在96小时的培养时间后加入1ml百分点溶液。最后,在培养时间120小时后取富含呋喃乌马林荧光荧光测定的培养样品[36.].
OTR的测定
该OTR是由内部开发和建造的呼吸活动监测系统(RAMOS)确定的[12,13].该技术能够进行准连续的在线测定氧传输速率(OTR)。传统的摇瓶配有四个端口,包括气体入口和出口,接种端口和用于测量顶部空间中的氧分压的氧气传感器。在整个栽培中,连续重复漂洗和测量循环。在漂洗相期间,入口和出口阀门都被打开以提供抖动烧瓶的曝气。将空气流量调节到常规摇动烧瓶中,用棉塞[13].在测量阶段之前,对氧传感器进行校准。在测量阶段,两个阀门都关闭了,由于耗氧,氧分压下降。根据分压随时间的变化计算氧气转移速率。RAMOS设备的商业版本可从Kühner AG, Birsfelden,瑞士和HiTec Zang GmbH, Herzogenrath,德国。
荧光测量
用二维荧光法测定呋喃香豆素的分泌[47.,48.].样品取自与RAMOS烧瓶在相同条件下培养的摇瓶。文化肉汤120 h后收获种植时间和离心机在4000 rpm和4°C 10分钟。然后,3毫升的上层清液被转移到一个石英试管(10 x10 mm Suprasil石英,Hellma GmbH & Co .公斤,Mullheim,德国)和放置在荧光光谱仪(Fluoromax-4, HORIBA Jobin Yvon GmbH,战胜了,德国)。测量了250 ~ 500 nm的二维光谱,增量为5 nm,狭缝宽度为1 nm。柱状图的数据是从二维荧光光谱中提取的。选择激发波长为335 nm和发射波长为400 nm的荧光强度进行比较[8,10]. 为了获得校正的荧光强度,用未处理培养物上清液的总荧光信号减去培养物上清液的总荧光强度。于是,将仅用引发化合物和仅用Pep13处理的培养物上清液的校正荧光强度之和设置为100%,取校正的相对荧光强度。
缩写
- 4-CSA:
-
4-chlorosalicylic酸
- 3-HBA:
-
3-羟基苯甲酸
- 4-HBA:
-
4-hydroxybenzoic酸
- cSA:
-
SA浓度
- 二甲基亚砜:
-
二甲基亚砜
- 500英尺:
-
百克敏
- MAMP公司:
-
微生物相关分子模式
- 梅贾:
-
茉莉酸甲酯
- OTR:
-
氧气转移率
- 朋友:
-
苯丙氨酸裂解酶
- 拉莫斯:
-
呼吸活动监测系统
- 活性氧:
-
活性氧物种
- 南非:
-
水杨酸
- 合成孔径雷达:
-
系统获得的阻力
工具书类
- 1.
奥尔克E-C。害虫造成的作物损失。农业科学杂志。2006;144(01):31–43.
- 2.
Beckers GJM,Conrath U。抗压力启动:从实验室到现场。植物生物学。2007;10(4):425–31.
- 3.
Conrath U, Beckers GJM, Langenbach CJG, Jaskiewicz MR. Priming for enhanced defense。Annu Rev Phytopathol. 2015;53:97。
- 4.
Conrath U,PieterseCmj,Mauch-Mani B.植物病原体相互作用的启动。趋势植物SCI。2002; 7(5):210-6。
- 5。
Conrath U,Beckers GJM,Flors V,García-AgustínP,Jakab G,Mauch F等人。启动:准备战斗。Mol植物微生物相互作用。2006; 19(10):1062-71。
- 6。
牧师V、露娜E、莫奇·马尼B、顿J、弗洛斯V。准备好的植物不会忘记。环境实验机器人。2013;94:46–56.
- 7。
Noutoshi Y,Okazaki M,Kida T,Nishina Y,Morishita Y,Ogawa T,et al.通过高通量化学筛选目标水杨酸葡萄糖基转移酶在拟南芥中鉴定的新型植物免疫启动化合物。植物细胞。2012;24(9):3795–804.
- 8。
Siegrist J,Mühlenbeck S,Buchenauer H。培养的欧芹细胞,快速检测非生物和天然物质作为系统获得性抗性诱导物的模型系统。植物病理生理学。1998;53(4):223–38.
- 9
Nürnberger T, Nennstiel D, Jabs T, Sacks WR, Hahlbrock K, Scheel D.高亲和结合真菌寡肽激发子欧芹质膜触发多重防御反应。细胞。1994;78(3):449 - 60。
- 10.
A苯并噻二唑引导欧芹细胞增强对防御反应的诱导。植物杂志。1998;117(4):1333 - 9。
- 11.
Kauss H, frank R, Krause K, Conrath U, Jeblick W, Grimmig B等。香菜调理(脆油悬浮细胞增加诱导子诱导的细胞壁酚类物质的掺入。植物生理学。1993;102(2):459–66.
- 12.
安德雷T,藏W,帕帕斯庇鲁M,Büchs J。摇瓶法在线测定呼吸活动(OTR,CTR,RQ)。生物化学工程杂志。2004;17(3):187–94.
- 13.
Anderlei T, Büchs J.用于无菌在线测量摇瓶中氧气转移速率的设备。生物化学工程,2001;7:57 - 62。
- 14。
关键词:聚类,聚类,聚类,聚类引用本文:综合表征两种不同烟草细胞系通过培养基优化导致GFP和HA蛋白产量加倍。中国生物医学工程学报,2012;
- 15.
Raval KN、Hellwig S、Prakash G、Ramos Plasencia A、Srivastava A、Büchs J。印楝素类柠檬苦素悬浮培养两步法生产的必要性Azadirachta indica. 生物科学杂志。2003;96(1):16–22.
- 16。
Geipel K、Socher ML、Haas C、Bley T、Steingroewer J。a的生长动力学向日葵和一个鼠尾草悬浮细胞系:摇瓶培养,在线监测系统。工程生命科学。2013;13(6):593–602.
- 17。
Brunner F, Rosahl年代,李J,陆克文JJ,盖尔C, Kauppinen年代,et al。Pep-13,一种植物防御诱导病原体相关模式疫霉转谷氨酰胺酶.EMBO j . 2002; 21(24): 6681 - 8。
- 18。
Cvetkovska M, Alber NA, Vanlerberghe GC。应激过程中线粒体超氧化物爆发的信号传递作用。植物信号处理研究进展。2013;
- 19。
Lennon Am,Neuenschwander Uh,Ribas-Carbo M,Giles L,Ryals Ja,Siedow Jn。水杨酸和烟草叶片病毒感染对烟草替代氧化酶的影响。植物理性。1997; 115(2):783-91。
- 20.
细胞色素与烟草的替代途径呼吸(水杨酸的影响)。植物杂志。1993;103(3):877 - 83。
- 21.
诺曼·C,豪威尔·卡,米勒·阿,惠兰·吉咪,戴·达。水杨酸是线粒体电子传递的解偶联剂和抑制剂。植物生理学。2004;134(1):492–501.
- 22.
Kapulnik Y,Yalpani N,Raskin I。水杨酸诱导烟草悬浮细胞抗氰呼吸。植物生理学。1992;100(4):1921–6.
- 23.
Cvetkovska M, Vanlerberghe GC。替代氧化酶通过影响活性氧线粒体的生成来影响植物对生物胁迫的响应。Plant Cell Environ. 2013;36(3): 721-32。
- 24.
Chen Z,Silva H,Klessig D.诱导植物全身抗旱性抗水杨酸的活性氧。科学。1993年; 262(5141):1883-6。
- 25.
考斯H,犹太人W。用水杨酸预处理欧芹悬浮培养物可提高H2O2. 植物生理学。1995;108(3):1171–8.
- 26。
范德梅尔韦亚,杜伯里。苯并噻二唑抑制烟草线粒体NADH:泛醌氧化还原酶。植物生理学杂志。2006;163(8):877–82.
- 27。
Conrath U、Chen Z、Ricigliano JR、Klessig DF。植物防御反应的两种诱导剂2,6-二氯异烟酸和水杨酸抑制烟草过氧化氢酶活性。美国国家科学院学报。1995;92(16):7143–7.
- 28。
杜纳J,Klessig DF。植物防御反应诱导剂水杨酸和2,6-二氯异烟酸对抗坏血酸过氧化物酶的抑制作用。美国国家科学院学报。1995;92(24):11312–6.
- 29。
møllerim。植物线粒体和氧化应激:电子传输,NADPH转换和反应性氧物种的代谢。Annu Rev植物植物植物Mol Biol。2001; 52(1):561-91。
- 30
Kawano T,Muto S.过氧化物酶作用的机制,用于水杨酸诱导的活性氧物质产生和烟草细胞悬浮培养中的细胞溶质钙的增加。J Exp Bot。2000; 51(345):685-93。
- 31
保龄球手C,阿利奥特T,德洛斯M,范蒙塔古M,因泽D。锰超氧化物歧化酶在大鼠应激反应中的诱导作用白花烟草.禁止J. 1989; 8(1):31-8。
- 32.
Chen Z, Malamy J, Henning J, Conrath U, Sánchez-Casas P, Silva H,等。植物防御反应中水杨酸信号的诱导、修饰和转导国家自然科学基金资助项目:国家自然科学基金资助项目;
- 33.
Levine A, Tenhaken R, Dixon R, Lamb C. H2O2从氧化爆发中协调植物的超敏抗病反应。牢房。1994;79(4):583–93.
- 34.
贝克CJ,奥兰迪艾夫。植物发病机制中的活性氧气。Annu Rev phytopathol。1995年; 33(1):299-321。
- 35.
Mur LAJ,Brown IR,Darby RM,Bestwick CS,Bi Y-M,Mansfield JW等。烟草中对无毒细菌病原体的抗性丧失与水杨酸增强的氧化爆发的减弱有关。植物J。2000;23(5):609–21.
- 36.
二氯异烟碱和水杨酸是系统获得性抗性的诱导物,增强了真菌诱导物在香菜细胞中的反应。植物j . 1992; 2(5): 655 - 60。
- 37.
Tietjen Kg,Hunkler D,Matern U.培养的欧芹细胞的差异反应来自真菌两种非致病菌菌株的elictors。EUR J Biochem。1983; 131(2):401-7。
- 38。
Hauffe KD、Hahlbrock K、Scheel D。诱导子刺激培养的欧芹细胞中呋喃香豆素生物合成:S-腺苷-L-蛋氨酸:bergaptoI和S-腺苷-L-蛋氨酸:黄原醇O-甲基转移酶。Z自然福斯。1985;41c:228–39。
- 39。
贝尔·瑞典,Ivie GW,Oertli eh。来自普通草本荷兰芹的线性呋喃古兰辛和墓石。植物化学。1994年; 36(4):869-72。
- 40
Thulke O, Conrath U.水杨酸在欧芹防御相关基因激活中具有双重作用。植物j . 1998; 14(1): 35-42。
- 41
Herms S、Seehaus K、Koehle H、Conrath U。一种strobilurin杀菌剂增强烟草对烟草花叶病毒和烟草花叶病毒的抗性丁香假单胞菌光伏烟粉虱.植物杂志。2002;130(1):120 - 7。
- 42
Köhleh,Grossmann K,Jabs T,Gerhard M,Kaiser W,Glaab J等人。斯特流蛋白杀菌剂F 500对植物,现代杀菌剂和抗真菌化合物III的生理效应。波恩:AgroOncept GmbH;2002. p。61-74。
- 43
欧芹的预处理(脆油L.)茉莉酸甲酯悬浮培养可增强活性氧的激发。植物生理学。1994;105(1):89–94.
- 44.
Kauss H,KRAUE K,JEBLICK W.甲基己酸酯条件荷兰芹悬浮细胞增加苯基丙醇防御反应的诱导。Biochem Biophys Res Communce。1992年; 189(1):304-8。
- 45.
Pieterse CMJ,房龙信用证。水杨酸独立的植物防御途径。植物科学趋势。1999;4(2):52–8.
- 46.
大豆根系细胞悬浮培养的营养需求。Exp Cell Res. 1968;50(1): 151-8。
- 47.
Lozoya E, Block A, Lois R, Hahlbrock K, Scheel D.通过诱导子处理培养的欧芹细胞,转录抑制光诱导的类黄酮合成。植物j . 1991; 1(2): 227 - 34。
- 48.
Kombrink E,Hahlbrock K.培养的欧芹细胞对来自植物疗法真菌的elictors的反应:Elicitor诱导反应的时序和剂量依赖性。植物理性。1986; 81(1):216-21。
致谢
我们感谢德国联邦和州政府卓越计划对该项目的支持。我们还感谢亚琛工业大学科技转让团队通过“创新基金”进行金融支持。德国研究基金会(DFG),德国联邦政府和州政府的卓越倡议,以及拜耳作物科学研究支持在康拉思实验室启动。
作者信息
从属关系
相应的作者
附加信息
相互竞争的利益
除SM、YR、SS外,其他作者均为与本作品相关的欧洲专利申请EP14182508的发明人。
作者的贡献
JS设计了实验,进行了图中所示的实验。3.,分析数据,说明数字,起草文稿。BS保持了欧芹细胞培养,并有助于实验设计和数据解释。SM进行了有关SA衍生物的所有其他实验。YR用F500进行实验。SS用MeJA进行了实验。UC设计实验,协助数据分析,修改稿件。JB发起研究,协助数据分析和稿件准备。所有作者阅读并批准最终稿件。
附加文件
额外的文件1:
欧芹细胞悬浮培养中sa剂量依赖性反应的参考培养。a -C:氧转移速率(OTR)随三种浓度水杨酸(SA)浓度变化的函数:(a)添加10 μM SA, (B)添加50 μM SA, (C)添加100 μM SA。查看:w / o添加剂(黑色方块),在72小时后添加完全SA(蓝钻)96小时后添加50μm Pep13(灰色三角形)添加SA和50 pM Pep13(蓝色圆圈). 虚线表示添加了(1)SA、(2)Pep13和(3)呋喃香豆素荧光测量取样。D-E:在激发波长为335nm和发射波长为400nm的条件下对实验进行了比较。栽培:不含添加剂(黑列),添加完全水杨酸(SA)(蓝色列),添加完全50 pp13(灰色柱)添加SA和50 pM Pep13(绿色、浅蓝色和深蓝色列). 培养条件:摇瓶容积250ml,灌装容积50ml,振荡频率180rpm,振荡直径5cm,25°C(TIF(16034 kb)
附加文件2:
欧芹细胞悬浮培养的SA剂量依赖性反应的附加培养。A-C:氧传输速率(OTR)作为三种水杨酸(SA)浓度的时间函数:(a)加入1μmSA,(b)加入100μmSA,(c)加入200μmSA。查看:w / o添加剂(黑色方块),在72小时后添加完全SA(蓝钻)96小时后添加50μm Pep13(灰色三角形)添加SA和50 pM Pep13(紫色圆圈). 虚线表示添加了(1)SA、(2)Pep13和(3)呋喃香豆素荧光测量取样。D-E:在激发波长为335nm和发射波长为400nm的条件下对实验进行了比较。栽培:不含添加剂(黑列),添加完全水杨酸(SA)(蓝色列),添加完全50 pp13(灰色柱)添加SA和50 pM Pep13(紫色列). 培养条件:瓶容250ml,灌装量50ml,振荡频率180rpm,振荡直径5cm,25℃(TIF(16270 kb)
附加文件3:
欧芹细胞悬浮培养物的Pep13剂量依赖性反应的参考培养。三种Pep13浓度下氧转移率(OTR)随时间的变化:(a)添加100μm Pep13,(B)添加50μm Pep13,(C)添加1μm Pep13。栽培:不含添加剂(黑色方块)72 h后,只加入100 μM SA(蓝钻), 96 h后只加入Pep13(灰色三角形)加入100 μM SA和Pep13(绿色圆圈). 虚线表示添加了(1)SA、(2)Pep13和(3)呋喃香豆素荧光测量取样。D-E:在激发波长为335nm和发射波长为400nm的条件下对实验进行了比较。栽培:不含添加剂(黑列),添加完全水杨酸(SA)(蓝色列),添加完全50 pp13(灰色柱)加入100 μM SA和50 pM Pep13(绿色列). 培养条件:摇瓶容积250ml,灌装容积50ml,振荡频率180rpm,振荡直径5cm,25°C(TIF 4013 kb)
附加文件4:
对SA衍生物和Pep13处理后的西芹细胞悬浮培养的反应进行参考培养。A-D:四种水杨酸(SA)衍生物的氧转移速率(OTR)随时间的变化:(A)水杨酸(SA),(B)4-氯水杨酸(4-CSA),(C)3-羟基苯甲酸(3-HBA)和(D)4-羟基苯甲酸(4-HBA)。不含添加剂(黑色方块)72小时后加入100μM SA衍生物(蓝钻)96小时后添加50μm Pep13(灰色三角形)加入100 μM SA和50 pM Pep13(红圈)加入100 μM 4-CSA和50 pM Pep13(半橙色左三角形)添加100μM 3-HBA和50μM Pep13(打开浅红色三角形),并添加100 μM 4 hba卡和50 pM Pep13(开放的棕色直角三角形).虚线表示添加了(1)SA, (2) Pep13和(3)呋喃香豆素荧光测量的采样。E-H:实验在激发波长为335 nm和发射波长为400 nm时进行比较。查看:w / o添加剂(黑列),添加了SA衍生物(蓝色列),添加完全50 pp13(灰色柱)加入100 μM的SA衍生物和50 pM的Pep13(红色列).培养条件:250ml瓶容积,50ml灌装量,180rpm摇频,50mm摇径,25℃。(TIF 5309 KB)
权利和权限
开放获取本文在知识共享归属4.0国际许可条款下发布(http://creativecommons.org/licenses/by/4.0/),允许在任何介质中不受限制地使用、分发和复制,前提是您给予原始作者和来源适当的信任,提供到知识共享许可证的链接,并说明是否进行了更改。知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用本文
Schilling,J.v.,Schillheim,B.,Mahr,S。等。氧转移速率识别欧芹细胞中的引物。BMC植物BIOL.15,282(2015)。https://doi.org/10.1186/s12870-015-0666-3
收到了:
接受:
发表:
关键词
- 欧芹细胞培养
- 启动
- 水杨酸
- 政治公众人物13
- 氧气转移率
- 呼吸活动监测系统