摘要
背景
阿拉伯半乳聚糖蛋白(AGPs)是植物细胞壁中普遍存在的组成部分,通过将脯氨酸转化为羟脯氨酸(Hyp)和向Hyp残基中添加阿拉伯半乳聚糖多糖(AG)进行广泛的翻译后修饰。AGP在植物生长发育的各个方面都有作用,但AGP聚糖的功能贡献仍有待阐明。hypp糖基化是由一组hypp -的作用引起的O半乳糖基转移酶(忧郁O-GALT)酶仍有待完全鉴定。
结果
GT31家族的三位成员(GALT3-At3g06440,GALT4-At1g27120,GALT6-At5g62620)被鉴定为Hyp-O-GALT基因在烟草叶表皮细胞中的异源表达,并与两个先前的特征进行了检测Hyp-O-GALT的基因,GALT2而且GALT5.通过实时PCR对这五种病毒进行转录谱分析Hyp-O-GALTs揭示了重叠但不同的表达模式。瞬时表达的GALT3, GALT4和GALT6荧光蛋白融合在高尔基囊泡内。对五种突变体进行生化分析Hyp-O-GALT基因显示agp特异性Hyp-显著降低O-GALT活性和β-Gal-Yariv可沉淀agp。对这些突变体的进一步表型分析表明,根毛生长减少,种皮粘液减少,结实率降低,叶片衰老加速。这些突变体还表现出一些条件表型,包括根生长受损,根尖在盐胁迫下的各向异性生长缺陷,以及对根和花粉管中β-Gal-Yariv试剂生长抑制作用的敏感性降低。
结论
这项研究提供的证据表明,这五种Hyp-O-GALT基因编码催化AGP半乳糖化初始步骤的酶,AGP聚糖在营养和生殖植物生长中发挥重要作用。
背景
阿拉伯半乳糖蛋白(AGPs)是富含羟脯氨酸(Hyp)的细胞壁糖蛋白超家族的成员,被高糖基化O-链接AG多糖。agp存在于几乎所有植物细胞、组织和器官类型的细胞壁、质膜和细胞外分泌物中[1].中等大小的基因家族在整个植物王国编码各种AGP蛋白主干。例如,基于生物信息学研究,拟南芥含有85个AGP基因,而水稻含有69个AGP基因[2,3.].此外,这些基因在空间和时间上以多种模式表达,这可能与它们的多重功能有关。
AGPs在植物生长发育的各个方面发挥作用,包括根伸长、体细胞胚胎发生、激素反应、木质部分化、花粉管生长和引导、程序性细胞死亡、细胞扩张、耐盐性、宿主-病原体相互作用和细胞信号转导[4- - - - - -10].然而,对于任何单个AGP的生物物理和生物化学作用模式仍然缺乏了解。这种对功能的缺乏理解也延伸到碳水化合物部分或AG多糖,它们广泛装饰AGP核心蛋白,并在很大程度上定义了它们的相互作用表面。
鉴于了解植物细胞壁生物合成的重要性,特别是在生物燃料生产方面,最近关于agp的大部分工作都集中在它们的生物合成上。这些努力已经确定了几种负责AG多糖生产的生物合成糖基转移酶(GT)基因/酶[6,11].特别地,我们鉴定并克隆了以下酶:两种CAZy GT-37家族的α-1,2-焦点转移酶(FUT4和FUT6) [12- - - - - -14],二羟脯氨酸-O-半乳糖基转移酶(GALT2和GALT5),是GT-31的成员,包含一个半乳糖蛋白结构域[15,16],另外三种羟脯氨酸-O-半乳糖基转移酶(HPGT1-HPGT3),是GT-31的成员,但缺乏半乳糖结构域[17],一个β-1,3-半乳糖转移酶(At1g77810),是GT-31的成员[18],一种具有延伸活性的β-1,6-半乳糖基转移酶,是GT-31 (GALT31A)的成员[19],一种具有分支起始和分支伸长活性的β-1,6-半乳糖基转移酶,是GT-29 (GALT29A)的成员[20.],三种β-1,6-谷氨酸醛基转移酶是GT-14的成员(GlcAT14A, GlcAT14B, GlcAT14C) [21,22],以及一种推测为GT-77家族成员的AGP β-阿拉伯糖基转移酶(RAY1) [23].
羟脯氨酸-O-galactosyltransferases(忧郁O-GALT)将半乳糖添加到AGP核心蛋白的肽基Hyp残基上,这是AG多糖添加的第一步,也是研究AG多糖对AGP功能贡献的理想控制点。之前,我们已经演示过了GALT2(At4g21060),GALT5(At1g74800)是一个小的多基因家族的成员,并编码hyph - galt [15,16].此外,广泛的表型特征的等位基因galt2而且galt5单个突变体和galt2galt5在生化和生理水平上进行双突变,证实了这两种酶在AG生物合成中的作用,并阐明了AG多糖对AGP功能的贡献。在这里,我们通过描述这个小的六元基因家族中剩余的GALT成员(即GALT1, GALT3, GALT4和GALT6)来扩展这项工作,这些成员通过编码一个GALT结构域和一个GALECTIN结构域来区分。
结果
在网上GALT1、GALT3、GALT4、GALT6分析
本研究重点研究了拟南芥中的六成员基因/蛋白质家族,该家族属于CAZy GT31家族,并通过同时存在GALT (pfam 01762)和GALECTIN (pfam 00337)结构域来区分。最近,这六个成员中的两个GALT2 (At4g21060)和GALT5 (At1g74800)被证明催化半乳糖加成到AGP骨架的Hyp残基上[15,16].这个家族的另一个成员GALT1,由At1g26810,之前被鉴定为参与Lewis a表位形成的β - 1,3-半乳糖基转移酶N-链聚糖[24].其余成员的开放阅读框架,At3g06440(GALT3),At1g27120(GALT4),At5g62620(GALT6)分别对应于1860、2022和2046 bp,并分别指定含有619 (70 kDa)、673 (77.0 kDa)和681 (77.7 kDa)氨基酸的蛋白质(附加文件)1:表S1)。这六种蛋白质共享的氨基酸特性范围从35%到70%(附加文件)1:表S2)。此外,这6个成员与最近发现的3个agp特异性Hyp-进行了比较O-GALT (HPGT1, HPGT2, HPGT3),也属于GT31家族,含有GALT结构域,但缺乏GALECTIN结构域[17].通过多个亚细胞定位预测程序(TargetP,http://www.cbs.dtu.dk/services/TargetP/和高尔基预言器,http://ccb.imb.uq.edu.au/golgi/) [25],附加文件1:表S2)。这9个galt也被提交到TMHMM服务器(http://www.cbs.dtu.dk/services/TMHMM/)用于跨膜结构域(tmd)的预测,tmd是一种在GTs中常见的典型的II型膜拓扑[26](附加文件1:图S1)。除GALT3、HPGT2和HPGT3外,所有基因都被预测有一个单一的TMD,而这些TMD含有疏水区域,可能作为高尔基膜的锚点。疏水聚类分析(HCA)通过将蛋白质序列提交到drawhca服务器(http://bioserv.impmc.jussieu.fr/hca-form.html),用于鉴定含有6种galt“DXD”基序的疏水袋;该分析还包括两个先前鉴定的agp相关的GT31成员,GALT31A和At1g77810,它们分别与AG多糖β-1,6-半乳聚糖侧链和β-1,3主链的延伸有关(附加文件)1:图S2) [18,19,27,28].HCA分析显示,在各种疏水口袋中所含的所有蛋白质中都存在保守的DDD基序。DXD基序与二价金属离子的结合有关,二价金属离子有助于在酶的活性位点上锚定udp -糖供体的焦磷酸基[18].共表达分析采用GENEMANIA (http://www.genemania.org/),并透露GALT3,GALT4,GALT6表达与特征良好的agp特异性GT31成员以及许多agp密切相关(附加文件1:表S3) [15,18,19,24,29].
暂时性的表达高尔特基因在烟草有agp特异性Hyp-O高尔特活动
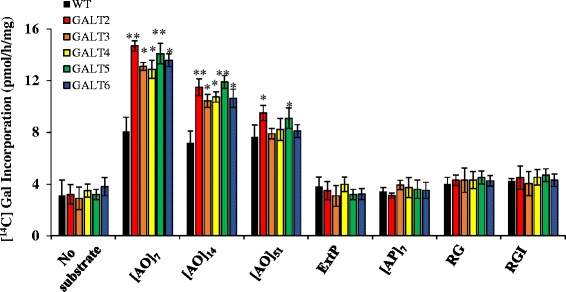
用于生化表征,全长GALT1,GALT2,GALT3,GALT4 GALT5,而且GALT6基因结构,每个含有一个n端6XHis标签,在叶片中瞬时表达烟草.用所需结构物浸润的叶片最初被分离成三个部分:上清液、总微粒体膜和富含高尔基体的微粒体膜。在富含高尔基的洗涤剂渗透的微粒体膜中观察到最高的GALT活性(附加文件)1:表S4),因此该馏分随后被用作瞬时测定的酶源(图4)。1).这里,6个galt中的5个(即GALT2-GALT6)显示Hyp-O-GALT活性,与对照相比[烟草WT叶单独或与空载体或不相关的糖基转移酶基因,唾液酸转移酶(ST)渗透]。先前鉴定的GALT2和GALT5被用作本试验的阳性对照,而GALT1有效地作为阴性对照,因为它涉及N-聚糖生物合成[15,16,24].
GALT2-GALT6的底物特异性
我们测试了各种潜在底物受体,以研究GALT3、GALT4和GALT6的酶特异性。也就是说,(AO)7, (AO)14,和d[AO]51由不连续的肽基Hyp残基组成的模型AGP肽序列被用来检测这些不同长度的模型AGP肽序列对GALT活性的影响。(美联社)7由交替的Ala和Pro残基组成,对肽基Hyp进行半乳糖化的需求进行了测试。ExtP是一种化学合成的由相邻肽基Hyp残基组成的延伸肽,测试了相邻肽基Hyp残基是否作为潜在受体。两种市售的果胶多糖,从马铃薯中提取的鼠李半乳聚糖I和从大豆中提取的鼠李半乳聚糖(RGI和RGII的混合物),也作为潜在的底物受体进行了测试。所有非agp底物受体,包括[AP]7,未能合并[14C]Gal,表明GALT活性对含有非连续肽基Hyp的AGP序列具有特异性(图;2).有趣的是,在烟草中表达的GALT2和GALT5比在烟草中表达的GALT5活性更高毕赤酵母属即使考虑到烟草中相对较高的背景活性。这表明存在植物特异性因子或辅助蛋白对Hyp-起关键作用O-GALT活性[15,16].
Hyp-的附加生化特征O-GALTs
异源表达Hyp-O-GALTs需要二价阳离子Mn+ 2为最大的活动和利用UDP-半乳糖单独作为糖供体(附加文件1:图S3)。这与GALT2和GALT5的表达相反毕赤酵母属,这需要Mg+ 2为其最佳活性[15,16].
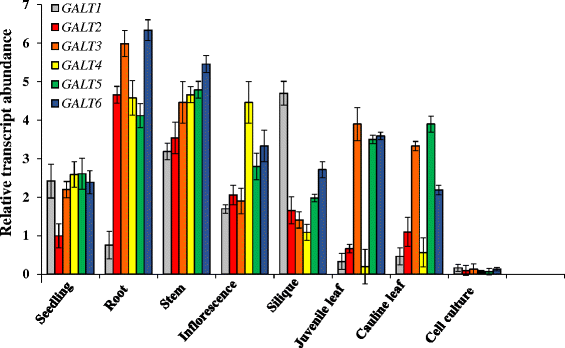
的表达式配置文件Hyp-O-GALT基因
利用qRT-PCR和公共数据库的数据挖掘分析了该基因的表达谱Hyp-O-GALT基因。qRT-PCR分析表明GALT1-GALT6广泛表达,具有重叠但不同的表达模式(图。3.).这些Q-PCR数据与genevarcheator和eFP浏览器提供的公开表达数据一致[30.,31]以及之前Strasser等人的研究[24](附加文件1:图S4)。来自大规模转录组数据库的数据被用来提供洞察高尔特表达和提供线索,以集中在哪里的表型分析高尔特敲除突变植物。显着的表达模式如下:最高表达GALT6其次是种子、种皮、根毛、花和角果,而GALT4主要在幼花、成熟花和成熟花中表达。GALT3在根、成熟花粉和下胚轴中含量丰富(附加文件1:图S4)。
大量研究表明,花粉管在雌蕊中生长时发生了剧烈的变化,它们在雌蕊中快速生长,感知并响应雌蕊分泌的导航线索,而agp在这种相互作用中起着关键作用[32- - - - - -34].然而,花粉管对雌蕊生长的反应所表达的基因的特征很不明确。秦等。[35]利用半离体授粉的新组合,随后进行微阵列分析,以确定专门参与花粉-雌蕊相互作用的基因,包括Hyp-O-GALTs。GALT5表达量最高的是GALT2而且GALT4,而HPGT3仅在花粉伸长后期表达。此外,有趣的是,这些表达模式存在时间差异Hyp-O-GALTs花粉伸长期间(附加文件1:图S4)。
此外,利用激光捕获的解剖种皮组织(http://seedgenenetwork.net/arabidopsis)表明所有五个Hyp-O-GALT在胚胎发生过程中,转录水平在种皮中显示独特的表达模式(附加文件)1:图S5) [36].值得注意的是,GALT6在种子发育过程中表达,而GALT2而且GALT5转录本在种子发育早期高于种子发育后期。相比之下,GALT4仅在种子发育的后期观察到,而GALT3在种子中表达最少。
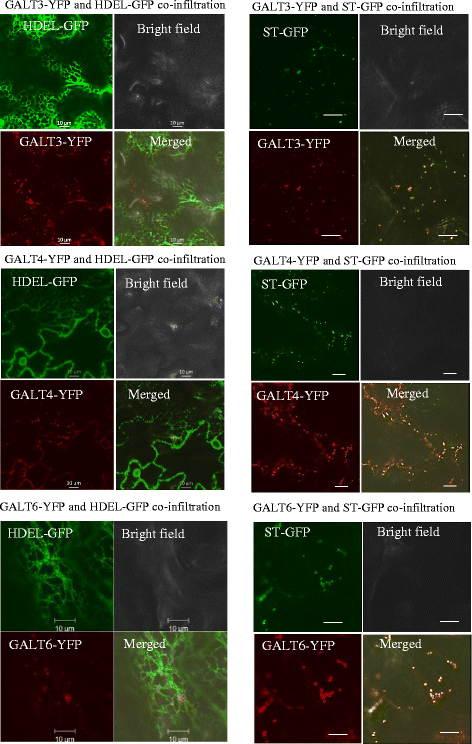
GALT3, GALT4和GALT6靶向高尔基囊泡
c端YFP融合到GALT3, GALT4和GALT6的瞬时表达被浸润n tobaccum在表皮叶细胞中检测这些酶的亚细胞定位(图;4).GALT3-YFP、GALT4-YFP和GALT6-YFP分别与高尔基标记蛋白唾液酸转移酶(sialyl transferase)共表达,并融合到GFP (ST-GFP),表明这三种galt都定位于高尔基体。此外,也排除了它们定位于ER的可能性,因为GALT-YFP融合结构没有与ER标记共定位,HDEL与GFP融合(HDEL-GFP)。分析了ST-GFP、hdell - gfp和GALT-YFP的单浸润对照,以优化每个通道的增益和针孔设置,并排除通道之间的任何荧光出血(附加文件)1:图S6)。
GALT3,GALT4,而且GALT6突变体表现出AGP生化缺陷
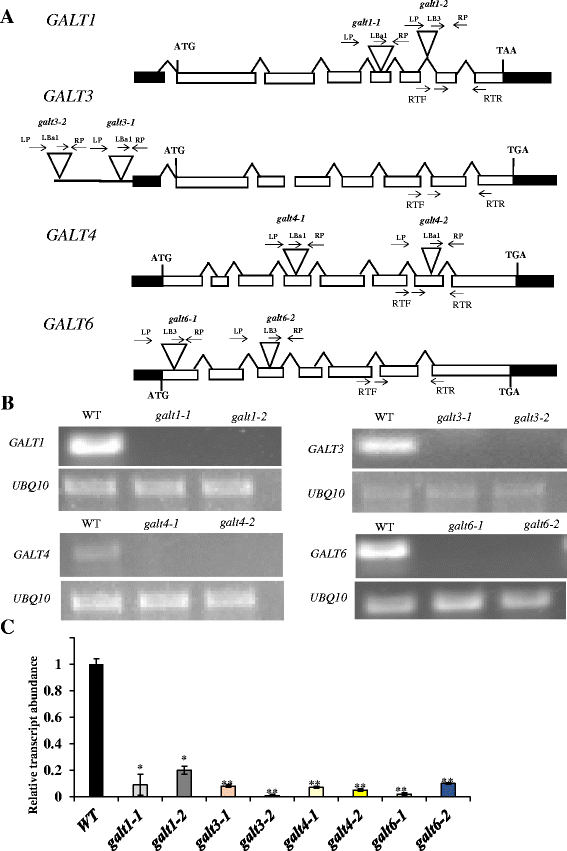
在这六种基因中,每一种都鉴定出两个独立的带有T-DNA插入的等位突变系高尔特以研究Hyp-的生物化学作用O- galt在体内。产生纯合突变体,PCR鉴定,测序确认(图。5).RT-PCR和qRT-PCR分析表明,在突变体中几乎没有检测到转录本(图2)。5 b而且c).从14 d老苗木中获得的β-Gal-Yariv可沉淀AGPs在敲除突变体中显著降低GALT3(galt3-1而且galt3-2),GALT4(galt4-1而且galt4-2),GALT6(galt6-1而且galt6-2)与WT相比(表1).这种减少以前报道的敲除突变体GALT2(galt2-1而且galt2-2),GALT5(galt5-1而且galt5-2),以及galt2galt5双突变体和用作阳性对照[16].与GALT1合成Lewis a结构而缺乏Hyp-的结果一致O-GALT活性(图;1),敲除突变体GALT1(galt1-1而且galt1-2)没有显示出这种减少,并且与WT难以区分(表1) [24].
基因模型示意图,T-DNA突变插入的位置,和转录本分析GALT1,GALT3,GALT4,GALT6.一个GALT1 GALT3。GALT4而且GALT6基因结构和T-DNA插入位点galt1-1,galt1-2,galt3-1, galt3-2, galt4-1, galt4-2, galt6-1,而且galt6-2突变体。的内含子-外显子结构Galt1 galt3 galt4,而且GALT6表示(内含子画成线,外显子画成矩形,白色矩形表示编码序列和黑色的矩形代表utr)。T-DNA插入位置标记为(三角形),引物序列的位置(箭头以上基因)用于PCR筛选。b14日龄WT (Col-0)莲座叶转录本与等位基因纯合子RT-PCR分析galt1, galt3,galt4而且galt6突变体线。基因下方的箭头(一个)表示用于RT-PCR分析转录水平的引物位置(记为RTF和RTR)。UBQ10引物被用作内部对照。c定量实时反转录pcr (qRT-PCR)分析,定量并比较指示基因与相应WT基因的转录水平。换句话说,相对表达水平高尔特将突变体中的基因与WT值进行比较,每个突变体的WT值设置为1.0高尔特基因。星号表示与指示基因的WT表达显著不同的值(Dunnett’s test, *P< 0.01;**P< 0.001)
已知这些Hyp-的微分表达式O-GALTs和agp的广泛表达,agp也从突变体的其他器官定量。在这些突变体的其他器官中也观察到类似的β-Gal-Yariv可沉淀agp的减少模式。一般来说,五种方法中的任何一种都可能被破坏高尔特(GALT2-GALT6)导致AGP含量显著降低,最显著的影响表现为galt5在茎,galt4在锡利克斯,和galt6在衰老叶(表2).这些突变体AGP定量数据与基因表达谱数据一致GALT2-GALT6.用反相高效液相色谱法测定了这些β-Gal-Yariv可沉淀agp的分布高尔特结果显示,与WT或agp相比,几乎所有这些agp,而不是这些agp的单个或子集,都受到了影响galt1控制配置文件(附加文件1:图S7)。此外,AGP在galt3 galt4,而且galt6与WT或突变体相比,突变体洗脱较晚,因此具有较少的糖化蛋白galt1对照AGP峰值,与低半乳糖化降低一致。
GALT3,GALT4,而且GALT6突变体表现出根毛缺陷
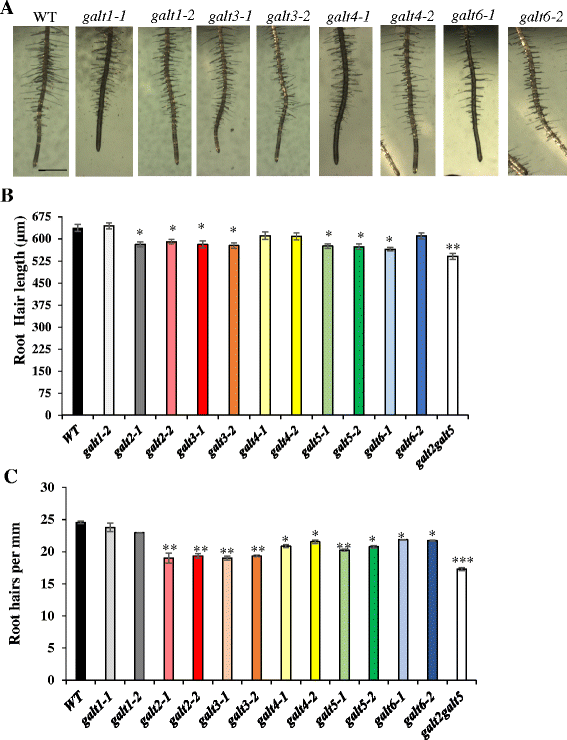
为了研究这六种galt在体内的生理功能,在MS板上培养突变体并与WT进行比较。除了根毛外,未观察到初级根生长的显着差异。单突变敲除系为GALT3,以及forGALT2而且GALT5和galt2galt5双突变体,与WT相比始终表现出更短和更稀疏的根毛;最重要的台词GALT6,GALT4,而且GALT1表现出不太严重或没有这种根毛表型(图;6).
GALT4而且GALT6突变体的结实率降低
的galt4而且galt6突变体的结实率分别降低了16%和13%(图2)。7和表3.).的互交galt4而且galt6对野生型植物进行突变,以确定这种缺陷是由雄性配子体还是雌性配子体赋予的。这种杂交表明,这些突变体的雄配子体主要是造成结实率降低的原因(图2)。7和表3.).因此,用亚历山大染色法检查花粉,这表明花粉是可行的(附加文件)1:图S8A)。此外,离体花粉的萌发频率没有改变galt4而且galt6与WT相比的突变体(附加文件1:图S8B和S8C)。
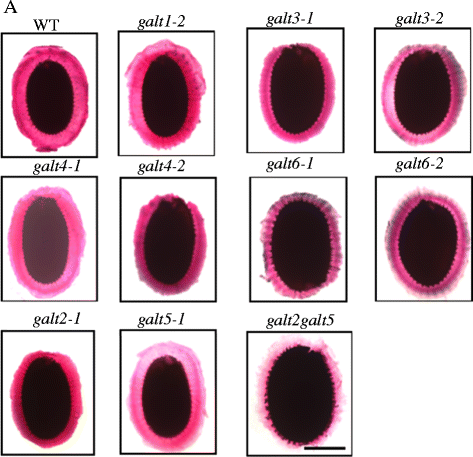
GALT3而且GALT6突变体显示粘附种皮粘液染色减少
AGPs (SOS5)和GALT2/GALT5参与种皮黏液的先前证据促使研究了AGPs (SOS5)的潜在功能GALT3,GALT4,而且GALT6在修饰种皮粘液时[16,37,38].六人分裂的效果高尔特用钌红染色水合种子,研究粘附种子黏液上的基因家族成员,钌红染色带有负电荷的生物聚合物,如果胶[39].的Galt3-1 galt3-2 galt6-1 galt6-2而且galt2galt5突变体种子的黏附黏液染色模式较薄,而WT,galt2,galt4, galt5,galt1种子显示强烈的,规则的,球形染色模式(图。8).此外,还测量了黏液的质量和体积,以确定黏液厚度的减少。WT组和WT组的黏液粘连量无差异高尔特单突变和双突变种子,而粘附黏液大小galt3,galt6,而且galt2galt5与WT相比显著降低(20 ~ 30%)(表4).相比之下,galt1,galt4,galt2,而且galt5与WT相比,突变体的变化较小(5 ~ 13%)。
为了确认和量化非粘附(可溶性)和粘附黏液的变化,WT和高尔特对突变种子进行分析。用草酸铵、0.2 N NaOH和2 N NaOH依次提取种子,以评估可溶性和粘附黏液的变化(表1)5).这两个galt6而且galt3与野生型种子相比,草酸铵和0.2 N NaOH提取物(可溶性和弱附着果胶)中总糖含量显著增加galt1突变体)。差异不显著galt2,galt4,galt5单突变体,而在galt2galt5突变体。所有的高尔特变种人除了galt1显示出2 N NaOH提取物中总糖含量的减少,这代表了粘附粘液的大部分,并含有强连接果胶和交联聚糖/半纤维素[40,41].
GALT6突变体表现为早衰
只有GALT6突变体(galt6-1而且galt6-2)较WT和其他大鼠表现出较早的衰老高尔特突变体。这可以从叶片的过早发黄中看出,并与叶绿素含量和蛋白质含量的略微更大的减少有关GALT6与WT相比的突变体(附加文件1:图S9)。这些观察结果与丰富的GALT6衰老叶片中β-Gal-Yariv可沉淀AGPs的减少显著增加galt6衰老的叶子(附加文件1:图S4;表格2).
GALT3,GALT4,而且GALT6突变体表现出花粉管和根的生长,对β-Gal-Yariv试剂不敏感
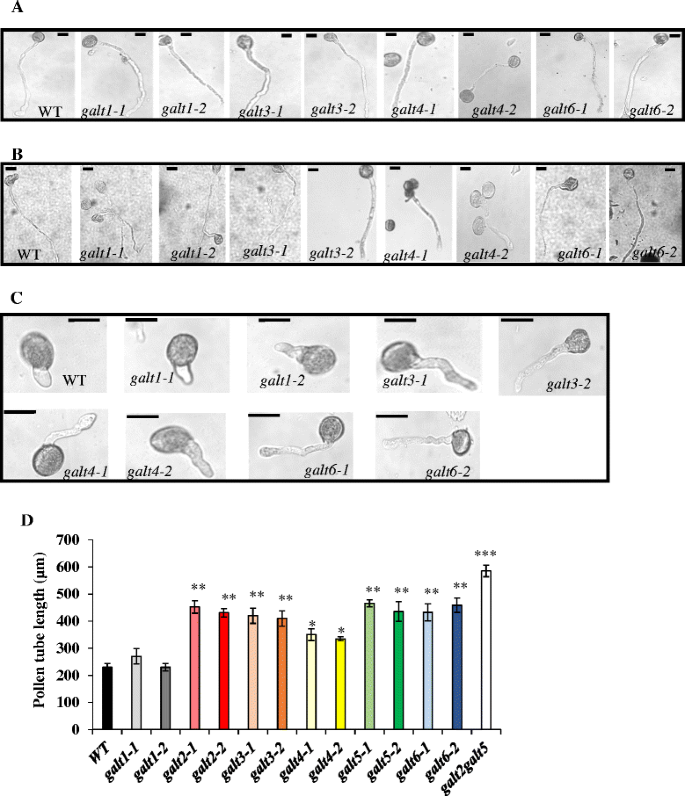
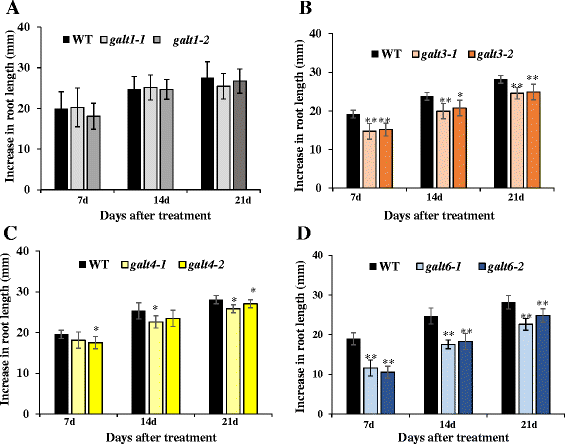
的galt3 galt4,而且galt6与WT或α-Gal-Yariv对照处理相比,β-Gal-Yariv试剂对突变体花粉管和根系生长伸长的抑制作用减弱。9,10,附加文件1:图S10)。正如所料,GALT1与WT相比,突变体在花粉管或根的生长伸长方面没有表现出任何差异。此外,在未补充的萌发介质中,花粉管或初级根的生长伸长没有观察到显著差异,表明该表型具有条件性质(图2)。9而且10).
的高尔特在β-Gal-Yariv试剂的存在下,单个突变体对花粉管生长的抑制减弱。一个来自WT的花粉管代表图像,galt1,galt3, galt4,galt6突变体在花粉萌发培养基中培养16 h后b在花粉萌发培养基中添加30 μM α-Gal-Yarivc在花粉萌发培养基中添加30 μM β-Gal-Yariv试剂。Bar = 50 μm。dWT的花粉管长度,galt1-galt6突变体,galt2galt5在添加30 μM β-Gal-Yariv试剂的花粉萌发培养基中,在16h内检测双突变体。利用Image J软件对各基因型20朵花和25支花粉管进行了测定。本实验共做了三次,星号表示与WT显著不同的平均值(Dunnett’s test, *P< 0.05;**P< 0.01;***P< 0.001)
减少对初生根生长的抑制galt3,galt4,而且galt6β-Gal-Yariv试剂检测突变体。WT的根长度,galt1,galt3, galt4,galt6在发芽后7、14、21 d,幼苗建立5 d后分别在MS板、添加50 μM α-Gal-Yariv试剂的MS板和添加50 μM β-Gal-Yariv试剂的MS板上进行测定。统计学差异由方差分析确定,其次是Tukey的诚实显著性差异检验。星号表示在一个治疗组内与所示基因WT表达显著不同的平均值(Dunnett’s test, *P< 0.05;**P< 0.01)。纵柱表示至少三个独立实验的实验均值±SE,其中每个实验的实验均值来自10到15个幼苗
条件盐过敏表型高尔特突变体
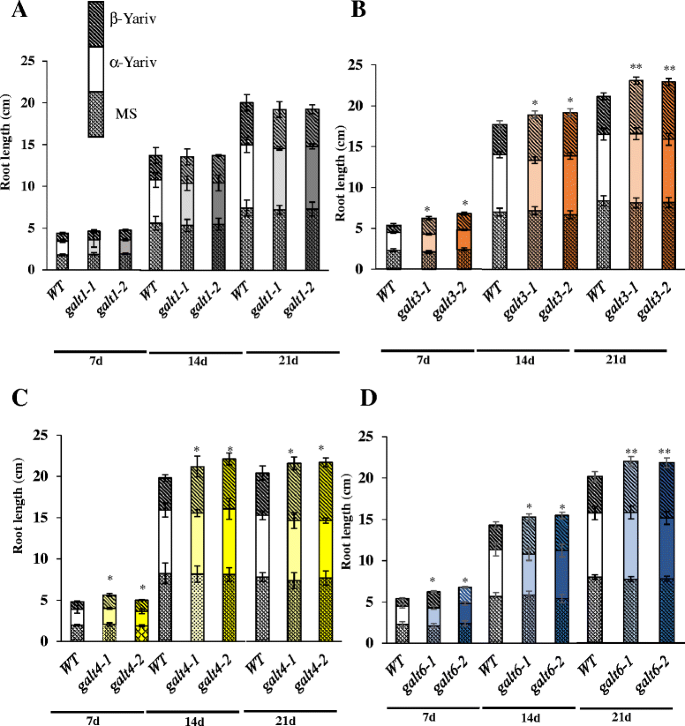
GALT3(galt3-1而且galt3-2),GALT6(galt6-1而且galt6-2)突变体,在较小程度上GALT4(galt4-1而且galt4-2与WT相比,在100和150 mM NaCl环境下生长时,突变体的根伸长显著减少(图2)。11和附加文件1:图S11)。这种根伸长的减少以前在敲除突变体的报道GALT2(galt2-1而且galt2-2),GALT5(galt5-1而且galt5-2),以及galt2galt5双突变体[16].正如所料,GALT1突变体没有表现出盐敏性生长,在本试验中与WT没有区别。的高尔特单双突变体对渗透胁迫不敏感,如甘露醇所示(附加文件)1:图S12)。
显微检查GALT3,GALT6,在较小的程度上GALT4在100 mM NaCl的作用下,突变体的根尖各向异性生长也出现缺陷(即根尖肿胀),这在WT和NaCl中没有观察到GALT1变种人(附加文件1:图S13)。这种盐过敏根尖肿胀反应先前在galt2,galt5,galt2galt5突变体和被包括在这里作为阳性对照[16].
采用根弯曲试验作为另一种评价盐过敏反应的方法高尔特变种人(附加文件1:图S14)。该方法通常被植物研究人员用于评估盐敏感性/耐盐性,包括监测幼苗180度重定向后的根生长重定向。实验结果表明GALT3(galt3-1而且galt3-2),GALT6(galt6-1而且galt6-2)突变体,在较小程度上GALT4(galt4-1而且galt4-2)与WT相比,在100 mM NaCl环境下,突变体的根系生长调整速度较慢。这种延迟的重新定位以前报道的敲除突变体GALT2(galt2-1而且galt2-2),GALT5(galt5-1而且galt5-2),以及galt2galt5双突变体;这些突变体被用作阳性对照[16].正如所料,GALT1突变体(galt1-1而且galt1-2)迅速重新定向,在本试验中与WT难以区分。
讨论
GALT2-GALT6为agp编码hyph - galts,在拟南芥中广泛表达
生物信息学方法以前被用于识别CAZY数据库的GT 31家族中的一个小的6成员基因家族,作为编码Hyp-的潜在候选基因O- agp的galt [15,18,42].该家族的蛋白质成员被命名为GALT1-GALT6,并通过存在GALT结构域和GALECTIN结构域来区分。之前,GALT1被证明可以催化半乳糖的添加,形成Lewis表位N-链聚糖[24],而GALT2和GALT5被证明是agp特异性的hyph - galt [15,16].在本研究中,生物化学和遗传证据表明,GALT3、GALT4和GALT6也作为agp的hyph - galt。
的异源瞬时表达GALT1-GALT6与各种控烟植物相比,烟草表皮细胞中的hypa - galt活性显著增加,但显著的例外是GALT1(无花果。1和附加文件1:表S4)。Hyp-的缺失O-GALT活性高于背景水平,以防GALT1与其报道的非agp相关功能一致,并为本文报道的研究提供了有用的对照[24].此外,这项在烟草中的瞬时表达研究证实了先前的发现,GALT2和GALT5在烟草中表达毕赤酵母属pastoris,作为agp特异性hyph - galt [15,16].值得注意的是,在这两种异源表达系统中检测到的活性量是不同的;烟草系统的活性水平远远高于毕赤酵母属即使考虑到与烟草系统相关的较高水平的内源性活动。这一观察结果可以解释为需要其他植物性蛋白质或因子来增强或优化Hyp-O高尔特活动。
使用各种潜在受体底物研究了GALT2-GALT6的底物特异性,并证明GALT2-GALT6对AGP模型序列具有特异性(图2)。2).这些发现与hypp邻近假说一致,该假说认为聚集的、不连续的hypp残基是AG的添加位点,而连续的hypp残基是Ara低聚糖的添加位点[43,44].尽管在瞬时烟草表达系统中观察到较高的酶活性毕赤酵母属, GALT2和GALT5在两个系统中都观察到对AGP底物的相同尺寸依赖偏好,其中[AO]7是首选底物[16].GALT3, GALT4和GALT6在烟草系统中也以类似的方式起作用。
异源瞬时表达GALT2-GALT6烟草微粒体中的GALT(s)与拟南芥微粒体膜中的GALT(s)具有相似的生化性质GALT2而且GALT5表达毕赤酵母属,具体来说都需要UDP-Gal作为糖供体[15,16,45,46].它们需要Mn2 +接着是Mg2 +以获得最佳的活性,而Mg2 +其次是Mn2 +在毕赤酵母属微粒体。
基因突变分析提供了额外的体内证据,证明GALT3、GALT4和GALT6具有类似GALT2和GALT5的hyph - galt功能1而且2).等位基因的高尔特所有这些基因的敲除突变体表现出较低的(即减少15 - 35%)hyph - galt活性,并含有相当少的(即减少10 - 60%)糖基化(即β-Gal-Yariv可沉淀)agp。此外,AGP剖析的galt3,galt4,galt6突变体扩展了这些发现,并表明它们的活性不局限于特定的AGP或AGP的一小部分,而是广泛作用于共表达的AGP,与先前报道的相似galt2而且galt5变种人(附加文件1:图S7)。
qRT-PCR分析GALT1-GALT6进行了检测,以检查其表达模式,并提供相关的信息,表型分析其相应的等位突变体(图。3.).这六种基因都得到了广泛的表达GALT2-GALT6与agp的广泛分布及其相关的多种功能相一致。这些模式通过搜索公共表达数据库得到证实,这揭示了更广泛的器官和组织表达模式(附加文件)1:图S4)。HPGT1-HPGT3,三个最近发现的Hyp-O- galt用于缺乏GALECTIN结构域的agp,也包括在本分析中,并显示出同样广泛的基因表达模式[17].尽管如此,在一个特定的器官或组织内Hyp-O-GALT基因的表达模式在时间和空间上都有差异。利用激光捕获解剖种皮组织提取的RNA进行转录组分析[36的不同组织特异性表达模式提供了一个特别引人注目的例证GALT2-GALT6而且HPGT1-HPGT3(附加文件1:图S5)。
GALT3、GALT4和GALT6局限于高尔基囊泡
各种方法表明AGP糖基化发生在高尔基囊泡中。这些方法包括使用信号P和高尔基预测器进行生物信息学预测,对富羟脯氨酸糖蛋白(HRGP)生物合成进行生化实验[25,45- - - - - -49],一种利用同位素标记技术定位细胞器蛋白质的蛋白质组学技术[49],并对其他AGP GTs进行了定位研究,包括GALT2, GALT5, HPGT1-HPGT3, AT1G77810, GALT31A, GALT29A, GlcAT14A和FUT6 [12,15,16,18,19,21].考虑到GALT3、GALT4和GALT6与GALT2和GALT5的相似性,以及它们被证明的hypa - galt活性,GALT3、GALT4和GALT6被认为存在于高尔基囊泡中,这一点在烟草叶片中荧光标记蛋白融合的异源表达中得到了证实(图2)。4).有趣的是,在ER和高尔基体中都只发现了GALT2,这表明hyph -半乳糖化可能在ER中开始,但在高尔基体中完成O- galt位于[15].
GALT突变表型揭示了AGP糖基化在正常生长发育中的功能作用
利用基因突变分析来研究和比较AGP糖基化在体内的功能贡献GALT3,GALT4,而且GALT6有了GALT2而且GALT5(无花果。5;额外的文件1:表S1)。迄今为止,基于突变体分析,多种功能被归因于某些agp或GTs作用于agp;这些突变体表现出胚胎致死率、初生根生长的条件缺陷、细胞伸长和花粉管生长(附加文件)1:表S5) [13,14,16,17,19,21,23].就像galt2而且galt5, galt3,galt4,galt6在正常的土壤生长条件下,单个突变系表现出微小的或不可见的生长表型,这可能是由于突变体内部的功能冗余GALT2-GALT6基因家族[15,16].由单个突变体在这里显示的表型包括减少根毛长度和/或密度galt3,galt4,galt6(无花果。6),减少种子设置为galt4而且galt6(无花果。7;表格3.),减少种子黏液的粘附galt3,而且galt6(无花果。8和表4),加速叶片衰老galt6(附加文件1:图S9)。虽然这些表型与这些基因的表达谱是一致的,但仅从表达数据很难预测这些表型。预计会翻倍和翻倍高尔特突变体将表现出更明显的突变表型,当galt2galt5双突变体产生并鉴定[16].
就根毛的长度和密度而言,敲除突变体的GALT3GALT6和GALT4在较低程度上表现出较短和/或较密的根毛,表明糖基化AGPs在根毛尖端生长中起作用拟南芥(无花果。6).的galt2,galt5,galt2galt5双突变体也证明了这种反应,并被用作阳性对照[16].根毛密度的降低可归因于表皮细胞纵向长度的增加和/或根毛形成细胞数量的减少,从而导致根毛的形成减少[50,51].使用β-Gal-Yariv试剂和脯氨酸羟化酶基因突变体的其他研究也表明HRGPs(即agp和延伸素)与根毛生长有关[52- - - - - -55].
关于种子粘液,galt3而且galt6突变体在粘附种子黏液层的宽度上显示出最显著的减少galt2而且galt5与WT种子相比,钌红染色后,这表明糖基化AGPs参与了维持种子中黏液层的粘附(图2)。8、表4而且5).的galt2galt5双突变体也证明了这种反应,并被用作阳性对照[16].Harpaz-Saad等人。[37]报告说FEI2在种皮粘液中,富含亮氨酸的受体激酶(细胞壁富含亮氨酸的受体激酶)和束素蛋白(SOS5)对纤维射线的合成和适当沉积至关重要,这与种皮粘液中果胶成分溶解度的增加相一致。的GALT6种皮分化过程中的表达谱与种皮分化过程中的表达谱相同FEI2.此外,GALT6与早期胚胎发生阶段相比,在胚胎发生后期表达水平较高,这与它参与种皮发育和种皮粘液粘附一致。综上所述,GALT6、GALT3、GALT2和GALT5可能糖化AGPs,如SOS5,这对水化过程中保持种子黏液粘附至关重要。
关于结子,galt4而且galt6两种花粉特异性AGPs基因的敲除突变体,AGP6而且AGP11但花粉结构没有异常,虽然偶尔会观察到花粉塌陷galt4而且galt6突变体(无花果。7、表3.,附加文件1:图S8)这表明GALT4和GALT6可能参与了花粉特异性agp的糖基化。多项研究表明,AGPs在授粉后花粉生物发生、花粉管生长发育、花粉管引导以及花粉-雌蕊相互作用中起着关键作用[56- - - - - -61].事实上,据报道,许多AGP基因在拟南芥中表现出花粉特异性表达,包括AGP6,AGP11,AGP23,而且AGP40.突变体与WT的相互杂交证实了这种表型的遗传传播是由雄性配子体贡献的(图2)。7和表3.).相反,有趣的是注意到AGP18据报道,由于RNAi植物中的功能性大孢子不能扩大和分裂,导致胚珠败育和结实率降低,因此对雌性配子体发生至关重要[62].
关于叶片衰老,galt6突变体显示出年龄依赖性的叶片衰老早发性,表明AGP糖基化与植物衰老相关(附加文件)1:图S8和Table2).多项证据表明agp参与调控细胞程序性死亡和衰老[63- - - - - -67].例如,已知β-Gal-Yariv处理可促进植物细胞程序性死亡,而过度表达AGPs可使番茄植株寿命延长[67].在这种情况下,值得注意的是,GALT6在衰老叶片组织中高度表达,并且只有galt6突变体显示衰老叶片中β-Gal-Yariv可沉淀agp显著降低(附加文件)1:图S4和Table2).
任何一个导致AG糖基化降低的缺陷都可能损害多个agp的功能,从而导致在这里观察到的多效效应。然而,至少有一些参与AGP糖基化的基因存在于小的冗余或部分冗余的基因家族中,当家族中的某个特定基因被敲除时,它们可能会相互补偿[12,15- - - - - -17,21,22].在某些情况下,异常表型在正常条件下可能无法识别,但在次优生长条件下可能会显示出来。
条件表现型表明GALT3 GALT4,而且GALT6尖端生长的作用
的galt3,galt4,galt6在β-Gal-Yariv处理或盐处理后,突变体表现出若干条件花粉和根表型,与在植物中观察到的相似galt2而且galt5单一突变体以及galt2galt5双突变体[16].已知在花粉管和根中,β-Gal-Yariv处理可以结合AGPs,特别是结合到它们的β-1,3-半乳聚糖链上,并抑制花粉管和根的伸长[68- - - - - -71表明agp对这种生长很重要。这种抑制在单个突变体中得到缓解,这些突变体由于缺乏相应的galt而降低了AGP糖基化(图2)。9,10,附加文件1:图S10和图S11)。在正常条件下(即没有β-Yariv治疗),在单个突变体中没有观察到抑制,很可能是由于基因冗余,这一结论得到了观察结果的支持galt2galt5双突变体在正常条件下表现出抑制作用[16].因此,GALT3, GALT4和GALT6,就像GALT2和GALT5一样,对花粉管和根的生长很重要,这表明AG多糖是这些生长功能所必需的。
在根中,盐处理会导致根生长减少,这可以直接或通过根弯曲试验来测量,这通常用于筛选植物或突变体的盐敏感性。在这里,galt3,galt4,galt6突变体在这两种试验中都表现出盐敏感根的生长(图2)。11).因此,GALT3, GALT4和GALT6,像GALT2和GALT5一样,在根的生长中起作用,并表明AG多糖在这一过程中的重要性。GALT3, GALT4和GALT6,就像GALT2和GALT5一样,也有防止根尖在盐胁迫下肿胀的作用(附加文件)1:图S13和图S14)。由于SOS5(束素样AGP)以及FEI1和FEI2(两种细胞壁受体样激酶)也可以防止这种根尖肿胀,并且与GALT2和GALT5具有相同的遗传途径,因此AGP糖基化通过五种galt中的任何一种(GALT2-GALT5)可能在SOS5上产生碳水化合物信号,该信号由FEI1/FEI2激酶检测和转导,以促进细胞壁完整性[16,72,73].
结论
总之,本文提出的生化和遗传学证据表明,GALT3、GALT4和GALT6与GALT2和GALT5一样,具有agp特异性hyph - galt的功能。在植物生长、发育和繁殖的多个方面,在基因缺失突变体中观察到的每个基因的大量但不完全重叠的多效作用表明AG多糖对agp功能的重要性。因此,这些Hyp-GALT基因的功能在很大程度上是冗余的,当研究多个基因突变时,预计将出现更严重的生化和生理表型,揭示额外的AGP功能。事实上,未来的工作旨在研究这种多突变体,GALECTIN结构域的作用,hyph - galt和其他参与AGP生物合成的GTs之间酶复合物形成的潜力,hyph - galt /AGP运输,以及AG多糖的潜在信号作用,将为这种小酶家族和作为其底物的AGP家族成员的进化和生物学提供更深入的见解。
方法
在网上六成员GALT家族的分析
GALT1, GALT3, GALT4和GALT6的蛋白质序列通过多个预测程序(TMHMM 2.0, TargetP 1.1, SignalP v2.0)运行。B2服务器),以获取有关其假定的亚细胞定位和拓扑结构的信息[25,26,74].疏水聚类分析(HCA)图从互联网上的drawhca服务器(http://bioserv.impmc.jussieu.fr/hca-seq.html),并按照Breton等人的描述进行分析。[75].GT31成员基因的共表达网络使用GENEMANIA程序(www.genemania.org)使用GALT2而且GALT5作为查询基因。
植物系和植物生长条件
拟南芥接入Columbia-0 (Col-0)和两条T-DNA插入系At1g26180-(galt1-1, Sail_170_A08和galt1-2,Salk_006871),At3g06440(galt3-1, Salk_085633和galt3-2,Salk_005178),At1g127120 (galt4-1, Salk_136251和galt4-2, Salk_131723),以及At5g62620 galt6-1,Sail_59_D08和galt6-2,Sail_70_B02)来源于拟南芥生物资源中心(ABRC, Ohio State University)。本研究中使用的所有植物都在4°C的黑暗中分层4天后发芽,并在生长室或生长室中在长昼条件下(光照16 h /黑暗8 h, 22°C,湿度60%)生长。对突变植物扩增的PCR产物进行测序,可以准确确定T-DNA插入位点。
PCR和RT-PCR检测突变体
从突变体和WT植物叶片中分离基因组DNA,采用Murray和Thompson描述的2× CTAB方法[76].随后使用基因特异性引物和T-DNA引物进行PCR分析。引物位置如图所示。4,相应引物序列见附加文件1:表S6。测序时,PCR产物通过凝胶提取(Wizard®SV gel and PCR purge System, Promega, Madison, WI, USA)纯化,并通过俄亥俄大学基因组学设备(http://www.dna.ohio.edu/).的转录水平分析GALT1,GALT3,GALT4,GALT6,从WT和突变株2周龄幼苗中分离总RNA。对于组织特异性表达谱,根据Boyes等人的定义,在不同的生长阶段收集组织。[77].在这两种情况下,RNA提取使用Trizol (Life Technologies, Grand Island, NY, USA)和Direct-zol™RNA MiniPrep试剂盒(Zymo Research, Irvine, CA, USA)。使用oligo-dT (Coralville, Iowa)和GoScript逆转录酶(Promega, Madison, WI, USA)从2 μg总RNA中合成第一链cDNA。使用OneTaq DNA聚合酶(New England Biolabs, Ipswich, MA, USA)和基因特异性RT引物(附加文件)进行RT- pcr1:表S6)。扩增循环次数为28次,以评估和量化反应达到饱和前转录水平之间的差异。
对于定量实时PCR (qRT-PCR),使用Brilliant II SYBR Green qRT-PCR Master Mix with ROX(安捷伦科技,La Jolla, CA, USA)在MX3000P实时PCR仪(安捷伦科技)中扩增cdna。优化PCR反应,反应重复3次。基于泛素10 cDNA扩增标准转录水平(UBQ10,At4g05320)作参考。引物序列在附加文件中列出1:表S6。
异源表达GALT1,GALT3,GALT4,GALT6hyph - galt活性测定
编码区域GALT1 GALT3,而且GALT4来自RIKEN生物资源中心,而GALT6从法国植物基因组资源中心(http://cnrgv.toulouse.inra.fr/).使用Q5高保真DNA Taq聚合酶扩增n -末端6x-His标签融合基因构建物(New England Biolabs, Ipswich, MA, USA),最初克隆到pENTR/D-TOPO载体(Life technologies, Grand Island, NY, USA),最终使用LR克隆酶混合物克隆到目的载体pMDC32网关载体(Life technologies Grand Island, NY, USA)。用于扩增的引物列在附加文件中1:表S6。基因结构转化为农杆菌属在Luria-Bertani (LB)培养基中过夜培养。通过离心收集细菌细胞,并悬浮在含有10 mM MES, 10 mM MgCl的缓冲液中250 μM乙酰丁香酮(OD600= 0.2)。6周WT的叶子n .烟草简历。小哈瓦那被用于农杆菌属-介导的瞬时表达。浸润4天后,收获叶片,按照Liang等描述的方法制备微粒体。[45稍加修改。
荧光蛋白融合和亚细胞定位
完整的长度GALT3,GALT4,GALT6将无终止密码子克隆到pENTR/D-TOPO载体(Life technologies, Grand Island, NY, USA)并进行测序。所得到的质粒通过网关克隆策略在目的载体pEarlyGate 101中克隆,使用LR克隆酶混合物(Life Technologies Grand Island, NY, USA)生成YFP n端融合构建物。这些基因结构被转化成农杆菌属菌株GV3101除细菌浓度较低(OD600= 0.05)。的GALT3-YFP,GALT4-YFP,GALT6-YFP与ER标记HDEL-GFP或高尔基标记唾液酸转移酶(ST)-GFP共表达,以确定亚细胞定位。转化植株在正常生长条件下培养,浸润2天后使用直立型蔡司LSM 510 META激光扫描显微镜(德国耶拿),40 ×油浸镜头和氩激光成像。对于YFP结构物表达的成像,激发线为514 nm,发射数据采集在535-590 nm;而对于GFP结构,激发线为458 nm,发射数据收集在505-530 nm。
用瞬时表达的微粒体制剂测定GALTGalt1 galt3 galt4,而且GALT6烟草表皮细胞
按照Basu等人的描述进行标准GALT反应。[15]使用洗涤剂渗透微粒体从瞬时表达GALT1,GALT3,GALT4,GALT6.3个渗透的微粒体膜作为对照,一个来自WT烟草叶片,一个来自WT烟草叶片农杆菌属用空表达载体(pMDC32)转化的GV3101,以及用ST-GFP结构物渗透的烟叶作为阴性对照。
反相高效液相色谱法纯化hypa - galt反应产物
Liang等采用反相高效液相色谱法对GALT反应产物进行纯化[45].
GALT2-GALT6底物特异性的测定
烟草叶片微粒体组分表达GALT2-GALT6结构物用于测定底物特异性,描述如下[15,16].
富含高尔基体的植物微粒体膜的分离
从WT中提取植物微粒体膜,galt1-1,galt1-2,galt3-1,galt3-2,galt4-1,galt4-2,galt6-1而且galt6-2根据Liang等人。[45稍加修改。
AGPs的提取
从WT中提取agp,galt1-1,galt1-2,galt3-1,Galt3-2, galt4-1, galt4-2,而且galt6-2舒尔茨等人所描述的突变植物[78]如Gao等人所描述的那样沉淀和量化。[79和Yariv等人。[80].按照Youl等人的描述进行AGP分析[81作了修改。从8 g植物材料中提取AGPs,用β-Gal - Yariv试剂沉淀,用1 ml去离子水溶解,然后将100 μl滴入聚合反相色谱柱(prp - 1,5 μm, 4.1 × 150 mm;Hamilton)与缓冲液A(0.1%三氟乙酸)平衡。50 μg [AO]7作为对照,监测纯AGP肽的保留时间。样品以溶剂B(0.1%三氟乙酸,80%乙腈):0 - 30%溶剂B, 30分钟,30分钟,30 - 100%,流速为0.5 ml/min,按线性梯度洗脱。色谱在215和280 nm处进行吸收监测。
从角果、花、花序茎和衰老叶中提取agp,方法由Lamport [82],只做了一些小修改。为了从角果(2.5 g)、花(1.5 g)、花序茎(5g)和衰老叶(5g)中提取AGPs,将它们在液氮中研磨成细粉。将研磨组织添加到CaCl萃取缓冲液中2(2% w/v),每克组织的体积为2毫升,在室温下搅拌3小时。样品在室温下10,000 g离心30分钟。将上清冷冻干燥一夜,再悬于1毫升2%的氯化钙中2并转移到2毫升微量离心管中。AGPs在4℃下用等体积的β-Gal - Yariv试剂(2 mg/m, 2% w/v氯化钙)沉淀过夜2).不溶性β-Gal-Yariv - agp复合物在微量离心机中以10,000 g离心1小时收集。β-Gal-Yariv通过在2% (w/v)氯化钙中洗涤三次来去除2然后在甲醇中进行两次。将颗粒干燥后,用100 μl水和25 mg固体二亚硫酸钠溶液溶解,50℃孵育30 min至脱色。然后将得到的溶液在与水平衡的PD-10柱(Pharmacia)上脱盐,并将洗脱液冷冻干燥。
种子集评价
6周龄WT的成熟角果,galt1,galt3,galt4,而且galt6采集植物,测量角石长度和重量。对于种子数量,在分离前将角果在37°C的100%乙醇中孵育过夜脱色。对于互花授粉,WT的10朵花,galt4-1,galt42,galt6-1,而且galt6-2在第12阶段被选中。这些花在第13期用从花中获得的新鲜花粉授粉之前被阉割。10天后,从这些花中采集角果,以检测结实率。
根系生长测量
用于监测对β-Gal-Yariv试剂反应的根生长,WT,galt1-1,galt1-2,galt3-1,galt3-2,galt4-1,galt4-2, galt6-1而且galt6-2幼苗在MS板上生长7 d后转移到添加50 μM α-Gal-Yariv试剂或50 μM β-Gal-Yariv试剂的MS板上。对于盐环境下的幼苗生长,WT 7日龄幼苗galt1-1,galt1-2,galt3-1,Galt3-2, galt4-1, galt4-2,而且galt6-2转移到含有1%琼脂和100 mM或150 mM NaCl的MS培养基中。根的长度是通过低倍率(×10)的数字图像来确定的,这些图像是用CCD相机和免费的图像分析软件(ImageJ;http://rsb.info.nih.gov/ij/).为了分析突变植物的盐超敏性,使用根弯曲试验监测根系生长[83],图像使用尼康SMZ1500立体显微镜与CCD Infinity 2相机和分析软件进行拍摄。
离体花粉萌发试验
从WT采集的花朵,galt1-1, galt1-2,galt3-1,Galt3-2, galt4-1, galt4-2, galt6-1,galt6-2抽苔后1 ~ 2周的植株进行花粉管表型检测。如Boavida和McCormick所述,单个开放的花在离体中发芽[84],在固体萌发培养基上(0.01% H3.薄3., 1 mM MgSO4, 5毫米氯化钾,5毫米氯化钙2, 10%蔗糖,1.5%低熔点琼脂糖,pH 7.5, 30 μM β-Gal-Yariv试剂或30 μM α-Gal-Yariv试剂),22℃,100%湿度,暗处。花粉管发芽率用萌发管总数除以粒数计算。花粉管在尼康Phot-lab2显微镜下,结合SPOT RT彩色CCD相机和SPOT 4.2分析软件,在20倍放大倍率下成像和测量。
根毛形态异常
在琼脂板上生长的8天大植物的根毛长度是通过低倍率(×10)的数字图像确定的,这些图像是使用CCD相机和免费图像分析软件(ImageJ;http://rsb.info.nih.gov/ij/).为了保证结果的可比性,对根尖后3 - 5mm的区域进行了分析。在琼脂板上生长的植物,在显微镜载玻片上用100 μl的半强MS培养基小心去除,进行分析。每个基因型采用10株幼苗进行根毛长度和密度的量化,每个根测量25根根毛。
种子的细胞化学染色和粘附粘液大小和质量的测定
所有指示基因型的种子在水中预水化,用0.01%钌红染色。按照Willats和Knox的描述进行染色,[85]和Harpaz-Saad等人。[37].成像使用蔡司LSM 510共聚焦显微镜。使用Yu等人描述的方法测量粘附粘液的体积。[86].
亚历山大的花粉染色
为了检查花粉的活力,花药从花中取出,并安装在显微镜载玻片上,并用Alexander 's染色,如Alexander [87].
叶片衰老测定
第7叶标记为18 DAG(发芽后几天),从19 DAG开始取样,每隔一天继续采样,直到达到完全衰老(39 DAG),如Breeze等人所述。[88].由于叶片的年龄会影响其对影响衰老的因素的反应,因此从同步生长的种群中选取具有指示基因型的植物,并且仅收集相同年龄的叶片进行叶绿素和蛋白质含量的测量。
叶绿素含量测定
从WT中提取叶绿素,galt6-1,而且galt6-2将叶片浸泡在1ml N, N-二甲基甲酰胺中,在黑暗中4℃浸泡48小时。在664和647 nm处记录吸光度,并按照Xiao等人的描述计算总叶绿素浓度。[89].以每克鲜重为单位测定总叶绿素含量并归一化。
细胞壁制备
100毫克WT和高尔特突变体种子分别用0.2%草酸铵、0.2和2 N氢氧化钠在37℃剧烈震动1 h提取。两种氢氧化钠萃取物均用醋酸中和。总糖(μg/mg种子)采用基于Dubois等的苯酚-硫酸法测定。[90].将200 μl重悬提取物与100 μl现制5% (v/v)苯酚水溶液和1 ml浓硫酸在30℃下孵育2h。在500 nm处对0.5、2.5、5、7.5、10、15、25 μg葡萄糖标准品进行吸光度检测,得到线性响应曲线。
统计分析
对于每一项分析,突变体的酶活性和表型差异都与WT进行了单向方差分析比较。P值来自事后测试,使用Dunnett调整进行多重比较。使用Prism 6软件(GraphPad software, Inc.)进行统计分析。
支持数据的可用性
支持本文结果的数据集包含在本文及其附加文件中。本研究分析的基因接入数如下:GALT1: At1g26810;GALT2: At4g21060;GALT3: At3g06440;GALT4: At1g27120;GALT5: At1g74800;GALT6: At5g62620。
缩写
- AGP:
-
阿拉伯半乳聚糖-蛋白质
- CAZy:
-
碳水化合物活性酶数据库
- GT:
-
糖基转移酶
- HRGP:
-
hydroxyproline-rich糖蛋白
- 忧郁:
-
羟脯氨酸
- 忧郁,O高尔特:
-
羟脯氨酸,O半乳糖基转移酶
参考文献
王晓明,王晓明,王晓明,等。阿拉伯半乳聚糖蛋白在植物发育中的多重作用。植物物理学报2000;122:3-10。
肖文华,李志强,李志强,李志强。一种生物信息学方法鉴定,分类和分析富羟脯氨酸糖蛋白。植物学报,2010;
马红,赵娟。水稻阿拉伯半乳聚糖蛋白基因家族的全基因组鉴定、分类及表达分析。中国科学(d辑),2010;
王志强,王志强。阿拉伯半乳聚糖蛋白的生物学研究。植物生物学,2007;58:137-61。
Ellis M, Egelund J, Schultz CJ, Bacic A.阿拉伯半乳聚糖蛋白:细胞表面的关键调控因子?植物学报。2010;153:403-19。
谭亮,肖华,李志刚,王志刚,王志刚。植物细胞表面蛋白聚糖的研究进展。植物学报(自然科学版)2012;3:1-10。
谭玲,陈志强,陈志强,陈志强,等。拟南芥细胞壁蛋白聚糖由果胶和阿拉伯木聚糖共价连接到一个阿拉伯半乳聚糖蛋白组成。《植物科学》2013;25:270-87。
Pereira AM, Pereira LG, Coimbra S.阿拉伯半乳聚糖蛋白:越来越受到植物生物学家的关注。植物再生。2015;28:1-15。
恩古马-欧娜E, Coimbra S, Vicré-Gibouin M, Mollet JC, Driouich A.阿拉伯半乳聚糖蛋白在根和花粉管细胞中的分布和功能。安·波特。2012;110:383-404。
王晓明,张晓明,张晓明,等。拟南芥束链蛋白LIKE基因与脱落酸信号通路协同调控根系生长的研究。安·博。2014;114:1125-33。
Knoch E, Dilokpimol A, Geshi N.阿拉伯半乳聚糖蛋白:关注碳水化合物活性酶。植物科学进展(英文版);
吴云云,王志强,王志强,王志强,王志强。拟南芥α(1,2)聚焦转移酶的功能鉴定。中国生物化学杂志,2010;
梁勇,邓巴苏,许文林,马文涛,等。拟南芥中阿拉伯半乳糖蛋白集中修饰缺陷突变体fut4和fut6的生化和生理特征中国科学(d辑),2013;
Tryfona T, Theys TE, Wagner T, Stott K, Keegstra K, Dupree P. FUT4和FUT6 α-(1→2)-聚焦转移酶的特征表明,缺乏阿拉伯半乳聚糖聚焦转移酶会增加拟南芥根生长的盐敏感性。PLoS ONE。2014;9:Article ID e93291。
刘晓东,梁勇,刘晓东,刘晓东,张晓东,等。一种在拟南芥中合成阿拉伯半乳聚糖蛋白的羟脯氨酸- o -半乳糖基转移酶的功能鉴定。中国生物化学杂志,2013;
王伟,马淑娟,王志强,王志强,等。两种羟脯氨酸半乳糖基转移酶GALT5和GALT2在拟南芥阿拉伯半乳糖蛋白糖基化和生长发育中起作用。PLoS ONE。2015;10:Article ID e0125624。
小川大西,宋林。拟南芥中三种羟脯氨酸o -半乳糖转移酶的鉴定。植物学报(英文版);
曲杨,Egelund J, Gilson PR, Houghton F, Gleeson PA, Schultz CJ,等。一组新的拟南芥β-(1,3)-半乳糖转移酶的鉴定。植物分子生物学,2008;68:43-59。
葛西,刘志强,刘志强,等。半乳糖基转移酶作用于阿拉伯半乳糖蛋白聚糖对拟南芥胚胎发育至关重要。植物J. 2013; 76:128-37。
diokpimol A, Poulsen CP, Vereb G, Kaneko S, Schulz A, Geshi N.拟南芥生物合成II型阿拉伯半乳聚糖中的半乳糖转移酶:分子相互作用增强酶活性。BMC植物生物学。2014;14:90。
郭雄,李志强,李志强,等。拟南芥中参与II型阿拉伯半乳聚糖生物合成的β -葡萄糖醛酸基转移酶在幼苗生长过程中对细胞伸长有作用。植物学报,2013;
拟南芥葡萄糖苷转移酶GT14家族研究。植物信号学报。2014;9:e28891。
Gille S, Sharma V, Baidoo EEK, Keasling JD, Scheller HV, Pauly M.一种yariv可沉淀细胞壁聚合物的阿拉伯糖基化影响植物生长,例如拟南芥糖基转移酶突变体ray1.植物学报。2013;6:1369-72。
张志刚,张志刚,张志刚,张志刚,等。一种独特的β-1,3-半乳糖基转移酶是必不可少的生物合成N拟南芥中含有Lewis a结构的-聚糖。《植物科学》2007;19:2278-92。
Emanuelsson O, Brunak S, von Heijne G, Nielsen H.利用TargetP, SignalP和相关工具定位细胞中的蛋白质。Nat protocol . 2007; 2:953-71。
克罗A,拉尔森B,冯·海恩G,桑哈默尔EL。用隐马尔可夫模型预测跨膜蛋白拓扑结构。应用于完成基因组。中国生物医学杂志,2001;
李志强,李志强,李志强,等。利用疏水聚类分析(HCA)破译蛋白质序列信息:现状与展望。细胞生物学与生物工程学报,1997;
陈建平,陈建平。酿酒酵母甘露糖基转移酶复合物M-Pol I在甘露聚糖合成中具有不同的功能。生物化学学报,2002;
穆斯塔法维S,雷D,沃德-法利D,格鲁欧斯C,莫里斯QD。GeneMANIA:用于预测基因功能的实时多关联网络集成算法。中国生物工程学报。2008;9:S4。
齐默曼P,赫施-霍夫曼M,亨尼格L, Gruissem W. genresearcher。拟南芥微阵列数据库和分析工具箱。植物物理学报。2004;136:2621-32。
花粉-雌蕊相互作用中的肽信号。植物生理学报,2010;
张AY,吴慧敏。花粉管中极性细胞生长机制的结构和信号网络。植物学报。2008;59:547-72。
Suárez C, Zienkiewicz A, Castro AJ, Zienkiewicz K, Majewska-Sawka A, Rodríguez-García MI.橄榄(Olea europaea L.)雌蕊组织发育过程中果胶和阿拉伯半乳聚糖蛋白的细胞定位和水平:花粉-雌蕊相互作用的意义。足底。2013;237:305-19。
温特D,醋B,纳哈尔H,阿玛尔R,威尔逊GV,普罗瓦特NJ。一个“电子荧光象形文字”浏览器,用于探索和分析大规模生物数据集。PLoS ONE。2007;2:Article ID e718。
秦Y, Leydon AR, Manziello A, Pandey R, Mount D, Denic S,等。柱头和花柱的穿透在花粉管中引发了一种新的转录组,指出了在雌蕊中生长的关键基因。5:文章编号e1000621。
李志强,李志强,李志强,等。拟南芥种子发育过程中基因活性的全局分析及种子特异性转录因子的鉴定。中国自然科学学报(英文版),2010;
Harpaz-Saad S, McFarlane HE, Xu S, Divi UK, Forward B, Western TL,等。通过FEI2 RLK/SOS5途径和纤维素合成酶5合成纤维素是拟南芥种皮粘液结构所必需的。植物J. 2011; 68:941-53。
郭志刚,蔡文杰,王志强,王志强,等。盐过度敏感5介导拟南芥种皮黏液粘附和组织通过果胶。中国生物医学工程学报。2014;26(3):349 - 349。
Koornneef m测试突变体。拟南芥Inf Serv. 1981; 18:45-51。
王志刚,王志刚,王志刚。拟南芥种皮黏液细胞在植物细胞壁研究中的应用。植物学报。2010;5:796-801。
黄j, DeBowles D, Esfandiari E, Dean G, Carpita NC, haughw GW。拟南芥转录因子LUH/MUM1是种皮粘液挤出所必需的。植物科学进展。2011;
杨晓明,王晓明,王晓明,王晓明,等。植物糖基转移酶家族基因与酶的研究进展。见:植物多糖:生物合成与生物工程,编辑,Ulvskov P.牛津:Wiley-Blackwell;2011; 213 - 234。
Kieliszewski MJ, O 'Neill M, Leykam J, Orlando R.对富含羟脯氨酸的植物细胞壁糖蛋白糖肽的串联质谱和结构解析表明,相邻的羟脯氨酸残基是羟脯氨酸O-阿拉伯糖基化的主要位点。中国生物化学杂志,1995;
Kieliszewski MJ, Shpak E.用于阐明阿拉伯半乳糖蛋白和其他富羟脯氨酸糖蛋白糖基化编码的合成基因。中国生物医学工程学报,2001;
梁毅,Faik A, Kieliszewski M, Tan L,徐伟林,Showalter AM。烟草和拟南芥中参与阿拉伯半乳糖蛋白糖基化的半乳糖转移酶活性的鉴定和鉴定。植物科学学报。2010;54(4):344 - 344。
冈T,斋藤F,岛马Y,横尾T,野村Y,松冈K,等。内质网定位的udp - d -半乳糖的表征。羟基脯氨酸o -半乳糖转移酶在拟南芥中的合成肽底物。植物科学学报。2010;42(2):332 - 332。
加德纳M,克里斯皮尔MJ。高尔基体参与富羟脯氨酸细胞壁糖蛋白的合成和分泌。植物物理学报。1975;55:536-41。
黄志刚,张志刚,张志刚。胡萝卜根盘中含羟脯氨酸大分子的分泌动力学。植物细胞杂志1982;5:197-8。
Nikolovski N, Rubtsov D, Segura MP, Miles GP, Stevens TJ, Dunkley TP,等。LOPIT蛋白质组学揭示了糖基转移酶和其他植物高尔基体蛋白。植物科学进展。2012;
杨天伟,陈春春,林克良,孟楠,Schmidt W.拟南芥根毛密度与TRY和CPC1增强子位置信号通路表达的关系。PLoS ONE。2013; 8 (10): e75452。
张晓明,张晓明,张晓明,张晓明,等。拟南芥根毛形成过程中纤维素合成酶突变的研究进展。BMC植物生物学,2008;8:57。doi:10.1186 / 1471-2229-8-57.
Baumberger N, Doesseger B, Guyot R, Diet A, Parsons RL, Clark MA,等。在拟南芥和水稻中富含亮氨酸重复延伸蛋白的全基因组比较:细胞壁蛋白的一个保守家族形成了一个营养和生殖分支。植物科学学报,2003;
Marzec M, Szarejko I, Melzer M.阿拉伯半乳聚糖蛋白参与大麦根毛发育。中国科学(d辑),2015;
Velasquez SM, Ricardi MM, Dorosz JG, Fernandez PV, Nadra AD, Pol-Fachin L. o -糖基化细胞壁蛋白在根毛生长中至关重要。科学。2011;332:1401-3。
Velasquez SM, Ricardi MM, Poulsen CP, Oikawa A, Dilokpimol A, Halim A,等。脯氨酸-4-羟基化酶的复杂调控影响根毛扩张。植物学报。2015;8:734-46。
贾秋生,朱震,徐旭峰,岳林,张志林,张志平,等。拟南芥AT-hook蛋白TEK正向调控阿拉伯半乳聚糖蛋白的表达,从而形成nexine。植物学报。2015;8:51 - 60。
科英布拉S,科斯塔M,门德斯MA,佩雷拉AM,平托J,佩雷拉LG。阿拉伯半乳聚糖蛋白基因AGP6和AGP11双零突变体拟南芥花粉的早期萌发有性植物生殖。2010;23:199-205。
张AY,王浩,吴慧敏。一种花传递组织特异性糖蛋白吸引花粉管并刺激其生长。细胞。1995;82:383 - 93。
Levitin B, Richter D, Markovich I, Zik M. arabin半乳聚糖蛋白6和11是拟南芥雄蕊和花粉功能所必需的。植物J. 2008; 56:351-63。
Coimbra S, Costa M, Jones B, Mendes MA, Pereira L. G拟南芥agp6 agp11缺失突变体花粉粒发育受损。中国科学(d辑),2009;
Acosta-Garcia G, Vielle-Calzada JP。一种经典的阿拉伯半乳聚糖蛋白对拟南芥雌性配子体发生的启动至关重要。《植物科学》2004;16:14 - 28。
Acosta-Garcia G, Vielle-Calzada JP。一种经典的阿拉伯半乳聚糖蛋白对拟南芥雌性配子体发生的启动至关重要。《植物科学》2004;16:14 - 28。
莫罗C, Aksenov N, Lorenzo MG, Segerman B, Funk C, Nilsson P,等。用基因组方法研究杨树木质组织发育性细胞死亡。中国生物工程学报。2005;6:R34。
Schindler T, Bergfeld R, Schopfer P.玉米胚层中的阿拉伯半乳聚糖蛋白:与木质部分化期间细胞死亡的发育关系,但与延伸生长无关。足底。1995;183:139-42。
高MG,肖沃尔特AM。一种模块化阿拉伯半乳糖蛋白-1的免疫定位揭示了其在番茄中的发育调控表达。足底。2000;210:865 - 74。
Chaves I, Regalado AP, Chen M, Ricardo CP, Showalter AM。(β- d -半乳糖)诱导细胞程序性死亡3.Yariv试剂烟草BY-2悬浮培养细胞。物理学报。2002;116:548-53。
孙W, Kieliszewski MJ, Showalter AM。番茄legp -1阿拉伯半乳糖蛋白的过表达促进了番茄的横向分支,阻碍了生殖发育。植物J. 2004; 40:870-81。
Willats WGT, Knox JP。阿拉伯半乳糖蛋白在植物细胞扩张中的作用:来自β -葡萄糖Yariv试剂与植物幼苗相互作用研究的证据拟南芥.植物学报1996;9:19 19 - 25。
王志刚,王志刚,王志刚。阿拉伯半乳聚糖蛋白与花粉管生长的关系及其对花粉管生长的影响。原生质。2002;219:89 - 98。
王晓明,王晓明,王晓明,王晓明,等。拟南芥根皮层微管结构的研究进展。植物J. 2007; 52:240-51。
恩圭马-欧娜E,摩尔JP, Fagerström A,朱范杰,威拉斯WGT,雨果A,等。利用高通量技术分析烟叶主要细胞壁多糖。碳水化合物,2012;88:939-49。
徐世林,王志强,王志强。在拟南芥中,两种富含亮氨酸的重复受体激酶介导信号通路,连接细胞壁生物合成和ACC合成酶。《植物科学》2008;20:3065-79。
石浩,金勇,郭勇,史蒂文森B,朱继科。拟南芥SOS5位点编码一种假定的细胞表面粘附蛋白,是正常细胞扩张所必需的。植物细胞。2003;15:19-32。
Nielsen H, Brunak S, von Heijne G.预测信号肽和其他蛋白质分类信号的机器学习方法(综述)。中国科学(英文版),1999;12(3):344 - 344。
Breton C, Bettler E, Joziasse DH, Geremia RA, Imberty A.原核和真核半乳糖转移酶的序列功能关系。J生物化学(东京)。1998; 123:1000-9。
默里MG,汤普森WF。高分子量植物DNA的快速分离。核酸res 1980; 8:4321-5。
Boyes DC, Zayed AM, Ascenzi R, McCaskill AJ, Hoffman NE, Davis KR,等。基于生长阶段的拟南芥表型分析:植物高通量功能基因组学模型。植物学报,2001;13:1499-510。
李志强,李志强,李志强,等。拟南芥阿拉伯半乳聚糖蛋白基因家族的研究。植物学报,2000;12:1751-67。
高敏,Kieliszewski MJ, Lamport DT, Showalter AM。一种与legp -1基因相对应的新型模块化番茄阿拉伯半乳聚糖蛋白的分离、鉴定和免疫定位植物J. 1999; 18:43-55。
王志强,李志强,王志强,等。糖基苯偶氮染料沉淀阿拉伯酸和种子多糖的研究。生物化学学报。1967;
尤尔·杰,巴奇·A,奥克斯利·D.阿拉伯半乳糖蛋白烟草alata而且Pyrus普通的含有糖基磷脂酰肌醇膜锚。中国科学院学报(自然科学版),1998;19(2):366 - 366。
Lamport DTA, Várnai P.周质阿拉伯半乳聚糖糖蛋白作为调节植物生长发育的钙电容器。新植物,2013;197:58-64。
朱建坤,刘娟,熊玲。拟南芥耐盐性的遗传分析。钾营养的关键作用的证据。《植物科学》1998;10:1181-91。
温对拟南芥离体花粉萌发率的影响。植物J. 2007; 52:570-82。
Willats WGT, McCartney L, Knox JP。拟南芥种子黏液和根表面果胶多糖的原位分析。足底。2001;213:37-44。
于磊,史东,李娟,孔燕,于燕,柴刚,等。纤维素合成酶- like A2是一种葡甘露聚糖合成酶,参与维持拟南芥种子黏液的粘附结构。植物物理学报。2014;164:1842-56。
亚历山大议员。败育花粉和未败育花粉的鉴别染色。染色技术。1969;44:17 - 22。
布雷兹E,哈里森E, McHattie S,休斯L,希克曼R,希尔C,等。拟南芥叶片衰老过程中转录本的高分辨率时间分析揭示了一个独特的过程和调控年表。植物学报。2011;23:873-94。
肖松,戴丽丽,刘丰强,王志林,彭伟,谢晓东。COS1:一种拟南芥冠状廷不敏感抑制因子,对茉莉酸介导的植物衰老和防御至关重要。《植物科学》2004;16:1132-42。
Dubois M, gillik, Hamilton JK, Rebers PA, Smith F.糖及相关物质的比色测定方法。肛交化学,1956;28:350-6。
李娟,于敏,耿丽玲,赵娟。拟南芥小孢子发育与束素样阿拉伯半乳聚糖蛋白基因FLA3的研究。植物J. 2010; 64:482-97。
Johnson KL, Kibble NAJ, Bacic A, Schultz CJ。拟南芥簇素样arabin半乳糖蛋白FLA突变体,fla1,显示芽再生缺陷。PLoS ONE。2011; 6: e25154。
麦克米伦CP,曼斯菲尔德SD,斯塔彻斯基ZH,埃文斯R,南顿SG。束素样阿拉伯半乳聚糖蛋白:拟南芥和桉树茎生物力学和细胞壁结构的专门化。植物学报(英文版);
杨杰,Sardar HS, McGovern KR,张玉珍,Showalter AM。在拟南芥中富含赖氨酸的阿拉伯半乳聚糖蛋白是植物生长发育所必需的,包括细胞分裂和扩张。植物J. 2007; 49:629-40。
Gaspar YM, Nam J, Schultz CJ, Lee LY, Gilson PR, Gelvin SB,等。拟南芥富含赖氨酸的阿拉伯半乳糖蛋白的研究AtAGP17突变体(rat1),导致农杆菌转化效率降低。植物物理学报。2004;135:2162-71。
Demesa-Arévalo E, Vielle-Calzada JP。经典阿拉伯半乳聚糖蛋白AGP18介导拟南芥大孢子选择。《植物科学》2013;
van Hengel AJ, Roberts K.聚焦的阿拉伯半乳糖蛋白是拟南芥根细胞完全伸长所必需的。植物学报,2002;32:105-13。
致谢
我们感谢Jeff Thuma在共聚焦显微镜方面的技术支持。这项工作得到了国家科学基金会的资助。0918661)和俄亥俄大学贝克基金FN1006071。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
LT、SB、HH和AT辅助DB筛选纯合突变体并进行表型分析。WW克隆GALT4和GALT6进行亚细胞定位。AMS和DB构思了这项研究并撰写了手稿。所有作者都已阅读并批准了最终版本的手稿。
额外的文件
附加文件1:
6个补充表,14个补充图及其对应图例。表S1。GALT1,GALT3,GALT4,GALT6突变体和编码区域信息。表S2。MATCHER预测的GALT1-GALT6和HPGT1-HPGT3氨基酸序列与GT31家族氨基酸序列的同源性/相似性(http://mobyle.pasteur.fr/).表S3。候选AGP特异性糖基转移酶和拟南芥AGP共表达的名单GALT2而且GALT5作为查询基因使用基因CAT共表达工具。表S4。从烟草中瞬时表达的GALT1-GALT6获得hyph - galt活性的亚细胞分布。表S5。agp特异性糖基转移酶和agp及其各自突变表型的列表[15- - - - - -22,37,57,60,62,69,91- - - - - -97].表S6。本研究中使用的引物列表。图S1。预测GALT1-GALT6和HPGT1-HPGT3的跨膜区域。图S2。galt的疏水簇(HCA)分析显示DXD基序位于一个疏水氨基酸口袋中。图S3。hyph - galt活性的生化表征。图S4。基因表达谱Hyp-GALTs而且GALT1在不同的器官/组织中。图S5。转录水平Hyp-GALTs在发育中的种皮中http://seedgenenetwork.net/[36].图S6。烟草表皮细胞的单一浸润。分别用ST-GFP、HDELGFP和GALT2-YFP对烟叶进行浸润。尺寸棒= 10 μm。图S7。野生型和单一型AGPs的反相高效液相色谱图谱高尔特突变体。图S8。花粉活力、花粉萌发率和花粉管生长galt4而且galt6突变体。图S9。叶衰老的年龄依赖表型galt6-1而且galt6-2突变体植物。图S10。WT和的代表图像高尔特50 μM β -Gal-Yariv试剂处理根系。图S11。WT的代表图像,galt1,galt3,galt4,galt6在添加100 mM NaCl的MS板上培养14 d。图S12。的高尔特突变体对甘露醇胁迫不敏感。图向。条件根各向异性生长缺陷galt2-galt6突变体,galt2galt5与WT和相比,突变体为双突变体galt1植物。图S14系列。WT的根弯曲试验,galt1,galt3,galt4,galt6突变的幼苗。(PDF 2122kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
巴苏,D,田,L,王,W。et al。一个小的多基因羟脯氨酸-O-半乳糖基转移酶家族在拟南芥阿拉伯半乳糖蛋白糖基化、生长发育中的作用。BMC植物生物学15日,295(2015)。https://doi.org/10.1186/s12870-015-0670-7
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-015-0670-7
关键字
- 拟南芥
- Arabinogalactan-proteins
- AGP生物合成
- 半乳糖基转移酶
- O -糖基化
- 植物细胞壁
- 羟脯氨酸
- 半乳糖