- 研究文章
- 开放获取
- 发表:
JMJ704积极调节米防御反应黄oryzae pv。oryzae.感染通过减少与阴性疾病抗性调节剂相关的H3K4ME2 / 3
BMC植物生物学体积15, 文章编号:286(2015年)
摘要
背景
含Jumonji C(JMJC)域域的蛋白质是一组功能保守的组蛋白赖氨酸脱嘌呤脱甲基酶在真核生物中。增长的证据表明,JMJC在植物中表现出各种生物过程。然而,到目前为止,它们在植物生物应激中的作用,特别是在水稻细菌枯燥的抗性中。
结果
在本研究中,我们发现组蛋白3的多个赖氨酸位点的整体二甲基化和三甲基化水平在被白叶枯病病原体感染后发生了显著变化黄oryzae pv。oryzae.(XOO).XOO感染诱导15 JMJC的转录,表明这些JMJC涉及水稻细菌枯竭。JMJC突变体的进一步函数表征显示JMJ704是水稻细菌枯燥抗性的正调节剂JMJ704.变得更容易受到XOO比野生型。在JMJ704.,H3K4ME2 / 3水平显着增加;建议JMJ704可以参与H3K4ME2 / 3去甲基化。此外,JMJ704抑制了米防晒剂负调节剂基因的转录,例如NRR,Oswrky62和OS-11N3.,通过减少其上的激活标记H3K4me2/3。
结论
JMJ704可以是控制细菌枯燥途径的多种基因的通用开关。JMJ704通过表现母背部负面防御稳压器来积极调节米防御,提出与其同源际JMJ705不同的新机制,该机制也积极调节米防御但是通过激活积极防御调节。
背景
组蛋白甲基化是一种非常重要的翻译后修饰,在真核细胞中的基因转录和基因组稳定性中起重要作用1-3.].组蛋白H3在赖氨酸4,9,27,36位点(H3K4me1/me2/me3,H3K9me1/me2/me3,H3K27me1/me2/me3,H3K36me1/me2/me3)的单甲基化,二甲基化或三甲基化被认为与表观遗传基因调控有关[4.].一般来说,H3K4和H3K36甲基化与活性转录基因相关,而H3K9和H3K27甲基化具有转录抑制功能[4.那5.].组蛋白赖氨酸去甲基化酶(kdm)可逆转组蛋白赖氨酸甲基化[6.].kdm包含两种已知的进化保守类型:赖氨酸特异性去甲基酶1 (LSD1) [7.]和具有jumonji C (JmjC)结构域特征的组蛋白去甲基化酶[8.那9.].LSD1已被证明与H3K4的去甲基化有关[7.].在拟南芥, LSD1-like 1 (LDL1)、LSD1-like 2 (LDL2)和开花位点D (FLD)三个同源基因均抑制开花位点C (FLC.) 表达通过去甲基化单甲基化的H3K4 [10].FLD亦须用于系统性获得性耐药性[11那12].含有JmjC结构域的组蛋白去甲基化酶在酵母、动物和植物中通常是保守的[8.那13].JMJC蛋白优先通过亚铁离子和α-酮戊酸依赖性氧化反应除去组蛋白赖氨酸中的二甲基和三甲基化[8.].例如,JHDM1在人和酵母中特别地将H3K36ME2移除[8.),而拟南芥JMJ14、JMJ15和JMJ18是H3K4me2/me3去甲基酶[14-16].在水稻中,共有20个JMJC含域的蛋白质名为JMJ701-JMJ720 [17-20.].JMJ701-JMJ720基于JMJC域和整体蛋白质域架构分为五个不同的组,包括含JMJC域的组蛋白去甲基酶2(JHDM2),含有富有的JMJC蛋白的JMJC域2(JMJD2),JMJC蛋白质互动域(Jarid),JMJC域名和N终端FY-Rich_C-Terminal Fy-Rich(Fyrn_Fyrc)[18].
最近,新兴的证据表明,JMJCS参与水稻发育过程的各个方面并对应力的反应。在Fyrn_Fyrc集团,JMJ703.据报道为H3K4去甲基酶。这JMJ703.突变体表现出叶片矮化、直立、次生穗少、粒级小等多效表型。此外,JMJ703.可以通过将赖氨酸4的赖氨酸4位点抑制赖氨酸3的赖氨酸4位点,这是维持水稻基因组稳定性的主要机制[21那22].JMJ706是JMJD2组成员,被鉴定为H3K9去甲基酶,并参与了花卉发展的调节[18].最近,已经发现了JMJ705.,一种H3K27二甲基化和三甲基化去甲基化酶参与了植物对白叶枯病病原菌(BB)的防御反应(黄oryzae pv。oryzae, Xoo语) 感染。突变JMJ705.降低耐水稻Xoo语而过度的JMJ705.水稻对XOO.建议在病原体感染期间JMJ705去甲基酶活性受到茉莉酸甲基诱导的影响,并且诱导的JMJ705可以从标记的防御相关基因中除去H3K27ME3,并提高水稻疾病抵抗[23].有趣的是,JMJ705.不是植物免疫对病原体的唯一案例进行外膜遗传调控。以前的研究表明了拟南芥(拟南芥)组蛋白H3K36甲基转移酶设定结构域组8(SDG8)和H3K4甲基转移酶Trithorax1(ATX1)也在生物应力中起关键的作用。突变SDG8降低抗病性真菌病原体链格孢属brassicicola和Botrytis cinerea[24那25[下调耐药性的表达(R.)基因Pst DC3000[25那26].在atx1突变体对水杨酸(SA)的响应途径受到抑制,而乙烯(ET)/茉莉酸(JA)的响应途径受到抑制Pst DC3000感染(25那27那28].JMJ705、SDG8和ATX1的研究充分支持组蛋白去甲基化/甲基化参与植物对病原体的防御的假设。
水稻白叶枯病(BB)XOO侵染是水稻生产中最具破坏性的疾病之一,产量损失可达50% [29].虽然许多BB抗性基因,如Xa4那xa5, xa13和Xa21,已通过单基因导入或基因堆积等方法鉴定并应用于育种[30.,获得的耐药性可能很快就会消失,因为病原体进化得非常快,可以克服耐药性。因此,发现新的抗BB基因,特别是控制基因转录重编程的表观遗传基因,对水稻抗病育种具有重要意义。在这项工作中,我们检查了全球水平的各种组蛋白甲基化修饰XOO感染。这XOO感染诱导的表达模式表明JMJC脱甲基酶基因参与BB抗性。JMJ704的击倒,潜在的H3K4ME2 / 3去甲基酶,显着提高了植物易感性XOO与野生型相比。与此同时,一些水稻抗病的负调控大师,包括NRR,Oswrky62和OS-11N3.,被上调监管JMJ704.,表明JMJ704对水稻BB抗性具有正向调控作用通过在病原体感染期间表现出抑制负调节剂的转录。
结果
全局组蛋白赖氨酸甲基化动力学响应于XOO感染
虽然有一些例子表明,据报道,表明组蛋白甲基化介质介质植物疾病抗性,但全球组蛋白甲基化水平背后的动态响应于XOO感染仍不清楚。为了解决这个问题,我们研究了组蛋白在不同时间点的赖氨酸位点的二甲基化和三甲基化水平XOO感染。从4周龄的日本裸植株的叶片中分离出富含细胞核的蛋白质XOO在0、4、8、12、24和72 h,分别使用抗二甲基化和三甲基化H3K4、H3K9、H3K27和H3K36的抗体进行Western blot分析。以抗未修饰组蛋白H3的抗体作为负载对照。如图1所示。1,各种赖氨酸部位的全球甲基化水平随时间而变化XOO接种。对于组蛋白H3赖氨酸4,脱甲基化水平在4小时内保持不变(P.> 0.05),但在8 ~ 24 h时显著降低(P.< 0.05)。最低H3K4me2强度检测8 h。在这之后,信号强度逐渐返回到0.91 72 h的时间点,我们观察到H3K4me3强度显著增加在8 - 12 h,但减少到0.9和0.81分别在24和72 h,与0 h(相比P.< 0.05)。对于H3K9,二甲基化和三甲基化表现出相似的倾向。H3K9me2/3在12 h开始下降,24 h达到最低,72 h保持低水平(P.< 0.05),提示H3K9me2/3在晚期应答中起作用XOO感染。在组蛋白H3的赖氨酸部位27中,我们发现二甲基化水平在72小时下显着降低至0.68。有趣的是,H3K27ME3,H3K36ME2和H3K36ME3显示出非常相似的趋势,尽管它们在基因调节中的最终效果是不同的。三种修改达到8小时的最高水平,然后逐渐减少到24小时的最低水平(P.< 0.05)。以上结果表明,植物抗病是一个复杂的事件,多个组蛋白赖氨酸位点的甲基化都参与其中,而不同的组蛋白甲基化修饰在这一过程中可能发挥不同的作用。
这XOO稻米JMJC基因的感染诱导表达谱
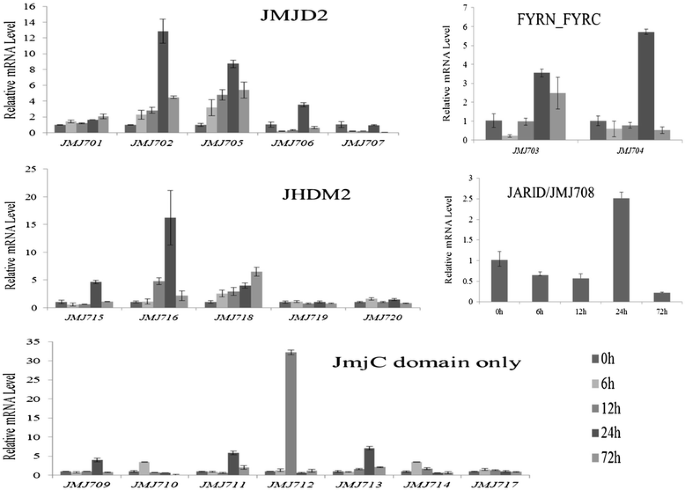
以前的研究揭示了水稻基因组中共20个JMJC基因(表1).在调查之前XOO感染诱导的表达谱,通过QRT-PCR检查了愈伤组织,根,叶,鞘,花和幼稚幼稚栽培种子的愈伤组织,根,叶,鞘,花和年轻/中/较老的培养种子中的组织特异性表达。如附加文件所示1:图S1,大多数JMJC基因组成型表达。然后,使用从四周龄野生型水稻CV Nipponbare植物的叶片分离的总RNA进行QRT-PCR进行XOO分别在0、6、12、24、72 hXOO感染时,四个基因的表达水平(JMJ701.那JMJ717那JMJ719和JMJ720)保持不变,而所有剩余的基因可以通过各种模式诱导XOO感染。如图1所示。2接种后24小时似乎是大多数JMJC基因的关键时间点XOO感染。11 JMJC基因的表达(JMJ702.那JMJ703.那JMJ704.那JMJ705.那JMJ706.那JMJ708.那JMJ709.那JMJ711.那JMJ713那JMJ715和JMJ716)表达上调,在24 h达到峰值。11个基因中,JMJ702,JMJ705和JMJ716对XOO在24小时,它们的表达水平上调了10倍以上JMJ705.与上一份报告一致[23].这JMJ710和JMJ714在6小时上调约3.5倍,表明它们在早期反应中的作用。为了JMJ712.,基因表达几乎保持在6小时的对照等水平。但是,在12小时内观察到非常急剧增加(32倍)。在此之后,JMJ712.回到了控制级别。与上调的JMJC基因相比,我们也发现了JMJ707.是由XOO感染。
混战的JMJ704.降低了耐水稻XOO感染
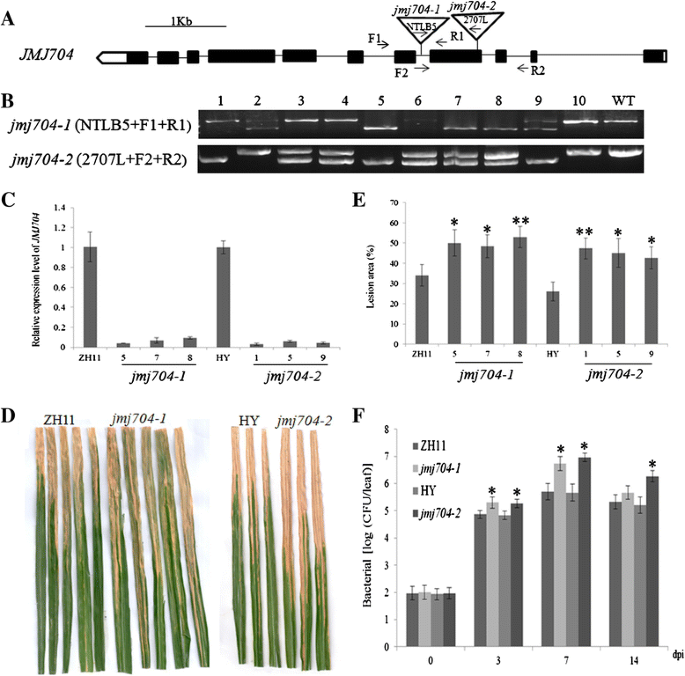
全局组蛋白的methyaltion动态结果和XOO目的研究JmjC基因在BB抗性中的作用。JmjCs的T-DNA插入突变系来源于RMD水稻突变体数据库(http://rmd.ncpgr.cn/)[31]和postech米突变数据库[32]XOO接种试验。在这些突变体中,JMJ704.当突变体表现出一种有趣的表型时,被进一步研究。两个等位基因JMJ704.突变体在这项研究中被命令和研究;jmj704-1来源于中华11 (ZH11)背景,在基因的第4内含子中插入了一个T-DNA,而jmj704-2在Hwayoung背景(HY)的第4个外显子中有T-DNA插入(图。3).通过使用基因特异性引物(F1 + R1,F2 + R2)与T-DNA左边界引物NTLB5和2707L一起使用引物组的PCR反应使我们能够容易地鉴定T-DNA纯合线(图。3 b).在mRNA水平上,qRT-PCR分析也证实了表达水平JMJ704.同时jmj704-1和jmj704-2显著被击倒(图。3 c).随后,XOO在每个等位基因突变体的3个后代线上对接种测定进行接种测定以及引导阶段的野生型对照。接种后十五天,显示了坏死区域,调查病变区域。有趣的是,两者都是JMJ704-1和JMJ704-2线条变得更容易受到影响XOO与野生型相比感染(图。3 d).野生型(ZH11和HY)叶片病变面积分别约为34%和26%。相比之下,在六种测试中,病变区域显著增加JMJ704.损伤区域的线条范围从43%到53%(P.< 0.05)(图3 e).我们也发现了XOO野生型的生长速度明显慢于JMJ704.线在3 DPI和7 DPI (P.< 0.05)(图3 f).几乎相同的表型jmj704-1和jmj704-2表明JMJ704对白叶枯病抗性的降低是由于其功能的丧失。同时,这些结果表明JMJ704.可能是对细菌枯萎病的正调控因子。
突变特征JMJ704..一种T-DNA插入突变的示意图jmj704-1和jmj704-2(打开三角形)。表示用于基因分型的引物的位置。B.基因分型jmj704-1和jmj704-2使用所示引物集分离和野生型(WT)。C中存在的检测JMJ704.记录在jmj704-1和jmj704-2行。D.叶片表型。引导舞台植物(jmj704-1/ ZH11和JMJ704-2 /接种HY)XOO分别通过剪切方法。接种后15天观察叶片表型。E.叶片病变面积(%)jmj704-1/ ZH11和JMJ704-2 /HY)与接种后的15天XOO.F细菌生长速率(Log [菌落/叶])在0(接种后2小时)和接种后3至14天的突变体中的3至14天测量(DPI)jmj704-1和jmj704-2分别与野生型ZH11和HY进行比较。条形图表示三个生物重复的SD值。野生型与突变型差异的显著性由Student值决定T.测试。*P.< 0.05那**P.< 0.01
H3K4的二甲基化和三甲基化水平增加JMJ704.
以往的研究表明,jmjc是去甲基酶,可以去除组蛋白3中各种赖氨酸位点的二甲基化和/或三甲基化。很明显,JMJ703参与了H3K4的去甲基化[21那22, JMJ705专门去甲基化H3K27me2/3 [23],而JMJ706是H3K9ME2 / ME3去甲基酶[18].然而,到目前为止,JMJ704的衬底仍然不确定。虽然会议摘要声称JMJ704可能是H3K4去甲基化酶,但没有正式出版,实验证据支持在公开上可用[19].指定JMJ704底物,ZH11的组蛋白蛋白和jmj704-1提取抗h3k4me2和抗h3k4me3进行免疫印迹。在无花果。4.,我们的免疫印迹结果清楚地显示H3K4me2和H3K4me3的整体甲基化水平增加了30%和60%jmj704-1分别 (P.< 0.05),当按H3抗体指示加载等量组蛋白进行分析时。鉴于报道的大多数JmjC成员都是功能保守的组蛋白去甲基化酶,我们的结果提示JMJ704可能是水稻中潜在的H3K4me2/3去甲基化酶,尽管这还需要我们在未来的研究中通过组蛋白去甲基化酶活性检测进一步证实。根据Lu et al.(2008)对JmjC基因的系统发育分析,JMJ703、JMJ704和拟南芥JMJ14,JMJ18属于相同的KDM5 / JARIDI类别[17].有趣的是,所有这些报告的KDM5 / JARIDI成员都是H3K4去甲基酶,表明该亚组的基材在植物物种中具有高度保守。
JMJ704.调节水稻BB防御相关基因的表达
评估效果JMJ704.水稻基因表达的突变,对ZH11和ZH11进行RNA-SEQ实验jmj704-1利用Illumina HiSeqTM 2500平台对萌发后两周的幼苗进行突变。共发现突变型与野生型差异表达基因446个,其中上调2倍以上的基因271个,下调175个JMJ704.(|日志2 |比率≥1;FDR <0.001)(附加文件2:表S1)。在这些差异表达基因中,有几个与植物防御相关。为例子,NRR(loc_os01g03940),OsWRKY62(LOC_Os09g25070)和OS-11N3.(LOC_Os11g31190)被报道为负调控因子XOO水稻抗性[33-35].在JMJ704.,这三个基因均显著上调,这与表型一致JMJ704.变得更容易受到BB。
基因本体论(GO)分析发现了8类富集基因。271个上调基因中有20个在“应激反应”类别中显著富集(p < 0.05);P.< 0.05)和D.own-regulated genes (54 of 175;P.< 0.05)(附加文件3.:表S2)。这些结果表明JMJ704.可能是应激反应基因表达的调节因子。此外,途径分析还发现,次级代谢物的代谢途径,植物 - 病原体相互作用和生物合成,优先参与次级代谢物(附加档案4.:图S2)。
为了验证RNA-SEQ数据,可以随机选择12个DEG用于QRT-PCR验证。如表所示2, qRT-PCR结果与RNA-seq实验显著相关(R.= 0.863,P.< 0.01)B.E.F要么E.XOO提示RNA-seq数据在本研究中是高度可靠的。此外,我们还检测了12个DEGs的mRNA丰度JMJ704.24 h afte的突变体和野生型r xoo感染。两种表达方式下的差异表达模式相似(上调或下调)XOO感染或正常生长条件,但程度可能因基因对基因而变化(表2)进一步证实,这些Degs受到调节的影响JMJ704..
H3K4me2/3上NRR那OsWRKY62和OS-11N3.增加在JMJ704.
为了研究JMJ704介导的H3K4ME2 / 3之间的关系和三个阴性防御调节剂的表达,我们检查了三种基因的H3K4ME2和H3K4ME3水平jmj704-1采用ChIP-PCR (Chromatin immunoprecipitation, followed by PCR)方法。利用ChIP和Input(免疫沉淀前染色质)DNA中各基因的丰度比来评估相应组蛋白修饰对基因的富集。正如我们所料,H3K4me2与NRR,Oswrky62和OS-11N3.被显着富集jmj704-1与ZH11相比(图。5.).例如,ChIP/Input的百分比OS-11N3.ZH11为0.086,jmj704-1,在突变体中富集4次。H3K4ME2富集其他两种基因jmj704-1范围从0.8到1.5。在H3K4me3 ChIP-PCR分析中也观察到类似的趋势(图)。5.).这一观察结果与我们的研究结果一致,即敲除JMJ704可使H3K4me2/3水平升高。另一方面,考虑到H3K4me2/3是激活标记,将H3K4me2/3升高NRR,Oswrky62和OS-11N3.也很好地解释了这三个基因在JMJ704.突变体.值得注意的是,该ChIP-PCR结果是在正常生长条件下的植物组织中获得的,基本上是在0 h后的阶段XOO感染,而H3K4ME2 / 3丰度NRR,Oswrky62和OS-11N3.在不同的时间点之后XOO感染仍然是未知的。研究H3K4me2/3基因在3个特异位点上的动态变化jmj704-1和ZH11的背景将对阐明其背后的机制有很大的兴趣JMJ704.突变体易感性XOO感染。
讨论
组蛋白修饰广泛参与植物抗病过程
最近,新兴证据表明,H3K4ME3,H3K9ME2,H3K9AC,H3K23AC,H3K27AC,H3K27ME3和H4Ac的组蛋白修饰可以是控制各种生物过程的重要机制。例如,当施加干旱胁迫时,发现组蛋白H3K18,H3K27和H4K5的乙酰化水平在水稻中被显着升高,而H3K9乙酰化水平保持不变[36].在该研究中,对组蛋白3上各种赖氨酸位点的全球甲基化水平的调查显示,在不同时间点之后明显改变了H3K4,H3K9,H3K27和H3K36的二 - 甲基化水平XOO说明组蛋白修饰在植物抗病中起着重要作用。事实上,之前的报道已经证明H3K4, H3K27和H3K36甲基化参与了在病原体攻击时的防御反应拟南芥和大米(23-28那37-39].组蛋白甲基转移酶SDG8的功能丧失降低了拟南芥抗坏死真菌病原体感染。证据还表明,SDG8参与JA / ET信令路径[24].组蛋白脱乙酰酶HDA19起到积极作用拟南芥通过抑制转录因子WRKY38和WRKY62对病原体的基础防御[40].同时,作为抗病抗性的主调节因子拟南芥,HDA19抑制SA生物合成和SA介导的防御,以防止在不必要的情况下对工厂过度反应,从而确保成功增长和发展[41].在水稻中,HDT701,组蛋白H4脱乙酰酶在植物防御中起着负面作用Magnaporthe oryzae和XOO.在水稻HDT701.过表达株的组蛋白H4乙酰化水平降低,植株对水稻病原菌的敏感性增强M. Oryzae.和XOO.进一步的证据表明HDT701物理结合并调节模式识别受体(PRR)和与防御相关基因的组蛋白H4乙酰化水平,例如MAPK6和WRKY53[42].
JMJC基因在水稻BB抗性中的作用
一个基因的应力诱导表达模式通常表明它在应力中的功能。在这项工作中,我们提供了20个JmjC去甲基化酶基因的表达谱XOO感染的大米。有趣的是,15个JmjC基因可以被诱导XOO强烈暗示他们可能参与植物防御响应BB。另一方面,已经清楚地清除了含JMJC域的去甲基酶优先除去通过铁离子的二甲基化和组蛋白的三甲基化[Fe [Fe [26和α-酮戊二酸依赖的氧化反应[]]8.].给出了JmjC基因诱导的表达谱和组蛋白甲基化过程的动态XOO因此,我们有理由推测jmccs介导的组蛋白修饰在水稻BB抗性中发挥重要作用。2013年,已有文献报道JMJ705.编码JmjC去甲基化酶调节水稻防御反应XOO通过去除JA诱导基因的组蛋白H3K27三甲基化,该基因很好地支持我们的猜测。在这项研究中,我们首次报告了这一点JMJ704.正向调节水稻的抗性XOO感染,如图所示XOO接种测定结果是多个JMJ704.线条表现出增加的易感性XOO比野生型更容易感染。此外,我们发现全球H3K4me2/3在JMJ704.与野生型相比增加,暗示JMJ704参与H3K4ME2 / 3去甲基化。即使JMJ704和JMJ705都在植物防御响应中发挥着同样的积极作用,其角色的基础是截然不同的。JMJ705通过去除它们的抑制改性H3K27ME3来激活阳性防御相关基因,这最终提高了植物阻力。然而,JMJ704通过在它们上减少激活标记H3K4ME2 / 3来抑制负调节因子基因的转录,但达到与JMJ705相同的目标。因此,JMJCS调节BB电阻通过一种双途径,包括阳性调节剂的上调以及负调节剂的下调。考虑到强者XOO我们认为,这些基因可能也参与了水稻抗BB的研究,这将在我们今后的研究中得到进一步的探索。同样值得注意的是,大多数XOO诱导诱导后24小时最大诱导诱导的JMJC,该阶段是植物疾病抗性中组蛋白修饰调节的关键时间点。
JMJ704.- 水稻中的细菌枯竭路径
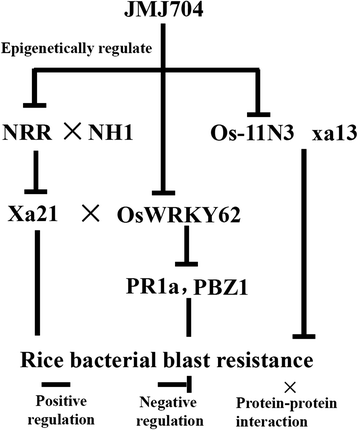
我们的RNA-seq实验鉴定了446个DEGsJMJ704.和ZH11,其中一些被称为与国防有关。KEGG途径分析发现,DEGs在植物-病原互作途径中优先发生,这支持了我们的结论,即JMJ704参与了BB抗性。特别是三股BB阻力调节器NRR,Oswrky62和OS-11N3.上调了JMJ704.行。进一步的ChIP-PCR分析表明,jmj704依赖性的H3K4me2/3基因显著富集NRR,Oswrky62和OS-11N3.在JMJ704.表明JMJ704可能在表观遗传上抑制了负防御调控因子的转录通过减少其活化修饰H3K4me2/3。NRR(负抗性调节剂)是一个上调的基因JMJ704..NRR可以与Rice NH1相互作用拟南芥NPR1,这是全身性获得性的关键稳压器。据报道,何时NRR组成型以表达,稻米降低了基础抗性,年龄相关的抗性以及Xa21-介导的抗性,最终导致对XOO[33].OsWRKY62,植物先天免疫的另一负调控因子,编码两种剪接变异(OSWRKY62.1.和OSWRKY62.2.).转基因植物过度表达OSWRKY62.1.在基础防御和基础上受到损害Xa21介导的抗XOO.此外,表达OSWRKY62.1.抑制防御相关基因的激活PR1a那Betv1那PR10和PBZ1[34].OsWRKY62可以阻止Xa21可能通过直接的蛋白质相互作用发挥作用。Park等(2012)的研究表明,在防御反应中,Xa21的胞内激酶结构域被裂解并移位到细胞核中,在细胞核中该结构域与OsWRKY62相互作用触发Xa21-介导免疫反应[43].OS-11N3.是水稻BB抗性隐性基因的密切同源物xa13。OS-11N3.和xa13可以由相同的TAL效应子AvrXa7或PthXo3诱导。据报道,对OS-11N3.导致植株失去对菌株的敏感性XOO依赖于AVRXA7或PTHXO3进行毒力。avrxa7驱动器表达式OS-11N3.和AVRXA7特异性地相互作用,并绑定在效应器绑定元件中OS-11N3.,支持TAL (transcription activator-like)效应结合特异性的预测模型[35].数字6.在本研究的基础上,提出了由JMJ704调控的BB响应途径。除了OS-11N3.途径,JMJ704协调其他两个关键基因Xa21提示JMJ704是一个通用开关,控制水稻抗病的多个位点。
结论
JMJ704通过表现母背部负面防御稳压器来积极调节米防御,提出与其同源际JMJ705不同的新机制,该机制也积极调节米防御但是通过激活积极防御调节。这些数据表明,通过组蛋白修饰完成的染色质重塑是植物生物胁迫反应的关键过程,组蛋白修饰酶是植物防御病原菌攻击的关键调控因子。另一方面,从DEGs中找出JMJ704的直接靶基因,对于阐明植物抗病调控网络具有重要意义。在我们不久的将来的工作中,像芯片测序这样的高通量技术将被用于这一目的。
方法
植物材料
水稻品种(奥雅萨苜蓿SPP japonica)Nipponbare,中华地区和Hwayoung在本研究中使用。T-DNA插入突变体jmj704-1(03 z11eq18)和jmj704-2(1C-14923)来自于RMD水稻突变体数据库(http://rmd.ncpgr.cn/)[31那44[分别[32].插入两个JMJ704.利用引物(F1+ R1+ NTLB5;F2 + R2 + 2707 L)(见附加文件5.:表S3)。所有的植物都是在中国水稻研究所的温室里种植的。对4周龄日本裸植株进行组织表达和胁迫分析。以孕穗期的T-DNA突变体ZH11和HY植株为材料XOO接种试验。
水稻细菌枯萎病
中国人XOO用浙173菌株进行接种试验。将4周龄和孕穗期植株接种浙173 (3 × 10)8./ml),在生长室(相对湿度90%,30/28°C,光照14 h /暗10 h循环)45].在接种后,在适当的时间内收获植物组织,并立即保持在液氮中直至使用。疾病被评分(每株植物3至5叶),作为接种后15天的病变区(病变长度/叶长度)百分比。通过计数成形单位作为前一项研究,还通过计算菌落形成单位分析ZHE173菌株的细菌生长速率[23].
RNA分离和定量RT-PCR(QRT-PCR)
使用Trizol (Invitrogen公司)按照厂家说明书分离各组织总RNA。用第一链cDNA合成试剂盒(Toyobo)逆转录总RNA 4微克。实时定量RT-PCR所用引物均列于附加文件中5.:表S3和泛素基因用作内部对照。在Lighycler 4.80实时PCR检测系统(Roche)上,在10微升的10微升(5μL雷伯鸟Sybr®QPCR混合[Toyobo],0.5μLCDNA,0.5μlprimers和4μLwater)中进行定量RT-PCR。通过评估阈值循环(CT)值来评估表达。测试基因的相对表达水平被标准化为遍在蛋白基因并通过2-计算ΔΔCT方法(46].实验采用技术重复三次。
组蛋白提取
使用如前所述的硫酸 - 提取方法从稻壳中萃取组蛋白富含蛋白质[47].简而言之,核从1g含有50mM Tris pH8.0,60mM KCl,5mM MgCl的缓冲液中分离1g米叶组织2,15 mm NaCl,1 mm Cacl2,0.25μm蔗糖,0.8%Triton X-100,2mM二硫醇(DTT)和2mM苯基甲基磺酰氟(PMSF)。然后,将分离物在6℃下培养2所以4.在4℃下为4-6小时,并在100%丙酮中沉淀过夜。最后,将粒料在丙酮中洗涤并重新悬浮在1×SDS加载缓冲液中。
免疫印迹分析
通过Western印迹分析了组蛋白的甲基化改性状态。将提取的组蛋白蛋白质在15%SDS-聚丙烯酰胺凝胶上溶解,然后使用电泳印迹系统(Bio-rad)转移到聚偏二氟乙烯含氟聚合物(PVDF)膜上。用5%(w / v)牛血清白蛋白封闭膜,然后与组蛋白H3(ab1791,abcam),h3k4me2(07-030,millipore),h3k4me3(07-473,millipore)孵育,H3K4ME3(07-473,Millipore)孵育,H3K9ME2(07-441,Millipore),H3K9ME3(07-442,Millipore),H3K27ME2(07-452,Millipore),H3K27ME3(07-449,Millipore),H3K36ME2(AB9049,ABCAM),H3K36ME3(AB9050,ABCAM)和然后是与辣根过氧化物酶(IH-0011,Dingguo)缀合的山羊抗兔IgG二级抗体。通过增强的化学燃烧(Pierce)方法检测膜上的抗体络合物。根据指令使用imagej软件进行免疫素线上的频带强度的量化(http://rsb.info.nih.gov/ij/docs/menus/analyze.html#gels.).首先将所有样本强度归一化到负荷对照组蛋白3,然后根据比值计算设定0 h的强度水平(图3)。1)或ZH11(图。4.)样品进入1。
RNA-seq分析
为了RNA-seq14日龄苗分析JMJ704.收获正常生长条件下的T-DNA突变体和野生型植物ZH11RNA-seq分析。根据制造商的指示(Invitrogen)使用Trizol提取RNA样品。通过使用Illumina Hiseq来构建的cDNA文库,如前所述和测序TM2500平台[48].通过SOAP对准器/ SOAP2软件分析样品之间的基因表达变化。用于分析RNA-seq数据,我们使用了Go :: Termfinder软件来查找不同的表达基因浓缩[49],选择P.< 0.05为显著GO项的截止值。
染色质免疫沉淀(ChIP)和ChIP- pcr
如前所述执行ChIP [50].简单地说,染色质从2 g的叶JMJ704.T-DNA突变体和野生型植物。在碎片超声处理后,DNA /蛋白质复合物免受针对H3K4ME2(07-030,Millipore)和H3K4ME3(07-473,Millipore)的碎片级抗体沉淀。在反向交联和蛋白酶K处理后,用苯酚/氯仿萃取免疫沉淀的DNA。使用基因特异性引物进行免疫沉淀和输入DNA用于定量PCR(附加文件5.:表S3)。定量PCR结果按照Magna ChIP™HiSens kit (Millipore)手册中报道的方法进行分析。所有的定量ChIP-PCR均在3个生物重复中进行。
可获得的支持数据
本文中描述的RNA-SEQ数据已被沉积到NCBI的GEO数据库(GSE74670)中。核酸序列数据可以在水稻基因组注释项目网站(http://rice.plantbiology.msu.edu/).登录号:JMJ704 (LOC_Os05g23670)、NRR (LOC_Os01g03940)、OsWRKY62 (LOC_Os09g25070)、Os-11N3 (LOC_Os11g31190)。
缩写
- XOO:
-
黄oryzaepv。oryzae.
- BB:
-
白叶枯病
- JmjC:
-
Jumonji C
- H3K4ME2 / 3:
-
组蛋白H3在赖氨酸4的二甲基化或三甲基化
- 主要决策者:
-
组蛋白赖氨酸demethylases
- JHDM2:
-
JMJC含域组蛋白脱甲基酶2
- JMJD2:
-
JMJC域的域2
- JARID:
-
JMJC蛋白质含有富有的相互作用域
- FYRN_FYRC:
-
n端富fy - _端富fy -
- 度:
-
差异表达基因
- 芯片:
-
染色质immuno-precipitation
参考文献
- 1.
伯杰sl。转录过程中染色质调控的复杂语言。自然。2007; 447(7143):407-12。
- 2.
王志强,王志强,王志强,等。植物基因组可及性的组蛋白修饰和动态调控。植物学报。2007;10(6):645-52。
- 3.
Margueron R,Trojer P,Reinberg D.开发的关键:解释组蛋白代码?CurrOpin Genet Dev。2005; 15(2):163-76。
- 4.
组蛋白赖氨酸甲基化的研究进展。细胞生物学杂志。2005;6(11):838-49。
- 5.
刘超,陆芳,崔旭,曹晓霞。高等植物组蛋白甲基化的研究进展。植物学报2010;61:395-420。
- 6.
Lan F,Nottke AC,Shi Y.参与组蛋白赖氨酸脱甲酶调节的机制。CurrOgin Cell Biol。2008; 20(3):316-25。
- 7.
Shi Y,LAN F,MATSON C,Mulligan P,Whetstine JR,COLE PA等。由核胺氧化酶同源物LSD1介导的组蛋白去甲基化。细胞。2004; 119(7):941-53。
- 8.
徐志强,方建平,王志强,等。组蛋白去甲基化由一个含JmjC结构域蛋白家族。大自然。2006;439(7078):811 - 6。
- 9.
关键词:蛋白质结构域,组蛋白,去甲基化[j] .地理科学进展。2006;7(9):715-27。
- 10。
姜东,杨伟,何颖,Amasino RM。人赖氨酸特异性去甲基化酶1亲缘拟南芥抑制FWA和开花位点C的表达,从而促进花的转变。植物细胞。2007;19(10):2975 - 87。
- 11.
等。拟南芥开花位点D是系统获得抗性的必需基因。植物生态学报。2013;26(9):1079-88。
- 12.
辛格v,roy s,singh d,nandi ak。拟南芥开花基因座D影响腕基因的全身性获得性抵抗诱导的表达和组蛋白修饰。j biosci。2014; 39(1):119-26。
- 13.
罗米,洪F-y,杨氏,刘X,吴酸组蛋白赖氨酸脱甲基酶及其在植物中的功能。植物MOL BIOL REP。2013; 32(2):558-65。
- 14.
关键词:拟南芥,JMJ14, H3K4去甲基化酶,开花时间细胞研究》2010;20(3):387 - 90。
- 15.
杨H,汉Z,Cao,风扇D,Li H,Mo H等。通过抑制FLC表达,伴随细胞 - 显性和发育调节的H3K4去甲基酶控制拟南芥中的开花时间。Plos Genet。2012; 8(4):E1002664。
- 16.
杨H,Mo H,风扇D,CaO Y,Cui S,MA L.组织H3K4去甲基酶的过表达,JMJ15加速了拟南芥的开花时间。植物细胞代表2012; 31(7):1297-308。
- 17.
关键词:拟南芥,组蛋白去甲基化酶,拟南芥,水稻植物生态学报。2008;50(7):886-96。
- 18.
孙强,周大东。水稻jmjC结构域基因JMJ706编码花器官发育所需的H3K9去甲基酶。中国科学(d辑:地球科学)2008;105(36):13679-84。
- 19.
周东,胡艳。组蛋白修饰对水稻基因表达和植物生长的调控作用。大米。2010;3:103-11。
- 20.
陈旭,胡勇,周大新。植物Jumonji组蛋白去甲基化酶的表观遗传调控。生物物理学报。2011;1809(8):421-6。
- 21.
Cui X,Jin P,Gu L,Lu Z,Xue Y,Wei L等。水稻中组蛋白H3K4脱甲基酶的转座子活性控制。Proc Natl Acad Sci U S A. 2013; 110(5):1953-8。
- 22.
陈强,陈旭,王强,张芳,娄智,张强,等。水稻茎伸长所需组蛋白H3赖氨酸4去甲基化酶的结构基础。公共科学图书馆麝猫。2013;9 (1):e1003239。
- 23.
李t,陈x,zhong x,zhao y,liu x,zhou s等。Jumonji C域蛋白JMJ705介导的组蛋白H3赖氨酸27三甲基化参与水稻中的防御相关基因活化。植物细胞。2013; 25(11):4725-36。
- 24.
沈文辉。拟南芥组蛋白甲基转移酶SET DOMAIN GROUP8介导植物对坏死营养真菌防御反应中茉莉酸/乙烯途径基因的诱导。植物杂志。2010;154(3):1403 - 14所示。
- 25.
沈文辉。染色质修饰和重塑:一个控制拟南芥防御反应对病原体攻击的调控景观。细胞Microbiol。2012;14(6):829 - 39。
- 26.
Palma K, Thorgrimsen S, Malinovsky FG, filil BK, Nielsen HB, Brodersen P, et al.;拟南芥acd11的自身免疫是由免疫受体的表观遗传调节介导的。公共科学图书馆Pathog。2010;6 (10):e1001137。
- 27.
刘志强,刘志强,刘志强,等。三胸拟南芥同源物,ATX1,结合磷脂酰肌醇5-磷酸,两者调节一组共同的靶基因。中国科学院院刊2006;103(15):6049-54。
- 28.
郭敏,王志刚,王志刚,王志刚。一种转录因子在两种拮抗途径横切面上的表观遗传控制。表观遗传学。2007;2(2):106 - 13所示。
- 29.
Verdier v,Vera Cruz C,Leach JE。控制非洲水稻细菌枯萎:需求和前景。j biotechnol。2012; 159(4):320-8。
- 30.
孙达伦,查特吉,李立华,等。水稻白叶枯病研究进展:第四届国际白叶枯病学术会议。大米。2014;7:12。
- 31。
张j,李c,吴c,xiong l,chen g,zhang q等。RMD:水稻基因组功能分析的水稻突变体数据库。核酸RES。2006; 34(数据库问题):D745-748。
- 32。
Jeon Js,Lee S,Jung Kh,Jun Sh,Jeong DH,Lee J等人。水稻功能基因组学的T-DNA插入诱变。工厂J. 2000; 22(6):561-70。
- 33。
Chern M,Canlas Pe,Fitzgerald HA,Ronald PC。米NRR,抗病症负调节剂,与拟南芥NPR1和水稻NH1相互作用。工厂J. 2005; 43(5):623-35。
- 34。
Peng Y,Bartley Le,Chen X,Dardick C,Chern M,Ruan R等人。Oswrky62是基础和XA21介导的防御Xanthomonas oryzae PV的负调节器。玉米酸盐。莫尔植物。2008; 1(3):446-58。
- 35.
Antony G,周J,Huang S,Li T,Liu B,White F等人。稻米XA13对细菌枯萎的隐性抗性被疾病易感性基因OS-11N3诱导击败。植物细胞。2010; 22(11):3864-76。
- 36.
方H,刘X,荆棘,段J,田L.干旱胁迫下水稻中组氨酸乙酰转移酶的表达分析。Biochem Biophys Res Communce。2014; 443(2):400-5。
- 37.
Mosher Ra,Durrant We,Wang D,Song J,Dong X.拟南芥SNI1的综合结构函数分析定义了基本区和转录压缩活性。植物细胞。2006; 18(7):1750-65。
- 38.
染色质修饰在植物胁迫反应中起着系统获得性抗性记忆的作用。EMBO众议员2011;12(1):50-5。
- 39.
拟南芥与假单胞菌的相互作用与表观遗传因子介导的疾病应答基因的调控。植物学报。2012;13(4):388-98。
- 40。
关键词:拟南芥,WRKY38, WRKY62,组蛋白去乙酰化酶,基础防御植物细胞。2008;20(9):2357 - 71。
- 41。
崔思敏,宋仁仁,韩世基,韩敏,金妍,朴杰,等。HDA19是抑制水杨酸生物合成和水杨酸介导的拟南芥防御反应所必需的。植物j . 2012; 71(1): 135 - 46所示。
- 42.
丁B,Bellizzi Mdel R,Ning Y,Meyers Bc,Wang GL。HDT701,一种组蛋白H4脱乙酰化酶,通过调节水稻中的外防相关基因的组蛋白H4乙酰化来负调节植物先天免疫。植物细胞。2012; 24(9):3783-94。
- 43.
朴CJ,罗纳德PC。水稻XA21免疫受体的卵裂和核定位。Nat Commun。2012;3:920。
- 44.
张军,郭东,常勇,尤晨,李旭,戴旭,等。通过分析13 804条T-DNA侧翼序列,发现T-DNA插入在基因组层次不同层次上的非随机分布。植物j . 2007; 49(5): 947 - 59。
- 45.
关键词:水稻,白叶枯病,抗白叶枯病基因,恢复系植物病理学。2002;92(7):750 - 4。
- 46.
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−Delta Delta C(T))方法分析相对基因表达数据。方法。2001;25(4):402 - 8。
- 47.
张旭,张晓东,张晓东,等。组蛋白H3赖氨酸9的二甲基化是拟南芥DNA甲基化和基因沉默的重要标志。Chromosoma。2004;112(6):308 - 15所示。
- 48.
Wang Z,Gerstein M,Snyder M.RNA-SEQ:转录组织的革命性工具。NAT Rev Genet。2009; 10(1):57-63。
- 49.
王志强,王志强,王志强,等。TermFinder——用于访问基因本体论信息和发现与基因列表相关的显著丰富的基因本体论术语的开源软件。生物信息学,2004;20(18):3710 - 5。
- 50。
张j,nallamilli br,Mujahid h,Peng z. Osmads6在胚乳营养积累中发挥着重要作用,并受到米饭(Oryza Sativa)的表观遗传调节。工厂J.2010; 64(4):604-17。
致谢
我们感谢Misissippi州立大学的Hana Mujahid博士,U.S.A.对稿件进行了批判性审查。这项工作得到了农业科学和技术创新计划,中国农业科学院到十世黄(水稻害虫管理研究小组)和建张(水稻生殖发展生物学集团),以及中国农业部的特殊转基因计划(2013ZX08010005)。
作者信息
从属关系
相应的作者
附加信息
利益争夺
作者声明没有竞争利益。
作者的贡献
HY、WLY、WL、LLM、LL、SL、RQ进行实验和数据分析,HS、ZJ构思项目,参与设计和协调,撰写稿件。所有的作者阅读并批准了最终的手稿。
附加文件
附加文件1:图S1。
JmjC基因在水稻组织特异性表达的qRT-PCR分析以泛素基因作为内对照,误差条表示3个技术重复的标准差。(TIF 7231 kb)
附加文件2:表S1。
差异表达的基因JMJ704.与野生型相比突变植物。(XLS 108 KB)
附加文件3:表S2。
中高、低表达基因的基因本体论分析JMJ704.用RNA-SEQ分析检测T-DNA突变体。(XLSX 10 KB)
附加文件4:图S2。
差异表达基因的统计途径富集分析JMJ704.和Zh11。基于Q值选择前20个富集的途径。(TIF 12146 KB)
附加文件5:表S3。
本研究中使用的引物的核苷酸序列。(XLSX 12 KB)
附加文件6:图S3。
显示芯片PCR测定的三种基因基因组区域的示意图。白盒表示未翻译的区域,黑匣子表示编码序列,通过盒子线表示基因的内含子区域,基因上方的线和数量表示用于芯片-PCR测定的区域和位置。(TIF 2795 KB)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
侯勇,王莉,王莉。等等。JMJ704积极调节米防御反应黄oryzae pv。oryzae.感染通过降低H3K4me2/3与阴性抗病调节相关。BMC植物杂志15,286(2015)。https://doi.org/10.1186/s12870-015-0674-3
已收到:
公认:
发表:
关键词
- 大米(奥雅萨苜蓿l .)
- 黄oryzae pv。oryzae.
- JMJC含域的去甲基酶
- 组蛋白修饰