- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
香叶基香叶基焦磷酸合成酶基因的鉴定及功能分析(gydF4y2BacrtEgydF4y2Ba)和植烯合酶基因(gydF4y2BacrtBgydF4y2Ba)用于类胡萝卜素的生物合成gydF4y2Ba眼虫属股薄肌gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba16gydF4y2Ba,文章号:gydF4y2Ba4gydF4y2Ba(gydF4y2Ba2016gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
眼虫属股薄肌gydF4y2Ba作为可再生能源生产的潜在原料,它引起了广泛的关注。在室外露天池塘种植生物燃料生产,过多的直接阳光可以抑制这种藻类的光合作用,降低其生产力。类胡萝卜素在光合作用期间的光收集中发挥重要作用,并为某些非光合生物和光合生物提供光保护,包括蓝藻、藻类和高等植物。虽然,白杨含有β-胡萝卜素和叶黄素(如玉米黄质,二黄质,二adinoxanthin和9 ' -)gydF4y2Ba独联体gydF4y2Ba新黄质),类胡萝卜素生物合成途径尚未阐明。gydF4y2Ba
结果gydF4y2Ba
阐明类胡萝卜素的生物合成途径gydF4y2Bae .股薄肌gydF4y2Ba,我们寻找假定的gydF4y2Bae .股薄肌gydF4y2Ba香叶基香叶基焦磷酸合成酶基因(gydF4y2BacrtEgydF4y2Ba)和植烯合酶基因(gydF4y2BacrtBgydF4y2Ba)通过tblastn搜索RNA-seq数据,获得他们的cdna。互补实验gydF4y2Ba大肠杆菌gydF4y2Ba具有类胡萝卜素生物合成基因的gydF4y2BaPantoea ananatisgydF4y2Ba显示,gydF4y2BaE. gracilis crtEgydF4y2Ba(gydF4y2BaEgcrtEgydF4y2Ba),gydF4y2BaEgcrtBgydF4y2Bacdna分别编码GGPP合成酶和植烯合成酶。系统发育分析表明,预测蛋白gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba分别属于藻类和高等植物的一组GGPP合成酶和植烯合成酶蛋白的分支。gydF4y2Ba
此外,我们还研究了光胁迫对基因表达的影响gydF4y2BacrtEgydF4y2Ba而且gydF4y2BacrtBgydF4y2Ba在gydF4y2Ba股薄肌。gydF4y2Ba460或920 μmol m的连续光照gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba在25°C时降低gydF4y2Bae .股薄肌gydF4y2Ba细胞浓度较对照光强(55 μmol m)分别提高28 ~ 40%和13 ~ 91%gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba).在920 μmol m连续光照下生长gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba,海藻细胞变成了红橙色,并显示出1.3倍的增加gydF4y2BacrtBgydF4y2Ba表达式。相比之下,gydF4y2BaEgcrtEgydF4y2Ba光胁迫处理对表达没有显著影响。gydF4y2Ba
结论gydF4y2Ba
我们鉴定了编码CrtE和CrtB的基因gydF4y2Bae .股薄肌gydF4y2Ba并发现他们的蛋白质产物催化了类胡萝卜素生物合成的早期步骤。此外,我们发现类胡萝卜素生物合成途径对光胁迫的响应gydF4y2Bae .股薄肌gydF4y2Ba至少在一定程度上,是由gydF4y2BacrtBgydF4y2Ba转录。这是第一个泛函分析gydF4y2BacrtEgydF4y2Ba而且gydF4y2BacrtBgydF4y2Ba在gydF4y2Ba眼虫gydF4y2Ba.gydF4y2Ba
背景gydF4y2Ba
眼虫属股薄肌gydF4y2Ba,是一种真核单细胞植物鞭毛藻,属一种次生植物[gydF4y2Ba1gydF4y2Ba]其中叶绿体携带叶绿素gydF4y2Ba一个gydF4y2Ba而且gydF4y2BabgydF4y2Ba和类胡萝卜素,与在绿藻和高等植物中观察到的相似[gydF4y2Ba2gydF4y2Ba].这种藻类作为可再生能源生产的潜在原料引起了广泛关注。在用于生物燃料生产的露天池塘养殖中,这种藻类的生产力取决于几个环境因素,如光强和温度。过多的阳光直射会抑制这种藻类的光合作用,降低其生产力。gydF4y2Ba
类胡萝卜素在光合作用和光合生物及某些非光合生物的光保护中起着重要作用。从各种生物中分离出750多种天然类胡萝卜素。类胡萝卜素由光养生物和非光养生物合成,包括细菌、古生菌、真菌、藻类和高等植物[gydF4y2Ba3.gydF4y2Ba].在光合作用途径中,类胡萝卜素和叶绿素都在叶绿体膜上构成光收获色素-蛋白质复合物。类胡萝卜素在类囊体膜的稳定中也起着重要作用[gydF4y2Ba4gydF4y2Ba],在光保护(即非光化学猝灭、叶黄素循环和清除活性氧)[gydF4y2Ba5gydF4y2Ba],以及在脱落酸的合成中[gydF4y2Ba6gydF4y2Ba]和独脚金内酯[gydF4y2Ba7gydF4y2Ba].gydF4y2Ba
类胡萝卜素分为两类,胡萝卜素(碳氢化合物)和叶黄素(胡萝卜素的含氧衍生物)。香叶酰焦磷酸(GGPP;CgydF4y2Ba20.gydF4y2Ba),胡萝卜素的前体,由焦磷酸法尼酯(CgydF4y2Ba15gydF4y2Ba)和焦磷酸异戊烯基(CgydF4y2Ba5gydF4y2Ba)由香叶酰香叶酰焦磷酸合成酶(CrtE,也称为GGPPS或GGPS)。然后是植烯(CgydF4y2Ba40gydF4y2Ba),第一个胡萝卜素,由两个GGPP分子经植烯合成酶(CrtB,也称为Psy或Pys)缩合而成。随后,ζ-胡萝卜素去饱和酶(CrtP,也称为Pds)、ζ-胡萝卜素去饱和酶(CrtQ,也称为Zds)和ζ-胡萝卜素去饱和酶催化的去饱和步骤和异构化转化为番茄红素gydF4y2Ba独联体gydF4y2Ba-胡萝卜素异构酶(CrtH,也称为CrtISO)。双环胡萝卜素,α-胡萝卜素和β-胡萝卜素及其氧合衍生物(叶黄素)由番茄红素合成[gydF4y2Ba3.gydF4y2Ba,gydF4y2Ba8gydF4y2Ba].gydF4y2Ba
综述了类胡萝卜素种类在蓝藻、红藻、褐藻和绿藻等藻类中的分布[gydF4y2Ba8gydF4y2Ba并根据类胡萝卜素化学结构的相似性,提出藻类与高等植物有几种共同的类胡萝卜素生物合成途径。与高等植物一样,其产物催化类胡萝卜素生物合成途径早期步骤的基因已在几种真核藻类中被功能鉴定,如gydF4y2BaPyropia umbilicalisgydF4y2Ba(gydF4y2BaggpgydF4y2Ba),gydF4y2Ba衣藻reinhardtiigydF4y2Ba(gydF4y2BacrtBgydF4y2Ba),gydF4y2BaHaematococcus pluvialisgydF4y2Ba(gydF4y2BapygydF4y2Ba),gydF4y2Ba小球藻zofingiensisgydF4y2Ba(gydF4y2Ba小组gydF4y2Ba而且gydF4y2BacrtPgydF4y2Ba)以及蓝藻细菌,如gydF4y2BaThermosynechococcus elongatusgydF4y2Ba(gydF4y2BacrtEgydF4y2Ba),gydF4y2BaGloeobacter violaceusgydF4y2Bapcc7421 (gydF4y2BacrtBgydF4y2Ba),gydF4y2Ba聚球藻属elongatusgydF4y2Bapcc7942 (gydF4y2BapygydF4y2Ba),gydF4y2Ba集胞藻属gydF4y2Bap.pcc6803 (gydF4y2BacrtQgydF4y2Ba而且gydF4y2BacrtHgydF4y2Ba) [gydF4y2Ba8gydF4y2Ba- - - - - -gydF4y2Ba10gydF4y2Ba].gydF4y2Ba
白杨含有β-胡萝卜素和叶黄素,如玉米黄质、二黄质、二adinooxanthin和9 ' -gydF4y2Ba独联体gydF4y2Baneoxanthin [gydF4y2Ba8gydF4y2Ba,gydF4y2Ba11gydF4y2Ba- - - - - -gydF4y2Ba13gydF4y2Ba],但该藻类合成类胡萝卜素的生物合成途径及相应基因尚未阐明。本研究旨在阐明类胡萝卜素的生物合成途径gydF4y2Bae .股薄肌gydF4y2Ba在Euglenida中,我们从一系列植物中寻找GGPP合成酶基因和phytoene合成酶基因的同源物gydF4y2Bae .股薄肌gydF4y2BacDNA序列(YoshidagydF4y2Ba等gydF4y2Ba.,未发表的观察)使用tblastn,我们确定gydF4y2BaE. gracilis crtEgydF4y2Ba(gydF4y2BaEgcrtEgydF4y2Ba),gydF4y2BaEgcrtBgydF4y2Ba分别编码GGPP合成酶和植烯合成酶。系统发育分析表明gydF4y2Bae .股薄肌gydF4y2BaCrtE和CrtB分别属于不同于藻类和高等植物的分支。此外,我们还研究了光胁迫对基因表达的影响gydF4y2BacrtEgydF4y2Ba而且gydF4y2BacrtBgydF4y2Ba在gydF4y2Bae .股薄肌gydF4y2Ba,揭示了类胡萝卜素的生物合成途径gydF4y2Bae .股薄肌gydF4y2Ba对过量光应激的反应水平gydF4y2BacrtBgydF4y2Ba转录。gydF4y2Ba
结果gydF4y2Ba
克隆gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba
我们执行BLAST (tblastn)搜索针对一系列gydF4y2Ba眼虫gydF4y2Ba全长cDNA序列(YoshidagydF4y2Ba等gydF4y2Ba.,未发表的观察)使用gydF4y2Ba甜椒gydF4y2BaGGPS [GenBank: CAA56554]和gydF4y2Bac .建立gydF4y2BaPSY1 [GenBank: CAA48155]作为查询。我们获得了GGPP合成酶基因的cDNA序列(gydF4y2BacrtEgydF4y2Ba)和植烯合酶基因(gydF4y2BacrtBgydF4y2Ba)gydF4y2Bae .股薄肌gydF4y2Ba.编码的cDNA序列gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba从RNA-seq数据中,每个序列都包含一个剪接前导(SL)序列5 ' -TTTTTTTTCG-3 ',这是一个被转移到mrna 5 '末端的特征序列gydF4y2Ba反式gydF4y2Ba拼接(gydF4y2Ba14gydF4y2Ba].在对应的cdna的5 '端存在SL序列gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba表明所获得的序列编码为全长cDNA。假设的cdnagydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba(附加文件gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba)是从gydF4y2Bae .股薄肌gydF4y2Ba用根据RNA-seq数据设计的引物进行RT-PCR检测。的序列gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2BacDNA分别提交给DDBJ,登录号分别为LC062706和LC062707。gydF4y2Ba
第一个ATG下游的SL序列gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2BacDNA被认为是各自mRNA的起始密码子。推导出的氨基酸序列gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba预测长度分别为402和406个氨基酸(图;gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba,和其他文件gydF4y2Ba1gydF4y2Ba而且gydF4y2Ba2gydF4y2Ba).中质体靶向蛋白的典型信号基序gydF4y2Bae .股薄肌gydF4y2Ba[gydF4y2Ba15gydF4y2Ba]在TMHMM程序的EgCrtE或EgCrtB中均未发现[gydF4y2Ba16gydF4y2Ba].此外,TargetP程序在EgCrtE和EgCrtB中没有预测到特征信号基序[gydF4y2Ba17gydF4y2Ba].gydF4y2Ba
推导的对齐gydF4y2Bae .股薄肌gydF4y2Ba已知GGPP合成酶的CrtE氨基酸序列。登录号为gydF4y2Ba拟南芥gydF4y2BaGGPPS1, [GenBank: NP_175376];GGPPS4 [GenBank: NP_179960];gydF4y2Ba甜椒gydF4y2BaGGPS, [GenBank: CAA56554]和gydF4y2BaThermosynechococcus elongatusgydF4y2BaBP-1 CrtE, [GenBank: NP_680811]。的GGPS序列数据gydF4y2BaPyropia umbilicalisgydF4y2Ba[gydF4y2BaP_umbilicalis_esContig5139gydF4y2Ba]是从gydF4y2Ba紫菜gydF4y2Ba爆炸(gydF4y2Ba58gydF4y2Ba].下划线序列分别表示第一个和第二个富含天门冬氨酸的基序FARM和SARM。盒装残基包括链长测定(CLD)区域。使用MEGA version 6.0的Clustal W进行多序列比对[gydF4y2Ba59gydF4y2Ba]gydF4y2Ba
推导的对齐gydF4y2Bae .股薄肌gydF4y2BaCrtB氨基酸序列与已知的植烯合酶。登录号为gydF4y2Ba甜椒gydF4y2BaPSY1, [GenBank: CAA48155];gydF4y2BaGloeobacter violaceusgydF4y2BaPCC 7421 CrtB [GenBank: BAC89685];gydF4y2Ba聚球藻属elongatusgydF4y2BaPCC 7942 PYS [GenBank: CAA45350];gydF4y2Ba集胞藻属gydF4y2Basp. PCC 6803 PYS [GenBank: CAA48922];gydF4y2Ba衣藻reinhardtiigydF4y2BaPSY [GenBank: XP_001701192];gydF4y2Ba小球藻zofingiensisgydF4y2BaPSY [GenBank: CBW37867]和gydF4y2BaHaematococcus pluvialisgydF4y2BaPYS [GenBank: AAY53806]。下划线序列表示两个富含天门冬氨酸的基序(DXXXD)。使用MEGA version 6.0的Clustal W进行多序列比对[gydF4y2Ba59gydF4y2Ba]gydF4y2Ba
在GGPP合成酶的系统发育树中(附加文件gydF4y2Ba3.gydF4y2Ba)的蛋白质编码gydF4y2BaEgcrtEgydF4y2Ba相对接近一个包括蓝藻和红藻的藻类分支。的氨基酸序列gydF4y2Bae .股薄肌gydF4y2BaCrtE与GGPP合成酶的同源性分别为46%和44%gydF4y2Bat . elongatusgydF4y2Ba而且gydF4y2Bap . umbilicalisgydF4y2Ba,对应序列相似度分别为59%和55%,与EMBOSS中的Needle对齐[gydF4y2Ba18gydF4y2Ba].EgCrtE含有典型的正菌和植物II型GGPPS中保守的富天门冬氨酸基序,即链长测定(chain-length determination, CLD)区域的第一个富天门冬氨酸基序(FARM: DDXXXD)和第二个富天门冬氨酸基序(SARM: DDXXD) [gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba(图。gydF4y2Ba1gydF4y2Ba).在系统发育树(附加文件gydF4y2Ba4gydF4y2Ba), EgCrtB与蓝藻(蓝藻)和绿藻(绿藻)的植烯合成酶分支不同。EgCrtB与植物素合成酶的氨基酸序列分别为38%、39%和40%gydF4y2Bah . pluvialisgydF4y2Ba,gydF4y2Bac . zofingiensisgydF4y2Ba,gydF4y2Bac . reinhardtiigydF4y2Ba,其序列相似度分别为52%、53%和56%,与EMBOSS中的Needle对齐[gydF4y2Ba18gydF4y2Ba].EgCrtB含有两个在植烯合酶中保守的富含天冬氨酸的基序(DXXXD) [gydF4y2Ba21gydF4y2Ba(图。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
功能分析gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba
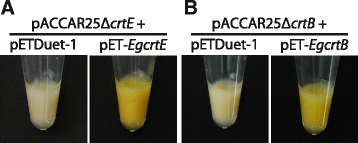
隔离功能gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba用颜色互补法对其cDNA进行分析gydF4y2Ba大肠杆菌gydF4y2Ba携带类胡萝卜素生物合成基因簇的gydF4y2BaPantoea ananatisgydF4y2Ba(原gydF4y2Ba欧文氏菌uredovoragydF4y2Ba) [gydF4y2Ba22gydF4y2Ba].gydF4y2Ba大肠杆菌gydF4y2BapET转化-gydF4y2BaEgcrtEgydF4y2Ba和pACCAR25ΔgydF4y2BacrtEgydF4y2Ba[gydF4y2Ba22gydF4y2Ba],其中载有gydF4y2Bap . ananatisgydF4y2Ba类胡萝卜素生物合成基因簇(gydF4y2BacrtBgydF4y2Ba,gydF4y2BacrtIgydF4y2Ba;八氢番茄红素desaturase,gydF4y2BacrtYgydF4y2Ba;番茄红素环化酶,gydF4y2BacrtZgydF4y2Ba;β-胡萝卜素羟化酶和gydF4y2BacrtXgydF4y2Ba;玉米黄质葡萄糖苷酶,但缺失gydF4y2BacrtEgydF4y2Ba),显示黄橙色色素的积累(图;gydF4y2Ba3gydF4y2Ba).相比之下,这种色素沉着没有观察到gydF4y2Ba大肠杆菌gydF4y2Ba携带pACCAR25ΔgydF4y2BacrtEgydF4y2Ba以及pETDuet-1(病媒控制)。同样的,函数gydF4y2BaEgcrtBgydF4y2Ba的分析gydF4y2Ba大肠杆菌gydF4y2Ba与pACCAR25ΔgydF4y2BacrtBgydF4y2Ba[gydF4y2Ba23gydF4y2Ba)携带gydF4y2BaP. ananatis crtEgydF4y2Ba,gydF4y2BacrtIgydF4y2Ba,gydF4y2BacrtYgydF4y2Ba,gydF4y2BacrtZgydF4y2Ba而且gydF4y2BacrtXgydF4y2Ba,但缺失gydF4y2BacrtB。大肠杆菌gydF4y2Ba与pET-共转化gydF4y2BaEgcrtBgydF4y2Ba和pACCAR25ΔgydF4y2BacrtBgydF4y2Ba呈黄橙色(图;gydF4y2Ba3 bgydF4y2Ba).这些结果表明,预测的蛋白质编码gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba分别具有GGPP合酶和植烯合酶活性。gydF4y2Ba
颜色互补实验gydF4y2Ba大肠杆菌gydF4y2Ba与gydF4y2Bap . ananatisgydF4y2Ba类胡萝卜素合成基因簇。gydF4y2Ba一个gydF4y2Ba大肠杆菌gydF4y2Ba携带pACCAR25ΔgydF4y2BacrtEgydF4y2Ba[gydF4y2Ba22gydF4y2Ba]使用pETDuet-1(病媒控制)或pET-gydF4y2BaEgcrtEgydF4y2Ba.gydF4y2BabgydF4y2Ba大肠杆菌gydF4y2Ba细胞携带pACCAR25ΔgydF4y2BacrtBgydF4y2Ba[gydF4y2Ba23gydF4y2Ba]使用pETDuet-1(病媒控制)或pET-gydF4y2BaEgcrtB。大肠杆菌gydF4y2Ba以菌株BL21(DE3)为宿主。数据至少代表了八种情况gydF4y2Ba大肠杆菌gydF4y2Ba结果相似的变革者gydF4y2Ba
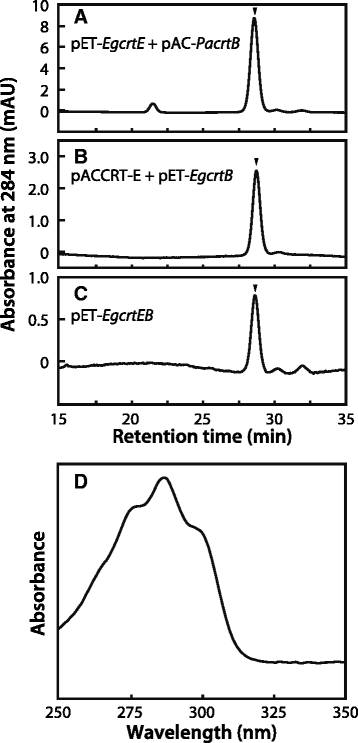
用高效液相色谱法(HPLC)研究了EgCrtE和EgCrtB在植物素生产中的作用。植物素在gydF4y2Ba大肠杆菌gydF4y2Ba窝藏gydF4y2BacrtEgydF4y2Ba的gydF4y2Bae .股薄肌gydF4y2Ba(pET -gydF4y2BaEgcrtEgydF4y2Ba),gydF4y2BacrtBgydF4y2Ba的gydF4y2Bap . ananatisgydF4y2Ba(pAC -gydF4y2BaPacrtBgydF4y2Ba),保留时间28.6 min(图;gydF4y2Ba4 dgydF4y2Ba).同样,植物素的产生也观察到gydF4y2Ba大肠杆菌gydF4y2Ba携带gydF4y2BacrtEgydF4y2Ba的gydF4y2Bap . ananatisgydF4y2Ba(pACCRT-E质粒[gydF4y2Ba23gydF4y2Ba])和gydF4y2BacrtBgydF4y2Ba的gydF4y2Bae .股薄肌gydF4y2Ba(pET -gydF4y2BaEgcrtBgydF4y2Ba)(图。gydF4y2Ba4 bgydF4y2Ba).此外,gydF4y2Ba大肠杆菌gydF4y2BapET转化-gydF4y2BaEgcrtEBgydF4y2Ba携带gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba合成的植烯(图;gydF4y2Ba4摄氏度gydF4y2Ba).相比之下,植物素未检测到gydF4y2Ba大肠杆菌gydF4y2Ba携带着gydF4y2BaEgcrtEgydF4y2Ba或gydF4y2BaEgcrtBgydF4y2Ba单独(附加文件gydF4y2Ba5gydF4y2BaA和B)。此外,植物素的产生没有观察到gydF4y2Ba大肠杆菌gydF4y2BapAC -gydF4y2BaPacrtBgydF4y2Ba或pACCRT-E与pETDuet-1(病媒控制)(附加文件gydF4y2Ba5gydF4y2BaC, D,综合起来,这些发现表明gydF4y2BacrtEgydF4y2Ba而且gydF4y2BacrtBgydF4y2Ba从gydF4y2Bae .股薄肌gydF4y2Ba分别为GGPP合成酶和植烯合成酶编码。gydF4y2Ba
植物烯生产分析gydF4y2Ba大肠杆菌gydF4y2Ba通过高效液相色谱法。高效液相色谱图(284 nm)gydF4y2Ba大肠杆菌gydF4y2Ba携带gydF4y2Ba一个gydF4y2Ba宠物,gydF4y2BaEgcrtEgydF4y2BapAC -gydF4y2BaPacrtBgydF4y2Ba,gydF4y2BabgydF4y2BapACCRT-E [gydF4y2Ba23gydF4y2Ba]用pET-gydF4y2BaEgcrtBgydF4y2Ba而且gydF4y2BacgydF4y2Ba宠物,gydF4y2BaEgcrtEBgydF4y2Ba.gydF4y2BadgydF4y2Ba在保留时间28.6 min时测定了植烯的吸光度谱gydF4y2Ba大肠杆菌gydF4y2Ba采用高效液相色谱法,按照Takaichi [gydF4y2Ba57gydF4y2Ba].色谱图中的箭头表示植物素洗脱的位置。数据代表三到四个实验,结果相似gydF4y2Ba
crtEgydF4y2Ba而且gydF4y2BacrtBgydF4y2Ba表达gydF4y2Bae .股薄肌gydF4y2Ba这是对轻微压力的反应gydF4y2Ba
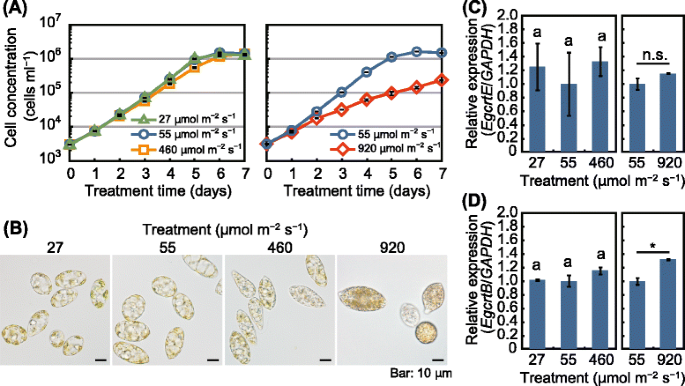
数字gydF4y2Ba5gydF4y2Ba的时间进程gydF4y2Bae .股薄肌gydF4y2Ba不同光强下细胞浓度的增长。当细胞在55 μmol m连续光照下生长时gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba(对照)培养7 d,细胞浓度由3 × 10增加gydF4y2Ba3.gydF4y2Ba细胞毫升gydF4y2Ba−1gydF4y2Ba到1.4−1.5 × 10gydF4y2Ba6gydF4y2Ba细胞毫升gydF4y2Ba−1gydF4y2Ba.照度为27 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba与对照组相比,在整个培养期间不影响细胞浓度。而在460和920 μmol m光照下,藻类的细胞浓度显著降低gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba(无花果。gydF4y2Ba5gydF4y2Ba).光强为460 μmol m的处理gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba显著(gydF4y2BaPgydF4y2Ba< 0.05)培养4、5、6 d后,细胞浓度分别为对照组的72、60、77%。照度为920 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba培养后1天将细胞浓度降低至对照的87%,细胞生长抑制程度呈时间依赖性增加。培养6 d后,细胞浓度为920 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba减少到9% (1.5 × 10gydF4y2Ba5gydF4y2Ba细胞毫升gydF4y2Ba−1gydF4y2Ba)。460和920 μmol m处理7 d后gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba时,细胞浓度达到1.4 × 10gydF4y2Ba6gydF4y2Ba细胞毫升gydF4y2Ba−1gydF4y2Ba(对照组的99%)和2.4 × 10gydF4y2Ba5gydF4y2Ba细胞毫升gydF4y2Ba−1gydF4y2Ba(对照组的16%)。gydF4y2Ba
光强对gydF4y2BacrtEgydF4y2Ba而且gydF4y2BacrtBgydF4y2Ba表达水平gydF4y2Bae .股薄肌gydF4y2Ba.gydF4y2Ba一个gydF4y2Ba细胞浓度的时间过程gydF4y2Bae .股薄肌gydF4y2Ba在27、55、460和920 μmol m连续光照条件下生长gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba25°C。gydF4y2BabgydF4y2Ba海藻细胞在指定的光胁迫下培养7天。gydF4y2BacgydF4y2Ba而且gydF4y2BadgydF4y2Ba表达水平gydF4y2BaEgcrtEgydF4y2Ba(gydF4y2BacgydF4y2Ba),gydF4y2BaEgcrtBgydF4y2Ba(gydF4y2BadgydF4y2Ba)在7天光胁迫处理的藻类细胞中。数据为平均值±SE (gydF4y2BangydF4y2Ba= 3)。数据至少代表两个具有相似结果的单独实验。用相同字母标记的酒吧没有显著差异(Tukey 's multiple range test,gydF4y2BaPgydF4y2Ba< 0.05)。N.s,不显著;*gydF4y2BaPgydF4y2Ba< 0.05,gydF4y2BatgydF4y2Ba以及gydF4y2Ba
在27 μmol m连续光照下,藻细胞的外观与对照组相比无显著差异gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba7天(图;gydF4y2Ba5 bgydF4y2Ba).对照组(55 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba),达到27 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba含有被认为是paramylon的半透明颗粒。在460 μmol m照射下,细胞中可见到半透明颗粒gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba细胞内也出现灰色颗粒(直径1-2 μm)。gydF4y2Ba5 bgydF4y2Ba).细胞在920 μmol m下发光gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba与460 μmol m照射的细胞相比,具有更多的灰色颗粒gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba.此外,在920 μmol m光照下生长gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba时,细胞看起来比对照组更红橙色。gydF4y2Ba
的表达式gydF4y2BacrtEgydF4y2Ba信使rna在gydF4y2Bae .股薄肌gydF4y2Ba当细胞在25°C连续光照下培养时,观察到的不同光强度对细胞无显著影响(图2)。gydF4y2Ba5度gydF4y2Ba).相比之下,的表达gydF4y2BacrtBgydF4y2Ba920 μmol m照射细胞gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba与对照组相比增加了1.3倍(图;gydF4y2Ba5 dgydF4y2Ba).这些结果表明,类胡萝卜素生物合成途径对光照胁迫的响应gydF4y2Bae .股薄肌gydF4y2Ba被控制,至少部分控制在gydF4y2BacrtBgydF4y2Ba转录。gydF4y2Ba
讨论gydF4y2Ba
的识别gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba
GGPSgydF4y2Bac .建立gydF4y2Ba[gydF4y2Ba24gydF4y2Ba]和大多数的GGPP合成酶家族蛋白gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba20.gydF4y2Ba定位于质体。高等植物有两条类异戊二烯生物合成途径,即质体1-脱氧-gydF4y2BadgydF4y2Ba-木酮糖5-磷酸/2- c -甲基赤藓糖醇4-磷酸(DOXP/MEP)途径和胞质醋酸酯/甲羟戊酸(MVA)途径[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].绿藻(绿藻)在进化过程中失去了MVA通路,因此这些藻类完全依赖DOXP/MEP通路[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba].高等植物和藻类依赖于源自DOXP/MEP途径的异戊烯焦磷酸盐进行GGPP的生物合成,并随后在质体中合成类胡萝卜素[gydF4y2Ba25gydF4y2Ba].gydF4y2Ba眼虫gydF4y2Ba是例外的,因为它缺乏DOXP/MEP途径,并通过MVA途径合成类异戊二烯[gydF4y2Ba26gydF4y2Ba,gydF4y2Ba27gydF4y2Ba].这与TMHMM预测的EgCrtE在细胞质中的定位一致[gydF4y2Ba16gydF4y2Ba]和TargetP [gydF4y2Ba17gydF4y2Ba].gydF4y2Ba
植物素合成酶定位于质体gydF4y2Ba答:芥gydF4y2Ba,gydF4y2Ba栽培稻gydF4y2Ba,gydF4y2Ba玉米gydF4y2Ba[gydF4y2Ba21gydF4y2Ba].然而,在本研究中,TMHMM和TargetP都没有预测EgCrtB n端区域的一个典型质体转运肽,尽管很难准确预测EgCrtB的质体靶向蛋白gydF4y2Bae .股薄肌gydF4y2Ba因为输送蛋白质的系统gydF4y2Ba眼虫gydF4y2Ba的质体,由三层膜包围[gydF4y2Ba1gydF4y2Ba],与高等植物不同[gydF4y2Ba28gydF4y2Ba].gydF4y2Ba
大多数鞭毛绿藻已经发展出一种光敏系统,即眼斑装置,由叶绿体内富含类胡萝卜素的脂球组成[gydF4y2Ba29gydF4y2Ba].蛋白质组学研究表明,一些β-胡萝卜素生物合成酶定位于眼睛器官gydF4y2Bac . reinhardtiigydF4y2Ba[gydF4y2Ba30.gydF4y2Ba]和β-胡萝卜素中gydF4y2Ba杜氏盐藻bardawilgydF4y2Ba[gydF4y2Ba31gydF4y2Ba],这表明β-胡萝卜素的部分合成发生在眼点小球中。gydF4y2Bae .股薄肌gydF4y2Ba还具有含有类胡萝卜素的眼点器官(柱头)[gydF4y2Ba32gydF4y2Ba],虽然这种藻类的柱头位于主鞭毛基部附近的细胞质中[gydF4y2Ba33gydF4y2Ba].此外,Kivic和Vesk [gydF4y2Ba33gydF4y2Ba]报道了这种藻类的柱头被一层膜包围,与叶绿体在结构上没有相似性。这表明EgCrtB可能被运输到柱头和质体,并且EgCrtB可能包含一个尚未识别的信号序列。gydF4y2Ba
虽然叶绿体在gydF4y2Bae .股薄肌gydF4y2Ba含有叶绿素gydF4y2Ba一个gydF4y2Ba而且gydF4y2BabgydF4y2Ba[gydF4y2Ba2gydF4y2Ba],在系统发育树中,EgCrtB属于一个与绿藻(绿藻)和高等植物(植物)不同的分支(附加文件)gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba).这一结果与分类学关系一致。gydF4y2Bae .股薄肌gydF4y2Ba属于挖掘机超群内的Euglenida [gydF4y2Ba34gydF4y2Ba].欧氏菌是一种原始生物,它与欧氏菌有共同的祖先gydF4y2Ba锥虫属gydF4y2Basp. (kinetoplasstea) [gydF4y2Ba34gydF4y2Ba- - - - - -gydF4y2Ba36gydF4y2Ba].从进化上看,裸齿纲动物包括裸齿纲和着丝纲被认为较早地从其他携带绿藻的真核生物中分枝而来[gydF4y2Ba37gydF4y2Ba,gydF4y2Ba38gydF4y2Ba].GGPP合酶和植烯合酶蛋白在各种光自养生物中的系统发育关系(附加文件)gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba)可能反映了独特的进化史gydF4y2Bae .股薄肌gydF4y2Ba.gydF4y2Ba
crtEgydF4y2Ba而且gydF4y2BacrtBgydF4y2Ba表达gydF4y2Bae .股薄肌gydF4y2Ba这是对轻微压力的反应gydF4y2Ba
斯坦布伦纳和林登[gydF4y2Ba39gydF4y2Ba的最高增长率gydF4y2Bah . pluvialisgydF4y2Ba在50-150 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba,光照250 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba减少单元格数量。同样,WahidingydF4y2Ba等gydF4y2Ba.[gydF4y2Ba40gydF4y2Ba的细胞浓度gydF4y2BaNannochloropsisgydF4y2Ba在200 μmol m光照下sp值降低gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba.在我们的初步实验中,光照为240 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba与对照组相比,在整个培养期间对细胞浓度没有显著影响(数据未显示)。照明强度为~460 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba被认为是一个阈值的过量光应力gydF4y2Bae .股薄肌gydF4y2Ba生长在25°C的连续光照下,这种水平的光照可能开始对这种藻类的光合作用造成光抑制。460 μmol m光照导致细胞生长延迟gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba在早期固定期(培养后6天)略有缓解,到培养结束时,藻类细胞数量与对照组一样增加(图2)。gydF4y2Ba5gydF4y2Ba).这一结果可能是由于细胞中积累的灰色颗粒的阴影效应(图2)。gydF4y2Ba5 bgydF4y2Ba).gydF4y2Ba
在920 μmol m连续光照下生长gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba时,藻细胞变为红橙色(图;gydF4y2Ba5 bgydF4y2Ba).这一结果与先前的研究一致,表明光胁迫诱导类胡萝卜素在某些绿藻中积累,如gydF4y2Ba杜氏gydF4y2Ba[gydF4y2Ba41gydF4y2Ba),gydF4y2Bah . pluvialisgydF4y2Ba[gydF4y2Ba42gydF4y2Ba),而gydF4y2Bac . zofingiensisgydF4y2Ba[gydF4y2Ba43gydF4y2Ba].KrolgydF4y2Ba等gydF4y2Ba.[gydF4y2Ba41gydF4y2Ba]报告了2500 μmol m时的过量辐照度gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba诱导类胡萝卜素在gydF4y2Bad .盐水湖gydF4y2Ba细胞。王gydF4y2Ba等gydF4y2Ba.[gydF4y2Ba44gydF4y2Ba的辐射gydF4y2Bah . pluvialisgydF4y2Ba在350 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba诱导类胡萝卜素含量增加,积累虾青素的红细胞对极高的辐照度(3000 μmol m)的抗性增强gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)而不是绿色细胞。gydF4y2Ba
在高等植物中,类胡萝卜素生物合成的调控主要是在幼苗去黄化和伴随的类胡萝卜素生物合成爆发的背景下进行研究的。LintiggydF4y2Ba等gydF4y2Ba.[gydF4y2Ba45gydF4y2Ba]报道了GGPP合成酶基因(gydF4y2BaggpgydF4y2Ba)gydF4y2BaSinapsis阿尔巴gydF4y2Ba在去黄化过程中,幼苗保持不变。这份报告与我们的数据是一致的gydF4y2BaEgcrtEgydF4y2Ba在光胁迫处理下,表达保持相对稳定(图2)。gydF4y2Ba5度gydF4y2Ba).高等植物MEP途径中类异戊二烯的通量主要受DOXP合成酶控制[gydF4y2Ba46gydF4y2Ba], DOXP还原异构酶[gydF4y2Ba47gydF4y2Ba],以及羟甲基二磷酸丁烯基还原酶[gydF4y2Ba48gydF4y2Ba].这三种速率决定酶上调和控制代谢通量到类胡萝卜素途径在去黄化gydF4y2Ba答:芥gydF4y2Ba[gydF4y2Ba49gydF4y2Ba].基因的光诱导gydF4y2BadxgydF4y2Ba中也报道了编码DOXP合成酶gydF4y2BaPhaeodactylum tricornutumgydF4y2Ba(硅藻)在暗光转换中的[gydF4y2Ba50gydF4y2Ba].gydF4y2Ba
相比之下gydF4y2BacrtEgydF4y2Ba,gydF4y2BacrtBgydF4y2Ba表达gydF4y2Bae .股薄肌gydF4y2Ba对强光照(920 μmol m)的响应增加了1.3倍gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba;无花果。gydF4y2Ba5 dgydF4y2Ba).这一结果与以往对光调控类胡萝卜素生物合成基因的研究一致。例如,植物素合成酶基因(gydF4y2Ba小组gydF4y2Ba)gydF4y2Ba答:芥gydF4y2Ba在幼苗去黄化过程中上调,导致类胡萝卜素的积累[gydF4y2Ba48gydF4y2Ba,gydF4y2Ba49gydF4y2Ba,gydF4y2Ba51gydF4y2Ba].Rodriguez-VillalongydF4y2Ba等gydF4y2Ba.[gydF4y2Ba49gydF4y2Ba]报道,PSY是增加黄化苗类胡萝卜素合成的关键驱动因素gydF4y2Ba答:芥gydF4y2Ba通过控制类胡萝卜素生物合成途径的代谢通量。在藻类中也观察到光诱导植烯合酶基因。鲍恩和林登[gydF4y2Ba52gydF4y2Ba报告说gydF4y2Bac . reinhardtiigydF4y2Ba的快速上调gydF4y2BacrtBgydF4y2Ba在暗光转换后的1-2小时内达到最大值。斯坦布伦纳和林登[gydF4y2Ba42gydF4y2Ba]报道了连续高强度光(125 μmol m .gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)导致…的轻微增加gydF4y2BapygydF4y2Ba表达量其次为虾青素的适量积累gydF4y2Bah . pluvialisgydF4y2Ba.这与我们的发现相一致,类胡萝卜素的生物合成途径gydF4y2Bae .股薄肌gydF4y2Ba在轻度应激下,部分控制在转录水平gydF4y2BaEgcrtBgydF4y2Ba类异戊二烯代谢中类胡萝卜素、叶绿素、生育酚、质体醌和赤霉素生物合成分支点的下游[gydF4y2Ba19gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
我们从功能上鉴定了GGPP合成酶基因(gydF4y2BaEgcrtEgydF4y2Ba)和植烯合酶基因(gydF4y2BaEgcrtBgydF4y2Ba),其催化类胡萝卜素生物合成途径的早期步骤gydF4y2Bae .股薄肌gydF4y2Ba在超群中。GGPP合成酶和植烯合成酶蛋白的系统发育分析表明,EgCrtE和EgCrtB分别属于不同于藻类和高等植物类群的进化支,与分类学结果一致。此外,我们还发现了类胡萝卜素的生物合成途径gydF4y2Bae .股薄肌gydF4y2Ba对过量光应激的反应水平gydF4y2BaEgcrtBgydF4y2Ba表达式。据我们所知,这是关于功能分析的第一份报告gydF4y2BacrtEgydF4y2Ba而且gydF4y2BacrtBgydF4y2Ba在gydF4y2Ba眼虫gydF4y2Ba.gydF4y2Ba
方法gydF4y2Ba
生物材料gydF4y2Ba
眼虫属股薄肌gydF4y2BaKlebs(菌株Z)在100ml Cramer-Myers培养基中培养[gydF4y2Ba53gydF4y2Ba]含有0.1%乙醇,细胞初始浓度为3.0 × 10gydF4y2Ba3.gydF4y2Ba细胞毫升gydF4y2Ba−1gydF4y2Ba在一个300毫升的锥形烧瓶中。藻类细胞在培养箱(LH-350SP, NK系统)中搅拌(90 rpm),并用荧光灯(FL20S EX-N-HG和FL40S EX-N-HG, NEC照明)照射。克隆gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba时,海藻细胞在25℃、55 μmol m持续光照下生长gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba7天。的表达水平分析gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba基因gydF4y2Bae .股薄肌gydF4y2Ba光照条件下,25°C, 27、55(对照)、460和920 μmol m连续光照条件下培养藻类细胞gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba7天。在460 μmol m和920 μmol m的光照下gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba,白色LED灯(LLM0175A, Stanley Electric)与荧光灯组合使用。每天在显微镜下用浮游生物计数器(MPC-200, Matsunami Glass Ind.)计数测量细胞浓度。培养7天后,用离心分离法(1000 ×gydF4y2BaggydF4y2Ba, 2 min),收集的细胞立即冷冻并在- 60°C保存,直到分离出RNA。gydF4y2Ba
克隆gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba
用RNAqueous kit (Ambion)和Plant RNA Isolation Aid (Ambion)分离藻类细胞总RNA。用SuperScript First-strand Synthesis System for RT-PCR (Invitrogen)从经DNase I (Invitrogen)处理的总RNA中合成第一链cDNA。互补脱氧核糖核酸含有gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba编码序列用PrimeSTAR GXL DNA聚合酶(Takara Bio)进行RT-PCR扩增。RT-PCR所用引物如下:gydF4y2BaEgcrtEgydF4y2Ba, 5 ' -TTTCGCTCACACGCACAATG-3 '和5 ' -CCCAGCGTACAGAAAAGCTA-3 ';gydF4y2BaEgcrtBgydF4y2Ba, 5 ' -TTCGGTCGCTCCCCTTCCA-3 '和5 ' -AGCAGCCGAGTATGATACGA-3 '。扩增片段经凝胶纯化(Gel/PCR Extraction kit, FastGene),用Mighty TA-cloning Reagent Set for PrimeSTAR (Takara Bio)亚克隆到pMD20-T载体中并测序。gydF4y2Ba大肠杆菌gydF4y2Ba以菌株JM109 (Takara Bio)为质粒寄主,在LB培养基中培养[gydF4y2Ba54gydF4y2Ba]在黑暗中37°C。氨苄西林(50 μg mlgydF4y2Ba−1gydF4y2Ba)根据需要添加到介质中。gydF4y2Ba
互补实验用质粒的构建gydF4y2Ba
的编码序列gydF4y2BaEgcrtEgydF4y2Ba用PrimeSTAR GXL DNA聚合酶和引物5 ' -TGAATTCCACACGCACAATGGCC-3 '和5 ' -ATAAGCTTCAGTTGGTGCGGGC-3 '扩增cDNAgydF4y2BaEcoRgydF4y2Ba我和gydF4y2Ba后gydF4y2Ba三、限制部位分别。的编码序列gydF4y2BaEgcrtBgydF4y2Ba引物5 ' -CTTCCATATGTCCGGCCAGAG-3 '和5 ' -TCTCGAGTAAGATCTTCAAGCCC-3 '扩增cDNAgydF4y2Ba濒死经历gydF4y2Ba我和gydF4y2BaXhogydF4y2Ba我分别限制网站。将扩增片段经凝胶纯化后,用Mighty ta克隆试剂Set for PrimeSTAR亚克隆到pMD20-T载体中。gydF4y2Ba大肠杆菌gydF4y2Ba菌株JM109作为质粒宿主,按上述方法培养。gydF4y2Ba
构造pET-gydF4y2BaEgcrtEgydF4y2Ba的编码序列gydF4y2BaEgcrtEgydF4y2Ba被克隆到gydF4y2BaEcoRgydF4y2Ba我/gydF4y2Ba后gydF4y2BapETDuet-1载体(Novagen)的III位点(多克隆位点1,MCS1)与ligigation Mighty Mix (Takara Bio)。宠物,gydF4y2BaEgcrtBgydF4y2Ba质粒是通过克隆gydF4y2BaEgcrtBgydF4y2Ba序列进入gydF4y2Ba濒死经历gydF4y2Ba我/gydF4y2BaXhogydF4y2BaI位点(MCS2)的pETDuet-1。宠物,gydF4y2BaEgcrtEBgydF4y2Ba是克隆出来的gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba到gydF4y2BaEcoRgydF4y2Ba我/gydF4y2Ba后gydF4y2BaIII位点(MCS1)和gydF4y2Ba濒死经历gydF4y2Ba我/gydF4y2BaXhogydF4y2Ba分别为pETDuet-1的I位点(MCS2)。gydF4y2Ba
pACgydF4y2Ba-PacrtBgydF4y2Ba构造如下。的开放阅读框gydF4y2BaP. ananatis crbgydF4y2Ba是从pACCAR25ΔgydF4y2BacrtEgydF4y2Ba[gydF4y2Ba22gydF4y2Ba]引物5 ' -GAACATATGGCAGTTGGCTCGA-3 '和5 ' -ACCTCGAGCTAGAGCGGGC-3 ',其中包含gydF4y2Ba濒死经历gydF4y2Ba我和gydF4y2BaXhogydF4y2BaI酶切位点分别克隆到pACYCDuet-1 (Novagen)的MCS2中。本研究中使用的限制性内切酶购自Takara Bio。gydF4y2Ba大肠杆菌gydF4y2Ba菌株JM109作为质粒的寄主,按上述方法培养。氨苄西林(50 μg mlgydF4y2Ba−1gydF4y2Ba)和氯霉素(30 μg mlgydF4y2Ba−1gydF4y2Ba)按需要添加到介质中。gydF4y2Ba
互补实验gydF4y2Ba
pACCAR25ΔgydF4y2BacrtEgydF4y2Ba,其中载有gydF4y2Bap . ananatisgydF4y2Ba类胡萝卜素合成基因簇(gydF4y2BacrtBgydF4y2Ba,gydF4y2BacrtIgydF4y2Ba,gydF4y2BacrtYgydF4y2Ba,gydF4y2BacrtZgydF4y2Ba而且gydF4y2BacrtXgydF4y2Ba的例外gydF4y2BacrtEgydF4y2Ba被引入gydF4y2Ba大肠杆菌gydF4y2Ba菌株BL21(DE3) (New England BioLabs)。变形人藏着pACCAR25ΔgydF4y2BacrtEgydF4y2Ba是按照InouegydF4y2Ba等gydF4y2Ba.[gydF4y2Ba55gydF4y2Ba]然后用pET-进行转化gydF4y2BaEgcrtEgydF4y2Ba.用于泛函分析gydF4y2BaEgcrtBgydF4y2Ba,gydF4y2Ba大肠杆菌gydF4y2Ba应变BL21 (DE3)转换与宠物-gydF4y2BaEgcrtBgydF4y2Ba和pACCAR25ΔgydF4y2BacrtBgydF4y2Ba[gydF4y2Ba23gydF4y2Ba带着gydF4y2Bap . ananatisgydF4y2Ba玉米黄质生物合成基因簇(gydF4y2BacrtEgydF4y2Ba,gydF4y2BacrtIgydF4y2Ba,gydF4y2BacrtYgydF4y2Ba,gydF4y2BacrtZgydF4y2Ba而且gydF4y2BacrtXgydF4y2Ba的例外gydF4y2BacrtBgydF4y2Ba.转换后的gydF4y2Ba大肠杆菌gydF4y2Ba细胞在5ml LB培养基中37℃黑暗中培养至ODgydF4y2Ba600gydF4y2Ba浓度为0.6 ~ 0.8,在含50 μM异丙基-β-的培养基中21℃培养2天gydF4y2BadgydF4y2Ba-硫半乳糖吡喃苷[gydF4y2Ba56gydF4y2Ba].氨苄西林(50 μg mlgydF4y2Ba−1gydF4y2Ba)和氯霉素(30 μg mlgydF4y2Ba−1gydF4y2Ba)按需要添加到介质中。的gydF4y2Ba大肠杆菌gydF4y2Ba细胞从培养基中离心(3000 ×gydF4y2BaggydF4y2Ba, 5分钟)。gydF4y2Ba
植物素的提取gydF4y2Ba大肠杆菌gydF4y2Ba高效液相色谱分析gydF4y2Ba
用于泛函分析gydF4y2BaEgcrtEgydF4y2Ba,gydF4y2Ba大肠杆菌gydF4y2Ba应变BL21 (DE3)转换与宠物-gydF4y2BaEgcrtEgydF4y2Ba和pAC -gydF4y2BaPacrtBgydF4y2Ba.用于泛函分析gydF4y2BaEgcrtBgydF4y2Ba,gydF4y2Ba大肠杆菌gydF4y2Ba与pET-gydF4y2BaEgcrtBgydF4y2Ba及pACCRT-E [gydF4y2Ba23gydF4y2Ba],其中载有gydF4y2BaP. ananatis crtE。大肠杆菌gydF4y2Ba携带宠物,gydF4y2BaEgcrtEBgydF4y2Ba也是被创造出来的。将转化后的细胞置于5ml LB培养基中,37℃孵育至ODgydF4y2Ba600gydF4y2Ba浓度为0.6 ~ 0.8,在含50 μM IPTG的培养基中21℃黑暗培养2天[gydF4y2Ba56gydF4y2Ba].的gydF4y2Ba大肠杆菌gydF4y2Ba采用离心分离法(3000 ×gydF4y2BaggydF4y2Ba, 5分钟),并在- 60°C冷冻直到色素提取。氨苄西林(50 μg mlgydF4y2Ba−1gydF4y2Ba)和氯霉素(30 μg mlgydF4y2Ba−1gydF4y2Ba)按需要添加到介质中。gydF4y2Ba
用2ml丙酮/甲醇(7:2,v/v)从细胞中提取色素两次。离心后,用旋转蒸发器干燥提取物。颜料溶解在少量的gydF4y2BangydF4y2Ba-己烷,然后装载在硅胶(Wakogel C-300, Wako)柱上。萃取物用1-2 ml溶液从色谱柱中洗脱gydF4y2BangydF4y2Ba-己烷,还有gydF4y2BangydF4y2Ba-己烷相用旋转蒸发器蒸发至干燥。将残留物溶解在少量乙醇中,并使用如下所述的高效液相色谱系统进行分析。提取过程在HPLC分析前的暗光下进行。gydF4y2Ba
HPLC系统采用PEGASIL ODS SP100色谱柱(6φ × 150 mm,森树科技有限公司)。流动相为乙腈/甲醇/四氢呋喃(58:35:7,v/v/v) [gydF4y2Ba57gydF4y2Ba]流速为1.0 ml mingydF4y2Ba−1gydF4y2Ba.用Shimadzu光电二极管阵列检测器SPD-M20A记录吸收光谱(250-350 nm, 1.2 nm分辨率)和保留时间。gydF4y2Ba
实时定量PCR (qPCR)分析gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2Ba表达式gydF4y2Ba
提取总RNAgydF4y2Bae .股薄肌gydF4y2Ba使用RNAqueous试剂盒和植物RNA分离辅助剂。用Qiagen定量反转录试剂盒(quantitative Reverse Transcription kit, Qiagen)从总RNA中合成第一链cDNA作为模板。qPCR用Fast SYBR Green Master Mix (Applied Biosystems)在7500 Fast Real-Time PCR系统(Applied Biosystems)上进行。gydF4y2BaGAPDHgydF4y2Ba[GenBank: L21903.1]作为样本间基因表达水平标准化的参考基因。引物序列如下:gydF4y2BaGAPDHgydF4y2Ba, 5 ' -GGTCTGATGACCACCATCCAT-3 '和5 ' -TGAGGGTCCATCGACAGTCTT-3 ';gydF4y2BaEgcrtEgydF4y2Ba, 5 ' -GGTCTGGCGTTCCAAATCAT-3 '和5 ' -TCATCCTTACCCGCTGTCTTG-3 ';而且gydF4y2BaEgcrtBgydF4y2Ba, 5 ' - ccaagtgacggaggatcaga -3 '和5 ' -ATCAAGGCCCGGTAATTCTCA-3 '。qPCR分析对每个处理的三个独立样本进行三次重复。gydF4y2Ba
支持数据的可用性gydF4y2Ba
支持本文结果的数据集包含在本文及其附加文件中。gydF4y2Ba
缩写gydF4y2Ba
- CrtB Psy, Pys:gydF4y2Ba
-
八氢番茄红素合成酶gydF4y2Ba
- CrtE GGPPS, GGPS:gydF4y2Ba
-
香叶基香叶基焦磷酸合成酶gydF4y2Ba
- CrtH CrtISO:gydF4y2Ba
-
独联体gydF4y2Ba胡萝卜素异构酶gydF4y2Ba
- CrtI CrtP:gydF4y2Ba
-
八氢番茄红素desaturasegydF4y2Ba
- CrtQ:gydF4y2Ba
-
ζ-胡萝卜素desaturasegydF4y2Ba
- CrtX:gydF4y2Ba
-
玉米黄质葡糖苷酶gydF4y2Ba
- CrtY:gydF4y2Ba
-
番茄红素环化酶gydF4y2Ba
- CrtZ:gydF4y2Ba
-
β-胡萝卜素羟化酶gydF4y2Ba
- DOXP:gydF4y2Ba
-
1-deoxy -gydF4y2BadgydF4y2Ba木酮糖5-phosphategydF4y2Ba
- GGPP:gydF4y2Ba
-
Geranylgeranyl焦磷酸gydF4y2Ba
- 高效液相色谱法:gydF4y2Ba
-
高效液相色谱法gydF4y2Ba
- IPTG:gydF4y2Ba
-
异丙基-β-gydF4y2BadgydF4y2Ba-thiogalactopyranosidegydF4y2Ba
- 议员:gydF4y2Ba
-
2-C-methylerythritol 4-phosphategydF4y2Ba
- 兆电子伏:gydF4y2Ba
-
甲羟戊酸gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
的叶绿体gydF4y2Ba眼虫gydF4y2Ba可能是从共生的绿藻进化而来的。中华民国学报。1978;56:2883-9。gydF4y2Ba
- 2.gydF4y2Ba
dunnford DG, Deane JA, Tan S, McFadden GI, Gantt E, Green BR真核生物光收集天线蛋白的系统发育评估,与质体进化的意义。中华药理学杂志,1999;39(4):529 - 529。gydF4y2Ba
- 3.gydF4y2Ba
从细菌到植物类胡萝卜素生物合成的分子进化。物理学报。2002;16:431 - 40。gydF4y2Ba
- 4.gydF4y2Ba
类胡萝卜素在叶绿体中的膜稳定剂。植物科学进展1998;3:147-51。gydF4y2Ba
- 5.gydF4y2Ba
类胡萝卜素和植物的光保护:叶黄素玉米黄质的作用。生物化学学报,1990;10:1 - 24。gydF4y2Ba
- 6.gydF4y2Ba
徐敏,高士波。植物ABA生物合成的复杂调控。植物科学进展,2002;7:41-8。gydF4y2Ba
- 7.gydF4y2Ba
Matusova R, Rani K, Verstappen FWA, Franssen MCR, Beale MH, Bouwmeester HJ。独脚金内酯对寄生植物的发芽促进剂gydF4y2Ba斯特gydF4y2Ba而且gydF4y2BaOrobanchegydF4y2Basp .来源于类胡萝卜素途径。植物物理学报,2005;39(2):339 - 344。gydF4y2Ba
- 8.gydF4y2Ba
类胡萝卜素在藻类中的分布、生物合成和功能。3月药品,2011;9:1101-18。gydF4y2Ba
- 9.gydF4y2Ba
科尔德罗BF,库索I, León R, Rodríguez H,巴尔加斯MÁ。促进类胡萝卜素的生物合成gydF4y2Ba衣藻reinhardtiigydF4y2Ba利用从植物中分离出的植烯合酶基因进行核转化gydF4y2Ba小球藻zofingiensisgydF4y2Ba.中国生物医学工程学报,2011;gydF4y2Ba
- 10.gydF4y2Ba
杨乐,黄晓强,卢qq,朱建勇,陆松。香叶酰香叶酰二磷酸合成酶(GGPS)的克隆与鉴定gydF4y2BaPyropia umbilicalisgydF4y2Ba.应用物理学报,2015。doi:gydF4y2Ba10.1007 / s10811 - 015 - 0593 - 6gydF4y2Ba.gydF4y2Ba
- 11.gydF4y2Ba
Aitzetmüller K, Svec WA, Katz JJ,菌株HH。二亚迪诺黄质和主要叶黄素的结构和化学特性gydF4y2Ba眼虫gydF4y2Ba.化学学报,1968;1:32-3。gydF4y2Ba
- 12.gydF4y2Ba
T.海藻中的叶绿素和类胡萝卜素gydF4y2BaEutreptiella gymnasticagydF4y2Ba.Phytochem。1982;21:1715-9。gydF4y2Ba
- 13.gydF4y2Ba
高一,米黑。新黄质在含氧光养生物中的分布和几何异构gydF4y2Ba独联体gydF4y2Ba是唯一的分子形式。植物生理学报。1998;39:968-77。gydF4y2Ba
- 14.gydF4y2Ba
Tessier LH, Keller M, Chan RL, Fournier R, Weil JH, Imbault pgydF4y2Ba反式gydF4y2Ba拼接在gydF4y2Ba眼虫gydF4y2Ba.杨晓明,1991;10:1 - 5。gydF4y2Ba
- 15.gydF4y2Ba
dunnford DG, Gray MW。分析gydF4y2Ba眼虫属股薄肌gydF4y2Ba质体靶向蛋白揭示了不同类型的转运序列。真核细胞。2006;5:2079-91。gydF4y2Ba
- 16.gydF4y2Ba
TMHMM服务器,版本2.0。gydF4y2Bahttp://www.cbs.dtu.dk/services/TMHMM/gydF4y2Ba.2015年6月17日访问。gydF4y2Ba
- 17.gydF4y2Ba
TargetP 1.1服务器。gydF4y2Bahttp://www.cbs.dtu.dk/services/TargetP/gydF4y2Ba.2015年6月17日访问。gydF4y2Ba
- 18.gydF4y2Ba
李文杰,李志强,李志强,李志强,等。EMBL-EBI中的分析工具web服务。核酸科学,2013;41:W597-600。gydF4y2Ba
- 19.gydF4y2Ba
李志强,李志强,李志强,等。植物类异戊二烯的生物成因、分子调控与功能。Prog血脂Res. 2005; 44:357-429。gydF4y2Ba
- 20.gydF4y2Ba
贝克G, Coman D, Herren E, Ruiz-Sola MÁ, Rodríguez-Concepción M, Gruissem W,等。植物GGPP合成酶基因家族的研究gydF4y2Ba拟南芥gydF4y2Ba.中国生物医学工程学报,2013;gydF4y2Ba
- 21.gydF4y2Ba
Shumskaya M, Bradbury LMT, Monaco RR, Wurtzel ET.关键类胡萝卜素酶植烯合成酶的质体定位受同工酶、等位基因变异和活性的影响。植物学报。2012;24:3725-41。gydF4y2Ba
- 22.gydF4y2Ba
三泽N,中川M,小林K,山野S,井泽Y,中村K,等。说明gydF4y2Ba欧文氏菌uredovoragydF4y2Ba类胡萝卜素生物合成途径中表达的基因产物功能分析gydF4y2Ba大肠杆菌gydF4y2Ba.中华微生物学杂志,1990;gydF4y2Ba
- 23.gydF4y2Ba
张志刚,张志刚,张志刚,等。分子克隆与表达的研究进展gydF4y2Ba大肠杆菌gydF4y2Ba植物素合成酶是一种类胡萝卜素生物合成酶。FEBS Lett. 1992; 296:305-10。gydF4y2Ba
- 24.gydF4y2Ba
孔兹M, Römer S, Suire C, Hugueney P, Weil JH, Schantz R,等。香叶基香叶基焦磷酸合成酶cDNA的鉴定gydF4y2Ba甜椒gydF4y2Ba:果实成熟过程中酶活性和转录水平的相关增加。Plant J. 1992; 2:25-34。gydF4y2Ba
- 25.gydF4y2Ba
Lichtenthaler港元。1-deoxy -gydF4y2BadgydF4y2Ba植物中类异戊二烯生物合成的-木酮糖-5-磷酸途径。植物物理学报,1999;50:47-65。gydF4y2Ba
- 26.gydF4y2Ba
Lichtenthaler港元。高光合辐照下叶片中类胡萝卜素、α-生育酚、质体醌和异戊二烯的生物合成、积累和释放。Photosynth Res. 2007; 92:163-79。gydF4y2Ba
- 27.gydF4y2Ba
Disch A, Schwender J, Müller C, Lichtenthaler HK, Rohmer M.甲丙酸和甘油醛磷酸盐/丙酮酸途径在单细胞藻类和蓝藻中生物合成类异戊二烯的分布gydF4y2Ba集胞藻属gydF4y2BaPCC 6714。生物化学学报(英文版);1998;gydF4y2Ba
- 28.gydF4y2Ba
Sláviková S, Vacula R,方Z, Ehara T, Osafune T, Schwartzbach SD。高尔基体的同源和异源重组对叶绿体的转运和蛋白质导入的复合叶绿体gydF4y2Ba眼虫gydF4y2Ba.中国生物医学工程学报,2005;gydF4y2Ba
- 29.gydF4y2Ba
绿藻眼点装置:原始的视觉系统和更多?柯尔·热内,2009;55:19-43。gydF4y2Ba
- 30.gydF4y2Ba
Schmidt M, Geßner G, Luff M, Heiland I, Wagner V, Kaminski M,等。眼斑的蛋白质组学分析gydF4y2Ba衣藻reinhardtiigydF4y2Ba提供对其组成部分和战术运动的新颖见解。《植物细胞》2006;18:08 - 30。gydF4y2Ba
- 31.gydF4y2Ba
李志强,李志强,李志强。β-胡萝卜素脂滴的蛋白质组学分析gydF4y2Ba杜氏盐藻bardawilgydF4y2Ba.植物科学进展。2015;gydF4y2Ba
- 32.gydF4y2Ba
李志强,李志强,李志强,等。植物光生细胞柱头类胡萝卜素的分离与鉴定gydF4y2Ba眼虫属股薄肌gydF4y2Ba中华微生物学杂志,1999;gydF4y2Ba
- 33.gydF4y2Ba
Kivic PA, Vesk M. Euglenoid眼点装置的结构和功能:精细结构和对环境变化的响应。足底。1972;105:1-14。gydF4y2Ba
- 34.gydF4y2Ba
Adl SM, Simpson AGB, Farmer MA, Andersen RA, Anderson OR, Barta JR,等。真核生物的新高级分类,强调原生生物的分类学。中国生物工程学报,2005;gydF4y2Ba
- 35.gydF4y2Ba
艾哈迈迪内贾德N,达甘T,马丁w共生杂交的基因组历史gydF4y2Ba眼虫属股薄肌gydF4y2Ba.基因。2007;402:35-9。gydF4y2Ba
- 36.gydF4y2Ba
辛普森AGB,吉尔EE,卡拉汉HA,利特克RW,罗杰AJ。动体纲(裸殖纲)的早期进化和锥虫纲的晚期出现。原生生物。2004;155:407-22。gydF4y2Ba
- 37.gydF4y2Ba
真核生物的早期进化与起源。《生物学报》1991;1:457-63。gydF4y2Ba
- 38.gydF4y2Ba
Watanabe Y, Gray MW。编码盒H/ACA snoRNAs相关蛋白的基因的进化外观:Cbf5pgydF4y2Ba眼虫属股薄肌gydF4y2BaGar1p和Nop10p在古细菌中的候选同源物。核酸Res. 2000; 28:2342-52。gydF4y2Ba
- 39.gydF4y2Ba
黄志强,李志强,李志强,等。绿藻类胡萝卜素合成基因的光诱导gydF4y2BaHaematococcus pluvialisgydF4y2Ba:通过光合作用氧化还原控制调节。植物化学学报,2003;gydF4y2Ba
- 40.gydF4y2Ba
Wahidin S, Idris A, Shaleh SRM。光强和光周期对微藻生长及脂质含量的影响gydF4y2BaNannochloropsisgydF4y2Basp. Bioresour technology, 2013; 129:7-11。gydF4y2Ba
- 41.gydF4y2Ba
Król M, Maxwell DP, Huner NPA。暴露的gydF4y2Ba杜氏gydF4y2Ba到低温模拟高光诱导的类胡萝卜素和类胡萝卜素结合蛋白(Cbr)的积累。植物细胞物理学报。1997;38:413 - 416。gydF4y2Ba
- 42.gydF4y2Ba
李志强,李志强,李志强,等。植物素合成酶和类胡萝卜素羟化酶两个类胡萝卜素合成基因在胁迫诱导的绿藻虾青素形成过程中的调控gydF4y2BaHaematococcus pluvialisgydF4y2Ba.植物物理学报,2001;gydF4y2Ba
- 43.gydF4y2Ba
李艳,黄娟,陈峰。强光和氯化钠胁迫对虾青素生物合成的影响gydF4y2Ba小球藻zofingiensisgydF4y2Ba(绿藻类)。中国生物医学工程学报(自然科学版),2009;gydF4y2Ba
- 44.gydF4y2Ba
王B, Zarka A, Trebst A, BoussibagydF4y2BaHaematococcus pluvialisgydF4y2Ba(绿兰科)作为一个积极的光保护过程在高辐照。中华物理学报。2003;39:1116-24。gydF4y2Ba
- 45.gydF4y2Ba
冯林tig J, Welsch R, Bonk M, Giuliano G, Batschauer A, Kleinig H.类胡萝卜素生物合成的光依赖性调控发生在植物素合成酶表达水平,并由光敏色素介导gydF4y2BaSinapsis阿尔巴gydF4y2Ba而且gydF4y2Ba拟南芥gydF4y2Ba幼苗。植物学报,1997;12:625 - 334。gydF4y2Ba
- 46.gydF4y2Ba
Estévez JM, Cantero A, Reindl A, Reichler S, León P. 1-脱氧-gydF4y2BadgydF4y2Ba-木酮糖-5-磷酸合成酶,植物中可塑性类异戊二烯生物合成的限制性酶。生物化学学报。2001;276:22901-9。gydF4y2Ba
- 47.gydF4y2Ba
卡雷特罗-保列,Cairó A, Botella-Pavía P, Besumbes O, Campos N, Boronat A,等。通过甲基赤藓糖醇4-磷酸途径增强通量gydF4y2Ba拟南芥gydF4y2Ba过表达脱氧木质素5-磷酸还原异构酶的植物。植物分子生物学杂志,2006;gydF4y2Ba
- 48.gydF4y2Ba
Botella-Pavía P, Besumbes Ó, Phillips MA, Carretero-Paulet L, Boronat A, Rodríguez-Concepción M.植物中类胡萝卜素生物合成的调控:羟甲基丁烯二磷酸还原酶在控制plastidial类异戊二烯前体供应中的关键作用的证据。植物J. 2004; 40:188-99。gydF4y2Ba
- 49.gydF4y2Ba
Rodríguez-Villalón A, Gas E, Rodríguez-Concepción M.植烯合酶活性控制类胡萝卜素的生物合成及其代谢前体的供应gydF4y2Ba拟南芥gydF4y2Ba幼苗。植物J. 2009; 60:424-35。gydF4y2Ba
- 50.gydF4y2Ba
刘志强,刘志强,杨晓明,杨晓明,等。岩藻黄质作为基因工程靶点生物合成的研究进展gydF4y2BaPhaeodactylum tricornutumgydF4y2Ba.应用物理学报,2015。doi:gydF4y2Ba10.1007 / s10811 - 015 - 0583 - 8gydF4y2Ba.gydF4y2Ba
- 51.gydF4y2Ba
李志强,李志强,杨晓明,Rodríguez-Concepción M.光敏色素作用因子对植物素合成酶基因表达和类胡萝卜素合成的直接调控。自然科学进展(英文版),2010;gydF4y2Ba
- 52.gydF4y2Ba
类胡萝卜素生物合成基因在光照下的调控gydF4y2Ba衣藻reinhardtiigydF4y2Ba.生物化学学报2002;1579:26-34。gydF4y2Ba
- 53.gydF4y2Ba
黄志刚,张志刚,张志刚,等gydF4y2Ba眼虫属股薄肌gydF4y2Ba.阿奇·微生物。1952;17:384-402。gydF4y2Ba
- 54.gydF4y2Ba
溶原性研究ⅰ:通过溶原性释放噬菌体的模式gydF4y2Ba大肠杆菌gydF4y2Ba.中华微生物学杂志,2001;gydF4y2Ba
- 55.gydF4y2Ba
井上H,野岛H,冈山HgydF4y2Ba大肠杆菌gydF4y2Ba与质粒。基因。1990;96:23-8。gydF4y2Ba
- 56.gydF4y2Ba
竹村,毛冈,三泽,等。苔类胡萝卜素的分析gydF4y2BaMarchantia polymorphagydF4y2Ba并对其番茄红素β-和ε-环化酶基因进行功能鉴定。植物科学进展。2014;gydF4y2Ba
- 57.gydF4y2Ba
胡萝卜素在CgydF4y2Ba18gydF4y2Ba具有等距洗脱和吸收光谱的高效液相色谱柱,带有光电二极管阵列检测器。光合作用res 2000; 65:93-9。gydF4y2Ba
- 58.gydF4y2Ba
紫菜gydF4y2Ba爆炸。gydF4y2Bahttp://dbdata.rutgers.edu/nori/index.phpgydF4y2Ba.2015年11月20日访问。gydF4y2Ba
- 59.gydF4y2Ba
田村K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析版本6.0。中国生物医学杂志,2013;30:2725-9。gydF4y2Ba
确认gydF4y2Ba
作者非常感谢N. Misawa博士(石川县立大学,日本),他提供了pACCAR25ΔgydF4y2BacrtEgydF4y2Ba, pACCAR25ΔgydF4y2BacrtBgydF4y2Ba和pACCRT-E质粒。我们也感谢M. Takemura博士(石川县立大学,日本)对颜色互补实验的有益建议。这项工作的一部分由JSPS KAKENHI(25450308)和mext支持的私立大学战略研究基金会项目(S1311014)资助给SK和TS。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
作者的贡献gydF4y2Ba
SK设计实验,进行藻类培养、cDNA克隆、高效液相色谱和基因表达分析;并起草了手稿。TI提供了RNA-seq数据,包括未发表的观察结果。MA与SK合作进行分子遗传学研究,包括cDNA克隆和基因表达分析。SK和ShT对GGPP合成酶和植烯合成酶蛋白进行了系统发育分析。ShT和SeT建立了黄芩中类胡萝卜素的分析方法gydF4y2Ba大肠杆菌gydF4y2Ba细胞的功能分析gydF4y2BaEgcrtEgydF4y2Ba而且gydF4y2BaEgcrtBgydF4y2BaSK. TS与HPLC合作构思本研究,并参与设计和协调;并帮助起草了手稿。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
作者的信息gydF4y2Ba
日本枥木县宇都宫市丰裕台1-1,日本理工学院生物科学系,加藤Shota Kato植物分子与细胞生物学实验室,320-8551。电话:+81-28-627-7111邮箱:shota.kato.680@gmail.comgydF4y2Ba
附加文件gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
核苷酸序列gydF4y2BaE. gracilis crtEgydF4y2Ba及其推导出的氨基酸序列。(PDF 1127kb)gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
核苷酸序列gydF4y2BaE. gracilis crbgydF4y2Ba及其推导出的氨基酸序列。(PDF 1130kb)gydF4y2Ba
附加文件3:图S3。gydF4y2Ba
推导的EgCrtE氨基酸序列与已知GGPP合成酶的系统发育关系。括号内的数字为GGPP合成酶的登录号。的GGPS序列数据gydF4y2BaPyropia umbilicalisgydF4y2Ba[gydF4y2BaP_umbilicalis_esContig5139gydF4y2Ba]是从gydF4y2Ba紫菜gydF4y2Ba爆炸(gydF4y2Ba58gydF4y2Ba].采用MEGA version 6.0的邻居连接法构建系统发育树[gydF4y2Ba59gydF4y2Ba].在每个节点旁边显示了1000个复制的百分比中的引导值。(PDF 972 kb)gydF4y2Ba
附加文件4:图S4。gydF4y2Ba
导出的EgCrtB氨基酸序列与已知植烯合酶的系统发育关系。括号内的数字为植烯合酶的登录号。采用MEGA version 6.0的邻居连接法构建系统发育树[gydF4y2Ba59gydF4y2Ba].在每个节点旁边显示了1000个复制的百分比中的引导值。(PDF 988 kb)gydF4y2Ba
附加文件5:图S5。gydF4y2Ba
植物烯生产分析gydF4y2Ba大肠杆菌gydF4y2Ba通过高效液相色谱法。高效液相色谱图(284 nm)gydF4y2Ba大肠杆菌gydF4y2Ba细胞携带(A) pET-gydF4y2BaEgcrtEgydF4y2Ba, (B) pET-gydF4y2BaEgcrtBgydF4y2Ba, (C) pAC-gydF4y2BaPacrtBgydF4y2Ba与pETDuet-1(病媒控制)和(D) pACCRT-E [gydF4y2Ba23gydF4y2Ba]和pETDuet-1。数据代表三到四个实验,结果相似。植物烯在28.6 min洗脱。gydF4y2Ba4gydF4y2Ba).21.5 min时的峰值不是类胡萝卜素。(PDF 1108kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
加藤,S.,高市,S.,石川,T.。gydF4y2Baet al。gydF4y2Ba香叶基香叶基焦磷酸合成酶基因的鉴定及功能分析(gydF4y2BacrtEgydF4y2Ba)和植烯合酶基因(gydF4y2BacrtBgydF4y2Ba)用于类胡萝卜素的生物合成gydF4y2Ba眼虫属股薄肌gydF4y2Ba.gydF4y2BaBMC植物生物学gydF4y2Ba16日,gydF4y2Ba4(2016)。https://doi.org/10.1186/s12870-015-0698-8gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-015-0698-8gydF4y2Ba
关键字gydF4y2Ba
- 眼虫属股薄肌gydF4y2Ba
- 光压力gydF4y2Ba
- 类胡萝卜素生物合成gydF4y2Ba
- 香叶基香叶基焦磷酸合成酶gydF4y2Ba
- CrtEgydF4y2Ba
- 八氢番茄红素合成酶gydF4y2Ba
- CrtBgydF4y2Ba