抽象的
背景
众所周知的受体样激酶在疾病抵抗力中发挥关键作用。其中,壁相关的激酶(Waks)已被证明是几种植物物种中真菌疾病抗性的正调节剂。瓦克基因在感染过程中经常受到转录调控,但参与这一调控的途径尚不清楚。在水稻,OsWAK与拟南芥相比,基因家族显著扩增。可能有几个WAKS.以不同的方式参与基础防御还没有得到解决。此外,直接需要大米奥斯瓦克规范防御的基因尚未探讨。
结果
这里我们用大米(栽培稻)四种选定的功能突变体OsWAK对稻瘟病的数量抗性需要单独的OsWAKs基因,麦格纳波特青铜币。OsWAK14、OsWAK91和OsWAK92对数量抗性有正向调节作用,而OsWAK112d则对稻瘟病抗性有负向调节作用。此外,我们还证明了水稻的早期转录调控OsWAK基因被几丁酸触发,并且部分在Chitin受体CeBip的控制下。最后,我们表明H需要奥斯卡赫912.O2.生产和足以增强感染期间的防御基因表达。
结论
我们得出结论,大米OsWAK所研究的基因是基底防御反应的一部分,可能由小蛋白从真菌细胞壁介导。这项工作也表明了一些OsWAKs,就像OsWAK112d,可作为抗病的负调节因子。
背景
植物已经进化了通过植物细胞表面局部化的图案识别受体(PRR)检测潜在致病微生物的能力[1.].PRR蛋白识别病原体相关分子模式(PAMPs),这是病原体中保守的基序,损伤相关分子模式(DAMPs)来自病原体侵入造成的损伤[2.].通过PRRS触发病原体的检测触发PAMP触发的免疫(PTI,也称为基础防御),其伴随着快速生产的活性氧物质(ROS),激活丝裂剂活化的蛋白激酶(MAPK)和免疫相关表达的变化基因[2.].
目前已鉴定出8种细菌、4种真菌PAMPs和20种prr[3.].在植物中研究最好的PAMP识别系统是被识别的细菌鞭毛蛋白拟南芥蒂利亚纳FLS2受体与CEBiP受体识别的真菌几丁质[1.].FLS2蛋白属于受体样激酶(RLK)基因家族。RLK的典型结构是识别PAMP分子,跨膜结构域和细胞内激酶结构域的细胞外受体结构域[4.].CeBip蛋白由锚定的膜锚定的细胞型溶液组成,但不含任何激酶结构域[5.]. FLS2和CEBiP分别与拟南芥中的BAK1和水稻中的CERK1等RLK蛋白有关[1.].FLS2和CERK1是基础防御的正调节因子,因为这些基因的突变会导致拟南芥抗性的降低[6.,7.]或在水稻中减少基础防御[8.].与PAMP相比,我们对潮湿检测的了解得多,迄今为止已经确定了三对PRR和潮湿[3.].其中之一是拟南芥壁相关激酶1 (AtWAK1)和低聚半乳糖醛酸(OGs)之间的PRR/DAMP配对[9]来源于大多数植物细胞壁中的果胶[10].
壁相关激酶的特征是由一个或几个重复的表皮生长因子(EGF)结构域组成的胞外结构域。在动物中,已知EGF结构域可以结合非常大范围的小肽,并在钙结合时二聚[11].含EGF的蛋白质可以在动物中的配体结合后形成同源和异二聚体[12].基于拟南芥中5种WAKs激酶结构域的同源性[13]在拟南芥和水稻中分别鉴定了21个WAK样蛋白基因和125个WAK样蛋白基因,揭示了WAK家族在单子叶植物中的扩展[14,15]. 为了简单起见,并遵循以前的水稻命名法[15,这种类似WAKs的蛋白质被称为WAKs。在这些稻谷中,有67个有一个善意表皮生长因子胞外区。只有少数来自拟南芥或水稻的wak具有激酶活性[16,17].类似地,只有少数WAK已经局限于拟南芥中的血浆膜[18]或大米(OsWAK1)[17],(OsDEES1/OsWAK91)[19].最近,玉米ZmWAK被证明定位于质膜[20].此外,WAKs似乎存在于未知成分的大膜蛋白复合物中[21].尚不清楚wak是否与其他rlks关联以确保与其他几个rlk一样适当的函数[22].
在植物中,显示几种配体粘合Wak蛋白的细胞外结构域。例如,AtgP3蛋白与Atwak1结合[21]果胶和OGs结合AtWAK1和AtWAK2[23–25]. 结果表明,在果胶处理后,AtWAK2激活有丝分裂原激活激酶MPK3和MPK6,并且AtWAK2的TAP标记(串联亲和纯化)版本组成性地激活ROS产生和防御基因表达[26].然而,没有指示本机WAK可以触发ROS,并且在感染期间只有非常有限的防御基因表达信息[20].
怪人参与植物的发育[27]. 例如,细胞壁扩张需要AtWAK1和AtWAK2[28]. 因此,WAK突变体在其发育过程中经常受到影响。在水稻中,植物沉默了一段时间OsDEES1/奥斯瓦克91显示的生育缺陷[19]这归因于胚胎发育的缺陷。植物沉默米籼稻奥西瓦克1基因被暂停了[29]在拟南芥中,沉默AtWAK1和AtWAK2是致命的[28].
WAK在植物抗病中的作用最初来自WAK突变体在触发防御相关反应中受到影响的间接证据[18].后来,几项研究提供了直接证据瓦克基因参与抵抗。首先,表明了RFO1 / WAKL22基因负责定量抗性镰刀菌素[30),Verticilium.[31].最近,两种不同的玉米壁相关激酶被证明是一个主要的抗土传真菌QTLSporisorium Reilianum.(ZmWAK) [20]并且一个对抗叶面真菌病原体绿脓杆菌(Htn) [32].其次,几个突变分析瓦克基因为其参与抗病性而提供了证据。过度表达AtWAK1导致抵抗力增强Botrytis.[9]和过度表达OsWAK1增强抵抗力稻瘟病菌[17].另一方面,沉默SlWAK1番茄对细菌病原菌的敏感性增强假单胞菌光伏番茄[33].尽管相应的蛋白缺失一个EGF结构域(奥斯卡克25.) [34]或激酶结构域(At5g50290)[35].因此,一些WAK突变体似乎作为抗病真菌和细菌的积极调节因子,而没有可见的发育表型。然而,目前还没有迹象表明PTI在这些突变体中受到影响。
WAKS与疾病反应有关的另一个迹象来自观察瓦克基因通常通过拟南芥中的细菌感染来调节[33]和通过稻瘟病感染[36,37].非常有趣的是,有两种病原体通过表达小RNA干扰其RNA来操纵WAK基因的表达[35]或者通过一种未知的机制[33]. 因此,WAKs是病原体试图抑制的基础防御的重要组成部分。PAMPs还可以直接调控基因的表达瓦克基因[38].鞭毛素诱导几个瓦克拟南芥的基因[39]和番茄[33].几丁质诱导奥斯瓦克91在细胞培养物中以CEBIP依赖性方式在水稻中[5.)和ATWAKL10拟南芥基因[40]. 然而,全球监管瓦克PTI中的基因还不清楚。
在这里,我们报告了几个米饭瓦克基因是上调的OsWAK112d在水稻中真菌感染下调。该转录控制的一部分可能是由于甲壳素受体CeBip的几丁质检测。我们提供了证据,即奥卡克14,奥卡克91和奥斯卡赫92作为定量阻力的正稳压器,而奥斯卡克112则作为负调节器。通过学习奥斯瓦克91突变体,我们证明,该WAK显着参与感染过程中的ROS生产和防御基因表达。
结果
OsWAK表达受冲击波感染的影响
以前的转录组分析确定了五个OsWAK感染后差异表达的基因M. Oryzae.在米(附加文件1.).系统发育分析显示,除OsWAK1外,所有稻瘟病应答WAKs都来自一个主要的水稻WAKs分支,即WAKb,它们属于四个不同的、明显不同的WAKb亚分支(附加文件2.).
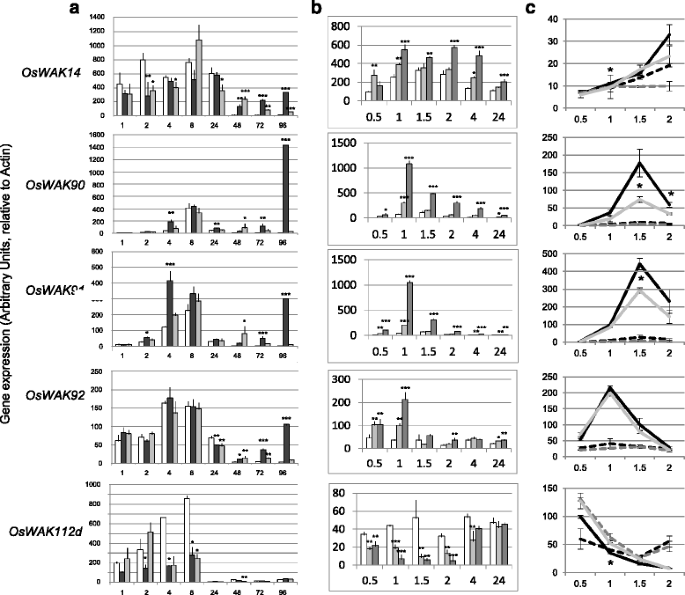
为了进一步研究这些对冲击波有反应的WAK,在感染早期和晚期(感染后1至24小时(hpi)和48至96小时(hpi)),分别使用分离株FR13和CL367测定它们在相容和不相容相互作用中的表达谱(图。1a级). 全部OsWAKs在感染期间在至少一种时间点和表达变化中差异表达转录物在相容和不相容的相互作用中相似。在晚期感染阶段,除了OsWAK112d, 全部OsWAK基因的诱导和表达在感病植物中往往比在抗性植物中更明显。在感染早期(2和4 hpi),表达奥斯瓦克90和奥斯瓦克91被诱发了。相比之下,OsWAK112d抄本,而且程度更低奥斯瓦克14,被压抑的早期。因此,在各种转录变化中发现的测试OsWAKs,大多数是在感染期间诱导,有时甚至在真菌渗透(<24HPi)和一个之前,OsWAK112d被压抑了。
OsWAK感染期间和几丁质处理后的基因表达。瓦克采用定量RT-PCR方法检测接种后叶片组织中基因的表达M. Oryzae.(A.),经几丁质处理后(B)和在cebip公司突变体(C). 使用肌动蛋白对数据进行标准化处理,显示的所有值均以任意单位表示。为了OsWAK112d,描述的两个替代转录物(附加文件3.A) 给出了相同的表达模式,显示了最长的一个。平均值与标准误差一起提供(N = 4). 统计差异根据单因素方差分析进行评估,然后根据每个数据点的模拟条件进行Dunnett检验P <0.05 (*),P <0.01 (**) andP< 0.001(* * *)。面板(C),只有在野生型和cebip公司显示用甲壳素处理的突变体。A.只接种明胶的植物(模拟处理:白色酒吧)或稻瘟病菌(强毒株FR13:黑暗的酒吧;无毒隔离CL367:灰条)。B将甲壳素和水喷洒在水稻植株上。这些数值是由四个独立的生物重复(白色酒吧:模拟;浅灰色的酒吧:100μg/ ml甲壳素;深灰色棒材:1000μg/mL甲壳素)。C管理OsWAK基因治疗后基因(连续线, 1000 μg/mL甲壳素)或模拟处理(虚线) 在里面cebip公司突变体(灰色的线)以及相应的空分离(野生型)植物(黑线)
几丁质触发了OsWAK基因表达
早期和非隔离特异性差异表达OsWAK基因(图。1b级)建议,这些隔离物共用的PAMP是触发器OsWAK早期感染的基因调控。几丁质在所有真菌中都是常见的,在一些生物系统中已被证明是重要的PAMP [7.,41]包括大米[5.,42].测试甲壳素的作用OsWAK基因表达,用几丁质寡聚体喷洒植物及表达OsWAKs是确定。几丁质强烈且快速地诱导了胚诱导基因的表达。1b级)奥斯瓦克91和奥斯瓦克90(1小时后两个基因的诱导率几乎是20倍)而冲击波抑制OsWAK112d被甲壳素处理下调(8倍)。的表达OsWAK14和奥斯瓦克92通过甲壳素治疗诱导程度更低。因此,我们得出结论OsWAK几丁质处理后的基因表现出相似的表达趋势。1b级)在爆炸感染的早期阶段(图。1a级).
为了检测甲壳素是否具有调节作用OsWAKs以受体依赖的方式,OsWAK对水稻中主要几丁质受体CEBiP缺失突变株的基因表达进行分析[5.,42,43]. 几丁质寡聚物喷洒在cebip公司功能丧失突变植物[44[处理后,测量基因表达直至2小时(图。1摄氏度).突变体CEBiP已经显示出转录反应减少OsWAKs几丁质低聚物[43].为了奥斯瓦克90和OsWAK91,触发引发的基因表达明显减少cebip公司突变体(图。1摄氏度).相比之下,对方响应的诱导响应OsWAK基因和抑制OsWAK112d只有轻微的影响cebip公司突变。这支持我们的假设,即CEBIP受体需要适当的激活和抑制几个OsWAK几丁质治疗的基因。
不同的要求OsWAKs对稻瘟病的定量抗性
阐明爆破和几丁质反应的作用WAKS.在抗病性方面,从水稻突变体库中寻找突变体[45,46].两个等位基因线OsWAK14(wak14-1和wak14-2),每一行各写一行奥斯瓦克91,奥斯瓦克92和OsWAK112d被确定(附加文件3.A).插入行包含TOS17反转录转座子插入到相应基因的编码序列中OsWAK基因。对于每一条插入线,我们分离出一条纯合子线TOS17元素(突变体)和一个没有的姐妹线TOS17元素(后来称为Null-Segregant:NS)。我们确认了目标的表达OsWAK与空白分离系相比,每个突变系的基因减少(附加文件3.b)。突变线没有显示出任何明显的生长表型(未显示数据),包括全部生育能力wak91突变体尽管先前的报告显示该基因的RNAi导致无菌[19].
以确定wak突变可能影响R基因介导的抗性,我们测试了无毒M. Oryzae.隔离CL367 On.wak突变体和零偏析线。用隔离CL367接种后,我们没有观察到之间的任何差异wak突变体及其各自的零偏析(数据未显示)。
为了检测WAK突变对基础抗性的影响,我们接种了wak突变体与毒性M. Oryzae.孤立FR13。这个wak14-1,wak14-2,wak91和wak92突变体易于分离FR13而不是它们各自的含氟分离对照(图。2a,b)并显示出孢子状病变的数量增加(更多为1.6倍wak14-1, 2.3倍wak14-2,2.5倍wak91和1.8倍wak92). 相反地,wak112d突变植物更耐药疾病。这表现为疾病病变数的1.6倍降低。因此wak突变体对稻瘟病的敏感性受到影响,表明相应的OsWAK基因是基础抗病的重要组成部分。
抵抗M. Oryzae.受到影响wak函数突变体突变体。植物接种了有毒的分离株FR13M. Oryzae.疾病被测量为7dpi。每一株系都有一个纯合突变体(Mut)和相应的空分株(Wt)。A.至少7株纯合子系和零分离系的幼嫩完全展开叶上的病变数为7 dpi。这些值以相对于零分离线平均值的百分数进行转换,并计算平均值和标准差。进行t检验,确定一个给定的突变系是否与其对应的空分离系(*:P <0.05; **:P <0.001). The experiment was repeated seven times and one representative experiment is shown.B接种5 d后拍照。磁化率的特征是灰色病变尽管小色斑来自一些剩余抵抗力
过度表达的影响奥斯瓦克91和OsWAK112d基础抗性的基因抗真菌
为了进一步研究其作用OsWAKs在抗抗抗抗抗抗性,我们决定生产过于快递的水稻植物奥斯瓦克91和OsWAK112d.我们关注这两个基因,因为它们代表了感染后最显著的表达模式(图。1.),以及相应功能缺失突变体中最强的疾病表型(图。2.).
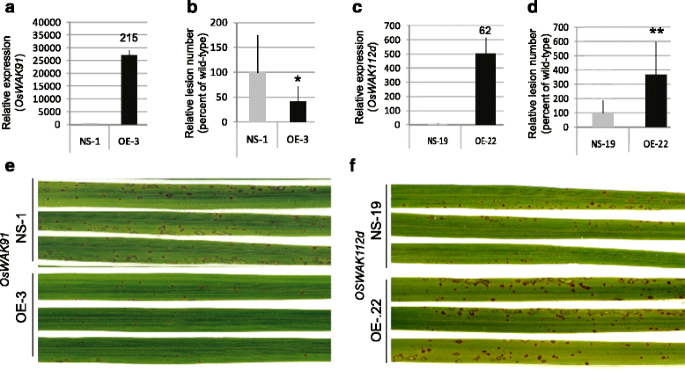
在用毒性菌株FR13感染后,所有10T0植物都在表达奥斯瓦克91与用空向量转换的植物相比,症状减少(附加文件4.a,b)。相比之下,过度表达OsWAK112d与空载体相比,基因易感性增加(附加文件4.C、 (D)。为了进一步分析这些抗病表型,选择了单位点插入系。在T1代,没有T-DNA的植株和有T-DNA的姊妹植株被鉴定,它们的种子被扩增,分别产生纯合的空分体(NS)和过表达系(OE)(图。3 a, b). OE和NS系接种中等毒力菌株M. Oryzae.孤立GY11。我们观察到OE的病变号减少Wak91.植物(60%;图。3C,E.)增加了OE-wak112d.植物(264%;图。3D,F.).因此,似乎过度表达奥斯瓦克91或者OsWAK112d改变了基础抗性,这两个基因对数量抗性的影响相反,与功能缺失突变体的表型一致。
奥斯瓦克91和OsWAK112d令人患的线条受到影响M. Oryzae.抵抗。表达奥斯瓦克91和OsWAK112d定量RT-PCR检测非感染过表达系(OE)奥斯瓦克91(A.)或者OsWAK112d(B)基因和相应的零偏析线(ns)。基因表达由三种生物重复计算,使用肌动蛋白标准化。还指示NS和OE之间的折叠变化(A.和B).用病毒的强毒分离物GY11接种植株M. oryzae。病变总数如图所示。2.排队等候-奥斯瓦克91(C)或OE -OsWAK112d(D).对于每个突变线,针对相应的过度迎膜和零偏析线计算超过7种植物的平均病变数。与含有含有零偏析植物的平均值相比,该值用于计算每个突变植物的病变百分比。然后计算平均值和标准偏差。该实验重复三次,并显示了一个代表性实验。进行T检验以评估观察到的差异的重要性(*:P <0.05; **:P <0.001). Pictures of typical symptoms on over-expresser and null-segregant lines were taken 5 days post inoculation (E和F).还生产并分析了其他几条令人越来越关注的线条(附加文件4.)
防御诱导in.奥斯瓦克91突变体行
进一步研究OE-部分耐药增加的特征Wak91.通过显微镜(附加文件)检查线、单个相互作用位点5.). 感染后第2天,侵入水稻表皮细胞的菌丝数仅在OE中略有减少-Wak91.在接种后3天,强烈减少了侵入多个细胞的真菌菌丝的比例。这些数据表明奥斯瓦克91过表达增强抗真菌渗透和影响在车前爆炸真菌的生长和/或侵袭新细胞。
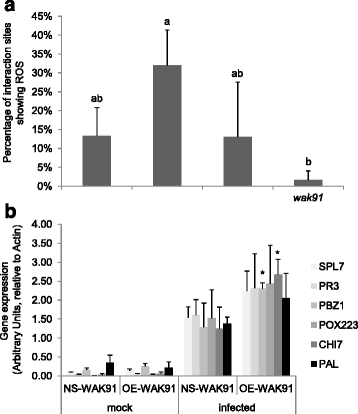
进一步了解如何奥斯瓦克91基因影响基础抗性,我们测定了几种基础抗性的分子标记奥斯瓦克91行(无花果。4.)接种后两天,真菌生长仅出现微小差异(补充文件5.).我们首先测试了氧化爆发,最早对真菌侵犯的反应之一受到影响。接种后两天,生产的生产2.O2.DAB染色结果显示,OE的阳性率是对照组的2倍-Wak91.线和两倍低的ko-Wak91.线与各自的对照相比(图。4A). 利用qRT-PCR检测防御标记基因,评价感染前后防御是否增强。接种前未检测到防御标记基因的表达有显著差异-Wak91.与控制线相比(图。4B.).相比之下,检测的一些标记物明显诱导OE-水平升高Wak91.植物48小时后接种(图。4B.).因此,我们可以将抗性的抗性水平增加 -Wak91.在3 dpi时可见,H增加2.O2.2 dpi时产生和防卫基因的诱导。
防御基因表达与H2.O2.OE生产-Wak91.线条。接种OE-WAK91系列M. Oryzae.(GY11中毒分离株),并在48 hpi时测定了植物的两个方面的防御反应:H2.O2.生产 (A.)及感染应答基因的表达(B).标准错误提供平均值(N = 4). 统计学差异采用单因素方差分析和Fischer's检验(A.)或Dunnett(B)测试:P <0.05(*),P <0.01 (**) andP< 0.001(* * *)。A.H2.O2.生产失去功能和OE-OsWAK91表达为显示DAB染色的感染部位(称为100)的感染部位(> 100的百分比。B防御相关基因在大鼠脑组织中的表达奥斯瓦克91超表达式(OE)和Null-Segregant(NS)线
讨论
的表达OsWAK几丁质在CEBiP受体的调控下诱导基因表达
以前的几份报告表明OsWAKs基因是在中调的转录环境M. Oryzae.感染[36].通过调查法规OsWAKs在早期感染步骤期间,在渗透之前M. Oryzae.,在耐药和易感植物中,我们确认五个选定OsWAK病毒的强毒株和非强毒株感染后基因表达差异M. Oryzae.(图。1a级). 我们发现OsWAK总体而言,数量抗性(与FR13分离株亲和性互作)的基因强度高于完全抗性(与CL367分离株不亲和性互作)。这与报告形成了鲜明对比OsWAK1基因在抗性植物中比在易感植物中更诱导[17].很有趣的是,OsWAK1基因属于另一种系统发育组OsWAKs此处测试(附加文件2.).这可以解释这些转录规则的这些差异。
这个奥斯瓦克91和OsWAK112d基因的特征在于在接种后早期的差异表达(2 HPI,渗透前)。这也与观察结果相比OsWAK1感染后诱导基因(16-24 HPI)[17].很明显的是,OsWAK112d在感染早期基因表达下调(图。1a级)和Vergne等人所预期的。[37]24h后轻度诱导。触发一些OsWAKs真菌穿透前的表达(< 24 hpi)表明真菌中存在的一个组成分子可以诱导这种表达。几丁质,一种已知能引起水稻防御的分子[5.)进行了测试。几丁质单独触发诱导奥斯瓦克90和奥斯瓦克91基因和抑制OsWAK112d基因(图。1b级),从而模拟感染期间观察到的事件(图。1a级).使用cebip公司突变后,我们发现几丁质对奥斯瓦克90和奥斯瓦克91,另一个较小的范围OsWAK测试,由CEBIP控制。因此OsWAK甲壳素的基因调节部分受到的影响cebip公司突变。测试Cerk1 [8.lyp4和lyp6 [47]需要突变体来确定这些其他几丁质受体是否参与触发OsWAKs表达式。AtWAK1和AtWAK2基因由FLG22略微下调[9,38]而AtWAKL基因被上调[39]. 同样,转录组分析表明ATWAKL10基因是由几丁质触发的[40].因此瓦克PAMPs基因调控似乎是植物的一个共同特征。
OsWAK水稻稻瘟病菌数量抗性的基因是必需的
现在有六份报告瓦克基因参与抗病性。在Dicots,几项研究报告了Wak在抗病抵抗中的作用:RFO1 / WAKL22[30,31],AtWAK1[9],SlWAK1[33].在大米方面,只有一种报道认为过度表达了OsWAK1基因增强了抵抗力M. Oryzae.[17].最近,两种QTL用于玉米的真菌疾病的抗抵抗力编码瓦克基因[20,32].我们的研究显示了四种因素的参与OsWAK稻瘟病抗性的基因显着延长了这份清单,并加强了这些受体样激酶在基底抗性中起核心作用的观点。实际上,我们表明三个功能突变体OsWAK14,奥斯瓦克91和奥斯瓦克92对稻瘟病真菌的毒性分离物具有降低的基础抗性(图。2.).两个独立的突变等位基因OsWAK14基因显示了类似的表型,表明,尽管缺乏互补分析,但OsWAK14是抗抗抗抗抗抗震稳定剂。事实如此奥斯瓦克91功能丧失表现为抵抗力降低,再加上奥斯瓦克91基因导致抗性增强(图。3 a, c, e)表明该基因也是抗抗抗性的正调节因子。无论奥斯瓦克92也是基础抗性的正向调节因子,有待进一步的遗传论证。
相当惊人,突变体OsWAK112d基因和过表达OsWAK112d基因分别导致抗性和敏感性增加。在感染时被抑制该基因的观察结果(图。1a级),这表示OsWAK112d是在感染期间压制水稻植物的基底抗性的负调节因子。同样,拟南芥LRR-RLKFERONIA基因被证明负调控参与基础防御的信号通路[48].因此,我们的结果延长了观察结果,即信号通路RLK的负调节可能是植物中的共同趋势。
迄今为止,大多数参与抗病的RLK的激酶结构域属于非RD组[4.], 包括OsWAK1.这是值得注意的OsWAKs在本研究中测试属于WAKb子组(附加文件2.)其特征在于RD类型的激酶结构域[49],就像所有已知的拟南芥都一样。因此,这项工作表明了几个OsWAK来自该WakB / RD激酶子组的基因也是水稻中爆炸真菌的定量抗性的调节因子。
奥斯瓦克91参与植物防御响应
测量H.2.O2.生产(图。4A)以及防御基因的表达(图。4B.)在奥斯瓦克91突变线表明该基因涉及对病原体的反应。这与在过度表达植物中观察到的增强的基底抗性水平一致(图。3 a, c, e).特别是植物的过度表达奥斯瓦克91显示增强型H.2.O2.生产和防御相关的基因表达。只有有限的证据表明WAK可以直接或间接调节防御 - 基因表达。的确,在他们的研究中,Zuo等人。[20]提供了一些证据表明(NPR1,PR5型和LOX1.)六个受试者中有一个在感染后被ZmWAK略微上调。我们的结果与这些微小的修改是一致的。与Zuo等人相比[20],我们没有观察到任何防御标记基因在接种前由过表达触发的表达增强奥斯瓦克91. 因此怪人可能有不同的方式来激活防御。
由他人提议[33],我们的数据支持这样一个模型,在这个模型中,识别像几丁质这样的PAMPs会导致OsWAKs以及质膜上OsWAK受体的增加。随后,病原体侵入产生的湿气可被OsWAK91识别,从而触发增强的免疫反应。该模型还需要进一步的实验来验证,例如对导弹防御反应进行广泛的时程分析wak91突变体。
结论
我们已经证明了OsWAK水稻对稻瘟病数量抗性所需的基因M. Oryzae..更重要的是,我们展示了四个OsWAK基因功能分析,一个是负调控。在拟南芥中,果胶可以结合AtWAK1和AtWAK2并激活信号转导[25].果胶是否需要测试在水稻中的类似作用。更一般地,现在通过使用本研究中描述的突变线,现在可以鉴定这些蛋白质蛋白识别的分子信号。
方法
鉴定wak突变体
鉴定了插入突变体和相应的空分离突变体(野生型)OsWAK在Nipponbare背景中的oryzatagline突变体系列中的基因[45,46].对每个插入株系,用PCR方法选择T2分离家族中的零突变株(纯合子系的同胞)和纯合子突变株。使用的引物在附加文件中给出6..将这些植物允许自我,并且通过PCR在T3产生中通过PCR证实基因型。
过度表达工厂的生产
完整的Lengh cDNA奥斯瓦克91和OsWAK112d通过使用从感染和未感染的Nipponbare植物的混合物中获得的cDNA(额外文件中的引物的CDNA通过RT-PCR扩增6.).PCR产物在PCAMBIA 2300OX中连接(由JC Breitler,Cirad)向量下的控制泛素促进剂,使用BP反应(网关)。在转换之前测序相应的矢量的插入物农杆菌肿瘤术(菌株EHA105)。将所得的Pubi :: Wak构建体转化为Nipponbare的水稻胚胎愈伤组织,并在含有200mg / L谷物蛋白的平板上选择转基因植物,400mg / L头孢噻吩和100mg / L万古霉素。将初级转化体(T0植物)移植到土壤中并使其自动。从T0植物中萃取来自T0植物的DNA,用于Southern印迹杂交以进行单一插入管线的筛选。通过PCR筛选得到的T1单次插入线以鉴定选择/不存在选择标记以鉴定呈现T-DNA的零偏析和兄弟姐妹。使这些T1植物自身,并将得到的纯合T2幼苗用于表型上M. Oryzae.感染。
真菌分离株,感染测定和脑蛋白处理
水稻和真菌的生长如Berruyer等人所述[50.]在28 - 30℃的光照条件下,进行12小时的光照处理。栽培稻L.)和三个分离株FR13、GY11和CL367(稻瘟病菌)被利用了。分离物CL367与日本血吸虫不相容,分离物FR13和GY11与日本血吸虫相容[44].对于疾病表型,典型的重复由4个突变体和4次含有4个含有的含有1L罐中的旁边生长的植物;通过喷涂25×10进行接种3.conidia / ml fr13或gy11分离物M. Oryzae.(相容菌株)而表达分析采用2 × 105.分生孢子/mL的FR13和CL367分生孢子悬浮液,在4周老植株底部的第4片叶子上(最后一片完全展开)。所有处理后的幼苗均置于相对湿度100%的黑暗中,在20-24℃下放置24 h。为了进行突变体表型分析,在感染后5天采集第4片叶片进行扫描,以观察和定量病变。我们通过灰色中心的存在或不存在来区分易感病变和耐药病变,这表明有孢子形成。
对于甲壳素治疗,用0.02%Tween 20(模拟),100μg/ ml或1000μg/ ml溶酶以0.02%吐温20喷洒3周龄Nipponbare植物(显示出三个完全扩张的叶子)。重复实验四次。这只甲壳素含有2至8种寡糖(YSK,Yaizu Suisankagaku工业)。第三,在治疗基因表达量化后,收获第三次,在液氮中冷冻在液氮中,在不同的时间点。
H2.O2.测量和基因表达分析
对于H.2.O2.测量,叶片片段在Vergne等人中被治疗。[37]使用DAB染色。将二氨基联苯胺(Sigma D-8001)溶解于1 mg/ml水中,将切下的叶子浸泡过夜(在黑暗中),并在室温下用乙醇/氯仿(4:1)清除组织过夜。对于定量RT-PCR应用,冷冻组织在液氮中研磨。取样在生长室中进行(在最初的24小时内,在接种暗室中以弱光进行)。每一个重复都是由至少4株同一基因型的植物组成的,并且这个设计被重复3到4次。然后按建议用1毫升TRIZOL(Invitrogen)处理约500微升粉末。DNA酶处理(Euromedex)后,RNA样品(5μg)在65℃下用oligo-dT变性5分钟18(3.5μm)和dntp(1.5μm)。然后在适当的缓冲液中用200μl,在37℃下在37℃下进行60分钟的逆转录转录60分钟。在适当的缓冲液中,200μl。然后使用两种微溶剂cDNA(稀释1/10)用于定量RT-PCR。定量RT-PCR混合物含有PCR缓冲液,DNTP(0.25mm),MgCl2.(2.5毫米),正向和反向引物(150,300或600nm最终浓度),1 u的热杆间聚合酶和Sybr Green PCR混合,根据制造商的建议(Eurogentec,比利时)。放大如下进行:95℃10分钟;40℃,95℃,62℃,1分钟,72℃为30秒;然后95℃持续1分钟,55℃持续30秒。使用MX3000P机(Stratagene)进行定量RT-PCR反应,并使用MX3000P软件提取数据。使用肌动蛋白(OS03G50890)作为内部对照标准化每个样品中的植物RNA的量。使用vergne等人所述的每个基因的测量效率进行基因表达。[37].使用的引物列表在附加文件中提供6..
缩写
- 潮湿:
-
损伤相关的分子模式
- 表皮生长因子:
-
表皮生长因子
- 地图:
-
丝裂原激活蛋白激酶
- 奥格:
-
oligogalacturonide.
- PAMP时:
-
病原体相关分子模式
- PRR:
-
模式识别受体
- PTI:
-
PAMP触发的免疫力
- RLK:
-
受体样激酶
- 活性氧:
-
活性氧物种
- WAK:
-
壁相关激酶
参考
- 1.
Macho AP,Zipfel C.植物PRR和先天免疫信号的激活。Mol细胞。2014; 54(2):263-72。
- 2.
博勒T,费利克斯G。激发子的复兴:模式识别受体对微生物相关分子模式和危险信号的感知。植物生物学年鉴。2009;60:379–406.
- 3.
植物模式识别受体。趋势Immunol。2014;35(7):345 - 51。
- 4.
Shiu Sh,Karlowski WM,Pan Rs,Tzeng YH,Mayer Kfx,Li Wh。拟南芥和稻米受体样激酶家族的比较分析。植物细胞。2004; 16:1220-34。
- 5.
Kaku H,Nishizawa Y,Ishii-Minami N,Akimoto-Tomiyama C,Dohmae N,Takio K,等。植物细胞识别通过血浆膜受体识别用于防御信号传导的几丁质片段。Proc Natl Acad Sci U S A. 2006; 103:11086-91。
- 6。
gómez-gómezl,瓶子T.FLS2:参与拟南芥细菌Elicitor鞭毛蛋白的感知的LRR受体样激酶。Mol细胞。2000; 5:1003-11。
- 7。
Miya A,Albert P,Shinya T,Desaki Y,Ichimura K,Shirasu K等。CERK1是一种LysM受体激酶,在拟南芥中是几丁质诱导子信号传导所必需的。美国国家科学院学报。2007;104:19613–8.
- 8。
Shimizu T,Nakano T,Takamizawa D,Desaki Y,Ishii Minami N,Nishizawa Y等两个LysM受体分子CEBiP和OsCERK1协同调控水稻中的几丁质诱导子信号。植物J。2010;64:204–14.
- 9。
Brutus A,Sicilia F,Macone A,Cervone F,De Lorenzo G.域交换方法揭示了植物壁相关激酶1(Wak1)作为寡聚菌尿酸酯的受体的作用。Proc Natl Acad Sci U S A. 2010; 107:9452-7。
- 10。
水稻胚乳细胞壁的果胶多糖。植物化学。1984;23:1425-9。
- 11
Hynes Ne,麦克唐纳德G. erbb受体和癌症信号通路。CurrOgin Cell Biol。2009; 21:177-84。
- 12
施莱辛格J。配体诱导、受体介导的EGF受体二聚化和活化。牢房。2002;110:669–72.
- 13
他Z-H,芝士曼I,他D,科霍恩B。5个细胞壁相关受体激酶基因Wak1–5在拟南芥的特定器官中表达。植物分子生物学。1999;39:1189–96.
- 14
是的,他是。细胞壁相关激酶(WAK)和WAK样激酶基因家族。植物生理学。2002;129:455–9.
- 15
张某,陈C,李L,孟L,辛格j,姜n等。进化膨胀,基因结构和水稻壁相关激酶基因家族的表达。植物理性。2005; 139:1107-24。
- 16。
Kohorn BD、Kohorn SL、Saba NJ、Martinez VM。拟南芥对果胶甲基酯酶的需求和对壁相关激酶激活的EDS1/PAD4依赖性应激反应的偏好。生物化学杂志。2014;289(27):18978–86.
- 17。
关键词:稻瘟病,抗稻瘟病,壁相关受体样蛋白激酶,OsWAK1植物学报。2009;69:337-46。
- 18。
他,何Dz,Kohorn Bd。在病原体反应期间对细胞壁相关受体激酶诱导表达的诱导表达。工厂J. 1998; 14:55-63。
- 19。
王宁,黄洪军,任st,李建军,孙勇,孙大勇,等。水稻壁相关受体样激酶基因OsDEES1在雌性配子体发育中起重要作用。植物杂志。2012;160(2):696 - 707。
- 20。
左伟,晁强,张宁,叶娟,谭刚,李斌,等。一种玉米细胞壁相关激酶对黑穗病具有定量抗性。Nat麝猫。2015;47:151-7。
- 21。
Park AR,Cho SK,Yun UJ,Jin MY,Lee SH,Sachetto Martins G等.拟南芥受体蛋白激酶Wak1与富含甘氨酸蛋白AtGRP-3的相互作用.生物化学杂志。2001;276:26688–93.
- 22。
BöhmH,Albert I,Fan L,Reinhard A,NürnbergerT.免疫受体络合物在植物细胞表面。CurrOp植物BIOL。2014; 20:47-54。
- 23。
Cabrera JC、Boland A、Messiaen J、Cambier P、Van Cutsem P。寡半乳糖醛酸的蛋盒构象:诱导子活性构象的时间依赖性稳定增加了其生物活性。糖生物学。2008;18:473–82.
- 24。
Decreux A, Thomas A, Spies B, Brasseur R, Van Cutsem P, Messiaen J.使用定点诱变技术体外鉴定壁相关激酶WAK1的半乳糖醛酸结合域。植物化学,2006;67:1068 - 79。
- 25。
Kohorn BD、Johansen S、Shishido A、Todorova T、Martinez R、Defeo E等。果胶对MAP激酶的激活和基因表达依赖于WAK2。植物J。2009;60(2):974–82.
- 26。
Kohorn BD,Kohorn S1,Todorova T,Baptiste G,Stansky K,McCullough M. Arabidopsis果胶结合壁相关激酶的主要等位基因诱导由MPK6而不是MPK3突变抑制的应力应答。莫尔植物。2012; 5(4):841-51。
- 27。
Kohorn BD,Kohorn SL.细胞壁相关激酶,WAKs,作为果胶受体。前植物科学。2012;3:88.
- 28.
Wagner-TA,Kohorn-BD.细胞壁相关激酶在植物发育过程中表达,是细胞扩张所必需的。植物细胞。2001;13:303–18.
- 29.
Kanneganti V,Gupta AK。RNA干扰介导的细胞壁相关激酶OsiWAK1的沉默栽培稻导致由于花药盲目而受损的根系开发和无菌性:来自奥古萨苜蓿的壁相关激酶。physiol mol biol植物。2011; 17(1):65-77。
- 30.
Diener AC,Ausubel FM。抗镰刀菌的抗性,占拟拟拟南芥抗病基因,不是种族特异性。遗传学。2005; 171(1):305-21。
- 31。
Häffnere,karlovsky p,splivallo r,Traczewska A,Diederichsen E.2.2.2.2A,水杨酸,脱落酸和茉莉酸调节拟南芥拟南芥的定量疾病抗性到长霉菌。BMC植物BIOL。2014; 14:85。
- 32。
胡尔尼等[1]研究了一种新型的聚类分析方法。玉米抗北方玉米叶枯病基因Htn1编码一个壁相关受体样激酶。美国国家科学院学报2015;112(28):8780-5。
- 33。
郑勇,马庞波,钟山,庞伟,费忠,等。基于转录组学的鞭毛蛋白诱导和被病原效应者抑制的基因筛选识别了一个涉及植物免疫的细胞壁相关激酶。基因组医学杂志。2013;14 (12):R139。
- 34。
SEO ys,Chern M,Bartley Le,Han M,Jung Kh,Lee I等。建立水稻应激反应互联蛋白酶。Plos Genet。2011; 7:E1002020。
- 35
Weiberg A,Wang M,Lin FM,Zhao H,Zhang Z,Kaloshian I,等。真菌小RNA通过劫持宿主RNA干扰途径抑制植物免疫。科学。2013;342(6154):118–23.
- 36
Bagnaresi P、Biselli C、OrrùL、Urso S、Crispino L、Abbruscato P等。持久抗性与易感水稻基因型对稻瘟病早期反应的比较转录组分析。公共科学图书馆一号。2012;第7章:e51609。
- 37
Vergne E,Ballini E,Marques S,Mammar BS,Droc G,Gaillard S等人。早期和特异性基因表达由稻米抗性基因PI33引发,响应ACE1无毒的毒药菌感染。新的植物学家。2007; 174:159-71。
- 38
Denoux C,Galletti R,Mammarella N,Gopalan S,Werck D,De Lorenzo G,等。拟南芥幼苗的OGS和FLG22 Elictors的防御响应途径激活。莫尔植物。2008; 1(3):423-45。
- 39
Zipfel C, Robatzek S, Navarro L, Oakeley EJ, Jones jtg, Felix G等。通过鞭毛蛋白感知拟南芥的细菌病害抗性。大自然。2004;428:764-7。
- 40
拟南芥壁相关激酶样10基因编码一个功能性鸟苷环化酶,并与病原体防御相关基因共表达。《公共科学图书馆•综合》。2010;5:e8904。
- 41
Vander P,Varum Km,Domard A,Eddine El Gueddari N,Moerschbacher BM。部分正乙酰化壳聚糖和幼磷酸核苷酸在小麦叶中引出抗性反应的能力的比较。植物理性。1998年; 118:1353-9。
- 42
关键词:稻瘟病菌,几丁质寡糖,抗稻瘟病菌abstract:植物j . 2010; 64:343-54。
- 43。
[2]张国栋,张国栋,张国栋,等。CEBiP是水稻中主要的几丁质寡聚物结合蛋白,在感知几丁质寡聚物中起主要作用。中国生物医学工程学报,2014;
- 44。
Delteil A,Blein M,Faivre-Rampant O,Guellim A,Estevan J,Hirsch J等人。建立突变资源研究水稻抗病抗性揭示了若干基因涉及防御的枢轴作用。莫尔植物途径。2012; 13(1):72-82。
- 45。
Larmande P, Gay C, Lorieux M, Perin C, Bouniol M, Droc G等。水稻标签系,基因植物插入系库的表型突变体数据库。核酸杂志2008;36:22 - 7。
- 46。
Sallaud C,Gay C,Larmande P,BèsM,Piffanelli P,Piégub等。水稻中的高通量T-DNA插入诱变:朝向硅逆向遗传学的第一步。工厂J. 2004; 39:450-64。
- 47。
Liu B,Li JF,Ao Y,Qu J,Li Z,Su J,等。赖氨酸基序包含蛋白质LYP4和LYP6,在水稻天然免疫中的肽聚糖和几丁质感知中起双重作用。植物细胞。2012;8:3406–19.
- 48。
Keinath NF,Kierszniowska S,Lorek J,Bourdais G,Kessler SA,Asano H,等。PAMP诱导的血浆膜隔层化变化揭示了植物免疫的新组分。J Biol Chem。2010; 285(50):39140-9。
- 49。
Dardick C,Ronald P.植物和动物病原体识别受体通过非RD激酶信号信号。PLOS POAROG。2006; 2(1):E2。
- 50.
Berruyer R,Adreit H,Milazzo J,Gaillard S,Berger A,DIOH W等人。PI33的鉴定和精细映射,对应于Magnaporthe Grisea Avirulence Gene ACE1的耐水稻抗性基因。Al Appl Genet。2003; 107:1139-47。
确认
我们感谢Loïc Fontaine对这些植物的照顾,感谢Delphine Mieulet提供来自OryzaTagLine库的突变种子。AD的研究得到了CIRAD和Région Languedoc-Roussillon的博士资助。EG得到了INRA- bap部门INRA博士后奖学金的支持。这项工作得到了来自Génoplante计划的IRMA赠款(ANR-07-GPLA-007)和来自ANR-Génomique计划的谷物防御赠款(ANR-09-GENM-106)的支持。
作者信息
隶属关系
通讯作者
附加信息
相互竞争的利益
提交人声明没有竞争利益。
作者的贡献
A.Delteil:表达,突变产生和表型,数据分析;例如:表达数据;BC:表达,ROS数据;JE:突变分析,表达;厘米;突变产生;Dievart:系统发育分析;TK:数据分析;JBM:实验设计,数据分析。所有作者都阅读并批准了手稿的最终版本。
附加文件
附加文件1:
稻瘟病菌侵染调控水稻WAKs。(PDF 35 kb)
附加文件2:
拟南芥的系统发育树瓦克和EGF-containingOsWAK从水稻基因。蛋白质组拟南芥蒂利亚纳(TAIR 9:33,200序列)和栽培稻(TIGR版本6.0:67393序列)从GreenPhyl数据库下载(http://www.greenphyl.org/cgi-bin/index.cgi.(Conte等。,2008)。我们找回了OsWAK基因进入三个步骤。首先,我们运行了HMMSearch程序(eddy,2009)以搜索Kinase隐马尔可夫模型(HMM)轮廓(PF00069.16)(Sonnhammer等。,1998年)拟南芥和橘子序列。我们检索了含有激酶基序的3185个蛋白质。在这组序列上,我们再次使用寻求此时间EGFS HMM配置文件的HMMSearch程序(PF00008.18,PF09120.1,PF07974.4,PF04863.4和PF07645.6)。从这个第二屏幕,我们检索了248个蛋白质(33来自拟南芥蒂利亚纳和215年从栽培稻).我们提取了这些蛋白质的激酶域序列,并将它们与来自Mafft网站的电子INS-I程序(默认参数)对齐(http://mafft.cbrc.jp/alignment/software/).基于该对齐,我们通过100个引导重复的最大似然方法生成了系统发育树。所有的基因瓦克明确包含EGF motif(s)和激酶结构域的签名,在树中分组,bootstrap值为86。这支分支之外的所有其他基因都被认为是外群。对系统发育树的所有操作都已使用treedyn程序(http://www.treedyn.org/).空圆圈:新注释OsWAK基因;黑色方块:OsWAK已知感染后差异表达的基因;空荡荡的广场:瓦克已知与真菌抗性有关的基因;星号:OsWAK具有ACF激酶结构域的基因。(PDF 59 kb)
附加文件3:
Wak插入突变体.A.为每一个OsWAK显示了不同的剪接形式以及T-DNA插入位点的位置。小箭头表示引物(附加文件6.)进行基因分型,定量RT-PCR检测基因表达的引物。B通过定量RT-PCR在突变株(MUT)和相应的空分离株(WT)中测定相应基因的转录水平。基因表达用肌动蛋白标准化。这些值代表基因表达的百分比,与WT(100%)相比;这些值是从三个生物复制品中计算出的平均值和标准偏差(PDF(97 kb)
附加文件4:
T0转基因植物的疾病症状过度表达奥斯瓦克91或者oswak112d。独特的水稻T0植株过表达奥斯瓦克91(A, B, C;以“OE”开头的5行)或OsWAK112d(D, E, F;以“OX”开头的6行)被生产出来。用空向量变换的植物也显示出来(A;以“EV”开头的4行)。使用Actin对转基因表达水平进行归一化处理,表示为任意单位(A, C)。由于每个值代表一个唯一的T0植株,所以表示的值是唯一的。考虑到空载体中极低的表达水平和变异性,在过表达系中非常高的值被认为是显著的。植物接种了有毒的分离株FR13稻瘟病菌病灶数目为7dpi(B,E)。症状的例子也显示(C,F)。面板A/B和C/D中的实验不是同时进行的,而是在两个单独的实验中进行的。因此,空载体之间的差异可归因于接种物压力的差异(A/B情况下更高)(PDF(2113 kb)
附加文件5:
OE的真菌生长Wak91.线条。接种WAK91过表达系M. Oryzae.(GY11中等毒力菌株),在接种后的指定时间点,在显微镜下观察真菌的发育阶段;计算了四类生长阶段(100个相互作用位点/条件)。本实验重复3次,差异显著(t检验;P <0.05) are shown by *. (PDF 104 kb)
额外的文件6:
用于本研究的引物。(PDF 66 KB)
权利和权限
开放存取本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用本文
Delteil,A.,Gobbato,E.,Cayrol,B。等。几种壁相关激酶在稻瘟病的基础防御中起正、负作用。BMC植物生物学16,17(2016)。https://doi.org/10.1186/s12870-016-0711-x
已收到:
认可的:
发表:
关键词
- 大米
- 壁相关激酶(WAK)
- 基础免疫
- 菌类