- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
油菜素内酯生物合成基因过表达gydF4y2Ba矮gydF4y2Ba通过激活卡尔文循环酶来提高番茄的光合能力gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba16gydF4y2Ba文章编号:gydF4y2Ba33gydF4y2Ba(gydF4y2Ba2016gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
油菜素内酯(brassinosteroids, BR)生物合成或信号转导的遗传操作是提高作物产量和品质的有效策略。然而,br促进生长与光合作用之间的关系以及br调节光合能力的确切机制尚不清楚。在这里,我们通过过度表达产生了转基因番茄植株gydF4y2Ba矮gydF4y2Ba并与BR生物合成突变体进行光合能力比较gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba和野生型。gydF4y2Ba
结果gydF4y2Ba
过度的gydF4y2Ba矮gydF4y2Ba促进净光合速率(gydF4y2BaPgydF4y2BaNgydF4y2Ba),而BR缺陷在gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba导致了显著的抑制gydF4y2BaPgydF4y2BaNgydF4y2Ba不同基因型中RuBisCO的激活状态、RuBisCO活化酶的蛋白含量和活性与内源性BR水平密切相关,而RuBisCO的总含量和转录本与内源性BR水平无关。内源性BR对果糖-1,6-二磷酸酶的表达及活性有正向调节作用。gydF4y2Ba矮gydF4y2Ba过表达增强了脱氢抗坏血酸还原酶和谷胱甘肽还原酶的活性,导致氧化还原状态降低,而BR缺乏具有相反的影响。BR诱导2-半胱氨酸过氧化物还蛋白含量降低,但不影响蛋白质含量。gydF4y2Ba
结论gydF4y2Ba
BR具有调节光合作用的作用。BR可以通过诱导还原状态来维持卡尔文循环酶的活化状态,从而提高光合能力。gydF4y2Ba
背景gydF4y2Ba
光合作用是植物生物量积累的基本基础。来自光合作用的糖为植物的生长提供了基石。此外,糖作为信号与激素信号通路相互连接,导致基因表达的重新编程和广泛的发育过程的激活[gydF4y2Ba1gydF4y2Ba- - - - - -gydF4y2Ba3.gydF4y2Ba].最近的研究表明,光合作用是提高作物产量潜力的主要限制因素[gydF4y2Ba4gydF4y2Ba].然而,栽培作物的光合速率远低于理论模型预测的最佳值[gydF4y2Ba4gydF4y2Ba].光合作用受限于碳水化合物的碳库需求、二磷酸核酮糖羧化酶/加氧酶(RuBisCO)羧化效率、光化学反应的量子产率和COgydF4y2Ba2gydF4y2Ba通过气孔和叶肉细胞扩散[gydF4y2Ba5gydF4y2Ba].此外,环境胁迫对自然栖息地高等植物的光合作用也有不利影响。因此,了解光合过程的调控机制对优化CO具有重要意义gydF4y2Ba2gydF4y2Ba同化,提高作物的产量潜力。gydF4y2Ba
大量的证据表明,植物的光合能力受激素内稳态或信号转导的影响。低水平的乙烯促进植物生长[gydF4y2Ba6gydF4y2Ba],而乙烯不敏感会导致RuBisCO表达和光合能力的下调[gydF4y2Ba7gydF4y2Ba].赤霉素(gibberellin, GA)生物合成和失活相关基因表达的改变分别导致生物量积累增加和减少,在全株水平上与光合速率呈正相关[gydF4y2Ba8gydF4y2Ba].此外,GA在增强光合活性方面起着积极的作用,至少部分是通过调节叶绿体的发育[gydF4y2Ba9gydF4y2Ba].脱落酸(ABA)是一种著名的气孔关闭调节剂,它通过增加CO的限制来降低光合作用gydF4y2Ba2gydF4y2Ba扩散(gydF4y2Ba10gydF4y2Ba].此外,ABA是维持光化学猝灭和适应非生物胁迫所必需的[gydF4y2Ba11gydF4y2Ba].然而,我们对激素介导的光合作用调节机制的了解仍然是零散的。gydF4y2Ba
油菜素内酯(Brassinosteorids, BRs)是植物中的一组类固醇[gydF4y2Ba12gydF4y2Ba].BRs几乎参与了植物生命中所有的发育过程[gydF4y2Ba13gydF4y2Ba].BR生物合成和信号转导突变体的鉴定,深入剖析了BR作为植物激素的作用,为揭示BR信号转导机制铺平了道路[gydF4y2Ba14gydF4y2Ba].尽管对BR信号通路有了详细的了解,但目前还不清楚BR到底是如何控制生长的。转基因水稻过表达BR生物合成基因的特性表明,BR调节籽粒灌浆,提高产量[gydF4y2Ba15gydF4y2Ba].大米gydF4y2Ba小grain1gydF4y2Ba该突变体含有丝裂原活化蛋白激酶激酶4的突变,显示细胞增殖缺陷和BR反应降低[gydF4y2Ba16gydF4y2Ba].既往研究表明BR通过对细胞周期蛋白D的转录调控促进细胞分裂[gydF4y2Ba17gydF4y2Ba].然而,br促进生长与光合作用之间的关系尚不清楚。gydF4y2Ba
过表达BR生物合成基因的水稻增产与CO增加有关gydF4y2Ba2gydF4y2Ba同化率和增强的同化物流向谷物[gydF4y2Ba15gydF4y2Ba].反义抑制gydF4y2BaCPDgydF4y2Ba基因是BR生物合成的关键,导致CO的减少gydF4y2Ba2gydF4y2Ba同化(gydF4y2Ba18gydF4y2Ba].但目前尚不清楚转基因株系光合能力下降的原因是碳水化合物代谢的改变、光化学反应量子产率的降低还是卡尔文循环的抑制。通过外源BR或其生物合成抑制剂,我们发现BR通过激活RuBisCO在调控光合作用中起着至关重要的作用[gydF4y2Ba19gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].然而,遗传证据仍然缺乏。在本研究中,我们获得了过表达BR生物合成基因的转基因番茄植株gydF4y2Ba矮gydF4y2Ba并对转基因株系和BR生物合成突变体与野生型的光合能力进行了比较。结果表明,植物的BR水平与光合能力密切相关。br促进光合能力与增强抗氧化能力和降低细胞氧化还原状态有关。提出了BR通过对卡尔文循环酶的氧化还原调节促进光合作用的潜在机制。gydF4y2Ba
方法gydF4y2Ba
转化和植物生长条件gydF4y2Ba
的gydF4y2Ba矮gydF4y2BaPCR扩增自番茄(gydF4y2Ba茄属植物lycopersicumgydF4y2BaL. cv Condine Red),根据已发表的序列,使用正向引物5 ' -GGGGTACCCCATGGCCTTCTTC-3 '和反向引物5 ' -GCTCTAGAGCTTAGTGAGCTGAAAC-3 ' (Sol基因组网络登录Solyc02g089160.2)。在转化过程中,我们使用了携带大分子霉素耐药基因的二元载体pMV2进行细菌筛选,携带新霉素磷酸酶II基因进行转化植株筛选[gydF4y2Ba21gydF4y2Ba].构造二值向量是通过插入gydF4y2Ba矮gydF4y2Ba花椰菜花叶病毒35S启动子驱动意义定向KpnI和XbaI位点的cDNA分析gydF4y2Ba根癌土壤杆菌gydF4y2Ba用菌株C58介导载体导入番茄康定红愈伤组织。转基因植株在含卡那霉素的选择培养基上筛选再生苗后,以基因组DNA为模板,采用35S正向引物和基因特异性反向引物进行PCR验证。选择两条线(DWF:OX2和DWF:OX3)进行实验。gydF4y2Ba
比较野生型BR合成突变体Condine Red (CR)的光合能力gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba(在CR背景下),使用DWF:OX2和DWF:OX3。的gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba该突变体来源于番茄遗传资源中心(加州大学戴维斯分校,CA, USA, accession LA0571)。在泥炭和蛭石(1:1,v/v)的混合溶液中,200 μmol m光照16 hgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba;(25°C)和8小时的黑暗(20°C)周期。实验用的是两个月大的植物。为了测定卡尔文循环酶活性,采集不同基因型的叶盘,立即在液氮中冷冻,并在分析前保存在-80°C。抗氧化酶活性以鲜重为准,基因表达量以全叶为准。gydF4y2Ba
叶片气体交换和叶绿素荧光分析gydF4y2Ba
对6gydF4y2BathgydF4y2Ba使用开放式气体交换系统(LI-6400;)。测量时间为上午8点至11点。同化和细胞间COgydF4y2Ba2gydF4y2Ba浓度(A/Ci)曲线根据von Caemmerer和Farquhar [gydF4y2Ba22gydF4y2Ba].最大核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCO)羧化率(gydF4y2BaVgydF4y2Bac,马克斯gydF4y2Ba和最大核酮糖-1,5-二磷酸(RuBP)再生率(gydF4y2BaJgydF4y2Ba马克斯gydF4y2Ba),采用Ethier和Livingston所描述的方法从A/Ci曲线估计[gydF4y2Ba23gydF4y2Ba].gydF4y2Ba
采用Dual-PAM-100系统(Walz, Germany)分析慢速动力学曲线,确定叶绿素荧光参数。当植株适应暗环境30 min后开始分析,打开测量束获得初始荧光(Fo),施加0.8 s的饱和脉冲(>10000 μmol m)获得最大荧光(Fm)gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba).荧光信号衰减20s后,光化光(280 μmol mgydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba)开关300 s,在此期间,饱和脉冲每20s施加一次。记录饱和脉冲前的稳态荧光(Fs)和光照下的最大荧光(Fm’)。光照下的最小荧光(Fo’)由Baker [gydF4y2Ba24gydF4y2Ba].PSII的最大量子子产率(Fv/Fm), PSII的实际量子子产率(ФgydF4y2BaPSIIgydF4y2Ba)、天线激励转移效率(Fv ' /Fm ')和光化学猝灭系数(qP)分别计算为(Fm-Fo)/Fm、(Fm ' -Fs)/Fm '、(Fm ' -Fo ')/Fm '和(Fm ' -Fs)/(Fm ' -Fo ')。gydF4y2Ba
内源BRs、总叶绿素和可溶性蛋白含量测定gydF4y2Ba
内源BRs的测定采用固相萃取-双层抽提-高效液相色谱-串联质谱[gydF4y2Ba25gydF4y2Ba].BRs及其代谢物的测定,(gydF4y2Ba2gydF4y2BaHgydF4y2Ba3.gydF4y2Ba) castasterone (D-Cs)及(gydF4y2Ba2gydF4y2BaHgydF4y2Ba3.gydF4y2Ba)油菜素内酯(D-BL)加入1 g叶片样品的提取液中。叶绿素含量测定采用Arnon [gydF4y2Ba26gydF4y2Ba].总可溶性蛋白含量使用Bradford试剂(Bio-Rad, Hercules, California)测定。gydF4y2Ba
Western-blot检测rbcL、rcs、RCAgydF4y2Ba
蛋白质从叶子样本中提取,如前所述[gydF4y2Ba20.gydF4y2Ba].对于Western-blot分析,使用12.5% (w/v)丙烯酰胺凝胶通过SDS-PAGE分离蛋白,并电泳转移到硝化纤维素膜(Millipore, Saint-Quentin, France)。用抗rbcL、rbcS和RCA的商业抗体(Agrisera, Vannes, Sweden)检测蛋白。gydF4y2Ba
2-半胱氨酸过氧化物还蛋白的非还原SDS-PAGE和western blot分析gydF4y2Ba
2-半胱氨酸过氧化物酶(2-CP)的检测方法为:用含100mm HEPES、pH 7.5、5mm EDTA、5mm EGTA、10mm Na的缓冲液提取样品gydF4y2Ba3.gydF4y2BaVO4, 10 mM NaF, 50 mM β-甘油磷酸,1 mM苯基甲基磺酰氟,10%甘油,7.5%聚乙烯聚吡咯烷酮(PVP), 10 mM二硫苏糖醇(DTT)和10 mM n -乙基马来酰亚胺(NEM,巯基封闭试剂)。研磨后的样品在13 000 g的条件下离心20分钟。为了分析2-CP的氧化还原状态,DTT在提取缓冲液中被省略,如前所述[gydF4y2Ba27gydF4y2Ba].蛋白质样品(15 μg)添加5×负载缓冲液[225 mM Tris-HCl, pH 6.8, 5% (w/v) SDS, 50%甘油,0.05 %溴酚蓝],通过12% SDS- page分离,通过western blot检测2-CP,如前文所述[gydF4y2Ba28gydF4y2Ba研究了一种抗2-CP的多克隆抗体(北京蛋白质创新公司,北京,中国)。gydF4y2Ba
RuBisCO、RuBisCO活化酶(RCA)、FBPase活性测定gydF4y2Ba
Ward和Keys[通过耦合3-磷酸甘油酸生成与NADH氧化,用分光光度法测定RuBisCO活性[gydF4y2Ba29gydF4y2Ba],并做了一些修改。用提取缓冲液(50 mM HEPES, pH 8.0, 1 mM EDTA, 10 mM MgCl)匀浆叶片gydF4y2Ba2gydF4y2Ba, 2%不溶性PVPP和10 mM β-巯基乙醇)。匀浆量为15000g, 4℃离心15min。粗提物在0.1 ml含50 mM HEPES (pH 8.0)和26.6 mM MgCl的活化混合物中被激活后,测定总活性gydF4y2Ba2gydF4y2Ba和16.6 mM NaHCOgydF4y2Ba3.gydF4y2Ba在28℃下放置15分钟。在0.1 ml含50 mM HEPES-NaOH (pH 8.0)和10 mM NaHCO的反应介质中测定RuBisCO的初始活性gydF4y2Ba3.gydF4y2Ba, 20mm氯化镁gydF4y2Ba2gydF4y2Ba, 1u肌酸磷酸激酶,1u 3-磷酸甘油磷酸激酶,1u甘油醛3-磷酸脱氢酶,0.5 mM ATP, 0.015 mM NADH, 0.5 mM磷酸肌酸和0.06 mM RuBP。在340 nm处观察吸光度变化90 s。使用RuBisCO活化酶测定试剂盒(Genmed scientific, Washington, DC, USA)测定RCA活性。简单地说,0.2 g叶片样品在15 ml的含液体N的试管中迅速研磨gydF4y2Ba2gydF4y2Ba.然后加入500 μL裂解缓冲液。混合物被涡旋和均质化。将匀浆转移到1.5 ml的epppendorf管中,300 g, 4°C离心5 min。取上清液,移入新的epppendorf管,以1000 g离心,4℃10 min。取上清液,200 μL裂解缓冲液悬浮颗粒。悬液用于RCA活性测定。在ATP存在或不存在的情况下,用酶提取物孵育失活的RuBisCO后,根据RuBisCO活性测定RCA活性。采用耦合分光光度法测定RuBisCO活性。gydF4y2Ba
FBPase活性通过在340 nm处监测吸收,使用6.2 mM的消光系数来测定gydF4y2Ba−1gydF4y2Ba厘米gydF4y2Ba−1gydF4y2Ba[gydF4y2Ba30.gydF4y2Ba].粗提物在0.1 ml含100 mM DTT、2 mM果糖-1,6-二磷酸(FBP)、10 mM MgCl的活化混合物中被活化后,测定总活性gydF4y2Ba2gydF4y2Ba, 0.1 M Tris-HCl (pH 8.0)。匀浆后立即测定初始活性。实验混合物由0.1 M HEPES (pH 8.0), 0.5 mM Na组成gydF4y2Ba2gydF4y2BaEDTA, 10毫米氯化镁gydF4y2Ba2gydF4y2Ba, 0.3 mM NADPgydF4y2Ba+gydF4y2Ba, 0.6 mM FBP, 0.6 u来自烘焙酵母(Sigma, Santa Clara, CA, USA)的葡萄糖-6-磷酸脱氢酶,1.2U来自烘焙酵母(Sigma, Santa Clara, CA, USA)的葡萄糖-磷酸异分酶,100 μl酶提取物,最终体积为1ml。gydF4y2Ba
谷胱甘肽和抗坏血酸含量的测定gydF4y2Ba
为了测定还原性谷胱甘肽(GSH)和氧化性谷胱甘肽(GSSG),植物叶片组织(0.3 g)在2 ml含2 mM EDTA的6%偏磷酸中匀浆,在4℃下12 000 g离心10分钟。用0.5 M磷酸盐缓冲液(pH 7.5)中和后,将0.1 ml上清加入0.2 mM NADPH、100 mM磷酸盐缓冲液(pH 7.5)、5 mM EDTA和0.6 mM 5,5 ' -二硫双(2-硝基苯甲酸)的反应混合物中。加入3U来自酵母(Sigma, Santa Clara, USA)的谷胱甘肽还原酶(GR)启动反应,并通过在412 nm处测量1分钟的吸光度变化来监测反应。对于GSSG测定,在中和的上清液中添加40 μl 2-乙烯基吡啶来掩盖GSH,而在总谷胱甘肽测定中添加40 μl水。GSH浓度由总浓度减去GSSG浓度得到[gydF4y2Ba31gydF4y2Ba].gydF4y2Ba
AsA-GSH循环中酶活性的测定gydF4y2Ba
为了测定AsA-GSH循环中涉及的酶的活性,将0.3 g的叶片组织(0.3 g)置于3 ml冰冷缓冲液中,其中含有25 mM HEPES (pH 7.8)、0.2 mM EDTA、2 mM抗坏血酸和2% PVP。匀浆12 000 g, 4℃离心20 min,取上清液测定酶活性。脱氢抗坏血酸还原酶(DHAR)活性通过测量265 nm处吸光度的增加来评估,如Nakano和Asada所述[gydF4y2Ba32gydF4y2Ba].根据Halliwell和Foyer描述的方法,根据340 nm处吸光度的下降来测定GR活性[gydF4y2Ba33gydF4y2Ba].所有分光光度分析均在SHIMADZU UV-2410PC分光光度计(SHIMADZU Corporation, Kyodo, Japan)中进行。gydF4y2Ba
总RNA提取及基因表达分析gydF4y2Ba
根据制造商提供的说明书,使用TRIZOL试剂(Sangon, Shanghai, China)从番茄叶片中分离总RNA。提取后,将总RNA溶解于无rnase水中。使用ReverTra Ace qPCR RT Kit (Toyobo, Osaka, Japan),从2 μg总RNA中合成qRT-PCR cDNA模板。gydF4y2Ba
采用iQ SYBR Green SuperMix (Bio-Rad, Hercules, CA, USA)扩增产物25 μl进行qRT-PCR分析。采用iCycleriQ 96井实时PCR检测系统(Bio-Rad, Hercules, CA, USA)进行PCR,循环条件为:95°C变性3分钟,然后在95°C变性30秒,58°C退火30秒,72°C延伸30秒,循环40次。番茄gydF4y2Ba肌动蛋白gydF4y2Ba吉恩被用作内部控制。用于qRT-PCR分析的引物列在附加文件中gydF4y2Ba1gydF4y2BaS1:表。按照Livak和Schmittgen的方法计算相对基因表达[gydF4y2Ba34gydF4y2Ba].gydF4y2Ba
统计分析gydF4y2Ba
试验设计为完全随机区组设计,4个重复。每个复制包含10株植物。采用SPSS统计软件(ver.19.0, SPSS Inc., Chicago, IL, USA)进行统计分析,采用单因素方差分析(ANOVA)。为了评估治疗效果,Tukey’s test (gydF4y2BaPgydF4y2Ba< 0.05)。gydF4y2Ba
结果gydF4y2Ba
BRs推广有限公司gydF4y2Ba2gydF4y2Ba番茄植物的同化gydF4y2Ba
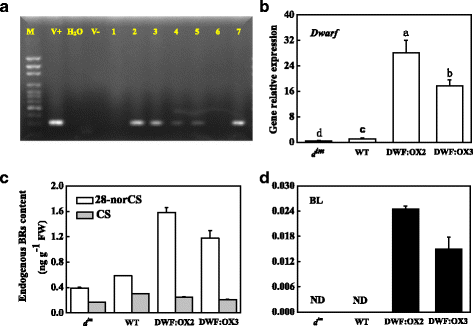
为了研究内源性BRs在光合作用调控中的作用,我们过表达gydF4y2Ba矮gydF4y2Ba在番茄植株中编码CYP85A1基因催化6-脱氧castasterone转化为castasterone,获得多个独立的转基因株系(图;gydF4y2Ba1gydF4y2Ba).PCR证实转基因株系中存在35S启动子。结合转基因表达水平,选择DWF:OX2和DWF:OX3两个株系进行进一步研究。qPCR分析表明,其表达gydF4y2Ba矮gydF4y2BaDWF:OX2和DWF:OX3的表达分别增强28倍和17倍以上,而gydF4y2Ba死亡。gydF4y2Ba60%gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba突变体与野生型(WT)相比。对BR生物合成前体的分析表明,转基因株系中28-norCS (28-norcastasterone)含量显著增加,而(castasterone)含量略有降低。28-norCS和CS含量均下降gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba突变体。在我们的研究中,两者均未检测到油菜素内酯(BL)gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba和野生型植物,但在两者中都可检测到gydF4y2Ba矮gydF4y2Baoverexpressing线。gydF4y2Ba
缺陷突变体的BR生物合成能力gydF4y2Ba矮gydF4y2Ba(gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba)、野生型(WT)和gydF4y2Ba矮gydF4y2Ba过表达线(DWF:OX2和DWF:OX3)。gydF4y2Ba一个gydF4y2Ba用PCR方法确认所选品系中存在转基因。M, 100bp标记;V +,转换向量;V-,野生型植物基因组DNA;1-7,选定株系。gydF4y2BabgydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba矮gydF4y2BaBR生物合成前体的转录和积累。萌发后45d采收叶片,进行基因表达和BRs含量分析。数据是4个独立生物样本的平均值±标准差。根据Tukey的检验,相同字母表示的平均值没有显著差异(gydF4y2BaPgydF4y2Ba< 0.05)。CS, castasterone;28-norCS 28-norcastasterone;提单,油菜素内酯gydF4y2Ba
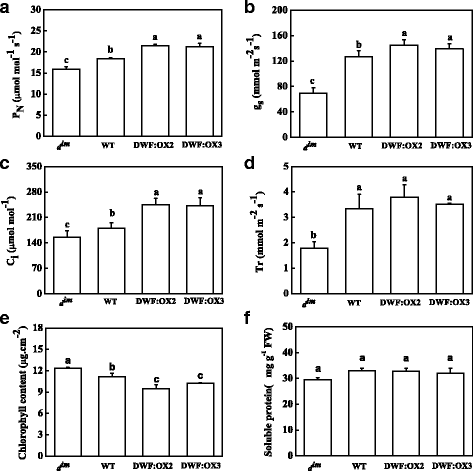
理解的要求gydF4y2Ba矮gydF4y2Ba对于光合作用,我们首先比较了气体交换参数gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba, WT和gydF4y2Ba矮gydF4y2Baoverexpressing线。结果表明,BR生物合成缺陷显著抑制了净光合速率(gydF4y2BaPgydF4y2BaNgydF4y2Ba)gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba与WT相比(图1)gydF4y2Ba2gydF4y2Ba).气孔导度(ggydF4y2Ba年代gydF4y2Ba),细胞间有限公司gydF4y2Ba2gydF4y2Ba浓度(CgydF4y2Ba我gydF4y2Ba)和蒸腾速率(Tr)显著降低gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba突变体。同时,与野生型植物相比gydF4y2BaPgydF4y2BaNgydF4y2Ba和CgydF4y2Ba我gydF4y2BaDWF:OX2和DWF:OX3显著升高。然而,克gydF4y2Ba年代gydF4y2Ba和Tr均未受显著影响(图2)。gydF4y2Ba2b c dgydF4y2Ba).叶绿素总含量gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba与WT相比,突变体显著增加,而转基因系显著减少(图4)。gydF4y2Ba2 egydF4y2Ba),说明BR对光合作用的促进与叶绿素和/或光吸收能力无关。可溶性总蛋白含量在各品种间无显著差异gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba, WT和gydF4y2Ba矮gydF4y2Baoverexpressing行(无花果。gydF4y2Ba2 fgydF4y2Ba),表明br促进光合作用可能与氮同化无关。gydF4y2Ba
的影响gydF4y2Ba矮gydF4y2Ba基因过表达(DWF:OX2和DWF:OX3)和突变(gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba)的净光合速率(gydF4y2BaPgydF4y2BaNgydF4y2Ba), (gydF4y2Ba一个gydF4y2Ba),气孔导度(ggydF4y2Ba年代gydF4y2Ba), (gydF4y2BabgydF4y2Ba),细胞间有限公司gydF4y2Ba2gydF4y2Ba浓度(CgydF4y2Ba我gydF4y2Ba), (gydF4y2BacgydF4y2Ba),蒸腾速率(Tr), (gydF4y2BadgydF4y2Ba)、总叶绿素含量(gydF4y2BaegydF4y2Ba)及可溶性蛋白质含量(gydF4y2BafgydF4y2Ba).数据是用SDs进行4次重复的平均值。根据Tukey的检验(gydF4y2BaPgydF4y2Ba< 0.05)gydF4y2Ba
BRs可提高RuBP的光化学量子产率和体内RuBP的羧基化和再生能力gydF4y2Ba
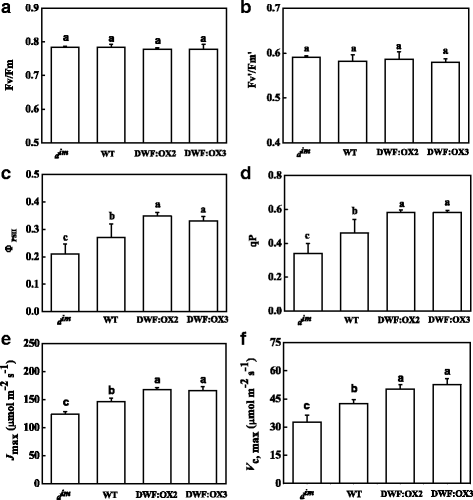
为了进一步研究BR对光合作用的调控机制,我们通过分析叶绿素荧光来揭示光系统II (PSII)的功能状态。结果表明,至少在本研究正常条件下,不同基因型PSII的最大量子产率(Fv/Fm)不受内源BR水平的影响,这反映了光抑制PSII的作用(图2)。gydF4y2Ba3gydF4y2Ba).同样,天线激励传递效率(Fv ' /Fm ')不受BR水平的影响,说明BR水平对PSII天线的能量耗散没有影响(图2)。gydF4y2Ba3 bgydF4y2Ba).与的变化一致gydF4y2BaPgydF4y2BaNgydF4y2Ba, PSII的实际量子子产率(ФgydF4y2BaPSIIgydF4y2Ba)被抑制在gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba,而ФgydF4y2BaPSIIgydF4y2Ba与WT相比,DWF:OX2和DWF:OX3明显增加。gydF4y2Ba3 cgydF4y2Ba).反映PSII能输电子的比例的光化学猝灭系数(qP)的变化与Ф的变化密切相关gydF4y2BaPSIIgydF4y2Ba,暗示CO的调控gydF4y2Ba2gydF4y2BaBR的同化速率和PSII电子传递最可能归因于NADPH和ATP的需求(图。gydF4y2Ba3 dgydF4y2Ba).gydF4y2Ba
的影响gydF4y2Ba矮gydF4y2Ba基因过表达(DWF:OX2和DWF:OX3)和突变(gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba)对PSII最大量子产率的影响(Fv/Fm), (gydF4y2Ba一个gydF4y2Ba),天线激励传输效率(Fv ' /Fm '), (gydF4y2BabgydF4y2Ba), PSII的实际量子子产率(ФgydF4y2BaPSIIgydF4y2Ba), (gydF4y2BacgydF4y2Ba),光化学猝灭系数(qP), (gydF4y2BadgydF4y2Ba最大核酮糖-1,5-二磷酸(RuBP)再生率(gydF4y2BaJgydF4y2Ba马克斯gydF4y2Ba), (gydF4y2BaegydF4y2Ba和最大核酮糖-1,5-二磷酸羧化酶/加氧酶(RuBisCO)羧化率(gydF4y2BaVgydF4y2Bac,马克斯gydF4y2Ba), (gydF4y2BafgydF4y2Ba).数据是用SDs进行4次重复的平均值。根据Tukey的检验(gydF4y2BaPgydF4y2Ba< 0.05)gydF4y2Ba
接下来,我们独立测定了RuBisCO的体内羧化效率(gydF4y2BaVgydF4y2Bac,马克斯gydF4y2BaRuBP的再生速率(gydF4y2BaJgydF4y2Ba马克斯gydF4y2Ba),安装空调gydF4y2Ba我gydF4y2Ba使用Farquhar模型的曲线。结果表明,BR生物合成的缺陷抑制了其活性gydF4y2BaVgydF4y2Bac,马克斯gydF4y2Ba而且gydF4y2BaJgydF4y2Ba马克斯gydF4y2Ba在gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba,而gydF4y2Ba矮gydF4y2Ba超表达显著增加gydF4y2BaVgydF4y2Bac,马克斯gydF4y2Ba而且gydF4y2BaJgydF4y2Ba马克斯gydF4y2Ba与WT相比(图1)gydF4y2Ba3 egydF4y2Ba而且gydF4y2BafgydF4y2Ba).gydF4y2Ba
BR促进了卡尔文循环酶的活性gydF4y2Ba
为了更好地了解br调控光合作用的机制,我们分析了RuBisCO和果糖1,6-二磷酸酶(FBPase)的酶活性,这是RuBP再生的关键。结果表明,内源性BR水平的变化对RuBisCO的总活性没有影响(图;gydF4y2Ba4gydF4y2Ba).然而,BR水平调控RuBisCO的初始活性的方式类似于gydF4y2BaVgydF4y2Bac,马克斯gydF4y2Ba在不同基因型中,导致转基因株系RuBisCO活化状态的增加和减少gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba分别突变(无花果。gydF4y2Ba4 b和cgydF4y2Ba).与RuBisCO的激活状态一致,RCA活性在gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba,转基因株系中表达上调(图3)。gydF4y2Ba4 dgydF4y2Ba).与RuBisCO相比,BR在gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba显著抑制FBPase总活性,而转基因株系的高BR水平使FBPase活性显著升高。此外,FBPase的初始活性也受到BR水平的类似调控(图。gydF4y2Ba4 e和fgydF4y2Ba).gydF4y2Ba
的影响gydF4y2Ba矮gydF4y2Ba基因过表达(DWF:OX2和DWF:OX3)和突变(gydF4y2BadgydF4y2Ba即时通讯gydF4y2BaRuBisCO的总羧化活性和初始羧化活性(gydF4y2Ba一个gydF4y2Ba而且gydF4y2BabgydF4y2Ba, RuBisCO的激活状态(gydF4y2BacgydF4y2Ba, RuBisCO活化酶的活性(gydF4y2BadgydF4y2Ba),以及果糖1,6-二磷酸酶(FBPase)的总活性和初始活性(gydF4y2BaegydF4y2Ba而且gydF4y2BafgydF4y2Ba).数据是用SDs进行4次重复的平均值。根据Tukey的检验(gydF4y2BaPgydF4y2Ba< 0.05)gydF4y2Ba
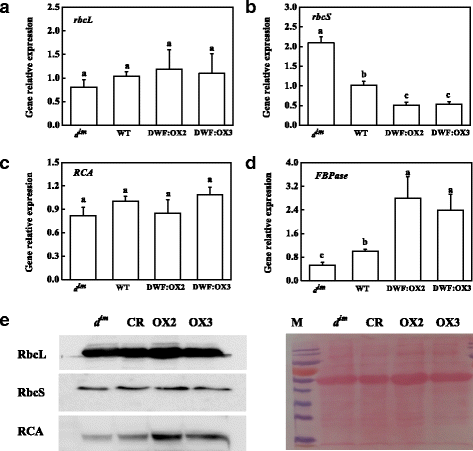
卡尔文循环酶基因表达分析表明,卡尔文循环酶mRNA水平稳定gydF4y2Ba:gydF4y2Ba,gydF4y2Ba红细胞表面gydF4y2Ba而且gydF4y2Ba美国广播公司gydF4y2Ba,分别编码RuBisCO大亚基、小亚基和激活酶,与酶活性不一致(图。gydF4y2Ba5gydF4y2Ba- - - - - -gydF4y2BadgydF4y2Ba).内源性BR水平对mRNA水平无影响gydF4y2Ba:gydF4y2Ba而且gydF4y2Ba美国广播公司gydF4y2Ba.与Rubisco活性相比,BR缺乏gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba导致上调gydF4y2Ba红细胞表面gydF4y2Ba,而转基因株系中较高的BR水平抑制了gydF4y2Ba红细胞表面gydF4y2Ba.有趣的是,FBPase的mRNA水平与酶活性呈正相关,表明BR在转录水平上调控FBPase。gydF4y2Ba
的影响gydF4y2Ba矮gydF4y2Ba基因过表达(DWF:OX2和DWF:OX3)和突变(gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba编码RuBisCO大基因的相对转录水平(gydF4y2Ba:gydF4y2Ba)和小型(gydF4y2Ba红细胞表面gydF4y2Ba)亚基(gydF4y2Ba一个gydF4y2Ba而且gydF4y2BabgydF4y2Ba)、RuBisCO活化酶(gydF4y2Ba美国广播公司gydF4y2Ba) (gydF4y2BacgydF4y2Ba果糖1,6-二磷酸酶(gydF4y2BaFBPasegydF4y2Ba) (gydF4y2BadgydF4y2Ba).数据是用SDs进行4次重复的平均值。根据Tukey的检验(gydF4y2BaPgydF4y2Ba< 0.05)。western blot检测对rbcL、rbcS和RCA蛋白水平的影响(gydF4y2BaegydF4y2Ba)gydF4y2Ba
western blot检测rbcL、rbcS和RCA的蛋白含量与转录水平不同。内源性BR水平对rbcL和rbcS蛋白水平无影响,与RuBisCO总活性一致(图2)。gydF4y2Ba5 egydF4y2Ba).然而,BR在gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba和超表达gydF4y2Ba矮gydF4y2Ba导致RCA蛋白质含量分别降低和增加。gydF4y2Ba
BR诱导氧化还原状态gydF4y2Ba
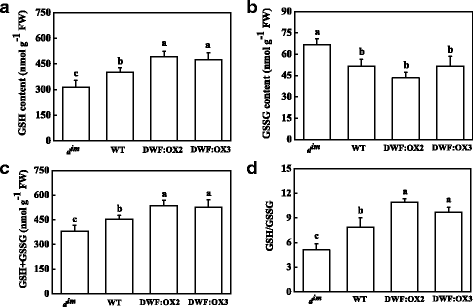
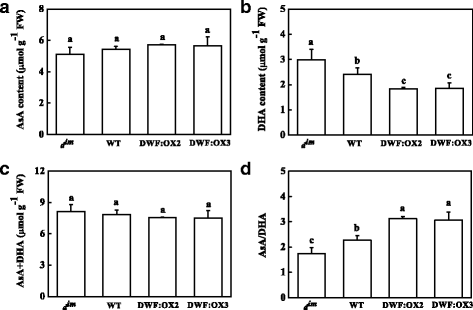
卡尔文循环酶是众所周知的调节氧化还原后翻译修饰。为了进一步研究BR调控RuBisCO和RCA活性的机制,我们分析了谷胱甘肽和抗坏血酸的含量和氧化还原状态。结果表明,低的BR含量gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba突变体导致还原性谷胱甘肽(GSH)含量下降,而与野生型相比,高BR水平的转基因株系导致GSH积累增加(图1)。gydF4y2Ba6gydF4y2Ba).与此相反,氧化谷胱甘肽(GSSG)含量显著增加gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba,但在转基因株系中未受影响(图3)。gydF4y2Ba6 bgydF4y2Ba).总谷胱甘肽(GSH + GSSG)的变化与谷胱甘肽类似。gydF4y2Ba6摄氏度gydF4y2Ba).重要的是,BR缺乏gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba导致谷胱甘肽氧化还原状态,表现为谷胱甘肽/GSSG比下降,而转基因品系中高BR水平导致谷胱甘肽氧化还原状态降低,表现为谷胱甘肽/GSSG比上升(图3)。gydF4y2Ba6 dgydF4y2Ba).不同BR水平对还原抗坏血酸(AsA)含量无影响(图1)。gydF4y2Ba7一个gydF4y2Ba).然而,BR缺乏显著增加了氧化抗坏血酸(DHA)的含量,而高BR水平导致DHA含量显著下降(图4)。gydF4y2Ba7 bgydF4y2Ba).相应地,低BR和高BR水平会导致大鼠AsA/DHA比值的升高和降低gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba和转基因株系(图。gydF4y2Ba7 dgydF4y2Ba).gydF4y2Ba
BR激活了抗氧化酶gydF4y2Ba
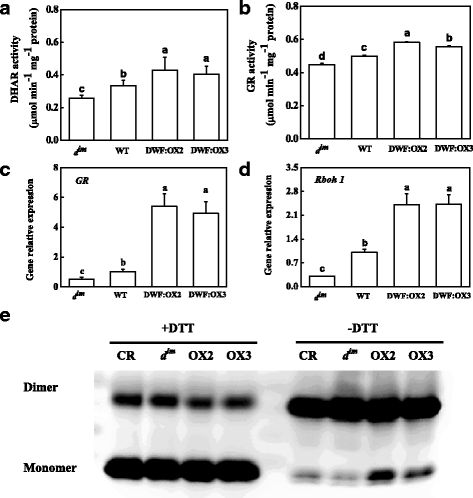
维持细胞氧化还原状态需要抗坏血酸-谷胱甘肽循环的高周转率。脱氢抗坏血酸还原酶(DHAR)和谷胱甘肽还原酶(GR)两种酶的活性均受到抑制gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba突变体,但在转基因株系中是由高BR水平诱导的。gydF4y2Ba8gydF4y2Ba而且gydF4y2BabgydF4y2Ba).转录丰度gydF4y2BaGRgydF4y2Ba与GR活性一致(图2)。gydF4y2Ba8 cgydF4y2Ba).有趣的是,表达gydF4y2BaRboh1gydF4y2Ba编码质膜NADPH氧化酶,在抗氧化信号的调控中起着关键作用,被抑制gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba突变体,但在转基因株系中显著上调。gydF4y2Ba8 dgydF4y2Ba).gydF4y2Ba
的影响gydF4y2Ba矮gydF4y2Ba基因过表达(OX2和OX3)和突变(gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba)对脱氢抗坏血酸还原酶(DHAR)活性的影响gydF4y2Ba一个gydF4y2Ba谷胱甘肽还原酶(GR), (gydF4y2BabgydF4y2Ba)的相对mRNA丰度gydF4y2BaGRgydF4y2Ba而且gydF4y2BaRboh1gydF4y2Ba基因(gydF4y2BacgydF4y2Ba而且gydF4y2BadgydF4y2Ba)和2-半胱氨酸过氧化物还蛋白(2-CP)的氧化还原状态(gydF4y2BaegydF4y2Ba),通过western blot检测2-CP在还原和非还原条件下的表达。色谱柱表示SDs重复4次的平均值。根据Tukey的检验(gydF4y2BaPgydF4y2Ba< 0.05)gydF4y2Ba
虽然不同基因型的BR水平显著影响氧化还原状态,但2-半胱氨酸过氧化物还蛋白(2-CP)的总含量没有改变。Western blot结果显示,蛋白提取物经DTT处理后,2-CP大部分为活性单体/还原态,各基因型间未检测到2-CP蛋白含量的显著变化(图1)。gydF4y2Ba8 egydF4y2Ba).然而,在没有DTT的条件下,大部分2-CP以二聚体形式存在。BR不足gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba结果表明,转基因植株的2-CP单体数量较野生型略有减少,而高水平的BR诱导的2-CP单体数量较野生型显著增加。gydF4y2Ba
讨论gydF4y2Ba
BRs激发了广泛的生物过程,不仅能够提高作物的产量,而且还能提高作物的质量[gydF4y2Ba12gydF4y2Ba,gydF4y2Ba13gydF4y2Ba].因此,BR生物合成的调控被认为是一个有希望提高农业生产的生物技术指标[gydF4y2Ba35gydF4y2Ba].目前有许多关于BR生物合成基因操作的研究,重点是通过修改植株结构来提高水稻产量[gydF4y2Ba36gydF4y2Ba或通过增加COgydF4y2Ba2gydF4y2Ba同化(gydF4y2Ba15gydF4y2Ba].然而,通过改变BR的生物合成而对园艺作物进行基因改造的研究却很少。本研究表明,高内源BR水平对转基因株系生长的刺激与光合能力的提高有关。相反,BR生物合成突变体的BR缺陷gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba导致光合能力下降,从而证实了BRs在光合作用调控中的作用。gydF4y2Ba
从气体交换分析可以看出,高BR水平主要通过调控转基因植株的非气孔因子来促进光合作用(图2)。gydF4y2Ba2gydF4y2Ba).然而,光合速率的降低gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba突变体伴随气孔导度和细胞间CO降低gydF4y2Ba2gydF4y2Ba浓度(图。gydF4y2Ba2gydF4y2Ba),表示COgydF4y2Ba2gydF4y2Ba气孔扩散至少是BR调节光合速率的目标之一。我们最近的研究表明,施用低浓度BR促进番茄气孔开放[gydF4y2Ba37gydF4y2Ba].然而,我们没有观察到转基因植株的气孔导度增加。这种差异可以用CO的影响来解释gydF4y2Ba2gydF4y2Ba而细胞间CO含量较高gydF4y2Ba2gydF4y2Ba浓度(图。gydF4y2Ba2gydF4y2Ba)可以抑制气孔的打开[gydF4y2Ba38gydF4y2Ba].另外,高BR水平可能导致气孔数量的减少[gydF4y2Ba39gydF4y2Ba].gydF4y2Ba
BR调节拟南芥PSII的类囊体结构和功能,缺乏BR生物合成的突变体表现出氧演化复合体的热不稳定性[gydF4y2Ba40gydF4y2Ba].这就解释了为什么番茄的PSIIgydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba与WT相比,突变体在热胁迫下更容易受到光抑制[gydF4y2Ba41gydF4y2Ba].然而,我们没有观察到Fv/Fm和Fv ' /Fm '的显著差异(图。gydF4y2Ba3.gydF4y2Ba),这意味着至少在目前的实验条件下,PSII在基因型间的内在功能未受影响。鉴于类囊体结构和PSII功能可以在一定范围的BR水平上保持[gydF4y2Ba40gydF4y2Ba]时,不能排除BR水平进一步降低时影响最大量子产率的可能性gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba.与Fv/Fm和Fv ' /Fm '相比,ФgydF4y2BaPSIIgydF4y2BaqP与光合速率变化趋势一致(图2)。gydF4y2Ba3.gydF4y2Ba),这表明光合电子传递在PSII下游的位置受到限制,例如,暗反应中NADPH/ATP合成和消耗的周转决定了电子汇[gydF4y2Ba42gydF4y2Ba].gydF4y2Ba
RuBP的羧化和再生消耗大量的NADPH和ATP。RuBisCO和FBPase的A/Ci曲线和生化分析表明BR通过正向调节Calvin循环酶来促进光合作用(图3)。gydF4y2Ba3.gydF4y2Ba而且gydF4y2Ba4gydF4y2Ba).BR主要通过增加RuBisCO的活化态来调控RuBisCO的活性,而不是通过增加RuBisCO的总活性来调控RuBisCO的活性。再加上western blot检测的rbcL和rbcS的蛋白含量(图1)。gydF4y2Ba5 egydF4y2Ba)提示过度表达或突变gydF4y2Ba矮gydF4y2Ba对RuBisCO含量无影响。RuBisCO全酶由大小亚基组成,由gydF4y2Ba红细胞表面gydF4y2Ba而且gydF4y2Ba:gydF4y2Ba.rbcS和rbcL的蛋白质合成是紧密协调的,以确保在确定的化学计量比中组装[gydF4y2Ba43gydF4y2Ba].相比之下,转录水平gydF4y2Ba红细胞表面gydF4y2Ba而且gydF4y2Ba:gydF4y2Ba并不总是相关的[gydF4y2Ba43gydF4y2Ba,gydF4y2Ba44gydF4y2Ba].因此,BR负向调控的转录gydF4y2Ba红细胞表面gydF4y2Ba而对转录本没有影响gydF4y2Ba:gydF4y2Ba(图;gydF4y2Ba5gydF4y2Ba).有趣的是,转录上调或下调在gydF4y2BadgydF4y2Ba即时通讯gydF4y2Ba突变体,gydF4y2Ba矮gydF4y2Ba-过表达的植株没有引起RuBisCO含量的变化。一种可能的解释是rbc的合成效率不同于之前的研究,过度表达的gydF4y2Ba红细胞表面gydF4y2Ba并没有导致整个植物冠层的RuBisCO含量持续升高[gydF4y2Ba45gydF4y2Ba].另外,翻译gydF4y2Ba:gydF4y2Ba是RuBisCO组装的限制。当细胞谷胱甘肽池处于氧化状态时,rbcL蛋白中一个假定的抑制基序暴露,导致结合和翻译阻滞gydF4y2Ba:gydF4y2Ba不依赖于红细胞的mRNA [gydF4y2Ba46gydF4y2Ba,gydF4y2Ba47gydF4y2Ba].考虑到BR在调节谷胱甘肽氧化还原状态中的作用(图。gydF4y2Ba6gydF4y2Ba的翻译是可想而知的gydF4y2Ba:gydF4y2Ba受到影响。与RuBisCO相反,我们的数据表明BR在转录水平上调控FBPase。gydF4y2Ba5gydF4y2Ba).敲除叶绿体和胞质FBPase会导致拟南芥侏儒和碳水化合物代谢失衡[gydF4y2Ba48gydF4y2Ba];与BR生物合成突变体相似的表型表明FBPase活性与BR调控的发育过程密切相关。gydF4y2Ba
BR正向调控RuBisCO活化状态的机制可能与谷胱甘肽氧化还原状态有关。GSH通过促进硫醇/二硫化物交换来激活RuBisCO [gydF4y2Ba49gydF4y2Ba,gydF4y2Ba50gydF4y2Ba].br调控RuBisCO活性与高比值的GSH/GSSG和AsA/DHA有关gydF4y2Ba矮gydF4y2Baoverexpressing行(无花果。gydF4y2Ba6gydF4y2Ba而且gydF4y2Ba7gydF4y2Ba).从我们的结果可以清楚地看出,高GSH/GSSG和AsA/DHA比值归因于DHAR和GR活性的增加(图。gydF4y2Ba8gydF4y2Ba).加速GSH-AsA循环gydF4y2Ba矮gydF4y2Ba-过表达系有助于叶绿体保持还原性状态,促进RuBisCO的活化。BR可能通过RCA的氧化还原调节来激活RuBisCO [gydF4y2Ba20.gydF4y2Ba,gydF4y2Ba51gydF4y2Ba].本研究发现,高内源性BR水平可促进RCA活性和蛋白质含量,与谷胱甘肽、抗坏血酸和2-CP的降低状态相关,这支持了这一结论。硫氧还蛋白(Trx)介导的氧化还原系统介导了2-CP的还原[gydF4y2Ba52gydF4y2Ba].结合我们之前研究的观察,BR诱导胞外ROS [gydF4y2Ba37gydF4y2Ba,gydF4y2Ba53gydF4y2Ba), upregulationgydF4y2BaRboh1gydF4y2Ba通过内源性BRs(图;gydF4y2Ba8gydF4y2Ba)表明BR可调控植物的整个氧化还原系统,包括Trx。众所周知,Trx对于激活RCA至关重要[gydF4y2Ba54gydF4y2Ba,gydF4y2Ba55gydF4y2Ba].因此,Trx可能参与BR对RCA的激活。事实上,沉默番茄叶绿体Trx会损害br促进的光合作用[gydF4y2Ba28gydF4y2Ba].gydF4y2Ba
结论gydF4y2Ba
综上所述,本研究结果表明,过表达BR生物合成基因提高内源BR水平可提高光系统II和CO的量子产量gydF4y2Ba2gydF4y2Ba同化率。内源BR主要通过激活卡尔文循环酶的活性来调控光合能力。br诱导的ROS信号转导可能参与了卡尔文循环酶的氧化还原调控。gydF4y2Ba
缩写gydF4y2Ba
- 2 cp:gydF4y2Ba
-
2-cystein酶类gydF4y2Ba
- 阿坝:gydF4y2Ba
-
脱落酸gydF4y2Ba
- AsA:gydF4y2Ba
-
降低抗坏血酸盐gydF4y2Ba
- br:gydF4y2Ba
-
brassinosteoridsgydF4y2Ba
- CgydF4y2Ba我gydF4y2Ba:gydF4y2Ba
-
细胞间有限公司gydF4y2Ba2gydF4y2Ba浓度gydF4y2Ba
- DHA:gydF4y2Ba
-
氧化抗坏血酸盐gydF4y2Ba
- 达:gydF4y2Ba
-
dehydroascorbate还原酶gydF4y2Ba
- FBPase:gydF4y2Ba
-
果糖1,6-bisphosphatasegydF4y2Ba
- 阵线/ Fm:gydF4y2Ba
-
PSII的最大量子产率gydF4y2Ba
- 艘“/ Fm”:gydF4y2Ba
-
天线激励传输效率gydF4y2Ba
- 气体:gydF4y2Ba
-
赤霉素gydF4y2Ba
- 格:gydF4y2Ba
-
谷胱甘肽还原酶gydF4y2Ba
- ggydF4y2Ba年代gydF4y2Ba:gydF4y2Ba
-
气孔导度gydF4y2Ba
- 谷胱甘肽:gydF4y2Ba
-
减少谷胱甘肽gydF4y2Ba
- GSSG:gydF4y2Ba
-
氧化谷胱甘肽gydF4y2Ba
- JgydF4y2Ba马克斯gydF4y2Ba:gydF4y2Ba
-
最大RuBP再生速率gydF4y2Ba
- PgydF4y2BaNgydF4y2Ba:gydF4y2Ba
-
净光合速率gydF4y2Ba
- PSII:gydF4y2Ba
-
光系统IIgydF4y2Ba
- 表示为:gydF4y2Ba
-
光化学猝灭系数gydF4y2Ba
- :gydF4y2Ba:gydF4y2Ba
-
二磷酸核酮糖羧化酶大亚基gydF4y2Ba
- 红细胞表面gydF4y2Ba:gydF4y2Ba
-
二磷酸核酮糖羧化酶小亚基gydF4y2Ba
- 美国广播公司gydF4y2Ba:gydF4y2Ba
-
二磷酸核酮糖羧化酶活化酶gydF4y2Ba
- 二磷酸核酮糖羧化酶:gydF4y2Ba
-
核酮糖1 5 5-bisphosphate,羧化酶/加氧酶gydF4y2Ba
- RuBP:gydF4y2Ba
-
核酮糖1 5 5-bisphosphate,gydF4y2Ba
- Tr:gydF4y2Ba
-
蒸腾速率gydF4y2Ba
- VgydF4y2Bac,马克斯gydF4y2Ba:gydF4y2Ba
-
最大RuBisCO羧化速率gydF4y2Ba
- ФgydF4y2BaPSIIgydF4y2Ba:gydF4y2Ba
-
PSII的实际量子产率gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
黄晓明,李文华,李文华,等。植物体内糖的感知与信号转导:保守的和新的机制。植物学报。2006;21(4):429 - 436。gydF4y2Ba
- 2.gydF4y2Ba
拟南芥幼苗早期发育过程中,光合蔗糖作为子叶来源的远距离信号调控根系生长。中国科学:地球科学。2012;39(9):11217 - 21。gydF4y2Ba
- 3.gydF4y2Ba
熊毅,McCormack M, Li L, Hall Q, Xiang CB, Sheen J.葡萄糖- tor信号重组转录组并激活分生组织。大自然。2013;496:181-7。gydF4y2Ba
- 4.gydF4y2Ba
龙SP,朱晓光,奈度SL, Ort DR.光合作用的改善能提高作物产量吗?植物细胞环境。2006;29:315-30。gydF4y2Ba
- 5.gydF4y2Ba
von Caemmerer S, Evans JR.增强C-3光合作用。植物杂志。2010;154:589 - 92。gydF4y2Ba
- 6.gydF4y2Ba
李志刚,李志刚,李志刚,等。乙烯对生长的抑制与刺激。中国植物科学。2006;11(4):458 - 463。gydF4y2Ba
- 7.gydF4y2Ba
Tholen D、Pons TL、Voesenek LACJ、Poorter H.乙烯不敏感导致烟草rubisco表达下调和光合能力下降。植物杂志。2007;144:1305-15。gydF4y2Ba
- 8.gydF4y2Ba
黄晓明,张晓明,张晓明,等。赤霉素代谢变化对转基因烟草植株生物量积累、木质素合成和光合作用的影响。植物杂志。2004;135:254 - 65。gydF4y2Ba
- 9.gydF4y2Ba
蒋欣,李华,王涛,彭超,王华,吴华,等。赤霉素间接促进叶绿体的生物发生,作为维持扩增细胞叶绿体数量的一种手段。植物j . 2012; 72:768 - 80。gydF4y2Ba
- 10.gydF4y2Ba
光合作用和干旱:我们能从现有数据中建立代谢联系吗?中国生物医学工程学报。2011;62:869-82。gydF4y2Ba
- 11.gydF4y2Ba
Galvez-Valdivieso G, Fryer MJ, Lawson T, Slattery K, Truman W, Smirnoff N等。拟南芥的高光响应与维管束鞘细胞和束鞘细胞之间的ABA信号通路有关。植物细胞。2009;21:2143 - 62。gydF4y2Ba
- 12.gydF4y2Ba
Khripach V, Zhabinskii V, De Groot A. 20年的油菜素内酯:类固醇植物激素保证了21世纪更好的作物。安机器人。2000;86:441-7。gydF4y2Ba
- 13.gydF4y2Ba
C.利用植物类固醇促进作物产量。植物细胞。2012;24:842-57。gydF4y2Ba
- 14.gydF4y2Ba
Clouse SD。油菜素内酯信号转导:从受体激酶激活到调节植物发育的转录网络。植物细胞。2011;23:1219-30。gydF4y2Ba
- 15.gydF4y2Ba
吴春华,张凯,张凯,张国强,张国强,张国强,等。油菜素内酯调节水稻籽粒灌浆。植物细胞。2008;20:2130-45。gydF4y2Ba
- 16.gydF4y2Ba
段鹏,饶勇,曾丹,杨勇,徐锐,张斌,等。gydF4y2Ba小粒1gydF4y2Ba该基因编码一种丝裂原活化蛋白激酶激酶4,影响大米的颗粒大小。植物j . 2014; 77:547-57。gydF4y2Ba
- 17.gydF4y2Ba
胡兴耀,鲍芳,李建勇。油菜素内酯对拟南芥细胞分裂的促进作用涉及一个独特的cycd3诱导途径。植物j . 2000; 24:693 - 701。gydF4y2Ba
- 18.gydF4y2Ba
Schluter U, Kopke D, Altmann T, Mussig C.碳水化合物代谢分析gydF4y2BaCPDgydF4y2Ba反义植物与油菜素内酯缺乏gydF4y2Bacbb1gydF4y2Ba突变体。植物细胞环境。2002;25:783-91。gydF4y2Ba
- 19.gydF4y2Ba
于建强,黄瑞麟,胡文华,周永华,毛文华,叶顺丰,等。油菜素内酯在调节光合作用中的作用gydF4y2BaCucumis巨大成功gydF4y2Ba.中国地质大学学报(自然科学版)2004;gydF4y2Ba
- 20.gydF4y2Ba
夏晓军,黄丽芬,周永华,毛文华,史凯,吴建新,等。油菜素内酯通过促进Rubisco活化和光合基因表达来促进光合作用和生长gydF4y2BaCucumis巨大成功gydF4y2Ba.足底。2009;230:1185 - 96。gydF4y2Ba
- 21.gydF4y2Ba
杨超,李华,张杰,罗智,龚鹏,张超,等。一个调控基因诱导番茄毛状体的形成和胚胎的致病性。中国科学:地球科学。2011;gydF4y2Ba
- 22.gydF4y2Ba
von Caemmerer S, Farquhar GD。光合生物化学与叶片气体交换的一些关系。足底。1981;153:376 - 87。gydF4y2Ba
- 23.gydF4y2Ba
Ethier GJ, Livingston NJ。需要考虑对CO的敏感性gydF4y2Ba2gydF4y2Ba将电导传递到Farquhar-von Caemmerer-Berry叶片光合模型中。植物细胞环境。2004;27:137-53。gydF4y2Ba
- 24.gydF4y2Ba
叶绿素荧光:体内光合作用的探针。植物学报。2008;29(3):349 - 356。gydF4y2Ba
- 25.gydF4y2Ba
丁杰,毛丽娟,王圣,袁宝强,冯永强。双层固相萃取-高效液相色谱-串联质谱法测定植物组织中内源油菜素内酯的含量。Phytochem肛门。2013;24:386 - 94。gydF4y2Ba
- 26.gydF4y2Ba
亚迪。离体叶绿体中的铜酶-多酚氧化酶gydF4y2Ba甜菜属gydF4y2Ba.植物杂志。1949;24:1-15。gydF4y2Ba
- 27.gydF4y2Ba
张志强,张志强,张志强,等。巯基氧化还原蛋白质组学在植物研究中的应用。方法中国生物医学杂志2010;639:219-38。gydF4y2Ba
- 28.gydF4y2Ba
程飞,周永华,夏晓军,史凯,周杰,于建强。叶绿体硫氧还蛋白f和硫氧还蛋白m1/4在油菜素内酯诱导的CO变化中起重要作用gydF4y2Ba2gydF4y2Ba番茄的同化和细胞氧化还原稳态。中国地质大学学报(自然科学版)2014;gydF4y2Ba
- 29.gydF4y2Ba
Ward DA, Keys AJ。RuBP羧化酶的耦合分光光度法与非耦合辐射法的比较。Photosynth杂志1989;22:167 - 71。gydF4y2Ba
- 30.gydF4y2Ba
Scheibe R, Fickenscher K, Ashton AR.硫氧还蛋白m和低分子量硫醇还原活化nadp -苹果酸脱氢酶的机理研究。生物物理学报1986;87:191 - 197。gydF4y2Ba
- 31.gydF4y2Ba
Rao MV, Ormrod DP。臭氧暴露降低拟南芥UVB敏感类黄酮突变体的敏感性。Photochem Photobiol。1995;61:71-8。gydF4y2Ba
- 32.gydF4y2Ba
过氧化氢被菠菜叶绿体中的抗坏血酸特异性过氧化物酶清除。植物细胞物理。1981;22:867-80。gydF4y2Ba
- 33.gydF4y2Ba
抗坏血酸,金属离子和超氧自由基。j . 1976; 155:697 - 700。gydF4y2Ba
- 34.gydF4y2Ba
Livak KJ, Schmittgen TD。利用实时荧光定量PCR和2gydF4y2Ba——ΔΔCgydF4y2Ba方法。方法。2001;25:402-8。gydF4y2Ba
- 35.gydF4y2Ba
油菜素内酯:提高作物产量和抗逆性的生物技术目标。新的生物技术。2009;26:131-6。gydF4y2Ba
- 36.gydF4y2Ba
张志勇,张志勇,张志勇,张志勇,等。油菜素内酯缺乏症引起的直立叶片增加了水稻的生物量和产量。生物科技Nat》。2006;24:105-9。gydF4y2Ba
- 37.gydF4y2Ba
夏晓军,高劲松,宋丽霞,周永华,史凯,于建强。H的作用gydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba油菜素甾醇诱导的气孔关闭和开放的动力学gydF4y2Ba茄属植物lycopersicumgydF4y2Ba.植物细胞环境学报。2014;37:2036-50。gydF4y2Ba
- 38.gydF4y2Ba
薛松,胡H, Ries A, Merilo E, Kollist H, Schroeder JI。碳酸氢盐在CO中s型阴离子通道激活和OST1蛋白激酶的中枢作用gydF4y2Ba2gydF4y2Ba保卫细胞的信号转导。EMBO j . 2011; 30:1645-58。gydF4y2Ba
- 39.gydF4y2Ba
Kim TW, Michniewicz M, Bergmann DC, Wang ZY。油菜素内酯通过gsk3介导的MAPK通路抑制调控气孔发育。大自然。2012;482:419-U1526。gydF4y2Ba
- 40.gydF4y2Ba
刘志强,刘志强,刘志强,等。油菜素内酯调节类囊体膜结构和光系统II功能。光化学;2013; 126:97 - 104。gydF4y2Ba
- 41.gydF4y2Ba
周军,王军,李霞,夏晓军,周永华,史凯,等。HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba介导油菜素内酯和脱落酸在番茄对热和氧化应激反应中的串扰。中国地质大学学报(自然科学版)2014;gydF4y2Ba
- 42.gydF4y2Ba
张志强,张志强,张志强,等。光合作用对植物光合特性和基因表达的影响。中国生物医学工程学报。2012;33(3):393 - 393。gydF4y2Ba
- 43.gydF4y2Ba
Rubisco大亚基翻译在烟草叶绿体中是根据组装状态自动调节的。中国科学:地球科学。2007;gydF4y2Ba
- 44.gydF4y2Ba
田志明,张志明gydF4y2Ba:gydF4y2Ba在水稻衰老叶片中Rubisco基因的协调表达中起作用。中国生物医学工程学报2013;64:1145-52。gydF4y2Ba
- 45.gydF4y2Ba
Suzuki Y, Miyamoto T, Yoshizawa R, Mae T, Makino A. Rubisco基因过表达水稻不同部位叶片Rubisco含量与光合作用gydF4y2Ba红细胞表面gydF4y2Ba.植物细胞环境。2009;32:417 - 427。gydF4y2Ba
- 46.gydF4y2Ba
Cohen I, Knopf JA, Irihimovitch V, Shapira M.氧化应激抑制Rubisco组装及其亚基表达的机制。植物杂志。2005;137:738-46。gydF4y2Ba
- 47.gydF4y2Ba
Cohen I, Sapir Y, Shapira M. Rubisco大亚基在不同光合生物中的翻译是由一种保守机制控制的。植物杂志。2006;141:1089 - 97。gydF4y2Ba
- 48.gydF4y2Ba
Rojas-González JA, Soto-Súarez M, García-Díaz Á, Romero-Puertas MC, Sandalio LM, Mérida Á,等。破坏叶绿体和胞质FBPase基因会导致矮化表型和重要的淀粉和代谢物的变化gydF4y2Ba拟南芥gydF4y2Ba.中国生物医学工程学报。2015;66:2673-89。gydF4y2Ba
- 49.gydF4y2Ba
刘志强,刘志强,刘志强。Rubisco的半胱氨酸残基对Rubisco构象和活性的氧化还原调节。中国地质大学学报(自然科学版)2008;gydF4y2Ba
- 50.gydF4y2Ba
利用叶绿体谷胱甘肽池控制核酮糖1,5-二磷酸羧化酶/加氧酶活性。中国科学:地球科学。2015;29(3):393 - 393。gydF4y2Ba
- 51.gydF4y2Ba
蒋永平,程峰,周永华,夏晓军,毛文华,石凯,等。细胞谷胱甘肽氧化还原稳态在油菜素内酯诱导的CO增加中起重要作用gydF4y2Ba2gydF4y2Ba同化的gydF4y2BaCucumis巨大成功gydF4y2Ba.新植醇。2012;194:932-43。gydF4y2Ba
- 52.gydF4y2Ba
黄海燕,李志强,李志强,等。NADPH硫氧还蛋白还原酶C-2-Cys过氧化物还蛋白系统在机体氧化还原调节中的作用。2月。2012;586:2974 - 80。gydF4y2Ba
- 53.gydF4y2Ba
聂文福,王明敏,夏晓军,周永华,史凯,陈志新,等。沉默的番茄gydF4y2BaRBOH1gydF4y2Ba而且gydF4y2BaMPK2gydF4y2Ba废除brassinosteroid-induced HgydF4y2Ba2gydF4y2BaOgydF4y2Ba2gydF4y2Ba生成和抗压能力。植物细胞环境。2013;36:7803。gydF4y2Ba
- 54.gydF4y2Ba
张宁,Portis AR. Rubisco的光调控机制:Rubisco活化酶亚型在thioredoxin-f还原活化方面的特殊作用。中国科学院学报1999;96:9438 - 438。gydF4y2Ba
- 55.gydF4y2Ba
张宁,Kallis RP, Ewy RG, Portis AR.拟南芥Rubisco的光调控需要Rubisco活化酶亚型的氧化还原调控能力。中国科学:地球科学。2002;gydF4y2Ba
确认gydF4y2Ba
我们非常感谢加州大学戴维斯分校的番茄遗传资源中心,感谢他们对我们的建议gydF4y2BadgydF4y2Ba即时通讯gydF4y2BaCondine Red背景下的突变体及其对应的WT。基金资助:国家自然科学基金国家重点项目(31430076)、国家自然科学基金项目(31272155,31000905)、农业科学公益研究专项(201203004)和国家优秀博士学位论文作者基金(201263)。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者声明他们之间没有利益冲突。gydF4y2Ba
作者的贡献gydF4y2Ba
XJL参与数据收集和统计分析。XG参与了卡尔文循环酶和抗氧化酶活性的测定。参与气体交换和叶绿素荧光参数分析。XJX、KS参与western blot。JZ参与谷胱甘肽和抗坏血酸的分析和基因表达。JQY和XJX参与研究设计。XJX帮助起草了手稿。所有作者已阅读并批准了最终版本的手稿。gydF4y2Ba
额外的文件gydF4y2Ba
附加文件1:表S1。gydF4y2Ba
设计用于qRT-PCR的基因特异性引物。(医生75 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许不受限制地在任何媒体上使用、分发和复制,前提是您要适当地注明原作者和来源,提供创作共用许可的链接,并说明是否进行了更改。知识共享公共领域转让豁免书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文提供的数据,除非另有说明。gydF4y2Ba
关于这篇文章gydF4y2Ba
引用这篇文章gydF4y2Ba
李,XJ。,Guo, X., Zhou, YH.et al。gydF4y2Ba油菜素内酯生物合成基因过表达gydF4y2Ba矮gydF4y2Ba通过激活卡尔文循环酶来提高番茄的光合能力。gydF4y2BaBMC植物杂志gydF4y2Ba16,gydF4y2Ba33(2016)。https://doi.org/10.1186/s12870-016-0715-6gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-016-0715-6gydF4y2Ba
关键字gydF4y2Ba
- BrassinosteroidsgydF4y2Ba
- 2-cystein抗氧化蛋白gydF4y2Ba
- 矮gydF4y2Ba
- 谷胱甘肽gydF4y2Ba
- 光合作用gydF4y2Ba
- 二磷酸核酮糖羧化酶gydF4y2Ba