摘要
背景
木质素是植物细胞壁的重要结构成分,具有抗生物和非生物胁迫的机械强度和耐受性;然而,它影响了小麦秸秆等生物质在某些工业应用中的使用,如生物燃料生产。通过基因改造木质素的质量和数量,可以解决这一问题。然而,小麦生物量中木质素形成的分子机制尚未得到研究。本研究结合分子生物学和生物化学方法,研究了两个具有不同倒伏特性的小麦品种木质素生物合成的转录调控及其对涝渍的响应。它还研究了组织中木质素水平与植物激素水平的关系,涉及木质素生物合成的控制。
结果
对两个小麦品种木质素生物合成的分析表明,抗倒伏性与节间木质素含量和表达密切相关4-coumarate:辅酶a ligase1(4 cl1),p-coumarate 3-hydroxylase1(C3H1),cinnamoyl-CoA reductase2(CCR2),ferulate 5-hydroxylase2(F5H2),咖啡酸o -甲基转移酶2(COMT2),是小麦组织中高表达的基因之一,提示这些基因在介导小麦茎秆木质素沉积中的重要性。涝渍降低了小麦节间木质素的含量,这种影响伴随着小麦节间高表达的三个基因的转录抑制,包括苯丙氨酸ammonia-lyase6(PAL6),CCR2而且F5H2然而,淹水诱导了其他基因的表达,这表明它们在其他苯丙醇衍生分子的合成中发挥作用,并在胁迫响应中发挥作用。不同品种间木质素含量的差异或渍水后木质素水平的变化与细胞分裂素水平有关。
结论
小麦生物量的抗倒伏性、抗生物和非生物胁迫能力以及原料品质与其木质素含量密切相关。因此,本研究结果为研究小麦木质素形成的分子机制提供了重要的视角,为开发分子工具在不影响其他木质素相关农艺效益的情况下,优化木质素含量和提高饲料品质的小麦品种育种迈出了重要一步。
背景
木质素是一种与纤维素、半纤维素紧密结合的复合酚醛聚合物,是植物次生细胞壁的重要结构成分。它为植物提供机械强度和维管完整性[1],并在赋予生物和非生物胁迫的耐受性方面发挥重要作用[2,3.].最近,对气候变化的日益关注和减少碳排放的需求引发了人们对从木质纤维素生物质中生产可再生燃料和生物制品的日益浓厚的兴趣[4].小麦是全球最重要的经济作物之一,其秸秆代表了丰富的生物质来源,可作为可持续生产生物燃料和生物制品的原料[5,6].
木质纤维素生物质有效转化为生物燃料受到木质素的阻碍,木质素限制了植物细胞壁多糖进入化学、酶和微生物消化的途径[7,8].植物生物量中木质素数量和质量的遗传改变已被认为是缓解这一问题的可行替代方法[9- - - - - -11].然而,小麦等谷类作物的木质素含量已被证明与抗倒伏密切相关[12],是小麦生产的主要障碍之一,可收获产量损失高达80% [13].因此,有必要设计工具和方法来改变小麦生物量中木质素的数量和质量,而不影响其为正常生长发育和田间性能提供结构支持的功能。然而,这需要对小麦生物量中木质素形成的分子机制进行详细的解剖。
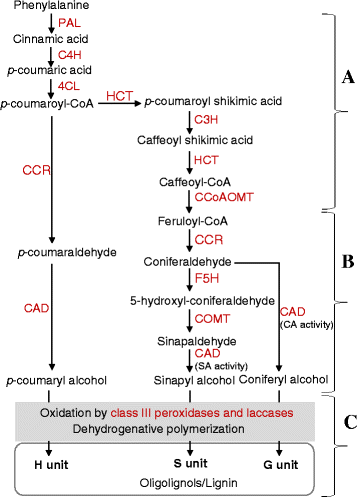
已经确定,植物中的木质素是由三种作为构件的单木质素氧化偶联形成的;松柏,辛纳柏和p-香豆醇[1].这些单木烯醇是由苯丙氨酸通过一般的苯丙醇和单木烯醇特异性途径合成的(图。1),连续脱氢聚合反应分别生成愈创木酰(G)、丁香基(S)和羟基苯基(H)单元,形成复杂的三维木质素聚合物[1].此外,木质素的形成涉及到其他单体的掺入,如羟基肉桂基乙酸酯,羟基肉桂基p-羟基苯甲酸酯和羟基肉桂基p-特定遗传和环境条件下的香豆酸酯[14].
植物木质素生物合成途径。单木烯醇(针叶醇、辛纳醇和p-香豆醇)由苯丙氨酸通过一般苯丙醇途径合成(一个)和单木质素特异性通路(B)被氧化并分别并入G(愈创木酰基)、S(丁香基)和H(羟基苯基)单元,形成木质素的复合立体聚合物(C).低聚木质素是木素聚合过程中形成的外消旋自由基偶联产物。苯丙氨酸解氨酶;C4H,肉桂酸4-羟化酶;4CL, 4-香豆酸酯:辅酶a连接酶;C3H,对香豆酸酯3-羟化酶;HCT, p-羟基肉桂酰- coa:quinate/shikimate p-羟基肉桂酰转移酶;CCoAOMT,咖啡酰辅酶a o -甲基转移酶;CCR:肉桂酰辅酶a还原酶;F5H,阿魏酸5-羟化酶; COMT, caffeic acid O-methyltransferase; CAD, cinnamyl alcohol dehydrogenase
木质素的生物合成已经在模式植物拟南芥和其他双子叶植物(如苜蓿和烟草)中进行了广泛的研究,这些研究已经导致识别了编码酶的基因,这些酶催化通路中的许多步骤(图。1) [1].由于PAL和CAD酶分别催化一般苯丙烷途径的第一步和单木质素合成的最后一步,因此它们被认为在调节植物木质素积累中起着关键作用[15- - - - - -17].鉴于大多数木质素生物合成酶具有同型,它们似乎是由基因家族编码的[18,19],而先前的研究已经证实了这些基因在决定木质素沉积和组成方面的生理作用[1,10].例如,抑制早期通路中的基因如朋友,C4H,HCT,摘要:而且CCoAOMT在苜蓿和烟草中,总木质素含量降低,而抑制F5H或COMT的,它们参与木质素S单位的合成,导致木质素S/G比的改变,而对木质素总含量的影响很小[9].基因抑制计算机辅助设计编码一种催化单木质素生物合成最后一步的酶,也会导致S/G比的降低,但对总木质素含量的影响有限。类似地,f5h1而且comt的拟南芥突变体的特征是含有低聚木质素的S单位减少,但对总木质素含量没有影响c4h,4 cl1,ccoaomt1,ccr1与野生型相比,突变体的总木质素含量较低[20.].
虽然木质素生物合成途径在小麦中尚未阐明,但已有研究确定了小麦木质素生物合成基因同源体的表达模式。与叶鞘和叶片相比,这些同源体的转录本在茎组织中表现得非常丰富PAL6,C4H,4 cl1,C3H1,CCR2,F5H1而且F5H2尤其发现与木质素含量有显著相关性[3.].此外,茎表现出较高的丰度CCR1而且cad 1相应酶的转录本和活性高于其他组织,而COMT1在包括茎、叶和根在内的不同组织中构成性表达[12,21,22].不同抗倒伏程度的小麦品种间的对比分析表明,抗倒伏能力的转录丰度较高CCR1,COMT1而且cad 1抗倒伏品种抽穗期后茎秆中相应酶活性提高,且这些因素与茎秆木质素含量和机械强度密切相关[21].尽管有这些结果,在小麦组织中合成木质素的分子机制仍然知之甚少。
内涝是影响作物产量的非生物因素之一;它导致气体扩散减少,从而影响根际氧气的可用性,引起生化和代谢过程的变化[23].主要的代谢变化之一包括从有氧呼吸到无氧呼吸的转变,损害ATP的产生。为了弥补由此产生的能量不足,糖酵解酶和发酵酶的活性增加,从而加速糖酵解,导致碳水化合物储备的耗尽,这一现象被称为“巴斯德效应”[24,25].在缺氧条件下,糖酵解和发酵基因的转录激活在水稻胚层中一直有报道[26].与此相反,根系缺氧条件已被证明会导致小麦幼苗根和茎组织中可溶性碳水化合物(如蔗糖)和具有储存功能的果聚糖(如果聚糖)的积累[27].在长期缺氧条件下,小麦根系中大量的蔗糖隔断到以纤维素为主的细胞壁组分的合成,导致细胞壁结构发生变化[28].因此,这种细胞壁结构的改变很可能是根组织用来补偿皮质细胞逐渐溶解以形成通气组织的策略之一,从而有助于在低氧条件下维持细胞壁功能2应力状况[29].然而,迄今为止,关于木质素生物合成对涝渍条件的响应的分子特征所知甚少。
除环境因素外,植物激素等细胞信号分子也可调节木质素的生物合成[30.,31].例如,生长素和细胞分裂素诱导木质素生物合成基因的表达,过氧化物酶(插件可以),在Zinnia线虫,以及次生生长/木质化[30.].始终如一的促进者插件可以由调节反应的母题组成插件可以从而作为调控次生生长的转录因子的靶点[30.,32].此外,重力诱导的生长素积累导致木质素生物合成基因的选择性表达增强,进而在拟南芥花序茎中木质化[33].此前已有研究表明,水杨酸(SA)水平与植物木质素含量呈负相关,通过下调特定木质素生物合成基因降低木质素含量,SA介导了这些植物的生长抑制;然而,遗传降低SA水平可恢复生长,但不能恢复木质素含量[34].
为了深入了解调控小麦木质素形成的分子机制,我们对不同抗倒伏程度的小麦品种节间组织中木质素的生物合成进行了比较分析,这一特性与茎秆木质素含量和机械强度密切相关。此外,该研究还确定了介导小麦组织中木质素生物合成对涝渍反应的候选基因,并研究了木质素水平与所选植物激素之间的关系,这些激素被认为在木质素生物合成的调节中起着重要作用。
方法
植物材料
本研究使用了两个六倍体小麦品种Harvest和Kane,这些品种的种子由加拿大农业和农业食品(AAFC)谷物研究中心(Winnipeg, Manitoba, Canada)的Stephen Fox博士提供。这两个品种都是由AAFC开发的硬红春小麦品种[35,36],根据其抗倒伏(茎秆机械强度的衡量指标)方面的农艺性状,以及密切的亲缘关系,选择它们进行本研究。将两个品种成熟的干种子在培养皿中培养3天,然后将发芽的种子移植到1加仑的塑料罐中(每罐一粒种子),罐中含有18克肥料(ACER®nt 13-12-12,含13% N, 12% P)2O5, 12% k2O和微量元素)。在22/20°C(白天/晚上)的生长室中,在16/8小时的光周期下种植,直到收获。抽穗阶段,采集两组样品:第一组从cv中采集。收获期由旗叶片、旗叶鞘、花梗、第一节间(IN-1)、第二节间和第三节间的组合(in -2和3)和第四节间(IN-4)组成。节间的数值指定是基于它们与花梗的相对位置,其中in -1是位于花梗旁边的最年轻的节间,而in -4是位于茎基部旁边的最古老的节间。第二组样品取自两个栽培品种cvs。Harvest和Kane,由整个旗叶(包括叶片和鞘)和节间(IN-2&3)组成。组织在收获后立即在液氮中冷冻,然后在−80°C保存,直到进一步使用。
涝治疗
对于内涝处理,植物cv。除了由粘土和沙子(2:1,v:v)组成的土壤混合物外,按照上述方法进行种植。移栽4周后,对48株植物进行内涝处理,将每株植物浸泡在5升的装满水的容器中,以保持水位高于土壤表面2厘米。大容器里的水按要求补充了。同时,另一组48株植物进行定期浇水(每盆每隔一天0.5 L水)。在抽穗期,即处理和未处理对照植物开始内涝后20 ~ 22天,旗叶和in -2&3组织在液氮中收获,并保存在−80°C下,待进一步使用。
木质素生物合成候选基因的鉴定及系统发育分析
来自达纳-法伯癌症研究所(DFCI)小麦基因指数(TaGI)发布的候选木质素生物合成基因的初步共识(TC)序列[3.]在TaGI release 12中搜索相应的tc (ftp://occams.dfci.harvard.edu/pub/bio/tgi/data/Triticum_aestivum/) [37].与新鉴定的tc相对应的GenBank id被用于搜索包含56,943个unigenes的国家生物技术信息中心(NCBI)小麦UniGene数据集(http://www.ncbi.nlm.nih.gov/UniGene/UGOrg.cgi?TAXID=4565) [38]以获得各自的unigenes,这些unigenes由一组序列组成,代表一个独特的木质素生物合成基因家族成员。每个序列簇中的完整编码序列(CDS)或版本12中的TC序列(当完整的CDS不可用时)被用作查询来blast搜索NCBI GenBank核苷酸数据库(http://www.ncbi.nlm.nih.gov/nuccore/) [39]对于来自小麦的其他家族成员(源自不同的单基因)或来自其他物种的同源基因,使用查询序列覆盖率至少50%且e值≤10的标准−20.为每个木质素生物合成基因家族收集符合这些标准的序列,并用于生成系统发育树。序列主要来源于水稻(Ozyza漂白亚麻纤维卷,的士编号4530)、高粱(高粱二色的、的士编号4558)、大麦(大麦芽、的士编号4513)、柳枝稷(黍virgatum、的士编号38727)、玉米(玉米(taxid 4577),以及其他可获得木质素生物合成候选基因序列信息的物种。基于Xu等报道的蛋白序列,收集拟南芥木质素生物合成基因序列。[19].利用ClustalW程序对基因核苷酸序列进行比对(http://www.ebi.ac.uk/Tools/msa/clustalw2) [40],系统发育树由Molecular Evolutionary Genetic Analysis (MEGA, version 6)软件(http://www.megasoftware.net) [41]采用Tamura-Nei模型和500重复bootstrap方法进行系统发育试验。
RNA提取和cDNA合成
按照制造商的协议(Life Technologies, Carlsbad, CA, USA),使用TRIzol试剂从组织中分离总RNA。RNA样品用DNase (DNA-free Kit;Ambion, Austin, TX, USA)来消除基因组DNA污染。用iScript逆转录Supermix (Bio-Rad, Hercules, CA, USA)从1 μg总RNA合成第一条cDNA,总反应量为20 μl。将得到的cDNA样本稀释20倍,然后作为实时定量PCR (qPCR)的模板。
实时定量PCR检测
对候选木质素生物合成物进行实时qPCR检测,并为其提供参考β-肌动蛋白用先前描述的基因特异性引物进行基因处理[3.]除了本研究中发现的新的候选基因和由于缺乏靶基因特异性而需要重新设计引物的基因(附加文件1:表S1)。所有引物的基因特异性均通过在GenBank数据库中blast搜索目标扩增子,再通过RT-PCR验证。qPCR检测在CFX96 Real-Time PCR系统(Bio-Rad)上进行,反应由5 μL稀释cDNA为模板,10 μL SsoFast EvaGreen Supermix (Bio-Rad), 1.2 μL 5 μM正向引物(终浓度300 nM), 1.2 μL 5 μM反向引物(终浓度300 nM)和2.6 μL二乙基pyrocarbonate处理水组成。将样品置于以下热循环条件下:DNA聚合酶在95°C下激活5分钟,然后在95°C下变性15秒,在50-66°C下退火30秒(取决于引物组的熔化温度),在72°C下伸展30秒,重复放置在96孔光学反应板(Bio-Rad)中。用归一化后表达靶基因的转录水平β-肌动蛋白利用Livak和Schmittgen方法[42].
酶活性测定
用分光光度法测定蛋白质浓度和酶活性箴, Artisan Scientific,香槟,IL,美国)。总蛋白提取,测定针叶醛识别CAD (CAD- ca)和sinapyl醛识别CAD (CAD- sa)活性的实验如Zhang等所述[43].简单地说,将冷冻植物组织(约200mg旗叶或约300mg节间)用砂浆和杵研磨成细粉末,与蛋白质提取缓冲液混合,然后在4℃下孵育2.5小时。使用Quick Start™Bradford蛋白测定法(Bio-Rad, Hercules, CA, USA)测量提取物中的蛋白质浓度。用总蛋白提取物(100 μg)在500 μL反应缓冲液中检测CAD-CA和CAD-SA的活性,并在400 nm处监测CAD-CA底物针叶醇和CAD-SA底物sinapyl醇的转化。根据Edwards和Kessmann的描述,测定蛋白提取物中PAL的活性[44用总蛋白提取物(旗叶100 μg或节间10 μg)在1 mL反应缓冲液中,在290 nm处监测l -苯丙氨酸生成肉桂酸的过程,反应时间长达2小时。每种酶的活性表示为每克总蛋白质的nKatal(指每秒转化1nmol底物所需的酶活性)。
测定木质纤维成分
冷冻的叶片和节间组织样本被冻干,然后在萨斯喀彻温大学饲料创新研究所(萨斯卡通,萨斯喀彻温,加拿大)进行木质纤维素成分分析。木质素和酸性洗涤纤维(ADF)含量采用官方分析化学家协会(AOAC)方法973.18测定[45]中性洗涤纤维(NDF)含量采用AOAC法2002.04测定[45].纤维素含量以ADF与木质素含量之差表示;半纤维素含量表示为NDF和ADF含量之差。
测量激素水平
激素水平从用于分析基因表达和木质纤维成分水平的相同组织样本中测量。如前所述,从节间组织中提取生长素(吲哚乙酸[IAA])、细胞分裂素(异戊烯基腺嘌呤[IPA]和反式玉米素[t-玉米素])和水杨酸(SA) [46除了初始提取是用80% (v/v)乙腈含1% (v/v)乙酸进行,IAA和SA提取物分别用80% (v/v)乙腈含1% (v/v)乙酸进行洗脱,而IPA和t-玉米素提取物用60% (v/v)乙腈含5% (v/v)氨水洗脱。IAA、IPA、t-玉米素和SA水平的定量使用液相色谱-串联质谱系统(Agilent 6430) (Agilent, Santa Clara, CA, USA),按照Yoshimoto等人描述的方案进行。[47].
统计分析
使用LSD检验或t-student检验检验样本均值之间的显著差异P< 0.05。使用GenStat版本12进行统计分析[48].
结果
小麦木质素生物合成基因同源体研究进展
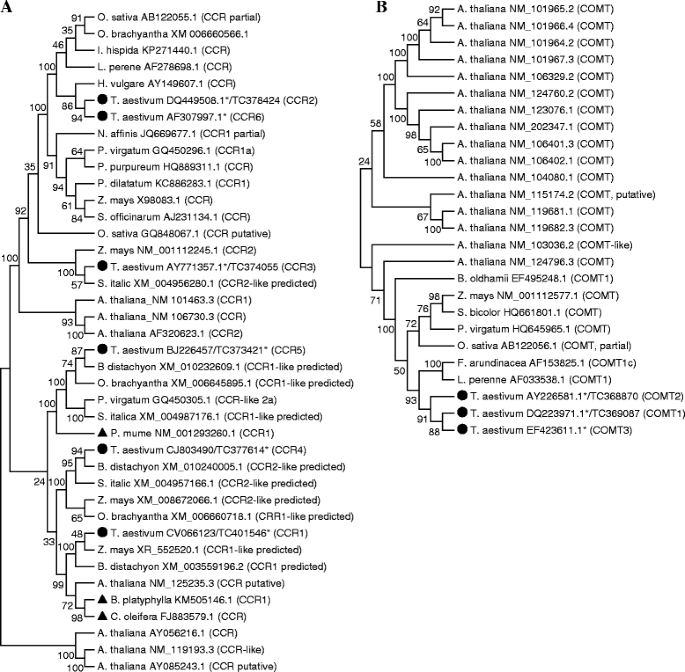
使用TaGI发行版10和11,Bi等人。3.]鉴定出32个候选木质素生物合成基因,属于10个基因家族;然而,只有两个,COMT1而且COMT2,在各自的序列簇中发现了代表完整CDS的序列。由于GenBank数据库更新了更多的小麦基因序列,并且自Bi等人的报告以来,已经提供了包含221925个tc的TaGI版本12。[3.],我们进行了进一步的数据库挖掘,并更新了候选小麦木质素生物合成基因的列表(表1).我们的搜索揭示了Bi等人指定的特定ESTs。[3.不同的基因家族成员似乎起源于同一个unigene,因此代表同一个基因家族成员而不是不同的成员。Bi等中指定的ESTs [3.]4 cl1而且4氯被发现属于同一单基因(Ta. 45532),因此代表相同4 cl以下为基因4 cl1;无害环境技术指定为CCoAOMT1而且CCoAOMT4来自同一单基因(Ta. 18653),因此代表相同CCoAOMT以下为基因CCoAOMT1;无害环境技术指定为CCoAOMT3而且CCoAOMT5源于同一单基因(Ta. 48354),因此代表相同CCoAOMT以下为基因CCoAOMT3,以及指定为PAL2,PAL3而且PAL4来源于同一单基因(Ta. 47240),因此代表相同朋友以下为基因PAL2.因此,Bi等人鉴定的ESTs [3.]PAL5,6,7而且8被重新指定为PAL3,4,5而且6,分别。每个家族成员中特定EST的选择是基于他们的编码区域覆盖,这些特定的EST被考虑用于我们的基因表达分析(表2)1).此外,由同一作者指定的EST为cad 2被发现是同源的CCR基因,因此以后将其重新命名为CCR5(表1和无花果。2).我们的研究也导致鉴定新的候选木质素生物合成基因属于摘要:(指定为C3H3),CCR(指定为CCR6),COMT的(指定为COMT3)基因家族(表1).
木质素生物合成候选基因的系统发育分析
对小麦候选木质素生物合成基因与来自其他物种的代表性同源基因(9至34个基因取决于基因家族)的系统发育分析表明,每个小麦候选基因都与来自其他物种的一个以上同源基因聚在一起,除了所有三种小麦COMT的基因形成了自己的组(图;2;额外的文件2:图S1,附加文件3.:图S2,附加文件4:图S3和附加文件5:图S4)。相比之下,六CCR基因分布在5个不同的进化支(图;2 b).总的来说,大多数小麦木质素生物合成基因主要是由来自单子叶植物的同源基因组成,而不是来自拟南芥和其他双子叶植物的同源基因(图2)。2;额外的文件2:图S1,附加文件3.:图S2,附加文件4:图S3和附加文件5:图S4)。
小麦品种的倒伏行为
Harvest和Kane是加拿大大草原小麦种植区广泛种植的品种[49].这两个品种在遗传上是密切相关的,因为它们是由一个涉及共同亲本系的杂交发展而来的;Kane源自AC Domain和McKenzie的杂交[35],以及从AC Domain*2和ND640的杂交中获取[36](*2表示两剂AC域;在最初的交叉之后再进行一次回交叉)。在拒绝住宿方面,嘉信和嘉实分别被评为“非常好”和“好”[50,51].从Harvest和Kane的登记数据中可以推断,Harvest在多个地点对每个品种与同一检查品种进行了三年多的比较,其住宿分数低于Kane;住宿以1 - 9分,1 =垂直,9 =平[35,36].凯恩表现出与对照品种AC Barrie一致的寄存分数(凯恩的平均寄存分数为第一年1.7分,第二年2.1分,第三年2.5分,而AC Barrie的平均寄存分数为第一年1.9分,第二年2.2分,第三年2.5分)[35].相比之下,Harvest表现出比对照品种AC Barrie更低的倒伏得分(Harvest在第1年平均为2.0,第2年平均为1.4,第3年平均为1.7,AC Barrie在第1年平均为2.6,第2年平均为2.4,第3年平均为2.5)[36].由于将每个品种与普通检查品种进行比较的研究是在不同的时间进行的,结果也表明,在Harvest性能测试的年份,倒伏的严重程度更严重。
木质素生物合成候选基因在不同小麦组织中的表达
木质素生物合成候选基因在小麦不同组织和不同时期的表达模式已被阐明[3.].鉴于候选基因的列表已经更新了最新的数据库(表1),我们的实验材料涉及不同于Bi等人使用的小麦品种。[3.],我们决定重新检测所有候选基因的时空表达模式。分析结果表明,所有候选基因在茎梗和/或节间组织中的表达量均高于旗叶/鞘CCR1而且CCR5基因在旗叶中的表达量显著高于本研究分析的其他组织COMT2而且cad 2在旗叶鞘和节间组织中均有高表达(附加文件)6:表S2)。的C3H2,CCoAOMT2而且CCR4在所有分析的组织中,基因的表达水平都非常低/无法检测到。
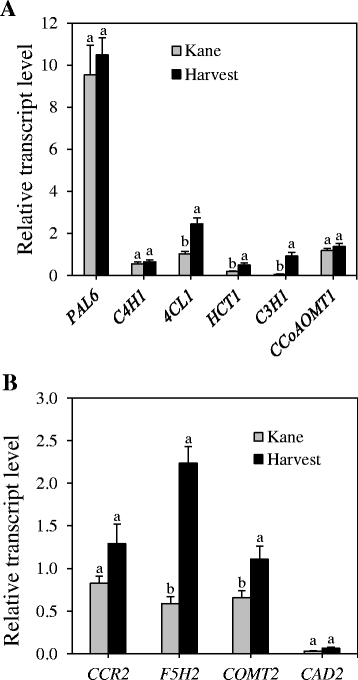
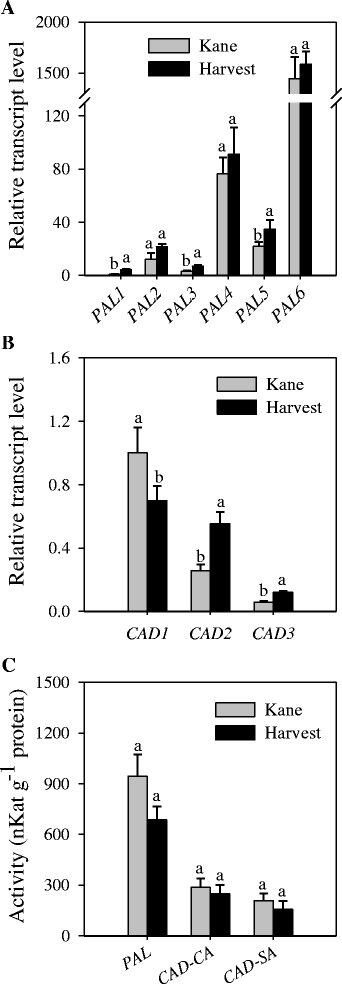
每个基因家族的特定成员包括PAL6,C4H1,4 cl1,HCT1,C3H1,CCoAOMT1,CCR2,F5H2而且COMT2在花序梗/节间表达量高(表2).从计算机辅助设计基因家族,两者的转录本cad 1而且cad 2在节间高度丰富,虽然转录水平cad 2是略高于的cad 1.不同节间切片的比较分析显示,这些基因大多在in -2&3和/或in -4切片中高表达(表2 -4)2).因此,我们进一步比较了两个抗倒伏程度不同的品种在in -2和3中的表达,而抗倒伏与茎秆木质素含量密切相关。从我们的分析来看4 cl1,HCT1,C3H1,F5H2而且COMT2基因在cv节间表现出较高的转录水平。收获比简历中多。凯恩(无花果。3.).虽然没有统计学意义,但较高的表达CCR2在cv节间也有明显的变化。收成。其他四个基因,PAL6,C4H1,CCoAOMT1而且cad 2,表现出相似的表达水平。
候选木质素生物合成基因对涝渍的转录反应
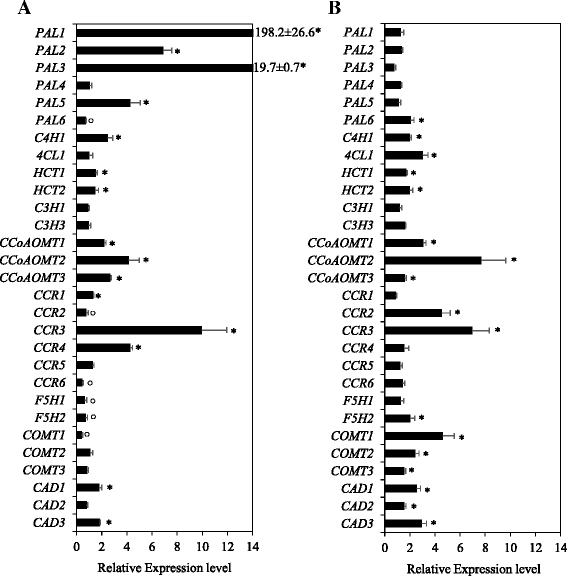
为了进一步了解涝渍对木质素生物合成基因的转录调控,我们对所有候选基因在涝渍植物节间的表达进行了分析。涝渍导致转录的显著抑制PAL6,4氯,CCR2,CCR6,F5H1,F5H2而且COMT1基因(图。4).另一方面,所有的朋友基因,除了PAL4而且PAL6,为应对内涝而上调;的表达式PAL1特别是诱导~200倍。然而,该基因在未处理对照植物节间的基础表达量相对较低(附加文件6:表S2)。其他对涝渍反应有2倍以上上调的基因包括C4H1,CCoAOMT1,CCoAOMT2,CCoAOMT3,CCR3而且CCR4.涝渍处理也能诱导其上调(约1.8倍)cad 1而且cad 3基因,虽然不是≥2倍。然而,的表达PAL4,4 cl1,C3H1,C3H3,COMT2,CCR5而且cad 2不受涝渍处理的影响。
木质素生物合成基因在节间和旗叶中对内涝响应的表达。各基因在节间的相对转录水平(一个)及旗叶(b)涝渍植物的组织。收获是相对于对照植物相应组织中检测到的收获,其值被任意设置为1。数据为3至4个独立的生物学重复±SE。*和○符号表明,在涝渍胁迫下,与对照相比,标靶基因分别有显著的上调和下调P< 0.05。C3H2未进行分析,因为在小麦的节间(in -2&3)和旗叶组织中未检测到该基因的转录本(见附加文件6:表S2)
为了更好地了解涝渍对木质素合成的影响,我们还对涝渍植物旗叶(叶片+鞘)木质素生物合成基因的表达进行了分析。内涝导致土壤中磷含量上调≥2倍PAL6,C4H1,4 cl1,CCoAOMT1,CCoAOMT2,CCR2,CCR3,F5H2,COMT1,COMT2,cad 1而且cad 3基因(图。4 b),其中PAL6,C4H1,4 cl1,CCoAOMT1,F5H2而且COMT2均为各自科系中叶组织中的优势基因(表2;额外的文件6:表S2)。虽然CCoAOMT2而且CCR3对涝渍反应有显著的诱导(超过7倍),其在对照未处理植株旗叶中的基础表达量非常低(附加文件)6:表S2)。
内涝引起≥2倍的上调PAL1,PAL2,PAL3,PAL5而且CCR4在节间明显,但在旗叶中不明显,在旗叶中它们的表达似乎不受涝渍的影响(图2)。4).而内涝导致土壤中磷含量上调≥2倍PAL6,4 cl1,CCR2,F5H2,COMT1而且COMT2在旗叶中,但在节间中没有,在节间中,它们的表达要么被抑制,要么不受影响。
木质素生物合成酶活性分析
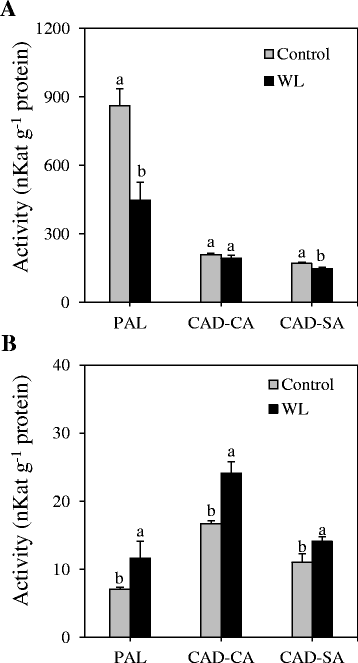
为了深入了解编码关键木质素生物合成酶的基因的转录和转录后调控之间的关系,我们测量了PAL催化苯丙醇途径第一步的活性和CAD催化单木质素途径最后一步的活性(图2)。1).我们的数据显示cv中节点间衍生PAL的活性略高。凯恩比在简历。收获(无花果。5度).两个品种间CAD-SA和CAD-CA活性基本相同。涝渍导致节点间衍生的PAL和CAD-SA酶活性显著降低,但对CAD-CA酶活性没有明显影响(图2)。6).然而,它导致旗叶来源的PAL、CAD-CA和CAD-SA酶活性显著增加(图。6 b).
主要木质纤维素成分分析
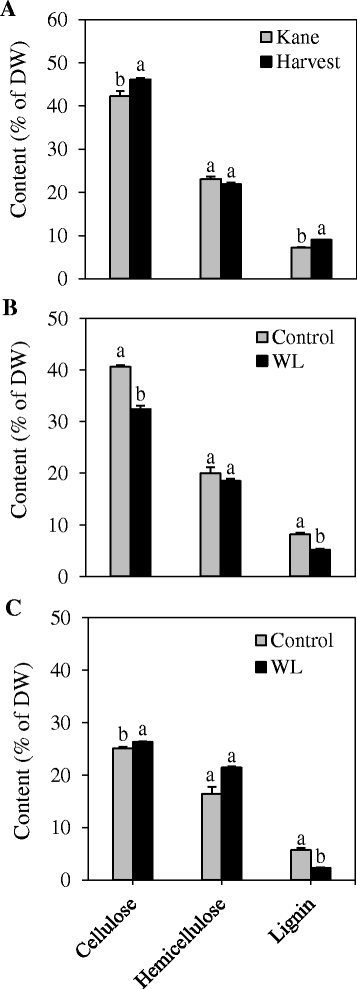
为了确定茎抗倒伏与木质素和其他细胞壁成分(包括纤维素和半纤维素)水平的关系,我们在cvs的节间组织中测定了它们的水平。Harvest和Kane。结间木质素含量。收获比在cv中观察到的高23%以上。凯恩(无花果。7一个).同样地,cv。收获比cv高9个百分点以上。凯恩。对于半纤维素,cv。Kane比cv高约6%。收成。渍水显著降低了节间组织中木质素含量(36%)和纤维素含量(20%);然而,对半纤维素含量没有明显的影响(图。7 b).结果表明,处理后旗叶木质素含量降低60%,纤维素和半纤维素含量分别提高5%和30%(图2)。7 c).
木质纤维素的主要成分概况。测定了凯恩和Harvest两个小麦品种节间的纤维素、半纤维素和木质素含量(一个),在节点间(b)和叶(ccv的组织。对涝渍的响应(WL)。数据为2至3个独立的生物学重复±SE。不同的信在每一种木质纤维成分中,在水平上显示出统计学上的显著差异P< 0.05。研究两个品种间木质纤维素主要成分数量差异的植物材料是在Super Mix中生长的(见方法),而研究内涝对木质纤维素主要成分水平影响的植物材料,则在粘土和沙子的混合土壤中生长(2:1,v:v)。
激素分析
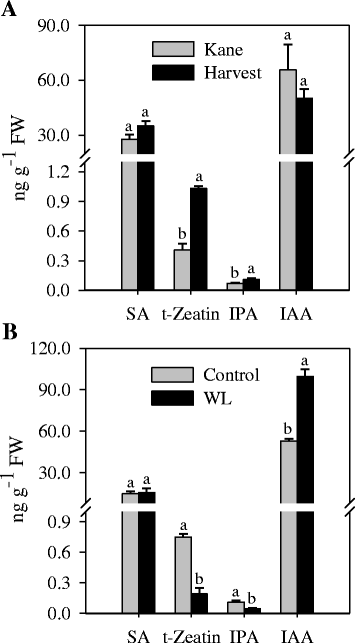
为了研究木质素水平与调节木质素生物合成的植物激素之间的关系,我们测量了节间组织中IAA、IPA和t-玉米素以及SA的含量。研究了玉米节间IPA、t-玉米素和SA的含量。结果表明,籽粒的收获量高于节间的收获量。而IAA含量与Kane无明显差异(图。8).内涝使木质素含量降低(图;7 c),导致IPA和t-玉米素水平显著降低。相比之下,IAA水平随着内涝而增加,而SA含量没有明显变化(图2)。8 b).
水杨酸(SA),细胞分裂素(t-玉米素和IPA)和生长素(IAA)的概况。测定了凯恩和Harvest两个小麦品种的节间激素水平(一个),并在cv的节间。因应内涝而进行的收割(b).数据为2至3个独立的生物学重复±SE。不同的信在各激素水平上均有统计学差异P< 0.05。研究两个品种间SA、t-玉米素、IPA和IAA水平差异的植物材料是在Super Mix中种植的(见方法),而研究涝渍对SA、t-zeatin、IPA和IAA水平影响的植物材料,在粘土和沙子的混合土壤(2:1,v:v)中种植。
讨论
为了深入了解调控小麦组织中木质素生物合成的分子基础,本研究首先检测了不同小麦组织中木质素生物合成基因的表达,然后比较了两个不同抗倒伏程度的小麦品种节间组织中所选基因的表达模式。该研究还调查了涝渍对木质素生物合成基因表达和主要木质纤维素成分水平的影响。此外,我们还评估了木质素含量是否与调节其他物种木质素生物合成的植物激素水平相关。
我们的基因表达数据表明高的转录丰度PAL6,C4H1,4 cl1,HCT1,C3H1,CCoAOMT1,CCR2,CCR5,F5H2,COMT2而且cad 2小麦组织中的基因(表2;额外的文件6:表S2),因此,这些基因更有可能在调控小麦木质素生物合成中发挥重要作用。这些结果与先前报道的木质素生物合成基因在小麦和拟南芥中的表达模式一致[3.,18].在茎内,较老的节间段似乎比较年轻的节间段有更高的候选基因表达。一致地,木质素生物合成基因的表达和木质素水平均随节间年龄的增加而增加[3.].虽然每个基因家族中的一个特定成员在不同的小麦组织中表现出显性表达,但该基因家族中的两个成员CCR基因家族具有组织特异性;CCR5主要表现在旗叶而CCR2在节点间(表2).之前也有研究表明我们指定为CCR2在淋巴结间表达较高[21].
我们进一步比较了两个抗倒伏程度不同的小麦品种Harvest和Kane的候选基因表达;简历。Harvest在农艺上比cv更抗倒伏。凯恩。叶片节间木质素含量较高。收获比cv多。凯恩(无花果。7一个)表明茎秆机械强度/抗倒伏能力与茎秆木质素含量密切相关[12,22].柑桔节间木质素含量与柑桔节间木质素含量的关系。用表达来收获4 cl1,CCR2,F5H2而且COMT2基因反映了这些特定基因在调控小麦茎秆机械强度/抗倒伏中木质素含量方面的意义。小麦茎秆木质素含量与基因表达密切相关CCR而且COMT的相应酶的基因和活性在以前也有报道[12,21].然而,这两个品种在抗倒伏能力上的差异也可能至少部分是由于其他因素造成的,这些因素影响茎的硬度和厚度,而不是节间木质素含量,例如纤维素和半纤维素的密度、次生细胞壁的结构特性以及与皮质纤维组织相关的结构性状[52- - - - - -54].一致地,在缺乏木质素的水稻品种a中,茎秆机械强度的增强已被证明与高密度的纤维素和半纤维素、发育良好的次生细胞壁和皮层纤维组织的厚层有关[53].
植物木质素的生物合成受到生物和非生物胁迫因子的共同影响[55].涝渍是非生物胁迫因素之一,可引起叶片光合能力降低[56,57]和可溶性碳水化合物在植物生物量中的积累[27].此外,它还会引发对可溶性糖的需求增加,特别是葡萄糖[58,59],这可能导致更多的磷酸烯醇丙酮酸转向糖酵解,而不是转向莽草酸途径,产生重要的木质素前体苯丙氨酸[20.].这些变化对纤维素、半纤维素和木质素等结构碳水化合物聚合物的含量和/或组成具有重要意义[60,61].在渍水胁迫下,节间叶和旗叶组织中的木质素水平均显著降低。7 b, c).在节间,内涝也使纤维素含量显著降低;导致结构性碳水化合物总量的减少。由于木质素等结构碳水化合物成分的合成是一个消耗能量且不可逆的过程[62,63],降低它们的水平可能是植物在内涝条件下所采取的节能/碳节约策略之一[24,25].然而,在旗叶中,木质素含量的下降似乎被纤维素和半纤维素水平的显著增加所补偿。7 b).
在小麦生物量中被鉴定为高表达的基因中,转录抑制PAL6,CCR2而且F5H2尤其在涝渍小麦植株的节间明显(图2)。4 b),表明这些基因在这种胁迫条件下调节节间木质素形成的重要性。与木质素的剖面和表达相一致PAL6基因,涝渍导致节间衍生PAL活性降低(图2)。6),是一种催化一般苯丙烷途径的第一步,从而控制木质素合成的酶[15,16].相反,内涝介导的节间和叶片组织木质素含量的降低伴随着木质素含量的上调PAL1,2,3.而且5在节间和PAL6在叶子里;upregulation的PAL6与PAL酶活性的增加有关考虑到那个人朋友基因对非生物压力的不同反应[64]和一些朋友基因与其他苯丙类分子的合成有关,如单宁和花青素[65,66],它们在不同的应激反应中发挥作用[67,68],很可能是朋友涝渍植物组织中上调的基因在增强抵御涝渍胁迫的分子生产中起着重要作用。自PAL1,2,3.而且5涝渍节点间基因上调而PAL活性大幅降低,不能排除这些基因受到转录后调控的可能性。为了支持这一点,Kelch重复F-box (KFB)蛋白介导的泛素化和PAL同工酶的降解已被证明发生在拟南芥中[69].此外,磷酸肽在PAL的映射玉米而且Medicago truncatula导致人们推测PAL活性可以通过磷酸化在转录后调控[70].
涝渍显著降低了木质素含量,并诱导其下游数个基因表达上调≥2倍朋友包括C4H1,HCT1而且CCoAOMT1在节间和C4H1,4 cl1,HCT1,CCoAOMT1,F5H2,COMT2,cad 1而且cad 3叶片中的基因(图;4);以及归纳cad 1而且cad 3与CAD活性增加相关(图。6 b).先前的研究表明,苯丙烷/单木质素途径中间体不仅可以作为木质素的前体,还可以作为一系列次生代谢产物的前体,如类黄酮、香豆素、二苯乙烯、羟基肉桂酸缀合物和木聚糖,这些物质在应激相关过程中发挥重要作用[64,66].在胁迫条件下,当光合作用次优时,植物可能会重新引导苯丙烷/单木质素途径中间产物生产这些次生代谢产物[64].因此,涝渍诱导下游的几个木质素生物合成基因上调朋友在节间组织和叶片组织中,木质素水平的降低可能表明这些基因以木质素为代价,增加抗胁迫次生代谢产物的合成,以帮助植物克服涝渍的不利影响。为了支持这一假设,酶的一些亚型或下游基因的家族成员朋友已涉及苯丙类衍生次级代谢物的合成[66,71].然而,不能排除这些下游单木酚通路基因的转录后调控的可能性,因为最近在杨树中的研究表明,5-羟基针叶醛的活性O-甲基转移酶(AldOMT)/COMT可通过磷酸化调控[72],一些物种的CAD和CCR中含有磷酸化肽,作为磷酸化介导的转录后调节位点[70].
以往的研究为不同植物激素在植物组织中木质素合成调控中的作用提供了重要的见解。例如,在通过下调木质素生物合成基因降低木质素含量的植物中,SA和木质素水平已被证明呈反比关系,并且据报道SA可介导这些植物的生长减少[34].然而,遗传降低SA水平可以恢复生长,但不能恢复木质素含量。在cvs的节间间存在类似数量的SA。Harvest和Kane(图。8)或从涝渍植物和对照植物中提取的植物(图。8 b),而不考虑其木质素含量的差异,这可能意味着SA并不直接影响木质素的形成。IAA与木质素水平之间的密切联系已被报道,IAA诱导木质素生物合成基因的表达和相应酶的活性,从而木质化[30.,32].而木质素含量不同的两个品种的节间IAA水平相似(图2)。8).此外,涝渍小麦植株的节间,其木质素含量降低(图。7 b)中IAA含量高于对照植物(图;8 b).这些结果可能暗示了IAA信号而非IAA水平在控制小麦茎秆木质素形成中的作用。与它们促进木质素合成的作用一致[30.,32], IPA和t-玉米素两种活性细胞分裂素的含量与节间木质素含量直接相关,说明可以通过调控细胞分裂素、IPA和t-玉米素的水平来优化小麦生物量中木质素的水平。由于这些植物激素也能影响其他植物发育过程,从而可能影响细胞壁特性和组成[73],需要进一步研究它们在确定小麦组织木质素形成中的具体生理作用。最近的一份报告还指出,其他激素如亚基酸、油菜素内酯、茉莉酸酯和乙烯也可调节细胞壁的性质和组成[73,74].鉴于植物激素在调节多种植物发育过程中或协同或拮抗地相互作用[75],阐明激素相互作用在控制小麦组织木质素合成中的作用的分子机制是重要的。
结论
本研究结果表明,在小麦组织中高表达的木质素生物合成候选基因中,木质素生物合成基因的表达量明显降低4 cl1,C3H1,CCR2,F5H2而且COMT2似乎与节间木质素含量有关,这至少在一定程度上有助于抗倒伏。涝渍小麦节间木质素含量的降低似乎是由转录抑制介导的PAL6,CCR2而且F5H2这些基因在调节木质素水平方面具有重要意义。此外,节间木质素含量的变化伴随着细胞分裂素、IPA和t-玉米素水平的变化,表明细胞分裂素在调节小麦生物量木质素沉积中起着重要作用。鉴于麦秸的机械强度/抗倒伏能力、对生物和非生物胁迫的耐受性以及原料质量与木质素含量密切相关,本研究结果为我们理解小麦生物质木质素形成的分子机制提供了重要的见解。这是开发分子工具的重要一步,可以促进具有优化木质素含量的小麦品种的育种,在不影响木质素相关农艺性状的情况下提高小麦秸秆的原料质量。
支持数据的可用性
支持本文结论的数据集包含在本文及其附加文件中。
缩写
- ADF:
-
酸性洗涤纤维
- 计算机辅助设计:
-
肉桂醇脱氢酶
- CAD-CA:
-
针叶醛识别CAD
- CAD-SA:
-
大豆醛识别CAD
- :
-
节间
- NDF:
-
中性洗涤纤维
- 旅客:
-
愈创木酯木质素的单位
- H:
-
木质素的羟基苯基单位
- 史:
-
木质素的丁香基单位
参考文献
范霍梅,李志强,李志强,李志强。木质素的生物合成与结构研究。植物科学进展。2010;
刘佳杰,王丽娟,王丽娟,王磊。苯丙素通路与植物防御的基因组学研究。植物病理学杂志,2002;3:371-90。
毕成,陈芳,李伟,陈峰,李伟。真菌侵染对小麦木质素生物合成基因表达的影响。植物分子生物学杂志2011;29:49 - 61。
戴穆拉,叶振华。植物生物量生产的调节。植物学报,2010;13:299-304。
Sokhansanj S, Mani S, Stumborg M, Samson R, Fenton J.加拿大大草原谷物秸秆的生产和分布。农业工程学报。2006;48:39-46。
Somerville C, young H, Taylor C, Davis SC, Long SP.木质纤维素生物燃料的原料。科学。2010;329:790-2。
生物质乙醇生产:技术和商业化现状。《微生物学》2001;4:24 - 9。
基廷JD,潘加尼班C,曼斯菲尔德SD。产乙醇酵母对木质纤维素抑制性化合物的耐受性和适应性。生物工程学报。2006;29(3):366 - 366。
李霞,翁建科,夏平。木质素改性对生物质的影响。植物J. 2008; 54:569-81。
西蒙斯BA, Loque D, Ralph J.改性木质素增强生物燃料生产的进展。植物学报,2010;13:313-20。
付c, Mielenz JR,肖x,葛y, Hamilton CY, Rodriguez JR M,等。木质素的遗传调控降低了柳枝稷的顽固性,提高了乙醇产量。中国科学院学报(自然科学版),2011;
这么多。咖啡酸3- o -甲基转移酶在两种不同抗倒伏基因型小麦中的表达。中国机械工程学报,2009;30(2):344 - 344。
Foulkes MJ, Slafer GA, Davies WJ, Berry PM, Sylvester-Bradley R, Martre P,等。提高小麦产量潜力。3优化粮食分配,同时保持抗倒伏。中国科学(d辑),2011;
Ralph J, Lundquist K, Brunow G, Lu F, Kim H, Schatz PF,等。木质素:4-羟基苯-丙类化合物氧化偶联形成的天然聚合物。植物化学,2004;3:29-60。
Whetten R, Sederoff R.木质素生物合成。《植物科学》1995;7:1 - 13。
吴国强,李志强,李志强。木质素的性质和功能。上榜:Barton SDHR, Nakanishi K, Meth-Cohn O,编辑。综合天然产物化学。牛津大学:爱思唯尔;1999.p . 617 - 745。
Baucher M, Chabbert B, Pilate G, Van Doorsselaere J, Tollier MT, Petit-Conil M,等。下调肉桂醇脱氢酶对杨树木质素提取率的影响。植物物理学报。1996;12:1479 - 90。
Raes J, Rohde A, Christensen JH, Van de Peer Y, Boerjan W.拟南芥木质化工具箱的全基因组特征。植物物理学报,2003;
徐震,张东,胡娟,周欣,叶霞,Reichel K,等。植物界木质素生物合成基因家族的比较基因组分析。BMC生物信息学。2009;10:S3。
范霍姆R, Storme V, Vanholme B, Sundin L, Christensen JH, Goeminne G,等。拟南芥木质素生物合成扰动响应的系统生物学观点。《植物科学》2012;24:35 6 - 29。
这么多。与小麦茎发育相关的肉桂酰辅酶a还原酶的特征。中国科学(d辑),2007;
这么多。小麦木质素生物合成中肉桂醇脱氢酶的功能分析。中国科学(d辑),2010;
Sairam RK, Kumutha D, Ezhilmathi K, Deshmukh PS, Srivastava GC。植物耐涝生理生化研究。生物植物。2008;52:401-12。
缺氧和根代谢:缺氧和缺氧下的损伤和驯化。植物物理学报,1997;48:423 - 423。
李嘉德B,库伊I,雷蒙德P, Saglio PH,圣格斯V, Pradet A.缺氧和缺氧条件下植物代谢。植物物理与生物化学。1994;32:1-10。
Lasanthi-Kudahettige R, Magneschi L, Loreti E, Gonzali S, Licausi F, Novi G,等。缺氧水稻胚芽鞘的转录谱分析。植物物理学报。2007;44:218 - 31。
Albrecht G, Kammerer S, Praznik W, Wiedenroth EM.小麦幼苗果聚糖含量(小麦l)在缺氧条件下再通气。新植物,1993;123:471-6。
Albrecht G, Mustroph A.蔗糖合酶在小麦根系中的定位:蔗糖合酶原位活性的增加与缺氧下纤维素沉积引起的细胞壁增厚有关。足底。2003;217:252-60。
杰克逊MB,阿姆斯特朗W.通气组织的形成和植物通风过程与土壤淹水和淹没。植物学报1999;1:274-87。
古铁雷斯J,洛佩兹·努涅斯-弗洛雷斯MJ,戈麦斯-罗斯LV,诺沃·乌扎尔E,埃斯特班·卡拉斯科A,迪亚兹J,等。激素调节的碱性过氧化物酶同工酶Zinnia线虫.足底。2009;230:767 - 78。
López Núñez-Flores MJ, Gutiérrez J, Gómez-Ros LV, Novo Uzal E, Sottomayor M, Ros Barceló A.碱性过氧化物酶同工酶的下调Zinnia线虫用赤霉素。中国植物学报,2010;
埃雷罗,埃斯特班·卡拉斯科,萨帕塔JM。拟南芥参与木质素生物合成的过氧化物酶:在硅启动子分析和激素调节。植物化学学报,2014;
Tamaoki D, Karahara I, Nishiuchi T, Wakasugi T, Yamada K, Kamisaka S.生长素动态在重力诱导下促进拟南芥花序茎木质素相关基因表达的参与。中国科学(d辑),2011;
Gallego-Giraldo L, Escamilla-Trevino L, Jackson LA, Dixon RA。水杨酸介导木质素下调植物的生长减慢。中国环境科学学报(英文版);2011;
福克斯SL,汉弗莱斯DG,布朗PD,汤利史密斯TF,麦卡勒姆BD, Fetch TG,等。凯恩硬红春小麦。植物科学进展,2007;26(3):344 - 344。
Fox SL, Townley-Smith TF, Thomas JB, Humphreys DG, Brown PD, McCallum BD,等。收获硬红春小麦。植物科学进展(英文版);2010;
小麦基因索引FTP站点。ftp://occams.dfci.harvard.edu/pub/bio/tgi/data/Triticum_aestivum/(2014)。2014年9月5日访问。
小麦: UniGene Build #63。国家生物技术信息中心,贝塞斯达,2015。http://www.ncbi.nlm.nih.gov/UniGene/UGOrg.cgi?TAXID=4565.2015年2月10日访问。
GenBank核苷酸数据库。国家生物技术信息中心,贝塞斯达,2015。http://www.ncbi.nlm.nih.gov/nuccore.2015年9月1日访问。
拉金MA, Blackshields G, Brown NP, Chenna R, McGettigan PA, McWilliam H,等。Clustal W和Clustal X 2.0版本。生物信息学。2007;23:2947-8。
Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析版本6.0。中国生物医学杂志,2013;30:2725-9。
Livak KJ, Schmittgen TD。相关基因表达数据的分析采用实时定量PCR和2——ΔΔCT方法。方法。2001;25:402-8。
张凯,钱强,黄志,王勇,李明,洪磊,等。GOLD HULL和INTERNODE2编码水稻中一个主要的多功能肉桂醇脱氢酶。植物学报。2006;40:972 - 83。
类异黄酮植物抗毒素及其生物合成酶。进:Gurr SJ, McPherson MJ, Bowles DJ,编辑。分子植物病理学,一种实用的方法。纽约:牛津大学出版社;1992.45 - 62页。
小拉蒂默。AOAC国际官方分析方法,2012年第19版。
Kanno Y, Jikumaru Y, Hanada A, Nambara E, Abrams SR, Kamiya Y,等。发育拟南芥种子的综合激素分析:ABA生物合成、ABA转运和激素相互作用位点的检测。植物生理学报,2010;
吉本K, Jikumaru Y,神谷Y,草野M,辅音尼C, Panstruga R,等。拟南芥自噬通过控制衰老过程中npr1依赖的水杨酸信号通路和先天免疫应答负向调控细胞死亡。植物学报。2009;21:2914-27。
Payne R, Murray D, Harding S, Raird D, Sourta D. GenStat for Windows(第12版)简介。Hemel Hempstead: VSN International;2009.
曼尼托巴农业服务公司。曼尼托巴2015年投降。加拿大马尼托巴省温尼伯:农场商业通讯;2015.
曼尼托巴农业,食品和农村发展,曼尼托巴种子种植者协会。种子马尼托巴2016。加拿大马尼托巴省温尼伯:马尼托巴省合作者;2015.
萨斯喀彻温省农业部。粮食作物的品种。加拿大萨斯喀彻温省里贾纳:萨斯喀彻温省政府;2015.
松田,江原,张南,等。水稻茎秆下部节间断裂抗性的组织学研究:IV.节间和叶鞘各组织在断裂抗性中的作用。中国农业科学(英文版),2003;
Ookawa T,井上K,松冈M, Ebitani T, Takarada T,山本T,等。提高长秆、低木质素gh2水稻的抗倒伏能力,以改善饲料和生物能源生产。科学通报2014;4:6567。
田中K,村田K,山崎M, Onosato K, Miyao A, Hirochika H.三种不同的水稻纤维素合成酶催化亚基基因在次生壁中合成纤维素。植物物理学报。2003;133:73-83。
Moura JC, Bonine CA, de Oliveira Fernandes Viana J, Dornelas MC, Mazzafera P.植物非生物和生物胁迫与木质素含量和组成的变化。中国生物工程学报,2010;
马斯格雷夫我。涝渍对8个冬小麦品种产量和光合作用的影响。作物科学1994;34:1314-8。
梅斯瑞勒CN, Buck F, Lüthje S.淹水胁迫对玉米幼苗可溶性III类过氧化物酶的影响。中国科学院学报(自然科学版),2014;
黄波,约翰逊JW。两个基因型小麦根系呼吸和碳水化合物状态对缺氧的响应。张志强,1995;25(5):427 - 32。
黄斌,李志强,李志强,李志强。小麦根系特征及其对低氧和乙烯响应的生理活性。作物科学,1997;37:812-8。
李志强,李志强,李志强,等。糖信号与植物生长发育的关系。中国科学(d辑),2014;
Usadel B, Blasing OE, Gibon Y, Retzlaff K, Hohne M, Gunther M,等。拟南芥玫瑰花结碳水化合物逐渐耗竭过程中,整体转录水平对碳状态的微小变化作出反应。植物物理学报。2008;146:1834-61。
Amthor JS。木质素生物合成效率的定量分析。杨文强,2003;21(3):377 - 382。
赵q, Dixon RA。木质素生物合成的转录网络:比我们想象的更复杂?植物科学进展(英文版);2011;
苯丙类生物合成。Mol Plant, 2010; 3:2-20。
高艳艳,哈丁萨,蔡昌杰。两种不同苯丙氨酸解氨酶基因在震杨凝集单宁和木质化细胞中的差异表达。植物物理学报,2002;30(2):796 - 807。
张晓明,张晓明,张晓明,等。拟南芥苯丙素途径研究。拟南芥之书/美国植物生物学家学会。2011;9,e0152。
花青素在植物胁迫反应中的环境意义。光化学与生物工程。1999;30(1):1 - 9。
Peter Constabel C, Yoshida K, Walker V.植物单宁的不同生态作用:植物防御和超越。入:罗曼尼A,拉坦齐奥V,奎多S,编辑。多酚研究的最新进展。英国奇切斯特:John Wiley & Sons, Ltd;2014.115 - 42页。
张旭,苟敏,刘成杰。拟南芥Kelch重复F-box蛋白通过控制苯丙氨酸解氨酶的周转调节苯丙醇的生物合成。《植物科学》2013;
程宏,邓伟,王勇,任军,刘志刚,薛艳。植物蛋白磷酸化的综合数据库。数据库。2014;2014:bau121。
杨晓明,杨晓明,杨晓明,Loqué D.木质素生物工程。生物技术,2014;26:189-98。
王建平,庄林,Loziuk PL,陈华,林永春,史锐,等。磷酸化是杨树单木酚生物合成中5-羟基针叶醛o -甲基转移酶活性的开关。中国科学院学报(自然科学版)2015;
李志刚,李志刚,李志刚。植物与坏死性病原体相互作用中细胞壁与植物激素的相互作用。植物化学,2015;112:63 - 71。
植物细胞壁完整性维持机制——细胞壁质膜信号网络的一个案例研究。植物化学。2015;112:100-9。
范士林,Benková E.激素与植物发育的相互作用。细胞发育生物学,2012;28:463-87。
确认
这项工作得到了卓越中心网络计划-加拿大生物燃料网和马尼托巴卓越中心基金的资助,马尼托巴大学研究生奖学金给T-NN。作者要感谢Stephen Fox博士提供种子,以及Feng Gao和Zhen Yao的技术支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者宣称他们之间没有利益冲突。
作者的贡献
BTA构想了这个实验。BTA和T-NN设计了实验并撰写了手稿。BTA、T-NN和SHS分别进行实验和数据分析。MCJ和DBL提供了材料,并为项目方向提供了意见。所有作者都阅读并批准了最终的手稿。
附加文件
附加文件1:表S1。
用于木质素特定生物合成基因qPCR检测的引物序列。引物序列是针对新发现的候选木质素生物合成基因设计的,或在先前报道引物的情况下重新设计[3.]不表现出靶基因特异性。(PDF 12kb)
附加文件5:图S4。
小麦的系统发育关系F5H而且计算机辅助设计与其他物种同源的基因。系统发育树F5H(A, B)和计算机辅助设计(C)基于14个小麦基因的核酸序列相似性生成F5H和22计算机辅助设计从NCBI核苷酸数据库中鉴定的其他单子叶和双子叶物种的基因[39]使用MEGA程序[41],采用基于Tamura-nei模型的最大似然法推断树。在500个重复的自举试验中,相关类群聚集在一起的复制树的百分比显示在分支旁边。小麦产生了两个独立的系统发生树F5H1(一)和F5H2(B)基因与MEGA之间找不到共同位点F5H1而且F5H2.●,小麦候选基因;▲,拟南芥以外双叶芥的基因;*,小麦序列用于分析。(PDF 178kb)
附加文件6:表S2。
小麦不同组织中木质素生物合成候选基因的相对转录水平。不同组织的转录水平。收成相对于的收成表示4 cl1在标志叶中,该值被任意设置为1。数据为2至3个独立的生物学重复±SE。各基因内不同字母后的均值在P< 0.05。Nd,未检测到;FB,旗状叶片;FS,旗叶鞘;PE、花梗;IN-1,第一节间;IN-2&3,第二和第三节间;IN-4,第四个节间(参见方法节为节点间的数值指定)。(PDF 106kb)
权利和权限
开放获取本文根据创作共用属性4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条所提供的资料。
关于本文
引用本文
阮,TN.,孙,S.,乔丹,M.C.et al。小麦木质素的生物合成(小麦L.):它对内涝的反应和与激素水平的关系。BMC植物生物学16日,28(2016)。https://doi.org/10.1186/s12870-016-0717-4
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-016-0717-4
关键字
- 基因表达
- 植物激素
- 木质素
- 住宿
- 洪涝灾害
- 小麦