抽象的
背景
钙作为第二信使,将细胞外信号转导到细胞反应中。胞质钙浓度的升高是植物暴露于微生物相关分子模式(MAMPs)后的最初反应之一。我们之前报道过拟南芥蒂利亚纳变种人改变了钙海拔“(cceflg22是一种由细菌鞭毛蛋白衍生的22氨基酸MAMP。
结果
在这里,我们描述了CCE2.突变体及其弱等位基因突变体,CCE3..除了FLG22之外,突变体还通过降低的钙升高对几种其他扫描物和植物内源性肽进行抗衡,该植物在伤害期间从预蛋白质蛋白质蛋白质解除。下游防御相关的事件如此FLG22诱导的丝裂剂活化蛋白激酶活化,反应性氧物质的积累和生长滞留也衰减cce2 / cce3.通过基因定位,下一代测序和等位基因分析,CCE2 / CCE3被确定为ALG3.(天冬酰胺连接的糖基化3).这对α-1,3-甘露糖基转移酶编码负责核心寡糖GLC的第一步3.男人。9GlcNAc2聚糖组件在内质网(ER)腔侧。酵母的互补测定和聚糖分析ALG3.突变体证实了该基因编码的蛋白质的酶功能降低cce2 / cce3等位基因-导致M5的积累呃,在ER中发现不成熟的五种含有含有的寡糖结构。ER / GOLGI加工和将膜蛋白的运输到质膜需要适当的蛋白质糖基化。FLG22受体,FLS2的内皮糖苷酶H-不敏感性,在cce2 / cce3突变体表明受体中改变了聚糖结构。
结论
对MAMP受体(或其他出口蛋白质)的适当糖基化是对MAMPS的最佳反应所必需的,对宿主植物的免疫信号传导至关重要。
背景
为了最佳的增长,植物需要抵御病原体攻击。除了预先形成的屏障外,初始电阻机制之一依赖于在感染过程中释放的保守的微生物或病原体相关分子模式(MAMPS / PAMP)或内源植物分子的感测(所谓的损伤相关分子图案,潮湿).这激活了信令事件,以协调本地和系统防御响应并安装所谓的模式触发免疫(PTI)[1].由植物识别的MAMPS包括微生物电池壁组分,例如脂多糖(LPS)[2],肽聚糖[3.甲壳素[4- - - - - -8或细菌蛋白如鞭毛蛋白[9]或EF-Tu [10],而DAMPs可能是细胞外ATP [11],从果胶中释放的少杀菌酸酐[12或植物肽称为百事可乐[13].
MAMPs/DAMPs的感知是在与同源模式识别受体(PRRs)结合后实现的,PRRs通常是表面定位蛋白,具有一个用于配体结合的胞外外域,一个单通道跨膜域,在某些情况下,还有胞内信号域(见下)[14].不同的外结构域(如LysM、富含亮氨酸重复序列(LRR)、凝集素和表皮生长因子(EGF)样结构域)对应于它们结合的不同种类的分子(全面综述见[15])。在植物中,大多数lrr型受体识别肽MAMPs,而已知的含有LysM-、凝集素-和egf -样结构域的受体结合不同的(脂)聚糖结构[16].具有胞内激酶结构域的prr被指定为类受体激酶(receptor-like kinases, RLKs),缺乏此类信号域的prr被分类为类受体蛋白(receptor-like proteins, RLPs) [17].RLKs和RLPs都与共受体或适配器蛋白形成杂合物,以充分诱导免疫信号。这类蛋白伴侣的例子包括SERK(体细胞胚胎发生受体激酶)家族成员和/或SOBIR1 (BIR1抑制因子)[18].对于诸如Cerk1(Chitin Elicitor受体激酶1)的Lysm-Domain PRR,两个相互作用的激酶,lik1 [19]及LYK5 [20.,调控几丁质信号。与早期显示几丁质诱导的CERK1二聚形成最佳几丁质结合袋的研究相反[21, LYK5-CERK1异源二聚体现在被认为是主要的几丁质受体,比CERK1同源二聚体具有更高的亲和力[20.].
在MAMP/DAMP与受体结合后,CIS.和反式受体复合物组分之间的磷酸化[9]免疫应答需要其他细胞内靶标的磷酸化。PRR络合物的一类细胞内磷酸化靶标是受体样细胞质激酶(RLCK),例如Bik1(Botrytis诱导的激酶1)和Bik1 / PBL(AVRPPHB敏感1状)家族的其他成员,如PBL1,PBL2和pbl5,以及Bsk1(芸苔类固醇受体 - 信令Kinase1)[22- - - - - -25].这些rlck在磷酸化时从受体复合物中释放出来,进而可使下游底物磷酸化。NADPH氧化酶RBOHD(呼吸爆发氧化酶同系物D),是感知MAMP时质外体活性氧(ROS)的主要来源[26,27,最近被描述为BIK1的目标,直接将模式识别与防御和信号输出联系起来[28,29].RBOHD也由钙依赖性蛋白激酶,CPK5靶向30.,表明活性氧、磷酸化和钙信号的相互作用。
作为完整的膜蛋白,PRRs受到内质网(ER)的质量控制和天门冬酰胺连接糖基化的相关性(N-糖基化)的受体功能和PTI已被证明[31- - - - - -34].N-糖基化是一种保守的蛋白质修饰[35].在真核生物中,这是通过ER腔中的寡核酸转移酶(OST)复合物(ER腔中的OligosacCharyl转移酶(OST)复合物)达到,其将预形成的四糖(所谓的核糖寡糖)转移到新生多肽,因为它通过转移翻译翻译。通过称为ALG的一系列糖基转移酶(天冬酰胺连接的糖基化)预先组装在ER膜的两张面上的二醇 - 焦磷酸盐(DOL-PP)载体上。有关路径的摘要,请参阅附加文件1:图S1。合成从膜的细胞质面开始通过顺序转移开始N- 乙酰甘氨酸胺(GLCNAC)和甘露糖(人)残留物到生长的聚糖结构。在翻转膜之后,通过转移人和葡萄糖(GLC)残留物,通过ER局部化藻对ER膜的腔面进行最终合成步骤。完成的glycan(glc3.男人。9GlcNAc2),然后转移en bloc.通过OST复合物生长多肽[36].N- 糖基化会影响改性蛋白质的生物学功能;其中一个是在Calnexin / CalreteLIN(CNX / CRT)循环期间蛋白质折叠的ER质量控制。简而言之,展开蛋白质分别经历甘油糖蛋白或UDP-葡萄糖酶或糖糖苷:糖蛋白葡萄糖糖基转移酶的循环颗粒,糖蛋白:糖蛋白葡萄糖糖基转移酶,促进与CNX或CRT的结合或解离,这是针对单葡聚糖化的核糖寡糖的凝集素。重复这直至蛋白质正确折叠,由此最终的聚糖修整步骤通过CNX和CRT释放蛋白质,并允许蛋白质将ER出来给Golgi复合物。如果蛋白质保持展开,则靶向ER相关的降解(ERAD)[37].所以,N -糖基化对所有分泌蛋白和膜蛋白的质量控制都很重要。在MAMP信号转导的情况下,具有非功能性calreticulin 3 (CRT3)或OST亚基的植物,其ef - tu受体EFR的积累水平较野生型低,更容易受到mam的感染假单胞菌含油PV。番茄 (PTO.)DC3000。令人惊讶的是,FLS2受体的功能和蛋白质水平似乎对影响较小CRT3.和奥斯特突变体(32,34,38].
在PRR激活,ROS和一氧化氮产生之后,MAPK激活以及离子熔融(包括细胞钙浓度的增加)构成协调/潮湿信号转导的早期信令步骤。响应于MAMPS / DAMPS的血浆膜钙通道的分子标识仍然尚不清楚[18].钙信号突变体的分离表明受体复合物和钙通量调节通道之间有非常密切的联系[39].迄今为止没有直接相互作用,遗传和基于抑制剂的研究表明通道可以通过PRR复杂组分或其下游靶(S)通过磷酸化激活[24].或者,如提出的Pep1(潮湿)受体(PEPR1),PEPR1的瓜旺环酶活性产生CGMP以激活CNGC2环状核苷酸门控钙通道[40].rapidopsis ca.2+-ATPase ACA8调控MAMP反应,直接与鞭毛蛋白受体FLS2相互作用[41.].这些发现支持与植物免疫信号传导中的受体复合物密切关联和钙信号传导紧密整合的假设。
为了阐明MAMP介导的钙信号通路,我们以前描述了几种突变体的分离改变了钙海拔(cce)表型使用鞭毛蛋白衍生的flg22肽。除了几个新FLS2.和Bak1.(BRI1受体相关受体激酶1)等位基因,cce确定具有增强或降低钙升高的突变体[39].在这项工作中,我们证明了等位基因CCE2.和CCE3.突变体是由突变引起的天冬酰胺连接糖基化3,从而导致多个prr糖基化不足,并影响MAMP/DAMP信号通路。
结果
两者的遗传分析改变了钙海拔突变体,CCE2.和CCE3.
我们在FLG22治疗后测试了三种先前报告的突变体,减少了钙升高[39等位性)。在杂交的F1代幼苗中缺乏互补CCE2.和CCE3.突变体表明这些是等位基因的。相比之下,CCE1.突变体补充说CCE2.或CCE3.并且在不同的基因上发生突变(图。1).在本报告的其余部分,我们将集中描述CCE2./CCE3.轨迹。
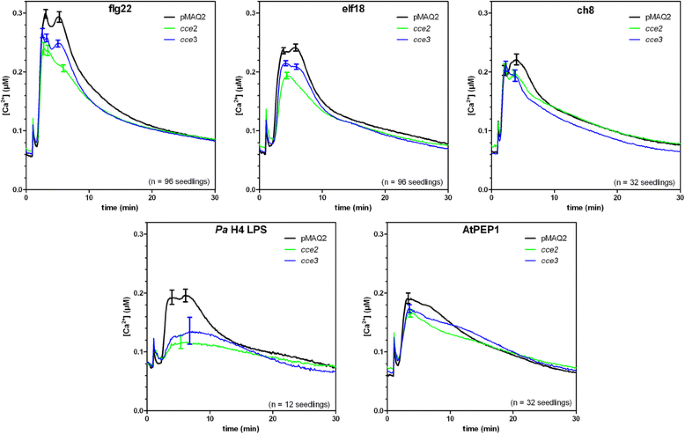
进一步的十字架是用的Bak1.或FLS2.排除变种人CCE2./CCE3.是已知的FLG22信号传导组分的弱突变等位基因,其已被证明会影响钙升高。在f1之间的交叉Bak1.和CCE2.或CCE3.,FLG22诱导的钙升高恢复到与亲本PMAQ2线类似的水平(图。1 b).相比之下,十字架FLS2.没有补充cce2 / cce3表现型。而对这一观察结果的初步推断是CCE2./CCE3.事实上突变了FLS2,在一个4031 bp的扩增子序列中未检测到突变FLS2基因cce2 / cce3突变体(39].此外,降低的钙高度升高cce2 / cce3用其他MAMPs/DAMPs如elf18、几丁质、LPS和AtPep1处理后也可以看到突变。2).这种广泛的频谱效应cce2 / cce3对多种MAMPS / DAMPS的突变反对特异性PRR基因中的突变,但对于受体功能所需的常见因素。来自这些测量的也值得注意的是,对MAMP / DAMP诱导的钙高度的降低更加明显CCE2.比CCE3.(图。2),这表明CCE3.与...相比是一种较弱的突变CCE2..
突变的flg22诱导的反应cce2 / cce3突变体
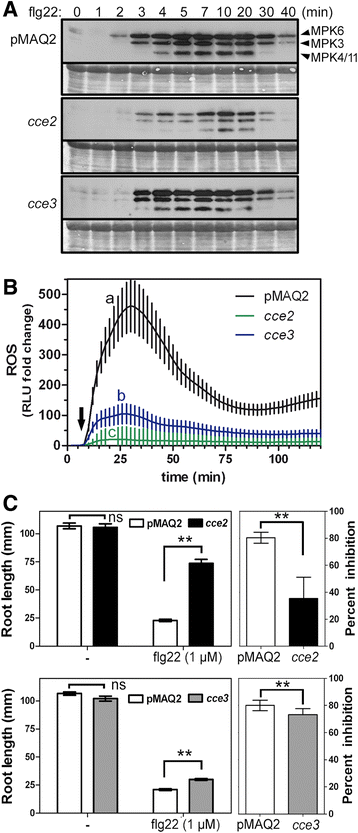
来测试其他的反应,除了钙的升高,是如何在cce2 / cce3在突变体中,我们观察了flg22诱导的MAPK激活、活性氧(ROS)积累和生长停滞。基于检测磷酸化(即激活)的MAPK形式的免疫印迹分析,flg22诱导的MAPK激活被延迟和减少CCE2.(图。3A).为CCE3.,虽然激活的MAPK频段强度几乎没有差异,但在MPK6激活的时序中似乎存在边缘延迟(这可以在三个独立实验中看到)。FLG22刺激的ROS积累是另一种快速植物响应,可以在曝光后几分钟内测量。在与减毒钙响应的同意中,相对ROS积累减少了cce2 / cce3突变体与亲本pMAQ2系的比较(图。3B.).
一些flg22诱导的钙瞬态下游反应部分减弱一个在指定的时间点,在flg22 (100 nM)处理后收集14天的幼苗,并提取蛋白,用识别磷酸化(即激活形式)MAPKs的抗体进行western blot分析。右边是三个MAPK波段的恒等式。这个实验重复了三次,得到了相似的结果。b在120分钟内每种基因型的24个叶盘中评估反应性氧物质(ROS)积累。每盘的基础发光(相对光单元,RLU)监测6分钟(在处理之前),并用于在FLG22处理后归一化RLU的折叠变化(标有)箭头).误差条描绘了95%的置信区间。使用具有Tukey的多重比较后的单向ANOVA分析统计学意义(不同的字母表表示统计学上不同的组,p< 0.05)。c生长抑制cce2 / cce3与PMAQ2父母线相比的突变体。将幼苗置于琼脂培养基上而没有( - )或含有Flg22(1μm),14天后测量的根长。左侧面板显示代表实验的绝对根长度(n= 22日至23日苗)。右图是3个独立进行的实验巩固的抑制百分比(n = 67–69 seedlings). Statistical significance was analyzed using two-way ANOVA with Bonferroni post-test (** = p < 0.0001, ns = not significant)
持续暴露于mamp的植物通常会发育不良。根据无flg22 (1 μM)和无flg22 (1 μM)生长的幼苗根长差异,可以看出CCE2.突变体比PMAQ2父母抑制不那么抑制(附加文件1:图S2)。相比之下,主要根源CCE3.在含FLG22的培养基上生长时,突变体的长度仍然强烈减小,但是,显着的(p< 0.01)较pMAQ2亲本长。这种由flg22引起的生长阻滞依赖于功能性FLS2受体的存在[39].图中所示为三个独立实验的代表性实验。3C(左面板)。虽然不同实验之间的绝对根长存在差异,但生长抑制率从三个独立的实验中得到了巩固(图。3C,右图)确认CCE3.不太受影响CCE2.突变体。一起服用,所有三种测试的FLG22诱导的反应显示衰减响应CCE2./CCE3.突变体。此外,与MAMP/ damp诱导的钙升高一致,其影响较小CCE3.等位基因支持这一观点CCE3.是较弱的等位基因吗CCE2..
映射和下一代测序数据在AT2G47760中显示SNP
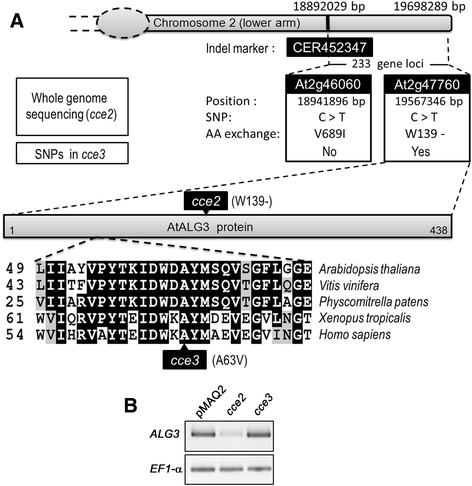
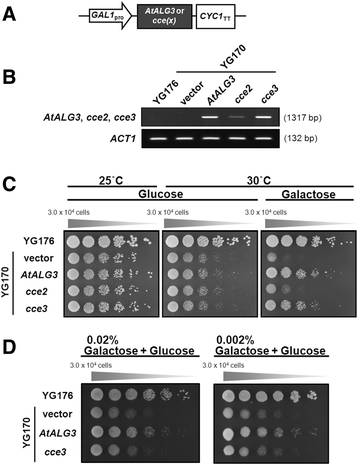
识别CCE2.基因,更强CCE2.突变体与拟南芥杂交erecta(左呃0)。对44个F2植株的定位分析表明CCE2.位于Indel Marker Cer452347之间的染色体2上[42.[18892029 bp (TAIR 10,5重组体)和染色体末端19698289 bp (TAIR 10)。该区域包含233个基因座。Illumina全基因组测序,用基因组DNACCE2.突变体以及pMAQ2亲本。与参考Col-0基因组比较,共发现405个单核苷酸多态性(SNPs)CCE2.,其中77个snp导致错义突变(附加文件2:表S1)。在染色体2上的映射区域内,检测到两个SNP(在基因座160606060606060和AT2G47760中),可以通过测序包含突变区的DNA扩增子来重新确认CCE2..自CCE3.是等位基因的CCE2.,相应的CCE3.基因组区域也进行了pcr扩增和测序。未检测到At2g46060位点的SNP,但检测到At2g47760位点的SNPCCE3.扩增子。AT2G47760编码天冬酰胺连接的糖基化3(ALG3),致氯酰焦磷酸(DOL-PP) - 甘露糖α-1,3-甘露糖基转移酶,其在从细胞溶溶剂翻转到腔骨侧的聚糖后催化前体聚糖的第一个甘蔗化物呃(见附加文件1:图S1为生物合成途径)[43.,44.].
的CCE2.等位基因是一种无意义的突变,它将色氨酸139转化为过早停止CCE3.SNP会导致A63V交换。半定量反转转录-PCR显示了该转录物cce2 / cce3不检测到的MRNA;尽管如此,可能是由于废话介导的mRNA腐烂,表达CCE2.背景低得多(图。4B.).
通过与T-DNA插入突变体交叉的等位感测定(ALG3-T.)
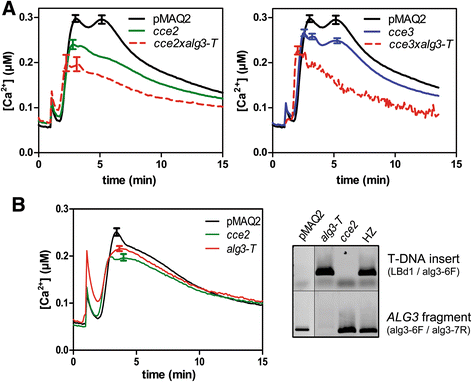
确认检测到的突变ALG3.都是由cce2 / cce3表型,用T-DNA制备十字架ALG3.插入突变体,ALG3-T.[44.].通过F1代的PCR和F2代的钙通量测定,证实了杂交的成功。如果ALG3.对降低的钙签名负责cce2 / cce3在美国,人们预计75%的被隔离的F2群体具有野生型特征。然而,与pMAQ2对照相比,F2群体中没有补体,“钙反应”的幅度降低(图2)。5A).这表明,ALG3-T.和cce2 / cce3等位基因。此外,我们从中基因分型F2植物CCE2.xALG3-T.杂交鉴定表达aequorin的植物是纯合的ALG3-T.这些植物的突变和叶片直接用于钙测量。如图所示。5B., flg22诱导的钙升高ALG3-T.与pma2对照相比减少,但与CCE2.(1路的方差分析,p< 0.01)。
的CCE2./CCE3.突变体是等位基因ALG3..一个T-DNA插入ALG3.突变体(alg3-T,SALK_064006)CCE2.和cce3,通过PCR在F1中验证成功的交叉,在隔离F2幼苗中监测FLG22诱导的钙响应(标有红色虚线).误差栏表示标准偏差(PMAQ2的n = 96,CCE2.或CCE3.;n= 66CCE2.xALG3-T.,n = 49 forCCE3.xALG3-T.).相同的PMAQ2(“野生型”)参考钙曲线用于两个图。通过单向ANOVA测试基因型之间的统计显着性进行钙签名(具有Tukey的多重比较测试,p< 0.05)。b识别纯合后ALG3-T.个人(从CCE2.xALG3-T.通过基因组DNA PCR,与指定的引物杂交,除使用4周龄植株的叶盘(Ø 4 mm)外,其余均监测flg22诱导的钙响应(n = 96 forALG3-T.;n =32对于pma2或CCE2.).钙海拔CCE2.和ALG3-T.(单因素方差分析与Tukey的多重比较检验,p < 0.01)
的cce2 / cce3等位基因未能或仅部分地补充酵母ALG3.突变体
该基因编码的ALG3蛋白中的A63V氨基酸交换CCE3.等位基因位于几个分类群的ALG3蛋白的保守区域,范围从较低/高等植物,两栖动物到哺乳动物(图。4).然而,丙氨酸与缬氨酸是一种“保守”的氨基酸交换。因此,我们很想知道这种变异是否有功能。因此,我们从CCE2.和CCE3.等位基因并使用它们来补充一个Saccharomyces Cerevisiae ALG3-缺陷突变株(YG170) [44.,45.].这些都是在半乳糖诱导启动子的控制下,逆转录- pcr分析表明,它们在酵母细胞中表达良好(图)。6A,b).在限制条件下(在30°C)下,ALG3.- 用空向量或与空载体转换时,菌株(YG170)不会生长CCE2.W139Stop.等位基因,但在表达野生型时能够生长AtALG3或者是CCE3.A63V变种,尽管后者的增长略慢(图。6C).当用于诱导表达的半乳糖浓度降低时,可以看到减少的互补CCE3.A63V(图。6D.).这些结果表明,ALG3A63V变体酶活性,但可能效率较低。
互补的酵母alg3-1突变株(YG170)与拟南芥ALG3.变体。拟南芥ALG3.(AtALG3从野生型和野生型植物的cdna中扩增出开放阅读框(ORFs)cce2 / cce3突变体,克隆到酵母表达载体中,并转化到酵母菌株YG170中。一个在半乳糖诱导型启动子控制下指示ORFS的表达载体构建方案(GAL1pro)和一种细胞色素C终止子(Cyc1TT.).bRT-PCR验证转染后的基因表达。actin 1.(ACT1)作为放大/负载控制。c互补的alg3-1通过在非允许温度(30℃)下比较没有或与半乳糖诱导的表达的生长来测定突变酵母株YG170。使用允许温度(25℃)的生长来显示酵母细胞的活力。在所有情况下进行五次连续稀释液。d通过减少表达来进一步测试互补AtALG3或者是CCE3.变体(通过将半乳糖浓度降低2%至0.02 / 0.002%)
酵母甘草分析证实了ALG3的酶活性
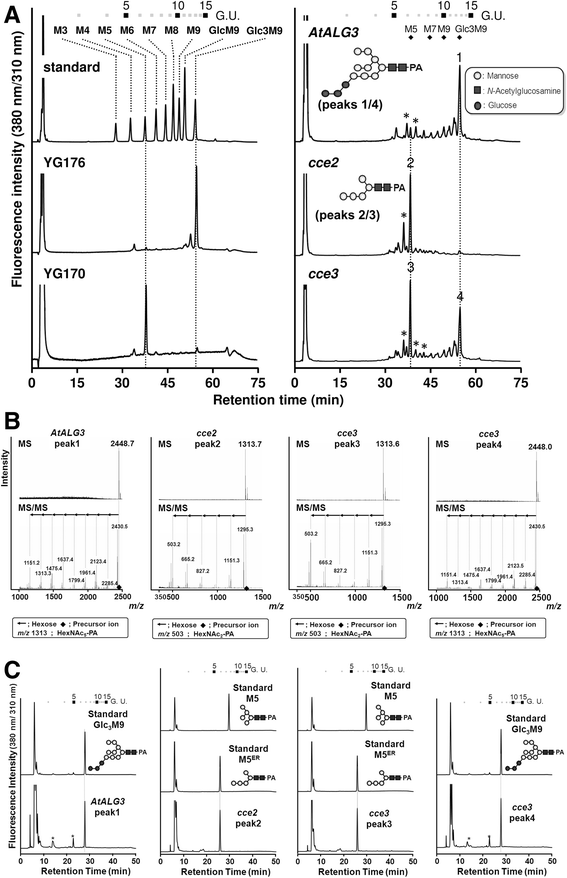
确认酵母生长是由于互补的互补ALG3.在酵母菌株YG170缺乏的情况下,从生长在半乳糖诱导培养基中的各种酵母菌株中提取脂联寡糖,水解后用2-吡啶胺(PA)标记,用于聚糖分析。以hplc为基础的粒径分馏显示出明显的主峰,保留时间与Glc一致3.M9标准菌株的野生型(YG176)和补充菌株。的ALG3.突变体(YG170)和cce2 -互补菌株均具有具有保留时间的主要峰,其对应于含5甘露糖的M5标准。的CCE3.- 符合抑菌均具有峰(图。7A).
四个样本(peak1从AtALG3补充应变;峰值2来自cce2 -补充应变;和峰值3和4来自cce3 -补充应变;见图。7A)被收集。LC-MS / MS的结构测定(图。7B.)表示Peaks1 / 4是glc3.男人。9GlcNAc2-PA(或十六进制12HexNAc2)峰值2/3是m5呃(即含有5甘露糖的人5GlcNAc2ER中发现ALG3的-PA底物;或十六进制5pa)。反相高效液相色谱法分析时,1号峰的洗脱时间与Glc相符3.M9 pa -糖标准峰2/3与M5 pa -糖标准峰不同,M5 pa -糖标准峰是真核生物高尔基体中典型产生的形式,但与M5共迁移呃形式(图。7C.).这些发现证实了Atalg3或ALG3的补充A63V体内变体确实是Er-indiplatedα-1,3-甘露糖基转移酶.的CCE3.A63V-补充酵母含有两种Glc的混合物3.米9GlcNAc2和m5.呃形式,表明ALG3A63V蛋白质降低了酶的活性,或者,它可能在酵母细胞中部分错误定位。
各种植物模式识别受体糖基化不足,但似乎仍然针对质膜
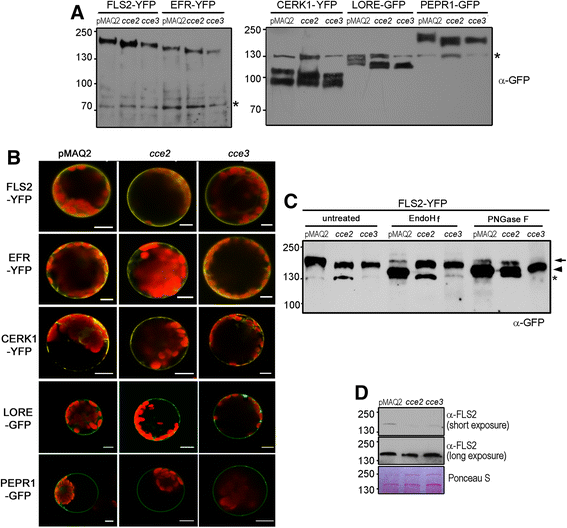
由于糖基化对于PRR的ER质量控制很重要[31,32,34[我们分析了PRR蛋白cce2 / cce3通过在拟南芥原生质体中瞬时表达YFP / GFP标记PRR的突变体。正如预期的损害N -当表达时,观察到标记FLS2,EFR,CERK1,LORE(推定的LPS受体)和PEPR1的糖基化,较高的迁移率(在SDS-PAGE)中观察到cce2 / cce3背景与父母PMAQ2相比(图。8A).各自的MAMPs/DAMPs都引起了钙离子的减少反应cce2 / cce3背景(图。2).要知道这是否可能是由于PRR定位改变,共聚焦显微镜用于以图像图像图像标记为PRR。在血浆膜定位方面,大多数YFP / GFP信号处于周边,并且在某些情况下,在沿膜的“斑块”斑点,原生质体。在突变体和PMAQ2背景之间看到局部化的明显差异(图。8B.).
PRRs的糖基化和定位cce2 / cce3突变体。一个表达质粒构建物P35S :: PRR-YFP / GFP将融合转染到从指示的基因型分离的原生质体中,并通过用α-GFP抗体进行蛋白质印迹分析。的星号标记GFP抗体识别的非特异性条带,作为内载对照。请注意,不同的缓冲区(参见方法部分)用于右侧或左侧面板中的蛋白质萃取。左边的数字是KDA中的分子大小标记。bPMAQ2父母的GFP或YFP标记PRR的共聚焦显微图像,CCE2.或CCE3.背景。在拟南芥原生质体中瞬时转染质粒以表达所述PRRs。比例尺代表10 μm。cFLS2-GFP在原生质体中表达,如上所述在A中,对萃取的膜蛋白质进行内糖苷酶H(endOHf)或肽:N -糖苷酶F(PNGase F)消化。一个箭头标志弱糖苷酶抗性FLS-YFP带箭头标记消化蛋白的迁移率。在里面cce突变体,Endo hf抗性来自于改变N盖子结构堵塞时ALG3.步骤在路上(见附加文件1:图S1)。在pngas - f酶切中,野生型(pMAQ2)和野生型(pMAQ2)中FLS2-YFP的剩余弱带cce车道可以用大约10%的核心焦点装饰来解释(因此PNGase f抗性)N-末端有GlcNAc残基的聚糖(见Kajiura et al. [44.]),表示在静电中正确折叠FLS2-YFP后通过GOLGI装置的通道。请注意,〜130 kda频段(标有星号)是用抗GFP抗体出现的非特异性信号。d内源性FLS2水平cce2 / cce3突变体与pMAQ2亲本进行比较。Western blotting (α-FLS2)用于观察8日龄幼苗微粒体蛋白中的FLS2水平
为了检查prr是否确实糖基化,我们用多肽处理转染原生质体的膜蛋白提取物N -糖苷酶F(Pngase F)去除N-聚糖链直接从天冬酰胺。FLS2作为我们检测的代表性PRR。FLS2-YFP经PNGase F处理后,大部分基因型均被消化,并发生迁移。这说明FLS2蛋白是N- 糖基化。By contrast, when treated with endoglycosidase H (EndoH) that cleaves the β-1,4-bond between the two GlcNAc moieties of the N,N’ diacetylchitobiose core linked to the modified asparagine residue, a mobility shift was seen for the FLS2-YFP expressed in the pMAQ2 but not for the FLS2-YFP expressed incce2 / cce3背景(图。8C).因此,对EndOH消化的抵抗表明N-glycan树上发生在fls2-yfp中CCE2./CCE3.背景在父母PMAQ2背景中具有不同的结构。
为了排除由于大多数上述测定的过度表达引起的误解,我们使用抗FLS2在微粒体膜蛋白制剂中查看内源性FLS2水平。虽然不像YFP标记的FLS2那么明显,但可以在速度下看到FLS2带的移动性的轻微差异CCE2./CCE3.背景。此外,FLS2蛋白水平略有下降cce2 / cce3突变体(图。8D.).长时间的western blot显示,突变体中仍有大量FLS2表达,这可以解释为什么这些突变体的反应减弱,但通常仍对flg22有反应(图2)。2).综上所述,糖基化改变导致FLS2水平的边际降低,推测是对flg22的反应减弱。在本研究中,可以假定所有的prr都处于同样的情况,尽管在每个单独的病例中,糖基化改变是否会影响配体结合还有待检验。
mamp诱导的电阻在ALG3.突变体
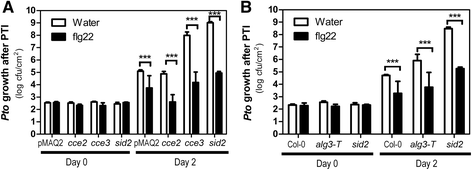
由于PRR的改变的糖基化被降低的钙响应反射,因此如果对病原体的抗性受到影响,我们测试了。FLG22预处理激活对随后感染的抗性,导致病原体的生长降低了。假单胞菌含油PV。番茄(PTO.)DC3000 [46.].如图所示。9,这种PTI响应保持在CCE2.,CCE3.和ALG3-T.突变体,以及水杨酸缺陷sid2突变体(47.],作为过敏反应的参考。因此,与钙测量显示MAMPs降低但仍有相当大的反应性(图。2),我们可以得出结论,足够的功能FLS2(见图。8D.存在以触发混乱诱导的电阻途径。除了诱导的抗性外,还要注意三个之间的基底电阻水平ALG3.突变体是不同的。虽然这一点CCE3.和ALG3-T.突变体(如sid2)支持更多的细菌生长CCE2.植物更具抵抗力(见附加文件1:图S3)。这些变化的易感性PTO.DC3000可能是由于每个突变体中发现的额外突变,特别是对于EMS致诱变的EMScce突变体,不太可能与ALG3.突变。综上所述,各被试的基本阻力水平有所不同ALG3.(由于仍然未知的原因),mamp诱导的抗性大部分是完整的。
模式触发的免疫力不会受到强烈影响CCE2.,CCE3.或alg-T突变体。一个,b采用模式触发免疫(pattern-triggered immunity, PTI)方法,先用1 μM flg22浸渍植株24 h,然后接种PTO.DC3000(10−5cfu / ml)。误差条描绘标准错误(n = 6). Two-way ANOVA (with Bonferroni post-test) was used to evaluate statistical significance (*** = p < 0.001). Thesid2突变体(47.作为超敏感对照,但注意PTI在该突变体中似乎是完整的
讨论
在这项研究中,我们证明了CCE2./CCE3.编码ALG3, α-1,3甘露糖基转移酶,催化人的第一次甘露糖基化5GlcNAc2-pp-dol(m5呃)内质网内的糖前体,在糖前体从胞质翻转到内质网腔侧后[43.- - - - - -45.].在野生型植物中,由此产生的人6GlcNAc2-PP-Dol进一步被另外两种er腔内甘露糖基转移酶ALG9和ALG12进行甘露糖基化,形成含有9甘露糖的Man9GlcNAc2-PP-Dol。完全组装的聚糖,Glc3.男人。9GlcNAc2,随后通过ALG6,ALG8和ALG10葡糖糖基转移酶的连续三曲旋糖酶组成(用于脂质连接的低聚糖生物合成途径的概述,参见附加文件1:图S1)。借助于寡糖转移酶,聚糖转移到多肽以用于共同和翻译的N- 糖基化,可以影响折叠和调节蛋白质的生物学功能[48.].例如,与CNX或CRT凝集素的结合对于新生多肽的折叠和er质量控制过程非常重要,在这些过程中,如果形成不完全或错误折叠的糖蛋白,er相关降解(ERAD)途径被激活[49.].
的CCE2.和CCE3.等位基因分别导致过早停止(W139-)和A63V交换。虽然缩短了all3W139-是无功能的,ALG3A63V变量可以部分替代中缺失的函数ALG3.酵母,但显然效率较低,因为它导致生产完全组装的混合Glc3.米9GlcNAc2和m5.呃在补充酵母细胞中形成。或者,由于ALG3在酵母和拟南芥中均为ER-定位[43.在发生行动的情况下,它也可能是一些ALG3A63V可能是部分错误定位的。以前的N -来自拟南芥的总蛋白质的聚糖分析ALG3.突变体显示稀有N -通常不被检测到的聚糖结构;包括M3, M4呃, M5呃和glcm5呃(请参阅附加文件1:图S1为结构)。总的来说,还有较低层次的复杂类型N -甘草比在野生型Col-0植物中。令人惊讶的是,尽管蛋白质N -糖基化差异与野生型相比,ALG3.在正常和高温或盐/渗透胁迫条件下均无明显表型[44.].在一个独立的报告中,在另一个中没有检测到高甘露糖型糖蛋白ALG3.突变体(alg3-2(SALK_040296),在正常生长条件下也未观察到生长表型。然而,糖基化异常导致标记基因的激活,诊断未展开的蛋白反应。[43.].这些结果表明,而AtALG3是成熟的关键N -蛋白质的糖基化,对于拟南芥的细胞活力和生长至关重要,但可能影响某些应激相关过程。按照,我们的cce2 / cce3突变体显示正常增长(尽管CCE2.在玫瑰花柱大小,未示出的情况下有点小),但是在钙响应到多个MAMPS /潮湿时受到损害。然而,PTI对随后的细菌感染的抗性完好无损CCE2 / CCE3 / ALG3-T突变体(图。9).或者,因为某种程度的复杂类型N -聚糖在ALG3.突变体,植物中可能存在减少糖基化缺陷影响的代偿途径。一种可能是M5的两个α-1,2-甘露糖残基进入高尔基体后呃可以通过α-1,2-甘露糖苷酶I可裂解;并且可以随后处理所得到的M3结构N -乙酰甘氨酸氨基氨基转移酶I(GNTI)并使植物特异性最终成熟NGolgi装置中的糖粉[44.].由于GnTI对M3的亲和力是M5的20倍[50.[这种反应是可行的,但也许效率较低。这种“救助”机制表明适当的重要性N -蛋白质的糖基化作用,因此生物体的生存能力
在人类中,G蛋白偶联受体的胞外结构域(ECD)的n-糖基化是从激动剂结合、折叠、成熟、稳定到内化等功能所必需的[51.].我们在这里的工作表明,几个prr糖基化不足(图。8)有助于减毒/潮湿诱导的钙响应cce2 / cce3(ALG3.)突变体(图。2).在上述人类实施例中,通过受体辅助蛋白的存在,可以部分地补偿细胞表面对细胞表面的降低定位的底糖基化的G蛋白受体。51.].是否与FLS2(或EFR或PEPR1)受体相关的BAK1 / SERK系列的成员可以减少内糖基化植物PRR的遗体仍有待测试的影响。但是,基于未能将EFR和BAK1的ECDS共置于预测后的EMR和BAK1的eCDN-Glycosylation位点(N590Q / S592T)在EFR中,这似乎是案例 - 至少对于EFR [52.].在另一个研究中另一个保守的研究N-糖基化位点在EFR ECD中发生突变,此EFRN143Q在降低水平下累积的变体丧失了粘合ELF18配体的能力,并且相应的转基因植物缺乏ELF18引发的氧化爆发。这将解释为什么,尽管EFR正确地靶向质膜,但EFR功能受到损害stt3a.突变体(编码ER寡糖转移酶的STT3A亚基,OST,复合物)[31].在某些情况下(如EFR),结合袋内的糖基化位点可能有助于配体的结合[31].另一方面,FLS2耐受轻度糖基化不足发生在stt3a.突变体。这些发现在最近使用其他OST亚基的突变体的工作中得到了证实,ost3或ost6,其中EFR的MAMP反应比严重糖基化的FLS2受到更严重的影响[38].因此,不同的PRRs可能受到糖基化改变的不同影响。相比之下,在我们的研究中,我们没有观察到钙离子对flg22或elf18的反应有显著差异cce2 / cce3突变体,但这可能是因为ALG3比OST亚基的作用更早一步N- 糖基化途径(附加文件1:图S1)。因此,不同之处可能分别是修饰了更小的糖结构的PRRs与完全的糖基化。
据我们所知,我们在ALG3上的工作是如此初步的第一个报告N- 糖基化对PRRS在植物免疫信号中的作用,而其他研究基于后来的OST寡糖转移酶步骤。对于植物来说,到目前为止,ALG有多涉及生长和发展。在Brassinosteroid的抑制剂的EMS-诱变筛选中Bri1-9受体侏儒突变体,ASPARAGINE-LINKED GLYCOSYLATION-9和−12(ALG9 / ALG12.)被孤立[53.,54.].这些催化曼诺伊氏锰的两步(ALG3)转移到男人6GlcNAc2-pp-dol在er中(请参阅附加文件1:图S1)。的Bri1-9表型来自晶粒类固醇受体的Erad介导的去除。改变了由此引起的糖基化ALG9.或alg12突变影响BRI1的ER质量控制和ERAD,从而允许 - 尽管如此Bri1-9背景 - 芸苔类固醇信号传导足够BRI1受体的积累。令人惊讶的是,虽然在相同的线性途径中发生,但介绍了ALG3.突变具有相反的效果(即导致累积减少)对Bri1-9丰度[54.].同样,我们发现FLS2水平在我们的cce2 / cce3(ALG3.)突变体。
如上所述,FLS2可能更能耐受糖基化的改变[38]也许各种PRR都会受到差异影响。在我们的定量钙测量中,对LPS的响应似乎比对另一个测试的伴随/潮湿的响应比例更大CCE2./CCE3.突变体(图。2).推定的LPS受体的ECD,LORE [2[含有属于最初由杂草类药物“自我不相容性(Si)”轨迹受体的S-LOCUS结构域的B型凝集素样S域。与已知在推定识别位点内的糖基化的Si相关的S-RNase,LORE ECD也可能是糖基化的。因此,我们看到我们的LORE-GFP融合蛋白的改变流动性CCE2./CCE3.突变体(图。8A).N -糖基化确保了对血浆膜的适当和有效的亚细胞对S-基因座受体的影响[55.].然而,LORE在质膜上的定位似乎不受影响cce2 / cce3突变体(尽管这是基于通过强35S启动子的过度表达)。未来的研究可能会揭示LORE糖基化的改变是否会影响其配体的亲和性,但不幸的是,LPS结合检测目前仍是一项具有挑战性的任务。
除了主持人,N- 糖基化对病原体也很重要。突变ALG3.稻瘟病菌Magnaporthe oryzae导致内糖基化并降低分泌的SLP1效应蛋白的稳定性和甲壳蛋白结合活性。SLP1对甲壳素识别的抑制作用由水稻甲壳素Elicitor结合蛋白,CeBip,衰减,导致野生型真菌引起的更强的免疫应答诱导。因此,m . oryzae alg3突变体毒性较弱[56.].我们在这里展示ALG3对于适当的PRR糖基化并且损害植物免疫相关信号传导,例如钙通量很重要。有趣的是,N-糖基化直接影响低压激活t型钙通道的表面表达和功能,控制葡萄糖刺激时神经元的兴奋性[57.].由于大多数膜蛋白将不得不通过分泌途径来靶向质膜,这是诱人的推测,仍然难以捉摸的植物钙通道(s)响应MAMPs/DAMPs可能也糖基化和受影响ALG3.突变。最后,应该提到在动物/人类中,N-糖基化缺陷常与疾病尤其是先天性疾病有关[58.].因此,N-糖基化在真核生物中高度保守。植物糖基化突变体缺乏显著表型可能是由于补偿途径修复这一重要的协同和翻译后蛋白修饰途径的任何有害影响。
结论
钙信号突变体,cce2 / cce3受到影响的ALG3.(天冬酰胺连接的糖基化3),编码α-1,3-甘露糖基转移酶,负责err核心寡糖聚糖组装的第一步ALG3.突变体危害免疫反应对植物的矛盾。在病原体侧,还据报道,影响真菌病原体的毒力。
方法
植物材料和生长
的ALG3-T.(Salk_064006,插入外显子6)和alg3-T2(SALK_046061,插入外显子3)系之前已被描述[44.].为了进行钙和MAPK检测,种子表面消毒,在4°C下分层>2 d,并在液体MS中长日条件下(16 h光照,8 h暗循环)生长,如所述[39].对于成年植株,幼苗转移到土壤中,在22°C的短白天条件下(8小时光照,16小时黑暗循环)在气候室中生长。
突击和鉴定突变
的CCE2.突变体与拟南芥杂交erecta(左呃-0)和如上所述执行的映射[24].基因组DNA由幼花芽制备,并送到GATC Biotech(德国Constance),用于Illumina全基因组测序。
假定的snp在CCE2.通过扩增相应的基因组片段来验证CCE2.,cce3和PMAQ2植物具有附加文件中列出的引物3.:表S2。将扩增的片段发送给Sanger测序到GATC Biotech。用BioEdit(Tom Hall,Ibis Biosciences,Carlsbad,Carlsbad,USA)进行序列比对。
酵母互补化验
本研究使用的酵母菌株为:YG170 (MatαADE2-101ADE3 URA3-52 HIS3 ALG3-1 STT3-3)及YG176 (Mata ADE2-101 ADE3 URA3-52His3Δ200leu2 tyr1 stt3-3)[59.].的ALG3.从pMAQ2的cDNA中扩增出ORF,CCE2.或CCE3.植物(使用附加文件中列出的引物3.:表S2)并被克隆到BAM你好/XHO.i-difested pyes2矢量(Invitrogen,Carlsbad,CA)。通过测序验证所有克隆。通过电穿孔和如前所述进行的互补分析将所得的PYES克隆引入YG170菌株中。[44.].
Glycan分析
酵母中脂联聚糖的提取、2-吡啶胺标记、尺寸分级高效液相色谱和MS/MS分析如前所述进行[44.].
蛋白质提取和蛋白质印迹
对于从成熟植物或幼苗的蛋白质提取,在〜10-15Zircosil®微铣珠(Ø1的情况下,将冷冻叶片或幼苗均质化在〜10-15型氧化硅®微铣珠(Ø1。2-1.7毫米)(MühlmeierMahltechnik,Bärnau,德国)在6500 rpm 20 s。如有必要,重复该过程直至组织彻底均质化并防止过早解冻,将样品保持在液体n中2均化轮之间。瞬时转化原生质体(在1.5 ml试管中)由Mikro120微离心机(hetich, Tuttlingen, Germany)短脉冲离心收获,去除孵育缓冲液,颗粒在液体N中快速冷冻2.通过解冻50μl萃取缓冲液中的样品从原生质体或地面组织中萃取总蛋白质(缓冲液A:25mM Tris-HCl pH 8.0,150mM NaCl,1%(v / v)2- [2- [4- (2,4,4-三甲基戊烷-2-基)苯氧基]乙醇]乙醇(非特性P-40),1%(v / v)伺服蛋白酶抑制剂混合物P或缓冲液B:50mM Tris pH9.6,100mMNaCl,20mM DTT,1%(v / v)Serva蛋白酶抑制剂在恒定涡旋下混合P,0.1%Triton X-100和0.1%SDS 15分钟。通过在4℃下以20.000×g离心10分钟来沉积不溶性碎片。蛋白质在8%SDS-PAGE凝胶上分离并转移到PVDF膜(Carl Roth,Karlsruhe,Germany)上。在GFP和YFP标记的蛋白质或α-FLS2的情况下,将印迹与α-GFP(Life Technologies,Carlsbad,USA,1:2000稀释)一起温育[60.]对于内源性未标记的FLS2和用山羊抗兔过氧化物酶 - 共轭抗体(Life Technologies,Carlsbad,USA)和增强的化学发光(Ecl Prime,GE Healthcare,Freiburg,德国)的免疫装饰蛋白质。
Deglycosylation化验
如上所述,从表达FLS2-YFP的原生质体中提取总蛋白质。将萃取的蛋白质在100℃下在1×糖蛋白变性缓冲液中在100℃下煮沸10分钟(即0.5%SDS,40mM DTT)。将样品冷却至室温,并用1μl肽(磷酸钠pH7.5,1%NP-40)或1μlendoH的肽(50mM磷酸钠pH 7.5,1%)或1μl鼻窦酶(50mM磷酸钠)处理或用1μl糖苷酶F处理10μlf(内糖苷酶H与麦芽糖结合蛋白融合)在G5反应缓冲液(50 mM柠檬酸钠pH 5.5)中。糖苷酶在37°C下处理1 h。所有缓冲液和酶均从美国马萨诸塞州伊普斯维奇的New England Biolabs获得。
原生质体转染和共聚焦显微镜
从PMAQ2 /的5周龄植物中分离出原生质体/CCE1./CCE2./CCE3.如所述基因型[61.].用PXCSG-FLS2-YFP转化原生质体,PXCSG-EFR-YFP [31Pampat-PEPR-GFP,PUBC-CERK1-GFP(使用由Yusuke Saijo提供的PDONR-CERK1克隆的LR克隆重组产生)或PGGina-224C-LORE-EGFP(质粒为35s启动子介导的表达)LORE-eGFP fusion; S.R., unpublished) [2].在过夜孵育以允许蛋白质表达后,用LSM710共焦激光扫描显微镜(Carl Zeiss,Jena,Germany)进行转化的原生质体的显微镜。通过用488nm氩激光和具有514nm氩激光的YFP分子的激发来检测GFP信号。通过ZEN 2012软件(Carl Zeiss)获得的图像,并用imagej软件(国家健康机构,Bethesda,Maryland,USA)处理,配备了斐济插件捆绑[62.]和Biovoxxel工具箱(Jan Borcher / Biovoxxel;www.biovoxxel.de.).
评估植物对MAMPs的反应(ROS,生长抑制和致病分析)
如前所述,进行了检测如MAPK激活和反应性氧物质(ROS)积累和生长抑制测定的诸如MAPK活化和反应性氧物质(ROS)累积和生长抑制测定的响应27].
数据的可用性
支持本文的结论的数据集可在Labarchives存储库中使用(https://mynotebook.labarchives.com/share/JLee%2520IPB%2520lab/MzUuMXwxNDcxNTUvMjcvVHJlZU5vZGUvMjY2OTg4MzE2OHw4OS4x)或DOI:10.6070 / H4RX9932.这包括(1)用于绘制图1的数值数据集。1,2,3.,4,5,6,7,8和9(2)从Illumina全基因组重新排序数据生成的SNP / Indel列表。
缩写
- ACA8:
-
arabidopsis-autoinhibited Ca2+-Atpase,同种型8
- ACT1:
-
actin 1.
- all:
-
天冬酰胺连接的糖基化
- ALG3:
-
asparagine-linked糖基化3
- BAK1:
-
bri1相关受体激酶1
- BIR1:
-
Bak1 - 相互作用的受体样激酶1
- BRI1:
-
brassinosteroid麻木1
- BSK1:
-
芸苔类固醇受体 - 信号传导kinase1
- cce:
-
改变了钙海拔
- Cerk1:
-
几丁质Elicitor受体激酶1
- CNGC2:
-
循环核苷酸门控通道2
- CNX:
-
Calnexin.
- CPK5:
-
钙依赖蛋白激酶5
- CRT:
-
calreticulin
- CYC1TT:
-
细胞色素C终结者
- 潮湿:
-
损伤相关的分子模式
- DOL-PP:
-
多胆溶磷酸盐
- DPM1:
-
Dolichol磷酸甘露糖合成酶1
- 儿童早期开发:
-
细胞外结构域
- ECL:
-
增强化学发光
- EF1 -α:
-
延长因子1 -α
- EFR:
-
EF-TU受体
- ef-tu:
-
延伸系数热不稳定
- egf:
-
表皮生长因子
- ELF18:
-
来自EF-TU的18-残基肽
- EMS:
-
乙烷磺酸甲酯
- endo h:
-
内切糖苷酶H.
- ERAD:
-
ER-associated退化
- flg22:
-
来自鞭毛素的22-残基肽
- FLS2:
-
鞭毛蛋白敏感2
- G.U:
-
葡萄糖低聚物单位
- GAL1pro:
-
半乳糖 - 诱导酵母促进剂
- GFP:
-
绿色荧光蛋白
- glc:
-
葡萄糖
- GlcM5呃:
-
不寻常的糖结构,单甲基化的M5呃
- GlcN:
-
氨基葡萄糖
- GLCNAC:
-
N-Acetylglucosamine
- GnTI:
-
N-乙酰甘氨酸氨基氨基转移酶
- HexNAc:
-
己糖 - 乙酰甘氨酸胺结构
- LIK1:
-
LYSM RLK1 - 相互作用激酶1
- LPS:
-
脂多糖
- LRR:
-
富含亮氨酸的重复
- Lyk5:
-
含lysm受体样激酶5
- LysM:
-
Lysin主题
- M3:
-
聚糖合成中间体3种甘露糖残留物,ALG2的产物
- M4呃:
-
Glycan合成中间体,具有4个甘露糖残留物,ALG11的产品
- M5:
-
用5个甘蔗树脂修剪甘蔗树,在Golgi装置中催化催化
- M5呃:
-
聚糖合成中间体用5个甘露糖残留物,ALG11的产品
- MAMP:
-
微生物相关的分子图案
- 男人:
-
甘露糖
- MAPK / MPK:
-
丝裂原活化蛋白激酶
- 女士:
-
Murashige和Skoog.
- OST:
-
oligosaccharyltransferase.
- PA:
-
2-pyridylamine
- PAMP:
-
其分子模式
- PBL:
-
avrPphB敏感1
- PEP:
-
拟南芥蒂利亚纳肽
- PEPR1:
-
Pep1受体1
- Pngasef:
-
肽 -N- 糖苷酶F.
- PRR:
-
模式识别受体
- PS.H4:
-
铜绿假单胞菌应变H4
- PTI:
-
模式触发的免疫力
- PTO.:
-
假单胞菌含油pathovar番茄
- PV:
-
pathovar
- RBOHD:
-
呼吸爆发氧化酶同源物D.
- RLCK:
-
受体细胞质激酶
- RLK:
-
受体激酶
- RLP:
-
受体蛋白
- RLU:
-
相对光单元
- ROS:
-
反应性氧气
- SEC59:
-
分泌物59.
- SERK:
-
体细胞胚胎发生受体激酶
- SI:
-
自我不相容
- sid2:
-
水杨酸诱导不足2
- SLP1:
-
分泌的Lysm蛋白质1
- SNP:
-
单核苷酸多态性
- SOBIR1:
-
BIR1的抑制器
- S-RNAse:
-
S-locus编码核糖核酸酶
- stt3a:
-
staurosporin和温度敏感的3-like A
- yfp:
-
黄色荧光蛋白
- α-FLS2:
-
抗FLS2.
- αgfp:
-
抗GFP.
参考
- 1.
Boller T,Felix G. eLitorors的文艺复兴:通过模式识别受体对微生物相关分子模式和危险信号的感知。Annu Rev植物Biol。2009; 60:379-406。
- 2.
Ranf s,gisch n,schäfferm,illigt,westphal l,knirel ya等。凝集素S域受体激酶介导脂多糖感测拟南芥蒂利亚纳.NAT IMMUNOL。2015; 16(4):426-36。
- 3.
Willmann R,Lajunen HM,Erbs G,Newman Ma,Kolb D,Tsuda K,等人。拟南芥溶酶 - 基序蛋白质Lym1 ley3 cerk1介导细菌肽聚糖感测和免疫细菌感染。Proc Natl Acad Sci U S A. 2011; 108(49):19824-9。
- 4.
石南(Kaku H, Nishizawa Y, Ishii-Minami N, Akimoto-Tomiyama, Dohmae N, Takio K, et al.)植物细胞通过质膜受体识别几丁质片段进行防御信号传递。中国科学(d辑:地球科学)2006;103(29):11086-91。
- 5。
王志强,王志强,王志强,等。CERK1是一种LysM受体激酶,在拟南芥中几丁质诱导子信号传导中起重要作用。中国科学院院刊2007;104(49):19613-8。
- 6。
Petutschnig ek,琼斯am,serazetdinova l,Lipka U,Lipka V. Lysm-Rlk Cerk1是一个主要的依托碱结合蛋白拟南芥蒂利亚纳并受依托酸诱导的磷酸化。J Biol Chem。2010; 285(37):28902-11。
- 7。
Shimizu T,Nakano T,Takamizawa D,Desaki Y,Ishii-Minami N,Nishizawa Y等。两种Lysm受体分子,Cebip和osmerk1,协同调节水稻中的几丁质Elicitor信号传导。工厂J.2010; 64(2):204-14。
- 8。
万军,张晓春,Neece D, Ramonell KM, Clough S, Kim SY,等。拟南芥中LysM受体样激酶在几丁质信号转导和真菌抗性中起关键作用。植物细胞。2008;20(2):471 - 81。
- 9。
植物免疫中的鞭毛蛋白信号。医学生物学杂志2007;598:358-71。
- 10.
陈志强,陈志强,陈志强,等。受体EFR对细菌PAMP EF-Tu的感知限制了农杆菌介导的转化。细胞。2006;125(4):749 - 60。
- 11.
Choi J,Tanaka K,Cao Y,Qi Y,Qiu J,Liang Y等。细胞外ATP植物受体的鉴定。科学。2014; 343(6168):290-4。
- 12.
Brutus A, Sicilia F, Macone A, Cervone F, De Lorenzo G.一种结构域交换方法揭示了植物壁相关激酶1 (WAK1)作为寡半乳糖醛酸酯受体的作用。中国科学院院刊2010;107(20):9452-7。
- 13.
Krol E,Mentzel T,Chinchilla D,Boller T,Felix G,Kemmerling B等人。拟南芥危险信号肽1的感知涉及模式识别受体ATPEPR1及其密切同源物ATPEPR2。J Biol Chem。2010; 285(18):13471-9。
- 14.
Monaghan J,Zipfel C.植物图案识别受体复合物在质膜上。CurrOp植物BIOL。2012; 15(4):349-57。
- 15.
植物细胞表面的免疫受体复合物。植物学报。2014;20:47-54。
- 16。
Beck M,听到W,MBENGUE M,Robatzek S.细胞表面的图案识别受体的INS和OUT。CurrOp植物BIOL。2012; 15(4):367-74。
- 17。
Maekawa T,Kufer Ta,Schulze-Lefert P. NLR在植物和动物免疫系统中的功能:到目前为止,但却如此接近。NAT IMMUNOL。2011; 12(9):818-26。
- 18。
Seybold H,Trempel F,Ranf S,Scheel D,Romeis T,Lee J. CA2+植物免疫反应中的信号传导:从模式识别受体到CA2+解码机制。新植物。2014; 204:782-90。
- 19。
Le MH,Cao Y,Zhang XC,Stacey G. Lik1,Cerk1相互作用激酶,调节拟南芥的植物免疫应答。Plos一个。2014; 9(7):E102245。
- 20.
Cao Y,Liang Y,Tanaka K,Nguyen CT,Jedrzejczak RP,Joachimiak A等,是Kinase Lyk5是拟南芥中的一个主要的几丁质受体,并形成与相关激酶Cerk1相关的甲蛋白诱导的络合物。Elife 2014; 3:E03766
- 21.
刘T,刘Z,歌曲,胡y,han z,她j等。甲壳素诱导的二聚化激活植物免疫受体。科学。2012; 336(6085):1160-4。
- 22.
刘z,吴y,杨f,张y,chen s,谢q等。BIK1与PEPRS与PEPRS相互作用以介导乙烯诱导的免疫力。Proc Natl Acad Sci U S A. 2013; 110(15):6205-10。
- 23。
陆德华,吴胜,高晓霞,张玉英,单林,何平。一类受体样胞质激酶BIK1与鞭毛蛋白受体复合物的相互作用。中国科学院院刊2010;107(1):496-501。
- 24。
微生物相关分子模式诱导的钙信号需要受体样胞质激酶,PBL1和BIK1。中国生物医学工程学报。2014;14(1):374。
- 25。
张军,李伟,向涛,刘震,拉鲁克,丁旭,等。类受体细胞质激酶整合来自多种植物免疫受体的信号,并被a假单胞菌含油效应。细胞宿主微生物。2010;7(4):290-301。
- 26。
Mersmann S, Bourdais G, Rietz S, Robatzek S.乙烯信号调节FLS2受体的积累,并且是促进植物免疫的氧化爆发所必需的。植物杂志。2010;154(1):391 - 400。
- 27。
李志刚,李志刚,李志刚。钙信号与早期信号元件在微生物或损伤相关分子模式防御反应中的相互作用。植物j . 2011; 68(1): 100 - 13所示。
- 28。
张志强,张志强,张志强,等。prr相关激酶BIK1对植物免疫过程中NADPH氧化酶RBOHD的直接调控摩尔细胞。2014;54(1):43-55。
- 29。
李磊,李敏,于磊,周志强,梁旭,刘志强,等。fls2相关激酶BIK1直接磷酸化NADPH氧化酶RbohD来控制植物免疫。细胞宿主微生物。2014;15(3):329-38。
- 30。
Dubiella U,Seybold H,榴莲G,Komander E,Lassig R,Witte Cp,等。快速防御信号传播需要钙依赖性蛋白激酶/ NADPH氧化酶活化电路。Proc Natl Acad SCI U S A. 2013; 110(21):8744-9。
- 31。
HäwekerH,撕裂的,Koiwa H,Salomon S,Saijo Y,Chinchilla D等人。模式识别受体需要N-糖基化以介导植物免疫。J Biol Chem。2010; 285(7):4629-36。
- 32。
李家,赵辉C,Batoux M,Nekrasov V,Roux M,Chinchilla D等。植物先天免疫受体EFR的生物发生所需的特异性ER质量控制组分。Proc Natl Acad Sci U S A. 2009; 106(37):15973-8。
- 33.
Nekrasov V,Li J,Batoux M,Roux M,Chu Zh,Lacombe S等人。用植物免疫中的ER蛋白复合物控制模式识别受体EFR。2009年EMBO J. 2009; 28(21):3428-38。
- 34.
等。植物先天免疫内质网受体质量控制。EMBO j . 2009; 28岁(21):3439 - 49。
- 35.
ER中ebi M. n -连接蛋白糖基化。Acta botanica yunnanica(云南植物研究),2013;
- 36.
Burda P,Aebi M. n键合糖基化的二菱醇途径。Biochim Biophys Acta。1999; 1426(2):239-57。
- 37.
陈志强,陈志强,陈志强,等。早期分泌途径的蛋白质质量控制。EMBO j . 2008; 27(2): 315 - 27所示。
- 38.
寡糖转移酶复合物的保守亚基OST3/6在先天性免疫和非生物胁迫耐受中的特殊作用植物杂志。2013;162(1):24-38。
- 39。
Ranf S,Grimmer J,PöschlY,Pecher P,Chinchilla D,Scheel D等人。通过定量高吞吐量屏幕揭示的防御相关钙信号突变体拟南芥蒂利亚纳.莫尔植物。2012; 5(1):115-30。
- 40。
戚志刚,Verma R, Gehring C, Yamaguchi Y, Zhao Y, Ryan CA, et al. .Ca2+拟南芥Pep肽的信号转导依赖于AtPepR1,它是一种具有鸟苷酸环化酶活性的受体和cgmp激活的Ca2+频道。中国科学(d辑:地球科学)2010;
- 41。
Frei Dit Frey N,Mbengue M,Kwaaitaal M,Nitsch L,Altenbach D,HäwekerH,等。血浆膜钙ATP酶是植物免疫应答和发育中受体介导的信号传导的重要组成部分。植物理性。2012; 159(2):798-809。
- 42.
Salathia N, Lee HN, Sangster TA, Morneau K, Landry CR, Schellenberg K,等。Indel数组:基因分型的一种可负担得起的替代方法。51植物j . 2007;(4): 727 - 37。
- 43.
Henquet M,Lehle L,Schreuder M,Rouwendal G,Molthoff J,Helsper J,等。鉴定编码α1,3-甘露糖基转移酶(ALG3)的基因拟拟拟拟拟拟拟拟拟合和下游N-聚糖加工的表征。植物细胞。2008; 20(6):1652-64。
- 44.
Kajiura H,Seki T,Fujiyama K.Arabidopsis Thaliana ALG3.突变体在ER中合成未成熟的低聚糖并积累唯一的N-聚糖。糖生物学。2010; 20(6):736-51。
- 45.
Aebi M,Gassenhuber J,Domdey H,Heesen ST。ALG3基因的克隆与表征酿酒酵母.糖生物学。1996; 6(4):439-44。
- 46.
zepel C, Robatzek S, Navarro L, oakley EJ, Jones JD, Felix G, et al.;通过鞭毛蛋白感知拟南芥的细菌性疾病抗性。大自然。2004;428(6984):764 - 7。
- 47。
Nawrath C, Metraux JP。水杨酸诱导缺陷的拟南芥表达PR-2和PR-5,并在病原菌接种后积累高水平的camalexin。植物细胞。1999;11(8):1393 - 404。
- 48。
磨碎器R.植物中复合N-聚糖的生物学意义及其对植物生理学的影响。前植物SCI。2014; 5:363。
- 49。
Meusser B, Hirsch C, Jarosch E, Sommer T. ERAD:通往毁灭的漫长道路。细胞生物学杂志。2005;7(8):766-72。
- 50.
关键词:拟南芥,n -乙酰氨基葡萄糖转移酶,分子基础,n -乙酰氨基葡萄糖转移酶生物化学学报2005;387(p2): 385-91。
- 51.
天冬酰胺连接糖基化在293/FRT细胞表面表达和人促肾上腺皮质激素受体(黑素皮质激素2受体)功能中的作用。内分泌学。2010;151(2):660 - 70。
- 52.
Koller T,Bent Af。FLS2-BAK1防御信号激活所需的细胞外域交互位。Plos一个。2014; 9(10):E111185。
- 53.
洪Z,金H,Fitchette Ac,夏Y,Monk Am,Faye L等。α1,6甘露糖基转移酶的突变抑制拟南芥中有缺陷的芸苔类固醇受体的内质网相关降解。植物细胞。2009; 21(12):3792-802。
- 54。
红Z,kajiura h,su w,金h,kimura a,fujiyama k等。进化地保守的聚糖信号,以降解拟南芥中的异常芸苔类固醇受体。Proc Natl Acad Sci U S A. 2012; 109(28):11437-42。
- 55。
Yamamoto M, Tantikanjana T, Nishio T, Nasrallah ME, Nasrallah JB。十字花科植物s位点受体激酶的位点特异性n -糖基化及其在自交不亲和反应中的作用植物细胞。2014;26(12):4749 - 62。
- 56。
陈小龙,石涛,杨杰,石伟,高新世,陈东,等。-1,3-甘露糖基转移酶对效应蛋白的n -糖基化是稻瘟病菌逃避宿主先天免疫所必需的。植物细胞。2014;26(3):1360 - 76。
- 57.
魏志伟,陈丽,刘志伟。Cav3.2 t型钙通道的表面表达和功能受天冬酰胺连接糖基化控制。Pflugers Arch - Eur J Physiol. 2013;465(8): 1159-70。
- 58.
Barone R,Fiumara A,Jaeken J.先天性糖基化疾病,重点是小脑参与。Semin Neurol。2014; 34(3):357-66。
- 59.
Zufeey R,Knauer R,Burda P,Stagljar I,Te Heesen S,Lehle L等人。STT3,在体内酵母寡核酸转移酶活性所需的高度保守蛋白质。Embo J. 1995; 14(20):4949-60。
- 60。
Boutrot F,Segonzac C,Chang Kn,Qiao H,Ecker JR,Zipfel C等人。通过乙烯依赖性转录因子EIN3和EIL1直接对拟南芥免疫受体FLS2的转录控制。Proc Natl Acad Sci U S A. 2010; 107(32):14502-7。
- 61。
Yoo Sd,Cho Yh,Sheen J. Arabidopsis叶片原生质体:一种用于瞬态基因表达分析的通用细胞系统。NAT PROTOC。2007; 2(7):1565-72。
- 62。
Schindelin J,Arganda-Carreras I,Frize E,Kaynig V,Longair M,Pietzsch T等人。斐济:用于生物图像分析的开源平台。NAT方法。2012; 9(7):676-82。
致谢
我们感谢以下内容提供资料:Birgit Kemmerling(BAK1-4和FLS2.突变体),Marc骑士(apoaequorin转基因系PMAQ2),硅罗布拉(PXCSG-FLS2-YFP和PXCSG-EFR-YFP质粒)和Yusuke Saijo(Pampat-PEPR-GFP和PDONR-CERK1质粒)。为了评估整个基因组测序数据,Christian Ullrich(来自Marcel Quint,IPB组)写了用于将SNP分配给基因基因座和氨基酸交换的R脚本。通过优先计划SPP1212(GED和DS),协作研究中心SFB648 / TP-B1“植物中信息处理的分子机制”(植物中的信息处理)和SFB924 / TP-B10,这项工作得到支持米olecular mechanisms regulating yield and yield stability in plants” to S.R.
作者信息
从属关系
通讯作者
附加信息
利益争夺
作者声明他们没有相互竞争的利益。
作者的贡献
ft,sr和jg表征了cce突变体,进行等位基因测试,下一代测序分析,并与LW一起绘制基因图谱。HK和KF进行酵母补体和聚糖分析。CZ为这项工作提供了必要的材料。CZ, DS, KF和JL监督工作,构思研究,参与其设计、协调和帮助起草手稿。所有作者均已阅读并批准本稿件。
附加文件
附加文件1:图S1。
N-联糖基化模型在酵母(A)和N- 在文本(b)中提到的链接糖类结构。(a)模型在aebi后重新绘制[35]和kajiura等。[44.];和酿酒酵母使用酶或亚基的名称。(b)文本中提到的聚糖结构示意性地利用上述(a)中所示的相同代码来绘制,该代码基于推荐的联盟用于功能性族甘油结构命名法(http://www.functionalglycomics.org/static/consortium/Nomenclature.shtml).图S2: mamp诱导拦苗试验。具有代表性的照片显示了拟南芥幼苗在添加或不添加flg22 (1 μM)的琼脂平板上生长14天的根长。图S3:抵抗力假单胞菌含油PV。番茄DC3000(PTO.DC3000)在CCE2.,CCE3.或ALG3-T.突变体。表示定量的代表性实验(三个独立进行的实验)PTO.喷淋接种后叶片组织中DC3000菌落形成单位(cfu)。根据单因素方差分析与Bonferroni的多重比较检验(p< 0.05)。在过敏的sid2突变体(47.作为对照。(PDF 416 kb)
附加文件2:表S1。
发现的单一核苷酸多态性列表(SNP)CCE2.illumina的基因组重新排列后突变体。(XLSX 163 KB)
附加文件3:表S2。
本工作中使用的引物。(PDF 94 kb)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Trempel,F.,Kajiura,H.,Ranf,S。等等。改变出口蛋白质的糖基化,包括表面免疫受体,抑制钙和下游信号对微生物相关分子模式的反应拟南芥蒂利亚纳.BMC植物BIOL.16,31(2016)。https://doi.org/10.1186/s12870-016-0718-3
已收到:
接受:
发表:
关键词
- 钙
- 免疫信号
- 模式识别受体(PRRS)
- N- 糖基化
- 国防