- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
外源生长素调节多代谢网络和胚发育,控制种子次生休眠和萌发gydF4y2Ba烟草gydF4y2BalgydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba16gydF4y2Ba,文章号:gydF4y2Ba41gydF4y2Ba(gydF4y2Ba2016gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
生长素是一种次生休眠激素,控制着种子的休眠和萌发。然而,外源生长素控制种子休眠和萌发的生理过程和基因网络尚不清楚。gydF4y2Ba
结果gydF4y2Ba
1000mg /l生长素溶液浸泡烟草种子萌发率明显低于低浓度生长素溶液和ddH溶液gydF4y2Ba2gydF4y2Ba使用电子显微镜观察种子,与浸泡在ddH中的种子相比,种子没有正确展开gydF4y2Ba2gydF4y2BaO. WinRHIZO测得的胚根性状也弱于其他处理组。酶联免疫吸附测定结果表明,用梯度浓度生长素溶液浸泡的种子与用ddH浸泡的种子β-1,3葡聚糖酶活性和ABA含量无显著差异gydF4y2Ba2gydF4y2BaO.赤霉素酸(GA)和生长素含量在外源生长素吸胀时显著升高,在萌发时逐渐降低。RNA测序(RNA-seq)表明,与初级休眠种子相比,生长素响应休眠种子的转录组与吸收休眠种子的转录组更相似。基因差异表达分析结果表明,生长素控制的种子次生休眠与黄酮醇生物合成过程、赤霉素代谢过程、腺苷酰硫酸盐还原酶活性、硫氧还蛋白活性、谷氨酸合成酶(NADH)活性和染色质调控有关。此外,生长素响应性萌发响应ABA、生长素、茉莉酸(JA)和水杨酸(SA)介导的信号通路(红光、远红光和蓝光)、谷胱甘肽和蛋氨酸(Met)代谢。gydF4y2Ba
结论gydF4y2Ba
在本研究中,外源生长素介导的种子次生休眠是一种在不利条件下阻止种子萌发的环境模型。种子不能正常吸收,胚根也不能正常发育和发芽。为了完成萌发,其种子会刺激更多的GA合成,以拮抗外源生长素的刺激。外源生长素调控控制种子次生休眠和萌发的多代谢网络,其中最重要的是我们发现生长素响应型种子次生休眠是指表观遗传调控和萌发增强Met途径。因此,本研究揭示了在过量生长素信号激活下种子休眠和萌发的转录调控网络和生理发育过程。gydF4y2Ba
背景gydF4y2Ba
种子从休眠到萌发是植物生命周期中一个重要的生理过程。水分的吸收、种子休眠的释放、胚的膨胀、种膜的彻底突破被认为是种子萌发的完成[gydF4y2Ba1gydF4y2Ba].植物激素作为一种信号因子,对种子的休眠和萌发也很重要[gydF4y2Ba2gydF4y2Ba].GA和ABA被认为是关键内因,GA促进种子萌发和休眠,ABA抑制种子萌发和休眠[gydF4y2Ba3.gydF4y2Ba].最近的研究支持这样一个事实,即ABA/GA比值调节休眠释放和萌发所需的代谢转变[gydF4y2Ba4gydF4y2Ba- - - - - -gydF4y2Ba6gydF4y2Ba].在此基础上,可以推断其他激素如乙烯[gydF4y2Ba7gydF4y2Ba,gydF4y2Ba8gydF4y2Ba]和细胞分裂素[gydF4y2Ba9gydF4y2Ba,gydF4y2Ba10gydF4y2Ba]也会通过串扰机制影响发芽。gydF4y2Ba
生长素作为一种多功能的触发因子参与植物的许多发育过程[gydF4y2Ba11gydF4y2Ba],对根的发育也起着关键作用,如形成胚根极、决定根分生组织大小和控制根细胞伸长[gydF4y2Ba12gydF4y2Ba].然而,生长素在种子休眠和萌发中的生物学功能尚不清楚。近年来,一种以前未被认识的种子休眠调节因子生长素被确定为一种次级休眠激素。它与ABA信号一起控制种子休眠和萌发[gydF4y2Ba13gydF4y2Ba].gydF4y2Ba
许多参与休眠和萌发调控的基因已经被证实。ABA受体(gydF4y2BaPYR,所有供试/ RCARgydF4y2Ba)、蛋白质磷酸酶2C (gydF4y2BaAbi1 abi2 hab1 ahg3gydF4y2Ba)、蛋白激酶(gydF4y2BaSnRK2.2, 2.3, 2.6gydF4y2Ba)及其他休眠激素调节剂最近已获检讨[gydF4y2Ba14gydF4y2Ba].PIL5/PIF1被认为是一个重要的上游成分,它通过生物合成基因的转录控制,相互调节ABA和GA的水平[gydF4y2Ba12gydF4y2Ba],而PIL5被发现靶向多种激素信号基因的启动子,包括gydF4y2BaArf18, iaa16, crf2,gydF4y2Ba而且gydF4y2BaJAZ1gydF4y2Ba[gydF4y2Ba15gydF4y2Ba].最近有报道称,生长素在种子休眠的主要调节因子上游发挥作用,通过招募生长素响应因子ARF 10和16来控制种子萌发过程中ABI3的表达[gydF4y2Ba13gydF4y2Ba].gydF4y2Ba
然而,在转录组水平上,生长素调控种子萌发过程的机制以及外源生长素刺激的遗传应答仍不清楚。本研究的目的是分析生长素调控种子休眠和萌发的差异生理过程和基因表达gydF4y2Ba烟草gydF4y2BaL作为模型植物。这是第一个将外源性生长素控制的种子休眠和萌发在转录组尺度和生理发育过程也考虑在内的研究。gydF4y2Ba
结果gydF4y2Ba
种子休眠取决于外源生长素水平gydF4y2Ba
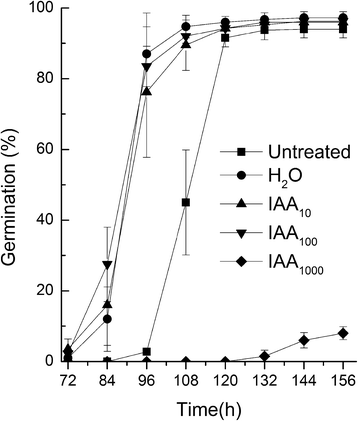
切记生长素对种子休眠的控制gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba13gydF4y2Ba],推测外源高浓度生长素可能促进烟草种子次生休眠。我们发现,与0、10和100 mg/l IAA溶液浸泡的烟草种子和未浸泡的种子相比,1000 mg/l IAA溶液浸泡的烟草种子萌发率明显降低(图2)。gydF4y2Ba1gydF4y2Ba).gydF4y2Ba
外源生长素调节种子胚根萌发gydF4y2Ba
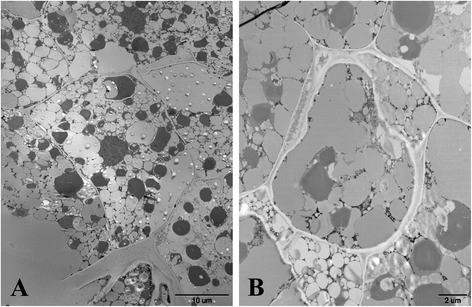
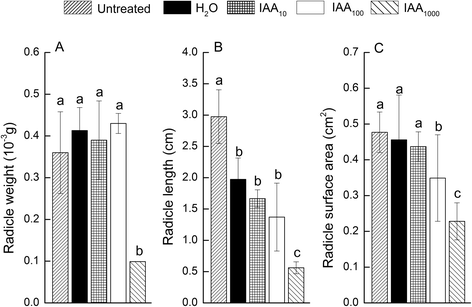
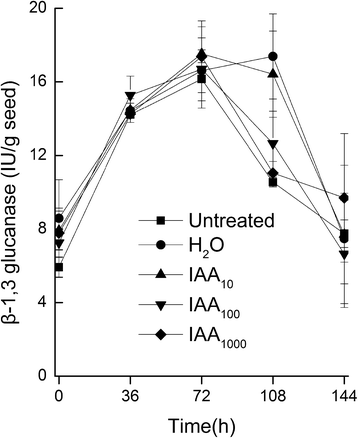
分析了外源生长素对种子萌发的影响,包括水分吸收、胚根萌发、胚乳破裂和子叶展开试验。结果表明,与ddH相比,1000mg /l IAA溶液中的种子液泡不能正常展开gydF4y2Ba2gydF4y2BaO(无花果。gydF4y2Ba2a和bgydF4y2Ba).此外,包括胚根重量、长度和表面积在内的胚根性状也明显较弱(图2)。gydF4y2Ba3得了gydF4y2Ba),但β-1,3葡聚糖酶活性无显著差异(图。gydF4y2Ba4gydF4y2Ba).在种子萌发过程中,当大约一半的子叶展开时,所有种子的胚根都没有出现。gydF4y2Ba
赤霉素水平受外源生长素而非脱落酸的调控gydF4y2Ba
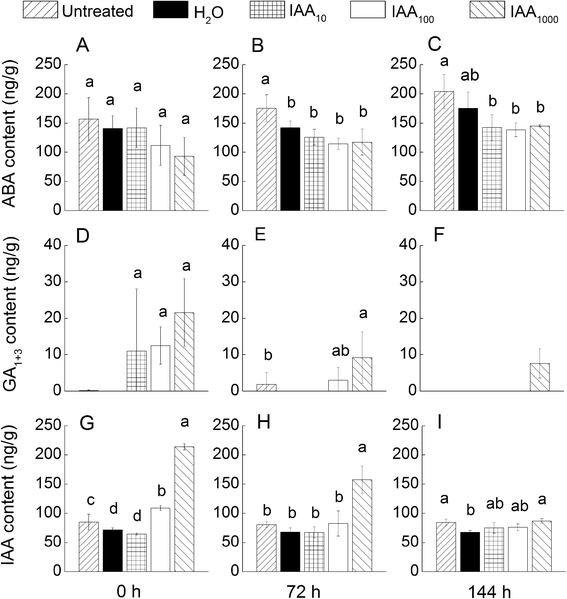
研究了外源IAA对内源激素ABA、GA和IAA含量的影响。ABA、GA的动态变化gydF4y2Ba1 + 3gydF4y2Ba3个发芽期的IAA含量见图。gydF4y2Ba5gydF4y2Ba.结果表明,在梯度浓度生长素溶液中浸泡的种子与ddH浸泡的种子ABA含量无显著差异gydF4y2Ba2gydF4y2BaO,在所有三个萌发阶段(图。gydF4y2Ba5 a - cgydF4y2Ba).然而,GAgydF4y2Ba1 + 3gydF4y2Ba(无花果。gydF4y2Ba5 d-fgydF4y2Ba)和IAA(图。gydF4y2Ba5胃肠道gydF4y2Ba)含量均显著升高,尤其是在第一期。gydF4y2Ba
外源生长素控制种子休眠和萌发的转录组分析gydF4y2Ba
数字gydF4y2Ba1gydF4y2Ba显示了发芽72和156 h烟草种子和无花果的表型。gydF4y2Ba6gydF4y2Ba说明了RNA-seq实验的过程通量。如图所示,0或1000 mg/l IAA的三次重复均在0、72或156 h后萌发(种子状态见表gydF4y2Ba1gydF4y2Ba)分别收集,混合,然后用于总RNA分离。然后,成对端库被准备和排序,如'gydF4y2Ba方法gydF4y2Ba”。分别使用Fast QC软件和Phred measure Score对数据和生成的序列进行质量检查。在所有情况下,高质量片段的百分比为> 80% (Phred值为20个单位或更多,对应测序错误率为1%)。生成的映射数据如表所示gydF4y2Ba1gydF4y2Ba.总共有7个样本。对于所有RNA-seq样本,平均产生约3700万个高质量的配对端读(2 × 100 bp)。我们得到了大约2.63亿个读取对,超过526亿个碱基。对于每个RNA-seq样本,72.61 - 91.43%(表1)gydF4y2Ba1gydF4y2Ba)的基因组被映射到gydF4y2BaN.tabacumgydF4y2BaK326参考基因组[gydF4y2Ba16gydF4y2Ba]使用TopHat软件[gydF4y2Ba17gydF4y2Ba].接下来,我们使用Cufflinks程序[gydF4y2Ba18gydF4y2Ba]以将每个样本的映射reads重新组装成一组转录本。然后使用袖扣中的cuffmerge模块将每个样本的转录本合并,生成一个唯一的转录本集,也称为unigenes。去除长度< 200 bp的转录本后,共检测到107403个unigenes。这些unigenes平均长度为1757 bp, N50值为2105 bp,其中长度为200 ~ 14848 bp。长度≥1000 bp的unigenes有80494个(74.94%)。gydF4y2Ba
对于unigenes的功能注释,我们在NCBI NR数据库中使用blastx搜索,e值为1E-05作为临界值。blastx检索结果显示,在NR数据库中有显著命中的unigenes约91840个(85.18%)。unigenes最佳爆轰击e值分布见附加文件gydF4y2Ba1gydF4y2Ba:图S1。大部分unigenes与NR数据库序列具有较高的相似性。其中e值≤1.0E-100的ungenes 70439个(65.58%),e值≤1.0E-5的ungenes 91839个(85.51%)。在91839个unigenes中,囊胚命中率最高的两个物种是gydF4y2Ba茄属植物lycopericumgydF4y2Ba(38,302, 41.71%)gydF4y2Ba茄属植物tuberosumgydF4y2Ba(37,890, 41.26%),是茄科最重要的模式生物。最佳命中物种的分布见附加文件gydF4y2Ba2gydF4y2Ba:图S2在EuKaryotic Orthologous Groups (EuKaryotic Orthologous Groups, KOG)数据库中对unigenes功能分类进行了blastx搜索,结果显示60497个unigenes与25个KOG簇相匹配。如附加文件所示gydF4y2Ba3.gydF4y2Ba:图S3, KOG分类显示最大的类别是“仅通用功能预测”,这与其他研究相同;接下来的类别是“翻译后修饰,蛋白质周转,伴侣”。对于基因本体(GO)注释,基于NCBI NR数据库的blastx检索结果,使用Blast2GO套件检索GO术语。在91839个标注的unigenes中,有76969个unigenes至少标注了一个GO术语。结果表明,62074个unigenes被划分为Biological Process (BP)组,61316个unigenes被划分为Molecular Function (MF)组,56760个unigenes被划分为Cellular Component (CC)组。三组中每个GO基因的单基因百分比见附加文件gydF4y2Ba4gydF4y2Ba:图S4最后,利用KAAS工具鉴定unigenes的通路。2100个京都基因与基因组百科全书(KEGG)直方图中有23261个unigenes(21.66%),被划分为327个KEGG通路。gydF4y2Ba
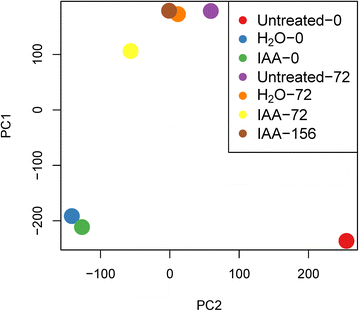
为了量化每个RNA-seq样本中unigenes的表达,我们使用蝴蝶结将干净的RNA-seq reads映射到所有unigenes序列,然后使用eXpress软件计算每个样本中unigenes的每千碱基外显子每百万片段映射(FPKM)。为了分析这些不同RNA-seq样本之间基因表达模式的相似性,我们首先过滤出所有样本中没有任何reads映射的unigenes,然后使用主成分分析(PCA)分析所有7个样本的unigenes FPKM值。主成分1和主成分2的PCA图显示H .gydF4y2Ba2gydF4y2BaO-0和IAA-0 HgydF4y2Ba2gydF4y2BaO-72点和IAA-156点更集中,说明这些样本更相似(图。gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
生长素响应型休眠种子和初级休眠种子的基因表达谱不同gydF4y2Ba
以未处理种子(初级休眠)和吸收生长素种子(次级休眠)为对照,进行差异表达分析gydF4y2Ba2gydF4y2Bao吸收种子(无休眠),单独。在很大程度上gydF4y2BapgydF4y2Ba< 0.05, fold change≥2,我们在未处理的种子和H . H .之间鉴定出了1958个上调和2917个下调的ungenesgydF4y2Ba2gydF4y2Bao吸收的种子(附加文件gydF4y2Ba5gydF4y2Ba:图S5A)。在相同条件下,我们还鉴定出了2506个上调和2634个下调的unigenesgydF4y2Ba2gydF4y2Bao吸收的种子(附加文件gydF4y2Ba5gydF4y2Ba:图S5B)。研究未处理和吸收生长素的紫花苜蓿种子中不同表达模式的紫花苜蓿基因gydF4y2Ba2gydF4y2Ba吸收o的种子,HgydF4y2Ba2gydF4y2Ba以吸收o的种子为对照,计算9种表达模式的单基因数。gydF4y2Ba
如图所示。gydF4y2Ba8gydF4y2Ba,gydF4y2Ba百分比gydF4y2Ba足球俱乐部gydF4y2Ba而且gydF4y2BaUnigenegydF4y2Ba足球俱乐部gydF4y2Ba根据单基因表达的fold change计算列数,其中fold change < 0.5的单基因为下调,fold change > 2.0的为上调;其余的被视为不变。饼状图是用gydF4y2Ba百分比gydF4y2Ba足球俱乐部gydF4y2Ba值。的gydF4y2BaUnigenegydF4y2BaPgydF4y2Ba列的计算基于gydF4y2Ba假定值gydF4y2Ba的基因差异表达分析,其中单基因与gydF4y2Ba假定值gydF4y2Ba< 0.05、fold change < 0.5视为下调,与gydF4y2Ba假定值gydF4y2Ba< 0.05, fold change > 2.0视为上调;其余的被视为不变。在9个表达模式中,我们将III/IV/VI/VII模式作为未处理种子与吸收生长素种子相对于H的差异表达模式gydF4y2Ba2gydF4y2BaO-imbibed种子。III/VII型相对于H具有完全的差异调节趋势gydF4y2Ba2gydF4y2BaO-imbibed种子。在IV/VI模式中,unigenes在吸收生长素的种子和HgydF4y2Ba2gydF4y2Ba吸收o的种子,在未处理的种子和HgydF4y2Ba2gydF4y2BaO-imbibed种子。因此,这四种表达模式中的unigenes也可以被认为是导致原生休眠与生长素诱导的次生休眠机制差异的主要原因,并可用于功能分析。gydF4y2Ba
对生长素响应性上调或下调的种子进行GO和KEGG通路基因富集分析,发现这些unigenes在初生休眠种子中也表现出不同的表达趋势(gydF4y2Ba假定值gydF4y2Ba< 0.05gydF4y2Ba,gydF4y2Ba3962;模式gydF4y2Ba3 + 4 +六世+七世gydF4y2Ba).与生长素介导的信号通路(黄酮醇生物合成过程、赤霉素代谢过程)、腺苷酸-硫酸盐还原酶活性、磷酸腺苷酸-硫酸盐还原酶(硫氧还蛋白)活性、谷氨酸合成酶(NADH)活性相关的GO术语显著富集(表)gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba6gydF4y2Ba:图S6)。KEGG通路富集分析表明,差异表达unigenes在植物激素信号转导中显著富集(附加文件)gydF4y2Ba7gydF4y2Ba:图S7)线粒体脂肪酸伸长,等等(表S7)gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
生长素响应型萌发种子与常规萌发种子在基因表达谱上存在差异gydF4y2Ba
采用与休眠实验相同的方法,对常规萌发种子(HgydF4y2Ba2gydF4y2BaO-72)和生长素反应性萌发种子(IAA-156)相对于生长素反应性休眠种子(IAA-72)。首先,在很大程度上gydF4y2Bap < 0.05gydF4y2Ba且折叠变化≥2,我们在未处理的种子和H . H .之间鉴定出3526个上调和2073个下调的unigenesgydF4y2Ba2gydF4y2Bao吸收的种子(附加文件gydF4y2Ba5gydF4y2Ba:图S5C)。在相同条件下,我们还鉴定出4458个上调和1616个下调的ungenesgydF4y2Ba2gydF4y2Bao吸收的种子(附加文件gydF4y2Ba5gydF4y2Ba图S5D)。对常规萌发种子(HgydF4y2Ba2gydF4y2BaO-72)和生长素反应性萌发种子(IAA-156)与生长素反应性休眠种子(IAA-72)进行比较。unigenes进一步分为9种表达模式(图。gydF4y2Ba9gydF4y2Ba).与上述休眠种子的差异表达分析一样,仅对III/IV/VI/VII模式下的unigenes进行分析,以鉴定样品IAA-156与样品H之间差异表达的基因gydF4y2Ba2gydF4y2Bao - 72。这些基因也可能是导致生长素响应型萌发种子与常规萌发种子在萌发机制上存在差异的主要原因。gydF4y2Ba
在生长素响应性上调或下调的萌发种子中基因的GO和KEGG通路富集结果表明,这些基因与常规萌发种子相比具有不同的表达趋势(gydF4y2Ba假定值gydF4y2Ba< 0.05gydF4y2Ba,gydF4y2Ba3048;模式gydF4y2Ba3 + 4 +六世+七世gydF4y2Ba).GO项的富集与ABA、生长素、JA和sa介导的信号通路、对红光、远红光和蓝光的响应、丝氨酸型内肽酶抑制剂活性、苯丙氨酸解氨酶活性、udp -葡萄糖转移酶活性以及光合作用等有关(表2)gydF4y2Ba2gydF4y2Ba和附加文件gydF4y2Ba8gydF4y2Ba:图S8)。KEGG富集通路与谷胱甘肽代谢、类黄酮生物合成相关(附加文件)gydF4y2Ba9gydF4y2Ba:图S9),苯丙类生物合成(表S9)gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
在熟悉的核心代谢途径中,生长素反应性种子休眠和萌发的遗传表达差异gydF4y2Ba
ABA和GA的串扰[gydF4y2Ba12gydF4y2Ba],以及生长素与ABA的相互作用[gydF4y2Ba13gydF4y2Ba]是控制种子休眠和萌发的最重要途径。其他重要的休眠调节因子可分为四类,涉及种子成熟、激素作用、休眠和染色质调节[gydF4y2Ba14gydF4y2Ba].为了研究这些重要基因和信号通路的变化,我们利用NCBI NR数据库对blastx进行搜索,并在烟草中鉴定了其同源unigenes。通过差异表达分析得到了这些unigenes的表达模式,结果表明gydF4y2BaEFSgydF4y2Ba,gydF4y2BaHUB1gydF4y2Ba而且gydF4y2BaAHG3gydF4y2Ba在生长素响应性种子休眠中显著上调和下调(表gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
Met代谢是所有生物的管家机制,也是种子发芽的核心[gydF4y2Ba19gydF4y2Ba].采用上述方法,对蛋氨酸代谢中的unigenes进行了研究。Met合成酶和丝氨酸乙酰转移酶基因在生长素反应型萌发种子和常规萌发种子中均显著不调控(表2)gydF4y2Ba4gydF4y2Ba).半胱氨酸(Cys)合成酶基因在生长素响应型种子休眠种子中表达上调,而在初级休眠种子中表达下调gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
实时荧光定量PCR检测生长素反应基因gydF4y2Ba
为了验证RNA-seq结果,采用实时定量逆转录pcr (qRT-PCR)对随机分配的19个生长素反应基因在休眠和萌发阶段进行表达分析。表格gydF4y2Ba4gydF4y2Ba和附加文件gydF4y2Ba10gydF4y2Ba:表S1显示了qRT-PCR和RNA-seq分析的对比,表明所有之前通过RNA-seq检测和鉴定的生长素响应基因都通过qRT-PCR得到了证实。结果表明,两种基因表达定量方法之间存在显著的正相关(Pearson correlation:gydF4y2BapgydF4y2Ba= 5.9 e - 3,gydF4y2BargydF4y2Ba= 0.65;斯皮尔曼相关:gydF4y2BapgydF4y2Ba= 5.2 e-5,gydF4y2BaρgydF4y2Ba= 0.84),表明所进行的RNA-seq表达分析具有较高的可靠性。gydF4y2Ba
讨论gydF4y2Ba
种子休眠和萌发是一个复杂的生物学过程,受发育因素和环境因素的共同影响。生长素是一种控制植物种子休眠和萌发的次生休眠激素gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba13gydF4y2Ba].本研究发现,高浓度外源生长素溶液可以促进烟草种子休眠,抑制种子萌发,抑制胚根突出和子叶变绿。然而,显微镜扫描结果表明,生长素溶液浸泡的种子正在发芽,尽管用ddH处理,但在液泡未完全扩张的细胞中发现了许多滤泡泡gydF4y2Ba2gydF4y2Ba转录组PCA结果还表明,生长素诱导的种子与ddH处理的种子更相似gydF4y2Ba2gydF4y2BaO与原始休眠种子相比。种子休眠被定义为一颗有活力的种子在有利条件下不能发芽[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba20.gydF4y2Ba].因此,这种外源生长素介导的种子休眠可以看作是一种在不利条件下阻止种子萌发的环境模型。gydF4y2Ba
休眠或发芽取决于周围组织的抵抗强度和伸长胚根生长力之间的平衡[gydF4y2Ba14gydF4y2Ba].在本研究中,我们发现外源生长素完全抑制了胚根的萌发,但通过β-1,3葡聚糖酶的活性判断,外源生长素并没有抑制胚乳破裂,β-1,3葡聚糖酶是烟草种子萌发过程中胚乳破裂所必需的一种特异性酶[gydF4y2Ba21gydF4y2Ba- - - - - -gydF4y2Ba23gydF4y2Ba].正如公认的那样,胚根细胞伸长对种子萌发是必要的,并且普遍认为胚根突出的完成就足以完成,而细胞分裂不是必要的[gydF4y2Ba24gydF4y2Ba].因此,生长素水平也可能是种子萌发过程中胚根发育和萌发的前提条件。三胞胎的种子gydF4y2Batir1afb2afb3gydF4y2Ba还有四倍突变体gydF4y2Batir1afb1afb2afb3gydF4y2Ba[gydF4y2Ba25gydF4y2Ba在gydF4y2Ba拟南芥gydF4y2Ba下胚轴和根分生组织发育失败。因此,本研究中高浓度的外源生长素也可能抑制下胚轴和根分生组织的发育。gydF4y2Ba
Liu等人2013年进行的一项最新研究gydF4y2Ba拟南芥gydF4y2Ba,揭示了植物生长素与ABA在种子休眠中的相互依赖关系。生长素通过激活ABA反应在种子休眠的主要调节因子上游起作用,但ABA的生物合成没有受到刺激[gydF4y2Ba13gydF4y2Ba].本研究还发现,过量外源生长素吸收的种子,ABA水平并没有增加。GA和IAA水平在吸胀期显著升高,在随后的萌发期逐渐降低。这些结果表明,为了使种子从休眠状态释放出来,需要合成更多的GA来对抗生长素的施用。研究表明,GA通路受到生长素的调控,生长素促进了GA通路的生长gydF4y2Ba拟南芥gydF4y2Ba调控赤霉素对根系生长的影响[gydF4y2Ba26gydF4y2Ba].GAs虽然是完成萌发所必需的,但并不直接参与萌发过程中发生的许多过程,这些过程发生在与胚根出现同时或非常接近胚根出现的阶段[gydF4y2Ba19gydF4y2Ba].因此,外源生长素的施用可能通过激活种子休眠过程中的ABA反应来显著促进种子休眠,并通过调节种子萌发过程中的赤霉素反应来抑制胚根的发育和萌发。gydF4y2Ba
种子休眠的诱导是由一组不同的调控因子控制的,这些调控因子可分为四组:1 .种子成熟;激素作用,iii。休眠和iv.染色质调节[gydF4y2Ba14gydF4y2Ba].在目前的研究中,我们发现一种激素调节器gydF4y2BaAHG3gydF4y2Ba被大幅下调。AHG3/AtPP2CA在ABA信号通路中起负调控作用,提示其在种子萌发和早期生长的ABA信号通路中起主要作用gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba27gydF4y2Ba].此外,两种表观遗传调控因子的表达水平gydF4y2BaEFSgydF4y2Ba而且gydF4y2BaHUB1gydF4y2Ba在本研究中显著上调。的gydF4y2BaEFSgydF4y2Ba在转录网络模拟研究中,基因被选为种子萌发过程中的相变调节因子,而突变体gydF4y2BaefsgydF4y2Ba种子还表现出多种种子表型,包括早熟[gydF4y2Ba28gydF4y2Ba].的gydF4y2BaRDO4 / HUB1gydF4y2Ba基因最初是基于其减少休眠表型[gydF4y2Ba29gydF4y2Ba].gydF4y2Ba
Met代谢是种子萌发的代谢中心[gydF4y2Ba19gydF4y2Ba].在种子萌发过程中gydF4y2Ba拟南芥gydF4y2Ba[gydF4y2Ba30.gydF4y2Ba- - - - - -gydF4y2Ba32gydF4y2Ba],大米[gydF4y2Ba33gydF4y2Ba,gydF4y2Ba34gydF4y2Ba]和豌豆[gydF4y2Ba35gydF4y2Ba], Met合酶或adometsynthease积累增加。在gydF4y2Ba拟南芥gydF4y2Ba,研究表明Met合成酶的积累水平在胚根出胚根前显著增加,但在胚根出胚根时未见进一步增加[gydF4y2Ba30.gydF4y2Ba- - - - - -gydF4y2Ba32gydF4y2Ba].本研究中Met合成酶和adometsynthetase基因均显著上调(参考生长素响应性萌发)。丝氨酸乙酰转移酶是Cys合成代谢的关键酶,在生长素反应性萌发种子中显著上调。Cys是Met生物合成的前体[gydF4y2Ba36gydF4y2Ba],并在Trxs的催化下,通过形成或减少二硫键,构成了有助于蛋白质结构的基石。有充分的证据表明,这些酶在萌发过程中影响着无数的蛋白质。gydF4y2Ba37gydF4y2Ba].Cys也是主要抗氧化分子谷胱甘肽(GSH)的前体,它参与了在萌发中起作用的几个过程。谷胱甘肽-抗坏血酸循环[gydF4y2Ba38gydF4y2Ba]或s -亚硝基谷胱甘肽(GSNO)的形成,或NO的储存形式在种子生理中起关键作用[gydF4y2Ba39gydF4y2Ba].最重要的是,生长素响应性萌发是指转录组中met通路的增强。gydF4y2Ba
结论gydF4y2Ba
与外源ABA在微观尺度上控制种子休眠不同,这种外源生长素介导的种子休眠更可能是一种在不利条件下阻止种子萌发的环境模式。与子叶相比,胚根对外源生长素的刺激更为敏感。在1 g/L外源生长素溶液中吸收的种子胚根不能正常发育和发芽。在外源生长素的刺激下,种子会刺激更多的GA的合成来拮抗生长素的作用。随着生长素水平的降低,种子由休眠状态恢复到萌发状态。主成分分析表明,与初级休眠种子相比,生长素响应休眠种子的转录组与吸收休眠种子的转录组更相似。与生长素响应型休眠种子相比,生长素响应型萌发种子的转录组与常规萌发种子的转录组更相似。为了获得生长素诱导的信号通路,未处理的种子和吸收生长素的种子的unigenes相对于HgydF4y2Ba2gydF4y2Ba选择o型种子,进行基因功能分析。生长素响应性休眠与黄酮醇生物合成过程、赤霉素代谢过程、腺苷酸-硫酸盐还原酶活性、硫氧还蛋白活性、谷氨酸合成酶(NADH)活性和染色质调控有关。生长素响应性萌发响应ABA、生长素、JA和SA介导的信号通路(红光、远红光和蓝光)、谷胱甘肽和蛋氨酸代谢,其中最重要的是我们发现生长素响应性次生种子休眠是指表观遗传调控和萌发增强Met通路。因此,本研究揭示了在过量生长素信号激活下种子休眠和萌发的转录调控网络和生理发育过程。gydF4y2Ba
方法gydF4y2Ba
种子吸胀;萌发和胚根性状测定gydF4y2Ba
烟草种子(gydF4y2BaNicotianatabacum L。gydF4y2Ba)南江3株来自贵州省烟草科学研究院。种子表面用1% CuSO消毒gydF4y2Ba4gydF4y2Ba溶液30分钟,再加入0.5% ZnSOgydF4y2Ba4gydF4y2Ba溶液在搅拌器上浸泡15分钟,然后用双重蒸馏水清洗三次,每次洗涤两分钟。无菌种子在(0、10、100、1000)mg/l IAA的补充激素溶液中,在25℃±1℃的光照/暗循环中吸收24 h,未处理的种子作为对照。样品用蒸馏水冲洗三次。然后,将各处理的种子播种在直径为90mm的塑料培养皿的纸床表面,在25°C±1°C的光/暗周期中孵育12 h。萌发被定义为可见的胚根萌发到种子长度。156小时后,从发芽种子中随机抽取10个胚根,在10gydF4y2Ba−3gydF4y2Bag平衡,用WinRHIZO测量胚根长度和表面积[gydF4y2Ba40gydF4y2Ba].gydF4y2Ba
种子中植物激素和β-1,3葡聚糖酶活性的提取、纯化和定量研究gydF4y2Ba
收集受精0、36、72、108和144 h的种子进行β-1,3葡聚糖酶活性测定,收集受精0、72和144 h的种子进行植物激素ABA和GA测定gydF4y2Ba1 + 3gydF4y2Ba和IAA量化。植物激素的提取、纯化和定量方法根据Wang [gydF4y2Ba41gydF4y2Ba].测定激素水平的ELISA试剂盒来自中国农业大学(北京,中国)。蛋白质提取的程序是根据Leubner-Metzger描述的[gydF4y2Ba21gydF4y2Ba].用于β-1,3葡聚糖酶活性测定的ELISA试剂盒来自R&D Systems母公司(Minneapolis, America)。gydF4y2Ba
用电子显微镜扫描吸收种子的液泡gydF4y2Ba
在吸收样品中,用0和1000 mg/L IAA处理的样品进行亚细胞结构观察。大约一半的种子被固定在FAA(福尔马林-醋酸-酒精)缓冲液中,并用抽吸泵排出。随后,取石蜡包埋组织连续横切面,依次用藏红花素和坚牢绿染色。最后,用透射电子显微镜(JEOL 1230, JEOL Ltd, and Japan)观察这些切片。gydF4y2Ba
RNA提取和下一代测序gydF4y2Ba
根据制造商的说明,使用总RNA纯化试剂盒(LC Science, TRK-1001)从烟草种子中提取总RNA。用NanoDrop 2000分光光度计(Thermo Scientific, USA)和甲醛琼脂糖凝胶电泳检测总RNA的完整性和质量。当Abs260 nm/Abs280 nm比值为>1.8时才使用RNA。建立数据库标准如下:RIN值≥7.5,RNA含量≥15 μg,浓度≥300 ng/μl。gydF4y2Ba
使用Invitrogen Dynabeads mRNA Ditect试剂盒从5ug合格的总RNA中富集mRNA,然后在95°C下将mRNA块化2min,然后加入停止液结束反应。经Qiagen kit纯化后,利用SMARTscript II逆转录酶进行首链cDNA合成。加入SMARTeroligos和dNTPs合成双cDNA。cDNA经凝胶纯化后,以纯化产物为模板生成测序文库。用qPCR检测文库质量,计算文库浓度。文库用Illumina HiSeq 2000平台测序,每个样品使用V3试剂从最终文库片段中获得10Gb数据。基地调用采用CASAVA 1.8软件(Illumina)进行。gydF4y2Ba
参考基因组转录组组装及功能分类gydF4y2Ba
由Illumina Genome Analyzer生成的RNA-Seq reads最初被处理以去除3 '端的适配器序列和低质量碱基。在预处理RNA-Seq数据后,使用称为Tophat的剪接校准器将reads映射到K326基因组[gydF4y2Ba42gydF4y2Ba],可以用来识别新的剪接事件并生成新的转录本。Tophat的默认参数允许最多两次不匹配,并在多个位置上报告最多40对读映射。由Tophat生成的sam文件被提供给软件Cufflinks [gydF4y2Ba18gydF4y2Ba],它将Sam文件中的排列组合成文本。然后,袖扣与参数一起运行,以构建最能描述RNA-Seq读取的最小转录本集。随后,所有的图书馆都由袖扣组装。Cuffmerge [gydF4y2Ba18gydF4y2Ba]被用来合并这些集合,以生成一个唯一的转录集,我们称之为unigenes。后来,这些unigenes被袖扣用来估计表达丰度(FPKM)。gydF4y2Ba
对于unigenes的函数标注,采用blastx算法进行同源搜索。首先在NCBI NR数据库(gydF4y2Baftp://ftp.ncbi.nih.gov/blast/dbgydF4y2Ba)及KOG资料库(gydF4y2Baftp://ftp.ncbi.nih.gov/pub/COG/KOG/kyvagydF4y2Ba)使用blastx。选择e值< 1.0e-5的最佳相似命中来生成转录注释信息。其次,每个长度≥200 bp的转录本使用GO数据库(gydF4y2Bahttp://www.geneontology.org/gydF4y2Ba)与Blast2GO [gydF4y2Ba43gydF4y2Ba],基于blast算法获得注释转录本的生物过程(Biological Process, BP)、细胞成分(Cellular Component, CC)和分子功能(Molecular Function, MF) GO术语信息。最后使用KAAS工具在KEGG数据库中检索所有转录本[gydF4y2Ba44gydF4y2Ba],选择多个植物生物,在默认参数下获得KEGG最佳同源同源同源同源体id。gydF4y2Ba
基因差异表达与基因富集分析gydF4y2Ba
在unigenes表达分析中,用Bowtie2将预处理过的RNA-seq reads映射到唯一的转录本上,然后用eXpress获得unigene reads计数,该软件可以校正多个映射的reads。然后利用R DESeq包检测两个无重复处理之间的差异转录物[gydF4y2Ba45gydF4y2Ba],根据文库reads计数对文库大小进行归一化,根据负二项分布对DE基因进行检测。nbinomTest()函数用于无复制分析。差分快速转录本gydF4y2Ba假定值gydF4y2Ba由Benjamini和Hochberg FDR校正。gydF4y2Ba
利用BiNGO插件识别差异表达unigenes中GO项的过度表达[gydF4y2Ba46gydF4y2Ba]进行超几何检验后,Benjamini和Hochberg FDR校正gydF4y2Ba假定值gydF4y2Ba< 0.05基于我们定制的烟草转录本GO注释数据集。gydF4y2Ba
用R GOstats包中的GSEAKEGGHyperGParams()函数检测差异表达unigenes KEGG通路的过度表达[gydF4y2Ba47gydF4y2Ba],这是基于超几何测试。gydF4y2Ba假定值gydF4y2Ba采用Benjamini和Hochberg FDR方法进行校正,然后选择gydF4y2Bap < 0.05gydF4y2Ba.KEGG原生图是使用R Pathview包中的keggview.native()函数获得的[gydF4y2Ba48gydF4y2Ba].gydF4y2Ba
实时定量PCRgydF4y2Ba
定量采用两步反应过程:逆转录(RT)和PCR。每次RT反应由0.5 μg RNA、2 μl PrimerScript Buffer、0.5 μl oligo dT、0.5 μl random 6mers和0.5 μl PrimerScript RT Enzyme Mix I (TaKaRa, Japan)组成,总体积为10 μl。反应在GeneAmp®PCR System 9700 (Applied Biosystems, USA)中在37℃下进行15分钟,然后在85℃下RT热失活5秒。将10 μl RT反应混合物在无核酸酶水中稀释10倍,- 20℃保存。gydF4y2Ba
采用瑞士Roche公司的LightCycler®480 II Real-time PCR仪进行实时PCR, PCR反应混合物为10 μl,其中cDNA 1 μl, 2 × LightCycler®480 SYBR Green I Master (Roche公司)5 μl,正向引物0.2 μl,反向引物0.2 μl,无核酸酶水3.6 μl。反应在384孔光学板(Roche, Swiss)中在95°C下孵育10分钟,然后在95°C下孵育10秒,在60°C下孵育30秒,循环40次。每个样品重复三份进行分析。在PCR循环结束时,进行熔化曲线分析,以验证预期PCR产物的具体生成。引物序列由Generay Biotech (Generay, PRC)根据从NCBI数据库(附加文件)获得的mRNA序列在实验室设计并合成gydF4y2Ba11gydF4y2Ba:表S2)。mrna的表达水平归一化至L25,并使用2-ΔΔCt方法计算[gydF4y2Ba49gydF4y2Ba].gydF4y2Ba
统计数据gydF4y2Ba
结果以每个处理至少三次重复计算的平均值±标准差(SD)表示。对胚根性状、β-1,3葡聚糖酶活性和植物激素水平进行方差分析(gydF4y2BaPgydF4y2Ba< 0.05误差水平)。采用SPSS软件Ver.16.0进行统计分析,使用Origin软件Ver.8.5进行绘图。gydF4y2Ba
支持数据的可用性gydF4y2Ba
RNA-seq读取数据已存入NCBI SRA数据库,登录号为SRP068795。gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
布雷JD。种子萌发和休眠。植物学报。1997;9(7):1055-66。gydF4y2Ba
- 2.gydF4y2Ba
王志强,李志强,李志强,等。植物激素在种子休眠释放和萌发过程中的相互作用。种子科学,2005;15(04):281-307。gydF4y2Ba
- 3.gydF4y2Ba
拉兹姆FA,巴伦K,希尔RD。开启赤霉素和脱落酸信号。植物学报。2006;9(5):454-9。gydF4y2Ba
- 4.gydF4y2Ba
山口赤霉素代谢及其调控。植物学报。2008;59:225-51。gydF4y2Ba
- 5.gydF4y2Ba
Morris K, Linkies A, Muller K, Oracz K, Wang X, Lynn JR,等。调节种子的萌发在接近gydF4y2Ba拟南芥gydF4y2Ba相对莴苣:全球组织特异性转录本分析。中国生物医学工程学报。2011;36(4):344 - 344。gydF4y2Ba
- 6.gydF4y2Ba
Nambara E, Okamoto M, Tatematsu K, Yano R, Seo M, Kamiya Y.脱落酸与种子休眠和萌发的控制。种子科学,2010;20(02):55-67。gydF4y2Ba
- 7.gydF4y2Ba
Linkies A, Muller K, Morris K, Tureckova V, Wenk M, Cadman CS,等。乙烯与脱落酸相互作用调节胚乳萌发过程中的破裂:一种比较方法gydF4y2BaLepidium一gydF4y2Ba而且gydF4y2Ba拟南芥gydF4y2Ba芥。植物学报。2009;21(12):3803-22。gydF4y2Ba
- 8.gydF4y2Ba
苏比亚V,雷迪KJ。乙烯、脱落酸和细胞分裂素在种子萌发和幼苗建立过程中的相互作用gydF4y2Ba拟南芥gydF4y2Ba.生物科学学报,2010;35(3):451-8。gydF4y2Ba
- 9.gydF4y2Ba
杨杰,杨建平,杨建平,等。etr1-2突变gydF4y2Ba拟南芥gydF4y2Ba影响脱落酸、生长素、细胞分裂素和赤霉素在种子休眠、湿冷和萌发过程中的代谢途径。植物学报,2005;42(1):35-48。gydF4y2Ba
- 10.gydF4y2Ba
贝林C, Megies C, Hauserova E, Lopez-Molina L.脱落酸抑制生长gydF4y2Ba拟南芥gydF4y2Ba胚轴萌发后增强生长素信号。植物学报。2009;21(8):2253-68。gydF4y2Ba
- 11.gydF4y2Ba
黄志刚,李志刚。植物生长素对植物生长发育的影响。细胞。2009;136(6):1005 - 16。gydF4y2Ba
- 12.gydF4y2Ba
王晓明,王晓明,王晓明,等。植物发育过程中激素相互作用的研究进展。细胞发育生物学,2012;28:463-87。gydF4y2Ba
- 13.gydF4y2Ba
冯赵刘备H, X, Y, Z,李问杨总部,等。生长素通过诱导arf介导的ABI3激活,刺激脱落酸信号,从而控制种子休眠gydF4y2Ba拟南芥gydF4y2Ba.中国科学(d辑:自然科学),2013;gydF4y2Ba
- 14.gydF4y2Ba
Graeber K, Nakabayashi K, Miatton E, Leubner-Metzger G, Soppe WJ。种子休眠的分子机制。植物细胞环境学报。2012;35(10):1769-86。gydF4y2Ba
- 15.gydF4y2Ba
吴e,姜华,山口S,朴J,李D,神谷Y,等。植物种子萌发过程中光敏色素相互作用因子3-LIKE5靶基因的全基因组分析gydF4y2Ba拟南芥gydF4y2Ba.植物学报。2009;21(2):403-19。gydF4y2Ba
- 16.gydF4y2Ba
李志强,李志强,李志强,等。烟草基因组序列及其与番茄和马铃薯的比较。Nat Commun. 2014;5:3833。gydF4y2Ba
- 17.gydF4y2Ba
Trapnell C, Pachter L, Salzberg SL. TopHat:发现RNA-Seq剪接连接。生物信息学,2009,25(9):1105 - 11所示。gydF4y2Ba
- 18.gydF4y2Ba
特拉内尔C, Williams BA, Pertea G, Mortazavi A, Kwan G, van Baren MJ,等。RNA-Seq转录本的组装和定量揭示了细胞分化过程中未注释的转录本和异构体转换。生物技术学报。2010;28(5):511-5。gydF4y2Ba
- 19.gydF4y2Ba
李志强,李志强,李志强,等。种子萌发和活力。植物科学学报,2012;gydF4y2Ba
- 20.gydF4y2Ba
种子休眠与萌发控制。中国植物学报。2006;26(3):531 - 531。gydF4y2Ba
- 21.gydF4y2Ba
Leubner-Metzger G, Frundt C, vogele - lange R, Meins Jr F.烟草胚乳在萌发过程中的I类β-1,3-葡聚糖酶。植物物理学报,1995;39(2):344 - 344。gydF4y2Ba
- 22.gydF4y2Ba
卢伯纳-梅茨格尔,Fründt C, Meins Jr .赤霉素、黑暗和渗透对烟草种子胚乳破裂和I类β-1,3-葡聚糖酶诱导的影响。足底。1996;199:282-8。gydF4y2Ba
- 23.gydF4y2Ba
Leubner-Metzger G, Petruzzelli L, Waldvogel R, Vogeli-Lange R, Meins F.烟草种子萌发过程中乙烯响应元件结合蛋白(EREBP)的表达及I类β-1,3-葡聚糖酶的转录调控。植物化学学报,1998;38:785 - 795。gydF4y2Ba
- 24.gydF4y2Ba
Barroco RM, Van Poucke K, Bergervoet JH, De Veylder L, Groot SP, Inze D,等。细胞周期机制在恢复胚胎后发育中的作用。植物科学进展。2005;37(1):1 - 4。gydF4y2Ba
- 25.gydF4y2Ba
麦烨,王林,杨海峰。IAA7/AXR2基因的功能获得性突变使植物在短日照条件下晚开花gydF4y2Ba拟南芥gydF4y2Ba.中国生物工程学报,2011;gydF4y2Ba
- 26.gydF4y2Ba
傅X,哈伯NP。生长素促进gydF4y2Ba拟南芥gydF4y2Ba通过调节赤霉素反应的根生长。大自然。2003;421(6924):740 - 3。gydF4y2Ba
- 27.gydF4y2Ba
吉田T,西村N,北畑N,黑森T,伊藤T,麻美T,等。aba -超敏萌发3编码一个蛋白磷酸酶2C (AtPP2CA),在萌发过程中强烈调节脱落酸信号gydF4y2Ba拟南芥gydF4y2Ba蛋白质磷酸酶2c。植物科学进展。2006;40(1):115-26。gydF4y2Ba
- 28.gydF4y2Ba
郭文杰,王志强,王志强,等。捕捉种子萌发的全基因组网络模型揭示了植物细胞相变的协调调节。中国科学(d辑),2011,26(3):379 - 379。gydF4y2Ba
- 29.gydF4y2Ba
刘勇,刘志刚,刘志刚。组蛋白H2B单泛素化的缺失gydF4y2Ba拟南芥gydF4y2BaHub1 (rdo4)突变体揭示了染色质重塑在种子休眠中的作用。植物学报。2007;19(2):433-44。gydF4y2Ba
- 30.gydF4y2Ba
Gallardo K, Job C, Groot SP, Puype M, Demol H, Vandekerckhove J,等。蛋白质组学分析gydF4y2Ba拟南芥gydF4y2Ba种子萌发和启动。植物科学学报,2001;26(2):344 - 344。gydF4y2Ba
- 31.gydF4y2Ba
Gallardo K, Job C, Groot SP, Puype M, Demol H, Vandekerckhove J,等。蛋氨酸生物合成的重要性gydF4y2Ba拟南芥gydF4y2Ba种子萌发和幼苗生长。物理学报。2002;116:238-47。gydF4y2Ba
- 32.gydF4y2Ba
Gallardo K, Job C, Groot SP, Puype M, Demol H, Vandekerckhove J,等。蛋白质组学的gydF4y2Ba拟南芥gydF4y2Ba种子发芽。野生型与赤霉素缺乏型种子的比较研究。植物物理学报,2002;29(2):344 - 344。gydF4y2Ba
- 33.gydF4y2Ba
金圣,姜世永,王勇,金圣生,黄杜华,姜基。GA和ABA对水稻萌发种子胚胎蛋白质组的调控分析。蛋白质组学。2008;8:3577 - 87。gydF4y2Ba
- 34.gydF4y2Ba
金st,王勇,姜世永,金松生,Rakwal R,金玉春,等。水稻胚蛋白质组学的发展揭示了胚蛋白在水稻种子萌发调控中的重要作用。中国生物医学工程学报,2009;gydF4y2Ba
- 35.gydF4y2Ba
王wq, Moller IM,宋sq。胚胎轴的蛋白质组学分析gydF4y2BaPisum一gydF4y2Ba种子萌发过程中与脱水耐性丧失相关的蛋白质鉴定。蛋白质组学杂志,2012;gydF4y2Ba
- 36.gydF4y2Ba
王志强,王志强,王志强,等。植物蛋氨酸生物合成与代谢的研究进展。中国科学院学报(自然科学版),1998;26(3):366 - 366。gydF4y2Ba
- 37.gydF4y2Ba
Buchanan BB, Balmer Y.氧化还原式监管:不断扩大的视野。植物学报2005;56:187-220。gydF4y2Ba
- 38.gydF4y2Ba
Bonsager BC, Shahpiri A, Finnie C, Svensson B.发芽大麦胚抗坏血酸-谷胱甘肽循环酶的蛋白质组学和活性谱。植物化学。2010;71(14):1650 - 6。gydF4y2Ba
- 39.gydF4y2Ba
Bethke PC, Libourel IG, Jones RL。一氧化氮减少种子休眠gydF4y2Ba拟南芥gydF4y2Ba.中国机械工程学报,2006;37(3):517-26。gydF4y2Ba
- 40.gydF4y2Ba
李志华,任晓丽,龙俊梅,孔德杰,王志华,刘丽丽。基于蒴果颜色定量的种子自然和人工干燥干燥力和干度评价gydF4y2Ba烟草。gydF4y2Ba中国科学(d) . 2015;gydF4y2Ba
- 41.gydF4y2Ba
王勇,李波,杜敏,Eneji AE,王波,段磊,等。植物激素参与缺钾诱导棉花叶片衰老的反馈调控机制。中国机械工程学报,2012;29(3):344 - 344。gydF4y2Ba
- 42.gydF4y2Ba
Kim D, Pertea G, Trapnell C, Pimentel H, Kelley R, Salzberg SL. TopHat2:存在插入、缺失和基因融合时转录组的精确对齐。中国生物医学工程学报。2013;14(4):R36。gydF4y2Ba
- 43.gydF4y2Ba
Gotz S, Garcia-Gomez JM, Terol J, Williams TD, Nagaraj SH, Nueda MJ,等。使用Blast2GO套件进行高通量功能注释和数据挖掘。中国生物医学工程学报,2008;36(10):3420-35。gydF4y2Ba
- 44.gydF4y2Ba
Moriya Y, Itoh M, Okuda S, Yoshizawa AC, Kanehisa M. KAAS:自动基因组注释和路径重建服务器。Nucleic Acids Res. 2007;35(Web Server issue): W182-5。gydF4y2Ba
- 45.gydF4y2Ba
李志强,李志强。序列计数数据的差分表达式分析。中国生物工程学报,2010;11(10):R106。gydF4y2Ba
- 46.gydF4y2Ba
Maere S, Heymans K, Kuiper M. BiNGO:一个评估生物网络中基因本体类别过度表示的Cytoscape插件。生物信息学。2005;21(16):3448 - 9。gydF4y2Ba
- 47.gydF4y2Ba
Falcon S, Gentleman R.使用GOstats测试GO术语关联的基因列表。生物信息学。2007;23(2):257 - 8。gydF4y2Ba
- 48.gydF4y2Ba
row, Brouwer C. Pathview: R/Bioconductor基于路径的数据集成和可视化包。生物信息学)。2013;29(14):1830 - 1。gydF4y2Ba
- 49.gydF4y2Ba
Livak KJ, Schmittgen TD。使用实时定量PCR和2(−δ δ C (T))方法分析相关基因表达数据。方法。2001;25(4):402 - 8。gydF4y2Ba
致谢gydF4y2Ba
本工作由中国烟草总公司分子遗传学重点实验室专项资金、中国烟草总公司贵州省烟草公司青年基金(201526)和中国烟草总公司贵州省烟草公司重点项目(201321)资助。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们之间没有利益冲突。gydF4y2Ba
作者的贡献gydF4y2Ba
LZH、LYL、ZJH和RXL进行了生理生化研究。LZH, ZJ, FJJ参与序列比对并起草手稿。LZH进行了电镜和ELISA实验。LZH, WGY和WJH构想了这项研究,并参与了研究的设计和协调。所有作者都阅读并批准了最终的手稿。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:图S1。gydF4y2Ba
在休眠期和萌发期,紫菜属的最佳芽苞的分布达到e值gydF4y2Ba烟草gydF4y2Barna序列分析后的L.植物。(TIF 9107 kb)gydF4y2Ba
附加文件2:图S2。gydF4y2Ba
最佳命中种的分布表现为休眠和萌发gydF4y2Ba烟草gydF4y2Barna序列分析后的L.植物。(TIF 7945kb)gydF4y2Ba
附加文件3:图S3。gydF4y2Ba
在休眠和萌发过程中观察到KOG的分类gydF4y2Ba烟草gydF4y2Barna序列分析后的L.植物。(TIF 27158kb)gydF4y2Ba
附加文件4:图S4。gydF4y2Ba
生长素反应基因的整体分布gydF4y2Ba烟草gydF4y2BaL.种子在几个GO类别。使用来自TAIR数据库的GO注释,将具有假定功能的基因分配到(A)分子功能,(B)生物过程或(C)细胞成分类别。(TIF 19948kb)gydF4y2Ba
附加文件5:图S5。gydF4y2Ba
在休眠和萌发过程中有显著基因的火山图gydF4y2Ba烟草gydF4y2Barna序列分析后的L.植物。x轴表示平均值y轴表示log2倍变化。Fc值的几个断点指示在y轴上,其中0表示“没有变化”。上调和下调基因用红色表示(gydF4y2Bap < 0.05gydF4y2Ba)和表达略有变化的基因用黑色表示(附加文件gydF4y2Ba5gydF4y2Ba:图S5A,未处理的0 vs HgydF4y2Ba2gydF4y2BaO-0;额外的文件gydF4y2Ba5gydF4y2Ba:图S5B, IAA-0 vs HgydF4y2Ba2gydF4y2BaO-0;额外的文件gydF4y2Ba5gydF4y2Ba:图S5C, H .gydF4y2Ba2gydF4y2Bao - 72 - vs iaa - 72;额外的文件gydF4y2Ba5gydF4y2Ba:图S5D, IAA-156 vs IAA-72)。(ZIP 1914 kb)gydF4y2Ba
附加文件6:图S6。gydF4y2Ba
在生长素响应休眠种子基因差异表达分析中富集GO项的实例。利用BinGO识别丰富的GO术语,并利用Cytoscape对网络进行可视化。圆圈的颜色表示gydF4y2Ba假定值gydF4y2Ba(Benjamini和Hochberg FDR校正的超几何检验)。圆圈的大小代表GO术语的背景基因计数。完整的氧化石墨烯富集清单见表gydF4y2Ba2gydF4y2Ba.(TIF 583 kb)gydF4y2Ba
附加文件7:图S7。gydF4y2Ba
植物激素信号转导KEGG途径中富集的差异表达unigenes在生长素响应休眠种子中(FDR调整gydF4y2Ba假定值gydF4y2Ba= 4.07 e-02)。通过超几何检验确定了富集的KEGG通路,FDR校正显著性水平gydF4y2Ba假定值gydF4y2Ba< 0.05。基因矩形的颜色表示基因表达模式,如图所示。完整的KEGG途径富集列表见表gydF4y2Ba3.gydF4y2Ba.(TIF 666 kb)gydF4y2Ba
附加文件8:图S8。gydF4y2Ba
在生长素响应性萌发种子基因差异表达分析中富集GO项的实例。由Cytoscape软件中的BinGO插件识别丰富的GO术语,如“gydF4y2Ba方法gydF4y2Ba”。圆圈的颜色表示gydF4y2Ba假定值gydF4y2Ba浓缩。圆圈的大小代表GO术语的背景基因计数。完整的氧化石墨烯富集清单见表gydF4y2Ba2gydF4y2Ba.(TIF 745kb)gydF4y2Ba
附加文件9:图S9。gydF4y2Ba
在生长素响应萌发种子中,黄酮生物合成KEGG途径富集的差异表达ungenes (FDR调整后)gydF4y2Ba假定值gydF4y2Ba= 8.04 e-04)。通过超几何检验确定了富集的KEGG通路,FDR校正显著性水平gydF4y2Ba假定值gydF4y2Ba< 0.05。基因矩形的颜色表示基因表达模式,如图所示。完整的KEGG途径富集列表见表gydF4y2Ba3.gydF4y2Ba.(TIF 600kb)gydF4y2Ba
附加文件10:表S1。gydF4y2Ba
RT-PCR检测生长素反应基因。(docx22 kb)gydF4y2Ba
附加文件11:表S2。gydF4y2Ba
用于RT-PCR验证的基因引物序列(docx22 kb)gydF4y2Ba
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文根据创作共用属性4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),允许在任何媒介上不受限制地使用、分发和复制,前提是您对原作者和来源给予适当的赞扬,提供到创作共用许可证的链接,并注明是否进行了更改。创作共用公共领域奉献弃权书(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)除另有说明外,适用于本条所提供的资料。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
李震,张俊,刘勇。gydF4y2Baet al。gydF4y2Ba外源生长素调节多代谢网络和胚发育,控制种子次生休眠和萌发gydF4y2Ba烟草gydF4y2BalgydF4y2BaBMC植物生物学gydF4y2Ba16日,gydF4y2Ba41(2016)。https://doi.org/10.1186/s12870-016-0724-5gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-016-0724-5gydF4y2Ba
关键字gydF4y2Ba
- 生长素gydF4y2Ba
- 种子休眠gydF4y2Ba
- 发芽gydF4y2Ba
- WateruptakegydF4y2Ba
- 胚胎发育gydF4y2Ba
- 胚乳破裂gydF4y2Ba
- 激素gydF4y2Ba
- 烟草gydF4y2Ba
- RNA-seqgydF4y2Ba