- 研究文章gydF4y2Ba
- 开放获取gydF4y2Ba
- 发表:gydF4y2Ba
转录组学,蛋白质组学和代谢的变化gydF4y2Ba拟南芥gydF4y2Ba光照开始后的叶片gydF4y2Ba
BMC植物生物学gydF4y2Ba体积gydF4y2Ba16gydF4y2Ba、物品编号:gydF4y2Ba43gydF4y2Ba(gydF4y2Ba2016gydF4y2Ba)gydF4y2Ba
摘要gydF4y2Ba
背景gydF4y2Ba
光在植物的生长发育中起着重要的作用。本研究通过转录组学、蛋白质组学和代谢组学分析,研究了光照对20 d龄拟南芥叶片生理的影响。由于叶绿体和线粒体中产生能量的电子传递链是由核基因组和细胞器基因组编码的,因此在去除核糖体RNA后对总RNA进行测序可以提供细胞器基因组转录的重要信息。ADP, ATP, NADP水平的变化gydF4y2Ba+gydF4y2Ba光照下,NADPH和41种代谢物也被量化。gydF4y2Ba
结果gydF4y2Ba
光照作用下,质体基因组编码的基因转录没有显著变化,但编码光系统中不同功能复合物的核基因转录受到差异调控,而同一复合物的成员之间相互共调控。然而,这三种基因组编码的mrna和蛋白质的丰度并不总是正相关的。其中一个例子是光系统成分的mRNA和蛋白质丰度之间的负相关,这反映了转录后调控在植物生理中的重要性。gydF4y2Ba
结论gydF4y2Ba
该研究提供了全系统的数据集,使植物研究人员能够检查光照下叶片转录组、蛋白质组和关键代谢物的变化,并确定光照下特定基因或途径的转录组变化与蛋白质丰度之间是否存在相关性。细胞器和光系统、卡尔文-本森循环、碳水化合物代谢、糖酵解、三羧酸循环和呼吸链的数据整合,从而为光照下植物生理变化提供了比迄今为止所获得的更完整的图景。gydF4y2Ba
背景gydF4y2Ba
光是植物生长的最终能量来源。在光合作用的光反应过程中,利用光能驱动电子从水中流向NAPDgydF4y2Ba+gydF4y2Ba在这个过程中,质子梯度在类囊体膜上形成ATP。光合作用为植物提供能量(ATP)和还原力,对植物生理产生重要影响。关于光照对拟南芥叶片转录组的影响,已有文献报道。然而,这些研究要么使用不到10,000个探针的自制微阵列[gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba]或Affymetrix ATH1 [gydF4y2Ba3.gydF4y2Ba]或Aligent Oligo微阵列[gydF4y2Ba4gydF4y2Ba]。Affymetrix ATH1微阵列仅包含24000个基因,探针不能代表拟南芥核基因组中的所有基因(> 30000个基因),并且在Aligent微阵列中未检测到叶绿体和线粒体基因组的转录物[gydF4y2Ba4gydF4y2Ba,gydF4y2Ba5gydF4y2Ba]。在植物中,许多生物过程都与光合作用有关。由于叶绿体和线粒体是植物细胞的两个关键动力源,而能量产生系统的许多组成部分(叶绿体中的光系统和线粒体中的呼吸链)都由核基因组和细胞器基因组编码,因此需要细胞器基因组的转录数据来清晰地描述植物能量生物学。在本报告中,通过RNA测序获得了全基因组转录组数据,包括叶绿体和线粒体基因组的转录本。鉴于转录物丰度的变化并不总是与蛋白质水平的变化相一致[gydF4y2Ba6gydF4y2Ba,gydF4y2Ba7gydF4y2Ba],也检测了叶片蛋白质组的变化[gydF4y2Ba8gydF4y2Ba]。此外,主要叶片代谢物的变化gydF4y2Ba拟南芥,gydF4y2Ba包括ATP ADP NADPgydF4y2Ba+gydF4y2Ba光照开始后NADPH的变化也进行了研究。代谢组学现在正成为这种后基因组研究的重要组成部分。由于测量mRNA和蛋白水平的变化并不总是直接反映植物生理的变化,代谢组学为植物的能量和营养状况提供了清晰的图像[gydF4y2Ba9gydF4y2Ba]。这些组学数据的整合有望使我们更好地了解光对植物叶片生理的影响[gydF4y2Ba10gydF4y2Ba]。gydF4y2Ba
结果gydF4y2Ba
rna序列和差异分析gydF4y2Ba
对于每个样本,深度测序获得了90个碱基和6 Gbp长度序列的近65 M reads。测序的总reads分别定位到拟南芥TAIR 10.0基因和基因组(表2)gydF4y2Ba1gydF4y2Ba和gydF4y2Ba2gydF4y2Ba).Reads被分为两个亚组:单个指定的Reads只映射一次基因/基因组位置;并且多次读取映射到基因/基因组中的多个位置。大约75%的reads可以定位到拟南芥基因。大约60%的读取只与一个位置对齐,而15%的读取被映射到两个或更多的位置(表1)gydF4y2Ba1gydF4y2Ba).然而,当这些序列被映射到拟南芥基因组时,每个文库中大约有85%的序列是一致的。80%被定位到基因组中的一个位置,4%被定位到基因组中的多个位置(表1)gydF4y2Ba2gydF4y2Ba).rna测序数据共检测到29,480个表达转录物,其中核基因组编码的转录物29,278个,线粒体基因组编码的转录物126个,叶绿体基因组编码的转录物96个(另附文件)gydF4y2Ba1gydF4y2Ba,gydF4y2Ba2gydF4y2Ba和gydF4y2Ba3.gydF4y2Ba).将已测序rna编码的基因按功能分类,并与TAIR 10.0 (gydF4y2Bahttp://www.arabidopsis.org/portals/genAnnotation/genome_snapshot.jspgydF4y2Ba)(表gydF4y2Ba3.gydF4y2Ba).表格gydF4y2Ba3.gydF4y2Ba结果表明,共检测到23840个核基因的转录本,其中22076个基因被分类为蛋白质编码类。由于一些基因表达不止一个剪接变体,因此这些数字少于检测到的转录本数量(>29,000)。在我们的样本中只发现了3个前trna,这很可能是因为大多数trna都短于90bp。gydF4y2Ba
为了区分来自细胞核和细胞器的同源转录本,分别将clean reads定位到拟南芥Col-0线粒体编码基因集和叶绿体编码基因集。结果显示,分别检测到96个和126个叶绿体和线粒体编码的转录本(另附文件)gydF4y2Ba2gydF4y2Ba和gydF4y2Ba3.gydF4y2Ba).细胞核、叶绿体和线粒体基因的平均RPKM分别为14.3、11040.2和155.3。值得注意的是,每个叶细胞只包含一个核基因组,但包含大约100个叶绿体,数百个线粒体,每个叶绿体和线粒体包含几个基因组。这解释了两个细胞器基因组编码的转录本的高RPKM。gydF4y2Ba
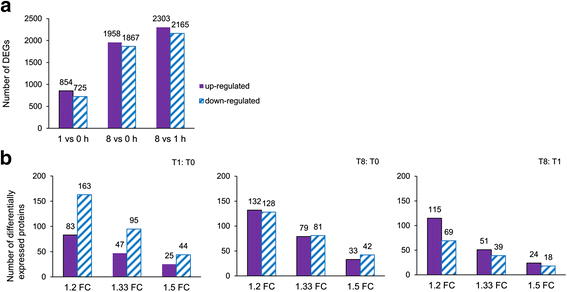
与T1相比,更多转录本在T8时发生了显著变化(图2)。gydF4y2Ba1gydF4y2Ba).T1和T0的差异表达基因(deg)代表了那些对光照立即做出反应的基因,而T8和T1之间的差异表达基因(deg)代表了间接受光照影响的基因,可能是由于代谢变化(如ATP、糖等)。大多数差异表达基因(log2比值≥1或≤-1)和gydF4y2BaPgydF4y2Ba-值< 0.05)均为核编码或线粒体基因组编码,而非叶绿体基因组编码(另附文件)gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
选择性剪接(AS)是rna测序数据可以提供新信息的另一个领域。一般来说,AS有七种常见类型,即外显子跳变(ES)、内含子保留(IR)、备选5 '剪接位点(A5SS)、备选3 '剪接位点(A3SS)、备选第一外显子(AFE)、备选最后外显子(ALE)和互斥外显子(MXE) [gydF4y2Ba11gydF4y2Ba]。迄今为止,TAIR 10数据库中的5,885个蛋白质编码基因已被记录为具有选择性剪接(gydF4y2Bahttp://www.arabidopsis.org/portals/genAnnotation/genome_snapshot.jspgydF4y2Ba).根据文献记载,这种现象受一天中不同时间的影响[gydF4y2Ba12gydF4y2Ba]、环境条件[gydF4y2Ba13gydF4y2Ba]和重音[gydF4y2Ba14gydF4y2Ba]。我们的数据显示,最丰富的备选剪接位点分布在内含子保留和备选3 '剪接类型(附加文件)gydF4y2Ba5gydF4y2Ba).从我们的样本中还发现了新的转录本(附加文件)gydF4y2Ba6gydF4y2Ba).在时间点T1检测到的新转录本比在其他时间点检测到的新转录本更多,然而,这些假定的新转录本是否为真正的转录本仍需在未来的研究中验证。gydF4y2Ba
一些光系统转录本,包括gydF4y2BaPQL1gydF4y2Ba,gydF4y2BaPQL2gydF4y2Ba,gydF4y2Baferredoxin1gydF4y2Ba,gydF4y2BaCyt c6agydF4y2Ba,gydF4y2BaFdC2gydF4y2Ba,gydF4y2BaLhca3gydF4y2Ba,gydF4y2BaLhcb2.3gydF4y2Ba和gydF4y2BaLhcb4.2gydF4y2Ba使用深度测序的相同总RNA,通过定量逆转录酶PCR (qRT-PCR)进行验证。选择的基因在T0时的mRNA丰度调整为1。对T1: T0和T8: T0转录本丰度比值进行统计学分析。结果显示,所有选择的转录本在rna测序和qRT-PCR之间是一致的gydF4y2Ba7gydF4y2Ba).gydF4y2Ba
蛋白质组学研究gydF4y2Ba
经强阳离子交换(SCX)运行后,每分钟收集一次馏分,最后将80个馏分合并为9个馏分进行LC/MS/MS分析。SCX分离馏分的概况见附加文件gydF4y2Ba8gydF4y2Ba。使用ProteinPilot软件进行光谱、肽和蛋白鉴定。不同错误发现率(FDR)阈值的鉴定蛋白、肽和光谱结果在附加文件中给出gydF4y2Ba9gydF4y2BaA.总共鉴定出2689个蛋白质、19381个多肽和81481个光谱,在本地FDR中有95%的置信度。共鉴定出2872个蛋白、20343个多肽和91147个光谱,FDR率为99%。99.9%的置信度发生在局部FDR上,88.8%的置信度发生在全球FDR上,阈值在蛋白质水平上为1%(附加文件)gydF4y2Ba9gydF4y2BaB)。共鉴定了2,342个含有2个或更多多肽的蛋白(附加文件)gydF4y2Ba2gydF4y2Ba,gydF4y2Ba3.gydF4y2Ba和gydF4y2Ba10gydF4y2Ba).统计分析各组差异表达蛋白的数量(gydF4y2BapgydF4y2Ba< 0.05),如图所示。gydF4y2Ba1 bgydF4y2Ba。Western blotting验证蛋白质组学结果(附加文件)gydF4y2Ba11gydF4y2Ba).gydF4y2Ba
光照对叶绿体基因组转录和翻译的影响gydF4y2Ba
在88个叶绿体蛋白编码基因(TAIR 10.0)中,我们的RNA-seq数据中检测到87个CDS(附加文件)gydF4y2Ba2gydF4y2Ba).由于拟南芥染色体基因组包含两个反向重复序列(ATCG00830-ATCG00900和ATCG1240-ATCG1310),因此对这些区域的reads进行了两次计数。相比之下,ProteinPilot只将未使用的肽分配给蛋白质,每个肽只分配给一个蛋白质。对于重复序列,我们必须手动将一个重复序列获得的蛋白质组学数据复制到另一个重复序列。光照(1.5 fold change (FC) cut off)对大多数基因的转录水平没有显著影响;gydF4y2BapgydF4y2Ba< 0.05)。尽管如此,在各自的蛋白质谱中可以观察到显著的变化。在等重标记相对定量和绝对定量(iTRAQ)实验中检测到的60个叶绿体蛋白中,只有1个蛋白(rps 11)和3个蛋白(atpE、petA、rpoA)的丰度在T1: T0时分别上调或下调,而8个和7个蛋白的丰度在T8: T0时分别上调和下调。8个上调蛋白均为核糖体蛋白(rps7.1、rps7.2、rps11、rps18、rpl20、rpl23.1、rpl23.2、rpl32)。相比之下,7个下调蛋白中有5个(psaA, psaB, psbA, psbC, psbD, atpI, ycf4)在T8是光系统I (psaA/psaB)和光系统II (psbA, psbC, psbD)的核心蛋白。转录组和蛋白质组之间没有相关性。gydF4y2Ba
光照对线粒体基因组转录和翻译的影响gydF4y2Ba
在拟南芥数据库(TAIR 10)的122个线粒体CDS中,在rna测序和iTRAQ数据中分别检测到121个线粒体CDS转录本和11个蛋白。与质体转录本相比,许多线粒体转录本的丰度在光照下表现出显著的增加或减少,其中几乎所有的转录本都编码了未表征功能的蛋白质。相比之下,很少有蛋白质的丰度受到光照的影响(附加文件)gydF4y2Ba3.gydF4y2Ba).gydF4y2Ba
在核2号染色体(AT2G07671.1 ~ AT2G07777.1)的一个synsynblock中也发现了38个线粒体编码基因的对应同源物,并有一些轻微的倒置。引人注目的是,室间共线状块间的同源基因对极其相似,其中大多数完全相同,100%氨基酸同源。对于这些同源基因,在解释基因表达(RPKM)和蛋白质丰度水平时必须谨慎。gydF4y2Ba
光照对光系统转录和翻译的影响gydF4y2Ba
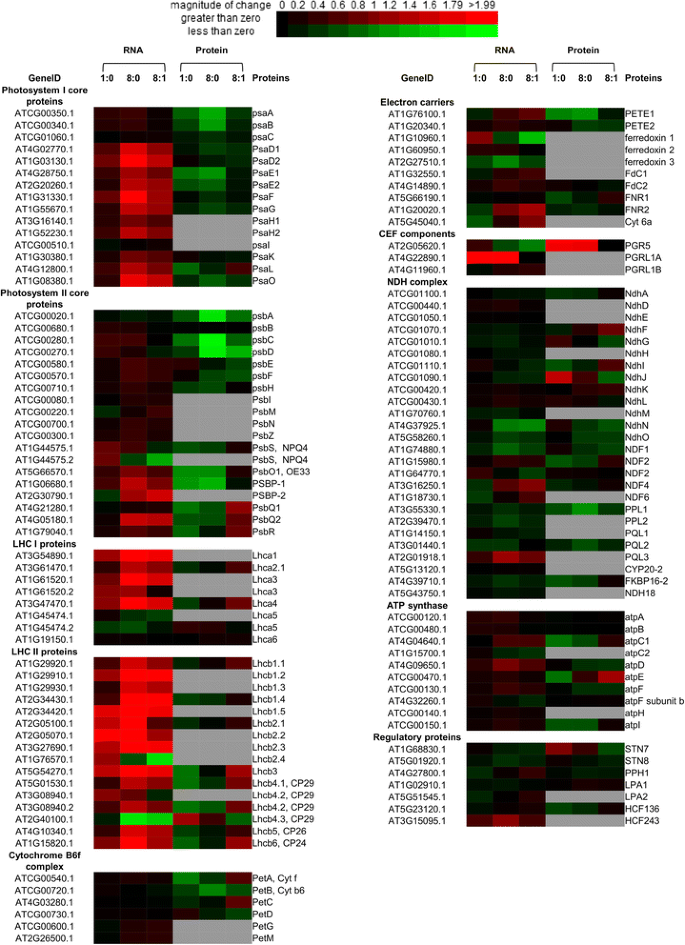
与黑暗条件下的转录水平相比,光照条件下大多数参与光合作用的基因转录水平显著上调(附加文件)gydF4y2Ba12gydF4y2Ba).叶绿体基因组编码的光系统I和II组分的mRNA转录量没有显著变化,而核基因组编码的PSI和PSII组分的转录量显著上调。对于大型强子对撞机(gydF4y2BaLhca1-4gydF4y2Ba)及LHCII (gydF4y2BaLhcb1-6gydF4y2Ba)基因,由核基因组编码。相比之下,NDH复合物和Cyt b6f复合物以及gydF4y2BaLhca5gydF4y2Ba和gydF4y2BaLhca6gydF4y2Ba没有显著改变。一些可溶性电子载体的转录,包括gydF4y2BaPETE1gydF4y2Ba,gydF4y2BaFd1gydF4y2Ba,gydF4y2Bacyt c6agydF4y2Ba和gydF4y2BaFNR2gydF4y2Ba也发生了很大的变化。对于一些基因,转录本丰度的增加发生在1小时内(T1),但对于大多数基因,需要更长的时间(T8)gydF4y2Ba12gydF4y2Ba).在蛋白丰度方面,虽然RuBisCo大亚基(ATCG00490.1)和ATP合成酶亚基(ATCG00480.1)的水平保持不变(比值= 1.00),但部分电子传递蛋白(PsaE1、PsaE2、PetA、PETE1、FNR1)、进化氧复合物(OEC)组分(PsbO1、PsbP1)和ATP合成酶亚基C1、E的丰度在T1: T0时下调。此外,在长时间光照(T8)后,光系统I (PsaA, PsaB, PsaE1, PsaE2),光系统II (PsbA, PsbC, PsbD), OEC (PsbO1, PsbP1)的某些组分的蛋白质丰度下调(图8)。gydF4y2Ba2gydF4y2Ba).gydF4y2Ba
不同时间点叶绿体光系统转录和翻译的热图。每个值由log2比率计算,颜色按行缩放,红色为上调,绿色为下调。缺失数据用灰框表示。生成热图gydF4y2Bahttp://bbc.botany.utoronto.ca/ntools/cgi-bin/ntools_heatmapper_plus.cgigydF4y2Ba。比较每两个时间点(T1:T0、T8:T1、T8:T0)的比值gydF4y2Ba
综上所述,虽然许多转录本在光照下显著上调,但大多数情况下蛋白质丰度并未增加,这表明其他因素,如翻译控制和蛋白质周转也可能影响蛋白质丰度。gydF4y2Ba
光照对氧化还原蛋白和中心碳代谢酶转录和翻译的影响gydF4y2Ba
C照射后gydF4y2Ba3.gydF4y2Ba在植物中,ATP和NADPH是由光系统产生的。利用ATP和NADPH, COgydF4y2Ba2gydF4y2Ba是通过卡尔文-本森-巴萨姆(CBB)循环被固定在三碳化合物上的。这些CgydF4y2Ba3.gydF4y2Ba这些化合物用于在质体中合成淀粉或通过糖酵解、TCA循环和线粒体呼吸作用输出到细胞质中合成蔗糖或生成ATP。上述途径的转录物和蛋白质丰度在光照下的变化显示在附加文件中gydF4y2Ba13gydF4y2Ba,gydF4y2Ba14gydF4y2Ba,gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba,gydF4y2Ba17gydF4y2Ba和gydF4y2Ba18gydF4y2Ba。来自LEF的多余电子可以传递给依赖fd的酶进行氮和硫的同化,或者传递给硫氧还蛋白(通过FTR)和NADPH(通过FNR)。发现CBB周期的一些蛋白在T1和T8时显著减少(附加文件)gydF4y2Ba13gydF4y2Ba).代谢物分析证实,蔗糖的量在T1时显著增加,而在T8时没有增加(表2)gydF4y2Ba4gydF4y2Ba).蔗糖合成的限速酶SPS蛋白(AT5G20280.1)的数量在T1和T8时增加,但mRNA转录没有实质性变化(另附文件)gydF4y2Ba14gydF4y2Ba).用于糖酵解中的酶(附加文件gydF4y2Ba15gydF4y2Ba)和TCA循环(附加文件gydF4y2Ba16gydF4y2Ba),大多数酶的蛋白质丰度无显著变化。对于呼吸链中的酶,它们的mRNA转录基本上不受光照的影响。光照下氧化还原蛋白转录物和蛋白丰度的变化见附加文件gydF4y2Ba17gydF4y2Ba。在蛋白丰度方面,只有复合物III的少数组分(AT4G32470.1、AT5G05370.1和AT5G40810.1)在T1下显著增加,而复合物I的一个组分(AT2G27730.1)和复合物II的一个组分(AT5G40650.1)在T1下显著降低(附加文件)gydF4y2Ba18gydF4y2Ba).gydF4y2Ba
代谢组学和途径活性分析gydF4y2Ba
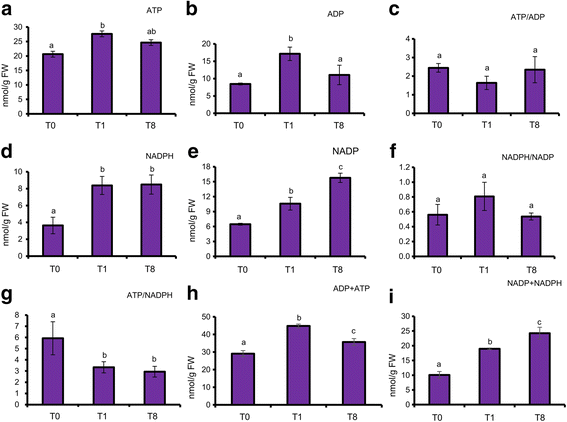
ATP, ADP, NADP的水平gydF4y2Ba+gydF4y2Ba测定20 d龄拟南芥不同光照时间收获植株叶片的NADPH。与T0时相比,T1时叶片ATP含量显著升高,但光照8 h后含量略有下降(图2)。gydF4y2Ba3.gydF4y2Ba).暗转光期间ADP水平也有相同的变化趋势。由于ATP和ADP水平变化幅度相似,ATP/ADP比值在三个时间点均不变。对于NADPH,光照(T1和T8)期间的水平是夜间(T0)结束时的两倍以上。由于光照条件下线性电子流(LEF)产生了大量的NADPH,因此在光照条件下代谢产物的水平较高是合理的。光照条件下NADPH增加2倍以上,而ATP仅略有增加,因此光照条件下ATP/NADPH比值明显下降。相反,NADPH/NADPgydF4y2Ba+gydF4y2Ba三个时间点之间的比率无关紧要。gydF4y2Ba
测定WT在T0、T1和T8时20 d龄拟南芥叶片的代谢物。gydF4y2Ba一个gydF4y2BaATP,gydF4y2BabgydF4y2BaADP,gydF4y2BacgydF4y2BaATP / ADP,gydF4y2BadgydF4y2BaNADPH,gydF4y2BaegydF4y2Ba辅酶iigydF4y2Ba+gydF4y2Ba,gydF4y2BafgydF4y2BaNADPH /辅酶iigydF4y2Ba+gydF4y2Ba,gydF4y2BaggydF4y2BaATP / NADPH,gydF4y2BahgydF4y2BaADP + ATP和gydF4y2Ba我gydF4y2Ba辅酶iigydF4y2Ba+gydF4y2Ba+NADPH分别呈现。数据以三个生物重复的平均值±SD表示。统计差异(gydF4y2BaPgydF4y2Ba< 0.05),采用单因素方差分析,并采用IBM SPSS 19统计程序进行HSD检验。在每一列中,用不同字母(gydF4y2Ba一个gydF4y2Ba,gydF4y2BabgydF4y2Ba,gydF4y2BacgydF4y2Ba)有显著差异(gydF4y2BaPgydF4y2Ba< 0.05)。数据在至少3个独立实验中是可重复的。FW:新鲜重量gydF4y2Ba
使用GC-MS平台测量的代谢物,包括氨基酸,有机酸,糖和其他如表所示gydF4y2Ba4gydF4y2Ba。葡萄糖、果糖和蔗糖的水平在T1时显著升高,而葡萄糖和果糖的水平在T8时显著降低。TCA代谢物方面,苹果酸和富马酸水平在T8时显著升高,琥珀酸水平显著降低。gydF4y2Ba
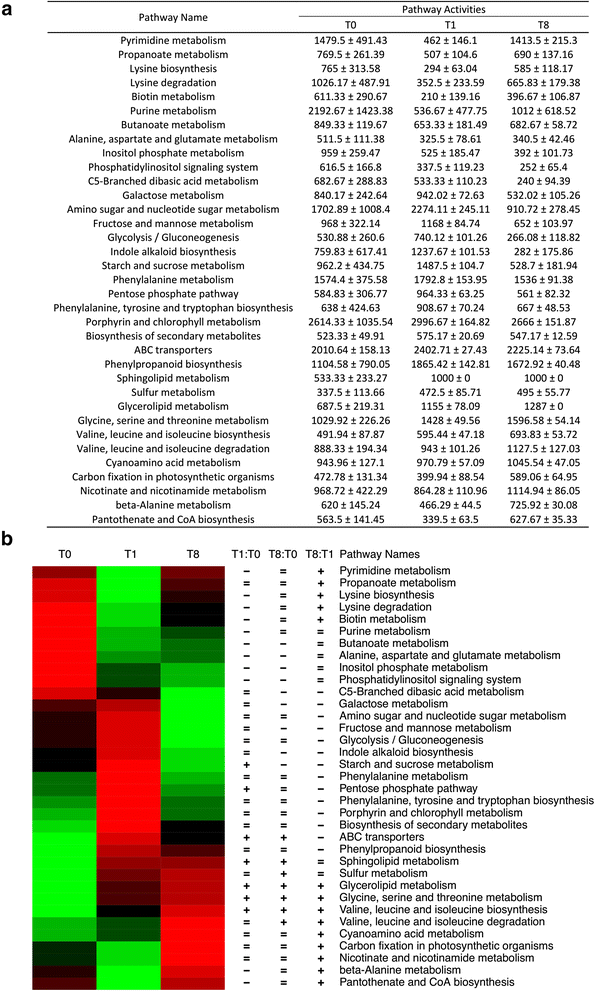
根据代谢组数据计算途径活性(附加文件)gydF4y2Ba19gydF4y2Ba),使用路径活动分析(PAPi)算法。在两两比较中,共发现35条通路的活动水平存在显著差异(gydF4y2BatgydF4y2Ba以及,gydF4y2BaPgydF4y2Ba< 0.05)。gydF4y2Ba4gydF4y2Ba).T1时,淀粉和蔗糖代谢、戊糖磷酸盐途径、缬氨酸、亮氨酸和异亮氨酸合成、甘氨酸、丝氨酸和苏氨酸代谢活性显著高于T0 (T1 > T0),而嘌呤、嘧啶、丙氨酸、天冬氨酸、谷氨酸和赖氨酸代谢活性显著低于T0 (T1 < T0)。值得注意的是,长时间光照后,淀粉和蔗糖代谢、戊糖磷酸盐代谢、糖酵解/糖异生、半乳糖、果糖、甘露糖代谢、氨基糖和核苷酸糖代谢等主要碳代谢途径活性显著降低(T1 > T8)。有趣的是,在所有三个比较(T1:T0, T8:T0和T8:T1)中,甘油脂代谢途径活性随时间显著增加。甘氨酸、丝氨酸和苏氨酸的代谢以及缬氨酸、亮氨酸和异亮氨酸的生物合成也出现了类似的趋势。gydF4y2Ba4gydF4y2Ba).gydF4y2Ba
基于代谢组学数据分析计算途径活性。gydF4y2Ba一个gydF4y2Ba表中显示了两两比较中发现的显著差异活动水平的通路(t检验,gydF4y2BapgydF4y2Ba< 0.05),三个时间点(T0, T1, T8)之间的差异。gydF4y2BabgydF4y2Ba不同途径活性的热图。红色表示通道活性较高,绿色表示活性较低。路径名称用三列符号标记,说明了三种基于路径的两两比较的显著水平。从左到右,三个符号分别代表T1:T0、T8:T0和T8:T1比较。“+”表示明显更活跃(T1 > T0、T8 > T0或T8 > T1),“-”表示明显更不活跃(T1 < T0、T8 < T0或T8 < T1),“=”表示比较无统计学意义。显著性截止值设为gydF4y2BapgydF4y2Ba-value < 0.05gydF4y2Ba
整合转录组和蛋白质组分析与代谢组为基础的途径活性数据gydF4y2Ba
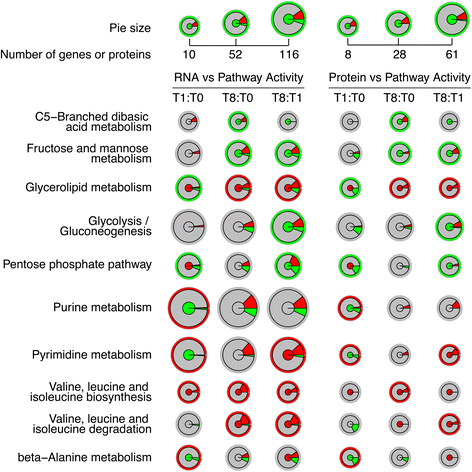
差异表达基因在KEGG数据库中被定位到>100条通路gydF4y2Ba拟南芥gydF4y2Ba。我们计算了三个时间点中任意两个的三个两两比较中所有通路中所有上调或下调基因的数量(附加文件)gydF4y2Ba20.gydF4y2Ba).显着性的平均比率(显着基因数除以通路中基因总数)为~ 16%。光合作用-天线蛋白、黄酮和黄酮醇生物合成和油菜素内酯生物合成是影响其表达水平的基因数量最多的代谢途径(分别为70%、67%和38%)。我们假设,当上调基因多于下调基因时,该途径的活性通常会更高,从理论上讲,这一信息应该在某种程度上与基于代谢组的途径活性相关。如图所示。gydF4y2Ba5gydF4y2Ba在美国,有几种途径可以观察到这种相关性。在缬氨酸、亮氨酸和异亮氨酸的生物合成中,代谢组通路活性在所有两两比较中均显著增加。所有发现有显著差异表达的基因均上调(图2)。gydF4y2Ba5gydF4y2Ba).在β -丙氨酸(T1:T0)和嘧啶代谢(T1:T0)中观察到类似的趋势。也有一些情况下,即使从两两比较中检索到上调和下调的基因,也可以观察到代谢组和RNA数据之间的相关性。对于缬氨酸、亮氨酸和异亮氨酸降解途径(T8:T1和T8:T0)、嘧啶代谢途径(T8:T1)和甘油脂代谢途径(T8:T0和T8:T1),途径中较高比例的上调或下调基因分别导致基于代谢组的途径活性增加或降低(图8:T1)。gydF4y2Ba5gydF4y2Ba).同样有趣的是,对于上述所有途径,都观察到了生物学的中心规律:丰度增加或减少的蛋白质比例分别与上调或下调基因的比例相关,当然也进一步与基于代谢组的途径活性相关(图2)。gydF4y2Ba5gydF4y2Ba).gydF4y2Ba
观察到基于代谢组的途径活性与RNA或蛋白质水平之间相关性的类似趋势的情况。分别基于时间点T0、T1、T8进行RNA和蛋白质水平的三组两两比较。半径表示目标通路的体积(基因或蛋白质的总数)。内圈表示基于代谢组的途径活性;灰色:通路活性无显著差异;红色:明显更活跃;绿色:活动量明显减少。中间环表示转录组或蛋白质组比较中上调或下调基因或蛋白质的比例;灰色:无显著差异表达的基因或蛋白质;红色:表达上调的基因或蛋白; green: down-regulated genes or proteins. The outer thin ring stands for the relationship between metabolome-based pathway activity and predicted RNA or protein level pathway activity; red: positive correlation, green: negative correlation
相反,也有一些途径显示代谢组活性与上调和下调基因/蛋白的比例呈负相关(图2)。gydF4y2Ba5gydF4y2Ba);c5支链二元酸代谢(T8:T0)、果糖和甘露糖代谢(T8:T0和T8:T1)、甘油脂代谢(T1:T0)、糖酵解/糖异生(T8:T1)和戊糖磷酸途径(T1:T0和T8:T1)是这样的途径,其中基因表达的变化在蛋白质丰度中被描述,但在这些途径的代谢活动中被逆转。其他值得注意的途径是丙氨酸、天冬氨酸和谷氨酸代谢和赖氨酸降解,其中大多数显著改变的基因的方向(向上或向下调节)与基于代谢组的途径活性之间的相关性的假设并不成立gydF4y2Ba20.gydF4y2Ba).在谷氨酸、天冬氨酸和谷氨酸代谢及赖氨酸降解T1:T0比较中发现的显著差异表达基因均上调;然而,基于代谢组的途径活性降低。然而,在这两种途径中,蛋白质丰度与基于代谢组的途径活性之间存在相关性;与T0相比,在T1中发现的两种途径中差异表达的蛋白质水平较低。碳固定途径的T8:T1比较是另一个例子,代谢组活性(增加)与蛋白质组(蛋白质数量增加,丰度增加)呈正相关,但与转录组数据无关(附加文件)gydF4y2Ba20.gydF4y2Ba).gydF4y2Ba
讨论gydF4y2Ba
叶绿体和线粒体协同产生各种生化反应所需的能量[gydF4y2Ba15gydF4y2Ba]。叶绿体产生还原力,ATP和磷酸三糖,线粒体消耗叶绿体产生的还原力和碳水化合物来产生ATP [gydF4y2Ba15gydF4y2Ba,gydF4y2Ba16gydF4y2Ba]。线粒体呼吸链在维持植物细胞氧化还原平衡中也起着重要作用[gydF4y2Ba17gydF4y2Ba]。而通常反映叶绿体和线粒体联合活动的光合氧气进化则在一分钟内对光照作出反应[gydF4y2Ba18gydF4y2Ba],光照引起的转录和翻译反应通常需要较长的时间。叶绿体(光系统)和线粒体(呼吸复合体)中产生能量的电子传递链都由核基因组和细胞器基因组编码[gydF4y2Ba19gydF4y2Ba]。因此,叶绿体和线粒体基因组的转录活性对于研究植物在黑暗到光照转换过程中的能量代谢变化也是至关重要的。RNA-seq通过对不含核糖体RNA的总RNA进行测序,使我们能够获得叶绿体和线粒体基因组编码的转录本信息。因此,我们的方法描绘了编码光系统的RNA转录物丰度变化的更完整的画面。gydF4y2Ba2gydF4y2Ba)和呼吸复合物(附加文件gydF4y2Ba18gydF4y2Ba).本研究还鉴定了2,342种由核和细胞器基因组编码的蛋白质(不少于2种肽),并检测了它们在光照下的丰度变化。gydF4y2Ba
光合作用是植物能量的最终来源。在本研究中,我们跟踪了拟南芥叶片在光照后代谢产物、mRNA水平和蛋白质丰度的变化。对比T8和T0, RNA-seq数据(图2)gydF4y2Ba2gydF4y2Ba)揭示了所有基因的转录gydF4y2BaLHCIgydF4y2Ba(gydF4y2BaA1-4gydF4y2Ba),gydF4y2BaLHCIIgydF4y2Ba(gydF4y2BaB1-6gydF4y2Ba)、OEC综合大楼(gydF4y2BapsbOgydF4y2Ba,gydF4y2BaPgydF4y2Ba,gydF4y2Ba问gydF4y2Ba),表达上调(FC >±1.5,FDR < 0.001)。核基因组编码的PSI和PSII成分也是如此。当T1与T0比较时,只有部分基因的转录gydF4y2BaLHCIgydF4y2Ba(gydF4y2BaA1 - 4gydF4y2Ba),gydF4y2BaLHCIIgydF4y2Ba(gydF4y2BaB1gydF4y2Ba,gydF4y2BaB2gydF4y2Ba,gydF4y2BaB3gydF4y2Ba和gydF4y2BaB6gydF4y2Ba),gydF4y2BapsaD1 / D2, psaFgydF4y2Ba上调(FC > 1.5, FDR < 0.001)。相比之下,编码细胞色素b6f和ATP合成酶的基因(除gydF4y2BaatpDgydF4y2Ba在T8和T0时上调),没有显著变化。上述rna测序数据表明,光系统中编码不同功能复合物的基因转录受到差异调控,但同一复合物的成员之间相互协同调控。虽然上述基因的转录在T1和T8时显著上调,但它们的蛋白丰度没有显著改变。相比之下,PsaE1/E2、PsbO、PsbP、Cyt f、PETE1和FNR1蛋白丰度在T1时下调,而PSI、PsbA、PsbC、PSII的PsbD、OEC和PETE1的PsbO和PsbP的PsaA/B和PsaE1/E2蛋白丰度在T8时下调。细胞色素f和LHCII在PSI上的对接位点PsaL两种蛋白在T1时丰度降低,在T8时丰度升高。应注意的是,公共服务计划及公共服务计划[gydF4y2Ba20.gydF4y2Ba],以及邮储银行和邮储银行[gydF4y2Ba21gydF4y2Ba]被转录成双顺反转录体。虽然它们的RNA水平在三个时间点上是稳定的,但它们在蛋白质丰度上的共同下调意味着双双转录本的翻译效率可能会在长时间的光照下受到损害。gydF4y2Ba
对暗生黄化水稻幼苗的蛋白质组学研究表明,光照2 ~ 3 h后,主要光系统蛋白的蛋白质丰度显著增加[gydF4y2Ba22gydF4y2Ba]。这在生理上与质体的绿化过程有关。相比之下,我们的蛋白质组学数据显示,成熟拟南芥叶片中一些光系统蛋白的蛋白质丰度在光照8小时后下降。为什么PSI (PsaA/B)、PSII (PsbA/C/D)和OEC (PsbO/P)的核心蛋白丰度在T8时降低?其目的可能是减少光能的收获和长时间照明后电子的过量产生,这可能会对光系统造成损害。拟南芥叶绿体含有至少6种Deg蛋白酶[gydF4y2Ba23gydF4y2Ba],其中Deg1降解光系统核心蛋白D1/D2 (PsbA/D) [gydF4y2Ba24gydF4y2Ba]。这些数据表明,光系统成分的蛋白质丰度可能受到复杂和通用的调节。gydF4y2Ba
PSI和PSII蛋白组分由核基因组和质体基因组编码。我们的rna测序数据显示,虽然核基因的转录在T8时上调,但质体基因组编码的基因的转录没有明显变化(附加文件)gydF4y2Ba12gydF4y2Ba).叶绿体基因组的转录由PEP (Plastid- encoded Plastid RNA polymerase)和NEP (Nuclear-Encoded Plastid RNA polymerase)完成。PEP参与trna和一些光合作用基因(gydF4y2BapsaAgydF4y2Ba,gydF4y2BapsbA-D, psbEFLJgydF4y2Ba)在六个核编码Sigma因子的控制下[gydF4y2Ba25gydF4y2Ba,gydF4y2Ba26gydF4y2Ba]。NEP参与了许多管家基因的转录。gydF4y2BaaccD, atpB, rpoBgydF4y2Ba),由不同的新经济政策启动子控制[gydF4y2Ba25gydF4y2Ba]。然而,一些叶绿体基因的转录(gydF4y2BaatpA, clpP, rpl33, rrn5, rrn16gydF4y2Ba和gydF4y2Barrn23gydF4y2Ba)是由PEP和NEP共同控制的[gydF4y2Ba26gydF4y2Ba]。叶绿体基因组转录数据(附加文件)gydF4y2Ba2gydF4y2Ba),光照1 h后转录本丰度变化不大。只有tRNA (gydF4y2BaTRNS.2gydF4y2Ba)增加了1.6倍。光照8 h后,转录本丰度gydF4y2BaTRNS.2gydF4y2Ba,两个PSB基因(gydF4y2BapsbLgydF4y2Ba和gydF4y2BapsbJgydF4y2Ba)和一些核糖体蛋白(gydF4y2BaRps12a, rps12b, rps12c, rpl20gydF4y2Ba)显著增加gydF4y2Barrn16gydF4y2Ba和gydF4y2Barrn23gydF4y2Ba显著降低。这两个词的转录gydF4y2Ba公安局gydF4y2Ba基因和gydF4y2BaTRNS.2gydF4y2Ba分别由SIG1和SIG2控制,核糖体RNA (gydF4y2BarrngydF4y2Ba)操纵子由PEP和NEP [gydF4y2Ba27gydF4y2Ba]。因此,光照通过PEP和NEP两种途径影响叶绿体基因的转录,且调控过程复杂。线粒体转录是由T3/7噬菌体的核编码RNA聚合酶(RpoT)进行的,在Eudicots中有2个靶向线粒体的RpoT (RpoTm和RpoTmp) [gydF4y2Ba28gydF4y2Ba]。RpoTm被认为是大多数线粒体基因转录的基本RpoT, RpoTmp在转录中起着特定的作用gydF4y2Bacox1, ccmC, matR, nad1, nad2gydF4y2Ba,gydF4y2Banad6gydF4y2Ba和gydF4y2Barps4gydF4y2Ba[gydF4y2Ba29gydF4y2Ba]。光照后,17个和13个线粒体转录本的丰度分别在T = 1和T = 8时增强(FC > = 1.5)。他们中的大多数(gydF4y2Ba羊痘疮gydF4y2Ba)编码未表征的蛋白质,除了gydF4y2BamatRgydF4y2Ba(T = 1)gydF4y2Barpl5gydF4y2Ba,gydF4y2Barpl16gydF4y2Ba和gydF4y2Baccb206gydF4y2Ba(T = 8)转录本。因此,光照也通过RpoT和RpoTmp影响这些线粒体基因的转录,且调控较为复杂。gydF4y2Ba
虽然大多数叶绿体基因的转录在光照下是稳定的,但叶绿体基因组编码的8和7蛋白的蛋白质丰度显著上调或下调(FC >±1.5)。gydF4y2BapgydF4y2Ba< 0.05)(附加文件gydF4y2Ba12gydF4y2Ba).这意味着这些蛋白质的丰度可以通过差异翻译调节或蛋白质降解来调节[gydF4y2Ba23gydF4y2Ba,gydF4y2Ba24gydF4y2Ba]。这也被报道为由线粒体体翻译的蛋白质[gydF4y2Ba30.gydF4y2Ba]。gydF4y2Ba
光合作用是植物减少能量和能量的最终来源。在光合作用过程中,电子从水分子中被提取出来,并通过LEF传递给铁氧还蛋白(Fd)。还原后的Fd可以通过铁氧还蛋白NADP将电子传递给NADPHgydF4y2Ba+gydF4y2Ba-还原酶(FNR)或硫氧还蛋白(通过铁氧还蛋白硫氧还蛋白还原酶,FTR),并分别通过铁氧还蛋白-亚硝酸盐还原酶和亚硫酸盐还原酶还原亚硝酸盐和亚硝酸盐。所有这些降低能耗的过程都是由光驱动的。这就解释了为什么在光照下,NADPH水平在T1和T8时都显著升高(图2)。gydF4y2Ba3.gydF4y2Ba).虽然光合作用也产生ATP,但在T1时ATP水平仅略有增加,而在T8时则不显著(图8)。gydF4y2Ba3.gydF4y2Ba).固定一个CO需要三个ATP分子和两个NADPH分子gydF4y2Ba2gydF4y2Ba在CBB循环中的分子。LEF产生ATP和NADPH的比例为1.29,ATP的不足必须通过其他机制如循环电子流来弥补[gydF4y2Ba31gydF4y2Ba]或源自线粒体[gydF4y2Ba17gydF4y2Ba]。或者,由LEF产生的多余还原力必须输出到细胞质并由线粒体消耗以产生ATP。光照后叶片中NADPH含量的增加更为显著,但ATP含量的增加程度要小得多(图2)。gydF4y2Ba3.gydF4y2Ba)反映了光合作用过程中合成代谢过程(如淀粉、蔗糖、细胞壁合成)对ATP的需求非常高,而光系统产生的还原能力绰绰绰用。光合作用产生的多余还原力可以通过苹果酸阀从叶绿体输出,并最终在线粒体转化为NADH用于ATP的生产[gydF4y2Ba16gydF4y2Ba]。在长时间光照下,苹果酸盐含量增加了2倍gydF4y2Ba4gydF4y2Ba),这可能反映了它作为线粒体呼吸链的底物产生ATP的作用[gydF4y2Ba32gydF4y2Ba]。通量平衡分析预测,当光照强度在180 ~ 280 μmol m之间时,线粒体和叶绿体ATP合酶分别贡献18%和82%的ATP合成gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba在C3植物中[gydF4y2Ba33gydF4y2Ba]。叶绿体ATP合酶产生的ATP是否足以固定碳是一个有趣的问题。寡霉素处理的大麦原生质体显著降低了线粒体和胞浆中的ATP水平,但没有降低叶绿体中的ATP水平,这表明线粒体在向胞浆供应ATP方面的重要性[gydF4y2Ba16gydF4y2Ba]。gydF4y2Ba
通过光合作用固定的碳以磷酸二羟基丙酮(DHAP)的形式输出到细胞质中。DHAP有两个主要作用,合成代谢(蔗糖或细胞壁合成)或通过糖酵解生成ATPgydF4y2Ba15gydF4y2Ba), TCA循环(附加文件gydF4y2Ba16gydF4y2Ba)和线粒体呼吸(附加文件gydF4y2Ba18gydF4y2Ba).TCA循环在黑暗中以循环模式运行,产生NADH/FADHgydF4y2Ba2gydF4y2Ba和ATP)时,TCA是ATP的主要来源,并且在光照下处于非循环模式(产生用于氨基酸合成的骨架)[gydF4y2Ba32gydF4y2Ba,gydF4y2Ba34gydF4y2Ba]。短期(5 - 60分钟)gydF4y2Ba13gydF4y2Ba有限公司gydF4y2Ba2gydF4y2Ba对拟南芥玫瑰叶的标记表明,固定碳被迅速纳入CBB中间体和ADP-Glu(用于淀粉合成),其次是蔗糖合成和光呼吸的代谢物,但非常缓慢甚至可以忽略TCA中间体[gydF4y2Ba35gydF4y2Ba]。虽然环三羧酸在光照下减少,但有趣的是,糖酵解过程中没有多少酶(附加文件)gydF4y2Ba15gydF4y2Ba)和TCA循环(附加文件gydF4y2Ba16gydF4y2Ba)改变了蛋白质的丰度,因为许多这些酶是由ATP/ADP比率变构调节的[gydF4y2Ba36gydF4y2Ba]。gydF4y2Ba
传统上认为,蛋白质的表达水平是由转录物的表达水平决定的。然而,我们的数据表明,这并不总是正确的(附加文件gydF4y2Ba21gydF4y2Ba).这种差异可能是由于以下原因:一部分转录mrna不被翻译或以较低的速率翻译[gydF4y2Ba37gydF4y2Ba]。植物细胞中有两种mrna:游离mrna和多体相关mrna。光可以促进一些mRNA与核糖体的结合并驱动它们的翻译。在这种情况下,蛋白质丰度可以在没有转录的情况下增加[gydF4y2Ba38gydF4y2Ba]。我们的RNA-seq数据仅测量了稳态mRNA的表达水平,即自由mRNA和多体相关mRNA的总和。因此,稳态mrna和蛋白质丰度之间会存在差异;(2)一些转录mRNA的半衰期可能很短[gydF4y2Ba39gydF4y2Ba]例如那些易被srna介导的过程降解的[gydF4y2Ba40gydF4y2Ba]。RNA-seq也可以对部分降解的mRNA进行测序,这是不可翻译的。拟南芥mRNA的半衰期从几分钟到>24小时不等,半衰期较短的mRNA每个mRNA分子翻译的蛋白质分子较少。我们的iTRAQ数据比较了蛋白质的相对丰度,这些蛋白质可能已经积累了几个小时;(3)蛋白质丰度是由翻译和降解共同决定的。尽管mRNA水平不变,但蛋白质丰度可能会下降。以上原因可以解释我们在研究中观察到的mRNA丰度与蛋白丰度之间的差异导致负相关。最有趣的例子之一是光系统组分的mRNA和蛋白质丰度之间的负相关(图2)。gydF4y2Ba2gydF4y2Ba).这种相关性的缺失不仅存在于核基因中,也存在于叶绿体基因组编码的基因中。gydF4y2Ba
总之,本研究提供了光对植物细胞所有三个基因组编码的基因转录和翻译影响的综合数据集。本报告详细分析了中心代谢的转录组和蛋白质组的变化。这些数据集对于对次级代谢感兴趣的研究人员也很有用。gydF4y2Ba
结论gydF4y2Ba
由于蛋白质是进行生物化学转化和生物过程的媒介,一般来说,mRNA转录与蛋白质水平之间缺乏正相关关系,因此之前的报道中对植物生理学的理解,仅使用微阵列或mRNA表达数据进行解释,应该仔细解释。本研究提供了20日龄拟南芥叶片在光照条件下转录组、蛋白质组和代谢物谱变化的叶片组学数据。这些数据将为植物研究人员提供一个数据库,以查找他们感兴趣的基因,并研究他们在光照1和8 h时叶片mRNA和蛋白质丰度的变化。该研究还提供了叶绿体和线粒体在光照下转录组和蛋白质组谱变化的信息。gydF4y2Ba
方法gydF4y2Ba
植物材料和生长条件gydF4y2Ba
拟南芥gydF4y2Ba本研究选用TAIR的Columbia (Col-0)生态型。灭菌后,将种子置于添加2% (w/v)蔗糖的Murashige和Skoog培养基上10 d,然后在光照(22°C) 16 h /黑暗(18°C)的生长室内,光照强度为120 ~ 150 μmol m,移栽到土壤中gydF4y2Ba−2gydF4y2Ba年代gydF4y2Ba−1gydF4y2Ba。采集20日龄拟南芥叶片,提取RNA、蛋白质和代谢物进行液氮冷冻。分别在T0(夜晚结束)、T1(光照开始后1小时)和T8(光照开始后8小时)三个不同的时间点采收叶片。gydF4y2Ba
转录组分析gydF4y2Ba
在所有三个时间点从叶片中提取总RNA,并用DNase I (RNeasy Plant Mini Kit, Qiagen, Hong Kong)去除DNA污染。在构建cDNA文库之前,使用植物叶片核糖零rRNA去除试剂盒(Epicentre,美国)从总RNA中去除核糖体RNA。使用Illumina HiSeq™2000对文库进行测序。去除低质量reads后,将来自三个不同RNA-seq样本(三个不同的时间点,T0, T1和T8)的clean reads与拟南芥基因组对齐。为了区分来自细胞核和细胞器的同源转录本,我们将clean reads分别定位到拟南芥Col-0 (TAIR10.0)核编码CDS基因集、线粒体编码CDS基因集和叶绿体编码CDS基因集。校准工具是SOAPaligner/SOAP2(参数:-m 0 -× 10,000 -s 40 -l 32 -v 5 -r 2 -p 6) [gydF4y2Ba41gydF4y2Ba]。转录物丰度通过每个隔室中每个基因的RPKM (Reads per千碱基转录物每百万Reads)计算来估计[gydF4y2Ba42gydF4y2Ba]。RPKM = 109*C/N*L (C为落在基因上的可映射reads数;N为实验中maptable读取的总次数;L是碱基对中基因的总和)。gydF4y2Ba
基于SOAPsplice软件对备选剪接转录物进行分析[gydF4y2Ba43gydF4y2Ba]。对于未在TAIR10.0数据库中发现的新转录本,组装的转录本必须满足以下三个标准:(i)转录本长度必须大于180bp。(ii)排序深度不小于2。(iii)转录本距离被注释基因至少200bp。然后使用编码电位计算器(CPC)将鉴定出的新转录本区分为蛋白质编码rna和非编码rna。gydF4y2Bahttp://cpc.cbi.pku.edu.cn/gydF4y2Ba).gydF4y2Ba
叶蛋白提取gydF4y2Ba
分别在T0、T1和T8采集20日龄叶片。提取蛋白质,在10% (v/v) TCA/丙酮(- 20°C)中沉淀,用10 ×体积的80% (v/v)甲醇/0.1 M NH洗涤gydF4y2Ba4gydF4y2BaOAc和预冷80% (v/v)丙酮。然后将颗粒在8 ml SDT缓冲液(4% (w/v) SDS, 0.1 M DTT和0.1 M Tris-Cl pH 8.0)中均质2 min。在95℃下加热5-10 min,然后在16000 ×离心2次gydF4y2BaggydF4y2Ba在4°C下放置5分钟。收集上清液,加入4倍体积的80% (v/v)冷冻丙酮,在- 20℃下沉淀蛋白质过夜。在2000 ×gydF4y2BaggydF4y2Ba在4℃下,用5-10倍体积的80% (v/v)丙酮洗涤15 min,然后风干。蛋白颗粒用2 ml尿素缓冲液(6 M尿素,200 mM MOPS)/4 mM CaCl溶解gydF4y2Ba2gydF4y2BapH 8.0)。然后将混合物超声处理20次,每次10秒,6秒休息,直到颗粒完全溶解。在7000 ×gydF4y2BaggydF4y2Ba室温下静置1 min,收集上清液,按Bradford法定量[gydF4y2Ba44gydF4y2Ba]。gydF4y2Ba
还原,烷基化和胰蛋白酶消化和iTRAQ标记gydF4y2Ba
然后将蛋白质提取物进行iTRAQ标记以标记肽[gydF4y2Ba45gydF4y2Ba]。用10 mM二硫苏糖醇(DTT)还原等量蛋白质(100 μg),并用40 mM碘乙酰胺(IAA)在黑暗中烷基化还原的半胱氨酸基团。烷基化后,用4mm氯化钙稀释gydF4y2Ba2gydF4y2Ba以1 μg胰蛋白酶/ 20 μg蛋白质为单位,按1:20的比例加入胰蛋白酶消化蛋白质,37℃过夜。胰酶消化后,用C18 SepPak反相墨盒(Waters, WAT023590, and Ireland)对肽进行脱盐。脱盐后的肽用8-plex iTRAQ标记试剂盒(AB Sciex, USA)进行标记。标记时,在T0、T1和T8 3个时间点采集的样品分别用113、114和115标记,第二个生物重复用117、118和119标记。将所有标记的样品(6管)组合在一起,用SCX分离标记的肽[gydF4y2Ba46gydF4y2Ba]。色谱柱为Eclipse XDB C18 (2.1 mm × 150 mm, 5 μm,窄孔)(Agilent Technologies, USA),室温下洗脱液A (10 mm H)gydF4y2Ba3.gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba/ KHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 25% ACN, pH 3.0)和洗脱液B (10 mM H)gydF4y2Ba3.gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba/ KHgydF4y2Ba2gydF4y2Ba阿宝gydF4y2Ba4gydF4y2Ba, 25% ACN, 350 mM KCl, pH 3.0)。15-40分钟收集的馏分被合并成9个馏分用于LC/MS/MS分析(TripleTOF 5600系统,AB SCIEX, USA)。进行了三次技术重复试验。质谱数据采用TripleTOF 5600系统,配备Nanospray III源(AB SCIEX,美国)。实验参数如下:离子喷雾电压(2.2 kV);幕帘气(20psi);雾化器气体(6psi);界面加热器温度(150℃)。对于IDA,在不超过250毫秒的范围内获得完整扫描gydF4y2Bam / zgydF4y2Ba400-1250,然后MS/MS扫描20个最丰富的峰,超过125次每秒,并在+2到+5之间的范围内携带电荷gydF4y2Bam / zgydF4y2Ba100 - 1500 (gydF4y2Ba46gydF4y2Ba]。采用ProteinPilot 4.0软件(Applied Biosystems)中的Paragon算法对MS/MS数据进行分析。美国)。从机器上获得的原始数据通过PeakView软件从。wiff格式文件转换为。mgf。为了鉴定和量化核和细胞器编码基因在不同条件下的蛋白质丰度变化,我们在TAIR网站上检索了ProteinPilot软件绘制的拟南芥核编码蛋白数据库、线粒体编码蛋白数据库和叶绿体编码蛋白数据库(gydF4y2Bahttp://www.arabidopsis.orggydF4y2Ba),分别。下游分析计算每个隔室中每个基因的蛋白表达水平是通过一系列内部perl脚本进行的。在所有的搜索中,胰蛋白酶分别被选择作为蛋白质消化的酶,IAA被选择作为半胱氨酸烷基化剂。同时进行了偏置校正和背景校正。对于蛋白质鉴定,需要至少两个肽的最低未使用ProtScore为1.3(置信度≥95%)。FDR分析使用基于反向序列诱饵数据库的ProteinPilot的PSPEP附加功能进行。4个重复比均采用1个样本进行统计分析gydF4y2BatgydF4y2Ba-test(单尾检验)。计算公式如下:gydF4y2Ba\ (t = {\ scriptscriptstyle \压裂{x -{\μ}_0}{\ raisebox{1例}{$ s $} \ !\左/ \ ! \ raisebox{1例}{$ \ sqrt {n} $} \。}} \)gydF4y2Ba,其中x为四个重复的平均比值,μgydF4y2Ba0gydF4y2Ba为假设值(分别为1.2、1.33和1.5),s为4个重复的标准差,n为重复的个数。允许的自由度为3,p < 0.05认为有统计学意义。gydF4y2Ba
定量rt - pcrgydF4y2Ba
利用20日龄拟南芥叶片转录的cDNA样本进行qRT-PCR分析。Primer premier 5.0 (gydF4y2Bahttp://www.premierbiosoft.com/primerdesign/gydF4y2Ba)设计qRT-PCR引物。PCR反应在含有2 × SYBR Green Master Mix (ABI体系)的10 μL体积中进行。扩增参数为95℃,1 min;95°C, 15 s和60°C 1 min 40个循环。Actin 2作为内参。对于每个转录本,每个cDNA样本分三份进行分析,并通过归一化至最大水平计算相对转录本丰度。采用ddCt比较阈值法(ΔΔCt)评估不同靶点的表达比较。gydF4y2BaPgydF4y2Ba-值由双尾配对的学生数据确定gydF4y2BatgydF4y2Ba测试。gydF4y2Ba
Western blotting验证gydF4y2Ba
将用于蛋白质组学的蛋白质样品放在- 80°C保存,用于western blotting。所有三个时间点(T0、T1和T8)的蛋白均被等量装载,并使用增强化学发光法(Amersham Biosciences, UK)通过特异性抗体检测抗原。gydF4y2Ba
ATP / ADP /辅酶iigydF4y2Ba+gydF4y2Ba/NADPH提取及测定gydF4y2Ba
在三个不同的时间点(T0, T1和T8)新鲜采集20天龄拟南芥植株的叶片约100 mg。用三氯乙酸法提取腺苷酸[gydF4y2Ba47gydF4y2Ba]。使用ATP生物发光测定试剂盒(Sigma, FL-AA)测定ATP水平[gydF4y2Ba48gydF4y2Ba]。用丙酮酸激酶将提取液中的ADP转化为ATP,测定ATP + ADP的总和[gydF4y2Ba47gydF4y2Ba]。NADP的提取gydF4y2Ba+gydF4y2Ba/NADHP是基于NADPH在酸性介质中选择性水解,以及NADP的选择性水解gydF4y2Ba+gydF4y2Ba在碱性介质中[gydF4y2Ba49gydF4y2Ba]。pH值调整后,NADP水平gydF4y2Ba+gydF4y2Ba和NADPH在96孔板上根据基于板阅读器的方法测定[gydF4y2Ba50gydF4y2Ba]。每孔0-40 pmol吡啶核苷酸标准曲线新鲜制备。gydF4y2Ba
代谢产物分析gydF4y2Ba
利用气相色谱-质谱分析拟南芥幼苗的代谢物。gydF4y2Ba51gydF4y2Ba]。冷冻叶片样品(50 mg)在700 μL甲醇中均质,加入ribitol (0.2 mg/ml水)作为极性相的内定量标准。在10000 g离心15 min后,加入375 μL氯仿和750 μL HgydF4y2Ba2gydF4y2BaO被加入并混合。在10000 g离心15 min后,取两等份150 μL上相(极性相),速真空干燥。在干燥后的样品中加入40 μl盐酸甲氧基胺(吡啶为20 mg/ml),在37℃下振荡2 h。将样品转移到样品瓶中进行GC-MS分析,加入70 μl MSTFA混合物(1 ml + 20 μl FAME)。37℃振荡30 min后,采用GC-MS (chroof软件,Pegasus driver 1·61;LECO)。使用TagFinder软件对色谱图和质谱进行评估[gydF4y2Ba52gydF4y2Ba]。代谢物鉴定使用Golm代谢组数据库的质谱和保留指数集合进行人工监督[gydF4y2Ba53gydF4y2Ba]。质量片段的峰高根据样品的新鲜重量和内标(利比醇)的添加量归一化。gydF4y2Ba
基于代谢组的途径活性计算gydF4y2Ba
通过Pathway Activity Profiling (PAPi)算法计算60条通路的通路活性[gydF4y2Ba54gydF4y2Ba],基于所有测量的代谢物。PAPi使用的途径数据库基于京都基因与基因组百科全书(KEGG) [gydF4y2Ba55gydF4y2Ba]。路径数据库中未包含的所有路径gydF4y2Ba拟南芥gydF4y2Ba被移除。作为“代谢途径”的全局途径不包括在分析中。计算代谢组数据的每个生物重复的途径活性,并计算每个样本的均值和SD。对三组两两比较(T1:T0, T8:T0和T8:T1)进行t检验,以确定显著差异表达途径(gydF4y2BaPgydF4y2Ba< 0.05)。gydF4y2Ba
数据和材料的可用性gydF4y2Ba
支持本文结论的数据集包含在本文及其附加文件中。所有原始和处理过的RNA-seq数据均保存在NCBI GEO (gydF4y2Bahttp://www.ncbi.nlm.nih.gov/geo/gydF4y2Ba),登记号为GSE57791。gydF4y2Ba
参考文献gydF4y2Ba
- 1.gydF4y2Ba
马磊,李军,曲林,Hager君,陈志,赵华,等。拟南芥发育的光控制需要基因组表达和细胞通路的协调调节。植物细胞。2001; 13(12): 2589 - 607。gydF4y2Ba
- 2.gydF4y2Ba
罗塞尔JB,威尔逊IW,波格森BJ。拟南芥在强光下基因表达的全局变化。植物生理学报,2002;13(3):1109 - 1190。gydF4y2Ba
- 3.gydF4y2Ba
Kim BH, von Arnim AG。cDNA微阵列分析揭示拟南芥的早期暗响应。植物化学学报,2006;36(3):391 - 391。gydF4y2Ba
- 4.gydF4y2Ba
Satou M, Enoki H, Oikawa A, Ohta D, Saito K, Hachiya T,等。核编码叶绿体蛋白中断的拟南芥白化或浅绿色突变体转录组和代谢组的综合分析。植物化学学报,2014;35(4):411 - 418。gydF4y2Ba
- 5.gydF4y2Ba
Covington MF, Maloof JN, Straume M, Kay SA, Harmer SL.全球转录组分析揭示植物生长发育关键途径的昼夜调节。中国生物医学工程学报,2008;9(8):693。gydF4y2Ba
- 6.gydF4y2Ba
李建军,李建军,李建军,等。酵母蛋白和mRNA丰度的相关性研究。中华生物医学杂志,1999;19(3):1720 - 1730。gydF4y2Ba
- 7.gydF4y2Ba
Fernie AR, Stitt M.代谢组学与蛋白质组学和转录组学的不一致性:应对逻辑、化学和网络相互作用日益复杂的科学对应。植物生理学报,2012;38(3):1109 - 1109。gydF4y2Ba
- 8.gydF4y2Ba
Motohashi R, Rodiger A, Agne B, Baerenfaller K, Baginsky S.不同白化病/淡绿色突变体的共同和特异性蛋白质积累模式在蛋白质组水平上的调控组织。植物生理学报,2012,31(4):389 - 391。gydF4y2Ba
- 9.gydF4y2Ba
王晓明,王晓明,王晓明,等。植物代谢产物的基因组学分析。生物工程学报,2000;18(11):1157 - 1161。gydF4y2Ba
- 10.gydF4y2Ba
梁超,张勇,程生,Osorio S,孙勇,Fernie AR,等。叶绿体和线粒体高ATP供给对水稻叶片代谢的影响gydF4y2Ba拟南芥gydF4y2Ba。植物科学,2015;6:922。gydF4y2Ba
- 11.gydF4y2Ba
Marquez Y, Brown JW, Simpson C, Barta A, Kalyna M.转录组调查揭示拟南芥选择性剪接景观的复杂性增加。基因工程学报,2012;22(6):1184-95。gydF4y2Ba
- 12.gydF4y2Ba
Staiger D, Zecca L, Wieczorek Kirk DA, Apel K, Eckstein L.生物钟调节的rna结合蛋白AtGRP7通过影响其自身前mrna的选择性剪接来自动调节其表达。植物学报,2003;33(2):361 - 361。gydF4y2Ba
- 13.gydF4y2Ba
Sanchez SE, Petrillo E, Beckwith EJ, Zhang X, Rugnone ML, Hernando CE,等。甲基转移酶将生物钟与选择性剪接的调节联系起来。大自然。2010;468(7320):112 - 6。gydF4y2Ba
- 14.gydF4y2Ba
Palusa SG, Ali GS, Reddy ASN。拟南芥富含丝氨酸/精氨酸蛋白的前mrna的选择性剪接:激素和应激的调节。植物学报,2007;49(6):1091 - 1097。gydF4y2Ba
- 15.gydF4y2Ba
Kromer S, Heldt HW。利用寡霉素对大麦原生质体和叶片光合作用的影响研究线粒体氧化磷酸化在光合代谢中的作用植物生理学报,2001;35(4):1290 - 1296。gydF4y2Ba
- 16.gydF4y2Ba
Kromer S, Malmberg G, Gardestrom P.线粒体对大麦光合代谢的贡献不同光强和CO2浓度下的叶片原生质体)。植物生理学报,1993;32(3):947 - 955。gydF4y2Ba
- 17.gydF4y2Ba
[3]李建平,李建平。线粒体在光合细胞能量代谢中的作用。生物质化学学报,1995;27(4):415 - 421。gydF4y2Ba
- 18.gydF4y2Ba
Igamberdiev AU,沈涛,Gardestrom P.大麦原生质体弱光向强光过渡过程中线粒体的功能。足底。2006;224(1):196 - 204。gydF4y2Ba
- 19.gydF4y2Ba
罗玉英,张锐,关旭,程生,孙峰,邓肯欧,等。拟南芥导入线粒体过程中pMORF3序列的磷酸化和去磷酸化。植物学报。2015;39(1):1 - 12。gydF4y2Ba
- 20.gydF4y2Ba
王晓明,王晓明,王晓明,等。光合作用对胞囊藻光合反应中心基因的影响。植物生理学报,2005;46(9):1484-93。gydF4y2Ba
- 21.gydF4y2Ba
杨建军,李建军,李建军,等。ppsbd - ppsbc mrna在叶绿体中的翻译作用:5′加工和翻译偶联。核酸学报,2012,40(7):3152-8。gydF4y2Ba
- 22.gydF4y2Ba
李建军,陈建军,李建军,等。水稻(Oryza sativa L.)质体去黄化过程的综合蛋白质组学和代谢分析。蛋白质组学。2011;11(9):1751 - 63。gydF4y2Ba
- 23.gydF4y2Ba
[3]张建军,张建军。植物胞内不同亚细胞区室中Deg蛋白酶及其在蛋白质质量控制和加工中的作用。植物生理学报,2012,31(1):344 - 344。gydF4y2Ba
- 24.gydF4y2Ba
zenkiewicz M, Ferenc A, Wasilewska W, Romanowska E.强光刺激拟南芥LHCII小天线蛋白CP26和CP29和PsbS蛋白的deg1依赖性切割。足底。2012;235(2):279 - 88。gydF4y2Ba
- 25.gydF4y2Ba
杨建军,李建军,李建军,等。植物叶绿体基因表达及其进化研究进展。植物科学,2014;5:61。gydF4y2Ba
- 26.gydF4y2Ba
Baba K, Schmidt J, Espinosa-Ruiz A, Villarejo A, Shiina T, Gardestrom P,等。拟南芥rpoT;2突变体对细胞器基因转录和幼苗早期发育有影响。植物学报,2004;38(1):38 - 48。gydF4y2Ba
- 27.gydF4y2Ba
Allison LA, Simon LD, Maliga P. rpoB缺失揭示了高等植物质体中第二种不同的转录系统。中华医学杂志。1996;15(11):2802-9。gydF4y2Ba
- 28.gydF4y2Ba
李丽丽,李伟和,王晓明,等。植物线粒体和叶绿体转录机制的组成、功能和调控。植物生理学报,2011;32(1):1 - 4。gydF4y2Ba
- 29.gydF4y2Ba
Kuhn K, Richter U, Meyer EH, Delannoy E, de Longevialle AF, O 'Toole N,等。噬菌体型RNA聚合酶RPOTmp在拟南芥线粒体中进行基因特异性转录。植物学报,2009;21(9):2762-79。gydF4y2Ba
- 30.gydF4y2Ba
Kwasniak M, Majewski P, Skibior R, Adamowicz A, Czarna M, Sliwinska E,等。编码线粒体核糖体蛋白的核RPS10基因沉默会改变拟南芥线粒体的翻译。植物学报,2013,25(5):1855-67。gydF4y2Ba
- 31.gydF4y2Ba
引用本文:利文斯顿,克鲁斯加,Kohzuma K,丁格拉A,克莱默DM.一个涉及NADPH脱氢酶复合物的高循环电子流的拟南芥突变体。植物学报,2010;22(1):221-33。gydF4y2Ba
- 32.gydF4y2Ba
Sweetlove LJ, Beard KF, Nunes-Nesi A, Fernie AR, Ratcliffe RG。不只是一个循环:植物TCA循环中的通量模式。植物科学进展,2010;15(8):462-70。gydF4y2Ba
- 33.gydF4y2Ba
张振宇,Poolman MG, Fell DA, Ratcliffe RG, Sweetlove LJ。Diel通量平衡模型捕获C3和天冬草酸代谢叶在昼夜循环中光和暗代谢之间的相互作用。植物生理学报,2014,31(2):917 - 929。gydF4y2Ba
- 34.gydF4y2Ba
Poolman MG, Miguet L, Sweetlove LJ, Fell DA。拟南芥基因组尺度代谢模型及其一些特性。植物生理学报,2009;31(3):1570 - 1581。gydF4y2Ba
- 35.gydF4y2Ba
李建军,李建军,李建军,等。照射下拟南芥莲座的代谢通量。植物学报,2013,25(2):694-714。gydF4y2Ba
- 36.gydF4y2Ba
李建军,李建军,李建军,等。线粒体三羧酸循环调控的研究进展。植物学报,2013;16(3):335-43。gydF4y2Ba
- 37.gydF4y2Ba
Barakat A, Szick-Miranda K, Chang IF, Guyot R, Blanc G, Cooke R,等。拟南芥基因组中细胞质核糖体蛋白基因的组织。植物生理学报,2001;27(2):398 - 498。gydF4y2Ba
- 38.gydF4y2Ba
刘俊杰,吴山,陈海明。广泛的翻译调控参与拟南芥光形态发生的调控。中国生物医学工程学报,2012;8(5):566。gydF4y2Ba
- 39.gydF4y2Ba
王晓明,王晓明,王晓明,等。拟南芥基因表达速率及其影响因素的基因组分析。植物学报。2007;19(11):3418-36。gydF4y2Ba
- 40.gydF4y2Ba
刘军,刘军,张军,等。mirna和sirna对基因翻译和mRNA降解的调控。基因工程学报,2006;20(5):515-24。gydF4y2Ba
- 41.gydF4y2Ba
李锐,余春,李勇,林涛涛,姚思敏,Kristiansen K,等。SOAP2:一个改进的用于短读对齐的超快工具。生物信息学,2009,25(15):1966 - 7。gydF4y2Ba
- 42.gydF4y2Ba
Mortazavi A, Williams BA, McCue K, Schaeffer L, Wold B.基于RNA-Seq的哺乳动物转录组定位与定量。地理学报,2008;5(7):621-8。gydF4y2Ba
- 43.gydF4y2Ba
黄松,张军,李锐,张伟,何铮,林涛,等。SOAPsplice:从RNA-Seq数据从头开始检测剪接连接的全基因组。Front Genet. 2011;2:46。gydF4y2Ba
- 44.gydF4y2Ba
利用蛋白质-染料结合原理的一种快速灵敏的微量蛋白质定量方法。生物化学学报。1976;72:248-54。gydF4y2Ba
- 45.gydF4y2Ba
Ross PL, Huang YN, Marchese JN, Williamson B, Parker K, Hattan S,等。用胺反应性等压标记试剂定量测定酿酒酵母菌的多重蛋白。生物工程学报,2004;3(12):1154 - 1169。gydF4y2Ba
- 46.gydF4y2Ba
李赵Y,香港RP, G, Lam MP,法律CH,李SM, et al。全自动二维亲水性相互作用液相色谱-反相液相色谱与在线串联质谱法用于霰弹枪蛋白质组学。九月科学学报;2012;35(14):1755-63。gydF4y2Ba
- 47.gydF4y2Ba
Meyer EH, Tomaz T, Carroll AJ, Estavillo G, Delannoy E, Tanz SK等。低磷酸化效率的ndufs4重塑呼吸抑制拟南芥萌发和生长,并改变夜间代谢控制。植物生理学报,2009;31(2):693 - 693。gydF4y2Ba
- 48.gydF4y2Ba
Ford SR, Leach FR.生物荧光法测定腺苷酸能量电荷。方法中华医学杂志。1998;02:69 - 81。gydF4y2Ba
- 49.gydF4y2Ba
刘建军,刘建军,刘建军,等。胞质谷胱甘肽还原酶活性升高对正常和胁迫条件下叶片细胞谷胱甘肽库及光合作用的影响植物生理学报,2001;19(3):863 - 872。gydF4y2Ba
- 50.gydF4y2Ba
测定组织提取物中NAD、NADP、谷胱甘肽和抗坏血酸的平板阅读器方法:在拟南芥花环发育过程中的氧化还原分析应用。中国生物医学工程学报,2009;32(1):1 - 6。gydF4y2Ba
- 51.gydF4y2Ba
李建军,李建军,李建军,等。基于气相色谱-质谱分析的植物代谢产物分析。自然科学学报,2006;1(1):387-96。gydF4y2Ba
- 52.gydF4y2Ba
李建军,李建军,李建军,等。基于指纹图谱的代谢组分析方法的研究进展。方法:中华医学杂志。2012;36(2):555 - 556。gydF4y2Ba
- 53.gydF4y2Ba
李建军,李建军,李建军,等。GMD@CSB.DB: Golm代谢组数据库。生物信息学。2005;21(8):1635 - 8。gydF4y2Ba
- 54.gydF4y2Ba
阿吉奥RB,鲁杰罗K,博阿斯SG。途径活性分析(PAPi):从代谢物谱到代谢途径活性。生物信息学,2010,26(23):2969 - 76。gydF4y2Ba
- 55.gydF4y2Ba
M . Kanehisa, Goto S. KEGG:京都基因与基因组百科。核酸学报,2000;28(1):27-30。gydF4y2Ba
致谢gydF4y2Ba
本项目由香港特别行政区基础研究种子基金(201011159168)、香港大学清洁能源与环境研究计划(ICEE)、香港特别行政区普通研究基金(HKU772012M)和创新及科技基金(香港国家重点实验室伙伴资助)资助。感谢Apple Chu、Quan Quan和William Chan在蛋白质组学研究方面的技术支持,感谢Maurice Cheung博士对本文的批注。GP和KK感谢香港大学清洁能源策略研究主题和香港大学基因组学策略研究主题的支持。gydF4y2Ba
作者信息gydF4y2Ba
从属关系gydF4y2Ba
相应的作者gydF4y2Ba
额外的信息gydF4y2Ba
相互竞争的利益gydF4y2Ba
作者宣称他们没有竞争利益。gydF4y2Ba
作者的贡献gydF4y2Ba
CL设计实验,样品采集和制备,数据分析,并起草稿件。SC参与了细胞器转录本的分析。YZ进行代谢物分析,YS进行qRT-PCR。KK和GP参与基于代谢组的途径活性计算。AF分析代谢组学数据并修改稿件。CLo设计蛋白质组学实验并修改稿件。BL负责整个项目的协调和实验设计。所有作者都阅读并认可了稿件。gydF4y2Ba
附加文件gydF4y2Ba
附加文件1:gydF4y2Ba
3个样本的转录本列表全部定位到拟南芥TAIR 10.0基因组。gydF4y2Ba(XLSX 4615kb)gydF4y2Ba
附加文件2:gydF4y2Ba
叶绿体编码基因的转录和翻译谱。gydF4y2Ba(xlsx33kb)gydF4y2Ba
附加文件3:gydF4y2Ba
线粒体编码基因的转录和翻译谱。gydF4y2Ba(xlsx33kb)gydF4y2Ba
附加文件4:gydF4y2Ba
(a) T1与T0相比,(b) T8与T0相比,(c) T8与T1相比,显著性deg总列表。gydF4y2Ba(xlsx183kb)gydF4y2Ba
附加文件5:gydF4y2Ba
RNA-seq发现的选择性剪接事件。gydF4y2Ba蓝色条表示每个样本中存在备选剪接事件的基因数目,红色条表示备选剪接事件数目。(DOCX 940kb)gydF4y2Ba
附加文件6:gydF4y2Ba
T0、T1和T8时每个样本中新转录本的数量。gydF4y2Ba(DOCX 13kb)gydF4y2Ba
附加文件7:gydF4y2Ba
野生型拟南芥光系统候选基因的qRT-PCR验证。gydF4y2Ba所有的数值都是通过两个比较时间点的数值的倍数变化来计算的。(A)为RNA-seq数据,(B)为qRT-PCR数据。数据以三个生物重复的平均值±SD表示。T1和T8分别较T0有显著变化。星号表示差异显著,*gydF4y2BaPgydF4y2Ba< 0.05, **gydF4y2BaPgydF4y2Ba< 0.01。(DOCX 212kb)gydF4y2Ba
附加文件8:gydF4y2Ba
用SCX分离肽段。gydF4y2Ba上图显示的是OD220、OD260和OD280的配置文件。(docx66kb)gydF4y2Ba
附加文件9:gydF4y2Ba
(A) ProteinPilot在不同FDR阈值下对蛋白、肽和光谱的鉴定产率。gydF4y2Ba(B). ProteinPilot报告的FDR水平与ID产率之间的对应关系(DOCX 24 kb)gydF4y2Ba
附加文件10:gydF4y2Ba
核编码蛋白的蛋白质组学数据。gydF4y2Ba(XLSX 1353 kb)gydF4y2Ba
附加文件11:gydF4y2Ba
western blotting对光系统中选定蛋白的验证。gydF4y2Ba(DOCX 153kb)gydF4y2Ba
附加文件12:gydF4y2Ba
光系统的转录和翻译概况。gydF4y2Ba(xlsx36kb)gydF4y2Ba
附加文件13:gydF4y2Ba
CBB酶的转录和翻译谱。gydF4y2Ba(xlsx17kb)gydF4y2Ba
附加文件14:gydF4y2Ba
碳水化合物代谢酶的转录和翻译谱。gydF4y2Ba(xlsx19kb)gydF4y2Ba
附加文件15:gydF4y2Ba
糖酵解酶的转录和翻译谱。gydF4y2Ba(xlsx16kb)gydF4y2Ba
附加文件16:gydF4y2Ba
TCA循环酶的转录和翻译谱。gydF4y2Ba(xlsx15kb)gydF4y2Ba
附加文件17:gydF4y2Ba
氧化还原蛋白的转录和翻译谱。gydF4y2Ba(xlsx16kb)gydF4y2Ba
附加文件18:gydF4y2Ba
呼吸系统蛋白的转录和翻译谱。gydF4y2Ba(XLSX 29kb)gydF4y2Ba
附加文件19:gydF4y2Ba
根据代谢组数据计算途径活性。gydF4y2Ba(xlsx24kb)gydF4y2Ba
附加文件20:gydF4y2Ba
基于代谢组的途径活性与RNA水平(左图)或蛋白质水平(右图)之间的相关性。gydF4y2Ba采用基于时间点T0、T1、T8的三组两两比较。(a)半径表示目标通路的体积(基因/蛋白总数)。(b)内圈表示基于代谢组的途径活性;灰色:通路活性无显著差异;红色:明显更活跃;绿色:活动量明显减少。(c)中间环表示上调或下调基因/蛋白的比例;灰色:无显著差异表达的基因/蛋白;红色:上调的基因/蛋白;绿色:下调的基因/蛋白。 (d) The outer thin ring stands for the relationship between metabolome-based pathway activity and the ratio of up- and down-regulated genes/proteins; red: positive correlation (e.g. higher metabolome- based activity and higher number of up-regulated genes), green: negative correlation (e.g. higher metabolome-based activity and higher number of down-regulated genes). (PDF 2601 kb)
附加文件21:gydF4y2Ba
RNA和蛋白质在通路水平上的相关性。gydF4y2Ba根据T0、T1、T8时间点进行三组两两比较。(a)半径表示目标通路的体积(基因总数)。(b)内圈表示目标通路中上调和下调蛋白的比例;灰色:无显著差异表达的蛋白;红色:上调蛋白;绿色:下调蛋白;白色:未检测到蛋白质。(c)中间环表示上调或下调基因的比例;灰色:无显著差异表达的基因;红色:上调基因; green: down-regulated genes. (d) The outer thin ring stands for the relationship between the ratios of up- and down-regulated genes and proteins in the target patwhay; red: positive correlation, green: negative correlation. (PDF 1889 kb)
权利和权限gydF4y2Ba
开放获取gydF4y2Ba本文遵循知识共享署名4.0国际许可协议(gydF4y2Bahttp://creativecommons.org/licenses/by/4.0/gydF4y2Ba),它允许在任何媒体上不受限制地使用、分发和复制,前提是您要适当地注明原作者和来源,提供到知识共享许可协议的链接,并注明是否进行了修改。创作共用公共领域免责声明(gydF4y2Bahttp://creativecommons.org/publicdomain/zero/1.0/gydF4y2Ba)适用于本文中提供的数据,除非另有说明。gydF4y2Ba
关于本文gydF4y2Ba
引用本文gydF4y2Ba
梁超,程松,张勇。gydF4y2Baet al。gydF4y2Ba转录组学,蛋白质组学和代谢的变化gydF4y2Ba拟南芥gydF4y2Ba光照开始后的叶片。gydF4y2BaBMC Plant BiolgydF4y2Ba16,gydF4y2Ba43(2016)。https://doi.org/10.1186/s12870-016-0726-3gydF4y2Ba
收到了gydF4y2Ba:gydF4y2Ba
接受gydF4y2Ba:gydF4y2Ba
发表gydF4y2Ba:gydF4y2Ba
DOIgydF4y2Ba:gydF4y2Bahttps://doi.org/10.1186/s12870-016-0726-3gydF4y2Ba
关键字gydF4y2Ba
- 三磷酸腺苷gydF4y2Ba
- 叶绿体gydF4y2Ba
- 线粒体gydF4y2Ba
- 代谢组学gydF4y2Ba
- 蛋白质组学gydF4y2Ba
- 转录组gydF4y2Ba