摘要
背景
丝裂原激活蛋白激酶(MPK)级联对真核生物的细胞信号转导很重要。它们调节生长、发育和对环境挑战的反应。MPK的级联作用通过级联组分MEKK、MEK和MPK的可逆磷酸化实现,也通过MPK底物的磷酸化实现。通过质谱分析,我们先前在体内发现了MPK3和MPK6底物拟南芥,并揭示了它们的磷酸化位点。
结果
我们使用非放射性体外标记试验验证了我们之前确定的几种MPK3/6底物的磷酸化。我们设计了MPK3、MPK4和MPK6,使其接受生物正交的ATPγS类似物,用于巯基化其适当的底物蛋白。硫代磷酸化氨基酸残基的后续烷基化允许使用硫代磷酸酯特异性抗体进行免疫检测。位点定向突变的氨基酸证实了蛋白质底物的位点特异性磷酸化由MPK3和MPK6。与MPK3、MPK6和MPK4的联合检测显示了单个激酶的底物特异性。
结论
我们的工作表明,体外标记试验是一种确定激酶-底物关系的有效、特异性和高灵敏度的试验。
背景
丝裂原激活蛋白激酶(MPK)级联是真核生物中保守的信号模块。它们通过磷酸化将外部信号转导到细胞内反应。MPK级联包含三种连续类型的蛋白激酶。它们是mpk, mpk激活激酶(MKKs或MEKs)和MKK/ mek激活激酶(MEKKs)。遗传和生化分析发现不同的MEKK/MKK/MPK模块在发育、免疫和非生物应激反应中具有重叠功能[1- - - - - -3.].除了MKKs之外,MPK的活性也受到MPK磷酸酶的调控,这些磷酸酶可以去磷酸化,从而使目标MPK失活。到目前为止,许多MPK底物的身份和MPK-底物相互作用的性质仍然难以确定,特别是在植物中。它们的揭示对于理解MEKK/MKK/ mpk介导的细胞信号转导至关重要。
近十年来,植物MPK的研究主要集中在MPK底物蛋白的大规模鉴定上。例如,在放射性标记ATP存在的情况下,用重组MPKs检测蛋白质和肽微阵列,以识别新的MPK底物蛋白质[4- - - - - -6].另一项体外筛选使用合成肽库,该肽库与纯化激酶一起孵育,然后用质谱法鉴定磷酸化位点[7].总的来说,这些筛选揭示了大量潜在的激酶-底物关系。
磷蛋白质组学的新协议使低丰度的MPK底物蛋白也能富集,从而使其可用于质谱分析[8,9].这些协议描述了双重富集策略,包括Al(OH)对磷蛋白的富集。3.基于金属氧化物亲和层析(MOAC)。Al (OH)3.在基础MOAC之前进行铵-硫酸盐预分馏[9],或随后使用TiO特异性富集磷酸肽2.我们将后一种方法称为串联MOAC [8].串联方法可以直接记录MPK3和MPK6的已知和许多未知底物候选蛋白的位点特异性磷酸化拟南芥.
在这里,我们使用一种新的非放射性体外标记方法来测定植物MPK底物磷酸化,验证了之前在拟南芥中选定的体内鉴定的MPK底物蛋白[8].我们使用的ATPγS类似物不能进入野生型激酶的atp结合口袋,但当激酶的atp结合口袋扩大时可以进入。这些所谓的类似物敏感(AS)激酶使用庞大的ATPγS类似物作为催化辅助因子。我们对拟南芥中脯氨酸导向的丝氨酸/苏氨酸激酶MPK3、MPK4和MPK6进行了工程改造,方法是突变相应激酶的atp结合口袋中的守门氨基酸。突变扩大了atp结合袋,从而允许AS激酶催化底物蛋白的硫代磷酸化。巯基磷酸化丝氨酸和/或苏氨酸残基的后续烷基化为单克隆巯基磷酸酯特异性(抗tpe)抗体提供了半合成表位[10].除了验证之前在拟南芥中发现的体内MPK3/6底物外,我们还证明了这些MPK3/6底物对于密切相关的拟南芥MPK4来说是较差的底物[5,8].
结果
拟南芥MPKs利用ATPγS硫磷化髓磷脂碱性蛋白
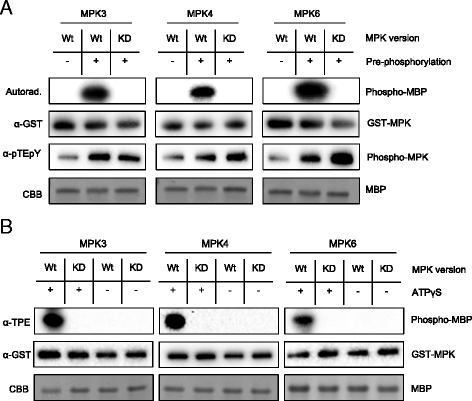
在传统的体外激酶测定中,激酶及其底物在[γ-]存在下孵育32P]或[γ-33P]标记ATP。孵化后,32P /33检测p放射性标记的底物是作为激酶活性或作为激酶底物的蛋白质或肽的适宜性的一种测量方法。为了确定在没有放射性标记的情况下拟南芥MPK3、MPK4和MPK6对所选蛋白质样底物的体外活性,我们将MPK3、MPK4和MPK6表达为gst融合大肠杆菌.在催化条件下,在通用MPK底物髓鞘碱性蛋白(MBP)的存在下,纯化并培养融合蛋白[11].MPK的活性是通过柱结合的GST-MPKs的磷酸化(洗脱前)来保证的,使用ATP存在下纯化的上游MKKs的组成活性版本。GST-MPK3和GST-MPK6被组成性活跃的MKK4和MKK5(随后称为MKK4)激活DD和MKK5DD),而列结合的GST-MPK4被MKK1激活DD和MKK2DD.在洗脱gst融合的mpk之前,用缓冲液广泛清洗色谱柱,以去除任何残留的MKK。作为对照,我们使用相同处理的激酶死亡版本MPK3, MPK4和MPK6(随后称为MPK3)KD, MPK4KD, MPK6KD).Pre-incubation MPK3的KD/ 4KD/ 6KD与他们适当的上游MKKDDs诱导了激酶激活环中TEY基序的双磷酸化,但没有刺激MPK3KD/ 4KD/ 6KD磷酸化MBP(图。1).相比之下,野生型MPKs与上游MKK在柱上预孵育DDs不仅增强了MPK的TEY motif的双磷酸化,而且还强烈诱导MPK3/4/6活性(图4)。1).
接下来,我们研究了MPK3/4/6是否接受ATPγS作为辅助因子来巯基化它们的通用底物MBP。我们还想知道商业抗tpe抗体是否可以用于检测MPK3/4/6的巯基磷酸化底物蛋白。为了回答这些问题,在存在或不存在ATPγS的情况下,将预磷酸化的野生型和激酶死亡型MPK3/4/6与MBP一起孵育。后添加p-甲磺酸硝基苄基(PNBM)烷基化MBP上潜在的硫磷基,反应混合物进行标准的western blotting分析和抗tpe抗体免疫检测。在没有ATPγS的对照反应中,或在有ATPγS的试验中使用激酶死亡MPKs时,没有检测到信号(图)。1 b).然而,在只含有活性野生型MPK3/4/6和ATPγS的反应混合物中,抗tpe抗体与MBP发生交叉反应(图1)。1 b).这一结果强烈表明,MPK3/4/6都接受ATPγS作为巯基磷酸酯MBP和其他底物蛋白的磷酸化供体。该研究还披露,商用抗tpe抗体可用于检测MPK3/4/6底物蛋白上的硫磷基团(图。1 b).
工程拟南芥AS-MPKs利用N6-benzyl-ATPγ年代代数余子式
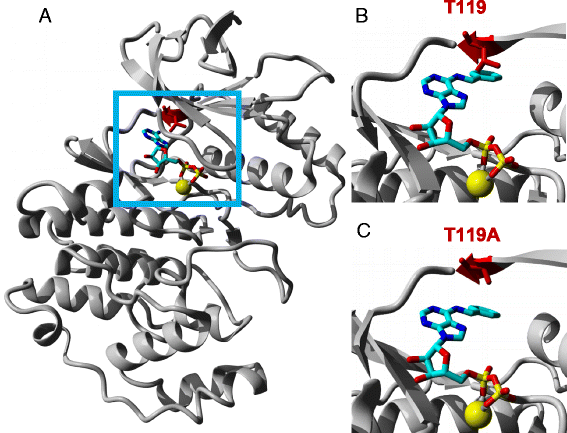
接下来我们询问AS-MPK3/4/6是否接受合成氮6-苄基- atp γ s (Bn-ATPγS)作为硫代磷酸盐供体,可以通过污染激酶来排除底物的硫代磷酸化,也可以防止底物发生潜在的自磷酸化。早期研究发现两个酪氨酸残基(MPK4中的Y124和MPK6中的Y144)是这两种激酶的把关氨基酸[12,13].为了识别MPK3中的守门残基,我们构建了MPK3和Bn-ADP的三维原子结构(图1)。2).该模型预测了MPK3中大的苏氨酸-119 (T119)氨基酸残基与Bn-ADP的庞大侧链发生原子碰撞(图1)。2 b).T119突变为更小的氨基酸,如丙氨酸(a),可能允许Bn-ATP访问MPK3的atp结合位点(图1)。2摄氏度).因此,T119可能是拟南芥MPK3中的“看门人”氨基酸残基。
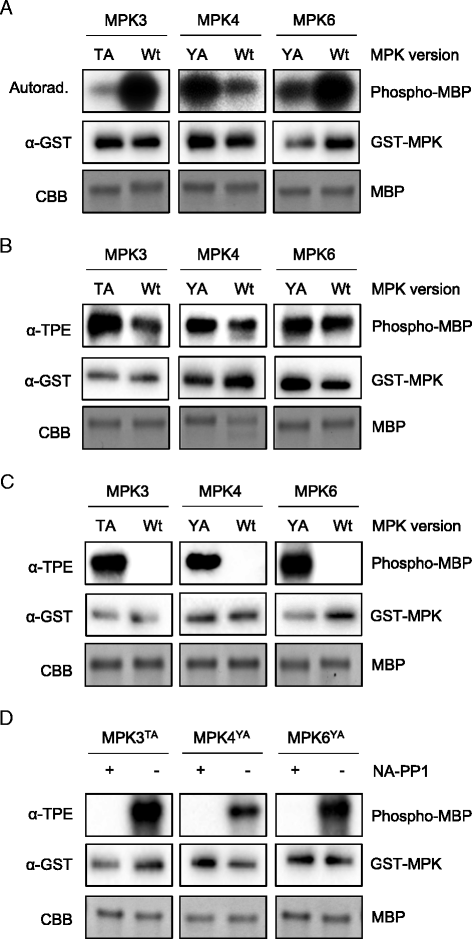
为了测试我们的在网上模型(无花果。2)体外纯化GST-MPK3T119A表达在大肠杆菌.我们还纯化了AS-MPK4的突变型(GST-MPK4)Y124A)和AS-MPK6 (GST-MPK6)Y144A)大肠杆菌.首先,将这些AS激酶磷酸化MBP的相对活性与它们适当的野生型版本在[γ-]存在时的活性进行比较32P] ATP(图。3)或ATPγS(图。3 b).Y124突变到丙氨酸没有影响(图。3 b) MPK4使用[γ-32P] ATP(图。3)或ATPγS(图。3 b).MPK6Y144A磷酸化的MBP达到相同水平(图。3 b)或稍低的范围(图。3)而不是MPK6野生型蛋白。MPK3T119A也催化了较低的MBP磷酸化(图。3)或稍高(图。3 b)比野生型的要多。
在另一组实验中,在体外底物标记试验中测试了as - mpk3 /4/6在催化过程中使用Bn-ATPγS作为辅助因子的能力。3 c).野生型MPK3/4/6不使用Bn-ATPγS作为巯基磷酸酯供体,而所有as激酶都使用生物正交的Bn-ATPγS类似物来巯基磷酸酯MBP(图。3 c).
AS-MPKs可以被嘌呤类似物特异性抑制,而不影响野生型激酶的活性。例如,先前的研究表明,4-氨基-1-叔丁基-3-(1 ' -萘基)吡唑啉[3,4-d]嘧啶(NA-PP1)可特异性抑制AS激酶,但不能抑制相应的野生型激酶,因为其较大的侧链阻止NA-PP1进入野生型激酶的atp结合袋[12,13].与此一致的是AS-MPK3/4/6似乎对NA-PP1很敏感,因为NA-PP1加入底物的标记反应完全消除了MPK3T119A, MPK4Y124A, MPK6Y144A活动(无花果。3 d).
通过体外底物标记对MPK目标进行位点特异性磷酸化
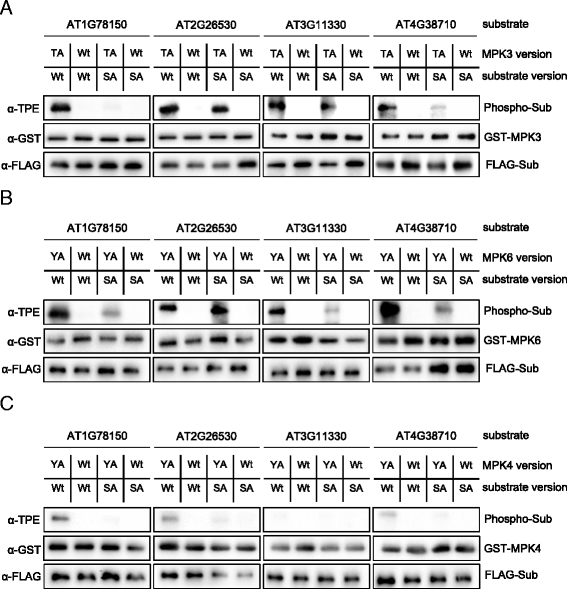
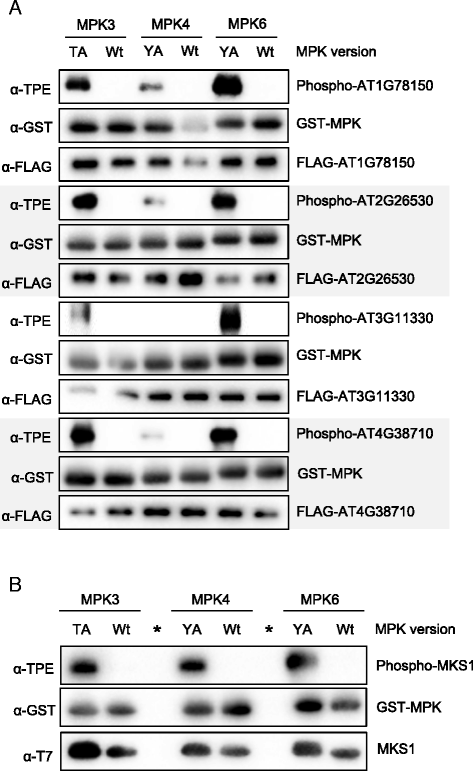
接下来,我们使用活性AS-MPK3/4/6的体外底物标记反应来验证之前在体内发现的MPK3/6底物及其靶向磷酸化位点。我们随机选择了四种mpk3 /6特异性体内底物,我们在之前的工作中通过串联MOAC识别了它们[8]:两个功能未知的蛋白(AT2G26530和AT1G78150),一个被认为是翻译起始因子(AT4G38710),一个是植物细胞内Ras群相关的富含亮氨酸重复序列(LRR)蛋白(AT3G11330)的成员。除了野生型蛋白,我们还克隆了先前记录的磷酸化丝氨酸和/或苏氨酸残基突变为丙氨酸的磷酸位点突变体。flag标记的野生型和突变型蛋白在小麦胚芽提取物中成功转译后,用抗flag琼脂糖树脂免疫沉淀。当蛋白与亲和力凝胶结合时,蛋白与活性AS-MPK3/4/6或适当的野生型激酶在Bn-ATPγS存在下孵育。如图所示。4,野生型AT1G78150, AT2G26530和AT4G38710均被这三种mpk磷酸化。然而,与MPK3/6相比,这些蛋白似乎只被MPK4弱磷酸化Y124A(无花果。4摄氏度).AT3G11330是MPK3/6的良好底物,但不能被MPK4磷酸化。4得了).在大多数情况下,研究蛋白中先前识别的磷酸化位点的突变在体外强烈降低了MPK3/4/6的磷酸化程度。这些发现表明,先前确定的丝氨酸/苏氨酸残基是MPK3/6的特异性靶向,而MPK4的靶向程度较低。
结果如图。4表明AT1G78150、AT2G26530、AT3G11330和AT4G38710是MPK3/6的良好底物,但不被MPK4磷酸化或仅被MPK4弱磷酸化。为了直接比较MPK3/4/6磷酸化这四种蛋白质的潜力,我们重复了所有三种MPKs的底物标记反应(图1)。5).我们测试了野生型AT1G78150、AT2G26530、AT3G11330和AT4G38710,并将这些蛋白的样品与MPK3/4/6结合加载在单独的凝胶上。本实验的结果支持先前的发现,即所测蛋白是MPK3/6的良好底物,但被MPK4轻微磷酸化。为了排除MPK4对这些MPK3/6底物磷酸化水平较低是因为MPK4体外活性较低的可能性,我们表达并纯化了已知的MPK4底物MAP激酶底物1 (MKS1)大肠杆菌发现MKS1同样被MPK3/6和4很好地磷酸化(图。5 b)[14].这些数据验证了AT1G78150、AT2G26530、AT3G11330和AT4G38710作为MPK3/6的底物蛋白,并提示其在体外底物标记反应中的特异性。
体外底物标记试验的特异性
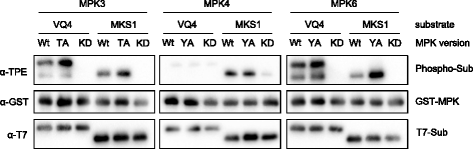
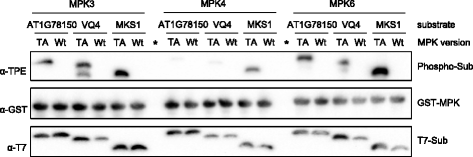
拟南芥MPKs不仅在序列上相关,而且它们还共享底物[4,5].底物重叠的报道主要是MPK3和MPK6,但也有MPK3和MPK4。为了分析体外底物标记反应的特异性,我们首先研究了MPK3/4/6的看门氨基酸对丙氨酸的突变是否会导致底物选择性的改变。因此,我们比较了野生型与AS-MPKs在含ATPγS体外标记反应中的底物特异性。作为mpk底物,我们选择了含有vq基基的蛋白家族中的两个成员,MPK3/6底物VQ4和描述良好的mpk4特异性底物MKS1(也称为VQ21) [8,14,15].AS-MPK4和野生型MPK4只能显著地巯基化MKS1,而VQ4和MKS1都被野生型和突变的MPK3和MPK6巯基化(图1)。6).因此,这些结果表明,大门氨基酸突变为丙氨酸不会影响MPK3/4/6的底物特异性。在最后一个实验中,为了比较AS-MPK3、AS-MPK4和AS-MPK6的底物偏好,我们再次测试了VQ4和MKS1,但也包括了mpk3 /6特异性底物AT1G78150 [8,14].三种MPK底物进行了表达和纯化大肠杆菌作为土生土长的他6-标记融合蛋白与额外的n端T7表位用于免疫检测。为了评估AS-MPK3、AS-MPK4和AS-MPK6的底物偏好,我们使用等量的上述蛋白底物进行了体外标记试验。这些样品被加载在同一个凝胶上,以便直接比较信号强度。与图中的结果一致。4而且5在研究中,未知蛋白AT1G78150被MPK3和MPK6很好地磷酸化,而MPK4只有较弱的磷酸化(图1)。7).同样,特定的MPK3/6底物蛋白VQ4 [8]也只被MPK4弱磷酸化(图。7).相比之下,已知的MPK4底物MKS1不仅像之前报道的那样被MPK4磷酸化[14,16],但同样被MPK3/6磷酸化(图5)。5 b而且7).这一结果表明,通过将三种主要植物MAP激酶的已知底物作为阳性对照,体外标记反应能够评估激酶-底物相互作用的特异性。
讨论和结论
传统的体外激酶分析使用激酶,它们的底物和γ-32P或γ-33P-labeled ATP。现在,放射性标记的核苷酸可以被非放射性的ATPγS取代,导致激酶底物的硫代磷酸化。用PNBM烷基化后,硫代磷酸化的底物可通过western blotting分析和抗tpe抗体免疫检测[10].特异性底物标记是通过工程激酶来实现的,以接受大块的ATPγS类似物,由于空间位阻,原始激酶不能使用。迄今为止,这种体外研究激酶-底物相互作用的方法尚未在植物生物学研究中得到应用。我们用这种方法证明AS-MPK3/4/6能够利用Bn-ATPγS对底物进行硫代磷酸化,并且这些体外反应具有特异性。此外,我们验证了之前在体内发现的MPK3/6蛋白底物的磷酸化,并证明这些底物对MPK4来说是相当差的底物。
底物硫代磷酸化测定方法简单、有效、灵敏度高。它不需要处理危险材料或有问题的废物处理。使用AS激酶和生物正交atp类似物的另一个优点是激酶-底物相互作用的特异性。当(i)激酶反应与纯度低于最佳的底物蛋白进行时,(ii)当反应需要一个额外的上游激活激酶时,或(iii)假定底物是具有激酶活性的蛋白质时,这是特别相关的。后者是正确的,例如,对于mpk3 /6特异性底物PIRL9 (AT3G11330)(图4)。4而且5)[17].因此,使用AS激酶和ATP类似物避免了通过污染反应混合物中的激酶对这种自磷酸化和/或磷酸化的不希望的检测。
到目前为止,AS激酶在研究酵母和哺乳动物的细胞信号转导时被广泛利用[10,18].在拟南芥中,AS-MPK4或AS-MPK6被用于基因补充mpk4或mpk6突变体(12,13].作者将这种把关氨基酸突变为甘氨酸。在NA-PP1的作用下,这种交换导致了体内激酶的特异性抑制。在本研究中,我们首次将AS-MPK3/4/6应用于底物标记反应。由于甘氨酸缺乏氨基酸侧链,它经常导致多肽骨架的急剧转变[19],因此,可能导致atp结合袋的崩溃和相关的激酶活性的丧失。相比之下,在看门人位置引入丙氨酸不仅保留了酶的活性(图。3.)和底物特异性(图。6而且7),但也保持了通过结合NA-PP1在扩大的活性位点口袋中阻断其活性的可能性(图。3.).
我们之前的工作使用串联moac结合地塞米松诱导的烟草MPK激酶(NtMEK2DD)在拟南芥中[8].NtMEK2磷酸化并活化拟南芥MPK3及MPK6 [20.].然而,我们不能排除在这些植物中其他MPKs的活性也受到影响。我们在体外验证了AT2G26530, AT1G78150, AT4G38710和AT3G11330可以被MPK3/6磷酸化,但它们是较差的底物拟南芥MPK4(无花果。4而且5).除AT2G26530外,通过对丝氨酸-脯氨酸或苏氨酸-脯氨酸二肽基序中的丝氨酸或苏氨酸氨基酸进行位点定向突变,敲除磷酸化靶向残基,导致这些蛋白质的磷酸化水平大幅下降(图2)。4).然而,除了已知的AT2G26530磷酸化位点外,该蛋白还包含8个推测的MPK磷酸化位点,这表明MPK3/6可能靶向AT2G26530中的其他磷酸化位点1:图S1)。总之,这些发现揭示了我们串联moac分析的力量和磷位点定位概率的高置信度。为了评估底物偏好,我们不仅独立测定了每个底物的MPK3/4/6磷酸化(图5)。4而且5),但我们也直接比较了这些MPKs对几种底物的磷酸化(图。7).与其他实验室的结果一致,MKS1是MPK4的良好衬底(图5)。5,6而且7)[14,21].然而,基于我们的数据,我们得出结论,MKS1也是MPK3/6的良好衬底,这与Sörensson等人(2012)和Pecher等人(2014)最近的报告相对照[16,21].
方法
克隆和定点突变
编码的区域MPK3, MPK4,MPK6用PCR扩增,在框架内连接到pGEX5x-3载体(GE Healthcare)并测序。Mkk1, mkk2, mkk4, mkk5, mks1, vq4而且AT1G78150.1被克隆到pET中λ他(22使用附加文件中列出的限制性内切酶1:表S1,转化为大肠杆菌BL21。MPK底物的编码区AT2G26530、AT1G78150 AT4G38710,AT3G11330经PCR扩增,克隆至pJET1.2 (Thermo Scientific)。定点突变(附加文件1:表S2)采用如下所述的双连接PCR方法进行[23或使用QuickChangeII位点定向突变试剂盒(Stratagene)。
蛋白的表达和纯化
重组蛋白表达2.5 mL an大肠杆菌过夜培养稀释在250毫升LB培养基。培养条件为37℃至外径600添加1 mM IPTG, 28°C孵育3 h。细胞在4000 × g 4°C离心15 min, -80°C保存,待进一步处理。用GSTrap FF (GE Healthcare)色谱柱纯化gst标记的蛋白质或Ni2 +-NTA柱(Qiagen)用于纯化his标记蛋白。用于GST-MPKs的磷酸化,由它们各自的,组成活性MKKDD(MKK4/5DDMPK3/6;MKK1/2DD对MPK4),柱上固定化GST-MPK与1 μg纯化的his标记MKK孵育2 hDD在激酶缓冲液(50 mM Tris-HCl pH 7.5, 10 mM MgCl2, 1毫米DTT, 1毫米ATP)。经过额外的洗涤步骤后,根据制造商的说明洗脱磷酸化的GST-MPK。以牛血清白蛋白为标准,用Bradford蛋白测定试剂盒(Bio-Rad)测定蛋白浓度。
体外转录和翻译
标记的AT1G78150, AT2G26530, AT3G11330和AT4G38710使用体外转录/翻译试剂试剂盒按照制造商的说明(BioSieg)合成。
放射性激酶活性测定
放射性激酶测定按所述方法进行[20.].简单地说,100 ng重组活性GST-MPK3、4或6与3 μg MBP混合在激酶反应缓冲液中(50 mM Tris-HCl pH 7.5, 10 mM MgCl2, 1 mM DTT)与25 μM ATP和[γ-32P]-ATP(每反应1 μCi)。30 min后,加入SDS负载缓冲液使反应停止。MBP磷酸化经过SDS-PAGE放射自显影显示。用PageBlue™蛋白染色液(Thermo Scientific)观察MBP的负载。
底物标记反应
按照所述进行底物标记反应[10].简单地说,100 ng重组活性GST-MPKs与3 μg MBP、1 μg重组t7标记的MPK底物或10 μL免疫沉淀的flag标记的底物混合,其中包括1 mM ATPγS (Sigma Aldrich)或1 mM N6-Bn-ATPγS (Biolog)。免疫复合物底物标记用40 μL EZview免疫沉淀体外翻译的flag标记蛋白TM红色抗旗M2亲和凝胶(西格玛奥尔德里奇)根据制造商的说明。在与flag标记底物结合的同时,用激酶缓冲液洗涤亲和力凝胶2次,树脂在40 μL激酶缓冲液中重悬。每次衬底标记反应使用10 μL的珠状悬浮液。1 h后加入20 mM EDTA终止反应,2.5 mM PNBM (Abcam)在5% (v/v) DMSO中烷基化2 h,加入SDS负载缓冲液终止烷基化反应。样品经过SDS-PAGE处理,转移到硝化纤维素膜上(Carl Roth),并如所述用于免疫检测[24].用兔抗硫代磷酸酯(α-TPE, Abcam)的原代抗体进行硫代磷酸化检测。抗phospho-p44/42 MPK (Thr202/Tyr204)抗体,可以检测双磷酸化的MPK3/4/6,来自新英格兰Biolabs。兔抗t7 (Cell Signaling Technologies)和小鼠单克隆抗flag M2 (Sigma Aldrich)表位抗体作为flag标记和t7标记MPK底物的负载控制。兔抗gst(细胞信号技术)抗体用于检查每个反应中等量的激酶。用辣根过氧化物酶偶联抗兔或抗小鼠二抗(Cell Signaling Technologies)检测抗原-抗体复合物,然后用Luminata Crecendo HRP底物(Millipore)进行化学发光检测。使用独立的蛋白质制剂,所有底物标记反应至少重复两次,得到相似的结果。
生物信息学
MPK3同源性模型由HHpred 2.0和modeler生成[25,26]基于人MPK7/ERK5的x射线晶体结构,PDB: 4ic7,序列一致性为51%,相似性为0.890;人MPK12, PDB: 1 cm8,序列一致性41%,相似性0.818;酵母FUS3, PDB: 2b9h,序列一致性为50%,相似性为0.922;人类MPK8, PDB: 2xrw,序列一致性为41%,相似性为0.717;人类CDK7, PDB: 1ua2,序列一致性为41%,相似性为0.609。MPK3的模型结构被MUSTANG覆盖[27] ADP和Mg2+绑定到FUS3结构(PDB: 2b9h),使用YASARA结构版本14.7.17 [28]和Mg的初始结合模式2 +将/ADP辅助因子引入MPK3的失模结构中。根据初始的mpk3mg2 +/ADP结合模型中,大块n6 -苄基- atp的结合模式是人工构建的,使用YASARA将能量降到最低[29].为了消除原子冲突和修正共价几何结构,首先进行了短的最陡下降最小化。去除构象应力后,模拟退火过程继续进行(时间步骤2 fs,原子速度每10步降低0.9),直到达到收敛,即在200步中每个原子的能量提高小于0.05 kJ/mol。我们应用了AMBER03 [30.]蛋白质残基的力场和一般琥珀色力场GAFF [31利用AM1BCC [32]计算了部分电荷和力截止0.786 Å和粒子网格Ewald [33],以使用周期边界条件精确处理远距离静电。对活性位点突变T119A进行相同的处理。
结论
我们的数据表明,体外标记试验是一种利用拟南芥MPKs确定激酶-底物关系的有效、特异性和高灵敏度的试验。通过应用类似物敏感的MPK3和MPK6,我们确认了之前发现的MPK3/6底物的体内磷酸化,并证明这些底物是密切相关的拟南芥MPK4的不良靶标。
数据和材料的可用性
所有支持的数据都可以在手稿及其附加文件中找到。
突出
我们描述了一种新的非放射性体外标记测定植物MPK蛋白底物磷酸化的方法。该方法对确定激酶-底物关系是有效的、特异性的和高灵敏度的。
参考文献
MAPK在植物抗病信号通路中的级联作用。植物病理学杂志,2013;51:24 45 - 66。
王晓燕,王晓燕,王晓燕,等。植物丝裂原激活蛋白激酶的信号转导。植物学报2010;61:621-49。
mapk及其底物mapk活化蛋白激酶的活化与功能研究。微生物分子生物学杂志2011;75:50-83。
Feilner T, Hultschig C, Lee J, Meyer S, Immink RG, Koenig A,等。潜力的高通量识别拟南芥丝裂原激活蛋白激酶底物。细胞蛋白质组学,2005;4:1558-68。
Popescu SC, Popescu GV, Bachan S, Zhang Z, Gerstein M, Snyder M,等。MAPK目标网络拟南芥使用功能性蛋白质微阵列揭示。基因Dev。2009;23:80 - 92。
施图勒梅耶IJE,斯特拉特曼JW,乔斯滕·马哈吉。番茄丝裂原激活蛋白激酶LeMPK1、LeMPK2和LeMPK3在Cf-4/ avr4诱导的过敏反应中被激活,具有明显的磷酸化特异性。植物杂志。2007;144:1481 - 94。
Ahsan N, Huang Y, Tovar-Mendez A, Swatek KN, Zhang J, Miernyk JA,等。一种多功能的基于质谱的方法,既可以识别激酶客户关系,也可以描述信号网络拓扑结构。J Proteome Res. 2013; 12:937-48。
胡恩华特W, Thomas M, Nukarinen E, Egelhofer V, Röhrig H, Weckwerth W,等。新型mapk激酶在体内底物的鉴定拟南芥通过使用串联金属氧化物亲和层析。细胞蛋白质组学。2013;12:369-80。
Lassowskat I, Böttcher C, Eschen-Lippold L, Scheel D, Lee J.持续丝裂原激活蛋白激酶激活重编程防御代谢和磷蛋白谱拟南芥.植物科学进展,2014。doi:10.3389 / fpls.2014.00554.
Allen J, Li M, Brinkworth CS, Paulson JL, Wang D, Hübner A,等。激酶底物的半合成表位。Nat方法。2007;4:511-6。
髓鞘蛋白磷酸化的研究进展。Neurochem杂志1996;21:527-35。
Brodersen P, Petersen M, Nielsen HB, Zhu S, Newman M- a, Shokat KM,等。拟南芥MAP激酶4通过EDS1和PAD4调节水杨酸和茉莉酸/乙烯依赖性反应。植物j . 2012; 47:532-46。
徐静,谢娟,闫超,邹旭,任东,张松。化学遗传学研究表明,MPK3/MPK6激活和NADPH氧化酶介导的氧化爆裂是植物免疫过程中两个独立的信号事件。植物j . 2014; 77:222-34。
Andreasson E, Jenkins, Brodersen P, Thorgrimsen S, Petersen NH, Zhu S,等。MAP激酶底物MKS1是植物防御反应的调控因子。EMBO j . 2005; 24:2579 - 89。
程勇,周勇,杨勇,迟勇军,周军,陈建勇,等。含VQ基序蛋白的结构和功能分析拟南芥作为WRKY转录因子的相互作用蛋白。植物杂志。2012;159:810-25。
Pecher P, Eschen-Lippold L, Herklotz S, Kuhle K, Naumann K, Bethke G,等。的拟南芥丝裂原激活蛋白激酶MPK3和MPK6靶向含有“vq motif”的蛋白质的亚类来调节免疫反应。新植醇。2014;203:592 - 606。
Nemoto K, Seto T,高桥H, Nozawa A, Seki M, Shinozaki K,等。自身磷酸化的剖析拟南芥蛋白激酶使用无细胞系统。植物化学。2011;72:1136-44。
你好,霍林沃斯。利用半合成表位系统鉴定减数分裂特异性芽出芽酵母激酶Mek1的直接底物。方法Mol Biol. 2011; 745:135-49。
Ho BK, Brasseur R.甘氨酸和前脯氨酸的Ramachandran图谱。BMC结构生物学。2005。doi:10.1186 / 1472-6807-5-14.
1-氨基环丙烷-1-羧酸合成酶被MPK6(一种应激响应的丝裂原激活蛋白激酶)磷酸化诱导乙烯的生物合成拟南芥.植物细胞。2004;16:3386 - 99。
Sörensson C, Lenman M, vede - vilg J, Schopper S, Ljungdahl T, Grøtli M,等。通过测定拟南芥MAPKs MPK3和MPK6的初级序列特异性,可以鉴定新的底物。j . 2012; 446:271-8。
Groot AJ, Verheesen P, Westerlaken EJ, Gort EH, van der Groep P, Bovenschen N,等。通过噬菌体显示对缺氧诱导因子1 α中ODD结构域特异性的单结构域抗体片段进行鉴定。实验室投资。2006;86:345-56。
Ho SN, Hunt HD, Horton RM, Pullen JK, Pease LR。利用聚合酶链反应的重叠扩展位点定向突变。基因。1989;77:51-9。
Beckers GJM, Jaskiewicz M, Liu Y, Underwood WR, He SY, Zhang S,等。丝裂原激活蛋白激酶3和6是完全启动应激反应所必需的拟南芥.植物细胞。2009;21:944-53。
Söding J, Biegert A, Lupas AN。用于蛋白质同源性检测和结构预测的HHpred交互服务器。《核酸学报》2005;33:W244-8。
王晓燕,王晓燕,王晓燕。基于模型的比较蛋白质建模方法的研究。蛋白质。1995;23:318-26。
Konagurthu AS, Whisstock JC, Stuckey PJ, Lesk AM。MUSTANG:一种多结构对齐算法。蛋白质。2006;64:559 - 74。
克里格E, Vriend G. YASARA观点-分子图形的所有设备-从智能手机到工作站。生物信息学。2014;30:2981-2。
Krieger E, Darden T, Nabuurs S, Finkelstein A, Vriend G.最佳利用经验能量函数:晶体空间力场参数化。蛋白质。2004;57:678 - 83。
段勇,吴超,Chowdhury S,李mc,熊刚,张伟,等。蛋白质分子力学模拟的点电荷力场。计算机化学。2003;24:1999-2012。
王杰,Wolf RM, Caldwell JW, Kollman PA,案件DA。一般琥珀力场的研制与试验。计算化学。2004;25:1157-74。
Jakalian A, Jack DB, Bayly CI。快速、高效地产生高质量的原子电荷。AM1-BCC模型:II。参数化和验证。计算机化学。2002;23:1623-41。
克里格E,尼尔森JE,斯波克CA, Vriend G.基于Ewald和的快速经验pKa预测。分子图模型。2006;25:481-6。
确认
这项工作获创新领域科学研究资助基金〔资助编号:23120520和25120718到YT]来自教育、文化、体育、科学和技术部(日本)和德国研究基金会(DFG) [BE4054/2-1到GJMB, CO186/9-1到UC]。FL获得亚琛工业大学RFwN奖学金的支持。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
作者声明他们没有竞争利益。
作者的贡献
FL做生化实验和分析;MN和YT提供体外翻译蛋白;MB和US指导MPK3的分子建模。GB设计研究并监督工作;UC和GB协调并协助起草稿件。所有作者阅读并批准了最终稿件。
额外的文件
附加文件1:图S1。
所选MPK3/6底物的蛋白质序列。表S1。用于克隆的引物列表。表S2。用于定点突变的引物列表。(多克斯21 kb)
权利和权限
开放获取本文根据创作共用署名4.0国际许可协议发布(http://creativecommons.org/licenses/by/4.0/),该协议允许在任何媒体上不受限制地使用、分发和复制,前提是您适当地注明原作者和来源,提供创作共用许可的链接,并说明是否有更改。创作共用公共领域奉献放弃书(http://creativecommons.org/publicdomain/zero/1.0/)除另有说明外,适用于本条提供的资料。
关于这篇文章
引用这篇文章
Leissing, F, Nomoto, M, Bocola, M。et al。拟南芥丝裂原激活蛋白激酶的底物硫代磷酸化。BMC植物杂志16日,48(2016)。https://doi.org/10.1186/s12870-016-0731-6
收到了:
接受:
发表:
DOI:https://doi.org/10.1186/s12870-016-0731-6
关键字
- 增殖蛋白激酶
- (含硫的)磷酸化
- MPK3/4/6
- 拟南芥
- Analog-sensitive激酶