抽象的
背景
黄曲霉毒素污染曲霉菌曲藤在花生(arachis hypogaea.),包括收获前和收获后阶段,严重影响工业发展和人类健康。虽然已经确定了花生对黄曲霉毒素产生的抗性,但其分子机制仍不清楚。了解花生对黄曲霉毒素产生的反应机制答:flavus利用RNA-seq技术对受真菌感染和黄曲霉毒素生产胁迫的抗性花生(中华6号)和敏感花生(中华12号)收获后种子进行全局转录组分析。
结果
共产生128.72gb的高质量碱基,组装成128725个单基因(平均长度765bp)。在NCBI非冗余蛋白质序列、NCBI非冗余核苷酸序列、Swiss-Prot、KEGG直系同源、蛋白质家族、基因本体或真核直系同源群数据库中,约有62352个单基因(48.43%)被注释,93%以上的单基因在样本中表达。在获得的30143个差异表达的单基因(DEG)中,842个潜在的防御相关基因,包括核苷酸结合位点富含亮氨酸重复蛋白、多聚半乳糖醛酸酶抑制剂蛋白、富含亮氨酸重复受体样激酶、丝裂原活化蛋白激酶、转录因子、ADP核糖基化因子等,花生对黄曲霉毒素产生的反应可能与致病相关蛋白和其它防御相关途径的关键因子有关。值得注意的是,参与苯丙烷类化合物生物合成途径的DEGs在抗性基因型中的诱导水平高于敏感基因型。类黄酮、二苯乙烯和苯丙酸的生物合成途径仅在抗性基因型中富集。
结论
本研究为响应于黄曲霉毒素的生产,提供了收获后花生种子的转录组的第一综合分析,并有助于更好地了解花生和花生之间的分子相互作用答:flavus. 本研究所获得的数据将为作物抗黄曲霉毒素污染的遗传和基因组研究提供有价值的资料。
背景
花生(arachis hypogaea.是一种重要的经济作物和油籽作物,也是全世界植物油和蛋白质的主要来源。但黄曲霉毒素污染引起的曲霉菌曲藤和/或A.帕拉塞术黄曲霉毒素是一种有毒、致癌和致畸的化合物,对动物和人类都有急性和慢性毒性[1.,2.].花生感染答:flavus发生在收获预处理中[3.,4.收获后阶段[5.,6.].经过适当的干燥、储存、加工、运输和监测,从正常生长条件下收获的健康花生被加工成安全、有营养的产品供人类/动物食用。不幸的是,亚洲和非洲许多发展中国家的农民负担不起与预防、监测和减轻花生食品/饲料中的黄曲霉毒素有关的费用。收获后黄曲霉毒素污染导致接触黄曲霉毒素的风险增加,导致急性黄曲霉毒素中毒爆发[7.[患有发育性发育性和营养不良的儿童的发病率增加[8.–10.].此外,收获后的黄曲霉毒素污染会遭受重大的经济成本,如生产和市场价值损失,医疗保健和相关疾病监测,以及对花生大多数商品中黄曲霉毒素的监测和减轻[2.,11.].因此,收获后性黄曲霉毒素污染是花生产品中的难治性问题。包括适当的储运和运输条件,严格的监测措施和育种对生物和非生物胁迫的育种,可以预防和/或降低收获后的储存和运输条件,以及养殖的养殖品种。改善抵抗力答:flavus在花生中产生黄曲霉毒素被认为是最具成本效益的管理方法。然而,花生对收获后黄曲霉毒素污染的抗性尚未得到充分了解。
菌丝体答:flavus必须穿透花生壳和种皮,才能到达营养丰富的子叶获取营养。花生对黄曲霉毒素污染的抗性可大致分为荚果侵染(壳)、种子侵染(种皮)和黄曲霉毒素产生(子叶)[12.]. 第一次相互作用答:flavus并且花生位于荚壳上,这是物理屏障,并且阻力归因于壳结构。对于收获后花生,对POD感染的抵抗力是有限的实用价值,因为脱壳是花生行业的重要考虑因素。而且,豆荚壳的电阻答:flavus当外壳损坏或花生脱壳时,感染就会消失。这种真菌的第二个屏障是种皮,它的厚度、栅栏层、蜡层的密度以及无裂缝和空洞是抵抗种子入侵的主要因素。然而,种皮无法抵抗答:flavus当测试损坏或纠正时侵入。答:flavus最终将子叶中的子叶植入种子中并产生黄曲霉毒素。对黄曲霉毒素产生的抗性是受各种生物和非生物因素影响的非常复杂的防御机制。然而,这种对黄曲霉毒素产生的抗性,包括应力响应机制,是持久性和有效的[13.,14.]. 研究花生对黄曲霉毒素产生抗性的分子机制,对制定有效的防治措施具有重要意义。
RNA测序(RNA-seq)是一种高效、高效、高通量的转录组分析技术,已成功应用于花生不同发育阶段的转录组检测和对各种胁迫的反应[15.–20.].具有较高的敏感性,RNA-SEQ可以有效地检测比微阵列更大范围的动态表达基因。此外,RNA-SEQ已被用于测量序列变异和具有低假阳性率的复杂转录域,以及再现性[21.]. 这项技术的应用大大加快了对基因表达、调控和网络复杂性的理解[21.[并表明了解释病原体感染的宿主抗性的分子机制的潜力。花生的抵抗力aspergillus.殖民化/黄曲霉毒素的产生已被广泛报道,表明花生已经演变了一系列针对真菌的防御机制[22.].然而,花生对黄曲霉毒素产生抗性的分子机制答:flavus一直默默无闻。
为了全面了解花生收获后种子对黄曲霉毒素产生抗性的分子机制,我们采用RNA-seq技术,获得了有和无抗性的花生收获后种子中抗基因型Zhonghua 6和敏感基因型Zhonghua 12的转录组谱,并进行了比较答:flavus接种,在全基因组水平。德诺维转录组合组件,功能作用和分析与花生对黄曲霉毒素产生的反应相关的特定转录物答:flavus实施了。通过比较揭示了差异表达的基因和与耐毒素产生的抗性相关的基因和代谢途径答:flavus- 抗性/易感花生基因型的植物和非接种的种子。更好地了解抗黄曲霉毒素生产的分子机制,有助于改善开发新的耐花生品种的策略。此外,转录组信息将有助于功能基因组学研究,并进一步了解作物中黄曲霉毒素污染的耐药机制。
结果
采后花生种子真菌定殖产生黄曲霉毒素的比较
量化了黄曲霉毒素含量以定义中华6(抗性,R)和中华12(易感,S)对黄曲霉毒素产生的响应答:flavus.黄曲霉毒素既没有在1中都没有测试过1圣孵化后的一天,从2开始测试nd在r和s基因型中孵育后的一天。在2之后,r和s在2中显着增加了黄曲霉毒素含量nd孵化后的一天;然而,在R和S基因型中变化了黄曲霉毒素积累的趋势(表1.).在R中,黄曲霉毒素含量在3rd.4.第孵育后的一天,然后增加比率减慢,并且在7后含量变得稳定第日。在S中,黄曲霉毒素含量从3开始迅速增加rd.到7.第第二天孵育后也保持稳定。黄曲霉毒素含量R远低于Snd日。在黄曲霉毒素积累的峰值中,S中的含量超过10倍,同时,在所有10个时间点的非接种的R和S样品中未检测到黄曲霉毒素(表1.).从上述实验中,R具有在收获后种子中对黄曲霉毒素产生的理想抗性,而S非常敏感。
转录组测序和德诺维集会
上述性黄曲霉毒素含量表明,花生可能会响应于黄曲霉毒素的产生而改变它们的基因表达答:flavus在孵化。1圣,3rd.7.第以孵化后第二天为拐点,研究了采后种子防御分子代谢对黄曲霉毒素产生的响应。因此,使用Illumina-HiSeq2000系统对12个样本进行转录组测序,包括在接种和未接种病毒的情况下的R和S基因型答:flavus并在1D,3D和7D时进行采样。We performed transcriptomic analysis of the 12 samples i.e., R_CK1, R_CK2, R_CK3, R_T1, R_T2, R_T3, S_CK1, S_CK2, S_CK3, S_T1, S_T2 and S_T3 (where CK is the non-inoculated control, and T indicates inoculated) with two biological replicates, to profile the peanut response to aflatoxin production (Table2.,附加文件1.).我们为R样本(R_CK1,R_CK2,R_CK3,R_T1,R_T2和R_T3)获得了大约638.53亿原始读取,以及S样本的675.53万原始读取(S_CK1,S_CK 2,S_CK 3,S_T1,S_T2和S_T3).过滤低质量和适配器序列后,24例转录组文库中留在128.72 GB的清洁碱基(表2.,附加文件1.).
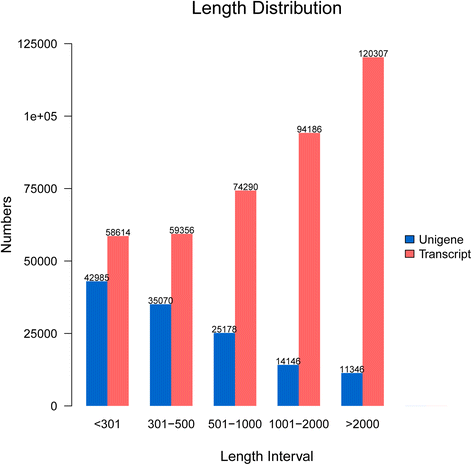
所有高质量的读取都被用于德诺维使用Trinity软件组装转录组数据。使用重叠信息在高质量的读数中,产生406,753转录物,平均长度为1,577bp和2,629bp的n50(表3.,图。1.和附加文件2.-一种)。在最低50bp重叠的聚类标准下,获得90%的身份,128,725 unigenes作为全面参考数据集获得答:hypogaea(表3.);进一步分析基于该最终未植物数据集。unigenes的长度从201到18,631bp的平均长度为765 bp;长度大于500 bp的unigenes占所有ungenes的39.36%(表3.,图。1.和附加文件2.-b)。
基因注释和抗性和易感花生转录组功能分类
为了使用NCBI BLAST 2.2.28+,首先将所有组装的未筛选筛选所有组合的unigenes筛选到NCBI非冗余蛋白序列(NR),NCBI非冗余核苷酸序列(NT)和瑞士 - PROD数据库程序。在128,725 unigenes中,52,691(40.93%)通过NR分析具有显着的相似性至39,488个独特的蛋白质。在所有unigenes中,32,396%(25.16%)与瑞士 - Prot蛋白质的显着身份均与17,871个独特的蛋白质放入相匹配。此外,41,555(32.28%)unigenes在NT数据库中匹配(表4.).总共62,352个unigenes(48.43%)在NR,NT,Swiss-prot,Kegg Ortholog数据库(PFAM),基因本体(GO)和真核原序中成功注释组(Kog)数据库;7,061 unigenes(5.48%)在所有七个数据库中注释。但是,66,373(51.56%)未成年人在这些数据库中没有匹配。这些未匹配的unigenes可以是新的基因或属于未翻译的地区,并且可能在对黄曲霉毒素产生的压力反应中发挥特异性作用答:flavus在花生种子。
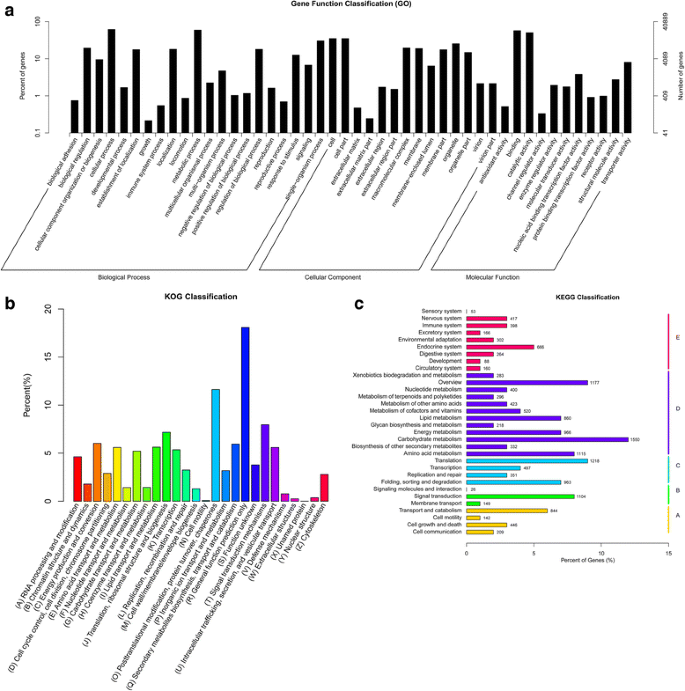
为了识别注释的未经成本,GO,Kog和Kegg的功能类别用于对已知蛋白质注释的unigenes进行分类。共有40,889个与已知蛋白质的Blast2Go匹配的未成年人被分配到广泛的GO术语(表4.,图。2a级和附加文件3.).大多数unigenes被分配到“分子功能”(27,630; 67.57%),其次是“生物过程”(27,092; 66.26%)和“细胞成分”(17,434; 42.64%)。使用Kog数据库共注释,共17,798个unigenes(表4.),这些unigenes被分配到26个Kog类别(图。2b级和附加文件3.).在26个Kog类别中,与“一般功能预测”(仅限一般函数预测“(3,218; 18.08%)是最大的群体,其次是”后期修饰,蛋白质转运,伴侣箱“(2,068; 11.62%)和”信号转导机制“(1,415; 7.95%)。此外,所有unigenes都与Kegg Pathway数据库,196,196(10.25%)分析了数据库中的显着匹配,并分配到五个主要类别,其中包括32个子类别和273 kegg路径(表4.,图。2厘米和附加文件3.).在32个子类别中,“碳水化合物新陈代谢”是少量未成年人(1,550; 11.75%)的子类别,其次是“翻译”(1,218; 9.23%)和“氨基酸代谢”(1,115; 8.45%)。这些注释和分类提供了一种有价值的资源,用于调查所识别的unigenes的具体过程,功能和途径。
差异表达基因的鉴定与分析
用转录本序列的每百万碱基对(FPKM)片段每千碱基对(Fragments Per Kilobase of transcript sequence Per Millions base pairs sequenced)来量化reads的转录本水平,便于样本内部和样本之间mRNA水平的比较[23.].收集的128,725个unigenes被用作参考,从每个文库的干净读取被映射到生成一个假定的转录本表达谱(附加文件4.).所有128,725未成件都被标准化并通过FPKM方法使用唯一映射的读取(附加文件)计算5.和6.).具有FPKM值> 0.3的unigenes被认为是转录表达的[24.].在unigenes中,在样品中的至少一种和19,230中,在所有24个图书馆中表达了93.16%(119,917),在所有24个文库中表达了230个unigenes(附加档案5.).表达的未预终原数据在r和s基因型中的两个生物学复制之间是高度可重复的,尽管从每个生物复制中获得一定数量的特异性表达的未成熟(附加文件5.和7.).为了验证RNA-SEQ数字表达数据,将尝试使用20个表达的Unigenes,设计了引物(附加文件8.)和定量实时反转转录PCR(QRT-PCR)进行。结果表明相关性高(R2.= 0.714;额外的文件9)与qRT-PCR数据进行比较,证实了这些表达的ungenes的真实性,并进行了转录组分析。
此外,DESEQ用于鉴定在样品中的差异表达基因(DEGS),其中仅具有校正的那些unigenesP(Q)值<0.05被认为是差异的表达[25.].对照与接种样品之间的差异比较鉴定了对两种基因型中的黄曲霉毒素产生的次数;接种样品之间的比较响应于黄曲霉毒素的生产(附加文件)鉴定了R和S基因型之间的DEGS10.).在两种基因型中的三个时间点中的比较中鉴定了一项重要的参数(30,143)(附加文件11.和12.).我们观察到,上调和下调的Degs通过三个时间点显示出类似的变化趋势(附加文件10.和11.).上调的DEG的数量明显高于对照和两种基因型的接种样本的比较下调。在r基因型中比在每个时间点中的r基因型中有更高的调节的次数,而在r基因型中的下调较少的下降比在每个时间点中的下降较少。为了获得基因表达式模式的全局视图,我们基于日志执行所有DEG的分层聚类10.fpkms为12个样本(附加文件13.和14.).结果表明,在R和S基因型的两个生物重复之间的DEGs数据具有高度的可重复性14.).在早期接种的样品(R_T1和S_T1)中发现了类似的表达模式;在后两个时间点的每个基因型中观察到不同的样品特异性表达模式(附加文件13.).
差异表达基因的功能分类
为了分析DEG的功能,使用BLAST2GO中的GoseQ方法进行GO分析[26.].纠正的条款P(Q)在DEGS之间被认为是显着富集的价值<0.05。将接种样品中的上调℃的富集分析分别与R和S基因型的配对时间点进行比较。确定了生物过程中的许多显着富集的术语,分子功能和细胞组分类别(附加文件15.).代谢进度(GO:0008152),催化活性(GO:0003824),氧化还原进度(GO:0055114)是占主导地位答:flavus-接种(治疗)到未接种(对照)(R\u T1)与.R_CK1,R_T2与. 路2,路3与.R_CK3,S_T2与.s_ck2和s_t3与. 第3节)。与R和S基因型的对照组相比,受黄曲霉毒素产生影响的许多其他常见/独特术语在处理组中更为丰富,而在S\ T1的比较中没有GO术语更为丰富与.s_ck1。值得注意的是,术语抗氧化活性(GO:0016209),苯基丙醇生物合成过程(GO:0009699),过氧化物酶活性(GO:0004601),LINOLEATE13S-脂氧酶活性(GO:0016165),奥氧基宾代谢进展(GO:0031407),香豆素生物合成过程(GO:0009805),斯蒂尔贝烯生物合成过程(GO:0009811),肉桂酸生物合成过程(GO:0009800)和黄酮类生物合成过程(GO:0009813),其对病原体的植物抗性有关键作用[27.],专门存在于THE3的R基因型中rd.孵育后第二天(R\u T2与.r_ck2)。这表明涉及一系列脂质和次级代谢物的代谢在R基因型的复杂性过程中非常活跃,响应于黄曲霉毒素产生。同时,对R和S基因型的接种样本中的下调DEGS进行GO分析(附加文件15.). 然而,该分析未能证实从RïT1获得的下调DEGs数据中的任何一项富集与. 路1,路1与. 序号1,序号2与.r_ck2和s_t2与.s_ck2。结果表明,花生的代谢被激活答:flavus花生早期定殖-答:flavus互动过程。当比较T3和CK3时,蛋白结合(GO:0005515)和蛋白折叠(GO:0006457)是两种基因型在第7天比较下调DEGs的主要GO项第孵化后第二天。诱导防御是成本密集型的,与病原菌的接触将极大地改变寄主植物的代谢[28.,29.].在花生期间R和S基因型的基因表达中观察到巨大变化 -答:flavus相互作用。尽管如此,GO分析显示R基因型中的响应比在S.
为了进一步研究基因的生物学功能和相互作用,我们采用KEGG进行通路分析[30.].使用KOBAS 2.0分析从治疗的比较与R和S基因型的对照中获得的所有曲面都是通过KOBAS 2.0进行分析,以识别其相关的KEGG代谢途径[31.].在治疗比较与双基因型中对照的比较中有显着上调18个途径,而黄曲霉毒素的生产显着压抑37条途径(Q价值 < 0.05)(附加文件16.). 然而,KEGG代谢途径分析未能证实在R\u T3中获得的任何上调途径中的富集与.R_CK3, S_T3与.S_CK3,表明收获后花生种子中的许多代谢途径可能被大量压制答:flavus菌丝和/或黄曲霉毒素。意料之中的是,“苯丙类生物合成”、“类黄酮生物合成”、“二苯乙烯类、二芳基庚类和姜辣素生物合成”等上调途径在基因型3中富集rd.接种后的一天。该分析与先前的观察结果一致,因为真菌攻击可以影响广泛的途径,并且转录网络中的大部分基因受到影响[20.,32.–35].
对花生与黄曲霉毒素生产的防御相关基因的表达分析答:flavus
分析R和S基因型对黄曲霉毒素产生反应的表达谱答:flavus,尤其是30,143个未经过显着差异转录的未成语(附加文件11.),我们检测到842个潜在的防御相关基因,参与了对黄曲霉毒素生产的花生反应(附加文件17.).这些防御相关基因编码核苷酸结合位点 - 富氨酸富氨氨酸的重复蛋白(NBS-LRR),富含亮氨酸的重复受体样激酶(LRR-RLK),丝裂原活化蛋白激酶(MAPK),转录因子(TFS),病因相关(PR)蛋白,以及其他防御相关途径的关键因素(附加文件17.).
在本研究中确定了NBS-LRR结构域的九十次。这nbs-lrr.基因在第一次调节到第一次(1圣在R基因型中有5种表达上调nbs-lrr.在第一次点的基因型中的基因;在第二个时间点(3rd.孵化后的一天),所有nbs-lrr.基因型上调基因;大约一半nbs-lrr.R(54.84%)和S(55.56%)在第三次点上调(7第孵化后的一天)。总体而言,表达水平nbs-lrr.此外,编码几丁质酶的19个DEGs和参与凝集素代谢途径的84个DEGs的表达模式与差异表达相似nbs-lrr.s。虽然差异表达了LRR-RLK.S(143)在各比较中均出现-或下调,均有上调LRR-RLK.在两种基因型中,s均高于下调的。有趣的是,在MAPK级联反应的前两个时间点共鉴定出28个DEGs,其中6个DEGs,在第三个时间点又鉴定出22个DEGs。在第三个时间点,两种基因型均检测到2个编码细胞外信号调节激酶1/2(K04371)的上调DEG(comp90525_c1和comp77989_c0)和1个编码MAPK激酶1(K04368)的上调DEG(comp90797_c0),其表达水平在R基因型高于S基因型。另外,71ARF.S(ADP-核糖基化因子),19熏鲑鱼S(脂氧合酶)和6pgip.s(多糖呋喃酶抑制剂蛋白)在t中差异表达vs.CK,大多数人在上调后答:flavus在两种基因型中接种。与S基因型相比,10ARF.S,13熏鲑鱼年代和6pgip.S在R.中诱导较高水平。
鉴定了第五十八次编码腕式转录因子(TFS),并在两个基因型中上调所有这些。表达的数量怀疑2和21基因型的S均随培养时间的延长而逐渐增加怀疑S分别在第一和第三时间点鉴定。那些的成绩单水平怀疑S含量高于r基因型,比在βTFS,65差异表达Bzip.S被确定;但是,没有Bzip.在两种基因型中的第二个时间点被发现。二Bzip.在第一次点鉴定S,但R和S基因型之间的表达水平没有显着差异。23Bzip.R基因型的转录水平明显高于s基因型,并鉴定出67个编码乙烯应答转录因子(ERFs)的DEGs。所有ERF.S在第一次点在R或S基因型中下调。这种下调比六个在六个中更严重ERF.s在第2个时间点表达量上调,其中s基因型表达量高于r基因型的有3个,在第3个时间点表达量上调的有43个,下调的有22个ERF.共鉴定出29个基因型。
共注释86只DEG蛋白在R和S基因型中作为PR蛋白,包括PR-1,PR-2,PR-5,PR-10,PR-STH2,PR-BET VI系列和其他抗性蛋白质。编码PR蛋白BET VI系列和4℃的第三次编码PR蛋白STH2与作为PR-10作为PR-10的S.一°(Comp91631_C1)相比,R基因型的更大表达变化。虽然在第三时间点仅在S基因型中鉴定了DEG。此外,一张DEG仅作为r基因型作为PR-2,以及PR-1和PR-5基因仅在S.中鉴定出来公关与S.相比,基因诱导基因在R基因型中诱导更高水平。
研究人员发现,在黄曲霉毒素产生过程中,45种参与植物激素代谢和信号通路的DEGs(包括水杨酸(SA)、乙烯(ET)和脱落酸(ABA))上调或下调。6个DEGs参与了两种基因型的SA信号通路,其中2个(comp80400_c0和comp91788_c0)编码病原体诱导的水杨酸糖基转移酶(K13691)。值得注意的是,编码水杨酸甲基转移酶样蛋白(NM_001250193.1)的一个DEG (comp78095_c0)仅在R基因型中被发现。此外,还发现了6个参与ET信号通路的DEGs。尽管所有与et相关的deg均被下调,但大部分在R基因型中受到的抑制比s基因型更严重。2个、3个和3个DEGs分别编码ABA生物合成的关键酶:醛氧化酶(AO)、9-顺式环氧类胡萝卜素双加氧酶(NECD)和玉米黄质环氧化酶(ZEP)。AO公司,NECD公司和ZEP.在第一个时间点上调,并在r基因型中的第三次点下调。在S基因型中,表达AO公司,NECD公司和ZEP.以后对各种范围进行上调答:flavus接种。另外,对ABA 8'-羟化酶(7),ABA不敏感蛋白(3),ABA受体(6)和ABA反应元件结合蛋白(1)进行升压或下调,对编码ABA 8'-羟化酶(7),ABA相关蛋白(3)和ABA响应元件结合蛋白(1)进行相关的。在R和S花生种子中的各种范围答:flavus殖民化。
存在38只涉及植物苯丙烷衍生的化合物的生物合成。我们的分析表明,在两种基因型中,对编码苯丙氨酸氨酶(PAL),肉桂醛4-羟基(C4h)和4-豆类酸乙酯(4CL)的表达在两种基因型中进行上调答:flavus接种。PAL,C4H和4CL催化苯基丙醇衍生的化合物生物合成的前三个步骤,一般苯丙醇丙酮途径(GPP)[36].然后,GPP的产物用作不同苯丙烷丙醇衍生的化合物的前体。在r基因型中的两种基因型中鉴定了五个编码PAL,其诱导r基因型较高的基因型比S.三个朋友在R基因型的三个时间点,s(comp75395、comp81599和comp83560)均被黄曲霉毒素激活,后两个时间点表达水平的变化显著高于第一个时间点。而在S基因型的比较中,没有一个和6个基因型有差异表达朋友在前两个时间点和第三时间点分别识别S.表达差异化C4H.s(4)和4 cls(9)基因经鉴定,其表达模式与对照组相同朋友此外,我们还研究了黄酮合成途径的切入点查尔酮合成酶(chalcone synthase, CHS)和其近亲二苯乙烯合成酶(stilbene synthase, STS),二苯乙烯合成的关键酶。共有19个deg编码CHS, 3个差异表达STS.S在两种基因型中被调高。表达模式CHS.沙STS.S类似于编码GPP的关键酶的DEG。结果表明,与S诱导诱导涉及苯丙烷丙醇途径的次数,并在r基因型中较高。
讨论
花生是一个重要的经济和营养作物,是殖民化最敏感的作物之一答:flavus随后的黄曲霉毒素污染。更好地理解抗黄曲霉毒素污染的分子机制将有助于设计策略,以发展具有改善的抗性的新花生品种。转录组分析是一种重要的研究方法,因为它不仅有助于MRNA的大规模鉴定,而且还提供了进入植物生理和病理过程所涉及的基因的分子基础的见解。在本研究中,RNA-SEQ用于询问转录组答:hypogaea探讨抗性和易感基因型对黄曲霉毒素产生的反应的分子机制答:flavus. 大量的答:hypogaea在NR,NT,Swiss-Prot,Go,Kog和Kegg数据库中成功地,获得了转录组unigenes(128,725),大约一半的unigenes(62,352; 48.43%)成功注释。据我们所知,这是鉴定鉴定在收获后花生种子中涉及不同代谢途径的大量基因的第一份基因,以应对使用RNA-SEQ技术的黄曲霉毒素产生。更重要的是,这里报道的unigenes的总清洁读取和unigenes,n50值和平均长度远远大于上一篇上一个关于开发花生种子的转录组分析报告[20.,37,38].由于技术限制(例如测序深度或读取长度),在本研究中不能注释大百分比(51.57%)[39]并且没有基因组信息答:hypogaea[15.],这是所有执行德诺维转录组分析。转录组序列是有价值的资源,特别是对于没有完全测序的基因组的物种,例如栽培花生。我们的结果丰富了基因组信息答:hypogaea在公共数据库中,为采后花生种子对黄曲霉毒素产生反应的评价和理解奠定了基础。
以前的植物抗性研究答:flavus感染/黄曲霉毒素的产量主要集中在收获预收获时间过程中积极开发种子[1.,17.,20.,35,40],只有少数报告检查了收获后花生种子[41,42]. 因此,研究花生采后种子对黄曲霉毒素产生的反应,有助于全面了解花生对黄曲霉毒素污染的抗性机制。在分析的比较中,包括两种基因型的三个时间点,我们鉴定了30143个deg。在两种基因型中,治疗组与对照组的比较中,上调的DEGs明显多于下调的DEGs。此外,在每个时间点,R基因型上调的DEGs数量均高于S基因型。结果表明,黄曲霉毒素的产生激活/抑制了R和S基因型中许多基因的表达。与S基因型相比,R基因型中参与黄曲霉毒素产生防御反应的基因被激活到更高水平。
花生已经进化出复杂的防御机制来对抗病原体的入侵,例如阻止病原体的入侵和激活一系列的防御反应[22.,43].答:flavus是一种兼容寄生虫,其表现为生物术和脑梗死[44]. 植物防御兼性寄生虫的分子机制相对复杂[43]. 花生对黄曲霉毒素产生的抗性机制相当复杂,在我们的研究中,许多防御相关的DEGs在R和s基因型之间表现出转录差异。微生物病原体成功地定殖植物组织需要克服细胞壁。为此,病原体产生一系列广泛的植物细胞壁降解酶[45]. 多聚半乳糖醛酸酶(PGs)在高半乳糖醛酸的D-半乳糖醛酸残基之间切割α-(1–4)键,导致宿主组织中的细胞分离。为了对抗PGs的活性,植物部署细胞壁PGIPs,专门抑制PGs的果胶解聚活性[46].除了PGS抑制作用外,PGS和PGIP之间的相互作用促进了寡替核苷酸的形成,这是各种防御反应的elictors [47]. 我们的分析表明,所有6个差异表达pgip.S在R基因型中诱导含量高于r基因型,表明PGIPS可能在R基因型中对黄曲霉毒素产生的防御反应中发挥更大的作用。LRR-RLK,一种包含通过跨膜结构域连接到细胞内适配器结构域或激酶结构域的细胞外重复的大家信号蛋白质。48]参加各种不同的病理过程[49].大约140差异表达LRR-RLK.在花生种子中鉴定出对黄曲霉毒素产生的影响答:flavus, 还有很多LRR-RLK.S在防御反应中受到监管。FLS2是典型的模式识别受体(PRR),可以激活MAPK级联[50].植物MAPK级联参与信号传导多种防御反应,包括植物应激和防御激素的生物合成和信号,反应性氧物种(ROS)生成,气孔闭合,防御基因激活,植物素生物合成,细胞壁强化和过敏反应(HR)细胞死亡[50,51].在R基因型中的较高级别诱导Mapk级联的二十八次参与答:flavus与S。
MAPK级联的激活诱导了几种TFS和其他关键调节器诱导[15.,52].WRKY,BZIP和ERF家庭的TFS已被证明涉及植物防御响应[53[本研究分析。转录怀疑虽然众多植物物种在病原体侵袭和伤口中,S强烈而迅速上调54].将腕骨蛋白的几乎所有DEG(58)均上调,以及那些活化的表达水平怀疑S的R比与WRKY更高,BZIP蛋白质形成介导植物应激响应的超级TFS [55].此外,BZIP转录因子ATFB是抗氧化基因和参与阿凡曲霉生物合成的基因的关键球员[56].65个差异表达Bzip.S,但它们都没有编码ATFB;但是,转录水平23Bzip.ERF家族仅在植物界中发现,包括多个参与抗病途径调控的基因[57].ERF可能会参与对花生种子的黄曲霉毒素产生抗性途径的调节类似于Wrky和Bzip,因为大多数ERF.S之后显着上调答:flavus接种。此外,最重要的是ARF.S在上调后答:flavus与S的接种和10个在r中的较高水平与S.相比,ARF是属于RAS超级家庭的小GTP酶的单体GTP结合蛋白质,其调节各种生理和病理各种植物的过程[58]. 像所有的小G蛋白一样,ARFs起着分子开关的作用,在GTP和膜结合的“开”状态和GDP结合的(主要是胞质的“关”状态)之间交替[59]. ARFs还可能改变花生对黄曲霉毒素产生反应的一些靶基因的表达。
花生种子中ABA、SA和ET植物激素途径的存在与它们对黄曲霉毒素产生的反应是同步的,它们介导和引导许多胁迫响应基因,帮助植物在胁迫下存活[60].ABA被认为是抗病性的负调节因子[61,62].与先前的报道一致,ABA生产和信号通路中涉及的DEG在S基因型中的高水平表达而不是R.几乎所有生物和非生物胁迫条件都会在植物中进行ET合成[63]ET对黄曲霉毒素的合成有抑制作用答:flavuson A&M medium [64].然而,所有参与等度生产和信号通路被抑制黄曲霉毒素的生产,和他们中的大多数被压抑的一个更高的水平在R比在美国根据病原体的不同,疾病症状似乎减少或增强等,不影响,在不同的植物63].我们推导出ET可能会抑制花生抵抗黄曲霉毒素生产的能力;但是,这种扣除需要进一步确认。SA在植物中起着至关重要的作用,对一些真菌具有抑制作用[65]. 近年来的研究表明,水杨酸抑制真菌的菌丝生长和真菌毒素的产生答:flavus体外和体内[66].在两个基因型中的SA信号通路中涉及SA信号通路的六次,并且除了编码水杨酸甲基转移酶样蛋白(NM_001250193.1)外,除了Comp78095_C0之外,除了在R基因型中鉴定。该DEG可能与R基因型的电阻相关。植物激素涉及调解真菌植物的相互作用,其角色完全不同[61].与先前的报道一致,我们的转录组分析显示出在植物激素生产中涉及植物激素生产和信号传导的不同表达模式,响应于黄曲霉毒素产生。
nbs-lrr.基因是植物抗病基因中最具代表性的一类,是植物与病原菌相互作用的关键组成部分[43,67].两组nbs-lrr.基因,CC-NBS-LRR和TIR-NBS-LRR,在两种基因型中鉴定并显示一般上调答:flavus接种。我们还发现,几丁酶和凝集素生物合成中涉及的那些参与的表达模式与差异表达相似nbs-lrr.植物几丁质酶[68,69]和章节[70]被认为参与植物防御答:flavus[40,71].结果表明,NBS-LRR、几丁质酶和凝集素可能在抑制黄曲霉毒素产生中起重要作用;这些基因型在R和S基因型之间有不同的反应。POD蛋白等花生免疫调节因子[72]有助于黄曲霉毒素的产生。差异表达荚S在r相比,在S的表达中表达了显着更高的表达.POD的表达,一种氧化自由基清除酶,表明在黄曲霉毒素生产过程中r基因型中的氧化自由基更好地管理。Oxylipins在黄曲霉毒素生物合成中起重要作用[73.];13s-hpode抑制了黄曲霉毒素的产生答:flavus[1.].结果表明,编码LOXs的19个DEGs基因型中,多数表达上调,其中“亚油酸13s脂氧合酶活性”和“氧脂素生物合成过程”在R基因型中富集。LOXs可以影响黄曲霉毒素的产生[73.[13-loxs及其氧化产品可参与在收获后花生种子中对黄曲霉毒素产生的防御反应。
PR蛋白被定义为由宿主植物编码,但由各种类型的病原体(如真菌、细菌、病毒)诱导的蛋白质,以及由模拟植物病原体感染效果或诱导类似胁迫的化学物质应用的蛋白质[61,74.,75.].PR-1,PR-4和PR-10的表达诱导更高水平,以引发许多真菌挑战植物种类中的防御响应机制的快速激活,例如小麦,米,玉米,拟南芥[61,76.,77.]. 在R和S基因型中,有86个DEGs被注释为PR蛋白,包括PR-1、PR-2、PR-5、PR-10等抗性蛋白。PR-1家族是由SA和病原菌诱导的,常用作系统获得性抗性的标记[78.].PR-2系列由β-1,3-葡聚糖酶组成,催化β-1,3-葡聚糖的水解,通过水解真菌细胞壁并通过产生elictors来解决真菌防御[75.].PR-5家族包括Permatins,Zeamatins和硫甜桃样蛋白质,引起真菌血浆膜上的跨膜孔的渗透破裂[75.].PR-10蛋白小而在结构上保守,但在应力信号中具有不同的作用[75.].此外,PR-10蛋白质对玉米抗性具有阳性作用答:flavus生长和黄曲霉毒素生产[76.].
植物苯丙类化合物是苯丙氨酸衍生的一系列次生代谢产物,包括黄酮类化合物、二苯乙烯类化合物、单脂醇类化合物和各种酚酸类化合物[79.].在植物中的许多功能中,苯基丙醇化合物在抗病原体攻击中起重要作用[27.此外,黄酮类化合物和斯蒂屈剂抑制答:flavus黄曲霉毒素的开发与生产[41,80–82.之后,苯丙素生物合成途径的关键酶PAL、C4H、4CL、CHS和STS在R和S基因型中均上调答:flavus接种。参与苯丙类生物合成途径的DEGs在R基因型中诱导水平高于inS。此外,“苯丙类生物合成”、“类黄酮生物合成”、“二苯乙烯类、二芳基庚类和姜酚生物合成”等术语仅富集于R基因型。这些数据表明,苯丙类化合物的生物合成可能与收获后花生种子对黄曲霉毒素产生的抗性密切相关。确定了这些候选基因后,还需要进一步的研究来确定这些DEGs是否与R和S花生对黄曲霉毒素产生的抗性差异有关。
尽管R和S基因型花生都经历了巨大的转录调节,代表了参与抵御黄曲霉毒素产生的各种代谢过程,但更多的抗性相关的DEGs在R基因型中显著上调和富集。表明R基因型对生物胁迫具有全面而迅速的反应。这些转录调控可能最终导致抗性相关蛋白、次级代谢产物和信号分子的合成,为花生提供防御优势。需要进一步的研究来表征这些分子的生物合成及其反应的分子机制答:flavus花生中的殖民化和黄曲霉毒素生产。对黄曲霉毒素产生应力下的转录谱的综合分析将加强对抗黄曲霉毒素产生抗性的基因和代谢途径的理解,并将为未来研究花生抗黄曲霉毒素污染的分子机制的研究。
结论
在本研究中,RNA-SEQ应用于对抗黄曲霉毒素产生的抗性和易感花生转录om的全局表征答:flavus. 从采后花生种子的24个文库中,共获得128.72gb的纯碱基,组装出128725个单基因。在R和S基因型中,有大量DEGs被黄曲霉毒素激活或抑制,在每个时间点,R基因型中DEGs的表达均高于S基因型。此外,还鉴定了842个抗黄曲霉毒素的候选基因。该研究首次全面报道了采后花生种子对黄曲霉毒素产生的反应,并完善了花生基因组资源数据库。今后对响应基因的功能分析将有助于更好地理解花生抗黄曲霉毒素污染的分子机制,并有助于确定提高花生抗黄曲霉毒素污染的主要候选基因和分子标记。
方法
植物材料和处理
“中华6号”和“中华12号”种子来源于中国农业科学院油料作物研究所。实验结果表明,中华6号和中华12号均对种子入侵敏感答:flavus在收获后种子;然而,它们对黄曲霉毒素的抗性高度不同,中华6抗性和中华12易感[41].的产毒素的答:flavus从花生分离的菌株(AF2202)在CAAs-OCRI中维持在20%甘油(-80℃)中。准备这一点答:flavus从保存的样品中取AF2202分生孢子,在新鲜马铃薯葡萄糖琼脂培养基上29±1℃培养7天。收集分生孢子,悬浮于含0.05 % Tween-80的无菌水中。用血细胞计测定悬液中分生孢子的浓度。
选择R、S两个基因型的健康成熟种子进行试验。种子经70%乙醇浸泡1.0min表面灭菌,无菌蒸馏水冲洗3次,每次5.0min。在人工接种处理中,孢子悬浮液0.5ml(4.0ml) × 106.将CFU / ml)直接加入到无菌培养皿中的10.0g花生种子中。在对照中,向花生种子中加入0.5ml 0.05%Tween-80溶液。然后,将接种的样品和对照置于培养箱中并在黑暗中以29±1℃培养。根据实验的特定目的,取出种子以测试黄曲霉毒素含量(五种复制)或在孵育1至10天后提取RNA(两次复制)。
将培养后的花生种子121℃蒸压30 min, 110℃干燥60 min。冷却后,将每个实验单元的种子(10 g)细磨成粉末,用50.0 ml甲醇-水(55:45;V / V)在烧瓶中。取滤液10.0 ml,置于125 ml烧瓶中,用90 ml甲醇-水(55:45)稀释,混合后用0.45 μm有机膜过滤。将纯化后的提取物(1.0 ml)收集到玻璃管中,制备10.0 μl用于高效液相色谱(HPLC)分析[5.,82.].用荧光检测器(G1321A)的Agilent 1200 HPLC系统(USA)进行HPLC分析,分别以360nm和440nm的波长为激发和发射。在C上进行色谱分离18.柱(150mm×4.6mm,5μl粒度),具有甲醇 - 水(45:55)流动相,流速为0.7ml / min。
RNA分离及cDNA文库构建
接种的R和S基因型的种子答:flavus(治疗)和不培养的接种(对照)为1,3和7天被取样用于RNA分离和cDNA文库构建。为每个样品制备两种重复,导致24个文库,用于使用Illumina Bioinformatics技术有限公司(北京)的Illumina Hiseq2000系统进行转录体测序。(北京,中国)。
根据制造商的协议,使用RNEasy®植物迷你套件(QIAGEN)分离出收获后花生种子的总RNA。用无RNase的DNase I处理所有RNA样品。使用Nanodrop®2000分光光度计,Qubit®Ullowometer2.0和Agilent 2100生物分析仪检查汇集总RNA的浓度和完整性,以确认所有样品所有样品都有RNA完整性数字大于6.5。通过先前的方法进行RNA质量检测,cDNA文库构建和illumina深度测序[15.,18.–20.].
数据过滤和从头组装序列
fastq格式的原始数据(Raw reads)首先使用内部perl脚本进行处理。然后通过数据处理步骤过滤原始数据,通过一个包括移除适配器、包含poly-N的读取和低质量读取的过程来生成原始的干净数据。感染病毒的样本答:flavus,原始清洁数据包含一定数量的答:flavus的转录组数据。所有配对结束清洁读数都与参考基因组对齐答:flavus使用Tophat(V2.0.7)与“不匹配2”作为参数[83.的转录组数据答:flavus过滤出并获得清洁数据答:hypogaea.计算Q20、Q30、GC含量和序列重复水平,所有下游分析均采用高质量的清洁数据。在生成干净数据后,进行装配答:hypogaea参考基因组使用Trinity软件进行处理,min_kmer_cov设置为1,其他参数设置为默认值[84.].
unigenes的功能注释
功能注释采用Nr、Nt、KOG、Swiss-Prot、pam、GO、KO七个数据库对组装的unigenes进行注释。unigenes在Nr、Nt和Swiss-Prot数据库中使用NCBI blast 2.2.28+进行注释,e值为1.0 × 10−5.,并使用NCBI Blast 2.2.28+在Kog数据库中注释,E值为1.0×10−3..应用KAAS(RL40224)以将ko数据库中的unigenes注释为1.0×10的截止e-value−10[85.].使用HMMSCAN(HMMER 3)在PFAM数据库中注释的unigenes,E值为0.01 [86.].此外,未使用BLAST2GO(B2G4PIPE_V2.5)分配了unigenes的GO注释,E值为1.0×10−6.[87.].
表达分析与富集分析
使用RNA-SEQ具有预期最大化(RSEM)(RSEM-1.2.0)方法的RNA-SEQ估计基因表达水平[24.].使用Bowtie(不匹配2)建造组装参考基因组的指数,并且使用RSEM将每个文库的清洁读数与组装的参考基因组对齐。然后,RSEM将读数的读数映射到每个基因。然后,基于基因的长度来计算每个基因的FPKM,并读取映射到它的读数[83.].
使用DESEQ R包(1.12.0)进行两个样品的差异表达分析。DESEQ提供统计数据以使用基于负二项式分布的模型来确定基因表达数据中的差异表达。所结果的P使用Benjamini和Hochberg的方法调整值来控制虚假发现率。在这项研究中,用调整的unigenesP(Q)Deseq发现的值<0.05被认为是差异表达的[25.].
利用基于Wallenius非中心超几何分布的GOseq R包对DEGs进行GO富集分析[26.],它可以调节基因长度偏置在DEG中。纠正的条款P(Q)值<0.05被认为在DEG中显著富集。KEGG路径数据库记录了细胞中分子相互作用的网络和特定生物的变体,分子信息主要来自基因组测序和其他高通量实验技术产生的大规模分子数据集[30.].Kobas(v2.0.12)软件用于丰富Kegg途径中的DEGS [88.].纠正P(Q)值<0.05是本研究中显着富集Kegg途径的阈值。
存在分析
验证通过RNA-SEQ获得的基因表达数据的可重复性和再现性答:hypogaea,我们随机选择了20个未通过QRT-PCR验证的Unigenes,如前所述[15.,18.–20.].没有的独立RNA;没有答:flavus为QRT-PCR分析制备在29±1℃下孵育1,3和7天的R和S基因型接种。如上所述进行RNA提取和质量控制。基因特异性底漆对(附加文件8.)根据20个基因的序列设计,使用在线可用的Genscript实时PCR引物设计程序(https://www.genscript.com/ssl-bin/app/primer.).为了确保准确性,每个引物在同一板上进行三种复制,具有阴性对照,缺少模板cDNA以检测非特定产品。在三份孔中和三次重复实验中测试候选基因。使用2计算基因的相对表达水平-ΔΔct方法 [89.,90.],代表cT(循环阈值)参考之间的差异施基因和靶基因产物[15.].
提供支持数据的可用性
本研究产生的测序数据已存入NCBI的Short Read Archive database (SRA,http://www.ncbi.nlm.nih.gov/Traces/sra_sub/sub.cgi),并可通过SRA系列登录号SRP061959(生物工程编号:PRJNA291797)获取。
参考文献
- 1。
Torres Am,Barros Gg,Palacios SA,Chulizs Sn,Battilani P.综述花生预先收获后和收获后管理,以最大限度地减少黄曲霉毒素污染。食物res int。2014; 62:11-9。
- 2。
Bhatnagar Mathur P、Sunkara S、Bhatnagar Panwar M、Waliyar F、Sharma KK。防治疟疾的生物技术进展曲霉菌曲藤和作物中的黄曲霉毒素污染。植物SCI。2015; 234:119-32。
- 3.
梁X,罗M,郭B。抵抗机制曲霉菌曲藤PEANUT中感染和黄曲霉毒素污染(arachis hypogaea.).植物Pathol J. 2006; 5(1):115-24。
- 4.
郭b,陈z-y,lee rd,scully bt。农业商品中的干旱压力和预磷酸毒素污染:遗传学,基因组学和蛋白质组学。J Intent Plant Biol。2008; 50(10):1281-91。
- 5.
丁X、李平、白Y、周H。中国花生采后黄曲霉毒素b1与膳食风险。食物控制。2012;23(1):143–8.
- 6.
Passone MA, Ruffino M, Ponzio V, Resnik S, Etcheverry MG。花生采后防治aspergillus.Flavi群通过配方的食品级抗氧化剂。int J食物微生物。2009; 131(2-3):211-7。
- 7.
Probst C,Schulthess F,Cotty PJ。的影响aspergillus.肯尼亚玉米黄曲霉毒素致死水平发展的黄曲霉群落结构(玉米).J appl microbiol。2010; 108(2):600-10。
- 8。
Williams JH,Phillly Td,Jolly Pe,山坡JK,Jolly Cm,Aggarwal D.发展中国家的人类早熟病毒:毒理学,暴露,潜在的健康后果和干预措施。AM J Clin Nutr。2004; 80(5):1106-22。
- 9。
龚Y,Hounsa A,Egal S,Turner PC,Sutcliffe AE,Hall AJ,Cardwell K,Wild CP。后期暴露于黄曲霉毒素导致儿童增长受损:西非贝宁的纵向研究。环境健康持态度。2004; 112(13):1334-8。
- 10。
Turner PC,Moore SE,Hall AJ,Prentice AM,Wild CP.《冈比亚儿童通过食用黄曲霉毒素对免疫功能的影响》。环境卫生展望。2003;111(2):217–20.
- 11.
关键词:黄曲霉毒素,玉米,棉籽,抗病性毒素。2011;3(6):678 - 96。
- 12.
Nigam SN、Waliyar F、Aruna R、Reddy SV、Kumar PL、Craufurd PQ、Diallo AT、Ntare BR、Upadhyaya HD。ICRISAT花生抗黄曲霉毒素污染育种。花生科学。2009;36(1):42–9.
- 13。
王Z,延S,刘C,陈F,王T.蛋白质组学分析显示了子叶中的黄曲霉毒素引发的免疫应答arachis hypogaea.感染了曲霉菌曲藤.J蛋白质组。2012; 11(5):2739-53。
- 14
张HL,Scharfenstein L,张DH,Chang PK,Montalbano BG,Guo Bz,Meng XJ,Yu JJ。花生抗性基因表达响应于曲霉菌曲藤种子萌发过程中的感染。J植物疗法。2015; 163(3):212-21。
- 15
陈y,ren x,周x,huang l,yan l,雷y,廖b,黄j,黄s,威W.抗性和易感花生的动态(arachis hypogaea.L.)Root转录组对Ralstonia Solanacearum感染的影响。BMC基因组学。2014; 15:1078。
- 16
朱武,陈X,李H,朱福,洪y,沃尔斯尼rk,梁x。空中与地下豆荚的比较转录组分析为花生种子流产的见解提供了洞察力。植物mol biol。2014; 85(4-5):395-409。
- 17
Geng L,Duan X,Liang C,Shu C,Song F,张J.从花生挖掘组织特异性葡萄酒(arachis hypogaea.L.)通过深度转录组测序克隆的启动子克隆。植物细胞生理。2014; 55(10):1793-801。
- 18。
花生快速诱导应答基因的鉴定(arachis hypogaea.)、水分亏缺和脱落酸。生物科技BMC》。2014;58。曾
- 19。
尹d,王y,张x,李h,卢x,张j,张w,陈s。德诺维装配花生(arachis hypogaea.L.)种子转录组显示出用于油累积途径的候选人未来。Plos一个。2013; 8(9):E73767。
- 20.
Guimaraes PM、Brasileiro ACM、Morgante CV、Martins ACQM、Pappas G、Silva Junior OB、Togawa R、Leal Bertioli SCM、Araujo ACG、Moretzsohn MCM。干旱和真菌侵染下花生两个野生近缘种的全转录组分析。BMC基因组学。2012;13:387.
- 21.
McGettigan PA.《RNA序列时代的转录组学》。当前化学生物。2013;17(1):4–11.
- 22.
霍尔布鲁克CC,缠扰者HT。花生育种和遗传资源。植物品种rev.2003; 22:297-356。
- 23.
Trapnell C,Williams Ba,Pertea G,Mortazavi A,Kwan G,Van Baren MJ,Salzberg SL,Wold BJ,RNA-SEQ的成绩单组件和定量揭示了细胞分化期间未经发布的转录物和同种型切换。NAT BIOTECHNOL。2010; 28(5):511-5。
- 24。
Li B,杜威CN。RSEM:具有或不具有参考基因组的RNA-SEQ数据的准确转录物定量。BMC生物信息学。2011; 12(1):323。
- 25。
安德斯,休伯W。序列计数数据的差分表达式分析。基因组生物学。2010;11(10):R106。
- 26。
年轻MD,Wakefield MJ,Smyth GK,Oshlack A. RNA-SEQ的基因本体分析:选择偏差。基因组Biol。2010; 11:2。
- 27。
Naoumkina MA、Zhao Q、Gallego Giraldo L、Dai X、Zhao PX、Dixon RA。苯丙素防御途径的全基因组分析。植物病理学。2010;11(6):829–46.
- 28。
Swarbrick PJ,Schulze Lefert P,Scholes法学博士。大麦叶片对白粉病敏感性和抗性(小种特异性和广谱性)的代谢结果。植物细胞环境。2006;29(6):1061–76.
- 29。
你好,BOSTOCK酒店。植物对病原菌的诱导系统抗性(ISR)安Bot-London。2002年,89(5):503 - 12所示。
- 30.
Kanehisa M,Araaki M,Goto S,Hattori M,Hirakawa M,Itoh M,Katayama T,Kawashima S,okuda S,Tokimatsu T. Kegg,用于将基因组联系起来的生命和环境。核酸RES。2008; 36 SOPL 1:D480-4。
- 31.
谢C,毛泽东,黄家,丁Y,吴家,董S,孔L,高G,Li Cy,Wei L. Kobas 2.0:用于注释和鉴定富集途径和疾病的网络服务器。核酸RES。2011; 39(SUP):W316-22。
- 32.
Asters MC、Williams WP、Perkins AD、Mylroie JE、Windham GL、Shan X。差异表达基因与免疫应答的关系及意义曲霉菌曲藤感染玉米。Sci Rep-UK。2014; 4:4815。
- 33.
王T,陈XP,李HF,刘清,洪YB,杨QL,奇XY,杨Z,yu Sl,Li L.转录组鉴定抗性相关基因(rags)对预收获花生的曲霉感染(arachis hypogaea.).Funct植物Biol。2013; 40(3):292-303。
- 34。
Dolezal Al,Obrian Gr,Nielsen DM,Woloshuk Cp,波士顿Rs,Payne Ga。本地化,形态和转录概况曲霉菌曲藤在种子殖民期间。莫尔植物途径。2013; 14(9):898-909。
- 35。
郭B,陈X,Dang P,Scully Bt,Liang X,Holbook CC,Yu J,Culbreth AK。在不同再生阶段的种子中发展种子的花生基因表达剖析曲霉属真菌寄生感染。BMC开发生物。2008;8:12.
- 36。
沃格特T。苯丙烷生物合成。摩尔植物。2010;3(1):2–20.
- 37。
陈X,朱W,Azam S,李H,朱F,李H,张E,吴H.花生空中和地下幼儿转录组的深度测序分析识别与早期胚胎堕胎相关的候选基因。植物Biotechnol J. 2013; 11(1):115-27。
- 38
张杰,梁S,段J,王J,陈S,程Z,张Q,梁X,李Y。花生种子发育过程中转录组的从头组装和鉴定及基因SSR标记的产生(arachis hypogaea.L.)。BMC基因组学。2012; 13:90。
- 39
Long Y, Zhang J, Tian X, Wu S, Zhang Q, Zhang J, Dang Z, Pei X. De novo assembly of the desert tree Haloxylon ammodendron (C. A. Mey.) based on RNA-Seq data provides insight into drought response, gene discovery and marker identification. BMC Genomics. 2014;15:1111.
- 40。
Coulombe Ra,Hawkins LK,Mylroie Je,Oliveira Da,Smith Js,Ozkan S,Windham GL,Williams WP,Warburton ML。玉米逐胰酶基因的表征及其影响曲霉菌曲藤以及黄曲霉毒素积累抗性。《公共科学图书馆•综合》。2015;10 (6):e0126185。
- 41。
王H,黄杰,雷Y,燕L,王S,江H,仁X,娄q,廖b。白藜芦醇含量与抗黄曲霉毒素累积的关系曲霉菌曲藤在花生种子。Acta Agron Sin。2012; 38(10):1875-83。
- 42。
Tsitsigiannis di,Kunze S,Willis Dk,Feussner L,Keller NP。aspergillus.感染抑制花生13s-hPode的种子脂氧基酶的表达。Mol植物微生物相互作用。2005; 18(10):1081-9。
- 43。
Yan Z,Thomas L,Mingliang X.植物抗病原体的遗传和分子基础。j遗传学基因组学。2013; 40(1):23-35。
- 44.
Amaike S, Keller NP。曲霉菌曲藤.在:Vanalfen NK,Bruening G,Leach JE,编辑。Annu Rev Phytopathol,Vol。49. 2011. p。107-33。
- 45.
Kalunke RM,Tungo S,Benedetti M,Cervone F,De Lorenzo G,D'Ovidio R.更新有关多肢乳糖醛酸酶抑制蛋白(PGIP)的更新,富含幼亮的重复蛋白,可保护作物植物对抗病原体。前植物SCI。2015; 6:146。
- 46.
Federici L,Di Matte A,Fernandez-RecoJ,Tsernoglou D,Cervone F. polygalactulonase抑制蛋白质:植物的球员天生免疫力?趋势植物SCI。2006; 11(2):65-70。
- 47.
法拉利S,Savatin DV,Sicilia F,Gramegna G,Cervone F,De Lorenzo G. Oligogalacturonides:植物损伤相关的分子模式和增长和发展调节因素。前植物SCI。2013; 4:49。
- 48。
Mitra SK, Chen R, Dhandaydham M, Wang X, Blackburn RK, Kota U, Goshe MB, Schwartz D, Huber SC, Clouse SD。中富含亮氨酸重复受体样激酶的自磷酸化位点数据库拟南芥.工厂J. 2015; 82(6):1042-60。
- 49。
Park S,Moon J-C,Park YC,Kim J-H,Kim DS,Jang CS。富含水稻亮氨酸的重复受体激酶(LRR-RLK)基因对非生物胁迫的响应的分子解剖。J植物理性。2014; 171(17):1645-53。
- 50。
徐杰、张S。丝裂原活化蛋白激酶在植物生长发育信号转导中的级联作用。植物科学趋势。2015;20(1):56–64.
- 51。
孟X,张S. Mapk患有植物疾病抵抗信令的瀑布。Annu Rev phytopathol。2013; 51:245-66。
- 52。
Pandey SP,SOMSSICH IE。Wrky转录因子在植物免疫中的作用。植物理性。2009; 150(4):1648-55。
- 53。
SEO E,Choi D.基因组学时植物防御中涉及的转录因子的功能研究。简短的Funct基因组学。2015;14(4):260-7.
- 54.
Ulker B,Somssch IE.WRKY转录因子:从DNA结合到生物功能。植物生物学。2004;7(5):491–8.
- 55.
ZG E,张YP,周耶,王L. Bzip基因家族在水稻中的角色。genet mol res。2014; 13(2):3025-36。
- 56.
Hong S-Y, Roze LV, Linz JE。氧化应激相关转录因子对次生代谢的调控。毒素。2013;5(4):683 - 702。
- 57.
Licausi F、Ohme Takagi M、Perata P。无花瓣/乙烯反应因子(AP2/ERF)转录因子:应激反应和发育程序的介质。新植物醇。2013;199(3):639–49.
- 58。
克劳斯王。PARPs和adp -核糖基化:50年…计数。摩尔细胞。2015;58(6):902 - 10。
- 59。
Pelletan LE, Suhaiman L, Vaquer CC, Bustos MA, De Blas GA, Vitale N, Mayorga LS, Belmonte SA。ADP核糖化因子6 (ARF6)通过调节脂质转换和rab3A活化促进顶体胞排。生物化学杂志。2015;290(15):9823-41。
- 60
Bari R,Jones J.植物激素在植物防御反应中的作用。植物mol biol。2009; 69(4):473-88。
- 61
Xin M,王X,彭H,姚y,谢C,韩y,镍锌,孙Q.t转录组族敏感和抗性小麦响应粉状霉菌感染的转录组比较。基因组学蛋白质组学生物信息学。2012; 10(2):94-106。
- 62。
摘要/ abstract摘要:脱落酸在植物-病原互作中起着重要的调节作用。植物杂志。2009;150(4):1750 - 61。
- 63。
Bleecker AB,Kende H.乙烯:植物中的气态信号分子。Annu Rev Cell Dev Biol。2000; 16:1-18。
- 64。
黄杰克,江赫赫,周悉,雷y,王度,辽bs。乙烯抑制过敏毒素生物合成是由于氧化应激缓解和与谷胱甘肽氧化还原状态的变化有关曲霉菌曲藤. 国际食品微生物杂志。2009;130(1):17–21.
- 65。
Seyfferth C,Tsuda K.水杨酸信号转导:生物合成,感知和转录重编程的启动。前植物SCI。2014; 5:697。
- 66。
Panahirad S,Zaare Nahandi F,Mohammadi N,Alizadeh Salteh S,Safaie N。水杨酸对大鼠心脏的影响曲霉菌曲藤感染和黄曲霉毒素B-1在开心果中积累(Pistacia Vera.l .)水果。中国农业科学,2014;94(9):1758-63。
- 67。
顾lj,si wn,zhao ln,yang sh,张诗。B面包小麦及其祖细胞中NBS-LRR基因的动态演变。Mol Genet基因组学。2015; 290(2):727-38。
- 68.
克利都J,巴拉苏伯拉曼尼亚V,瓦希斯特D,萨基维勒N。植物几丁质酶的转基因表达增强抗病性。生物技术公司。2013;35(11):1719–32.
- 69.
Singh HR,Deka M,Das S.增强了转基因茶中的抗水疱枯萎病(山茶花Sinensis.)通过来自马铃薯的类胰蛋白酶基因的过度表达(s奥兰姆汤伯乌斯).Funct综合基因组学。2015; 15(4):461-80。
- 70。
Dang L,Van Damme EJM。植物中有毒蛋白质。Phytochem。2015; 117:51-64。
- 71。
鸡血藤凝集素(Lectin from spatholobus parviflorus)具有抑制作用曲霉菌曲藤-淀粉酶:酶动力学和热力学研究。化学生物药物。2014;84(1):116–22.
- 72。
鳃SS,Tuteja N.作物植物中非生物胁迫耐受性耐受性氧气和抗氧化机械。植物理性生物化学。2010; 48(12):909-30。
- 73。
闫S,梁Y,张俊,陈Z,刘C-m。自动氧化的亚麻酸抑制了黄曲霉毒素生物合成曲霉菌曲藤通过奥氧哌林种。真菌遗传学Biol。2015; 81:229-37。
- 74。
SEL J,Mathys J,De Coninck Bma,Cammue BPA,De Bolle MFC。植物发病机制相关(PR)蛋白:对PR肽的关注。植物理性生物化学。2008; 46(11):941-50。
- 75。
发病机制相关-10蛋白体积小,结构相似,但在应激信号传导中起着不同的作用。Mol Biol rep 2014;41(2): 599-611。
- 76。
陈志勇,布朗RL,柯达曼,陈志勇。PR10在玉米中的表达及其对寄主抗虫性的影响曲霉菌曲藤感染和黄曲霉毒素生产。莫尔植物途径。2010; 11(1):69-81。
- 77。
关键词:玉米,核致病相关蛋白,玉米,抗病性曲霉菌曲藤感染和黄曲霉毒素生产。植物疗法。2006; 96(1):87-95。
- 78.
Mitsuhara I,Iwai T,Seo S,燕川哇,kawahigasi h,Hirose s,Ohkawa Y,Ohashi Y. 12米PR1家族基因的特征表达响应病原体感染,伤害和国防相关信号化合物(121/180).Mol Genet基因组学。2008; 279(4):415-27。
- 79.
刘杰,奥斯本A,马普。MYB转录因子作为植物苯丙酸代谢的调节因子。摩尔植物。2015;8(5):689–708.
- 80
诺顿RA。黄曲霉毒素B-1生物合成的抑制曲霉菌曲藤通过花青素和相关的黄酮类化合物。JAgric Food Chem。1999; 47(3):1230-5。
- 81
Delucca II AJ,Palmgren Ms,Daigle DJ。通过花生壳的黄酮类化合物产生黄曲霉毒素的抑制。植物疗法。1987年; 77(11):1560-3。
- 82
王亨,雷y,yan ly,cheng k,dai xf,wan ly,guo w等。转录om的深度测序分析曲霉菌曲藤对白藜芦醇有反应。BMC微生物学。2015;15
- 83
Trapnell C,Pachter L,Salzberg SL。Tophat:发现带RNA-SEQ的接头连接点。生物信息学。2009; 25(9):1105-11。
- 84
Grabherr Mg,Haas Bj,Yassour M,Levin JZ,Thompson Da,Amit I,Adiconis X,Fan L,Raychowdhury R,Zeng Q等。来自RNA-SEQ数据的全长转录组件没有参考基因组。NAT BIOTECHNOL。2011; 29(7):644-52。
- 85
Moriya Y, Itoh M, Okuda S, Yoshizawa AC, Kanehisa M. KAAS:一个自动基因组注释和路径重建服务器。核酸研究2007;35增刊2:W182-5。
- 86。
Punta M,Coggill PC,Eberhardt Ry,Mistry J,Tate J,Boursnell C,Pang N,Forslund K,Cercer G,Clate J.PFAM蛋白质数据库。核酸RES。2012; 40(D1):D290-301。
- 87。
Götzs,García-gómezJM,Terol J,Williams Td,Nagaraj Sh,Nueda MJ,Robles M,TalónM,Dopazo J,Conesa A.高吞吐功能注释和使用Blast2Go套件的数据挖掘。核酸RES。2008; 36(10):3420-35。
- 88。
毛XZ,Cai T,Olyarchuk JG,Wei LP。使用Kegg orthology(Ko)作为受控词汇的自动基因组注释和路径识别。生物信息学。2005; 21(19):3787-93。
- 89。
Livak KJ,Schmittgen TD。实时定量PCR的相对基因表达数据分析及2( - Delta Delta C)方法。方法。2001; 25(4):402-8。
- 90。
pfaffl mw。实时RT-PCR中相对量化的新数学模型。核酸RES。2001; 29(9),E45。
致谢
本研究由中国国家基础研究计划(2013CB127803和2011CB109304),中国国家高科技研发计划(2013AA102602),中国国家自然科学基金(No.31371662和31461143022)。中国农业研究系统(CARS-14)。
作者信息
从属关系
相应的作者
附加信息
利益争夺
作者声明他们没有相互竞争的利益。
作者的贡献
HMW构思,设计和执行实验,分析和解释了结果,并写了稿件。BSL,YL和LYW构思和设计了实验。Lyy协助培养和接种A. Flavus。JWL和XPR助攻黄曲霉毒素含量测试。HFJ,WG和XFD分别纠正了书面的背景,结果和分离。所有作者都已经阅读并赞成最终的手稿。
其他文件
额外的文件1:
原始读取的分类。原始读数包括清洁读取(紫色),适配器序列(绿色),含有未定义的核苷酸(N's)(黄色),以及由Illumina RNA测序产生的低质量读取(橙色)(RNA-SEQ)。(RAR 1485 KB)
额外的文件2:
未成年人和转录物的长度分布。(a)转录长度分布;(b)未成分长度分布。(RAR 97 KB)
额外的文件3:
Go,Kog和Kegg组装unigenes的分类摘要。(XLSX 32 kb)
附加文件4:
每个库中唯一映射读取的摘要。(XLSX 10 KB)
附加文件5:
每个图书馆中的未成语表达的分布。negs:每个图书馆中表达的未成年人数。nsegs:每个图书馆中专门表达的未成年人的数量。(docx 17 kb)
附加文件6:
所有unigenes的FPKM值统计分析。(XLSX 16479 KB)
附加文件7:
Pearson样品之间的相关分析。(RAR 473 KB)
附加文件8:
用于使用QRT-PCR验证基于FPKM的表达数据的基因的引物信息。(XLSX 10 KB)
附加文件9:
RNA-SEQ的基于FPKM的unigenes表达的定量实时PCR验证。注意:RE表示QRT-PCR的unigenes的相对表达水平。(RAR 18 KB)
附加文件10:
差异表达基因的比较分析。(DOCX 16 kb)
附加文件11:
在每次比较中差异表达的单基因分析和注释。(XLSX 16087 KB)
附加文件12:
控制中deg的数量答:flavus接种花生种子的样品。每个圆形显示一个样本或比较中的°的数量。两个样本或比较之间的°的数量显示在重叠区域中。(RAR 118 KB)
附加文件13:
在花生种子中差异表达的unigenes的分层聚类。蓝带、白带和红带分别表示低、中、高基因表达量。(RAR 2787 kb)
附加文件14:
花生种子的两个生物学复制中的DEG的分层聚类。A,B和C分别显示了三个培养时间点的分层聚类分析结果。蓝带、白带和红带分别表示低、中、高基因表达量。(RAR 110 KB)
附加文件15:
当花生种子对黄曲霉毒素产生的产生时,差异表达基因的功能性富集分析A. Flavus。(XLSX 78 KB)
附加文件16:
花生种子对黄曲霉毒素产生反应的KEGG途径富集分析A. Flavus。(XLSX 12 KB)
附加文件17:
花生防御相关基因对黄曲霉毒素产生的表达分析A. Flavus。(XLSX 373 kb)
权利和权限
开放访问本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/)如果您向原始作者和源给出适当的信用,则允许在任何介质中进行不受限制的使用,分发和再现,提供指向Creative Commons许可证的链接,并指示是否进行了更改。Creative Commons公共领域奉献豁免(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
王洪,雷勇,万磊。等。花生收获后抗病和易感种子对黄曲霉毒素产生反应的比较转录谱分析曲霉菌曲藤.BMC植物生物学16,54 (2016). https://doi.org/10.1186/s12870-016-0738-z
收到了:
认可的:
发表:
关键词
- arachis hypogaea.
- 收获后抗性
- 黄曲霉素的生产
- 转录组