摘要
背景
从营养成分中的营养成分(SAM)的过渡到植物开发中的关键事件,对生殖成功至关重要。在常年植物中,这种事件在树生活期间复发,受到树内和多年来的异质性。在本研究中,我们的目标是识别参与镇压或诱导成年苹果树的顶部芽的候选过程。
结果
利用qRT-PCR和微阵列分析方法,分别检测了人工设置在“ON”或“OFF”状态下和大多数芽中花诱导被抑制或诱导的树木之间的基因差异表达(GDE)。从FI到花的分化,GDE主要属于4个主要的生物学过程:(1)对刺激的响应,包括对氧化应激的响应;(ii)细胞过程,(iii)细胞壁生物发生,(iv)代谢过程,包括碳水化合物生物合成和脂质代谢过程。特别是几个关键的调节基因丹魄(TEM),花的过渡在分生组织(FTM1),Squamosa启动子结合蛋白样(SPL)被发现差异表达。而且,同源物SPL和Leucine-Rich Repeat蛋白存在于之前检测到的两年生产物QTL区。
结论
这组数据表明,由于代谢、激素和氧化还原状态的不同,“ON”和“OFF”树的顶端芽处于不同的生理状态,这可能有助于成年苹果树的FI控制。通过对来源到SAM的碳水化合物和激素通量以及细胞解毒过程的研究,有望进一步有助于确定成年苹果FI的潜在生理机制。
背景
在高等植物中,开花的转变是在环境和内源刺激的控制下发生的,这些刺激可分为几个部分重叠的遗传途径[60.那103].在拟南芥蒂利亚纳结果显示,所有途径的最终输出都集中在分生组织中有限数量的促花蛋白上,特别是那些由基因编码的蛋白开花轨迹T(英国《金融时报》),铜的过度表达抑制剂1(SOC1)[41那58.那82].这些蛋白质激活花分生组织特性基因,如多叶的(LFY),APETALA1(AP1),其反过来激活负责花器官分化的花卉归属基因[48那58.那80].然而,花的转变可以被花的阻遏因子如终端FLOWER1(TFL1),FT和TFL1的兄弟(BFT),它抑制LFY和AP1[10那60.那61.那96那117].此外,涉及的法规英国《金融时报》压缩机已突出显示拟南芥在长日(LD)或无感条件下生长。花卉阻遏蛋白,特别是营养期短(高级副总裁),开花轨迹C(FLC.),丹魄(TEM1和TEM2),已被证明与之相互作用君士坦斯(CO.) -英国《金融时报》遗传途径,以确定花卉过渡的最佳定时,取决于日间长度和温度[83那91].TEM1和TEM2可以调节英国《金融时报》在发展过程中变化的程度的表达[45那86].另外,两种高度保守的microRNAs (miRNAs),miR156和miR172[76.那112)目标Squamosa启动子结合蛋白样(SPL)家族转录因子,促进从少年期向成年期过渡杨树[110和主要的花抑制因子AP2-like转录因子家族基因[118),分别。其他与年龄相关的途径直接涉及碳水化合物[108]或与光周期相结合[62.].此外,植物的氧化还原状态与它对环境的感知有关,并通过新陈代谢的重编程来控制植物的生长和发育,可能也参与到花的转变的控制中[8.那49].
虽然一年生植物和多年生植物的开花生物学有一些基本的差异,但在模式植物中获得的知识可用于检测多年生植物开花的控制[One hundred.].由于它们对园艺产业具有巨大的经济重要性,许多研究有助于解释苹果和模型树种杨树的开花过程(回顾见[12那35那56.那111])。一组与已知开花基因序列相似的基因拟南芥在苹果树上也有类似的功能[26那28那36那44那50.-55.那67.那68.那94那95那105那107那115那116].此外,通过敲除或过于表达的花卉或花卉 - 阻遏物基因成功降低了树幼年相(例如[99[])和10个开花基因在苹果顶端芽中的时间表达表明它们可能在FI和花器官发育中起核心作用[36].然而,这些研究侧重于与少年到成熟树的过渡和开花日期的季节性控制相关的开花相关的方面。
虽然开花在常年植物中连续血液复发,但它只发生在每个生长周期中的芽的子集中[111].在苹果中,所有轴的顶芽都可能形成花序。它们在休眠的混合芽中保持预制状态,其中包括叶原基、花序和腋生枝的第一个原基([21那31])。携带花序的短的预先形成的生长单元通常称为栓子及其腋生会生枝,栓子枝。尽管在不同品种中这一点可能有所不同,但组织学观察和mRNA转录分析一致认为,FI发生在开花后39 - 53天的短枝顶端芽中,而与花芽起始时间相对应的形态变化大约开始于开花后60天[13那23那29那35那53.].然而,花的转变只有在轴的营养发育完成后才会发生,其时间取决于轴的类型和在树中的位置[19].无论它们的树内情况如何,花芽和花芽都发生在春季或夏季,即长日(LD)和高温下,而果实发育仍在进行。果实和营养生长通常被认为是负相关的[47]和FI被同时结实强烈抑制。这可能导致二年生,这一术语指的是树木每年有一个不规则的作物负荷。“开”年的特点是产量显著,其次是“关”年,特点是产量低。' OFF '年份的低产量通常是由于没有成花而不是结实果不好[47那69.那89].因此,双年轴承是在许多果实树中观察到的问题,似乎是FI而不是花卉分化的问题。
因此,果树物种连续季节间的花的转变仍然知之甚少,触发或抑制花形成的生理过程仍然有待鉴定。在柑橘中,已经比较了结果树和结果树的基因和蛋白质谱,这表明参与初级代谢和氧化还原状态的蛋白质在叶子中表达的差异取决于果实载量[70].此外,果实处理后,光合基因和依赖钙的IAA转运在' OFF '柑橘树中迅速被诱导[87].在芒果中,自主GA途径似乎参与两年生结果和开花控制[71.那77.].
在本研究中,我们的目的是研究参与成年苹果树顶端芽FI的生物学过程。为了达到这一目的,我们对处于“开”或“关”状态的树进行了操作,并假设它们的顶芽更有可能在抑制或诱导条件下。然后,我们利用微阵列分析,研究了果实的存在对成年苹果幼苗顶端芽花过渡相关基因差异表达的影响。利用qRT-PCR (Quantitative Reverse Transcription PCR, qRT-PCR)研究了在FI和花分化的关键时期,‘ON’和‘OFF’树关键开花基因的相对表达量,并验证了基因芯片的有效性。这项研究强调了在成年苹果树中更容易开花的芽之间的不同调控过程。这些过程中有多少实际上调控开花仍然是一个有待进一步研究的问题。
方法
植物材料
16岁的老树马吕斯x家庭按照正常的商业惯例,“Gala”(克隆的“银河”)是在法国CEHM实验站(马西里尔实验中心)种植的。一组五棵树被设置在“关闭”的情况下,完全手工在盛开的树中拔光。另一组五棵没有人工或化学稀释的树木被选中,以创建一个“开启”的情况。在交易所的芽刺的末端位置取样,在' OFF '树上不结果,或从交易所携带至少一个果实在' on '树上。在我们的条件下,充分开花发生在2010年4月14日。在2010年4月至8月的上午10点至12点,即15日、28日、48日、77日和119日进行了5次收获,对应于以下手稿中的118日、131日、151日、180日和222日。这一时期被认为包括花的诱导、起始和距顶端芽花分化的早期开始[29].每次治疗的四棵树和每棵树的三个芽在每个收获日期都被取样(附加文件1:图S1)。从顶芽中分离SAM并立即在液氮中冷冻。采用qRT-PCR对5个时间点上的3棵树和3个芽进行mRNA分析。通过对关键开花基因的qRT-PCR分析,筛选出5个月中的3个月。在每一个日期,从四棵取样树中提取的三个芽被用于微阵列分析(附加文件1:图S1)。
在春季萌芽后(2011),观察到开花终端芽的比例。返回绽放的特征在于侧面分支,这取决于所应用的处理,即.“开”和“关”树。以2010年常规疏伐的树木作为对照,评估采伐与不疏伐处理的效果。每个处理观察到5棵树,每棵树有132至344个顶芽。
RNA提取和定量
根据制造商的说明,使用NucleoSpin®RNA II ' RNA试剂盒(machery - nagel GmbH & Co. KG, Düren,德国)从单个顶端芽中提取总RNA,包括在色谱柱上进行DNA消化。使用Infinite®200 PRO NanoQuant (Tecan Trading AG, Männedorf,瑞士)对总RNA进行定量,使用安捷伦2100生物分析仪(RNA完整性号> 7)(安捷伦技术,圣克拉拉,美国)控制RNA质量。
qRT-PCR分析RNA
先前在苹果中表征的三个关键开花基因被用作QRT-PCR研究的开花过渡的分子标记物(MdTFL1那MdAP1a和MdAP1b)[50.那53.].随着MdFT1那MdFT2那AFL1和AFL2,这些基因使我们能够将我们的结果与之前的研究进行比较[36那50.那53.]并确定我们实验中的关键时期。
按照Udvardi的建议,采用定量逆转录PCR (Quantitative Reverse Transcription PCR, qRT-PCR)对RNA转录水平进行定量et al。[104].使用与微阵列分析相同的样本,qRT-PCR使用5个时间点的3棵树和每棵树3个芽进行mRNA分析,除了第118天和131天只有2棵树可用。根据生产说明书,用oligo (dT) 18引物和逆转录酶SuperScriptIII (Invitrogen, Carlsbad, CA, USA)从500 ng总RNA中合成第一链cDNA。利用位于内参基因5 '和3 '端,间隔700 bp的两对引物进行cDNA质量评价伸长率因子- 1α(EF-1α).5 '和3 '端阈值周期(Ct)差异超过3个周期的样本不再进一步用于分析。
通过设计引物,在两个外显子的连接处只扩增cDNA,或在分离的外显子上扩增基因组DNA的较长片段,来评估基因组DNA污染的存在(附加文件)2:表S1)。用于引物设计的基因序列从蔷薇科基因组数据库(GDR,http://www.rosaceae.org/)Malus x Domestica全基因组V1.0装配和注释。
对于QRT-PCR反应,将2μLcDNA样品(稀释1:20)用作含有3μl2xSybr Green(Roche)和3μm的每个引物的6μl最终反应体积中的模板。在LightCycler®480(Roche)上运行实时PCR反应,在95℃下初始变性为5分钟,然后在95℃下在55℃下为50℃,在55°C和15s处为72°。C。通过熔化曲线分析来分析PCR产物以验证基因特异性PCR产物的存在和没有基因组DNA污染。在PCR扩增在95℃下使用1分钟的PCR扩增后立即进行熔化曲线分析,在65℃下开始40℃,并以0.02°的时间增量开始95℃。CS。每次反应包括阴性和阳性对照,并且使用两种技术复制分析每个cDNA样品。在分析中不考虑显示在两个技术复制之间的CT差异高于一个循环的反应。使用由七种数据点(1:10至1:500)组成的所有cDNA样本的稀释范围的PCR效率测定。通过两种参考基因进行PCR,已知在测试的实验条件范围内稳定地表达,并以前用于苹果:组蛋蛋白和α肌动蛋白[22那36那51.那79.].用LightCycler®480软件(1.5.0.39,Roche)计算转录水平。
qRT-PCR结果用R [78.].标准化转录水平通过III型方差分析进行分析,考虑到处理(' ON ' v ' OFF ')、日期、树和芽嵌套树效应。学生的t-检验以估计“开启”和“关闭”处理在每个日期的差异的显著性。
微阵列分析
AryANE_v1微阵列由126,022个探针组成,对应于63,011个探针,每个探针在正向和反向意义上复制,包括来自“金美味”苹果基因组序列和对照的所有预测基因[15].探针长度为60 bp,探针结合在nimbllegen微阵列中(罗氏nimbllegen, Madison, USA)。
在第131、151和222天(28、48和119 DAFB),所有的斑点比较都是在‘ON’(对照)和‘OFF’树之间进行的。选取这些时间点分别代表距顶芽的成花诱导、花芽起始和花分化的第一步[29].在每个时间点上,每处理两棵树和每棵树和每个日期三个芽的总RNA,对应于6个单独的RNA提取液等量混合,构成一个生物复制(附加文件)1:图S1)。分别用Cy3和Cy5荧光染料标记的' ON '和' OFF ' cDNA克隆进行两个独立的生物复制。进行染料交换以消除两种荧光染料产生的任何偏置。
微阵列样品的标记、微阵列杂交、扫描、定量、标准化(使用lowess方法)和分析都按照Celton等人的描述进行。15].
基因筛选和功能分类
显著差异表达的转录本的鉴定使用R [78.]详细介绍GitHub上可用的R(https://github.com/Baptiste-Guitton/Microarray_biennial_bearing_apple).只有反义探针,杂交意义转录本,被考虑在分析。选择log差异高于1或低于−1且具有显著p值(<0.01)和探针特异性低于或等于2的转录本进行进一步分析。然后根据它们的表达谱对基因进行分组。在每个采样日期,如果其日志,每个基因被标记为“A”2比率小于−1,“b”如果它的日志2若无差异表达,则比值大于1或c。33.a、b和c的可能组合(减去1,因为没有考虑在这三个日期没有差异表达的基因)构成26个可能的基因组。维恩图的构造是用R函数“draw.triple”来完成的。维恩”(库文氏图)。功能分类分析使用拟南芥蒂利亚纳根据TAIR数据库的BLAST分析,在微阵列中存在于微阵列中的苹果转录物的基因(https://www.arabidopsis.org/blast/).利用网络工具agriGO进行基因功能分类[25].首先对整个基因子集进行基因本体研究,然后逐日详细分析。其次,为了在微阵列分析的特定日期确定差异表达基因列表中的富集GO项,我们进行了单一富集分析(SEA) [25].使用STRING v9.1搜索基因集内的蛋白质相互作用[30.].
基因的基因组位置及QTL定位
在三个采收日期中至少有一个显示显著差异表达的基因的基因组位置是使用最好的blast报告的马吕斯x家庭基因组v1.0蛋白文件(malus_x_domestica .v1.0_gene_pep_function_101210.format .xls)由Rosaceae基因组数据库(GDR,http://www.rosaceae.org/).
此前的研究基于苹果分离群体“Starkrimson”x“Granny Smith”(STK x GS)的QTL检测方法,确定了8个基因组区域,涉及控制两年生结果和花序产量[24那33].用于检测QTL的SSR标记的位置通过在Hidras数据库(Hidras,2014年11月)上爆炸标记序列(PRINER或AMPLICON)来检索。http://www.hidras.unimi.it/index.php)到苹果参考基因组[106],或者使用蔷薇科基因组数据库(GDR,http://www.rosaceae.org/,文件malus_x_domestica.v1.0.markers.xls)。对于SNP标记,基因预测(MDP)的位置用于设计标记[33]被认为是标记的基因组位置(附加文件2:表S2)。QTL定义在STK X GS集成遗传图上侧翼QTL的两个遗传标记之间(附加文件)之间定义2:表S3)。由于chr10的QTL位于连锁群的最底端,且侧边标记的遗传图谱与物理图谱的排列顺序相反,因此在我们的分析中,我们将chr10的下半部分,即MS06g03遗传标记以下的部分作为QTL置信区间。
结果
评估树木'返回绽放
手工稀释的树木在2010年被视为“off”大型诱导的花朵,其芽的92.3%是2011年花卉花卉,而“在”树上“的芽的62.8%仍然是植物人(表1,无花果。1).然而,2011年“在”树木上的芽为38.2%,这一百分比平均低于传统的减少的对照树(45.8%)。在'ON'和控制树上,树木之间的变化高于'OFF'树中的树木,其特征在于较高的标准偏差(表1).
利用qRT-PCR和基因芯片筛选开花基因的表达
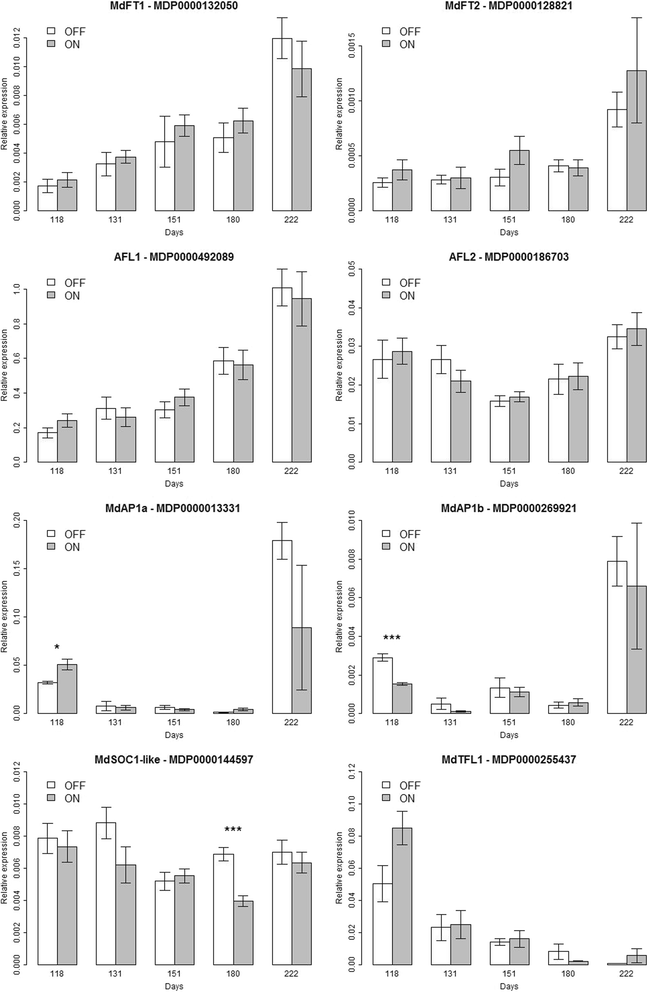
利用qRT-PCR技术,对5个时间点上已发表的苹果关键开花基因转录水平的表达谱进行了研究。这使我们能够将我们的结果与文献进行比较,根据这些基因的已知功能来解释谱图,并从5个可用的时间点中选择3个进行微阵列分析。
特异性和独特的PCR-产品被扩增MdFT1那MdFT2那AFL1那AFL2那MdAP1a那MdAP1b那MdSOC1-like和MdTFL1,通过熔化曲线分析并通过PCR扩增子测序确认(数据未显示)。转录物水平针对参考基因的mRNA表达水平归一化组蛋蛋白Apple,使我们能够通过以前的研究比较我们的结果[51.(图。2);相似的档案被确认使用α肌动蛋白参考基因(附加文件3.:图S2)。其中7个基因的转录水平AFL1和AFL2那MdAP1a和MdAP1b那MdFT1和MdFT2, 和MdTFL1,用于微阵列验证,并显示了具有强相关性的相似表达模式(附加文件4.:图S3)。
表达式模式MdFT1那MdFT2那AFL1那AFL2那MdAP1a那MdAP1b那MdSOC1-like和MdTFL1采用实时荧光定量PCR技术,对第118天、第131天、第151天、第180天和第222天采收的果穗顶端芽进行了测定。Graphics represent the average of the nine data points per date and per treatment with associated standard deviation. Significance of the difference of relative expression between ‘ON’ and ‘OFF’ trees for each studied gene and at each time point estimated by Studentt- 在图形上报道了最低(*,P.值< 0.05;**,P.值< 0.01;* * *,P.值< 0.001)。计算相对表达式组蛋蛋白管家基因
开花基因如MdFT1那MdFT2和AFL1在生长季,转录水平增加,但在‘ON’和‘OFF’树之间的表达模式没有显著差异(图2)。2额外的文件2:表S4)。相对表达轮廓MdSOC1-like(MDP0000144597)和AFL2(MDP0000186703)相似,从118天下降到151天,然后到222天略有上升。然而,MdSOC1-like在第13111和180天,“关闭”树木的成绩单水平高于这种趋势。'ON'和'OFF'之间的差异在180天中只有重要意义。
MdAP1a和MdAP1b表现出相似的表达模式(图。2),直到第180天,它们在芽中以低水平表达,然后在第222天显著增加。在这个时候,“OFF”树显示了更高水平的转录AP1由于在“ON”树中观察到的高标准错误,这两种处理之间的差异并不显著2:表S5)。MdTFL1(MDP0000255437)从第118天开始表达量迅速下降,到第180天表达量非常低。在第118天,“开启”树的转录水平高于“关闭”树,差异仅低于显著性阈值(P.-value = 0.054)(附加文件2:表S5)。
最后,作为英国《金融时报》/TFL1基因家族是苹果中的主要已知的开花基因家族,我们特别注意微阵列中的这些基因。在微阵列实验中,两者都是MdFT1(MDP0000132050)和英国《金融时报》的母亲(MdMFTa- MDP0000449224)的表达水平在第131天、151天和222天之间升高;然而,在治疗之间没有观察到差异表达。这两个TFL1拷贝(MdTFL1——MDP0000126761和mdtfl1a.-MDP0000255437)表现出预期表达谱,从第131天到第222天表达量逐渐下降,但无差异表达。两者都不MdFT2(MDP0000144597),FT的兄弟(MDP0000812208和MDP0000867916)TFL2(MdLHP1a,MDP0000293596和MdLHP1bMDP0000240165)在不同处理的任何时间点均有显著差异表达。
此外,三个苹果同源副本SOC1(MDP0000314765,MDP0000060753和MDP0000144597)没有差异表达,它们的表达保持稳定且常数(围绕log = 5)随时间点。两者都不CENTRORADIALIS(MdCENa、MDP0000761080和MdCENbMDP0000127457)也英国《金融时报》的母亲(MdMFTb(MDP0000208806)在任何日期的顶端芽中表达。
在微阵列中差异表达的基因概述
在63011个探针中,只有至少一个样本(45622个探针)中log2强度高于背景log = 1的靶向基因的高特异性转录本(46261个探针)被认为表达阳性。经过筛选程序,总共有648个转录本在三个时间点中至少有一个有显著差异表达,占微阵列上靶向的感官基因的1.03%。接下来,我们主要报道了‘ON’树中上调或下调的基因,只有在对基因解释有意义的情况下,才提到‘OFF’树中相应的下调和上调。
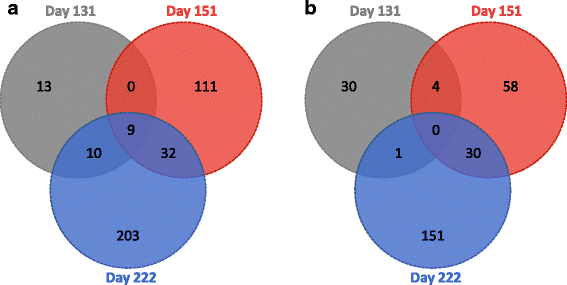
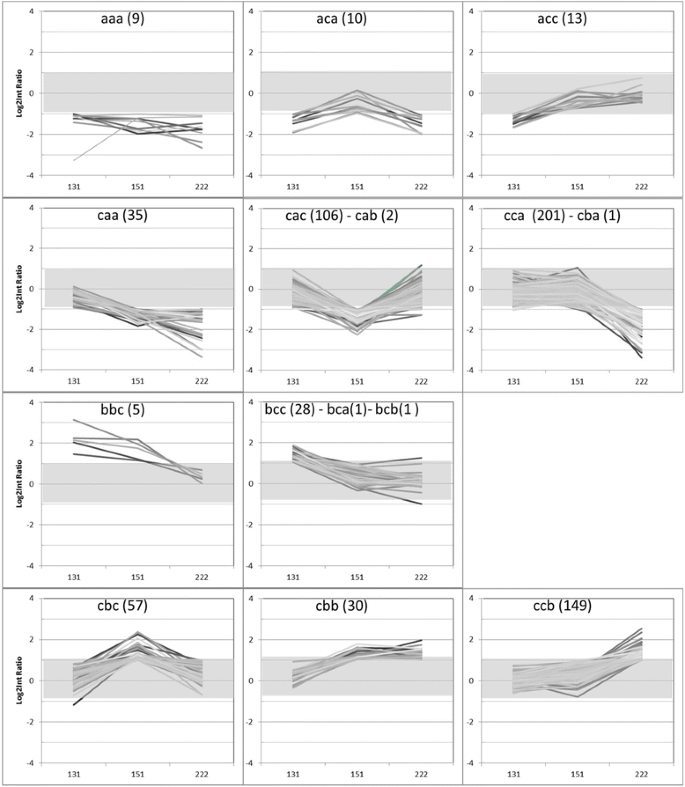
随着时间的推移,‘ON’树中上调(比率< - 1)和下调(比率> 1)的转录本数量增加,其中上调的转录本数量高于下调的转录本数量(图1)。3.).在这些转录本中,在第131天“ON”树中有32个转录本上调,而35个转录本下调。第151天,‘ON’树中有152和92个转录本上调和下调。第222天,‘ON’树中有254个转录本上调,182个转录本下调。有9个转录本在3个日期内持续上调,其中19个转录本在第131天和151天上调,41个转录本在第151天和222天上调,19个转录本在第131天和222天上调。在“ON”树中,只有4个转录本在131和151天下调,30个转录本在151和222天下调,1个转录本在131和222天下调。在‘ON’树的实验过程中,没有共同的基因被下调。从第131天到222天,苹果芽中的差异转录谱被可视化,共享相似差异表达谱的转录谱被用户定义为11组(图1)。4.).在上述26种可能的分布中,只有15种被观察到。四个组只包含1或2个基因,因此与另一组相似的概况(附加文件2:表S6)。第1-6组含有上调'ON'树上的顶芽的转录物,而群集7-11含有下调的转录物。
在我们的实验中差异表达的648个转录物中,535对其同源拟南芥其余113份转录本与任何一份转录本均无显著同源性拟南芥基因。535注释的Apple转录物与426个独一无二拟南芥基因。
利用AgriGO的单一富集分析(SEA)表明,“刺激反应”GO (P.-value = 7.3E-16)在至少三个时间点之一的差异表达基因子集中最显著。第131天,与刺激GO反应(包括对非生物胁迫的响应、对胁迫的响应和对刺激GO的细胞响应)序列同源的基因显著上调(附加文件)5.:图S4A,附加文件2:表S7A)。在第151天,四个主要的生物过程差异表达:(i)对刺激的反应,其中对压力GO的反应是数据集中最显著的(P.-value = 8.90E-11)的氧化应激反应(P.值= 8.40 e-05);氧化石墨烯属于细胞过程;(iii)细胞壁生物发生(P.-value = 1.50E-05)作为细胞组分生物发生氧化石墨烯的一部分;(iv)代谢过程,包括细胞碳水化合物生物合成过程(P.-value = 0.00094)和脂质代谢过程(P.-value = 0.00021)(附加文件5.:图S4B,附加文件2:表S7B)。在第222天,海分析表明,对刺激的响应仍然是最显着的过度代表的GO(p值= 1.50e-10),其包括对嗜酸甘油蛋白刺激的反应(p值= 4.30e-5),对茉莉酸刺激的反应(P.-value = 5.60E-5)和对氧化应激的反应(P.值= 2.60 e-06)。在发育过程中,GO以解剖结构发育结束(P.-value = 0.0037),发现35个转录本在两种处理之间存在差异。氧化石墨烯代谢过程包括碳水化合物的生物合成过程(P.-value = 0.0015)和转录的GO (P.-value = 8.40E-05),其中31个转录本在处理之间有差异表达(附加文件5.:图S4c,附加文件2:表S7C)。
代谢过程中的葡萄糖醛酸(GDE)表明,高产树木的顶芽处于饥饿状态
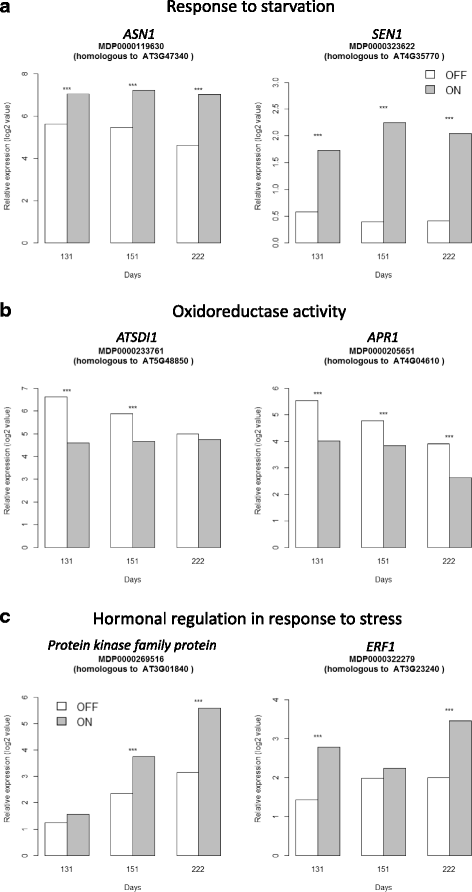
在这三年中,“ON”树中上调的9个转录本中,有5个与应激反应相关的基因同源:Asn1.(谷氨酰胺依赖性天冬酰胺合成酶1;MDP0000119630和MDP0000096208),参与蔗糖饥饿的细胞反应,SEN1(衰老1;MDP0000323622和MDP0000121259),一个由磷酸盐饥饿强烈诱导的衰老相关基因,以及MDP0000223224,一个假定的糖磷酸盐交换器(图2)。5A, 桌子2额外的文件2:表S8a)。
同源的一个转录本LPR2(低磷酸根2;mDP0000778113) involved in cellular response to phosphate starvation was found to be over-expressed in ‘ON’ trees at day 151. At this same date, primary carbohydrate metabolism in apical buds of ‘ON’ trees was oriented towards gluconeogenesis as indicated by the up-regulation of four homologous copies ofPCK1(磷酸烯醇丙酮酸CARBOXYKINASE;MDP0000293468、MDP0000321913、MDP0000397215和MDP0000517770)。参与碳利用的两个同源转录本CA1和游离钙(碳酸酐酶;MDP0000215729和MDP0000194249)和四个谷氨酸氧素家族蛋白质同源物(MDP0000376239,MDP00001555448,MDP0000406592和MDP0000257455)涉及细胞Homosteasis的Go也在“on”树上上调。我们也注意到了成绩单同源ATMT3(Metallothionein 3.;MDP0000760432)参与细胞铜离子稳态,已知参与对果糖刺激,生长和黄芪生物合成过程的阳性调节的响应以及成绩单SAG101.(SENESCENCE-ASSOCIATED基因101;MDP0000175733)编码一种参与衰老的酰基水解酶,尽管这两种转录本的同源性相对较低,分别为50%和38%(表2)2额外的文件2:表S8B)。
在第222天‘ON’树中上调的转录本中,我们特别注意到MDP0000142134,它是一个同源物BMY5和MDP0000123354的同源物ATPHS2编码α-葡聚糖磷酸化酶,涉及淀粉降解。同时,编码β-果糖苷酶的转录物BFruct3.同源物(MDP0000149570)和蔗糖-磷酸合酶ATSPS4F(MDP0000288684)分别下降和上调。此外,涉及碳水化合物生物合成过程的半乳糖醇合成酶同源物(MDP000042642,MDP0044666683和MDP000046683和MDP0000209143)和甘露糖6-磷酸还原酶同源物(MDP00251531)在“树上”(表格)上调2额外的文件2:表S8C)。
产量大的树木的顶芽处于不利的细胞氧化还原状态
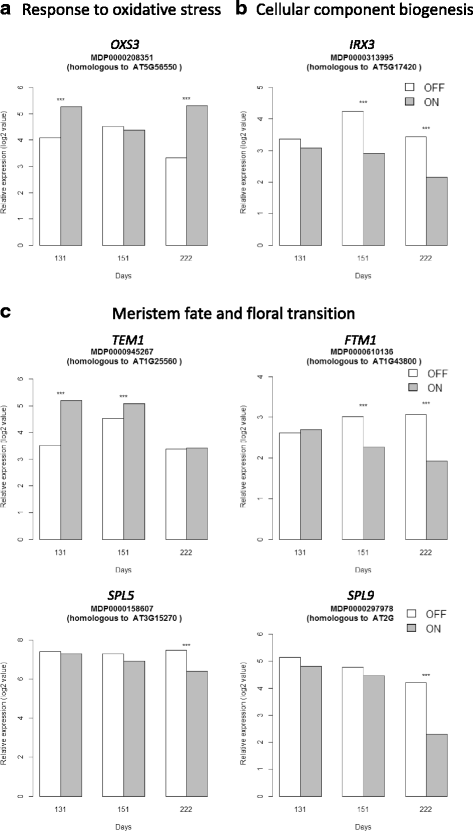
氧化还原酶分子函数显着过度地表示,分别在第131,151和222天上调8,21和25个基因。这表明氧化分子的还原在实验的三个时间点上是活性的。一份转录物特别相关与细胞氧化还原状态,同源牛津(OXYDATIVE压力3;MDP0000208351),参与抗氧化应激(Table2),在第131和第222天'在'树上上调(图。6).
参与氧化还原酶活性和催化活性的转录本GO在“ON”树的顶端芽中均显著过量,在第131天下调(附加文件)2:表S7A和S8A)。在转录组中发现了5个同源的AT1G23740,一个醌氧化还原酶样蛋白,可能参与了反应性羰基的解毒。属于硫酸盐还原和同化氧化石墨烯的基因也在‘ON’树中下调。有机硫化合物,如硫醇、硫代脂类、硫代葡萄糖苷或蒜素,在正常的植物生命周期中发挥重要作用,并保护植物免受胁迫和病原体的侵袭。同源染色体的APR1和APR2(5'Denylphosphosu硫酸盐还原酶;MDP0000205651和MDP0000279311编码同化性硫酸盐还原途径的关键酶,其酶活性的降低导致植物中硫酸盐的积累,在3个时间点上都被下调(图2)。5B.).然而,在第131天的同源中,差异只有统计学意义APR2第131天和第222天APR1同源物。两个同源副本ATSDI1(硫缺乏诱导1;MDP0000233761和mdp00006972337)在“ON”树中均在第131和151天下调(图2)。5B.).的另一个同源副本ATSDI1(MDP0000244589)在‘ON’树中仅在第131天出现下调。最后,三个与MIF1(迷你锌指1MDP0000477453、MDP0000739070和MDP0000799547)是一种参与多种激素调节的氧化还原酶,在第222天‘ON’树的顶端芽和同源转录本中均上调SRO5.(类似于RCD 1 5;MDP0000697620)是一个参与氧和活性氧代谢过程的基因,该基因在第222天表达上调2).
GDE参与激素调节
在第131天,在“ON”树的顶端芽中,13个与应对压力的激素调节相关的基因转录本上调,其中:RD26.(对干燥敏感的;MDP0000132623),参与对脱落酸刺激的反应;ABR1(阿坝REPRESSOR1;MDP0000235028)的成员乙烯反应的因素(ERF.)亚家族参与调节ABA介导的应激反应;ATHB-7(拟南芥同源盒7;MDP0000615948和MDP0000899816),参与脱落酸介导的信号传导和对脱落酸刺激的响应。四种同源转录本也参与乙烯反应:JMT(茉莉酸羧甲基转移酶;MDP0000941692),催化茉莉酸生成茉莉酸甲酯;和蜜蜂3.(3 .油菜素内酯增强表达;MDP0000879337)是油菜素内酯、生长素和乙烯诱导的转录因子,受脱落酸抑制;ERF1(乙烯反应因子1;MDP0000322279和MDP0000871689)(图4)5C).此外,在“ON”树中,有6个Leucine-Rich-Repeat (LRR)受体样转录本上调,其中MDP0000158551、MDP0000162801、MDP0000175260和MDP0000845743、MDP0000501298和MDP0000131814在第151天和第222天上调2).已知这些LRR蛋白涉及蛋白质氨基酸磷酸化,这是植物中最重要和频繁的调控机制之一。
在第151天,两个转录本与GA2ox(赤霉素2-氧化酶;MDP0000137705和MDP0000185333)的同源物GA20ox(赤霉素20-OXIDASE;MDP0000133105)在“ON”树中上调。我们也注意到BRC1(分支1;MDP0000219838),间接诱导蟾蜍素诱导的顶端优势控制的转录因子,并已知逮捕腋芽发育,预防腋芽产量和延迟早期腋芽发育,以及BR6OX2(BRASSINOSTEROID-6-OXIDASE 2;MDP0000307964),它们编码细胞色素P450酶,该细胞色素P450酶催化在生产铜苔醛的生产中的最后反应,其调节植物生长和生产率,并且已知可缓解各种生物和非生物胁迫效应。
Snak1.赤霉素刺激反应相关蛋白的同源基因MDP0000195254、MDP0000297328、MDP0000366256和MDP0000150771在第222天下调。在GO的发展过程中,除了BRC1之前提到的是,对参与分支对照的主要基因同源的另一种成绩单在'上的树木上上调,MAX1(多腋生分枝1MDP0000231714)。该基因是由腋芽产生的营养腋芽的特异性抑制因子,参与分生组织的组织调控、类黄酮生物合成过程的正调控、类胡萝卜素生物合成过程的正调控、次生芽的形成和生长素的极性运输(见表)2).
花抑制因子转录本在果实重的树的顶端芽中上调,而花增强子转录本在果实重的树中上调
在参与开花时间途径的转录本中,MDP0000945267与MDP0000945267的同源性为55.5%TEM1(丹魄1或Rav2.)在Malus x中,Diefiora全基因组V1.0在第131天'在'树上显着上调(图。6摄氏度).TEM1被认为是一种花的抑制因子,可能与光周期和依赖ga的开花途径有关。还有转录因子的两个同源副本没有顶端分生组织(纳姆) (MDP0000690168和MDP0000232008)在抑制花诱导的乔木(‘ON’乔木)中表达上调。该转录因子属于NAC蛋白家族,参与植物的各种发育过程,如SAM发育和胁迫诱导花的诱导。的转录因子KNAT1(从拟南芥的打结;MDP0000280307)已知在MID-MERISTEM中表达以促进叶子命运,在'ON'树上的SAM的第151天也上调。
另外两个感兴趣的同源转录本在‘ON’树中上调,MAF2.(影响开花的小麦2,MDP0000280712拥有76.2%的同源性开花轨迹c在日本梨)和PRR5(伪响应调节器5, MDP0000815065),但只在第222天。在拟南芥中,MAF2.已知的同源于开花轨迹C和M(FLC和FLM),这是开花和自然开花时间变化的主要决定因素的压缩机,响应寒冷的温度PRR5编码昼夜时钟中的负反馈循环中涉及的组件拟南芥蒂利亚纳也可能是花的抑制剂。
此外,一个同源副本FTM1(花的过渡在分生组织,MDP0000610136)在151和222天的树木中编码硬脂酰-ACP去饱和酶,并在'OFF'树上上调(图。6摄氏度).三位成绩单与同源性分享SPL(SQUAMOSA蛋白质像)家族成员在第222天在“开”树中也被下调(或在“关”树中被上调),SPL5(MDP0000158607)和SPL9(MDP0000297978和MDP0000322647)6摄氏度).在拟南芥中,已知这些转录本参与营养到生殖阶段的转变和开花调控。表达的SPL5和SPL9是由microRNA调控的吗miR156.但是,在我们的实验中miR156在两个治疗中没有显示出差异表达(表2).
排放树木的顶端芽在151和222天处于活性生物生物中
SEA分析表明,细胞壁生物合成氧化石墨烯和代谢过程,包括细胞碳水化合物生物合成过程和脂质代谢过程,在' OFF '树中显著上调(附加文件2:表S6B和S6C)。此外,与细胞过程和细胞壁生物发生相关的细胞成分生物发生过程也被上调,这与开始开花的树木(“OFF”树)的细胞活性和分生组织重组活动的增加一致。参与次级细胞壁生物合成的纤维素合成酶家族拟南芥成员同源转录本:IRX1(不规则的木门1MDP0000214413),IRX3(MDP0000313995和MDP0000470441),IRX6(MDP0000517378、MDP0000883782和MDP0000922681)IRX8(MDP0000271287),以及纤维素合酶a4(CESA4,MDP0000300098和MDP0000320351)和CESA8(MDP0000214413)在‘OFF’树中,除第151天和第222天上调外,其余均上调IRX8,在第222天没有显着上调(图。6 b, 桌子2额外的文件2:表S7B和S7C)。
二年生结实基因组差异表达基因的分布及其与QTL的共定位
在我们实验的648个差异表达基因中,610个基因位于苹果基因组的17条染色体中的一条上(附加文件)2:表S9)。这些基因平均分布在881.3 Mb的基因组中,平均每1.59 Mb有一个基因(附加文件)6.:图S5)。
总共有81个基因位于八个QTL区域内,与“斯卡里森”X'RAN的史密斯·斯密“隔离人口”中的双年轴承控制有关[33].在这81个基因中,征收62个(附加档案2:表S10)。SEA分析显示氧化还原酶活性在8个基因(P.值0.0012)。与“ON”树中上调的7个富含亮氨酸重复跨膜蛋白激酶序列同源的转录本位于qtl内:MDP0000148991 (chr 8,第222天),MDP0000175260, MDP0000845743, MDP0000162801和MDP0000158551 (chr 10,第151天),MDP0000269516 (chr 14,第151和222天),MDP0000131814 (chr 15,第151和222天)。
qtl中除了编码催化活性的基因外,还包括激素刺激反应和植物发育过程的相关基因。在8号染色体QTL区间内,重茬(' ON '乔木)中一个响应赤霉素(gibberellin)的基因(AT5G59845)的两个拷贝在222天下调。在第14号染色体上,转录调节因子SPL9(MDP0000297978)在第222天涉及生殖期转变的植物生殖期转变的植物。在第222天的QTL间隔中的QTL间隔(CHR 15),一种成绩单与转录因子同源没有顶端分生组织(纳姆) (MDP0000232008)在第151天‘ON’树中上调。
讨论
排放治疗显着诱导“关闭”树木的顶部芽中的花朵
结果表明,采伐处理对提高翌年春季的FI含量有显著作用。通过在盛开的花朵全部摘除而诱导到“OFF”状态的树木在接下来的一年里会大量开花,90%以上的花蕾会产生花序,处理过的树木之间的差异很小。相比之下,果量大的树(‘ON’树)的FI比作为对照的传统疏果树低。然而,有一部分芽(38.2%)在“ON”树上被诱导开花,这可能是因为“Gala”树有定期开花的倾向[38].很可能,具有比' Gala '更严重的二年生结果倾向的品种,可能在' ON '年之后产生更少的结果。然而,即使倾向于规则的品种也可以通过操纵被推到不规则,正如“ON”不稀疏树的62.8%的芽仍然保持营养。此外,在‘ON’和对照树中观察到的高变异性表明,在一棵树中芽的命运是异质的和不同步的,与在‘OFF’树中观察到的顶端芽的高度同步性形成对比,在OFF树中,花在上一年被移除。SAM同步与去同步的趋势被认为是基因型依赖的[24那57.].
开花基因的表达模式作为顶端芽转变的分子标记
利用qRT-PCR技术研究了花蕾发育的关键阶段,即从第118天到222天,这一阶段假设为花蕾FI、花序分生组织过渡和花分化早期开始[29].由于在苹果的SAM中没有单一且明显的FI标记,我们采用qRT-PCR研究了关键开花基因的表达模式。我们的研究结果与之前的研究结果一致,特别是MdFT1那MdSOC1-like那AFL1和AFL2它表现出类似的表达模式,尽管表达水平较低,日期之间的对比度比Hättasch等人观察到的日期.[36].特别是,我们没有观察到的表达峰MdTFL1在180天。表达谱的MdTFL1那MdFT1和MdFT2, 和MdAP1与Kotoda等人观察到的相似吗.[50.,但同样的,日期之间的对比也比较小。在这些研究中观察到的差异可能是由于不同的转录水平的标准化(相对于提高的植物的转录水平)在体外由(36),或者树木生长的不同环境以及不同品种的使用。
AP1已被提出作为桉树开花分化的分子标记(Jaya et al. [43])。在拟南芥中,作用的方式AP1是动态的,因为它主要在花发育的最早阶段作为转录压缩机;然而,它激活了在更先进的阶段的花器官形成所需的调节基因[48].AP1在花器官形成中的作用也已在苹果中确认[53.].在我们的qRT-PCR中,高表达MdAP1a在'ON''上的第118天可能被解释为与其转录压缩活动有关的FI,而两者的高表达水平MdPA1a和MdAP1b在相同的乔木中,180天后的花期分化发生在这个日期之后。类似地,的下表达式MdAP1a和MdAP1b在第222天,‘ON’芽中FI的含量高于‘OFF’芽,这可能反映了这些芽中FI的含量较低。缺乏显著差异表达MdAP1在微阵列中可能是开花和不开花花蕾的混合结果,考虑到花的分化时间,可能发生在200天到240天之间[29].伴随的下调MdTFL1也与之前的研究一致,在苹果和拟南芥中,TFL1压制AP1表达 [50.].的晚期表达MdPI,增强了MdAP1,与苹果花器官的发育有关[98],这与非常低的表达一致MdPI仅在222天检测到(数据未显示)。这也表明,花轮的形成开始于222天左右MdPI表达在季节后期增加。qRT-PCR图谱与之前的研究一起开发了关键开花基因,这些研究确定了苹果中FI的时间[29那35那53.],指导我们选择三个时间点进行微阵列分析,以代表FI(第131天),花芽启动(第151天)和花分化的开始(第222天)。这三个时间点是最有可能确定两年一年轴承的一些重要机制,并突出“ON”和'OFF'树之间的差异。
此外,转录水平AFL1和AFL2那MdAP1a和MdAP1b那MdFT1和MdFT2, 和MdTFL1, qRT-PCR与芯片检测结果高度相关,可作为芯片检测结果的验证。
在成年苹果树顶端芽中触发FI:若干候选过程
微阵列分析的结果表明,许多过程可以参与成年苹果树的顶端芽。实际上,将在文献中描述的途径中的芽中的芽中差异表达的主要基因定位为模型植物中的控制文件,表明这些途径中的几种途径可以参与成年苹果树。许多作者以前强调了植物中的多因素性质,随着遮阳,干旱,低营养,光质,热量和普通氧化应激的速度,加速开花,加速开花[34那59.那64.那66.].在多年生热带树木中,在没有低温的情况下,FI可由水分胁迫或其他胁迫行为触发[16那90那93].
重茬树木顶端芽的饥饿和不利的氧化还原状态
在该实验中,'ON'树的顶端芽在代谢过程中表现出患者的转录物中表达,这表明它们可以是饥饿的并且在氧化应激下(图。7.).顶芽碳水化合物供应的减少是最早观察到的事件之一,很可能是由于作物负荷高造成的。尽管水果的存在已经被证明能增强相邻叶片的光合作用[114,营养生长和生殖生长之间对碳水化合物的竞争是一个众所周知并有文献记载的现象[69.那90].Hyet提出了Hyet所建议的营养和生殖增长之间的必要平衡,以及对水果集和发展的最小叶片的要求,并提出了[39]尼尔森和丹尼斯[72.,他证明了苹果和梨的FI率随着与交易所相关的叶子数量的增加而增加。然而,如果将自主通路描述为诱导开花所需的叶片数量[77.,由于叶片相应的光合活性,几乎不可能将这种影响与碳水化合物的有效性区分开来。来源/库关系和精确细胞区域的遗传控制需要进一步的研究,以解释在更完整的植物尺度上观察到的芽命运和拓扑的多样性[20.].
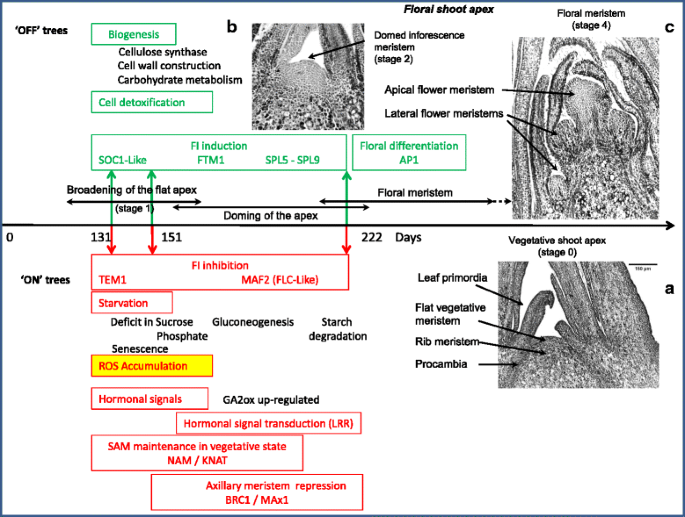
通过微阵列分析,比较“Gala”成年苹果树上采的刺尖芽中“on”(结果)和“OFF”(未开花)树之间差异表达的转录本,揭示了主要的代谢、激素和氧化还原状态调控。在‘ON’树的顶端芽中,更可能处于营养状态,转录本突出了对胁迫的反应,如蔗糖和磷酸盐的饥饿,应激激素信号和下调的细胞解毒过程,而与开花诱导抑制基因(如丹魄1),并参与植物状态下SAM的维持(如knat.和纳姆)差异。在' OFF '树的顶端芽中,更可能被诱导开花,转录本显示了活跃的细胞生物发生和解毒,有几个花诱导的启动子(如FTM1和SPL成绩单)差异。植物状态的时间和过渡阶段(插入一种)到Domed Meristem(第2阶段,从第203天,插入B.)和花分生组织(状态4,插入C),由Foster等人定义[29[苹果树的顶端芽中的组织学纵剖面的照片举例说明
此外,碳水化合物分配对特定组织或器官发育的影响也可能主导“行/不行”的决定,如器官下降、SAM死亡或FI触发。事实上,碳水化合物不仅被认为是营养物质,也是信号分子[32]并且已经提出了淀粉和蔗糖代谢在FI中的信号传导作用很长时间[7.那18].在我们的研究中,没有证据表明“ON”和“OFF”树的顶芽之间参与初级碳水化合物代谢的转录本的差异表达;然而,控制次生代谢的酶基因(包括磷酸酶还原酶、糖基转移酶、纤维素合酶)的表达存在较大差异,这些酶在‘ON’树的顶端芽中均下调。这表明,即使可以假设‘ON’树具有活跃的光合作用,但顶端组织可能无法获得足够的碳,并可能导致局部碳消耗和细胞活动减少。事实上,细胞分裂和分化的维持已经被证明在SAM中产生了强烈的碳水化合物需求[27].参与SAM维持的两个转录因子的' ON '树的上调(KNAT1和纳姆)与这个假设一致。KNAT1,诺克斯家族的一员[85),纳姆[92],参与胚胎发生时的SAM构成,既参与SAM模式形成,又阻止分生细胞分化。因此,它们在‘ON’树中的上调与SAM中碳需求的减少、FI抑制和营养命运的维持是一致的。此外,已知有两个基因参与了腋芽的控制,MAX1和BRC1,在树上也上调。上调MAX1,是AM发展和分支的抑制剂[9.]与营养生长与果量之间的拮抗作用一致。BRC1玉米的同源物墨西哥类蜀黍BRANCHED1,也被认为参与控制腋窝分支[11].有趣的是,BRC1也被证明与之相互作用英国《金融时报》和TFL1拟南芥腋生分生组织的花过渡[73.].
众所周知,营养和氧化还原状态之间的联系是由昼夜节律钟介导的,昼夜节律钟能够每天调节细胞代谢、能量平衡和氧化还原状态[37].在我们的研究中,参与控制氧化应激耐受性,细胞离子稳态,细胞氧化还原状态和衰老的几种基因在'ON'树上的顶部芽上上调。这表明ROS可以积累在这些芽中。在拟南芥中,从植物生殖期的过渡已经与增强的氧化蛋白积累有关[46]和缺乏类囊体抗坏血酸过氧化物酶和胞浆抗坏血酸过氧化物酶1的突变体表现出早期抽薹表型[66.].因此,有人认为,受到胁迫的植物开花更早,可能对胁迫强度有相应的反应,从基于忍受胁迫影响的策略,例如通过OXS表达,到通过生殖逃避胁迫[8.].然而,根据延迟和早期开花的物种,在压力条件下观察到,对年度和多年生植物之间的决定可能不同。在SAM和开花中的细胞氧化还原状态之间的推定链路的进一步表征可以有助于解密成人苹果树中涉及的生理机制。
激素可能有助于决定花
“开”和“关”树之间激素反应的差异,似乎与“开”树与“关”树的顶端芽感知到的营养和氧化应激一致。特别是,氧化还原中枢活性与激素信号传导有关,并导致植物对生物和非生物胁迫的抗性。例如,除了抗氧化功能外,抗坏血酸也是植物激素脱落酸、GA和乙烯生物合成所必需的[3.那4.].此外,低量的抗坏血酸促进植物抗毒素camalexin的积累[17]以及水杨酸[6.而这已经被证明会影响开花时间[63.].在我们的研究中,油菜素内酯和生长素诱导的基因和转录因子也有差异表达,大多数激素功能在‘ON’和‘OFF’树之间有差异导向。
其中,GA生物合成是直接参与调控苹果开花调控的最强候选功能,尽管目前尚未阐明不同形式GA的作用。遗传算法在苹果树上的应用表明7.对FI有最大的抑制作用[102],园艺实践通常涉及在' OFF '年施用GA,以防止过度的FI,从而减弱两年生结果周期[84].因此,具有生物活性的GAs似乎对苹果的关键开花基因/步骤有抑制作用,而被认为对多年生植物的FI有相反的作用,与它们在一年生植物中的作用相比[42].值得注意的是,在我们的研究中,在控制树木生产和交替的QTL聚类区间中发现了几个参与GA生物合成途径的差异转录本:MdGA20ox1a和MdGA3ox-like-bLG1和mdga2ox8a.在lg10 [33].另外,两份复印件GA2ox和一份副本GA20ox在‘ON’树的顶端芽中,参与分解代谢和GA活性形态代谢的基因分别被上调。这些结果强化了一个假设,即在苹果中,生物活性气体可能在关键开花基因/步骤的控制中发挥作用。
推定的开花基因和花卉压缩机涉及成人苹果树
与被称为控制FI关键行为体的主要基因序列同源的转录本在成年苹果树的顶端芽中有差异表达:两个是花抑制子(TEM1和AGL31/FLC-Like)在“ON”树中被上调,而促进开花的基因如SPL基因在'OFF'树上上调。
在我们的实验中,TEM1在第131和151天,“ON”树的基因都上调了。这个基因属于复合体rav.转录因子家族[14那65.那74.,其中可能存在功能冗余,因为两者都有TEM1和TEM2作为直接的抑制因子英国《金融时报》基因。TEM1当叶衰老通过植物激素(如乙烯或茉莉酸甲酯)加速叶子衰老时诱导转录[1那40),TEM1已被描述为不同开花途径(年龄依赖、GA、光质量和强度、环境温度和油菜素内酯)的整合者[65.].TEM1已被证明在叶片的维管和叶肉组织中表达,尽管其水平和空间分布随着发育而改变[14].在目前的研究中,我们发现TEM1在开花后(第131和151天)的早期顶端芽中表达,其差异表达水平与‘on’树中对FI的抑制作用一致。作为TEM1和TEM2表现出一个依赖于生物钟的表达谱,在下午三点左右达到最大值[14,进一步研究了日变化规律TEM1在绘制任何结论之前,应进行苹果树顶部芽中的表达。
转录因子' ON '树的上调MAF2.(影响开花的小麦2),属于一个大的疯了开花抑制子家族的发现,但仅在222天,即正常的FI期之后。在拟南芥中,MAF2.已知的同源于开花轨迹C和m(FLC.和FLM.)并参与春化途径和改编开花时间拟南芥蒂利亚纳到低温[97].自从FLC.和FLC-like据报道,转录因子是由氧化谷胱甘肽的上调[49的晚期表达MAF2.可能是由‘ON’树顶端芽的氧化还原状态引起的。同样的,的微分表达式伪响应监管机构(PRR)蛋白质PRR5,在该实验中观察到,已知其编码昼夜节点的组件拟南芥蒂利亚纳[81可能与日常细胞解毒和调节氧化还原状态有关。然而,这些建议还需要进一步的研究。
我们系统中的其他假定参与者是SQUAMOSA发起人BINDING-LIKE(SPL)转录因子。在拟南芥中,表达两者SPL5和SPL9是由microRNA调控的吗miR156.但是,在我们的实验中miR156在' ON '和' OFF '树之间没有表现出差异表达,与SPL-like在没有差异表达的柑橘中发现的基因miR156[88].然而,它的作用miR156在花的诱导方面需要进一步的研究miR156丰度随植物年龄的增加而降低,并与植物生长阶段的转变有关拟南芥蒂利亚纳[113].在我们的数据,SPL5和SPL9在‘OFF’树中仅在222天表达上调,且与MdAP1a和MdAP1b.这可能符合SPL9促进表达的作用AP1在拟南芥109],但作为FI过程中的晚期活动。有趣的是,最近的结果强调了GA与GA与GA和的相互作用SPL的转录因子拟南芥蒂利亚纳在漫长的日子里[2那75.].这些作者表明,血管组织中需要GA来增加英国《金融时报》和ft的孪生姐妹(TSF.)在FI期间编码从叶片传输到SAM的系统信号的MRNA。他们建议Ga可能在叶子和SAM之间的空间分离功能,因为GA可以促进激活英国《金融时报》在树叶和SPL分生组织中的基因。此外,Torti等人.[101描述一个英国《金融时报》-独立路径,其中FTM1在漫长的日子里在山姆中表达。我们的结果可能与此计划一致,因为FTM1转录本在花芽起始时(第151天)和随后的花分生组织分化时(第222天)有差异表达。尽管这是无法推测的英国《金融时报》由于本实验没有考虑到叶片对FI触发的影响营养期短(高级副总裁)可以怀疑存在,在微阵列中没有差异表达,存在几种主要基因并在“上”和“苹果树”之间的顶端芽中差异表达:GA2ox那FTM1那SPL5和SPL9.
结论
在诱导条件下(‘OFF’)和非诱导条件下(‘ON’)的转录本表达差异表明,不同的开花途径可能参与了成年苹果树FI的控制。营养和氧化还原状态的变化可能是自主途径的一部分,而GA(通过GA20ox和GA2ox)和生物钟(通过PRR5)和环境温度(通过FLC-Like)途径也可能参与其中。我们的研究结果提出的主要假设是,芽的氧化还原和营养状况不佳可能引发激素反应,进而激活分生组织命运的关键调节器。然而,在这个阶段,原因和影响不能从数据推断。此外,研究人员还发现,在白藜芦醇中,胁迫信号的关键调控因子(lrr受体样和蛋白激酶)和分生组织转变的关键调控因子拟南芥蒂利亚纳(没有顶端分生组织和SPL9)以QTL间隔存在于苹果中与双年轴承相关的特征的间隔。研究苹果树基因的等位基因多样性并将其与表型行为进行比较,可以使用分子标记产生强大的工具,用于育种常规品种。
可用性数据和材料
微阵列样品沉积在NCBI的基因表达综合症中[5.],并可透过GEO系列接入号GSE64646 (http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?token=onsdgqwotbuhbox&acc=GSE64646).用于分析数据的规范化数据和R脚本存放在GitHub (https://github.com/Baptiste-Guitton/Microarray_biennial_bearing_apple_Gala),以保证分析的重现性。
参考文献
- 1.
王志强,王志强,王志强,等。拟南芥全基因组插入突变研究。科学。2003;301:653-7。
- 2.
引用本文:刘志强,刘志强,刘志强,等。短的营养期减少了拟南芥茎尖赤霉素的生物合成以调节花的过渡。中国科学院大学学报(自然科学版)2014;111:E2760-9。
- 3.
Arrigoni o,Tullio MCD。抗坏血酸:远远超过抗氧化剂。Biochimica等生物物理学Acta(BBA) - 一般受试者。2002; 1569:1-9。
- 4.
Arrigoni o,Tullio MCD。抗坏血酸在细胞代谢中的作用:基因定向功能与不可预测的化学反应。J植物理性。2000; 157:481-8。
- 5.
王志强,王志强,王志强,等。NCBI GEO:功能基因组学数据集更新档案。核酸学报2013;41:D991-5。
- 6。
Barth C,摩尔人W,Klessig DF,Conklin PL。在抗坏血酸缺陷拟南芥突变体维生素C-1中改变了衰老和对病原体反应的时序。植物理性。2004; 134:1784-92。
- 7。
王志强,王志强,王志强,等。诱导植物开花的生理信号。植物细胞。1993;5:1147-55。
- 8.
Blanvillain r,Wei S,Wei P,Kim JH,OW DW。对植物中压力逃逸的压力耐受性:作用的作用oxs2.锌指转录因子家庭。embo J.2011; 30:3812-22。
- 9.
王志强,王志强,王志强,等。MAX1编码细胞十字P450在下游的家庭成员MAX3/4产生一种类胡萝卜素衍生的分枝抑制激素。Dev细胞。2005;8:443-9。
- 10.
Bradley D,Ratcliffe O,Vincent C,Carpenter R,Coen E.花序的开放承诺和拟南芥建筑。科学。1997年; 275:80-3。
- 11.
王志强,王志强,王志强,等。豌豆TCP.转录因子PsBRC1作用于独角金内酯的下游以控制芽分枝。植物杂志。2012;158:225-38。
- 12.
杨树功能基因组学研究进展。新植物学家。2004;164:43-51。
- 13.
苹果树花芽诱导的内控与分化。园艺评论。1982;4:174 - 203。
- 14.
卡斯蒂列霍C,佩拉兹s君士坦斯和丹魄活动决定英国《金融时报》表达触发开花。咕咕叫医学杂志。2008;18:1338-43。
- 15.
Celton JM,Gaillard S,Bruneau M,Pelletier S,Aubourg S,Martin-Magniette ML,Navarro L,Laurens F,Renou JP。苹果中的广泛反感转录与siRNA生产相关,表明转录和/或转录后对照的巨大潜力。新的植物学家。2014; 203:287-99。
- 16。
王志强,王志强,王志强,等。温度和水分对热带果树花诱导的影响。生物技术学报,1994;69:397-416。
- 17。
Colville L,Smirnoff N.抗氧化剂状态,过氧化物酶活性和PR蛋白转录水平,抗坏血酸缺乏拟南芥植物VTC突变体。J Exp Bot。2008; 59:3857-68。
- 18.
Corbesier L,Lejeune P,Bernier G.碳水化合物在拟南芥开花诱导中的作用:野生型和淀粉突变体之间的比较。Planta。1998年; 206:131-7。
- 19.
E.“青苹果”3年分枝系统中按位置的冬芽含量。安机器人。2003;92:581-8。
- 20.
近缘蔷薇科(Rosaceae)种的芽结构、位置和命运产生了不同的分枝模式。植物科学进展。2014;5:666。
- 21.
Crabbéj,escobedo-alvarez ja。activitésméristématiqueset和干线卧式保证人la转化florale des bourgeons chezle pommier(Malus×diverianta borkh。,cv。金色美味)。IN:L'Arbre,Biologie etDévelopement,2èmeColloqueIrternational Sur L'Arbre,C. Edelin(Ed。蒙彼利埃:HorsSérie; 1991.第369-79页。
- 22.
chechowski T, Stitt M, Altmann T, Udvardi MK, Scheible WR。拟南芥转录因子标准化相关内参基因的全基因组鉴定与检测。植物杂志。2005;139:5-17。
- 23.
Dadpour Mr,Movafeghi A,Grigorian W,Omidi Y.测定Malus Domestica中的花香术:一种新的形态发生方法。Biologia plantarum。2011; 55:243-52。
- 24.
杜兰·杰比,吉特顿·B, Peyhardi J, Holtz Y, Guédon Y, Trottier C, Costes, E.在果树生产的头几年中,分离不规律结果的苹果后代的遗传价值的新见解。J Exp Bot. 2013; 64:5099-113。
- 25.
杜志华,周旭,凌云,张志华,苏志华。一种面向农业社区的GO分析工具。核酸学报2010;38:W64-70。
- 26.
Esumi T,Tao R,Yonemori K.孤立多叶的和终端花1蔷薇科牡丹亚科六种果树的同源物。性植物再生。2005;17:277-87。
- 27.
Eveland AL, Jackson DP。糖、信号传导和植物发育。J Exp Bot. 2012;63:3367-77。
- 28.
Flachowsky H, Szankowski I, Waidmann S, Peil A, Tränkner C, Hanke MV。的MdTFL1苹果基因(苹果×家蝇。)减少营养生长和生成时间。树生理。2012; 32:1288-301。
- 29.
苹果早期花发育的形态和数量特征Malus x domestica borkh)。安机器人。2003;92:199 - 206。
- 30.
Franceschini A,Szklarczyk D,Frankild S等人。字符串v9。1:蛋白质 - 蛋白质相互作用网络,覆盖率增加和集成。核酸RES。2013; 41:D808-15。
- 31。
富勒福德RM。苹果芽的形态发生。III。鲜花的初始。Ann Bot。1966年; 30:207-19。
- 32。
吉布森SI。通过糖信号调控植物发育和基因表达。植物学报。2005;8:93-102。
- 33。
Guitton B,Kelner JJ,Velasco R,Gardiner Se,Chagnéd成本为E.苹果双年轴承的遗传控制。J Exp Bot。2012; 63:131-49。
- 34.
Halliday KJ, Koornneef M, Whitelam GC。光敏色素B和至少一种其他光敏色素介导植物的加速开花反应Arabidopsis Thaliana L..低红/远红比率。植物杂志。1994;104:1311-5。
- 35.
陈志强,陈志强,陈志强,等。无花无果-诱导果树开花的遗传潜力。基因基因组学。2007;1:1-20。
- 36.
Hättaschc,flachowsky h,Kapturska d,Hanke MV。与苹果(Malus Domestica)的花诱导和发育相关的开花基因和季节变化的分离。树生理。2008; 28:1459-66。
- 37.
Haydon MJ,Ordn TJ,贝尔LJ,Hannah Ma,Webb AAR。昼夜节日时钟的代谢调节。Semin Cell Dev Biol。2013; 24:414-21。
- 38.
hubourg B, Montagnon J, Ramonguilhem M, Lauri P. Fiche variétale: Gala et ses mutants。Réussir - fruit et Légumes。2003; 221: insert4p。
- 39.
Huet J.关于小苞叶的作用和果实诱导花的练习曲。Physiologie vegetale。1972; 10:529-45。
- 40.
胡应祥,王玉华,刘雪峰,李建勇。拟南芥Rav1.被油菜素内酯下调,可能在植物发育过程中起负调控作用。细胞研究》2004;14:8-15。
- 41.
Immink RGH, Posé D, Ferrario S, Ott F, Kaufmann K, Valentim FL, Folter, S de, Wal, F van der, Dijk ADJ van, Schmid, M, Angenent, GC。描述的SOC1通过对其上游和下游调控因子的识别,其在开花过程中的中心作用。植物杂志。2012;160:433-49。
- 42.
杰克逊迪,甜心GB。温带木质植物的花火。一项综述主要涉及针叶树和落叶果树的文献。在:园艺摘要。1972. p。9-24。
- 43.
Jaya Es,Clemens J,Song J,Zhang H,Jameson Pe。分析同质基因的定量表达分析桉树普通犬:AP1是开花的表达标记。树杂志。2010;30:304-12。
- 44.
郑正德,沈sk,安Constans-like“富士”苹果的cDNA克隆。J植物BIOL。1999; 42:23-31。
- 45.
约翰逊M,Staier D.SRR1在非诱导条件下抑制开花是必要的吗拟南芥蒂利亚纳.J Exp Bot. 2014; 65:5811-22。
- 46.
关键词:蛋白质氧化,生物活性,生命周期,蛋白质氧化拟南芥蒂利亚纳.J Biol Chem。2004; 279:22204-8。
- 47.
苹果和梨的两年生产物:文献调查。Sci Hortic。1979;11:303-17。
- 48.
Kaufmann K, Wellmer F, Muiño JM, Ferrier T, west SE, Kumar V, Serrano-Mislata, A, Madueno, F, et al.;通过APETALA1.科学。2010;328:85-9。
- 49.
Kocsy G, Tari I, Vanková R, Zechmann B, Gulyás Z, Poór P, Galiba, G.氧化还原对植物生长发育的控制。植物科学。2013;211:77 - 91。
- 50。
林志强,林志强,梁志强,等。的分子特征开花的轨迹t型苹果(马吕斯x家国内博尔德)。植物生理学报。2010;51:561-75。
- 51。
Kotoda N, Iwanami H, Takahashi S, Abe K.反义表达MdTFL1,一个TFL1-like基因,减少苹果的幼期。acta Hortic sinica, 2006; 131:74-81。
- 52。
Kotoda N,Wada M.MdTFL1,一个TFL1-like转基因拟南芥中苹果基因的表达,延缓了营养向生殖阶段的转变。植物科学。2005;168:95 - 104。
- 53。
Kotoda N,Wada M,Komori S,Tarkou S,Abe K,Masuda T,Soejima,J.表达模式的花卉营商形式基因的同源物LFY和AP1在苹果的花发育过程中。J AM SoC Hortic SCI。2000; 125:398-403。
- 54。
Kotoda N,Wada M,Kusaba S,Kano-Murakami Y,Masuda T,Soejima J.过度表达MDMADS5., 一个Apetala1在转基因拟南芥中导致早花。植物科学。2002;162:679 - 87。
- 55。
Kotoda N,Wada M,Masuda T,Soejima J.使用转基因方法在Apple中减少少年期的休息。XXVI国际园艺大会:园艺作物的生物技术改善:成就,机会和625. 2002年。337-43。
- 56。
黄志强,黄志强,黄志强,等。蔷薇科植物季节性开花规律的研究进展。J Exp Bot. 2013; 64:4131-41。
- 57。
Lauri Pe,Térouannee,Lespinasse JM,Regnard JL,Kelner JJ。几年苹果果实分支腋芽生长的基因型差异 - 一种水果轴承调控方法。SCI Hortic。1995年; 64:265-81。
- 58.
Lee J,Lee I. SoC1的监管和功能,开花途径集成商。J Exp Bot。2010; 61:2247-54。
- 59.
Levy YY, Dean C.《向开花的转变》。植物细胞。1998;10:1973 - 89。
- 60.
Lifschitz E,Ayre BG,Eshed Y.Fortigen和Anti-Florigen - 一种用于协调开花植物生长和终止的系统机制。植物科学的边疆。2014; 5:465。
- 61.
Liljegren SJ,Gustafson-Brown C,Pinyopich A,Ditta GS,Yanofsky MF。互动之间APETALA1那多叶的, 和终端FLOWER1指定Meristem命运。植物细胞。1999; 11:1007-18。
- 62.
吕强,赵磊,李东,郝东,詹勇,李文安GmRAV正交因子参与了大豆开花时间的光周期和蔗糖调控。《公共科学图书馆•综合》。2014;9:e89145。
- 63.
水杨酸调节开花时间,连接防御反应和生殖发育。植物j . 2004; 37:209-17。
- 64.
王志强,王志强,王志强,等。拟南芥的开花机制。:拟南芥。纽约:冷泉港实验室出版社,冷泉港;1994.403 - 33页。
- 65.
Matías-hernándezl,aguilar-jaramillo ae,Marín-gonzáleze,苏拉斯-LópezP,Pelaz S. Rav基因:花卉诱导和超越的调节。Ann Bot。2014; 114:1459-70。
- 66.
Miller G,Suzuki N,Rizhsky L,Hegie A,Koussevitzky S,Mittler R.缺乏细胞源和囊体抗坏血酸过氧化物酶的双突变体揭示了反应性氧物种,植物发育和对非生物应激反应之间的复杂相互作用。植物理性。2007; 144:1777-85。
- 67.
两个苹果(马吕斯x家国内博尔德。)同源物基因像异染色质PROTEIN1影响转基因拟南芥的开花时间和全植物生长。Mol Genet基因组学。2007; 278:295-305。
- 68.
Mimida N, Kotoda N, Ueda T, Igarashi M, Hatsuyama Y, Iwanami H, Moriya S, Abe kTFL1/CEN-like不同联动群体的基因显示出不同的表达模式来调节苹果中的营养和生殖发育(马吕斯x家国内博尔德)。acta botanica yunnanica(云南植物研究). 2009;50:394-412。
- 69.
Monselise SP,Goldschmidt EE。果树中的交替轴承。Hortic Rev. 1982; 4:128-73。
- 70.
Muñoz-fambuena n,Mesejo C,Agustím,Tárragas,iglesias dj,primo-millo e,gonzález-mas mc。“蒙卡萨”普通话蛋白质组学分析果实果实载荷。植物理性生物化学。2013; 62:95-106。
- 71.
中川M,本庄C,神崎S,清水K,宇都宫N.分离与表达分析开花的轨迹t型双年展芒果树中的胃肠杆菌素代谢基因。SCI Hortic。2012; 139:108-17。
- 72。
Neilsen JC, Dennis FG种子数、去果量、单枝长和密度对“斯潘塞无核”苹果开花的影响。Acta Horticult。2000;527:137-46。
- 73。
等。BRANCHED1与开花轨迹T以抑制拟南芥腋生分生组织的花过渡。植物细胞。2013;25:1228-42。
- 74。
奥斯纳托M,Castillejo C,Matías-HernándezL,Pelaz S.丹魄基因连接光周期和赤霉素途径控制拟南芥开花。Nat Commun。2012;3:808-15。
- 75。
陈建平,陈志强,陈志强,等。拟南芥生长发育过程中赤霉素对拟南芥开花的调控作用。发展。2012;139:2198 - 209。
- 76。
Preston JC, Hileman LC。植物的功能进化Squamosa-pligher结合蛋白质(SPL)基因家族。植物科学进展。2013;4:1-13。
- 77。
Ramírez F, Davenport TL, Fischer G.芒果成花启动子诱导和转运所需叶片数(Mangifera籼稻L。)在热带气候中。SCI Hortic。2010; 123:443-53。
- 78。
R核心开发团队。R:统计计算的语言和环境。维也纳:统计计算基础;2014.可以在:http://www.r-project.org/.
- 79。
陈志强,陈志强,陈志强,等。葡萄果实实时RT-PCR内参基因的克隆与表达分析。BMC Plant Biol. 2006;6:27。
- 80。
李志刚,李志刚。拟南芥花和果实发育的研究进展。Int J Dev Biol. 2005; 49:633-43。
- 81。
对季节线索的开花反应:有什么新发现吗?植物学报。2014;21:120-7。
- 82.
Samach A, Onouchi H, Gold SE, Ditta GS, Schwarz-Sommer Z, Yanofsky MF, Coupland g君士坦斯目的基因在生殖发育拟南芥.科学。2000;288:1613-6。
- 83.
Sawa M,Kay SA。Gigantea直接激活拟南芥拟南芥的开花座位。PROC NATL ACAD SCI U S A. 2011; 108:11698-703。
- 84.
陈志强,王志强,王志强,等。赤霉素对苹果二年生结果影响的研究。Acta Horticult。2009;884:663 - 70。
- 85.
Scofield S, Murray JAH。KNOX基因在植物干细胞龛中的功能。植物学报。2006;60:929-46。
- 86.
Sgamma T, Jackson A, Muleo R, Thomas B, Massiah A。丹魄是植物幼嫩度的调节剂。Sci众议员2014;4:3704。http://www.nature.com/articles/srep03704
- 87.
结果表明:果实负荷对柑橘花蕾整体基因表达和脱落酸(ABA)和吲哚乙酸(IAA)稳态的影响显著。J Exp Bot. 2014;65:3029-3044。
- 88.
柑橘轮作结果:开花期与非开花期植株开花控制基因表达的变化。《公共科学图书馆•综合》。2012;7:e46930。
- 89.
两年生轴承的研究:III。“开”和“关”年份树的生长研究。中国科学(d辑:地球科学);
- 90。
对多年生树木作物获得稳定年产量的限制。I:果实负荷大,营养生长占优势。植物科学。2013;207:158 - 67。
- 91。
宋艳红,王志强,王志强,等。植物花期的光周期和温度敏感性。植物生态学报。2013;18:575-83。
- 92。
在矮牵牛(Petunia)中,无顶分生组织(No Apical Meristem)基因在胚和花的模式形成过程中是必需的,在分生组织和原基边界表达。细胞。1996;85:159 - 70。
- 93.
李志强,李志强,李志强,等。不同水分胁迫对荔枝开花和产量的影响。Sci Hortic。1993;54:295 - 302。
- 94.
宋sk,余光华,安戈mdmads2.,一个成员Squamosa.基因亚家族,苹果。植物理性。1999; 120:969-78。
- 95.
宋志强,于光华,南俊,郑德辉,安国强。MADS-box基因的发育调控表达,mdmads3.和MDMADS4.,在苹果中的花蕾和水果的形态发生。Planta。2000; 210:519-28。
- 96。
宋志荣,陈磊,孟永华,李立峰。拟南芥花发育抑制机制的研究。植物学报2003;6:29-35。
- 97。
关键词:拟南芥,春化,基因调控,海拔梯度植物杂志。2014;166:1928-42。
- 98。
Tanaka N,Wada M,Komori S,Bessho H,Suzuki A.功能分析MdPI, 这激动人心苹果的基因同源物,在拟南芥.J日本SoC Hortic SCI。2007; 76:125-32。
- 99。
田中N, Ureshino A, Shigeta N, Mimida N, Komori S, Takahashi S, Tanaka- moriya Y, Wada M.过表达rapidopsis ft.苹果的基因导致永久开花。生物科技植物》。2014;31:11-20。
- 100。
Tan FC, Swain SM。一年生和多年生植物花起源和发育的遗传学。杂志。2006;128:8-17。
- 101。
Torti S,Fornara F,Vincent C,Andrésf,Nordströmk,GöbelU,Knoll D,Schoof H,Conceand G.拟南芥拍摄分析在花卉过渡期间的分析鉴定了不同的调节模式和富含少氨酸的重复蛋白开花。植物细胞。2012; 24:444-62。
- 102.
不同赤霉素对苹果花芽形成的影响。中国科学(d辑:地球科学)1982;57:277-82。
- 103.
陈志强。开花时间的远程调控。J Exp Bot. 2011; 62:4399-413。
- 104.
udvardi mk,czechowski t,scheible wr。十一金色定量RT-PCR规则。在线植物细胞。2008; 20:1736-7。
- 105.
Van der Linden CG, Vosman B, Smulders MJM。苹果营养组织中4个MADS box基因的克隆与鉴定。J Exp Bot. 2002; 53:1025-36。
- 106.
Velasco R,Zharkikh A,Firourtit J等人。驯化苹果的基因组(马吕斯×家国内博尔德)。NAT Genet。2010; 42:833-9。
- 107.
Wada M, Cao Q, Kotoda N, Soejima J, Masuda T. Apple有两个同源词FLORICAULA/多叶的参与开花。植物学报2002;49:567-77。
- 108.
张志强,张志强,张志强,等。海藻糖-6-磷酸信号对拟南芥开花的调控。科学。2013;339:704-7。
- 109.
王家,捷克B,Weigel D。miR156监管SPL转录因子在拟南芥中定义了内源性开花途径。细胞。2009; 138:738-49。
- 110。
王建伟,Park MY,王丽娟,古勇,陈学勇,Weigel D, Poethig RS. miRNA对树木营养阶段变化的调控。公共科学图书馆麝猫。2011;7:e1002012。
- 111。
陈志强,陈志强,陈志强,等。园艺树种花分化的调控。植物学报。J Exp Bot. 2008; 59:3215-28。
- 112。
吴克,公园我,康威,王家,伟莱D,Poithig卢比。顺序行动miR156和miR172调节拟南芥的发育时间。细胞。2009; 138:750-9。
- 113.
吴g,poethig卢比。拍摄开发的时间调节拟南芥通过mir156及其目标SPL3.发展。2006;133:3539-47。
- 114.
Wünschejn,palmer jw,greer dh。作物负荷对全套冠层“Braeburn”/ M.26苹果树的果实和气交换特性的影响。J AM SoC Hortic SCI。2000; 125:93-9。
- 115。
7个MADS-box基因在苹果果实不同部位的表达。acta Hortic sinica, 1999; 124:8-13。
- 116。
Yao JL, Dong YH, Morris BAM。MADS-box转录因子转座子插入突变授予单性果苹果果实产量。美国国家科学研究院2001;98:1306-11。
- 117。
yoo sj,chung ks,jung sh,yoo sy,lee js,ahn jh。ft和tfl1的兄弟(BFT) 拥有TFL1-like活动和功能冗余TFL1在拟南芥的花序分生成中。工厂J.2010; 63:241-53。
- 118。
朱QH,Helliwell Ca.开花时间和花卉图案的调节miR172.J Exp Bot. 2011; 62:487-95。
确认
我们感谢CIRAD(蒙伯利埃,法国)的基因分型平台提供的RNA提取和qRT-PCR测量设备,以及QuaSaV研究联盟的ANAN平台提供的微阵列设备。我们感谢T. Legavre对RNA提取的富有成果的讨论和宝贵建议,以及S. Gardiner和S. Tustin对手稿的批判性阅读。这项工作得到了法国国家农学研究所(INRA)植物育种部、新西兰植物和食品研究所有限公司(Pipfruit内部投资项目)以及新西兰商业创新和就业部[园艺基因组计划(CO6X0810)]的支持。
作者信息
从属关系
通讯作者
额外的信息
利益争夺
提交人声明他们没有竞争利益。
作者的贡献
BG进行了现场观察、qRT-PCR、微阵列统计分析并撰写论文;JJK进行了现场观察,参与了qRT-PCR和微阵列统计分析,并撰写了论文;XS提供了qRT-PCR专业知识和实验室设施;JPR和JMC设计了微阵列,并帮助详细阐述了结果;EC和DC设计了实验,解释了微阵列的结果并撰写了论文。所有作者都已阅读并批准了手稿的最终版本。
附加文件
附加文件1:图S1。
苹果芽取样策略。(PDF 130 kb)
附加文件2:表S1。
用于实时定量PCR分析的基因和引物列表。表S2。“红星”x“青史密斯”苹果遗传图谱遗传标记的基因组位置[35].表S3。用‘Starkrimson’x‘Granny Smith’苹果遗传图谱分析两年生结实相关QTL的基因组位置[25那35].表S4。通过qRT - PCR对每个苹果基因进行方差分析,估计其效应的显著性。表S5。苹果树之间相对表达差异差异的意义('ON')和树木对每次研究的开花('OFF')和每次日期。表S6。在三个采样日期中至少有一次差异表达的每组基因的基因数、平均和标准误差。表S7。基因本体(GO)对苹果树的顶端芽差异表达的基因分类,抑制开花('ON')或在第131(a),151(b)和222(c)时发起开花('关闭')。表S8。在第131 (A)、151 (B)和222 (C)天表现显著差异表达的苹果基因列表。表S9。在‘Golden Delicious’基因组上,抑制开花的苹果树(‘ON’)和开始开花的树(‘OFF’)表达的基因的基因组位置不同。表S10。在三个试验日期中至少有一个在抑制开花的苹果树(' ON ')和开始开花的苹果树(' OFF ')之间显示显著差异表达的基因列表,并利用' Starkrimson ' x ' Granny Smith '遗传图谱定位两年生结实相关性状的QTL区间[25那35].(XLS 1000 KB)
附加文件3:图S2。
表达式模式MdFT1那MdFT2那AFL1那AFL2那MdAP1a那MdAP1b那MdSOC1-like和MdTFL1采用实时荧光定量PCR技术,对第118天、第131天、第151天、第180天和第222天采收的果穗顶端芽进行了测定。(PDF 61 kb)
附加文件4:图S3。
通过qRT-PCR筛选候选基因的表达,验证微阵列的相对表达(log2比)。(PDF 63 kb)
附加文件5:图S4。
在第131(A),151(B)和222(C)的差异表达苹果基因的单一富集分析(SEA)产生的生物过程中的过度基因本体(GO)术语的分层树图。(PDF 533 KB)
附加文件6:图S5。
QTL苹果参考基因组的物理位置与双年轴承和基因显着表达。(PNG 1549 KB)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)除非另有说明,否则适用于本文中提供的数据。
关于这篇文章
引用这篇文章
Guitton,B.,Kelner,J.J.,Celton,J.M。et al。分析差异表达的成绩和断期的“晚会”成年树木的成绩单:对苹果的两年期轴承理解的贡献。BMC植物杂志16,55(2016)。https://doi.org/10.1186/s12870-016-0739-y.
已收到:
公认:
发表:
关键字
- 马吕斯x有明显
- 成花诱导
- 花卉抑制
- 微阵列
- QRT-PCR.
- 备用轴承