摘要
背景
尖孢镰刀菌。番茄根(FORL)是影响番茄作物的最具破坏性的病症病原体之一,导致相当大的场和温室产量损失。尽管存在如此重大的经济影响,但对调节的分子机制毫无疑问尖孢镰刀菌。番茄根番茄的抗性。
结果
通过转录组学研究了番茄抗感等基因系FORL反应的主要机制。在15 DPI(接种后天)进行的微阵列分析显示,两种基因型之间的基因表达模式不同接种vs徵条件。提出了植物对相容反应和不相容反应的反应模型。特别是在不相容的相互作用中,与次级代谢产物产生和色氨酸代谢相关的防御基因被激活。此外,FORL激发后细胞渗透势的维持是由脱水诱导蛋白介导的。至于相容的相互作用,激活由过氧化物酶和细胞色素单加氧酶介导的氧化爆发诱导细胞变性和坏死。
结论
我们的工作使我们能够全面了解番茄与FORL相互作用的分子基础。所得结果强调了抗性基因型和易感基因型对FORL攻击的不同转录反应。我们的发现可能导致疾病控制策略的改进。
背景
尖孢镰刀菌f、 sp。番茄根(FORL)是一种坏养殖病原体,番茄冠和根腐的因果剂,是商业番茄的全球经济重要性疾病。这种疾病导致温室,田间作物和水培培养的严重损失[1.].尽管已经有各种方法来控制这种病菌,但使用抗病品种是最可接受和最经济的控制系统[2.]. 在番茄里FRL.赋予Forl部分抗性的基因在染色体9的长臂上映射到染色体的长臂Tm-2基因座[3.].迄今为止,已释放有关涉及抗福尔抗性的基因的少数信息[4.]. 基于基因组的方法已被证明是非常有用的,以确定基因参与植物病原菌相互作用[5.]. 在小麦中,一种基于微阵列的方法揭示了每个植物器官(颖片、外稃、内稃、花药、子房和轴)的一种独特的转录组模式f . graminearum感染[6.].转录组分析也被证明在识别相关基因方面非常有用镰刀中国小麦地方品种对小麦赤霉病的抗性研究[7.]. 西瓜与小麦互作不亲和过程中的转录组分析F尖孢菌f、 sp。尼维(FON)表明,转运体蛋白可能有助于枯萎病症状的发展[8.]. 在番茄植株中也观察到防御相关基因的表达增加F尖孢菌f、 sp。Lycopersici.[9].
除了植物-微生物的相互作用,转录组学方法已经被广泛用于发现病原体定殖习性。为此,Carapito和他的同事[10]报道了一项全基因组转录组学分析f . graminearum,在不同的多糖源存在下提供该病原体生物学的新见解。NGS(下一代测序)方法有助于了解致病性的分子支撑F尖孢菌f、 sp。库本斯香蕉维管束萎蔫病的病原[11]. 事实上,转录组分析在揭示病原菌活动模式和防御反应的分子库方面非常有用,有助于剖析植物与病原菌相互作用的分子基础。
尽管由FORL引起的番茄病害很重要,但在发病过程中番茄基因组重编程的研究却很少。对番茄和这种土传真菌之间相互作用的更详细的了解将有助于发现更有效的控制这种疾病的方法。本研究的目的是研究耐药基因的转录变化(妈妈)易受影响(蒙纳博)通过Forl感染后的同种型番茄系,并比较兼容和不相容的相互作用之间的结果。此外,为了在这种相互关联和不相容的反应期间对这种相互作用进行更轻微的这种相互作用,基于在我们的研究中证明的互连途径的研究。
方法
实验中使用的植物和真菌菌株
易感番茄(茄属植物lycopersicum)多样化Marmande.用于初始致病性试验;同基因的番茄品种蒙纳博和妈妈,具有相同的很会赚钱的遗传背景除外FRL.基因[12],分别对FORL敏感和抗性,用于转录实验。我们实验中使用的番茄品种来自那不勒斯费德里科二世大学农业科学系植物遗传与生物技术科的种质收藏。FORL菌株为2007年从意大利Battipaglia自然感染的番茄植株中分离的For-l F55 NA。菌株For-l F55 NA常规保存在含有马铃薯葡萄糖琼脂(PDA;Oxoid),并在−80℃甘油(20%)中长期保存。
真菌侵染试验及植物侵染
从在24℃PDA上生长14天的孢子菌落中收集新鲜分生孢子。用5ml无菌蒸馏水(SDW)淹没培养皿,用无菌刮刀刮取分生孢子,并转移到50ml无菌试管中。然后将For-l F55NA的分生孢子悬浮液调节至最终浓度1 × 106.在光镜下用血细胞计计数分生孢子/mL。Marmande.植株先在无菌泥炭中生长至第一叶期,然后连根拔起,在1 × 10培养基中浸泡30分钟6.分生孢子/ml悬浮液。接种后的植株移入无菌沙盆中,在温室中生长21天。21天后对植株进行目测,根据以下疾病指数评定症状:0)无症状;1) 次生根和直根中度褐色病变;2) 主根和树冠严重腐烂;3) 死的或几乎死的植株。蒙纳博和妈妈幼苗在无菌泥炭中生长到第三叶期,然后从含有泥炭的盆中取出,根被轻轻冲洗以除去泥炭碎片。用分生孢子悬浮液浸根30min接种For-lf55na,以蒸馏水浸根30min作为对照。随后,将植株转移到含有无菌沙的盆中,并放置在生长室(22°C/14 h光照,16°C/10 h暗照)中。体积为5毫升的霍格兰溶液[13]在试验期间,每天都向植株供应。处理2周后,从盆栽中取出植株,在接种后10、15和21天(DPI)根据上述病害指数量表对番茄冠腐病和根腐病的发生进行目测评分。为了进一步证实For-lf55-NA菌株的接种效果,从发病指数大于1的植株组织中重新分离出真菌,将番茄植株连根拔起,用自来水冲洗;将茎段置于马铃薯葡萄糖琼脂平板上进行离体培养。
样品采集和mRNA分离
受感染和未受感染的根样本妈妈和蒙纳博在0dpi、7dpi、15dpi和21dpi采集基因型,分析真菌治疗后基因表达的变化。对于每个处理,采用30株植物,在三个独立重复试验中收集所有样品。从试管苗中取出根,称重,立即在液氮中冷冻,并在室温下保存−80摄氏度。使用RNeasy植物试剂盒(Qiagen)从粉末收集的样品中分离出根总RNA,然后按照制造商的说明用DNase I处理以去除任何污染的基因组DNA。使用Agilent 2100生物分析仪(Agilent Technologies)评估RNA完整性。
芯片设计与微阵列杂交
在使用Combimatrix平台合成的90k Tomatarray1.0微阵列上进行转录体分析[http://www.combimatrix.com在维罗纳大学植物功能基因组学研究中心。利用基因芯片技术研究了FORL感染后15天番茄基因表达谱,并与未感染对照组进行了比较。该芯片携带25789个非冗余探针(23282个唯一探针和2507个多目标探针),随机分布在整个阵列中,一式三份。序列信息的来源包括来自DFCI番茄基因IndexRelease 12.0的暂定一致序列(TCs)和表达序列标签。用上标间接RNA扩增试剂盒(Invitrogen)扩增总RNA(2μg)获得反义RNA(aRNA)。aRNA标记采用Alexa-fluor647活性染料。纳米滴™ 1000(Thermo Scientific)用于检查每个复制品的RNA和标记aRNA的数量和质量。由于对照分析失败的样本很少,因此采用两个生物复制品进行进一步的实验。根据制造商的建议,将标记的aRNA与阵列杂交[http://www.combimatrix.com]. 根据制造商的方案进行预杂交、杂交、洗涤和成像。使用Perkin Elmer扫描阵列4000XL(软件ScanArray Express微阵列分析系统v4.0)扫描阵列。
数据分析
扫描Combimatrix阵列分析使用生物导体封装[14]. 使用分位数标准化对数组进行标准化,并使用经验贝叶斯方法编制表达式估计[15].差异表达探针组使用R软件(R Core Team 2013)和limma软件包进行识别。使用基因芯片线性模型评估接种和非接种基因型的差异表达,以比较不同的实验条件(接种和非接种)[16]. 在我们的工作中,单个RNA样本的技术复制品(带有独立标记的小份)多达4个,非冗余探针在整个阵列中至少分布了3个,并且使用严格的参数进行统计分析,避免了混淆因素。差异表达分析的意义进行了评估,考虑到多重测试设置和控制错误发现率(FDR)在FDR = 0.05. 所有微阵列表达数据都可以在NCBI的GEO数据集中的序列ID条目GSE71393下获得。
注释基因芯片
用一个内部管道来注释作为微阵列探针的番茄暂定一致序列(tc)。利用BlastN (E-value 1e-3)将TC序列与番茄CDS序列进行比对,鉴定番茄相关基因。解析最新版本的番茄gff3注释文件,提取基因探针的CDS序列。Blast2GO管道(http://blast2go.bioinfo.cipf.es/),采用BlastP分析的期望值阈值为1e-6,对番茄蛋白鉴定进行自动高通量注释、基因本体定位和分类。Blast2GO还用于基于Fisher精确检验的GO项富集分析,并使用FDR截断值0.05进行多次测试校正。Sol基因组学(www.solgenomics.net.)数据库有助于找到更多关于注释基因的信息,而SolCyc (http://solcyc.solgenomics.net/)研究了番茄与FORL相互作用的途径和生化反应。为了进一步重建参与反应的途径,KEGG数据库(http://www.genome.jp/kegg/)被询问以发现参与不相容和兼容的相互作用的酶。
RT-qPCR分析
进行了三种QPCR测定:1)测定以监测报告基因的激活Marmande.在21 dpi;2)测定监测Forl疾病的时间课程妈妈和蒙纳博0dpi、15dpi、21dpi基因型;3) 测定妈妈和蒙纳博在0、7和15 DPI来验证微阵列结果。所有qPCR检测均按照实时荧光定量PCR实验指南(MIQE)的最低发布信息进行[17]具体描述如下。所有PCR反应均使用转子基因6000上的SensiFast SYBR Hi-Rox试剂盒(Bioline)进行三次™ (根据制造商的说明。按照制造商的说明,使用SuperScript®III逆转录酶试剂盒(Life Technologies)使用总共1μg提取的mRNA合成第一链cDNA。在最终体积为13μl的培养基中建立反应,包括:4.5μl(1:20稀释)cDNA模板、6.25μl SensiFast SYBR Hi-Rox 2x、4.28μM引物对混合物和水,以构成总体积。对于每对引物,使用高压灭菌双蒸馏水替换cDNA,包括阴性无模板对照。所有样本均标准化为肌动蛋白作为参考基因[18,19]用引物3设计了特异性引物(http://primer3.ut.ee/). 所有引物序列显示在附加文件中1.:表S1,最终扩增产物大小约为100bp。扩增条件为40个循环,95°15 s(变性),然后60°1 s和72°20 s(退火和延伸)。使用RotorGene6000进行数据分析™ 软件1.7使用未接种的样本作为校准品,使用ΔΔCT方法(Livak和Schmittgen,2001)分析表达数据。
结果
疾病时程研究
为了研究番茄与forl的互作关系,我们进行了一项评估感病品种病害演化的实验Marmande..在10 dpi少量棕色病变(疾病指数尺度0-1)上观察到次生,在15 dpi下,在胶带胶滴和植物冠上的腐烂情况下被证明(疾病指数规模1-2)和21 dpi严重腐烂在Taproot上植物冠(疾病指数尺度2-3)可见。在病原体反应中发挥关键作用的实时定量聚合酶链反应(QPCR),例如苯丙氨酸氨酶(PAL),过氧化氢酶,受体样蛋白激酶(RLK)4丝氨酸/苏氨酸和β-葡糖苷酶。为了监测感染和无感染的肉体响应Marmande.根示例(附加文件2.:图S1)。之所以选择这些基因,是因为它们的表达提供了对抗环境应激刺激的防御反应激活的间接证据[20,21]. PAL、β-葡萄糖苷酶和RLK4丝氨酸/苏氨酸基因在感染样本中表达上调,而过氧化氢酶基因表达下调。这些结果证实了感染和未感染样本之间的差异反应。随后,在这两个等基因型中评估过氧化氢酶和β-葡萄糖苷酶对福林的抗性(妈妈和蒙纳博)0 DPI、15 DPI、21 DPI(数据未显示)。在抗性基因型中妈妈过氧化氢酶基因在接种后的任何时间都被证实上调,而在易感基因型中蒙纳博,其表达由15 DPI下降到21 DPI。耐药基因型中,0 DPI时β -葡萄糖苷酶基因表达下调,15 DPI和21 DPI时表达上调。而易感基因型在0 DPI时表达上调,15 DPI时表达升高,21 DPI时表达显著降低。这些观察结果被用来建立在15 DPI时采集样本进行微阵列分析的时间,因为在这个时间点,两个等基因系之间的基因表达发生了切换。
全基因组转录分析
利用基因芯片技术研究了番茄抗病基因型和感病基因型在15dpi时与病原菌的相互作用。进行了四个不同的实验,以便对抗性/敏感性反应进行所有可能的比较(附加文件)1.:表S2)。在第一个实验中,我们比较了所有的转录激活或抑制在抗病,接种和未接种妈妈基因型(互作不亲和);在第二个实验中,我们比较了接种和未接种蒙纳博易感基因型,以探索所有的转录激活过程中的易感反应(兼容互动)。在第三个实验中,敏感基因型和抗性基因型之间的转录变化被强调(相容与不相容交互作用);在第四个也是最后一个实验中,我们监测了敏感和抗性非接种样品的反应(对照反应)。在对照反应中发现了极少量的差异表达基因;其中一个LRR受体(Solyc01g009690.1.1)、一个热休克蛋白(Solyc09g010630.2.1)和一个普遍应激蛋白(Solyc09g011670.2.1),证实两个分析基因型是同基因型。
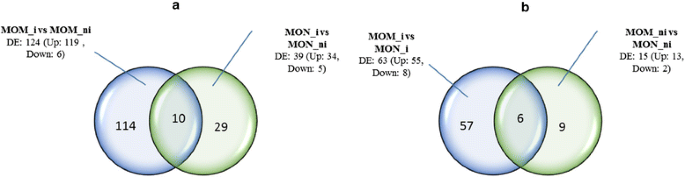
通过查询15734个番茄基因,研究了接种FORL的番茄抗感苗的转录反应。在不亲和互作中观察到124个差异表达基因,而在亲和互作中观察到39个差异表达基因。特别是119个基因(约90%)在不亲和互作中上调,表明在感染过程中有相当多的基因激活。在亲和互作中,有34个基因表达上调。在不亲和与亲和互作中,我们观察到63个差异表达基因,其中55个表达上调,而只有8个表达下调。在前两个比较中,很少观察到上调的重叠基因(10)。1a级),而在另外两个比较中,只有六个重叠基因被证明(图。1b级).4个实验中基因表达量比较,上调的基因多于下调的基因,提示FORL感染后基因组重编程导致了基因的高活化。
在不亲和互作中,乙烯生物合成的几个基因表达上调,包括一个推测的1-氨基环丙烷-1-羧酸盐(Solyc12g006380.1.1)和一个类似AP2的乙烯反应转录因子(Solyc03g044300.2.1)。参与赤霉素信号成分的GID1样赤霉素受体(Solyc01g098390.2.1)和编码钙调素等钙依赖蛋白的基因也上调(Solyc02g079040.2.1;Solyc11g071740.1.1;Solyc08g014280.2.1;Solyc01g068460.2.1)。此外,一些参与抗性反应的受体基因表达上调,包括CC-NBS-LRR(Solyc04g015210.2.1和Solyc04g007050.2.1)和LRR重复蛋白(Solyc07g066240.2.1)。有趣的是,在这种相互作用中检测到一种脱水诱导蛋白和一种细胞色素p450蛋白(分别为solyc09g09640.2.1和solyc12g09390.1.1)。CYP83B1单加氧酶(Solyc09g092640.2.1)是一种参与硫甙生物合成、色氨酸代谢和其他次生代谢产物生物合成的酶。此外,使用Blast2GO工具,一些DE基因被分配到精氨酸和脯氨酸代谢(Solyc04g014510.2.1谷氨酰胺合成酶)、谷胱甘肽代谢(Solyc05g006750.2.1谷胱甘肽S-转移酶)的KEGG图谱,吲哚生物碱途径(Solyc07g055740.1.1 Strictosidine合成酶样)和苯丙烷和木质素生物合成(Solyc12g094520.1.1 4-香豆酸:辅酶A连接酶),将进一步讨论。
在亲和互作中,通过比较接种和未接种的易感基因型的转录组,发现有几个基因表达上调。有趣的是,观察到参与脂肪酸(和茉莉酸)生物合成的基因的高度激活,包括ω-6脂肪酸去饱和酶(solyc04g04130.1.1)和茉莉酸ZIM结构域蛋白(Solyc12g009220.1.1)。一个上调的1-氨基环丙烷-1-羧酸盐(Solyc12g006380.1.1)基因参与乙烯生物合成和乙烯反应转录因子(Solyc02g077370.1.1)和一个下调的LRR受体如丝氨酸/苏氨酸(Solyc01g009690.1.1)。细胞色素p450蛋白(Solyc10g080840.1.1)作用于多种底物,在亲和作用中也被上调。参与嘌呤代谢(Solyc11g065930.1.1黄嘌呤脱氢酶/氧化酶)和苯丙氨酸代谢(Solyc03g025380.2.1过氧化物酶)的上调基因;Solyc04g071890.2.1(过氧化物酶4)也被检测到。
对亲和不亲和的基因型数据集进行直接比较,发现在敏感基因型中有若干过表达的致病相关(PR)蛋白,包括PR-2 (Beta 1-3-葡聚糖酶,Solyc10g079860.1.1和Solyc01g008620.2.1)、PR-3(几丁质酶,Solyc07g009510.1.1)、PR-11(酸性几丁质酶,Solyc05g050130.2.1)、PR-6 (kunitz型蛋白酶抑制剂,Solyc03g098710.1.1 -蛋白酶抑制剂II, Solyc03g020060.2.1 -蛋白酶抑制剂,Solyc11g021060.1.1)和PR-10 (PR-10相关去氯尿合酶样蛋白,Solyc07g005380.2.1和致病相关蛋白4B, Solyc01g097240.2.1)。
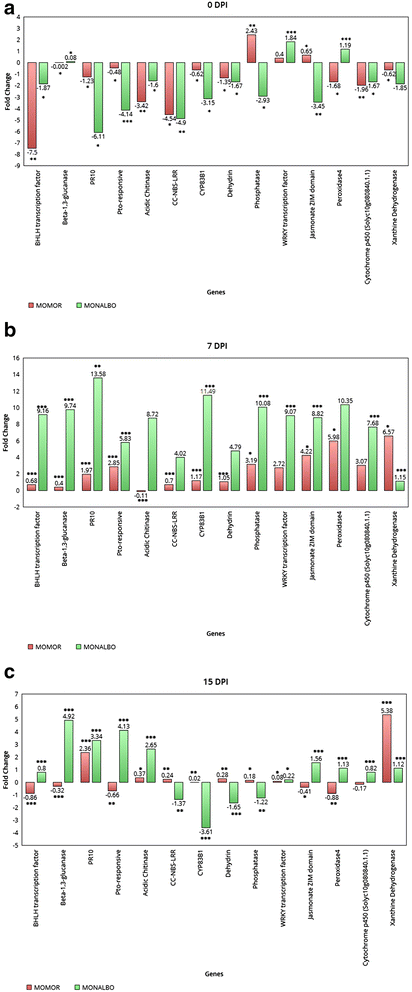
在3个时间点(0、7和15 DPI)对14个目的基因进行qPCR检测,结果表明,这14个目的基因在两种分析基因型的感染根和未感染根中均有差异表达。该实验的目的是监测在之前的微阵列实验中鉴定的关键基因的表达,这些基因属于参与植物防御反应的主要基因类别。两种基因型的基因表达模式不同接种的vs未接种情况得到了证实。在时间点0(图。2.面板A.)除了抗性品系中的磷酸酶和茉莉酸ZIM结构域蛋白基因、感病品系中的β-1,3-葡聚糖酶和过氧化物酶4以及两个品种中的WRKY转录因子上调外,大多数分析的基因都导致表达下调。几乎所有的靶基因在7dpi时都在两种基因型中上调(图。2.面板B)除酸性几丁质酶外,在抗性品系中表达不足。两种基因型对FORL的攻击都有很强的反应,特别是直接参与抗性过程的基因,在这个时间点显著上调。在15 DPI时,在不相容相互作用中观察到CC-NBS-LRR抗性蛋白、CYP83B1细胞色素p450、脱水素、磷酸酶和WRKY转录因子的上调,证实了微阵列实验中获得的结果(图。2.面板C). 在亲和互作中,大多数靶基因在最后两个qPCR实验时间点上调。
基因富集分析
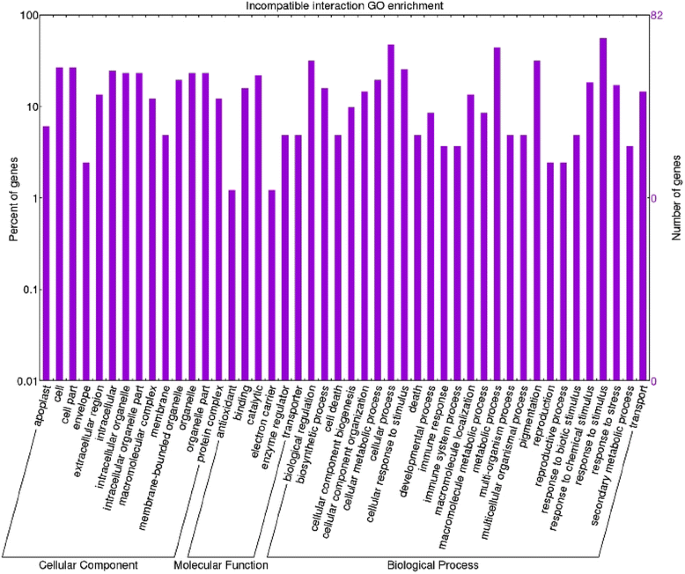
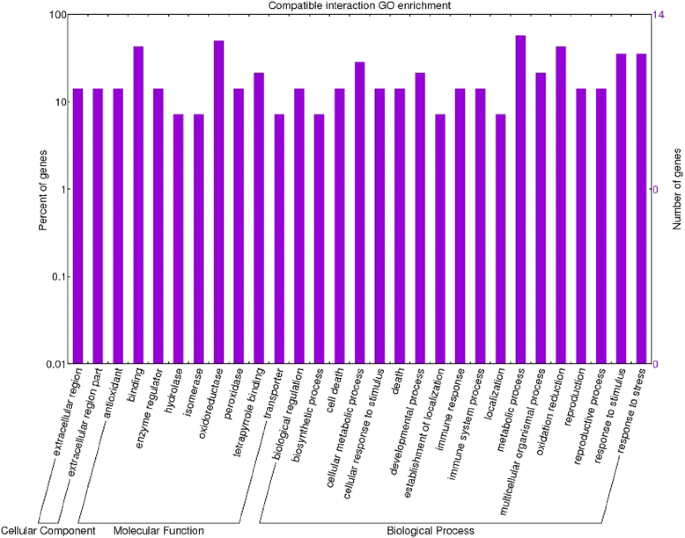
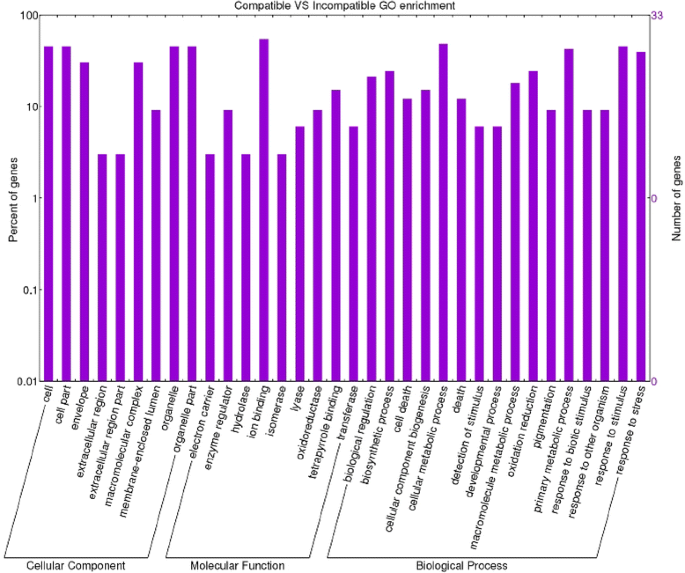
一个GO(基因本体论)术语注释分析进行了所有的转录。通过这种分析,我们能够为差异表达的转录本分配功能注释。在不相容交互数据集上进行的基因本体分析使我们能够在相容交互数据集中识别93个丰富的功能组和68个丰富的类别。直接比较两种基因型的数据集,共观察到198个富集GO项。在生物过程、分子功能和细胞成分类别中,在不相容相互作用中,术语“代谢过程”、“合酶活性”、“合酶复合物”、“生物合成过程”和“反应”占主导地位(图。3.). 特别是,发现了七个与硫代葡萄糖苷合成相关的特定GO术语(“吲哚葡萄糖酸生物合成过程”,GO:0009759-“S-糖苷生物合成过程”,GO:0016144-“硫代葡萄糖苷生物合成过程”,GO:0019761-“硫代葡萄糖苷生物合成过程”,GO:0019758–“S-糖苷代谢过程”,GO:0016143–“硫代葡萄糖苷代谢过程”,GO:0019760–“硫代葡萄糖苷代谢过程”,GO:0019757)。这一发现使我们可以考虑硫代葡萄糖苷和色氨酸衍生的代谢物作为番茄抗药性的主要参与者。有趣的是,参与色氨酸代谢的细胞色素p450基因‘Solyc09g092640.2.1’存在于上述GO类别以及‘细胞壁修饰’(GO:0042545)。在这种相互作用中还发现了其他几个与细胞壁结构变化相关的富集GO术语:“细胞壁增厚”(GO:0052386)和“细胞壁胼胝质沉积”(GO:0052543);”细胞大分子定位'(GO:0033036–GO:0070727);'韧皮部筛板中胼胝质沉积'(GO:0080165)、'多糖定位'(GO:0033037)和'胼胝质定位'(GO:0052545);'维管和韧皮部运输'(GO:0010233)。在信号转导、转录因子激活和细胞对刺激的反应(GO:0007165–GO:0009719–GO:0051716–GO:0060416–GO:0071495–GO:0009628)中也检测到丰富的GO类别,而在相容的相互作用中,术语“氧化过程、代谢过程、细胞死亡”,“氧化还原酶活性、抗氧化活性和结合”、“细胞外”分别是生物过程、分子功能和细胞成分中最丰富的(图。4.).在兼容和不兼容的数据集(图。5.检测到关于响应刺激和代谢过程的不同GO术语,表明对病原体的反应产生强烈作用。特别地,进一步研究了关于代谢过程的关于代谢过程的术语,因为它们揭示了有趣的激活植物 - 病原体相互作用的病因相关蛋白质。
番茄-杂合不亲和互作模型
转录型谱调查和转入富集分析用于重建在不相容的响应期间番茄素相互作用中涉及的途径。不相容的相互作用揭示了尤其是信号转导,代谢过程,色氨酸代谢和细胞壁修饰的变化。有趣的是,细胞色素P450基因(Solyc09G092640.2.1)以与葡萄糖苷和色氨酸衍生的代谢物的生产和细胞壁改性有关的几种富集的GO类别。该基因在这种代谢途径中的参与,在病原体反应期间活化,让我们假设它在抵抗过程中具有重要作用。值得注意的是,“Solyc07G056260.2.1”,葡聚糖合成酶,也称为胼callose合成酶7,在与细胞墙体结构变化相关的所有GO期类别中,超越了。在这种相互作用中也富集了对刺激,信号转导和转录因子激活的细胞响应的GO类别。
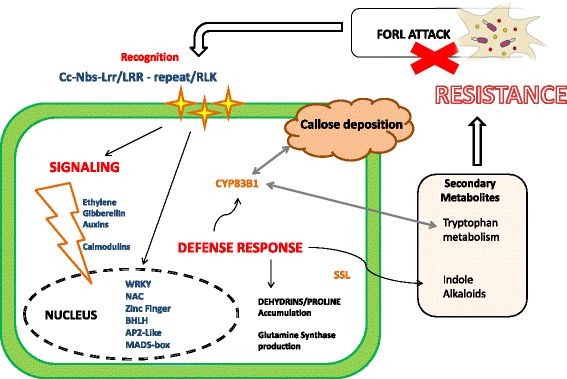
结合所获得的结果,我们能够勾勒出番茄不亲和互作的模型(图。6.).存在上调的CC-NBS-LRR,LRR重复和RLK抗性蛋白表明有效的病原体识别,导致由乙烯和尤其是钙调汀等激素介导的信号传导级联。该信号级联激活几个转录因子系列,触发双层防御响应:激活CYP83B1和SSL(Streterodine合酶样)基因。首先涉及在对病原体中产生色氨酸衍生的次生代谢物,并将核糖沉积到细胞膜上。SSL基因可能导致吲哚生物碱作为次级代谢产物产生对病原体发作产生负面影响的次级代谢物。同时,GST(谷胱甘肽S-转移酶)基因的上调支持来自所有次级代谢物的植物解毒机制的假设,植物本身的较大量可能是阴性的。最后,脱氢可以作为迫使根攻击后的细胞渗透潜力维持的调节剂。
番茄亲和互作模型
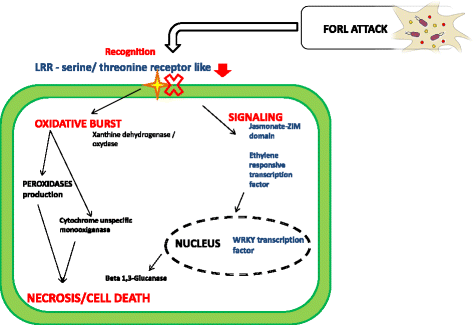
亲和互作对病原菌的攻击反应完全不同。氧化还原酶活性似乎在这种相互作用中起着核心作用,因为发现了与这种分子功能相关的不同富集GO术语('氧化还原酶活性,作用于成对供体,分子氧的掺入或减少(GO:0016705–“氧化还原酶活性”–GO:0016491“氧化应激反应”,GO:0006979–“超氧化物代谢过程”,GO:0006801)。其中,我们检测到黄嘌呤脱氢酶和血红素过氧化物酶,它们通常参与植物细胞壁的生物合成、对伤害的防御反应、木质素亚基的氧化聚合以及ROS的产生和次生代谢产物的合成。有趣的是,细胞色素p450(Solyc10g080840.1.1)似乎也参与了这种相互作用。这种单加氧酶作用于多种底物:催化的反应包括羟基化、环氧化、N-氧化、硫氧化等。共生体(GO:0034050)、植物型超敏反应(GO:0009626)和纤维素酶活性的明确调节(β-13-葡聚糖酶)诱导的宿主程序性细胞死亡在蒙纳博-FORL交互。这些发现可能与目测感病植物的坏死反应有关。的确,比较两种接种基因型(实验3)的结果发现,在涉及发病的敏感样本(Solyc01g008620.2.1 Beta-1 3-葡聚糖酶;Solyc03g098740.1.1 Kunitz胰蛋白酶抑制剂;Solyc05g050130.2.1酸性几丁质酶;Solyc11g021060.1.1蛋白酶抑制剂;Solyc03g020060.2.1蛋白酶抑制剂II)和其他有趣的氧化石墨烯术语,涉及应激反应(GO:0006950)、对真菌的防御反应(GO:0050832)、生物刺激检测(GO:0009595)和细胞死亡(GO:0008219)。这些发现让我们假设了一个完全不同的番茄和FORL相互作用模型:蒙纳博与抗性基因型相比,对病原体的反应似乎更弱、更慢。首先,在识别阶段,膜受体LRR丝氨酸/苏氨酸蛋白激酶表达下调。第二,该反应继续直接激活由过氧化物酶和细胞色素单加氧酶介导的氧化爆发。第三,乙烯和茉莉酸信号分子激活一个信号级联,诱导转录触发,由WRKY转录因子介导,导致细胞坏死反应。这种情况的发生不仅受到β1 3-葡聚糖酶(一种参与细胞壁降解的酶)上调的支持,而且还受到初始氧化爆发的酶活性的支持(图。7.).
讨论
通过四个不同的实验来评估抗性和易感反应中激活或抑制的转录本,完成了番茄- forl相互作用的全局转录组谱。番茄- forl相互作用似乎遵循了典型的坏死病原体反应,激活识别病原体源蛋白的受体,诱导三种主要防御激素的产生和运输,即SA、JA和ET(分别为水杨酸、茉莉酸、乙烯)[22–24].在不相容的相互作用中,通过转录因子的转录和/或翻译后激活,参与植物生长发育和防御反应的众多靶蛋白的细胞信号级联和调控,导致植物防御基因的诱导[25–27].特别是,钙调素/钙传感器蛋白和钙调素相关蛋白似乎在番茄- forl相互作用中发挥了积极的作用。这一发现表明,抗性基因型更有能力部署多种防御反应,以防止病原体定植。此外,不相容反应GO类别富集分析表明,色氨酸代谢/生物合成和细胞壁胼胝质沉积在对FORL的响应中起关键作用。CYP83B1是一种参与色氨酸特别是硫代葡萄糖酸代谢的单加氧酶,在这种相互作用中过表达。硫代葡萄糖苷及其产物具有抑菌作用镰刀菌素。[28,29]其水解产物也影响生物营养性病原体的反应[30]. 此外,在抗番茄黄化曲叶病毒的番茄中观察到高产量的色氨酸衍生代谢产物[31]. CYP83B1还与胼胝质合成酶7一起参与细胞壁修饰和胼胝质沉积。当胼胝质以较高的量沉积时,它能强烈地抵抗土传真菌的渗透[32].一种上调的类strictosidine合酶(SSL)基因支持单萜吲哚类生物碱在相互作用过程中释放的假说。这种酶位于根顶端分生组织的表皮上[33[催化通过从色氨酸合成的色氨酸,用单萜素Secologanin,产生术术,致细胞素,产生术术的初始步骤,催化单萜类吲哚生物碱(MIAS)途径的初始步骤。34].该基因可被乙烯AP2/ erf域转录因子(Solyc03g044300.2.1)诱导表达,本实验上调该基因,并已证实参与激活植物防御反应[35].旋毛虫苷合酶样蛋白也已被鉴定为植物防御激活的病原体,如黄瓜花叶病毒和十字花格孢[36].坏死病原菌引起的细胞损伤也会导致水分流失[37[耐药基因型中脱氢(Solyc12G099390.1.1)和谷氨酰胺合成酶(Solyc04G014510.1.1)的活化可以有助于纠正渗透应激,避免诱导的根和冠腐[4.]表明在妈妈被FORL感染的植物,以及较少量的谷氨酰胺合成酶(EC:6.3.1.2; solyc04g014510.2.1),涉及氮同化途径的酶,支持我们的结果。谷氨酰胺合成酶可以改变谷氨酸代谢,导致其他虚张胞菌病原体相互作用中已报告的“耐久性”状态[38]. 耐久性可以被定义为一种状态,在这种状态下,细胞的生存能力是通过氮(N)的再利用来维持的,并参与了衰老性质的“刀耕火种”防御反应[39].N向入侵区域的迁移证明对抵抗寄主是有效的[40,41.]. 谷胱甘肽S-转移酶(GST)的上调,以及在肝脏中发现的蛋白质水平的增加妈妈-FORL相互作用[4.],支持其参与抵抗进程。自从妈妈基因型组成性地表现出较高的谷胱甘肽S-转移酶的数量,无论FORL感染,可以推断该蛋白参与了抗性过程[4.]. 众所周知,GST有助于减轻感染区域周围细胞的进一步氧化损伤[20,42.,43.].
在亲和相互作用中,检测到一个上调的茉莉酸ZIM结构域蛋白和一个上调的Omega-6脂肪酸去饱和酶。一般来说,JA和ET在对坏死性病原体和咀嚼性昆虫的防御反应中起着重要作用,而SA则更多地参与对生物营养体和吮吸性昆虫的反应[44.,45.].在蛋白质组水平上对番茄- forl相互作用的研究证实了在相容相互作用中存在大量的过氧化物酶[4.]. 一种非特异性的单加氧酶也可能参与氧化还原酶的活性和对病原菌的敏感品种的坏死。与代谢过程和应激反应相关的GO术语,包括编码β1,3-葡聚糖酶、几丁质酶和蛋白酶抑制剂等PR蛋白的几个基因,在两种接种基因型之间的比较中上调。PR蛋白在受感染组织和周围组织以及远处未受感染组织中局部积聚[46.]. 在这些蛋白质中,β1、3-葡聚糖酶和几丁质酶是真菌侵染植物中非常丰富的水解酶,通过降解细胞壁在抵御真菌侵染的防御反应中起着重要作用[47.]. qPCR分析有助于我们更好地描述番茄FORL相互作用。两种基因型之间的基因表达模式不同接种的vs未接种结果表明,在0 DPI时,除WRKY转录因子参与植物防御反应的早期信号转导和激活外,两种基因型的绝大多数基因都出现了下调。在这一阶段,另一种信号蛋白(磷酸酶)在抗性系中表达上调,表明在这种基因型中,警报成分被迅速诱导。抗性基因型显然更有能力激活信号成分,防止病原菌定植,同时通过上调涉及渗透潜能维持(脱水诱导蛋白)和细胞解毒的基因来补偿病原菌诱导的整体应激(Glutathione-S-transferase)。易感基因型对病原体表现出完全不同的反应,其特征是明显激活氧化破裂,诱导细胞变性和坏死。
结论
转录组分析被证明是非常有用的,在识别番茄分子布局,可用于对抗病原体入侵,并进一步阐明生命形式之间的相互作用机制。抗性基因型通过一个关键基因(CYP83B1)来控制病原菌的攻击并维持细胞的适应性,而易感基因型则试图通过激活防御库来提醒植物病原菌的感染,但由于缺乏抗性机制而失败。我们的工作使我们对番茄与FORL相互作用的分子基础有了更深入的了解,并且可以作为今后功能研究和疾病控制策略改进的起点。
数据和材料的可用性
支持本文结果的微阵列数据集可在NCBI的GEO数据集(http://www.ncbi.nlm.nih.gov/gds)在序列号GSE71393下。
缩写
- DE基因:
-
差异表达基因
- DPI:
-
几天后培养液
- 电子技师:
-
乙烯
- 罗斯福:
-
错误发现率
- FHB公司:
-
镰刀头枯萎
- 归档:
-
尖孢镰刀菌。库本斯
- 电话:
-
尖孢镰刀菌f.sp。尼维
- 适用范围:
-
尖孢镰刀菌。番茄根
- 开始:
-
基因本体论
- 格林威治恒星时:
-
谷胱甘肽S-转移酶
- 是:
-
茉莉酸
- 军情处:
-
单萜吲哚生物碱
- 门店:
-
下一代测序
- 朋友:
-
苯丙氨酸解氨酶
- RLK:
-
像激酶等受体
- 南非:
-
水杨酸
- SSL地址:
-
狭窄苷合酶样
- TCS:
-
初步共识序列
工具书类
- 1.
麦戈文RJ。番茄尖孢镰刀菌病害的防治。作物保护。2015;73:78 - 92。
- 2.
Szczechura W,Staniaszek M,Habdas H. Fusarium Oxysporum F. SP。radicis-lycopersici - 番茄栽培中镰刀冠的原因和根腐蚀。j植物prot res。2013; 53:2-6。
- 3.
Ligoxigakis ek。联系之间FRL.(尖孢镰刀菌。番茄根阻力)和Tm-2番茄(Lycopersicon esculentum)抗烟草花叶病毒基因座的研究。植物病理学。1997;2:319–23.
- 4。
Mazzeo MF,Cacace G,Ferriello F,Puopolo G,Zoina A,Ercolano MR,Siciliano RA番茄根对forl侵染反应的蛋白质组学研究。植物生理生化。2014;74:42–9.
- 5。
Ercolano先生,Sanseverino W,Carli P,Ferriello F,Frusciante L。R基因介导番茄抗病性的遗传和基因组研究:回顾与展望。植物细胞代表2012;31:973–85.
- 6。
Golkari S,Gilbert J,Prashar S,Procunier JD。镰刀酸纤维素诱导的小麦基因的微阵列分析:鉴定器官特异性和差异表达基因的鉴定。植物Biotechnol J. 2007; 5:38-49。
- 7。
肖杰,金X,贾X,王H,曹A,赵W,裴H,薛Z,何L,陈Q,王X。基于转录组的小麦长白王水白抗赤霉病途径及相关基因的发现。BMC基因组学。2013;14:197.
- 8.
吕,郭S,张H,耿L,宋F,费Z,徐Y。西瓜与尖孢镰刀菌互作过程中的转录谱分析。泥鳅。植物病理学杂志。2011;131:585–601.
- 9.
Andolfo G,Ferriello F,Tardella L,Ferrarini A,Sigillo L,Frusciante L,Ercolano MR.番茄基因组对枯萎病和番茄花叶病毒的转录反应。公共科学图书馆一号。2014;9(5):e94963。内政部:10.1371/journal.pone.0094963.
- 10.
Carapito R,Vorwerk S,Jeltsch J-M,Phalip V.镰刀酸纤维素对植物壁衬底的基因组转录响应。有限元微生物吧。2013; 340:129-34。
- 11.
郭l,韩,杨l,zeng h,风扇d,zhu y,feng y,王g,彭c,江x,周d,ni p,梁c,刘l,王j,毛c,方x,彭米,黄杰。真菌病原体牡蛎F的基因组和转录组分析。sp。造成香蕉血管枯萎病的立方体。Plos一个。2014; 9:E95543。
- 12
拉特洛特H。不同抗病基因的Moneymaker型近等基因番茄品系修订表。代表番茄基因合作社。1993;43:79–80.
- 13
Hoagland dr,Robert D,Arnon Di。没有土壤种植植物的水培养方法。Circ Calif Agric Exp Station。1950; 347(第二次编辑):32。
- 14。
《生物导体:计算生物学和生物信息学的开放软件开发》。基因组生物学。2004;5:R80。
- 15.
吴Z,Irizarry R a,先生R,马丁内斯Murillo F,斯宾塞F。基于模型的寡核苷酸表达阵列背景调整。2004年美国统计协会;99:909–17.
- 16。
斯迈思GK,米肖J,斯科特HS。使用阵列内复制点评估微阵列实验中的差异表达。生物信息学。2005;21:2067–75.
- 17。
Bustin Sa,Benes V,Garson Ja,Hellemans J,Huggett J,Kubista M,Mueller R,Nolan T,Pfaffl MW,Shipley GL,Vandesompele J,Wittwer CT。MIQE指南:公布定量实时PCR实验的最低信息。Clin Chem。2009; 55:611-22。
- 18。
Expósito-rodríguezm,博尔斯A,Borges-PérezA,PérezJa。番茄开发过程中定量实时RT-PCR研究的内部对照基因的选择。BMC植物BIOL。2008; 8:131。
- 19.
马西娅T、桑托维托E、加里特利D、西洛F。侵染番茄植株中定量逆转录聚合酶链反应正常化参考基因的评价。植物病理学。2010;11:805–16.
- 20.
De Gara L、De Pinto MC、Tommasi F。植物与病原菌互作过程中抗氧化系统与活性氧的关系。植物生理生化。2003;41:863–70.
- 21.
氧化应激、抗氧化剂和应激耐受性。植物科学学报,2002;
- 22.
植物对昆虫食草动物的免疫。植物生物学杂志。2008;59:41-66。
- 23.
马洛佩斯,班纳伯格G,卡斯特雷萨纳C。控制激素信号是植物和病原菌生长和生存的挑战。植物生物学。2008;11:420–7.
- 24
植物免疫应答过程中激素串扰的意义。细胞宿主微生物。2008;3:348-51。
- 25
布斯凯尔P,里瓦斯S。植物防御反应的转录控制。植物生物学。2014;20:35–46.
- 26。
关键词:植物防御基因,转录激活,生物信息学当前的观点,Genet Dev. 1996; 6:624-30。
- 27。
兰蒂B,奥尔顿D,加劳德J。植物钙调素及其相关蛋白。电厂信号行为。2006;1(3):96–104.
- 28。
等。关键词:聚类;聚类;十字花科植物产生的异硫氰酸酯作为镰刀菌的抑制剂。工厂说。2003;87(4):407 - 12所示。
- 29。
Sarwar M, Kirkegaard J a, Wong PTW, Desmarchelier JM。芸苔属植物的生物熏蒸潜力。土壤植物。1998;201:103-12。
- 30.
硫代葡萄糖苷及其分解产物对坏死营养真菌的影响。《公共科学图书馆•综合》。2013;8:e70771。
- 31.
Sade D, Shriki O, Cuadros-Inostroza A, Tohge T, Semel Y, Haviv Y等。抗性和感病番茄品种对番茄黄曲叶病毒侵染反应的比较代谢组学和转录组学研究。代谢组学。2014;11:81 - 97。
- 32.
Ellinger D、Naumann M、Falter C、Zwikowics C、Jamrow T、Manisseri C等。早期胼胝质沉积增加导致拟南芥对白粉病的完全穿透抗性。植物生理学。2013;161:1433–44.
- 33.
法奇尼PJ,圣皮埃尔B。生物碱生物合成酶的合成和运输。植物生物学。2005;8:657–66.
- 34.
Kibble NJ,Sohani MM,Shirley N,Byrt C,Cut R,Antony B,Otto S,Carolyn JS:拟南芥功能植物生物学2009:1098–1109中狭窄苷合酶样基因的系统发育分析和功能表征。
- 35.
Licausi F、Ohme Takagi M、Perata P。APETALA2/乙烯反应因子(AP2/ERF)转录因子:应激反应和发育程序的介质。新植物醇。2013;199:639–49.
- 36
Sohani MM、Schenk PM、Schultz CJ、Schmidt O。拟南芥狭窄苷合成酶样基因家族的系统发育和转录分析揭示了其与植物防御反应的关系。植物生物学。2009;11:105–17.
- 37
哈宁M、布林尼F、埃贝尔C、托达Y、武田S、马斯穆迪K。植物脱水素与胁迫耐受:用于复杂机制的多功能蛋白质。电厂信号行为。2011;6:1503–9.
- 38
Seifi HS、Van Bockhaven J、Angenon G、Höfte M。谷氨酸代谢在植物疾病和防御中的作用:朋友还是敌人?植物与微生物相互作用。2013;26:475–85.
- 39。
Swartzberg D,Kirshner B,Rav-David D,Elad Y,Granot D.Botrytis Cinerea诱导衰老,并通过自动调节的IPT基因的表达抑制。EUR J植物途径。2008; 120:289-97。
- 40。
姜S,金HB,李H,崔JY,Heu S,吴CJ,权S日,安CS。小萝卜谷氨酸受体在拟南芥中的过表达增加谷氨酸介导的钙内流,延缓真菌感染。摩尔细胞。2006;21:418–27.
- 41
杜勒莫T,拉斯克C,中国G,痛风E,布利尼R,棉花P。向日葵坏死营养真菌灰霉病发病过程中碳的动态转移:从植物己糖到甘露醇。新植物醇。2009;183:1149–62.
- 42.
El-Zahaby嗯。大麦白粉病侵染对不同宿主-病原体相互作用下抗坏血酸-谷胱甘肽循环及其他抗氧化剂的影响植物病理学。1995;85:1225-30。
- 43.
Fodor J、Gullner G、Adam AL、Barna B、Komives T、Kiraly Z。抗氧化剂对烟草花叶病毒感染和烟草中水杨酸的局部和全身反应(在系统获得性抗性中的作用)。植物生理学。1997;114:1443–51.
- 44.
Felton GW,Korth Kl,Bi JL,Wesley SV,Huhman DV,Mathews MC,Murphy JB,Lamb C,Dixon R a。植物对微生物和昆虫草食的逆关系。Curr Biol。1999; 9:317-20。
- 45.
Andolfo G,Ercolano Mr。植物先天免疫多组分模型。前植物SCI。2015; 6:987。DOI:10.3389/fpls.2015.00987.
- 46.
易卜拉欣S,乌沙K,辛格B。病原相关蛋白(PR)在植物防御机制中的作用。2011年技术咨询报告;2:1043–54.
- 47.
Jongedijk E、Tigelaar H、Van Roekel JSC、Bres vloemans S a、Dekker I、Van Den Elzen PJM、Van Den、Cornelissen BJC、Melchers LS。几丁质酶和β-1,3-葡聚糖酶协同作用增强转基因番茄的抗真菌性。大提琴。1995;85:173–80.
致谢
我们衷心感谢Giuseppe Andolfo博士的支持。
资金
该研究得到了中国大学和研究部(Genpom项目)的支持。
作者信息
从属关系
相应的作者
附加信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
DM也参与其中生物信息学分析、解释资料和撰写手稿;FF参与实验设计、微阵列实验分析和数据解释;GP进行感染实验;AZ参与疾病评估;DD参与数据解释和结果讨论;参与统计分析;AF参与微阵列数据分析和讨论;MRE构思了这项研究,主要参与数据解释和手稿写作。所有作者都阅读并批准了最后的手稿。
附加文件
附加文件1:表S1。
用于qPCR分析的引物序列;表S2。微阵列实验设计。(DocX 14 KB)
附加文件2:图S1。
RT - qPCR检测苯丙氨酸解氨酶(a)过氧化氢酶(b) β -葡萄糖苷酶(c)受体样蛋白激酶(RLK)4丝氨酸/苏氨酸(d)基因Marmande.对不同品种感染和未感染的根进行FORL感染监测。条形图表示接种和对照条件下目标基因的相对数量。误差条表示三个生物重复的qPCR结果的标准偏差。(PPTX 621 kb)
权利和权限
开放存取本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/),允许在任何介质中不受限制地使用、分发和复制,前提是您给予原始作者和来源适当的信任,提供到知识共享许可证的链接,并说明是否进行了更改。知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Manzo,D.,Ferriello,F.,Puopolo,G。等。尖孢镰刀菌。番茄根诱导抗感等基因番茄不同转录组重编程.BMC植物BIOL.16,53 (2016). https://doi.org/10.1186/s12870-016-0740-5
收到了:
认可的:
出版:
关键词
- 茄属植物lycopersicum
- FORL阻力
- Necrotrophic病原体
- 转录组
- 胼胝质沉积
- 脱水诱导蛋白
- 氧化爆发
- 坏死反应