摘要
背景
植物免疫应答可通过内源和外源信号分子诱导。近年来,氨基酸及其代谢物已被报道影响植物免疫系统。然而,氨基酸是如何在植物防御反应中起作用的还有待澄清。在这里,我们报道了用谷氨酸(Glu)等氨基酸处理水稻根系诱导水稻叶片对稻瘟病的系统抗性。
结果
用谷氨酸处理根系可以激活根系和叶片中多种防御相关基因的转录。在叶片中,对水杨酸(SA)敏感的基因,而不是茉莉酸(JA)或乙烯(ET)敏感的基因。在缺乏SA信号的水稻中,葡萄糖诱导的稻瘟病抗性部分受损NahG表达水杨酸羟化酶的植物,WRKY45型-击倒,然后OsNPR1-knockdown植物。JA缺陷突变体CPM2.表现出完全的Glu诱导的抗爆性。
结论
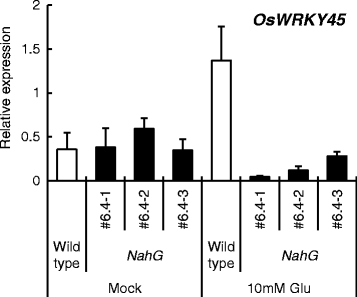
我们的结果表明,氨基酸诱导的稻瘟病抗性部分依赖于SA途径,但也涉及未知的SA非依赖性信号途径。
背景
20种蛋白质原氨基酸不仅是蛋白质的基石;它们或它们的代谢物在发育、体内平衡和生长中也起着关键作用。例如在植物中,色氨酸是合成生长素(如吲哚-3-乙酸)所必需的,生长素是一种重要的生长激素。蛋氨酸是乙烯(ET)的前体,是一种重要的植物激素,与发育和胁迫信号转导有关。异亮氨酸是茉莉酸(JA)活化所必需的。因此,氨基酸在植物的发育、生长和胁迫反应中起着重要的调控作用。
以往的研究揭示了氨基酸代谢在植物病害反应中的作用。在拟南芥,接种与无毒丁香假单胞菌PV。番茄(PTO.)表达avrRpt2基因激活参与氨基酸生物合成的基因转录[1.].代谢谱分析也表明,接种有毒或无毒病原体改变氨基酸含量拟南芥[2.].
分析拟南芥突变体有力地支持了氨基酸在植物防御反应中起重要作用的假说。这个左侧1(赖氨酸组氨酸转运体1) Pro、Gln和Ala水平降低的突变体对各种病原体表现出很强的抵抗力,如细菌、丝状真菌和卵菌[3.]. 前脱氢酶基因的突变体脯氨酸脱氢酶是高度易感的无毒PTO.AvrRpm1与细胞死亡相关的活性氧(ROS)水平降低[4.]. 这些结果表明氨基酸含量或氨基酸代谢可能参与了植物对病原菌的敏感性和防御反应。尽管氨基酸代谢与抗病性明显相关,但这些现象的细节仍有待阐明。
水杨酸(SA)、茉莉酸(JA)和内皮素(ET)等植物激素介导的多种信号通路在植物抗病性中起着重要作用。在过去的几十年中,SA途径已经被广泛研究,特别是在双子叶植物系统获得性抗性(SAR)中的作用。在拟南芥中,PR1非表达式(尼泊尔卢比1)在合成孔径雷达中起着关键作用[5.].在水稻中,SA途径分为两个子途径,它们依赖于(共)转录因子OsNPR1或奥斯本45,分别[6.–9].奥斯本45对SA-和苯并噻吩二唑(BTH)诱导的抗稻瘟病和白叶枯病至关重要[10,11].bth诱导的抗爆炸能力在两种情况下都有所减弱OsNPR1击倒(−kd)和奥斯本45-kd水稻品系[10,11].
JA和ET也参与水稻抗稻瘟病。例如,根系处理诱导水稻稻瘟病的系统抗性荧光假单胞菌wcs374r是独立的,ja-和et-in依赖[12]. 米饭胚芽鞘光形态发生2(每平方厘米)是丙烯氧化物环化酶(AOC)的单拷贝基因,对JA的合成至关重要。Riemann等人报道了aCPM2.突变体中JA的浓度极低,对一种其他不相容菌株敏感Magnaporthe oryzae[13].过度表达奥斯2编码联烯氧化物合成酶升高了JA浓度并提高了耐水稻m . oryzae[14].过度表达OsACS2型编码1-氨基环丙烷-1-羧酸合酶的ET浓度升高,因此增强了抗性m . oryzae在水稻15].这些研究表明,稻瘟病可能会激活多种信号通路。
之前,我们报道了谷氨酸发酵副产物(GFB)赋予抗性病原体感染拟南芥[16]. 在本研究中,我们旨在阐明氨基酸在水稻防御反应中的作用,发现用氨基酸处理根系可诱导系统防御反应并抑制稻瘟病菌对亲和水稻的侵染。我们发现SA信号通路和至少一个其他未知通路参与了这种系统性耐药。这些发现为理解植物免疫机制和水稻抗病机理提供了新的视角。
结果
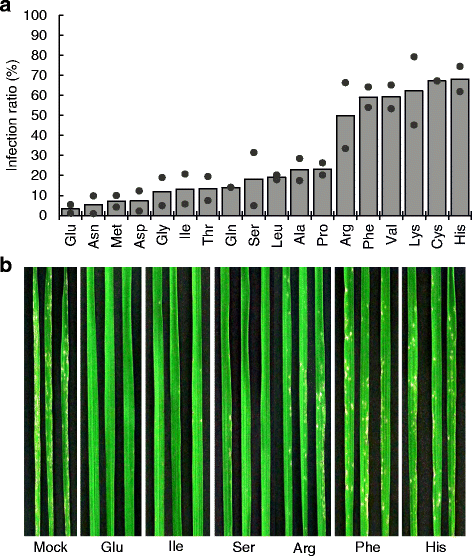
为了研究谷氨酸对水稻抗病性的影响,我们将水稻根系浸泡在0.1 mM - 25 mM谷氨酸溶液中,喷洒24 hm . oryzae对水稻植株进行分生孢子处理,并对处理5 d后的病害症状进行分析。谷氨酸处理显著降低了叶片上的稻瘟病损,且呈浓度依赖性(图。1.). 这一结果表明诱导了系统性抗病性。由于谷氨酸浓度超过10毫米抑制植物生长,我们使用10毫米谷氨酸在下面的实验。
为了测试其他氨基酸的效果,我们进行了类似的实验,其具有18个氨基酸(10mm;由于它们在水中的低溶解度而排除了Trp和Tyr)。我们发现所有氨基酸赋予抵抗力(图。2.). 除Glu外,Asn、Met和Asp三种氨基酸也诱导了较强的抗性。相反,碱性氨基酸(Arg、Lys和His)、一些疏水性氨基酸(Phe和Val)和Cys诱导的抗性较弱。疏水性似乎不是一个决定因素,因为其他疏水性氨基酸,如异亮氨酸和亮氨酸,诱导了实质性的抵抗。这些结果表明,氨基酸有可能触发对稻瘟病的抗性。当用Met或Ile处理根时,我们观察到一些生长抑制,但用其他氨基酸处理没有(数据未显示)。
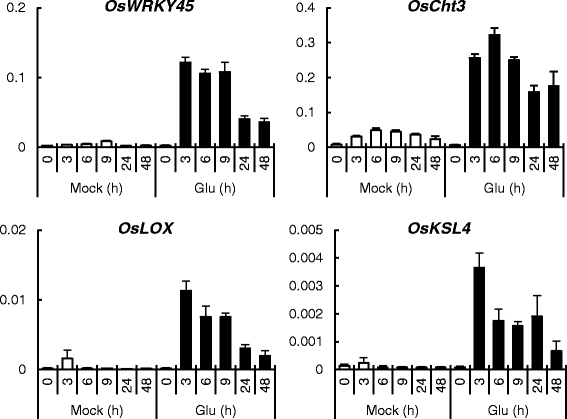
为了评估Glu诱导的防御反应,我们对2周龄植物的根进行了微阵列分析,这些植物的根分别被Glu处理8或24 h(附加文件1.).该分析表明Glu治疗增加了几种响应基因的转录物水平,例如OsWRKY76、OsWRKY19 OsWRKY45,水杨酸葡萄糖基转移酶,消费税,OSPR1B.(表1.)和一些ja反应基因,比如奥斯贾兹3和奥斯贾兹4被上调(表1)2.). 为了研究谷氨酸诱导的早期事件,我们通过qRT-PCR分析了防御相关基因在根中的表达模式(图。3.). 一些基因对Glu反应迅速,其转录水平在治疗后6h内达到最高水平。
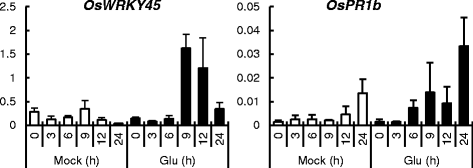
在我们的qRT-PCR分析了4号叶中几种病原应答基因,sa应答基因的表达奥斯本45谷氨酸处理显著上调OsPR1b(图5)。4.). 这些结果表明,Glu处理诱导根的快速反应,主要是SA信号,然后信号传导到叶片,激活SA反应。
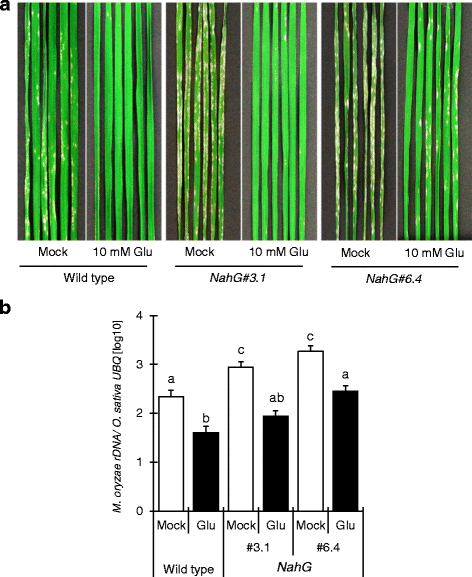
为了研究SA信号在水稻抗稻瘟病中的作用,我们使用了两个SA缺陷的水稻株系(#3.1和#6.4)NahG转基因植物;NahG由于水杨酸含量降低,水稻对稻瘟病的敏感性高于野生型[17]. 植株经Glu处理24h后接种m . oryzae. Glu显著抑制了两种病毒的爆发症状NahG尽管#6.4比#3.1更易受影响(图。5A)表明Glu诱导的稻瘟病抗性即使在缺SA的植株中也存在。水平m . oryzae28srdna与急变症状的严重程度一致。5B.).使用NahG(#6.4),我们还确定了谷氨酸对表达的影响奥斯本45(图。6.).胶合诱导的增加奥斯本45在野生型叶片中观察到表达,但在野生型叶片中几乎不明显NahG树叶(图。6.). 这些结果表明SA通路参与了Glu诱导的抗性,但其作用是部分的。
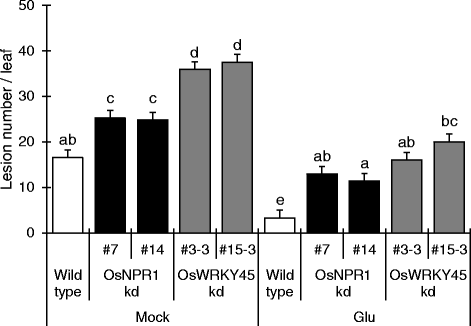
以前的研究表明,BTH诱导的抗爆性在一定程度上受到损害OsNPR1-杜兰特[7.] 和奥斯本45-杜兰特[10]米植物。进一步调查SA途径的参与,我们使用过OsNPR1-kd线(#7和#14)和奥斯本45-kd直线(#3-3和#15-3)(图5)7.).Mock-treatedOsNPR1-kd和奥斯本45-kd株对稻瘟病的敏感性比野生型高,说明kd株系的基础防御能力受损。Glu处理强烈诱导野生型稻瘟病抗性。在OsNPR1-kd和奥斯本45与模拟处理相比,谷氨酸处理-kd植株诱导了稻瘟病抗性。然而,Glu-treatedOsNPR1-kd和奥斯本45-kd植株表现出与模拟野生型相似的病害症状。综上所述,这些结果表明Glu诱导的稻瘟病抗性部分依赖于SA信号,但也涉及未知的SA非依赖性途径。
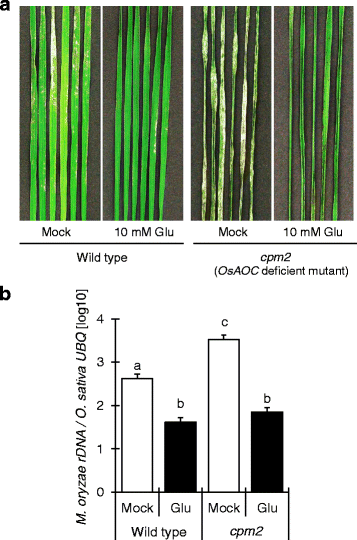
由于JA在水稻抗抗抗抗性中起作用,我们还研究了通过检查JA缺陷来参与Glu诱导的抗性CPM2.突变体。glu诱导抗爆炸抗性CPM2.野生型(图。8.),表明Glu响应与JA无关。
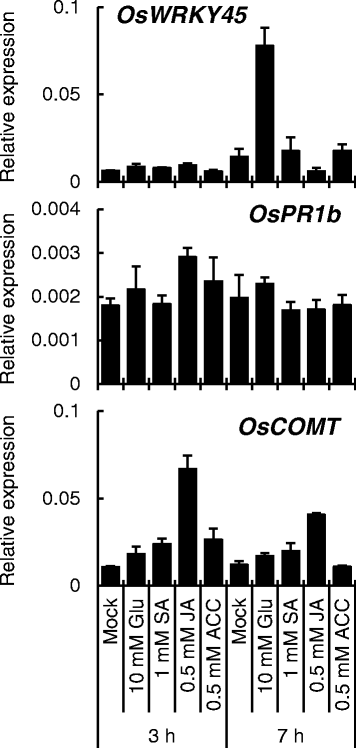
为了检测ET是否参与Glu诱导的抗病性,我们进行了基因表达分析奥斯本45,OSPR1B.和OsCOMTSA、JA、ACC或Glu根处理后3或7小时。成绩单水平奥斯本45在Glu处理后7 h显著升高,而在ACC处理后没有观察到升高(图。9),与之前的报告一致[10].这些结果表明ET途径对胶型抗性并不重要。ja-enveryive.OsCOMT1型与Glu诱导的小麦抗稻瘟病性不受影响的结果一致CPM2.. 有趣的是,1毫米水杨酸没有诱导OsWRKY45和OsPR1b在第四片叶中的表达,表明根系中的合成对于胶状诱导的抗性并不重要。
讨论
有报道表明,当植物受到病原菌侵染时,植物细胞内的氨基酸代谢会发生变化[2.].在拟南芥中氨基酸代谢改变的突变体,比如左侧1,初级代谢物,包括氨基酸,影响植物微生物相互作用,并提出了氨基酸代谢与SA途径之间的关联[3.].的左侧1基因通过野生类型的病原体感染上调,但不在NahG转化体和SA途径缺陷突变体,如pad4,sid2型和尼泊尔卢比1[3.]. 基因表达增强PTO.AvrRpm1-诱导脯氨酸脱氢酶编码Glu生成酶的基因依赖于外源SA的浓度,并且在细胞中显著降低sid2型和尼泊尔卢比1比野生型[4.]. 在水稻中,Glu的作用随着时间的推移而减弱奥斯本45-KD,OsNPR1- 和NahG转化体;因此,SA途径最有可能参与Glu诱导的抗性。然而,在每种转化体中,Glu诱导抗性的降低不完全。因此,除了SA之外的分子也可能介导通过Glu处理诱导的全身性抗性。
谷氨酸可能被谷氨酸受体样蛋白(GLR)识别。拟南芥有20个编码GLR的基因,它们在一级结构和预测二级结构上与动物嗜离子谷氨酸受体(iGluR)亚基具有相当的相似性[18].一些植物iGluR同源基因参与了根系发育、离子转运以及一些代谢和信号通路[19].拟南芥表达萝卜GLR公司cDNA显示防御相关基因的表达增加,并增强了抗病性灰葡萄孢[20.].的AtGLR3.3突变体更易受到Hyaloperonospora arabidopsidis和丁香假单胞菌而不能激活防御相关基因的转录[21]. 最近的研究表明GLR对氨基酸具有广泛的特异性[22].这与我们观察到各种氨基酸诱导不同范围的耐药性。因此,氨基酸诱导的全身抗性中的初始细胞事件可能涉及GLR。
从根到叶的防御信号转导最简单的模式是Glu或其代谢产物直接转运到叶上。然而,根系的Glu处理并没有显著改变叶片中游离氨基酸的含量(补充资料)2.). 如果GLRs参与外源氨基酸的识别,则电信号应该从根传递到叶。在拟南芥中,一些GLRs在激动剂刺激的质膜去极化中起作用,并能控制胞浆Ca2+流入[23].AtGLR 3.3也参与了对机械损伤的防御反应和全身损伤诱导的基因表达,并在其中消除了电信号传递atglr 3.3级和atglr 3.6级双突变体(24]. 各种新的信号分子已被报道[25].其中一个是吡烯醇酸(pip),由Lys合成的氨基酸,并在拟南芥中获得全身性获得的抗性(SAR)[26]. Pip-和Glu诱导的抗病性有几个相似之处,氨基酸诱导的抗病性是通过SA途径介导的。然而,我们的结果表明,Pip的直接前体Lys诱导的抗性比Glu弱得多。另一种诱导防御的氨基酸是Pro。自由脯氨酸积累已被观察到对环境胁迫的反应,包括病原体的攻击[27].Pro由ProDH和Δ两种酶催化的两种反应转化为Glu1.-pyrroline-5-carboxylate脱氢酶(P5CDH)。在这个分解代谢途径中产生的ROS有助于过敏反应和抗病[4.].然而在本研究中,我们发现Pro与Glu相比并没有产生较强的抗性。如果ProDH诱导水稻发生系统抗性,Glu的作用应弱于Pro。因此,水稻中葡萄糖诱导的系统抗性不太可能是由Pro分解代谢产生的ROS介导的。
防御反应需要氨基酸作为合成防御蛋白的资源。因此,谷氨酸和其他氨基酸可能通过贡献氨基酸库来诱导sa非依赖性抗性。谷氨酸通过谷氨酸脱氢酶与三羧酸循环相连,因此可以作为合成植物抗毒素等防御化合物的能量和碳源。这一途径可能有助于sa独立防御。
结论
在本研究中,我们证明外源游离氨基酸能诱导水稻抗稻瘟病。SA依赖性防御反应的系统诱导很可能与此有关,但另一个未知的机制似乎也与此有关。虽然我们不能完全阐明Glu和其他氨基酸诱导抗病的机制,但我们的发现部分解释了GFB在几种作物中诱导抗病的原因[16]. 这些知识可能有助于开发减少环境负荷的农业材料或农业系统。
方法
植物材料,生长条件和接种测定
所有实验均在水稻上进行(水稻简历。nipponbare或cv。nihonmasari)在4-叶阶段。oswrky45-kd [10],OsNPR1 kd型[7.] 和NahG[17如上所述,从Nipponbare产生转基因植物。Nihonmasari仅用于分析CPM2.突变分析。这个CPM2.如Biswas等人所述,从Nihonmasari的γ射线诱变M2系中分离到突变体[28].除特别说明外,将植物置于光照条件为16 h、28℃/ 8 h、25℃、光照强度为200 μmol m的生长室内培养−2.S−1.,湿度70%。用10 mM L-氨基酸、1 mM SA、0.5 mM JA或0.5 mM ACC(50 mL/株)浸泡根。在m . oryzae接种测定是十八氨基酸之一(Glu-Na,Ala,Asp-Na,Cys-HCl,Phe,Gly,His,Ile,Lys-HCl,Leu,Met,Asn,Pro,Gln,Arg,Ser,使用Thr或Val;市售产品)。水用于模拟处理。
稻瘟病菌日本分离物KEN53-33的分生孢子m . oryzae,以10的密度悬浮在0.01%吐温20中5./mL,并在四叶期喷洒于水稻植株,如所述[29,30.]). 通过计数病变或确定真菌感染来评估疾病症状28年代qPCR法测定第四片叶片rDNA含量[31].真菌生长的比值m . oryzae水稻的28srdna泛素1(UBQ公司)DNA。
实时PCR和微阵列分析
将根浸入含有氨基酸或植物激素的溶液中。合并从2株植物收获的根和第四片,使用RNEASY植物迷你试剂盒(QIAGEN)从每个池中分离出总RNA。根据制造商的说明,通过0.5μg总RNA从0.5μg的总RNA产生CDNA,并根据制造商的说明产生了混合物QPCR RT主混合物试剂盒(TOYOBO)。QPCR在ABI 7500快速实时PCR系统上进行了ABI Fast Sybr Green Master Mix(Life Technologies)。通过两步PCR在95℃下用40个变性的两步PCR进行扩增,并在60℃下延伸/检测30秒。UBQ公司(Shimono et al. 2007)和延伸系数1a(eEF-1a) [32]分别作为叶片和根的内标。PCR引物组(附加文件3.)经离解曲线分析和验证,证实无非特异性扩增。我们通过qPCR分析的基因名,列在附加文件中3..
对于微阵列分析,根用Glu溶液或水作为模拟物处理,第四片叶收获并如上所述汇集。用RNeasy植物小试剂盒(Qiagen)分离总RNA。如前所述进行微阵列分析[10(Shimono et al. 2007)。
支持数据的可用性
支持本文结果的数据集包含在本文及其附加文件中。支持本文结果的微阵列数据可在NCBI的基因表达Omnibus知识库中获得,并可通过GEO系列登录号GSE78266 (http://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE78266).
缩写
- CPM:
-
植物光学光膀胱
- 等:
-
乙烯
- 是:
-
茉莉酸
- NahG:NPR:
-
PR1非表达式
- 公关:
-
发病机制相关
- 南非:
-
水杨酸
工具书类
- 1.
Scheideler M,Schlaich NL,Fellenberg K,Beissbarth T,Hauser NC,Vingron M,et al.监测从家务管理到病原体防御代谢的转变拟南芥利用cDNA阵列研究拟南芥。生物化学杂志。2002;277:10555–61.
- 2.
Ward JL,Forcat S,Beckmann M,Bennett M,Miller SJ,Baker JM,等.植物感染拟南芥后疾病过程中的代谢转变丁香假单胞菌光伏番茄. 植物J。2010;63:443–57.
- 3.
刘庚,季勇,Bhuiyan NH,Pilot G,Selvaraj G,Zou J,等。氨基酸稳态调节水杨酸相关的氧化还原状态和拟南芥的防御反应。植物细胞。2010;22:3845–63.
- 4.
Cecchini NM,Monteoliva MI,Alvarez我。脯氨酸脱氢酶参与拟南芥的病原防御。植物生理学。2011;155:1947–59.
- 5。
拟南芥NPR1基因编码一种新的ankyrin重复序列。细胞。1997; 88:57 - 63。
- 6。
Nakayama A、Fukushima S、Goto S、Matsushita A、Shimono M、Sugano S等。介导苯并噻唑诱导水稻防御反应的WRKY45调控基因的全基因组鉴定。BMC植物生物学。2013;13:150.
- 7。
Sugano S,Jiang CJ,Miyazawa S,Masumoto C,Yazawa K,Hayashi N,等。通过全基因组表达分析揭示OsNPR1在水稻防御计划中的作用。植物分子生物学。2010;74:549–62.
- 8。
Takatsuji H,Jiang CJ,Sugano S。水稻水杨酸信号转导途径及其调控因子的潜在应用。贾克。2010;44:217–23.
- 9。
Takatsuji H。利用诱导抗病的调控成分培育抗病水稻。前植物科学。2014;5:630.
- 10.
Shimono M,Sugano S,Nakayama A,Jiang CJ,Ono K,Toki S等。水稻WRKY45在苯并噻二唑诱导的稻瘟病抗性中起关键作用。植物细胞。2007;19:2064–76.
- 11.
Shimono M、Koga H、Akagi A、Hayashi N、Goto S、Sawada M等。水稻WRKY45在真菌和细菌抗病性中起重要作用。植物病理学。2012;13:83–94.
- 12.
De Vleesschauwer D,Djavaheri M,Bakker PA,Höfte M。荧光假单胞菌WCS374r诱导水稻对烟草的系统抗性Magnaporthe oryzae基于假杆菌素介导的水杨酸抑制多面防御反应。植物杂志。2008;148:1996 - 2012。
- 13.
Riemann M,Haga K,Shimizu T,Okada K,Ando S,Mochizuki S,等。水稻丙二烯氧化物环化酶突变体的鉴定及茉莉酸盐的抗逆性Magnaporthe oryzae.工厂J. 2013; 74:226-38。
- 14.
梅C、齐M、盛G、杨Y。水稻丙二烯氧化物合酶基因的诱导过表达可提高内源茉莉酸水平、PR基因表达和宿主对真菌感染的抗性。植物与微生物相互作用。2006;19:1127–37.
- 15.
Helliwell ee,王Q,杨玉。具有诱导乙烯生产的转基因水稻对真菌病原体具有广谱疾病抗性Magnaporthe oryzae和辣椒。植物生物技术2013;11:33-42。
- 16。
谷氨酸发酵副产物激活植物的防御反应,使其能够抵抗病原体的感染。J Phytopathol。2010;158:668 - 75。
- 17。
杨妍,齐梅,梅丙。内源水杨酸保护水稻免受衰老以及生物和非生物胁迫引起的氧化损伤。植物J。2004;40:909–19.
- 18。
林浩民,赵杰,谢明华,梅赛尔,奥利维拉,申明,等。植物谷氨酸受体基因。自然。1998;396:125–6.
- 19。
Tapken D,Anschütz U,Liu LH,Huelsken T,Seebohm G,Becker D,et al.动物谷氨酸受体的植物同源物是一种由多种疏水氨基酸门控的离子通道。Sci信号。2013;第6章:ra47。
- 20.
Kang S,Kim HB,Lee H,Choi JY,Heu S,Oh CJ等。小萝卜质膜靶向谷氨酸受体在拟南芥中的过度表达增加谷氨酸介导的Ca2+侵入并延迟真菌感染。摩尔细胞。2006;21:418–27.
- 21.
刘国平,刘国平,等。谷氨酸受体AtGLR33参与植物防御信号和抗性的研究Hyaloperonospora arabidopsidis. 植物J。2013;76:466–80.
- 22.
Forde BG,Roberts Mr。植物中谷氨酸受体样通道:植物防御中作为氨基酸传感器的作用?F1000prime批准。2014; 6:37。
- 23.
Stephens NR, Qi Z, Spalding EP。谷氨酸受体亚型在脱敏和GLR33和GLR34基因依赖上的差异。植物杂志。2008;146:529-38。
- 24.
Mousavi SA、Chauvin A、Pascaud F、Kellenberger S、Farmer EE。谷氨酸受体样基因介导叶间损伤信号。自然。2013;500:422–6.
- 25.
邓普西检察官,克莱西格检察官。SOS——系统获得性耐药性的信号太多?植物科学,2012;
- 26.
NávarováH,伯尔尼奥夫F,DöringAc,Zeier J.苯磺酸,内源性防御扩增和引发的内源性介质,是诱导植物免疫的关键调节因子。植物细胞。2012; 24:5123-41。
- 27。
法布罗G,科瓦茨I,帕维特V,萨巴多斯L,阿尔瓦雷斯我。拟南芥植物-病原不亲和互作诱导脯氨酸积累和AtP5CS2基因激活。植物与微生物相互作用。2004;17:343–50.
- 28。
比斯瓦斯KK,诺依曼R,哈加K,雅托奥,伊诺M。水稻幼苗光形态发生:光敏色素介导的胚芽鞘生长抑制受损突变体。植物细胞生理学。2003;44:242–54.
- 29。
Hirata K, Kusaba M, Chuma I, Osue J, Nakayashiki H, Mayama S, et al.;基于多位点系统发育分析的蜱虫种形成。Mycol杂志2007;111:799 - 808。
- 30.
Watanabe T,Igarashi H,Matsumoto K,Seki S,Mase S,Sekizawa Y.探针(Oryzemates®)的控制控制稻瘟病。j pestic sci。1977年; 22:291-6。
- 31.
祁明,杨勇稻瘟病菌利用实时聚合酶链反应和northern杂交/磷酸化成像分析水稻植株侵染过程中的蛋白质变化。植物病理学。2002;92:870–6.
- 32.
Jain M,Nijhawan A,Tyagi AK,Khurana JP。家政基因作为实时定量PCR研究水稻基因表达内部控制的验证。生物化学Biophys Res Common。2006;345:646–51.
致谢
我们感谢你。土佐(神户大学,兵库,日本)提供爆炸株,M.Iino(大阪城市大学,大阪,日本)提供简历。尼翁马萨里和CPM2.突变体和K。北卡罗来纳州库努马市。北村和C。Kohara(Ajinomoto公司,日本东京)的技术支持。Ajinomoto公司资助了这项研究,没有使用外部资金。
作者信息
从属关系
相应的作者
附加信息
相互竞争的利益
提交人声明他们没有竞争利益。
作者的贡献
NK、AA、HT、TM和DI设计了实验。NK和AA进行了实验研究。NK、AA、HT和DI分析数据。NK,HT和DI写了手稿。所有作者都阅读并批准了最后的手稿。
权利和权限
开放获取本文根据知识共享署名4.0国际许可的条款分发(http://creativecommons.org/licenses/by/4.0/),允许在任何介质中不受限制地使用、分发和复制,前提是您给予原始作者和来源适当的信任,提供到知识共享许可证的链接,并说明是否进行了更改。知识共享公共领域放弃(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用本文
Kadotani,N.,Akagi,A.,Takatsuji,H。等。外源蛋白质酸氨基酸在水稻中诱导全身性抗性。BMC植物BIOL.16,60 (2016). https://doi.org/10.1186/s12870-016-0748-x
收到了:
认可的:
出版:
关键词
- 氨基酸
- 谷氨酸
- 抗病性
- 米饭
- 系统获得的阻力
- 水杨酸
- WRKY45型