摘要
背景
Brachypodium distachyon是一个有希望的草地的模型植物。感染Brachypodium通过报道各种病原体严重损害作物生产,因此物种是用于研究病原体毒力和植物疾病抗性的分子机制的替代平台。迄今为止,我们只有广泛的植物免疫图片拟南芥和米饭;所以,Brachypodium可以构成一个对手,显示植物物种之间的防御系统的共性和唯一性。植物激素在植物生物应激反应中发挥关键作用,并且激素响应基因用于定性和定量评估病原体感染期间的疾病抗性反应。出于这些目的,需要在适于防御反应监测的时间点表达的防御相关的植物激素标记基因。关于他们表达概况随时间的信息以及他们的响应特点也有所帮助。然而,有用的标记基因仍然罕见Brachypodium.
结果
我们选择了34个候选人Brachypodium标记基因是根据蛋白质序列与已知标记基因的相似性而应用的拟南芥还有米饭。Brachypodium用防御相关的植物植物水杨酸,茉莉酸和乙烯处理植物,并在处理后24和48小时测量其转录水平。用于水杨酸的两个基因,7用于茉莉酸和2用于乙烯的2个,在任一时或两个时间点显着诱导。然后,我们专注于11个基因编码致病相关(PR)1蛋白,并将其表达模式与那些相比拟南芥还有米饭。系统发育分析表明Brachypodium包含几个PR1-与水稻基因相似的家族基因。我们的表达谱揭示了一些PR1对于与防御相关的植物激素鉴定的基因以及与水稻的植物密切相关。
结论
我们建议Brachypodium在这项研究中确定的免疫激素标记基因将有助于植物病理学家使用Brachypodium作为一个模式的病理系统,因为他们的转录激活时间匹配的抗病反应。我们的结果使用Brachypodium同时也表明,单子叶植物具有与双子叶植物不同的特征性免疫系统,即共同防御系统。
背景
为了抵抗田间的各种病原体,植物主要通过两层免疫系统来保护自己。使用细胞surface-localised受体、植物识别病原体——或者microbe-associated分子模式(pamp或mamp),结构保守分子的广泛的微生物,可能包括产品的看家基因或细胞壁组件和诱导防务相关的基因的表达。这个系统提供的基础抗性称为PAMP/ mamp触发免疫(PTI/MTI) [1]. 为了T.he successful infection of host plants, pathogens use a few dozen effector proteins as a weapon to suppress PTI. Plants can directly or indirectly sense these effectors by cytoplasmic nucleotide-binding domain- and leucine-rich repeat-containing (NLR) immune sensors and activate a strong resistance response called effector-triggered immunity (ETI) that is effective against pathogens [2]. ETI通常伴随着超敏反应,包括含有病原体的感染区域的程序性细胞死亡。在一系列的免疫反应中,植物激素水杨酸(SA)在介导信号转导中起着重要作用。另一种植物激素乙烯(ET)也需要维持PTI中模式识别受体的水平[3.]. 这种防御系统能有效地阻断生物营养或半生物营养病原体。植物还有另一种防御系统,依靠植物激素茉莉酸(JA)和ET来对抗坏死性病原体和昆虫[4.].
为了表征植物对特定病原体的反应,除了观察病变形成的表型外,植物激素的产生可能是适当的指标。然而,在水稻和大麦中,内源SA水平并不会增加,即使是对不相容病原体的反应,这与研究充分的双子叶模式植物的情况不同,比如拟南芥和烟草[5.-7.].另外,植物激素生产可以用植物激素响应标记基因的表达谱替代。这种方法提供了关于时间、强度和植物的反应类型的信息。例如,发病机制相关1(PR1)以及PDF1.2版(植物DEFENSIN1.2)用作SA和JA或ET的标记,进入拟南芥[8.那9.].在模式植物中,被认为参与植物激素生物合成或信号传递的基因也被用作标记[9.那10].
Brachypodium distachyon紫色假雀麦是雀麦亚科的一种禾本科植物,包括小麦、大麦、黑麦和燕麦等经济作物。由于它身材矮小,生命周期短,自我繁殖,二倍体基因组小,Brachypodium可以是一个实验模型植物,用于研究包括谷物和生物量作物的草地[11].一种全基因组序列B双光子获得品种Bd21 [12]并建立了全长cDNA(FLcDNA)数据库[13].最近,这种植物作为细胞作物模型的优势已经被形态学性质的相似性和代谢剖面的共同示出了[14]. 为了investigation of immunity as one of the important traits in agriculture, infectivity onBrachypodium迄今为止,各种病原菌对世界作物栽培的威胁已得到证实[15]. 为了example,Fusarium Graminearum.和稻瘟病菌,小麦的病原真菌镰刀头部枯萎和稻瘟病分别是致病性的Brachypodium[16那17].细菌病原体稻黄单胞菌PV。oryzae.和致病病毒Panicum Mosaic病毒也是毒性的Brachypodium[18那19].因此,Brachypodium为在分子水平上研究作物病原菌毒力和植物免疫应答提供了一个有用的平台。
一些植物激素标记基因已被用于表征抗性反应Brachypodium但标记的数量仍然有限和不足。最近,一个综合的转录组分析各种植物激素在Brachypodium采用RNA-seq技术,鉴定了植物激素应答基因[20.]. 在这项研究中,激素处理1小时的JA和ET和3小时的SA使用幼苗。对于植物-微生物相互作用的研究,对于每一种免疫植物激素,需要在感染过程中的适当时间点上调多组标记基因。
在本研究中,我们选择了Brachypodium对SA、JA和ET有反应的基因基于蛋白质序列与已知标记基因的相似性拟南芥和米饭并分析治疗后24和48小时的每种激素的转录激活。结果,我们为每个激素鉴定了至少2个标记基因。另外,我们比较了构造和表达概况PR1家族基因来自拟南芥、大米和Brachypodium,找到B双光子具有与水稻相似的免疫机制,但与水稻不同拟南芥.
结果和讨论
响应于与防御相关的植物激素的标记基因的候选者的鉴定Brachypodium
我们为植物激素响应基因选择了候选人短足,基于与实验验证的水稻,大麦和拟南芥.为了BdTARL1和BdTARL2基因在B双光子,它们对ET的前体1-氨基环丙烷-1-羧酸(ACC)的反应性已被证实[21]. 这些选定基因的蛋白质序列被用作对RIKEN的BLAST搜索的查询Brachypodium并将相似度高的结果作为潜在的标记[13那22]. 在SA、JA或ET治疗期间测试了23个基因的转录诱导(表1)1).
整个Brachypodium幼苗以水作为模拟处理,1mm水杨酸钠、100μM茉莉酸甲酯(MeJA)或100μM乙烯利处理24或48h。从冷冻叶片样品中提取总rna并进行cDNA合成。利用Primer3程序设计的特异性引物,通过定量逆转录聚合酶链反应(qRT-PCR)分析候选基因的mRNA水平[23].每个基因的响应性总结在表中2.其中,8个基因被植物激素显著诱导,其余15个基因表达无变化。
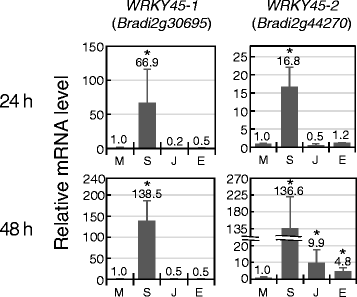
获得SA标记Brachypodium,我们专注于编码含有转录因子的Wrky域的基因。在米饭,奥斯本45那62和76SA处理诱导基因表达,所有基因均参与免疫应答[24-26].其中,奥斯本45在SA信号传递中起着核心作用,与OsNPR1型,并介导SA诱导的疾病抵抗[24]. 利用RNA-seq技术,研究了水稻基因组dna的转录上调奥斯本45在接种兼容和不相容的菌株后在24小时内检测到M稻属[27]. 在SA处理12h后观察到SA对其诱导作用[24].在短足,两个基因,布雷迪2G30695和BRADI2G44270,,其推断的蛋白质序列在整个长度上与OsWRKY45具有很高的相似性(分别为49和50%)(附加文件1:图S1)。如图所示。1SA处理后24h,这些基因的转录水平上调,48h表达水平升高。Kakei等人也报告说BRADI2G44270和布雷迪2G30695用100μmsa处理后在3 h诱导[20.]. 为了BRADI2G44270在JA和ET治疗后48h,也分别检测到9.9倍和4.8倍的表达变化,尽管它们的诱导水平低于SA。OsWRKY62和76是水稻抗病反应的负调控因子[25那26], 和不Brachypodium同源染色体的奥斯基62被发现,而三个基因,BRADI4G30360那BRADI1G30870和BRADI3G06070,显示相似奥斯基76. 在Kakei等人的RNA-seq结果中,只有BRADI4G30360,最相似的基因奥斯基76之间Brachypodium同源物,诱导(带有日志2SA处理后3小时的比例为3)。
在抗病抵抗期间拟南芥,SA在生物学上合成以诱导防御反应,随后代谢以重置免疫模式。主要的SA新陈代谢途径之一是糖基化,其中SA葡萄糖糖基转移酶(SAGT)将葡萄糖部分与SA缀合以产生SA-O-β-D.使用UDP-葡萄糖作为供体的葡糖苷(下垂)。SAG是SA的非活动形式[28].在拟南芥和水稻,SA治疗导致增加表达“基因(29那30.].在假设下“是一个sa标记,毛褶皱纱纱基因从cDNA数据库中检索。4和3Brachypodium同源物的拟南芥UGT76B1和UGT74F1,分别显示 > 40%的氨基酸序列被鉴定。同时筛选出一个与OsSGT1同源性最高的同源基因。在Brachypodium7例未发现SA诱导“基因(表2). 相反,我们发现BRADI4G41410诱导等(图。3.).目前尚不清楚这项研究中使用的基因是否具有SAGT的功能,因为在该基因组中发现了超过170个UGT预测基因Brachypodium基因组和使用全长的序列相似度并不总是反映功能标识。需要其他研究来确定参与SA新陈代谢的球员Brachypodium.
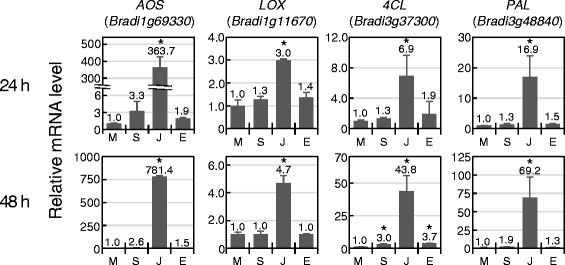
丙二烯氧合酶(AOS)和脂氧合酶(LOX)是JA生物合成所必需的[31]. JA对这些酶编码基因转录的正反馈调控已被广泛了解,并被用作多种植物的JA标记。在拟南芥,的表达ATAOS2.和Atlox2.被JA上调[32].在米饭中,诱导奥斯2和奥斯洛克1.在JA治疗后6小时检测到,根据水稻全球表达谱系统数据库米饭Xpro [33].在大麦中,JA的反应性AOS公司(续3096)液态氧(Contig2306_S_AT)通过微阵列分析和半定量RT-PCR验证[34].四Brachypodium基因,Bradi1g69330、Bradi1g07480 Bradi3g08160和BRADI3G01110,被识别为同源物奥斯2通过blastp搜索BRADI1G69330在这项研究中使用了最高分数。其推导的蛋白质序列也显示出与大麦AOS的高相似性。我们发现了强烈的诱导这一点毛花瓶AOS.JA治疗后24小时,其水平在48小时时增加了一倍(图。2). 为了液态氧, 10个基因(Bradi1g11670、Bradi1g11680、Bradi1g09260、Bradi1g09270、Bradi3g59710、Bradi5g11590、Bradi1g72690、Bradi3g39980、Bradi3g07010和Bradi3g07000)被发现为奥斯洛克1.(Os03g0700700型)同源物。最相似的布雷迪1G11670基因已被证明是表达后感染真菌病原体同源果菌核病在抵抗中Brachypodium加入208126[35].我们据此检查了它对JA的回复。如图所示。2在激素治疗后,分别在24和48小时观察到3.0-和4.7倍的表达变化。这些结果表明,两种基因都是有用的JA标记。
在抗病反应期间,植物使用苯丙烷化合物用于木质素,黄酮类化合物和植物脂素的生物合成,这是植物壁的设防和抗微生物的产生所需的[36].4-香豆素:CoA连接酶(4Cl)和苯丙氨酸氨裂解酶(PAL)是该代谢途径中的关键酶,以及转录上调朋友和4毫升经诱导子处理和病原菌接种后,国内外已有报道拟南芥、大米和Brachypodium[35那37-39].在Brachypodium, 三4毫升同系物,布拉迪3G37300那BRADI3G05750和布雷迪1G31320,使用BLASTP搜索使用蛋白质序列来识别拟南芥At1g51680作为查询(E值 = 0). 同样地,BRADI5G15830那BRADI3G48840那BRADI3G49280那BRADI3G49260那BRADI3G49270那布拉迪3G47110那布拉迪3G47120和BRADI3G49250被发现为同源物atpal1.(At2g37040).布拉迪3G37300作为代表4毫升和BRADI3G48840为了朋友在JA治疗后24小时明显诱导,在48小时下进一步增加水平(图。2). 我们检查了大米的表达OsPAL1和OS4CL5使用RiceXPro数据库[33]并发现它们在JA治疗后6小时内也诱导,符合我们的结果。在我们的研究中,表达短足藻4CLSA和ET也被检测到48小时。这些短足藻4CL和朋友也有报道称JA (log .)可以诱导基因的表达2比率 = 分别为1.59和1.96)[20.].
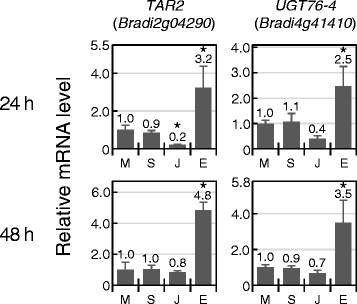
拟南芥1(TAA1)相关的色氨酸氨基转移酶(焦油)是L-色氨酸生物合成吲哚-3-丙酮酸所必需的拟南芥[40,其表达被ET上调[41].在Brachypodium,两个表达水平焦油同系物,BdTARL1(布雷迪2G34400)以及BdTARL2(BRADI2G04290.),在ACC治疗后3小时显示增加(表2) [21].在我们的实验条件下,转录BdTARL2但不是BdTARL1在乙烯利处理后24和48 h均显著诱导(图。3.).BdTARL2可能在治疗后3至48小时内通过ET持续表达。因为参与ET生物合成和信号转导的基因通常在转录过程中被ET激活拟南芥,我们选择了ACS.(ACC合成酶) (BRADI1G49966.),电流变(乙烯响应因子) (BRADI2G52370)以及EIN3.(乙烯不敏感3) (BRADI1G63780)作为et反应候选基因。它们是与相应的水稻基因最接近的同源基因(表1) [42-44].在我们的研究中,他们的转录不响应ET(表2).在Brachypodium,我们发现了EIN3.,但有4个ACS.同源物和超过100种同源物AP2 /小块土地家庭基因。因此,仍然可能存在ET-encooctiveACS.和电流变在基因组中。ACC治疗后3h的RNA-seq分析仅发现EIN4.同源物(BRADI5G00700.)作为ET-encooctive基因[20.].
在米饭,病因相关基因PR5和PR10(PBZ1型;普罗苯唑诱导蛋白1)典型的Pamps诱导等,典型的pamps [45那46].它们属于水稻多基因家族,共发现32个同源基因和5个同源基因Brachypodium为了PR5和PR10, 分别。表达水平布雷迪1G33540和BRADI4G05040作为标记候选人PR5和PR10分别评估,因为它们是最相似的同源物OSPR5.和OSP1.,和布雷迪1G33540已被证明是由病原体诱导的[19].但是,在我们的条件下可以检测到植物激素治疗的诱导(表2).
综上所述,我们分别成功鉴定了SA、JA和ET的2个、4个和2个标记基因。他们可能是有用的工具,为特征化的防御反应诱导免疫反应Brachypodium在各种宿主寄生虫相互作用中。
植物激素响应性的特征BDPR1基因家族在Brachypodium
SA主要用于植物防御生物营养性病原菌,JA和ET主要用于防御坏死性病原菌[47].在拟南芥SA和JA相互拮抗[48]. 为了instance, SA treatment suppresses JA-inducible genes such asPDF1.2版那VSP1.那LOX2那AOS公司那AOC2.和OPR3[49].最近,一项利用基因芯片对水稻进行的全基因组转录分析显示,在苯并噻二唑(BTH) (SA的功能类似物)上调的313个基因中,超过一半也被JA诱导,尽管其中三分之一被JA抑制[50].SA和JA的阳性调节该基因集被定义为常见的防御系统,可能用于响应水稻中的各种生物和非生物胁迫[50那51].奥斯本45还有几个OSP1.基因是属于这个组的基因的例子,它们的表达水平由SA和JA增加[52那53].
另一方面,这种共同的防御系统在烟草和拟南芥。在烟草中,pr1家族蛋白分别由SA和JA调控的酸性基团和碱性基团组成,各基因的诱导均受到其他激素的拮抗抑制[54].在拟南芥,仅限ATPR1(AT2G14610) 22PR1-基于微阵列数据,家族基因对SA和病原体接种有反应[55], 虽然AtPRB1型结果表明,MeJA和ET对根的诱导作用较弱[56].这些情况可能取决于水稻和双子叶在SA信号级联中的差异[57].因此,我们推测,这种共同的防御系统是单像的特征。然而,与正常情况下,水稻含有高水平的内源SA,与其他单像如大麦和Brachypodium[6.那58].为了确定这种常见的防御系统是否特定于米饭和驯化期间出现或由所有单码分享,我们表现了响应性质PR1-家族基因Brachypodium和米饭做比较拟南芥.
对Riken数据库的ATPR1蛋白质序列的BLASTP搜索BrachypodiumFlcdna克隆,识别Broachypodium Pr1同源,产生11个基因,定义为BDPR1家庭,其推导的蛋白质序列中具有高相似性(E值<1E-10)。其中,5和4个基因分别位于染色体1和3上,并且在染色体2和4上发现剩余的2个基因。根据米饭PR1基因命名法[52),这些BDPR1基因也根据其染色体位置来指定。优先顺序取决于染色体数目和5′端的位置。例如,5BDPR1染色体1的成员被命名BdPR1-1型那BdPR1-2型那BdPR1-3型那BdPR1-4型和BdPR1-5型按5'到3'。染色体2的基因被命名为BdPR1-6型.
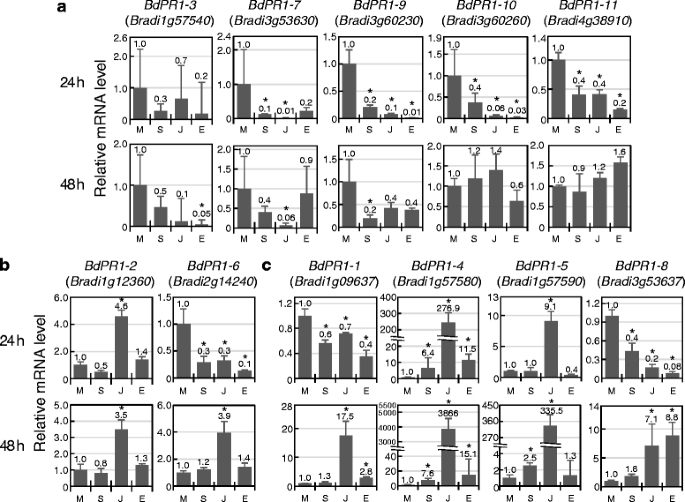
我们设计了针对每个特定检测的引物BDPR1在qRT-PCR实验中,检测SA、JA或ET处理后24h和48h的表达情况(图。4.).根据他们的表达模式,BDPR1成员被分为三组。A组有5个BDPR1转录的基因未被任何植物激素上调的(图。4).相反,在这些植物激素处理后的24或48小时,它们的表达明显或可能受到抑制。这种抑制在BdPR1-1型那BdPR1-6型和BdPR1-8型在植物激素治疗后24小时分为其他组。B组中有两个基因,其中的成员只对一种植物激素JA有反应(图。4 b).BdPR1-2型都是在24和48小时诱导的,而BdPR1-6型仅在48小时上上调。组C包含超过两种植物激素诱导的4个基因(图。4摄氏度).转录BdPR1-1型和BdPR1-8型治疗后48h用JA和ET诱导。BdPR1-5型该基因在24 h对JA表达有响应,48 h时表达量进一步增加,48 h时对SA的反应也较弱BdPR1-4型,所有被测植物激素均诱导其转录。其诱导对JA特别敏感,在48h检测到大量转录。
表达式模式BDPR1基因家庭用植物激素治疗后。表达水平BDPR1通过QRT-PCR分析测定植物激素处理后24或48小时的基因。提出了相对于模拟处理中的转录水平。一种,不可诱导基因;B.,仅由JA诱导的基因;C,多种植物激素诱导的基因。米,模拟治疗;年代,SA处理;J, JA治疗;E等治疗。误差栏代表标准错误(N = 3 independent treatments). Asterisks above the bars indicate significant differences compared to mock treatment atP. < 0.05(学生宿舍)T.测试)。实验至少进行了三次,得到了相似的结果,并给出了一个有代表性的结果
我们的结果透露了一些Broachypodium Pr1水稻基因是由多种植物激素诱导的[52]. 利用11、12和22个PR1家族的预测蛋白序列Brachypodium、大米和拟南芥分别用UPGMA(算术平均无加权对群法)构建系统发育树(图1)。5.). 水稻OsPR1的蛋白质序列及其序列分析拟南芥AtPR1家族分别来自MSU水稻基因组注释项目和拟南芥信息资源(Arabidopsis Information Resource, TAIR)。生成的树说明了这一点Brachypodium和米饭含有类似的一套PR1家庭基因除了拟南芥说明了单子叶植物与双子叶植物在植物组成上的差异PR1家族蛋白质。在图的右栏中。5.,总结了它们对植物激素的反应性Broachypodium Pr1本研究揭示的基因和报道的水稻信息OSP1.和拟南芥AtPR1基因。在ATPR1基因,只有两个基因(AT4G25780那At5g66590)被分类为同一思科的单码PR1基因,而其余20个基因,其中含有植物激素应答ATPR1和AtPRB1型,形成独立的分支。一些PR1基因Brachypodium同一分支的水稻对激素的表达反应模式相似。例如,BdPR1-4型和OsPR1第074页(OSPR1A.) 或者BdPR1-5型和OsPR1 # 101对多种植物激素有反应BdPR1-7、BdPR1-9那BDPR1-10,OSPR1#021和外包服务提供商1#022没有任何植物激素诱导。BdPR1-2型和OsPR1第071页仅由JA引起的。其他基因对显示出不同的表达模式,表明不同的角色PR1这些植物物种之间的家庭。
系统发育分析PR1基因家庭拟南芥、大米和Brachypodium.种系发生树PR1基因家庭拟南芥、大米和Brachypodium由Mega软件(http://www.megasoftware.net/),使用引导值(1000)的UPGMA方法。植物激素的可诱导性BDPR1在这项研究中分析的家庭和那些ATPR1家庭和OSP1.van loon等人报道的家庭。(2006)和Mitsuhara等人。(2008)分别总结在右栏中[52那55].诱导状态如下:++,与模拟处理相比,显着诱导了10倍;+与模拟治疗相比,显着诱导2倍;- ,不诱导;+ - ,诱导或表达的基因尚不清楚
从这些情况来看,我们假设一个共同的防御系统存在Brachypodium这种系统在单子叶植物中是保守的。我们的研究结果也支持了这一观点,至少WRKY45-2那4毫升那BdPR1-4型和BdPR1-5型受SA和JA调节(图。1那2和4摄氏度).全面的转录组分析Brachypodium使用RNA序列或微阵列可以证实这一假设。
结论
通过下一代测序和RNA-SEQ综合转录组分析的基因组解密,使得许多作物物种中的比较基因组学。作物中的独特特征往往妨碍了详细分子分析的进展,但只有大量的植物免疫图片拟南芥和米饭目前。鉴于Brachypodium具有有吸引力的优势,可以克服作物研究的局限性,特别是对于增长速度缓慢,大型基因组大小,高倍倍增等,预计会对植物物种之间防御系统的共性或独特性提供知识。在这项研究中,我们确定了植物激素标志物基因WRKY45-1和WRKY45-2对于SA;AOS公司那液态氧那4CL,PAL,PR1-2,PR1-5和PR1-6.对于JA和焦油和UGT76-4型对于等(图。1那2那3.和4.). 这些基因是根据时间点和强度来选择的,这两个参数用于监测许多植物病原菌侵染过程中的植物反应,它们不仅是描述植物对特定病原菌的时空免疫反应的有用工具Brachypodium也可以在一个统一的框架内将它们与其他病原体进行比较。基因表达谱的比较PR1家族基因表明Brachypodium植物激素的反应与水稻比水稻更相似吗拟南芥.
方法
植物材料和生长条件
这Brachypodium distachyon使用栽培品种BD21。Brachypodium种子在潮湿的滤纸上发芽。7天后,将幼苗转移到填充有土壤的24孔微量滴定板的井,并在生长室(LPH-350s; Nippon Medical&Chemical Instruments,Osaka,Japan,Osaka,Japan)的井中以20小时光/4小时黑色photoperiod [13].
植物激素治疗
水杨酸钠(SA; WAKO,大阪,日本),MEJA(JA; WAKO,大阪,日本)和ETHEVEON(SIGMA-ALDROCH,ST.LOUIS,MO,USA),ET发电机,用作植物激素。使用50ml锥形管浸入水(模拟处理)或植物激素溶液(1mM SA,100μLMEJA或100μm乙烯)中浸入3至4周的整个BD21幼苗。将幼苗在20小时光/ 4小时深光周周下在23℃下在23℃温育24或48小时。然后,将来自幼苗顶部的第一和第二完全膨胀的叶片收集在2ml管中并在液氮中冷冻。
RNA提取及基因表达分析
使用Shake Master Neo(BMS,日本东京)用四个氧化锆珠(ø2 mm)粉碎冷冻样品。总RNA用总RNA纯化试剂盒(JenaBioscience,Jena,德国)经柱上DNA酶处理(Invitrogen,Carlsbad,CA,USA)提取。用DS-11分光光度计(Denovix,Wilmington,DE,USA)验证RNA浓度和纯度。用带有gDNA擦除器的PrimeScript RT试剂盒从每个样本合成cDNA(Takara,Shiga,Japan)。使用KAPA-SYBR快速qPCR试剂盒(KAPA-BIOSYSTEMS,Woburn,MA,USA)和GVP-9600实时PCR仪(Shimadzu,Kyoto,Japan)通过qRT-PCR进行基因表达分析。使用GVP-9600内部软件GVP基因检测系统对目标转录物进行定量,并将数据标准化为B管路4基因(BRADI3G04730),已建立作为表达研究的参考基因B双光子[59].本研究中使用的引物列于附加文件2:表S1。
可用性数据和材料
所有支持性资料都可以在手稿及其附加文件中找到。
缩写
- ACC:
-
1-aminocyclopropane-1-carboxylic酸
- ACS公司:
-
ACC合酶
- AOC公司:
-
联烯氧化物环酶
- 代谢:
-
联烯氧化物合成酶
- BTH:
-
benzothiadiazole
- CoA编号:
-
辅酶A
- EIN:
-
乙烯不敏感
- ERF公司:
-
乙烯反应的因素
- 电子技师:
-
乙烯
- ETI公司:
-
effector-triggered免疫力
- FLcDNA:
-
全长cDNA
- 青年成就组织:
-
茉莉酸
- 液态氧:
-
脂氧合酶
- 梅贾:
-
mehyl jasmonate
- NLR:
-
胞质核苷酸结合域和富亮氨酸重复序列
- 超载比:
-
12-oxo-phytodienoic酸还原酶
- 朋友:
-
苯丙氨酸氨裂解酶
- pamp / mamp:
-
病原体或微生物相关的分子模式
- PBZ1:
-
probenazole-induced蛋白1
- PDF格式:
-
植物防御素
- 公关:
-
病因相关
- PTI/MTI:
-
pamp / MAMPs-triggered免疫力
- QRT-PCR:
-
定量逆转录聚合酶链反应
- 山:
-
水杨酸
- 凹陷:
-
SA-O-β-D.-葡萄糖苷
- 萨格特:
-
sa葡萄糖瘤转移酶
- 焦油:
-
拟南芥1(TAA1)的色氨酸氨基转移酶 - 相关
- Upgma:
-
具有算术平均值的未加权对组方法
- VSP:
-
营养储存蛋白
参考文献
- 1.
Boller T,Felix G. eLitorors的文艺复兴:通过模式识别受体对微生物相关分子模式和危险信号的感知。Annu Rev植物Biol。2009; 60:379-406。
- 2.
Jones JD,Dangl JL。植物免疫系统。自然。2006; 444(7117):323-9。
- 3.
Mersmann S,Bourdais G,Rietz S,Robatzek S.乙烯信号传导调节FLS2受体的积累,并且是有助于植物免疫的氧化突发。植物理性。2010; 154(1):391-400。
- 4.
琼斯JD。植物激素在植物防御反应中的作用。植物mol biol。2009; 69(4):473-88。
- 5.
关键词:水稻,水杨酸,生物合成,偶联作用植物杂志。1995;108(2):633 - 9。
- 6.
Huckelhoven R,Fodor J,Preis C,Kogel Kh。由粉末状霉菌真菌攻击的大麦的过敏细胞死亡和乳头形成与过氧化氢无关,但不具有水杨酸积累。植物理性。1999; 119(4):1251-60。
- 7.
probenazol诱导的水杨酸的积累使水杨酸具有抗性稻瘟病菌在成年水稻植株中。植物细胞生理学。2007;48(7):915–24.
- 8.
Ward er,Uknes Sj,Williams SC,Dincher SS,Wiederhold DL,Alexander DC等人。响应诱导全系统获得性阻力的药剂坐标基因活性。植物细胞。1991; 3(10):1085-94。
- 9.
莱昂斯R,吉咪,喀山K。单子叶植物茉莉酸生物合成和信号转导:比较综述。植物细胞代表2013;32(6):815–27.
- 10
Zhu F,席德文,袁S,Xu F,Zhang DW,Lin HH。水杨酸和茉莉酸对烟草花叶病毒的系统抗性至关重要尼古利亚娜·宾夕法尼亚州.Mol植物微生物相互作用。2014; 27(6):567-77。
- 11
Brkljacic J,Grotewold E,Scholl R,Mockler T,Garvin DF,Vain P等人。Brachypodium作为草地的模型:今天和未来。植物理性。2011; 157(1):3-13。
- 12
计划IB:模型草的基因组测序和分析Brachypodium distachyon. 自然。2010;463(7282):763–8.
- 13.
Mochida K,Uehara-Yamaguchi Y,Takahashi F,Yoshida T,Sakurai T,Shinozaki K.大规模收集和分析全长CDNABrachypodium distachyon与Pooideae序列资源集成。Plos一个。2013; 8(10):E75265。
- 14.
Onda Y,Hashimoto K,Yoshida T,Sakurai T,Sawada Y,Hirai MY,等。小鼠生长阶段和代谢特征的测定Brachypodium distachyon比较小麦科作物的发育背景。过程生物学。2015;282(1811):20150964. 内政部:10.1098 / RSPB.2015.0964.
- 15.
Fitzgerald TL、Powell JJ、Schneebeli K、Hsia MM、Gardiner DM、Bragg JN等。Brachypodium作为一种新兴的谷物-病原相互作用模型。安·博特。2015;115(5):717–31.
- 16.
Peraldi A, Beccari G, Steed A, Nicholson P。Brachypodium distachyon:学习的新遗嘱镰刀头枯萎等镰刀小麦的疾病。BMC植物BIOL。2011; 11:100。
- 17.
关键词:Enot DP, Overy DP, Rios ZC, Gilbert M,等稻瘟病Brachypodium distachyon作为研究寄主/病原体动态相互作用的模型系统。Nat协议。2008;3(3):435–45.
- 18.
曼迪克,学者KB。单子叶床中病毒协同作用的表征Brachypodium distachyon揭示了与疾病相关的明显改变的宿主分子方法。植物理性。2012; 160(3):1432-52。
- 19.
Pogorelko G,Lionetti V,Fursova O,Sundaram RM,Qi M,Whitham Sa等。拟南芥和Brachypodium distachyon转基因植物表达曲霉属真菌nidulans乙酰酯酶降低了多糖的乙酰化程度,提高了对病原体的抗性。植物杂志。2013;162(1):青岛举行。
- 20
关键词:激素诱导基因,转录组,转录组分析Brachypodium distachyon. Sci代表2015;5:14476.
- 21
帕切科·维拉洛沃斯D、桑卡尔M、永K、哈特克CS。局部生长素稳态的紊乱增强了细胞的各向异性,并揭示了生长素-乙烯串扰在细胞中的选择性连接Brachypodium distachyon精髓根。Plos Genet。2013; 9(6):E1003564。
- 22
altschul sf,gish w,miller w,myers ew,lipman dj。基本的局部比对搜索工具。J Mol Biol。1990年; 215(3):403-10。
- 23
Rozen S,Skaletsky H。为普通用户和生物学家程序员在WWW上发布Primer3。方法分子生物学。2000;132:365–86.
- 24
Shimono M、Sugano S、Nakayama A、Jiang CJ、Ono K、Toki S等WRKY45在苯并噻二唑诱导的稻瘟病抗性中起关键作用。植物细胞。2007;19(6):2064–76.
- 25
Peng Y,Bartley Le,Chen X,Dardick C,Chern M,Ruan R等人。奥斯基62是基础的负调节因子XA21介导的防御稻黄单胞菌PV。oryzae.在米饭中。莫尔植物。2008; 1(3):446-58。
- 26。
Yokotani n,Sato Y,Tanabe S,Chujo T,Shimizu T,Okada K,等。WRKY76型是一种稻米转录压缩机,在抗疾病抗性和冷应激耐受性中起相反应的作用。J Exp Bot。2013; 64(16):5085-97。
- 27。
关键词:水稻,稻瘟病菌,混合转录组,同步RNA-seq分析《公共科学图书馆•综合》。2012;7:e49423。
- 28。
dempsey da,vlot ac,wildermuth mc,klessig df。水杨酸生物合成和代谢。拟南芥书。2011; 9:E0156。
- 29。
Umemura K,Satou J,Iwata M,Uozumi N,Koga J,Kawano T,等。水杨酸葡糖基转移酶的贡献,OSSGT1.,在水稻植物中化学诱导的抗病性。工厂J. 2009; 57(3):463-72。
- 30
Noutoshi Y,Okazaki M,Kida T,Nishina Y,Morishita Y,Ogawa T,et al.通过高通量化学筛选水杨酸葡萄糖基转移酶鉴定的新型植物免疫启动化合物拟南芥. 植物细胞。2012;24(9):3795–804.
- 31
Mueller乔丹。参与茉莉酸生物合成的酶。杂志。1997;100:653 - 63。
- 32
Sasaki Y,Asamizu E,Shibata D,Nakamura Y,Kaneko T,Awai K,等。监测茉莉酸甲酸甲酸致敏基因拟南芥通过cDNA macroArray:茉莉酸生物合成的自激活与其他植物激素信号传导途径。DNA Res。2001; 8(4):153-61。
- 33
Sato Y,Takehisa H,Kamatsuki K,Minami H,Namiki N,Ikawa H等。RiceXPro 3.0版:扩展水稻转录组的信息学资源。核酸研究,2013年;41(数据库问题):D1206–13。
- 34
Walia H,Wilson C,Condamine P,Liu X,Ismail Am,Close TJ。茉莉酸介导的大麦盐析应力的大规模表达分析及生理特性。植物细胞环境。2007; 30(4):410-21。
- 35
Sandoya GV,Buanafina MMO。差分响应Brachypodium distachyon昆虫和真菌病原体的基因型。physiol mol植物疗法。2014; 85:53-64。
- 36
迪克森·雷,achnine l,kota p,刘cj,reddy ms,王l。苯丙丙烷途径和植物防御 - 一种基因组学视角。莫尔植物途径。2002; 3(5):371-90。
- 37.
Tonnessen BW,Manosalva P,Lang Jm,Baraoidan M,Bordeos A,Mauleon R等人。米苯丙氨酸氨酶基因OsPAL4与广谱抗病性有关。植物分子生物学。2015;87(3):273–86.
- 38.
Truman W, Bennett MH, Kubigsteltig I, Turnbull C, Grant M。拟南芥全身免疫使用保守的防御信号通路,并由Jasmonates介导。Proc Natl Acad SCI U S A. 2007; 104(3):1075-80。
- 39.
戴维斯kr,ausubel fm。悬浮培养细胞中引诱者诱导的防御反应的特征拟南芥.植物分子微生物的相互作用。1989;2(6):363-8。
- 40。
Mano Y,Nemoto K.植物中蟾蜍生物合成的途径。J Exp Bot。2012; 63(8):2853-72。
- 41。
Stepanova AN, roberson - hoyt J, Yun J, Benavente LM, Xie DY, Dolezal K等。TAA1-介导的生长素生物合成对激素串扰和植物发育至关重要。牢房。2008;133(1):177–91.
- 42。
毛C、王S、贾Q、吴P。Oseil1.,稻米同源物拟南芥EIN3调节作为阳性组分的乙烯反应。植物mol biol。2006; 61(1-2):141-52。
- 43。
胡勇,赵玲,崇康,王涛OsERF1一种新颖的大米电流变基因,上调乙烯响应基因表达外,除了影响生长和发育拟南芥. 植物生理学杂志。2008;165(16):1717–25.
- 44
Iwai T,Miyasaka A,Seo S,Ohashi Y.乙烯生物合成对幼儿植物抗菌性感染抗性的贡献。植物理性。2006; 142(3):1202-15。
- 45
Agrawal GK、Rakwal R、Jwa NS。乙烯发生剂乙烯利对水稻幼苗PR10、PR1b和PR5三个致病相关基因的光、暗诱导差异。植物生理学杂志。2001;158(1):133–7.
- 46
王永明,王永明,王永明,等。靶向基因破坏osmerk1.揭示其在几丁质感知和涉及水稻中肽聚糖反应和免疫的不可或缺的作用。Mol植物微生物相互作用。2014; 27(9):975-82。
- 47
格拉泽布鲁克J。生物营养型和坏死营养型病原体防御机制的对比。植物病理学年鉴。2005;43:205–27.
- 48
病原体防御中信号通路间的交叉交谈。植物生物学杂志。2002;5(4):225 - 231。
- 49
Leon-Reyes A,Van der Dome D,De Lange Es,Delker C,Wasternack C,Van Wees SC等。水杨酸介导的抑制茉莉酸官响应基因表达拟南芥靶向茉莉酸生物合成途径的下游。足底。2010;232(6):1423–32.
- 50。
本文主要介绍了一种新型的生物信息学方法:Tamaoki D, Seo S, Yamada S, Kano A, Miyamoto A, Shishido H, et al.。茉莉酸和水杨酸激活水稻的共同防御系统。Plant Sig behavior . 2013;8(6):e24260。
- 51
De Vleesschauwer D,Gheysen G,HöfteM.Chirmone的荷尔蒙防御网络:来自不同世界的故事。趋势植物SCI。2013; 18(10):555-65。
- 52
Mitsuhara I, Iwai T, Seo S, Yanagawa Y, Kawahigasi H, Hirose S,等。12种水稻的特征表达PR1对病原体感染、创伤和防御相关信号化合物作出反应的家族基因(121/180)。分子遗传学。2008;279(4):415–27.
- 53
Yamada S,Kano A,Tamaoki D,Miyamoto A,Shishido H,Miyoshi S等人。参与OsJAZ8茉莉酸诱导的水稻白叶枯病抗性研究。植物生理学杂志。2012;53(12):2060-72。
- 54
水杨酸和茉莉酸对受伤成熟烟叶致病相关(PR)蛋白基因表达的拮抗作用。植物生理学杂志。1998;39(5):500-7。
- 55
房龙立法会,代表M,彼得斯CM。诱导防御相关蛋白在被侵染植物中的意义。Annu Rev Phytopathol. 2006; 44:135-62。
- 56
Santamaria M、Thomson CJ、Read ND、Loake GJ。基础教育的推动者PR1- like基因,AtPRB1型,来自拟南芥建立有机特异性表达模式和对乙烯和茉鲸甲酸甲酯的反应性。植物mol biol。2001; 47(5):641-52。
- 57
Takatsuji H.使用诱导抗病抗性的调节组分进行抗病稻米的发展。前植物SCI。2014; 5:630。
- 58
艾利夫M、辛格D、帕克R、莫斯库M、普赖尔T。感染Brachypodium distachyon用选定的草生锈病原体。Mol植物微生物相互作用。2013; 26(8):946-57。
- 59
钱伯斯jp,behpouri a,鸟类,ng ck。评价使用多泛素基因,UBI4.和Ubi10作为表达研究的内参基因Brachypodium distachyon.Plos一个。2012; 7:E49372。
致谢
这项研究受到了ALCA(先进的低碳技术的研究和发展项目)资助从日本科学技术振兴机构,YN KAKENHI从教育部授予25292035 YN,文化,体育,科学和技术的日本和资助YN日本应用酶学的基础。
作者信息
从属关系
通讯作者
附加信息
利益争夺
作者们宣称他们没有相互竞争的利益。
作者的贡献
YK,KM,HM,MY,YI,KT和YN构思并设计了实验。YK,MK,YY,MW和YN进行了实验并进行了统计分析。yk,yo和yn起草了手稿。yo,Km,HM,我的,yi和kt有助于分析和解释数据和稿件的关键修订。所有作者阅读并认可的终稿。
附加文件
附加文件1:图S1。
OsWRKY45、BdWRKY45-1和BdWRKY45-2蛋白序列比对(PPTX 145kb)
附加文件2:表S1。
本研究使用的引物(docx32 kb)
权利和权限
开放获取本文根据创意公约署署署的条款分发了4.0国际许可证(http://creativecommons.org/licenses/by/4.0/),允许在任何媒介中不受限制地使用、分发和复制,只要您给予原作者和来源适当的信任,提供知识共享许可的链接,并说明是否有更改。“创作共用公共领域”豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
Kouzai,Y.,Kimura,M.,Yamanaka,Y。等等。防御相关植物激素水杨酸、茉莉酸和乙烯应答标记基因的表达谱分析Brachypodium distachyon.BMC植物杂志16日,59(2016)。https://doi.org/10.1186/s12870-016-0749-9.
收到:
公认:
发表:
关键词
- Brachypodium distachyon
- 植物激素
- 水杨酸
- 茉莉酸
- 乙烯
- 植物疾病抗性
- 防御机制
- 免疫系统
- 标记基因