摘要
背景
Saccharina粳稻是一种重要的商用褐藻,其主要产品为海藻酸盐,用于食品、纺织、化妆品、制药等行业。甘露糖脱氢酶(GMD)是参与海藻酸盐合成的关键酶。然而,对GMD知之甚少美国粳稻.在这里,我们报道了两个GMD基因的比较生化分析美国粳稻.
结果
两个GMD基因来自美国粳稻(Sjgmd1,Sjgmd2克隆。的开读帧长度Sjgmd1,Sjgmd2分别为963 bp和948 bp。比对结果显示,两条SjGMD序列同源性为79.38%。这两个蛋白都具有短链脱氢酶/还原酶超家族特征的GGxCLPKDV和GxGxVG序列基序。sjgmd的最适温度为30℃(SjGMD1)和20℃(SjGMD2),最适pH值为8.0 (SjGMD1)和8.25 (SjGMD2)。动力学分析表明Km值分别为289 μM (SjGMD1)和177 μM (SjGMD2)Km值的辅助因子NAD+分别为139 μM (SjGMD1)和195 μM (SjGMD2)。金属铁锌2+是SjGMD1和SjGMD2的有效抑制剂。实时荧光定量PCR分析表明,热处理和干燥处理显著增加Sjgmd1和Sjgmd2这表明sjgmd直接参与了植物的驯化美国粳稻非生物压力。
结论
我们的工作发现了两个新的基因编码GMD美国粳稻对其结构特征和酶动力学进行了比较分析,揭示了GMD在胁迫适应中的作用美国粳稻.这些知识丰富了我们对海藻酸盐合成机理的认识美国粳稻,并可能促进对GMD基因功能差异的进一步研究。
背景
Saccharina粳稻是最重要的商业褐藻之一,每年的水产产量约为500万吨(湿重)(http://www.fao.org/fishery/statistics/en).除了作为食物,美国粳稻也用于海藻酸盐的生产[1].目前每年生产近3万吨褐藻胶[2].
海藻酸(C6H8O6)n是一种由不同数量的β- d甘露糖酸(M)和其c5 -表聚物α-L-guluronic acid (G)组成的β- 1,4 -联线性杂聚物[3.].海藻酸盐在钙等二价/三价阳离子存在下可形成海藻酸盐,其化学性质随分子量和G/M比而变化。不同物种的藻蛋白丰度和性质不同[4),季节5,以及环境条件[1,6,7].褐藻胶具有特殊的胶凝、增粘和稳定性能,使其在食品、纺织、化妆品和制药工业中得到广泛应用。
藻酸盐合成途径存在于细菌中(假单胞菌和固氮菌)及大部分海洋褐藻[8].研究了细菌海藻酸盐的合成途径答:vinelandii和铜绿假单胞菌[9,10].所涉及的酶,藻类[11], AlgC [12]和AlgD [13,14,负责合成前体gdp -甘露糖酸,Alg8和Alg44参与了gdp -甘露糖酸的聚合[15,16], AlgG将d -甘露聚糖残基表渗为L-guluronate [2,17].褐藻中褐藻酸盐的合成机理尚不清楚。Lin等[18初步提出了海藻酸盐的合成途径岩藻加德纳,得到了进一步的证实Ectocarpus siliculosus和美国粳稻[19,20.].甘露聚糖合成酶和甘露聚糖c5 -表异构酶(MC5E)在这两种酶中均已被鉴定大肠siliculosus和美国粳稻[19].但到目前为止,在褐藻中,只有MC5E基因来自l . digitataGMD基因大肠siliculosus已从生物化学角度加以描述[21,22].有必要对褐藻酸盐合成基因进行功能分析美国粳稻.
一般认为GMD是海藻酸盐合成途径中的限速酶[23,24].以gpd -甘露糖+ 2NAD催化合成gpd -甘露糖酸++ H2O→GDP-Mannuronic + 2NADH。在细菌基因组,gmd是一个单拷贝基因[25,而在模型中是褐藻大肠siliculosus在美国,它是一个多复制基因,而且只有一个gmd进行了生物化学分析[22].
基于我们之前生成的美国粳稻转录组数据(26两个GMD基因来自美国粳稻(Sjgmd1和Sjgmd2),并进行功能分析。人们希望它能阐明Sjgmds以及它们在褐藻适应环境胁迫中的可能作用,进一步丰富我们对褐藻中褐藻酸盐合成的认识。
方法
样品收集
美国粳稻“中可2号”是2014年在中国山东荣城采集的人工木筏。此前曾获得山东高鲁水产品有限公司的抽样许可。选取同一生境的幼孢子体(长20 ~ 30 cm)作为样本。藻标本用无菌海水冲洗,10°C黑暗预培养过夜。在干燥和热休克处理中,藻类样品在黑暗中干燥0 h、0.5 h、1 h、1.5 h,同时其他藻类分别在25°C黑暗中培养0 h、0.5 h、1 h、1.5 h。所有采集的样品均用液氮冷冻保存在−80℃。
制备cDNA
总RNA美国粳稻用RNeasy Plant Mini Kit (Qiagen,德国)提取,用DS-11分光光度计(Denovix,美国)评估质量。高纯度RNA (OD260/280= 1.8 ~ 2.2),按照PrimeScript™II第一链cDNA synthesis kit (Takara, Dalian, China)说明书进行第一链cDNA的合成。所有模板保存在−20°C。
SjGMD基因的分离
候选GMD unigenes从我们之前的转录组数据库中检索美国粳稻(GSE33853) [26,并通过Blastx工具进行相似性分析。为了获得GMD基因转录本的完整序列,参照SMARTer RACE cDNA amplification kit (Clontech, USA)的说明书进行5 ' - rapid-amplification of cDNA ends (RACE),使用3 ' - full RACE Core Set ver2.0 (Takara, Dalian, China)进行3 ' -RACE。所有特异性引物均采用Primer Premier 5软件设计1).基于序列信息的开放阅读框架(ORF)Sjgmd1和Sjgmd2用两对引物(GMD1-F/GMD1-R和GMD2-F/GMD2-R)进行扩增(表1).PCR反应采用PrimeSTAR max DNA聚合酶,扩增程序为:98℃5 min, 98℃10 s, 55℃5 s, 72℃30 s, 72℃10 min, 35个循环。
SjGMD基因的生物信息学分析
部分序列Sjgmd使用DNAman 6.0进行组装,使用ORF finder工具识别ORF (http://www.ncbi.nlm.nih.gov/gorf/gorf.html).蛋白质分子量(MW)和理论等电点(pI)由ProtParam [27],并利用SOPMA程序预测SjGMD1和SjGMD2的二级结构[28].在MEGA 6.0中使用邻居连接算法构建系统发生树,共1000次bootstrap重复[29].
SjGMD1和SjGMD2的体外表达和纯化
采用pMAL系统(New England Biolabs, USA)进行融合蛋白的表达和纯化。特定的引物与濒死经历我和EcoR设计I酶切位点(GMD1-F/GMD1-R和GMD2-F/GMD2-R)扩增ORFSjgmd.将纯化的扩增产物连接到pMD-19T载体(Takara,中国大连)上,酶切濒死经历我和EcoRI.将目的条带纯化并重组到pMAL-c5X载体中,该载体能够表达麦芽糖结合蛋白(maltose-binding protein, MBP)融合蛋白,MBP与目的蛋白之间有一个TEV蛋白酶切割位点。内表达能力大肠杆菌表达重组蛋白,收集阳性克隆进行表达分析。
采用不同诱导温度(15°C、25°C、37°C)和IPTG浓度(0.1 mM、0.3 mM、0.5 mM)优化MBP-GMD的表达。将细胞颗粒重悬于柱缓冲液(20 mM Tris-HCl, pH 7.5, 200 mM NaCl, 1 mM乙二胺四乙酸(EDTA), 1 mM NaN)中3., 1 mM dl -二硫苏糖醇(DTT), 200 μM NAD+通过超声从细胞中释放目标蛋白,并按照说明书在直链淀粉树脂柱上进行纯化。纯化的SjGMD1和SjGMD2蛋白用Amiconultra-15离心过滤单元(Millipore, MWCO 30 kDa)浓缩,用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶(12%)验证。
酶化验
酶学检测OD变化340使用Powerwave HT微孔板分光光度计(BioTek,美国)吸收。酶解液(200 μL)中含有100 mM Tris-HCl缓冲液、0.33 mM gdp -甘露糖、1 mM NAD+,纯化SjGMD蛋白(30 ~ 40 μg)。根据不同的反应温度调整三盐酸缓冲液的pH值。为优化反应参数,分别在不同温度(20、25、27、30、32、35℃)和不同pH(6.5、7.0、7.5、8.0、8.25、8.5、9.0、9.5)下进行催化检测。每次反应持续20分钟K在不同的gpd -甘露糖或NAD条件下,测定了sjgmd的催化速率+浓度(0,1 /60,1/30,1/15,2/15,4/15,8/15 mM),在最佳条件下KM值用双倒数图计算。通过添加1 mM的氯化镁来评价重金属的影响2, MnCl2, CaCl2和ZnCl2到标准反应混合物。每个反应有三个重复。
gdp -甘露聚糖酸高效液相色谱(HPLC)分析
加入1体积磷酸钠缓冲液(100mm, pH 3.0)终止酶测反应[22].离心后,上清液20 μL注入日本岛津- 20a高效液相色谱系统,色谱柱为Partisil 10 SAX (250 × 4.6 mm,粒径10 μm;美国绘画纸)。以10mm磷酸钠(pH 3.0)和750mm磷酸钠(pH 3.7)作为流动相A和b0最小3% B;t25最小40% B;t33最小75% B;t35最小75% B;t56最小3% B,流速为1 mL min−1在30°C。利用光电二极管阵列探测器记录了紫外光谱(230 ~ 320 nm)。
质谱分析
在Amiconultra-15离心过滤器(Millipore, MWCO 10 kDa)上离心去除反应溶液中的酶后,在Sephadex G-10凝胶(1.0 cm × 20 cm)上分离,用水洗脱。糖采用苯酚-硫酸法测定[30.,选择含糖的馏分进行冻干。
粉末在氯气中溶解3.CN-H2O (1:1, v/v),并在LTQ ORBITRAR XL (Thermo Scientific, USA)上进行质谱分析。质谱记录在负离子模式下,流速为5 μL min−1.优化参数为:毛细管电压,−3000 V;锥形电压−50 V;源温度,80°C;溶解温度,150°C。碰撞能量在10 ~ 50 eV之间。所有光谱用Xcalibur进行分析。
实时荧光定量PCR分析Sjgmd1和Sjgmd2
引物qGMD1-F/qGMD1-R和qGMD2-F/qGMD2-R;表格1)的扩增片段分别为128 bp和126 bp。使用特定引物Actin-F和Actin-R进行内部控制测试[26].采用SYBR预混剂Ex进行实时PCRTaq二(Takara,中国大连)在TP800热循环骰子实时系统(Takara,日本)。热循环方案为:95℃30 s, 95℃5 s, 55℃10 s, 72℃20 s,循环45次。相对定量值由2——∆∆Ct方法(31],采用SPSS 19.0进行统计分析。
结果
克隆Sjgmd1和Sjgmd2
来自转录组数据的4个候选基因(Unigene50429, Unigene52620, Unigene57613和Unigene7396)被注释为GMD基因。在此基础上设计引物,通过5 ' -RACE和3 ' -RACE扩增得到352-bp和730-bp序列Sjgmd1.的全长cDNA序列Sjgmd1(1523 bp, KP172530), 5 ' -UTR、ORF和3 ' -UTR的长度分别为84 bp、963 bp和476 bp。为Sjgmd2通过3 ' -RACE扩增获得491 bp序列,并组装成包含5 ' -UTR (72 bp)、ORF (948 bp)和3 ' -UTR (63 bp)的cDNA全长序列(1083 bp, KP172531)。
sjgmd的结构分析和对齐
Sjgmd1编码320个氨基酸(35.20 kDa, pI 5.22)的蛋白质Sjgmd2编码315个氨基酸(34.46 kDa, pI 5.38)。同源性分析表明,SjGMD蛋白与短链脱氢酶/还原酶(SDR)超家族成员具有高度的相似性。SjGMD1与来自中国的GMD基因同源性为91.56%大肠siliculosus(CBJ27002)和SjGMD2与另一个GMD基因的同源性为93.97%大肠siliculosus(CBJ29903)。而SjGMD1和SjGMD2的同源性仅为79.38%,大部分变异发生在保守催化区外。gmd的多序列比对显示,两种sjgmd均含有保守的NAD+-结合基序GxGxVG (SjGMD1的14 ~ 19和SjGMD2的11 ~ 16)和c端活性基序GGxCLPKDV (SjGMD1的259 ~ 267和SjGMD2的256 ~ 264)(图2)。1).然而,在细菌gmd和sjgmd之间,一些关键的结合和催化残基存在差异,如Val (SjGMD1中的17;SjGMD2组14例,Ala组146例;143例SjGMD2)、Val(147例SjGMD1;144在SjGMD2和Pro(257在SjGMD1;SjGMD2中的254)(图。1).此外,与大肠siliculosusgmd [22, sjgmd包含不完整的n端罗斯曼褶皱。二级结构预测表明,SjGMD1含有35.94%的随机线圈和36.25%的α-螺旋,SjGMD2含有35.24%的随机线圈和33.33%的α-螺旋。
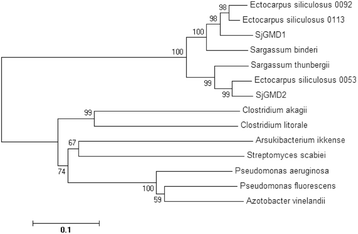
为了解GMD的进化历史,构建了系统发育树。所有褐藻gmd形成一个分支,而细菌gmd聚集成一个单独的分支(图1)。2).此外,褐藻分支倾向于形成两个独立的分支,每个分支都包含一个sjgmd。SjGMD1更接近大肠siliculosus0113 (CBJ27002)和大肠siliculosus0092 (CBJ26993), SjGMD2更接近大肠siliculosus0053 (CBJ29903)。
基于GMD序列构建系统发育树。该树是使用邻居连接算法与1000个bootstrap重复。Ectocarpus siliculosus0092年,CBJ26993;Ectocarpus siliculosus0113年,CBJ27002;Ectocarpus siliculosus0053年,CBJ29903;海藻binderi, ESTs DV668856 + DV669914;海藻thunbergiiSRA073158;akagii梭状芽胞杆菌WP_026882540;litorale梭状芽胞杆菌WP_038266433;Arsukibacterium ikkenseWP_046556127;链霉菌属scabieiWP_013000147;铜绿假单胞菌WP_034074438;荧光假单胞菌WP_042729895;固氮菌vinelandii, AAB01487
重组SjGMD1和SjGMD2的表达
MBP-SjGMD1经0.5 mM IPTG在25℃诱导16 h后成功表达,其分子量与预测的77.7 kDa一致;0.1 mM IPTG在15°C诱导MBP-SjGMD2 24 h,其MW与预测的76.96 kDa一致(附文件)1).重组蛋白经Xa蛋白酶切割后,SDS-PAGE(12%)分离,分子量分别为35.2 kDa (SjGMD1)和34.46 kDa (SjGMD2)(附文件)1).由于融合蛋白和剪切蛋白的活性没有差异,重组SjGMD1和SjGMD2蛋白在酶活性检测中直接分析。将纯化的融合蛋白浓缩至3 ~ 4mg mL-1用于酶活性测定。
酶法测定SjGMD1和SjGMD2的活性
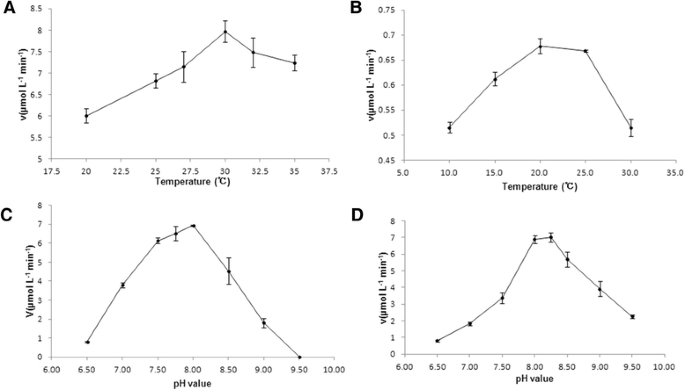
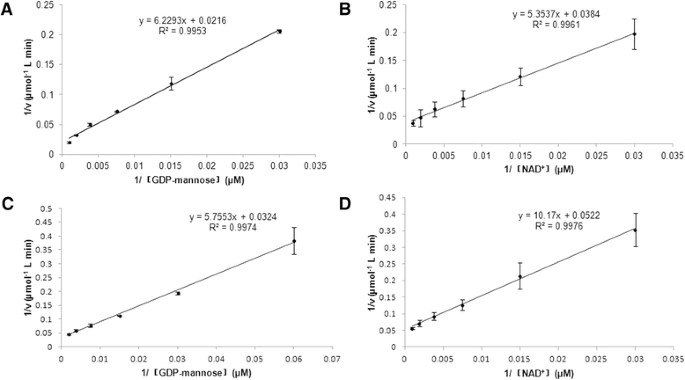
最适温度为30°C (SjGMD1)。3)和20°C (SjGMD2)(图。3 b),最适pH值为8.0 (SjGMD1)。3 c和8.25 (SjGMD2)(图。3 d),分别。由于这些酶遵循典型的Michaelis-Menten动力学模型,因此测定了动力学参数。的KSjGMD1对gdp -甘露糖的m值为289 μM(图2)。4), NAD为139 μM+(无花果。4 b),而KSjGMD2对gdp -甘露糖的m值为177 μM(图2)。4摄氏度), NAD为195 μM+(无花果。4 d).不同金属离子对sjgmd的活性均有影响,其中ZnCl对sjgmd的活性有影响2和MnCl2是sjgmd的抑制剂,而MgCl2增加了SjGMDs的活性(表2).更重要的是,CaCl2作为SjGMD1的激活剂和SjGMD2的抑制剂2).
HPLC和MS分析gdp -甘露糖酸
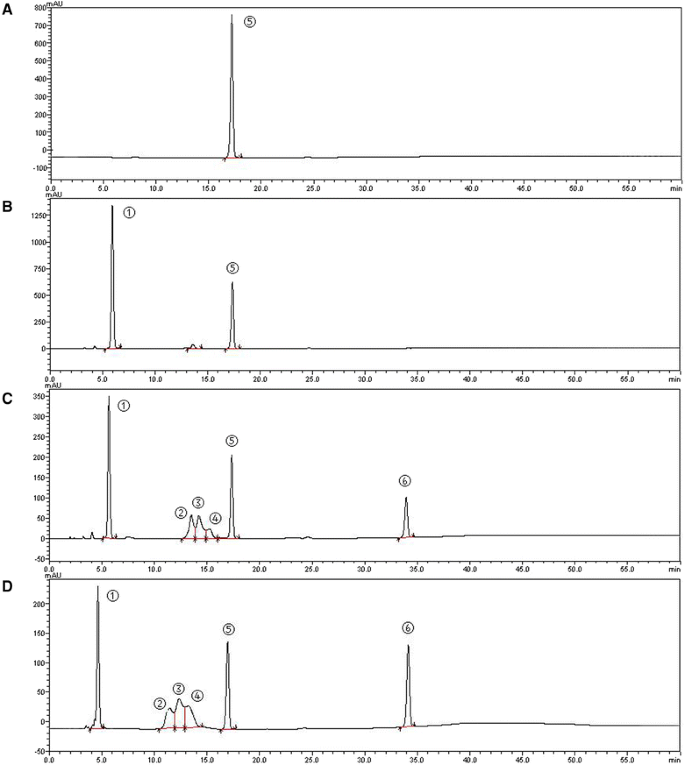
为了确认SjGMDs的催化活性,我们对反应溶液进行了HPLC分析(图。5).数字5显示底物gdp -甘露糖的峰值⑤.数字5 b表明在没有GMD的情况下,只有NAD+①和GDP-mannose⑤可以检测到。在下面的色谱图中,监测了反应时间为5分钟的产物(图。5度)和30分钟(图。5 d), NADH的峰值区域③和GDP-mannuronic酸⑥随着反应时间的增加,NAD的反应时间增加+①和GDP-mannose⑤显著降低。这一结果表明,gdp -甘露糖酸是由gdp -甘露糖氧化而来,SjGMD1和SjGMD2均具有功能性。
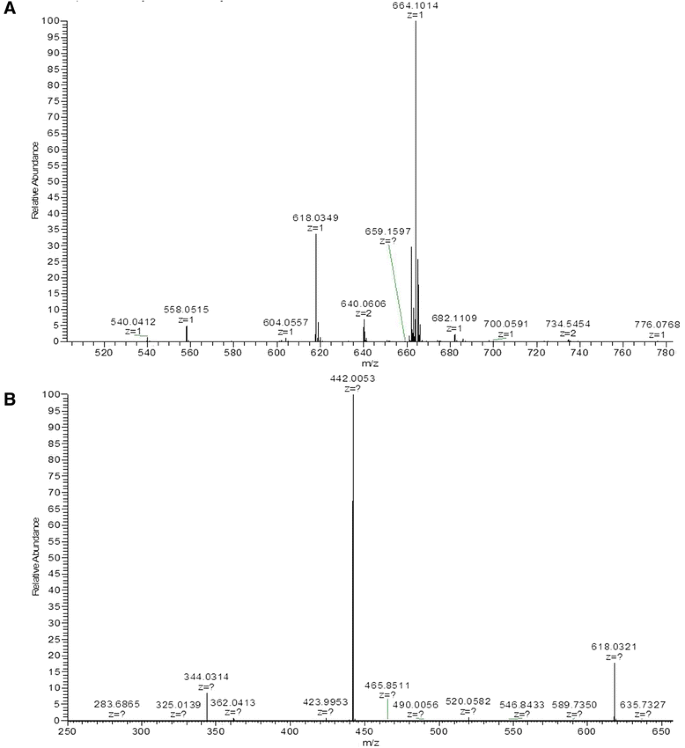
MS分析表明,从高丰度的痕量中可以很容易地识别出gdp -甘露聚糖酸和NADH,这与618和664的预测质量一致(图6)。6).此外,假设的gdp -甘露糖酸峰的碰撞诱导解离(CID)碎裂导致甘露糖酸或甘露糖酸没有磷酸的损失(图。6 b).这些结果进一步验证了gdp -甘露糖酸的生产。
转录分析Sjgmd年代
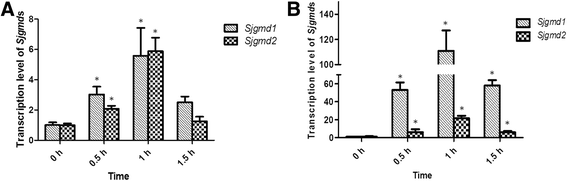
在高温和干燥的压力下,Sjgmd1和Sjgmd2显示出相同的转录谱(图。7).经过热处理后,其水平Sjgmd1和Sjgmd2转录本显著增加(P< 0.05),在1h后达到峰值(5.52倍Sjgmd1增长5.86倍Sjgmd2在1.5 h时,叶绿素含量显著降低至初始水平。干燥胁迫下,叶绿素含量显著降低Sjgmd1和Sjgmd2转录本在1 h后达到最大值(增加了110.63倍Sjgmd1增加了19.94倍Sjgmd2与对照组相比)。
讨论
两个新的GMD基因来自美国粳稻在本研究中分离和表征。序列分析和系统发育分析表明,两种gmd的方差在美国粳稻比中间值高吗美国粳稻和大肠siliculosus.这表明这两个SjGMD基因可能是从不同的gmd进化而来的,而不是来自于发生在美国粳稻.以前的研究表明,褐藻中的GMD是通过从细菌中水平转移单个GMD获得的[19,20.,22].因此,我们提出GMD复制事件发生在褐藻分化之前。
GMD的晶体结构由铜绿假单胞菌研究表明,该酶包含两个由r -螺旋连接的不同结构域,N端和c端结构域均具有典型的二核苷酸结合罗斯曼折叠[14].虽然表征的sjgmd包含保守的基序和残基,但在sjgmd中发现了不完整的n端罗斯曼折叠和残基替换,这与在大肠siliculosus。这些结果表明褐藻gmd可能具有一种新的结合机制,表明褐藻和细菌的gmd具有不同的生化特性。
SjGMD1和SjGMD2虽然催化相同的反应,但两者的生化性质却有很大的不同。较低的诱导温度表明SjGMD2更易形成夹杂体。SjGMD1的最佳温度为30℃,与SjGMD1的最佳温度相同大肠siliculosusGMD [22],而SjGMD2(20℃)的gmd与两者的gmd有较大差异铜绿假单胞菌(25、37或50°C) [32,33),大肠siliculosus(30°C)。最佳ph值(8.0;SjGMD1、SjGMD2的基因型与铜绿假单胞菌(7.7)和节细菌属sp。(8.2)13,34].这表明两种sjgmd具有不同的酶活性。的Ksjgmd的m明显高于细菌gmd [13],正如我们发现的那样大肠siliculosusGMD。这可能是因为gpd -甘露糖是海藻酸盐和fucan合成的共同底物KM可能对杂岩形成有利[22].此外,SiGMDs的活性受金属离子的影响很大。锌2+是SjGMD1和SjGMD2的强抑制剂。这可以解释为其较高的氧化性,可能导致催化残基Cys(262在SjGMD1;SjGMD2为259),Mg2+可以通过改善底物的结合来激活sjgmd。更重要的是,这2+对SjGMD1和SjGMD2的影响差异较大,这可能是由于SjGMD1和SjGMD2结合Ca2+.这表明,Ca2+可能是细胞内外环境变化时SjGMD活性的调节因子。
美国粳稻为寒温带藻类,分布于太平洋西北海岸的亚热带地区。温度和光照是影响其生长的主要因素。干燥也会威胁到它的生存。在非生物压力下,美国粳稻能调节其生理和代谢过程,以适应和生存不利条件[35,36].作为第一道防线,褐藻的细胞壁可以增厚,增加其对胁迫的耐受性[37].褐藻酸盐是褐藻细胞壁的主要成分之一,占细胞干重的45% [38].因此,海藻酸盐产量的增加可能有助于细胞壁增厚。在高温和干燥胁迫下,转录水平Sjgmdit’它在短时间内迅速增长。这一结果表明美国粳稻通过上调海藻酸盐合成途径相关基因的表达来增加海藻酸盐合成。SjGMD1和SjGMD2的表达可能对其适应性有重要影响美国粳稻在沿海环境中,以确保海藻的正常生长。
结论
在本文中,两个新的基因编码GMD美国粳稻进行了克隆和验证。sjgmd在序列和结构上存在差异,其生化性质和酶学动力学也存在较大差异。两者的丰富Sjgmds在非生物胁迫下,转录本增加,这可能有助于更好地适应美国粳稻.这些知识丰富了我们对褐藻褐藻酸盐合成的认识,并为研究GMD基因之间的功能差异提供了线索。
可获得的支持数据
支持本文结果的数据集包含在本文及其附加文件中。
缩写
- CID:
-
碰撞诱导解离
- 德勤:
-
DL-Dithiothreitol
- EDTA:
-
乙二胺四乙酸
- 旅客:
-
α-L-guluronic酸
- GMD:
-
GDP-mannose脱氢酶
- 高效液相色谱法:
-
高效液相色谱法
- IPTG:
-
Isopropy -β-D-thiogalactoside
- M:
-
β-D-mannuronic酸
- MBP:
-
Maltose-binding蛋白质
- MC5E:
-
Mannuronate C5-epimerases
- 女士:
-
质谱分析
- 兆瓦:
-
蛋白质的分子量
- 子:
-
开放式阅读框
- PI:
-
理论等电点
- 种族:
-
cDNA末端的快速扩增
- 特别提款权总科:
-
短链脱氢酶/还原酶超家族
- sds - page:
-
十二烷基硫酸钠聚丙烯酰胺凝胶电泳
- Sjgmd:
-
gdp -甘露糖脱氢酶基因来源于美国粳稻
- SjGMD:
-
GDP-mannose脱氢酶从美国粳稻
参考文献
- 1.
Bertagnolli C, Espindola APDM, Kleinübing SJ, Tasic L, da Silva MG。海藻filipendula巴西海藻酸盐:季节影响及特点。Carbohyd石油。2014;111:619 - 623。
- 2.
Hay ID, Rehman ZU, Moradali MF, Wang YJ, Rehm BHA。微生物海藻酸盐的生产、改性及其应用。生物科技活》。2013;6(6):637 - 650。
- 3.
陈志强,陈志强,陈志强,等铜绿假单胞菌.J Bacteriol。1973;116(2):915 - 924。
- 4.
张志强,张志强,张志强,等。不同来源海藻酸盐组成的比较。见:第六届国际海藻研讨会论文集。1969。p . 443 - 451。
- 5.
南GR.新西兰海藻酸盐水平Durvillaea(褐藻科),特别涉及年龄的变化d .南极洲.见:国际海藻研讨会论文集。1979。p . 133 - 142。
- 6.
Larsen B, Salem DM, salam MA, Mishrikey MM, Beltagy AI。在埃及红海海岸收获的藻类的藻酸盐的特征。Carbohyd研究》2003;338(22):2325 - 2336。
- 7.
陈志强,王志强,王志强,等。海藻酸盐的提取、分离和镉结合研究进展海藻应用植物学报,2004;16(4):275-284。
- 8.
海藻酸盐(Smidsrød O.)在:Stephen AM, Phillips GO, Williams PA,编辑。食品多糖及其应用。博卡拉顿:CRC出版社;2006.p . 289 - 334。
- 9.
海藻酸的生物合成固氮菌vinelandii.。1975;152:617 - 622。
- 10.
海藻酸盐生物合成的相关酶铜绿假单胞菌.acta Microbiol Biotechnol. 1981;13(3): 179-183。
- 11.
May TB, Shinabarger D, Boyd A, Chakrabarty AM。磷酸甘露糖异构酶鸟苷5 ' -二磷酸-d甘露糖焦磷酸化酶活性相关氨基酸残基的鉴定。海藻酸盐生物合成途径中的双功能酶铜绿假单胞菌.中国生物医学工程杂志。1994;26 (7):4872-4877
- 12.
Olvera C, Goldberg JB, Sánchez R, Soberón‐Chávez g.the铜绿假单胞菌algC基因产物参与鼠李糖脂生物合成。微生物学杂志。1999;179(1):85-90。
- 13.
王志强,王志强,王志强,等。鸟苷二磷酸-D甘露糖脱氢酶的分离纯化及酶学性质研究。海藻酸盐生物合成的关键酶铜绿假单胞菌.acta Biol Chem. 1989; 64(16): 9380-9385。
- 14.
斯努克CF,蒂普顿PA,激光LJ。国内生产总值-甘露糖脱氢酶的晶体结构:海藻酸生物合成的关键酶铜绿假单胞菌.生物化学。2003;42(16):4658 - 4668。
- 15.
Remminghorst U, Rehm BH。海藻酸盐生物合成所需的独特蛋白质铜绿假单胞菌.2月。2006;580(16):3883 - 3888。
- 16.
Remminghorst U, Rehm BH。海藻酸酯的体外聚合及其在海藻酸酯生产中的功能作用铜绿假单胞菌.应用环境微生物学报。2006;72(1):298-305。
- 17.
引用本文:王志强,王志强,王志强。海藻酸盐生物合成基因簇中c5 -邻位酶基因的克隆与表达分析荧光假单胞菌.基因。2001;278(2):107 - 114。
- 18.
林志强,王志强。褐藻中褐藻酸合成途径的研究。岩藻gardneri席尔瓦。[J] .中国生物医学工程学报,1996;41(22):5284-5297。
- 19.
黄志强,王志强,王志强,等。褐藻细胞壁多糖代谢的研究进展Ectocarpus siliculosus.真核生物细胞外基质多糖的进化。新植醇。2010, 188(1): 82 - 97。
- 20.
叶宁,张旭,苗敏,范旭,郑勇,徐东,等。Saccharina基因组为研究海带生物学提供了新的视角。Nat Commun。2015;6:6986。
- 21.
nevall P, Corre E, Boisset C, Barbeyron T, Rousvoal S, Scornet D,等。褐藻甘露聚糖c -5-异丙基酶基因的特性昆布属植物digitata.植物杂志。2003, 133(2): 726 - 735。
- 22.
Tenhaken R, Voglas E, Cock JM, Neu V, Huber CG。褐藻中gdp -甘露糖脱氢酶的特性Ectocarpus siliculosus为藻酸盐聚合物提供前体。中国生物医学工程学报。2011;28(4):597 - 598。
- 23.
Deretic V, Gill JF, chakrabartaray AM。编码gpd -甘露糖脱氢酶的algD基因在黏液中被转录激活铜绿假单胞菌.J Bacteriol。1987;169:351 - 358。
- 24.
gpd -甘露糖脱氢酶是海藻酸盐生物合成的关键调控酶铜绿假单胞菌:代谢物研究的证据。微生物学。1994;140(7):1745 - 1754。
- 25.
海藻酸盐生物合成基因簇的遗传分析铜绿假单胞菌显示出operonic结构的证据。摩尔Microbiol。1993;8(3):583 - 590。
- 26.
邓艳,姚静,王旭,郭华,段东。转录组测序及比较分析Saccharina粳稻(海带目,褐藻科)。《公共科学图书馆•综合》。2012;7 (6):e39704。
- 27.
gsteiger E, Hoogland C, Gattiker A, Duvaud SE, Wilkins M, Appel R, et al.;ExPASy服务器上的蛋白质鉴定和分析工具。出自:Walker J,编辑。蛋白质组学协议手册。纽约:哈门纳出版社;2005.p . 571 - 607。
- 28.
SOPMA:通过对多个序列的一致预测,在蛋白质二级结构预测方面有显著的改进。计算机应用生物科学1995;11:681-684。
- 29.
Tamura K, Stecher G, Peterson D, Filipski A, Kumar S. MEGA6:分子进化遗传学分析版本6.0。生物医学进展。2013;30(12):2725-2729。
- 30.
杜波依斯M,吉勒斯KA,汉密尔顿JK, Rebers PA,史密斯F.比色法测定糖和有关物质。肛门化学。1956;28(3):350 - 356。
- 31.
Schmittgen TD, Zakrajsek BA, Mills AG, Gorn V, Singer MJ, Reed MW。定量逆转录聚合酶链反应研究mRNA衰减:终点和实时方法的比较。肛门。2000;285(2):194 - 204。
- 32.
基梅尔JL,宾夕法尼亚州提普顿gdp -甘露糖脱氢酶失活铜绿假单胞菌通过青霉素酸识别出一个关键活性位点环。生物化学学报。2005;441(2):132-140。
- 33.
李飞,于军,杨华,万志,白东。氨溴索对成熟海藻酸盐的影响铜绿假单胞菌生物膜。咕咕叫Microbiol。2008;57(1):1 - 7。
- 34.
甘露糖脱氢酶节细菌属.方法Enzymol。1966;8:285 - 287。
- 35.
Liu F, Wang W, Sun X, Liang Z, Wang F. RNA-Seq在转录组水平上揭示了热胁迫的复杂反应Saccharina粳稻(褐藻类海带目)。应用植物学报。2014;26(3):1585-1596。
- 36.
Liu F, Wang W, Sun X, Liang Z, Wang F. the deep sequencing of Conserved and novel heat stress responsive micrornaSaccharina粳稻(褐藻类海带目)。植物学报。2015;38(7):1357-1367。
- 37.
福格通用电气。藻对压力的适应——一些一般性的评论。在:Rai L, Gaur J,编辑。藻类对环境压力的适应。柏林:施普林格;2001.p -。
- 38.
黄志强,王志强,王志强,等。褐藻硫酸化产物的多阴离子特性。国际生物学杂志。1986;8:38 - 386。
致谢
国家科技支撑计划项目(no . 2013BAB01B01);海洋公益性科研项目(no . 201405040)。关键词:边坡,边坡稳定性,边坡稳定性我们感谢J. M. Cock博士的意见、建议和英语修订。我们也衷心感谢匿名审稿人对手稿提出的批评和建议。
作者信息
从属关系
相应的作者
额外的信息
相互竞争的利益
两位作者宣称他们没有相互竞争的利益。
作者的贡献
PYZ进行了大部分的实验,分析了结果,并撰写了论文。ZRS为论文的数据解释和修正做出了贡献。WHJ设计并完成了HPLC分析和MS分析实验。DLD资助并构思了这项研究,并对论文进行了修订。所有作者都通过了手稿的最终版本。
额外的文件
额外的文件1:
重组SjGMDs的SDS-PAGE分析。(PDF 79 kb)
权利和权限
开放获取本文遵循知识共享署名4.0国际许可协议(http://creativecommons.org/licenses/by/4.0/),它允许在任何媒体上无限制地使用、分发和复制,前提是你给予原作者和来源适当的荣誉,提供一个到知识共享许可协议的链接,并指出是否作出了更改。创作共用及公共领域专用豁免书(http://creativecommons.org/publicdomain/zero/1.0/)适用于本条提供的数据,除非另有说明。
关于这篇文章
引用这篇文章
张鹏,邵昭,金伟。et al。两个gdp -甘露糖脱氢酶基因的比较特性Saccharina粳稻(海带目,褐藻纲)。BMC植物杂志16,62(2016)。https://doi.org/10.1186/s12870-016-0750-3
收到了:
接受:
发表:
关键字
- Saccharina粳稻
- 藻酸盐
- GDP-mannose脱氢酶
- 酶动力学
- 应激反应